冷冻加工在食品保存和延长保质期方面起着重要作用,能够有效地抑制食品中微生物的生长繁殖、酶的活性和生物化学反应,保持食品原有的品质和营养,同时也能够提高食品的稳定性、增加食品的多样性和便利性等[1]。冰晶形成和生长导致的冷冻损伤会造成冷冻产品在贮存过程中的质量损失[2],而且大多数冷冻损伤与冰晶的状态(形态、大小、数量和分布)有关[3]。过大或不均匀的冰晶会导致食品在解冻过程中出现大量的汁液流失[4],降低食品的营养价值;不稳定或重结晶的冰晶会改变食品中的水分分布,导致食品在贮存过程中出现质量劣化。如何准确地检测冷冻加工过程中冰晶的形态、大小、数量和分布,从而有效控制和调节冰晶的成核和生长,提高冷冻加工食品的品质,是冷冻加工领域的重要研究课题。
现有的冰晶检测技术主要可分为两大类:传统检测技术和综合物理方法的新型检测技术。第一类,传统检测技术,主要指基于显微镜的方法,这种技术依赖于光学原理来观察和测量冰晶的形态、大小、数量和分布,是一种相对直观准确的检测方式。然而,该方法要求对样品进行复杂的处理,可能影响检测效率和样品的完整性。第二类,综合物理方法的新型检测技术,包括但不限于电学、磁学和声学方法,以及利用光学原理的新型冰晶检测技术。这类技术通过多角度表征冰晶,能够提供更全面的信息。特别是当这些新型检测技术与人工智能技术结合时,可以极大地提高冰晶检测的准确性和效率。相比于传统方法,这些新型技术具有无损、在线和高效检测冷冻食品中冰晶的潜力,为食品质量控制和保质期评估提供了新的解决方案。尽管这些新型技术在理论和应用上都显示出巨大的潜力,但目前还没有专门系统总结诸多新兴技术应用于冰晶检测的综述性文章。
本文在介绍冰结晶过程及其对冷冻食品质量影响的基础上,综述了冰晶检测技术的最新研究进展,并对各技术未来的发展趋势和面临的挑战进行了分析和展望。期望本文能够为未来冷冻加工食品中冰晶的高效智能化检测技术研究提供新的方向和思路,为研究冰晶的形成、生长规律,研发基于冰晶智能感知的食品冻结保鲜技术,构建冷链贮运过程中食品鲜度劣化控制体系提供助力。
1 冰结晶过程
冰结晶是指水分子在低温条件下排列成有序的晶体结构的过程,它涉及到3个主要的步骤:成核、冰晶生长和重结晶[5]。了解冰结晶的机理和条件对在食品冷冻加工中冰晶的检测具有重要意义。
1.1 成核
成核是指水分子在低温下聚集形成稳定的冰晶核的过程,它是一个随机过程,也是冰结晶的起始阶段,对冰晶的形态、大小、数量和分布状态至关重要。成核温度与过冷度直接相关,是控制冰晶的重要问题[6]。成核可以分为自发成核和异相成核2种类型,其中自发成核是指水分子在没有外界干扰的情况下自发地形成冰晶核;异相成核是指水分子在有外界物质(如灰尘、细菌、蛋白质等)存在下形成的冰晶核,是冰结晶的主要形式[7]。
1.2 冰晶生长
冰晶生长是已经形成的冰晶核在低温条件下,通过水分子在其表面的积累和排列,逐渐转变为冰晶结构,从而增加冰晶体积的过程,它是冰结晶的发展阶段,涉及到水分子从液态转变为固态冰晶的相变,以及冰晶结构的有序生长。冰晶生长时,局部应力增加,直到生长被周围压力所阻止[8]。冰晶生长的速率取决于冷冻温度、冷冻速率以及食品成分等因素[9]。此外,超声波、高压、微波、电场和磁场等物理场[10-14],以及一些糖醇类、生物类、蛋白质水解产物和天然多酚等物质的添加[15-17],都会在一定程度上促进或抑制冰晶的生长。
1.3 重结晶
重结晶期发生在冷冻食品结晶期之后,是指冰晶在冷冻和冷冻贮存过程中由于温度波动或者其他不稳定因素的发生,使冰晶的数量、大小和形状等发生改变的过程,它是冰结晶趋向于稳定的阶段。重结晶阶段,通常大冰晶由于表面能比小冰晶小而变大,小冰晶由于表面能比大冰晶大而变小甚至消失。重结晶受到贮藏温度、时间、压力和冰晶分布等因素的影响。
2 冰晶对冷冻食品品质的影响
在食品冷冻加工过程中,水分子在低温条件下形成的冰晶会对细胞造成渗透性和机械性损伤。此外,冰晶的形态、数量、大小、分布和稳定性会影响食品的营养、风味、色泽等。
2.1 结晶期
结晶期包括成核和冰晶生长2个阶段[18]。结晶期冰晶对冷冻食品品质的影响主要体现在以下方面:a)组织结构的破坏[3]。当水分子形成冰晶时,会占据比液态水更大的体积,从而产生膨胀力,对食品的细胞和组织结构造成机械性损伤,大型或不规则形状的冰晶更容易刺破细胞膜导致细胞汁液流失,影响食品的营养和感官价值。b)蛋白质和脂质氧化的加速[19]。当水分子形成冰晶时,会使得食品中原来自然分布的蛋白质和脂质发生分离,从而使蛋白质和脂质更多地暴露于空气中,增加了与氧气接触发生氧化的机会,导致食品的品质降低。
2.2 重结晶期
重结晶会导致晶体形态的变化,对冷冻食品品质的影响主要体现在以下方面[20]:a)冰晶尺寸的增大。重结晶期,由于温度波动等因素,会导致小冰晶融化和大冰晶生长。冰晶尺寸的增大会加剧组织结构的破坏和水分流失,影响食品的品质。b)冰晶形态的改变。重结晶期,由于温度变化、溶液浓度变化、外界物质存在等因素,会导致冰晶从一种形态转变为另一种形态,例如从球状转变为柱状或针状等。冰晶形态的改变可能会影响食品的感官品质。c)冰晶分布的不均匀。重结晶期,由于温度梯度、溶液流动、外界物质干扰等因素,会导致冰晶在食品中不均匀的分布。冰晶分布的不均匀可能会影响食品的密度、弹性和硬度等性质。
3 冰晶检测技术的研究
冰晶检测技术的发展改进了冷冻食品中冰晶的表征和研究方法,有助于了解结晶成核、生长和重结晶等物理化学现象,提高食品加工和贮藏过程中结晶的控制能力[21]。传统的冰晶检测主要以显微镜观察为主,基于光学、电学、磁学、声学等物理方法的新型冰晶检测技术因具有无损在线表征冰晶的优势成为近年来研究的热门。
3.1 传统检测技术
基于显微镜的传统冰晶检测方法主要包括传统光学显微镜、电子显微镜和原子力显微镜,尤其传统光学显微镜和电子显微镜是直接或间接检测冰晶形态、大小和分布状态最常使用的方法,可以作为开发和评价新型高效冰晶检测技术的基础参考。
3.1.1 基于传统光学显微镜的冰晶检测技术
传统光学显微镜是利用光学原理,把人眼所不能分辨的微小物体放大成像,以供人们提取微细结构信息的光学仪器。传统光学显微镜是直观观察冷冻食品内部冰晶最常采用的方法,但其缺点和不足是一般只能观察经切片和染色等一系列复杂处理之后样品的冰晶,无法对冷冻过程中的样品进行实时的动态观察。图1是LUAN等[22]利用传统光学显微镜观察到的不同冷冻过程中采用冷冻切片与冷冻替代2种方法得到的冷冻带鱼肌肉的冰晶形态照片(图中白色区域),由图1可以看出,冷冻切片法与冷冻替代法所观察到的冰晶痕迹形状没有明显差异。同时,LUAN等[22]从冰晶的横截面积、圆度、拉伸度和当量直径等方面证明了冷冻切片法与冷冻替代法所观察到的冰晶并没有显著性差异,即冷冻切片法和冷冻替代法都可以用于冰晶观察,但与冷冻替代法相比,冷冻切片法极大缩短了时间并相应提高了效率,更适用于观察冷冻带鱼肌肉组织中的冰晶。CHOI等[23]结合苏木精和伊红染色处理,利用传统光学显微镜观察了射频、空气和微波3种解冻方式下肌肉纤维内的冰晶,结果显示,射频解冻肌肉纤维内所形成的冰晶比空气和微波解冻都小。通过观察冰晶的形成行为,可以直观判断不同冷冻条件下冷冻食品的质量[24]。随着显微镜和冷冻技术的发展,科研人员将显微镜、冷冻装置与激光技术相结合,开发了一些可用于实时观察食品冷冻过程中冰晶形成的低温显微镜[25]。EVANS等[26]将共聚焦激光扫描显微镜(confocal laser-scanning microscopy, CLSM)与导热台联合使用,动态观察了真菌蛋白的冻融循环并原位测量了其冰晶尺寸,同时对水(含荧光素)、蛋清蛋白溶液和蛋清蛋白凝胶也进行了冰晶尺寸测定。同时,EVANS等[26]指出该方法的主要优点是可以在固体样品中直接确定冰晶尺寸,而不会因为试图获得更薄的样品而引起任何微观结构变化,并且消除了与转移冷冻样品相关的问题,但该方法明显的缺点是,样品必须能够发出荧光,而且自体荧光样品和具有荧光标记的样品比简单地吸收荧光团的样品具有优势,因为前两者可以直接观察感兴趣的材料。CLSM是观察界面蛋白质分布、乳液液滴大小和乳液聚集度的常用工具[27],具有高分辨率、三维成像、非侵入性、实时观察,以及可结合荧光标记增强信号等优点,其缺点和不足是该设备一般成本高昂、操作复杂,所观察样品的深度受限并且对样品的透明度有一定要求。

A-未冻结带鱼的显微照片;B--20 ℃下的常规空气冷冻法的冷冻切片照片;C--20 ℃下的常规空气冷冻法的冷冻替代照片;D--80 ℃下的冰箱低温冷冻法的冷冻切片照片;E--80 ℃下的冰箱低温冷冻法的冷冻替代照片;F--196 ℃下的液氮浸泡冷冻法的冷冻切片照片;G--196 ℃下的液氮浸泡冷冻法的冷冻替代照片
图1 不同冷冻过程中冷冻切片与冷冻替代法观察到的冷冻带鱼肌肉的显微照片
Fig.1 Micrographs of frozen hairtail muscles by cryosectioning versus cryosubstitution during different freezing processes
3.1.2 基于电子显微镜的冰晶检测技术
电子显微镜具有高分辨率、高精确度等优点,可以观察冷冻样品中的冰晶的形态、大小和分布,从而评估冷冻过程中冷冻条件、冷冻速率、冷冻剂等因素对冰晶形成的影响。用于冷冻食品中冰晶分析的电子显微镜主要包括扫描电子显微镜(scanning electron microscopy, SEM)和透射电子显微镜(transmission electron microscopy, TEM)。SEM和TEM都需要经过仔细的固定和脱水等样品制备与处理,以确保最佳成像质量。研究人员使用SEM研究发现,通过提高冷冻速率、使用超声辅助浸渍冷冻和脉冲电场辅助冷冻能够使被冷冻样品形成更圆更小的冰晶[28-30]。MEZIANI等[31]利用TEM观察了快速冷冻面团(-40 ℃和液氮冷冻)中酵母细胞内形成的冰晶(图2)。YOON等[32]采用TEM对冷冻鸡胸肉在贮藏过程中的冰晶形成进行了评价,发现用10%的磷酸三钠和三聚磷酸钠溶液处理鸡胸肉可最大限度地抑制冰晶的生长。SU等[33]采用SEM对冷冻面团的微观结构进行表征时发现,与未添加羧甲基纤维素钠(carboxymethyl cellulose, CMC)的对照组相比,添加不同含量的CMC的实验组形成的冰晶更小,尺寸更均匀。然而,电子显微镜设备昂贵、样品制备复杂且不适用于在线监测等弊端在一定程度上限制其在冰晶检测方面的应用。
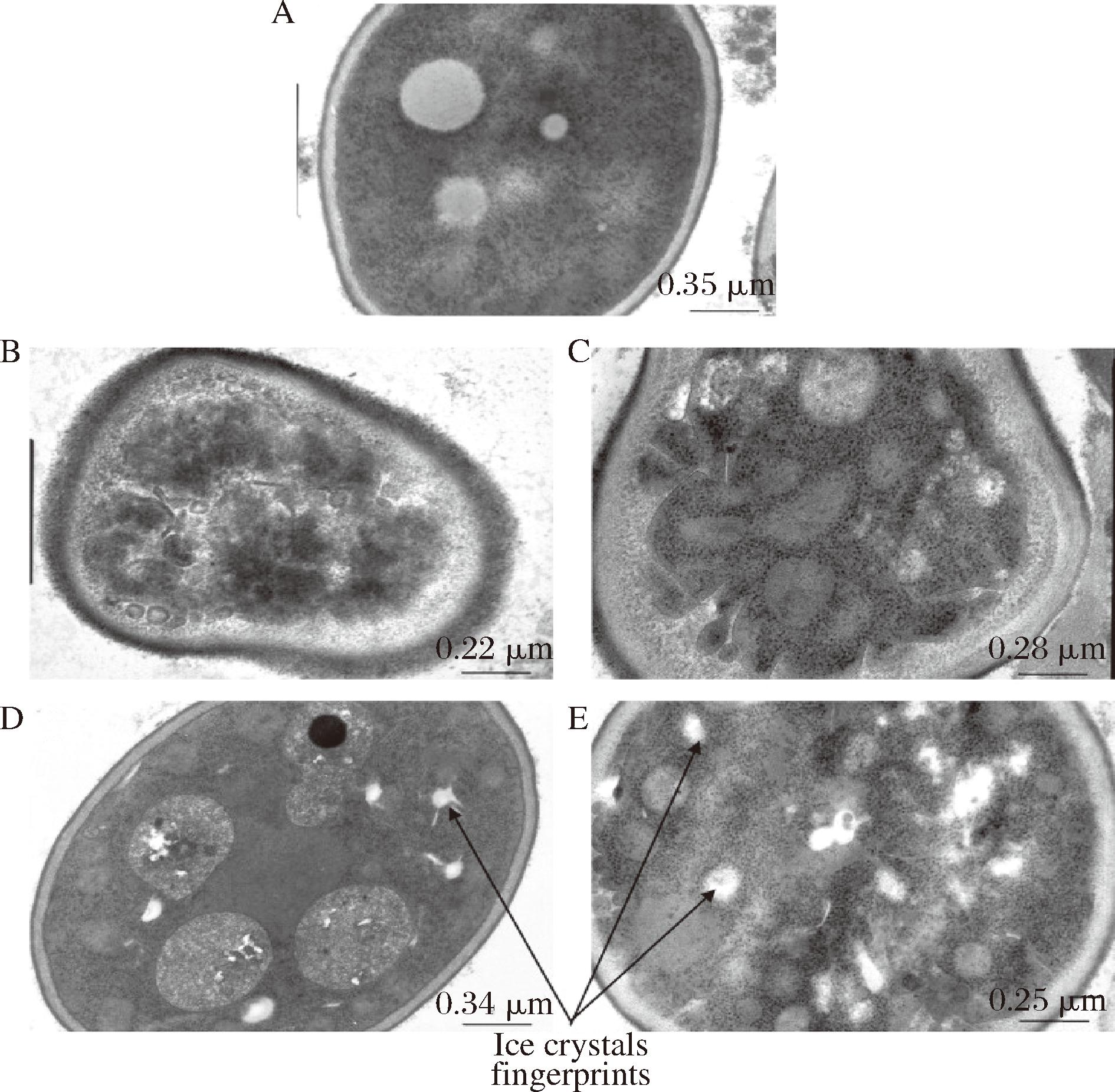
A-未冻结面团中的酵母;B--20 ℃下冻结的面团中的酵母;C--30 ℃下冻结的面团中的酵母;D--40 ℃下冻结的面团中的酵母;E-液氮中冻结的面团中的酵母
图2 面团的透射电子显微镜照片
Fig.2 TEM micrographs of dough
3.2 基于光学方法的新型冰晶检测技术
在冷冻食品冰晶检测领域具有潜力的光学技术主要是近红外光谱(near-infrared spectroscopy, NIR)、拉曼光谱和X射线计算机断层成像(X-ray computed tomography, X-CT)等。另外,MATSUMURA等[34]证明了太赫兹光谱亦可用于观察冰的升华,并可用于测量水和冰。
3.2.1 基于近红外光谱的冰晶检测技术
NIR是波长为780~2 526 nm的吸收光谱,是一种适用于预测样品化学和物理性质的分析方法。NIR的吸收与有机分子中含氢基团(O—H、N—H、C—H)的振动有关,可以指示食品材料中的化学成分并进行无损定量测定[35]。目前,NIR已广泛应用于各农产品和食品领域,为食品的掺假、分类、食品成分的定性和定量检测、冷冻干燥过程的控制以及食品安全的快速无损检测提供了技术保障。近年来,小型化和便携式的NIR仪器得到了越来越多的应用[36],而且实现了与智能手机的融合使用[37]。利用NIR可以检测样品在冻干过程中的残留水分[38],并辅助分析水的结构[39]。对于冷冻加工过程中冰晶的检测,BOLLIGER等[40]使用在线NIR对模型冰糕的冰晶尺寸进行了测量,在使用相同的粒度分析方法(基于2D平面上的晶体投影)对冰晶进行分析时,发现在线NIR测量的绝对值比光学显微镜的测量数据要小一个恒定值,并指出这种偏差可归因于在线NIR和光学显微镜分析之间的时间滞后,在光学显微镜分析前可能会有进一步的冰晶生长,导致冰晶的直径更大。DO等[41]采用低温微切片NIR光谱成像系统对冷冻材料中的冰晶进行识别并分析了其三维形态,结果表明冰晶在冻结过程中是沿传热方向形成的,并指出该方法为研究冻结条件对冰晶形态、大小和分布的影响提供了一种新的工具。然而,NIR光谱谱带重叠严重,谱峰较宽,灵敏度受限,且校正和标准化复杂可能限制了NIR技术在冰晶检测领域的发展。
3.2.2 基于拉曼光谱的冰晶检测技术
拉曼光谱,是一种散射光谱,其分析法是基于印度科学家C.V.拉曼(Raman)所发现的拉曼散射效应,对与入射光频率不同的散射光谱进行分析以得到分子振动、转动方面的信息,并应用于分子结构研究的一种分析方法。在大气科学领域,REICHARDT等[42]根据测量的水的拉曼光谱准确地确定了液态水和冰的含量,并讨论和量化了影响含水量测量精度的仪器和光谱参数。在冷冻食品冰晶检测方面,HUEN等[43]根据冰晶的特定拉曼光谱对冰晶进行了可靠的识别,并可视化了冷冻面团基质中的冰晶结构,指出冰在冷冻面团中表现为连续相,而不是孤立的晶体,图3是其采用2种光谱数据处理方法(波段积分和多元线性回归)得到的样品中各个面团成分的相对空间分布,可以看出2种数据处理方法都可以较好地识别出冰晶并对其形态大小进行测量。拉曼光谱具有实现无损检测冷冻食品中冰晶形态大小和分布的潜力,未来研究应集中在减少其重叠信号、消除定量误差、建立标准化的拉曼光谱数据库等方面[44]。

A-波段积分下的淀粉分布;B-多元线性回归下的淀粉分布; C-波段积分下的冰晶分布;D-多元线性回归下的冰晶分布;E-波段积分下的面筋分布;F-多元线性回归下的面筋分布;G-波段积分下的酵母分布;H-多元线性回归下的液态水分布;I-多元线性回归下的面团成分综合图
图3 基于2种拉曼光谱数据处理方法得到的面团成分的分布
Fig.3 Distribution of the dough components based on two Raman spectroscopy data processing methods
注:红色表示淀粉;黄色表示面筋;白色表示冰;绿色表示液态水。
3.2.3 基于X射线计算机断层成像的冰晶检测技术
X-CT是一种用于内部结构无损和可视化检测的技术,具有高分辨率、非破坏性和能够三维成像等优点,其原理是根据对不同辐射剂量的X射线的吸收来显示食品组织的截面结构并通过计算机3D重建呈现三维结构[45]。X-CT不仅被用于检测冻伤[46]、观察冷冻样品微观结构[47]、表征重结晶过程[48],还被应用于食物冷冻过程中冰晶结构可视化检测[49]。KOBAYASHI等[50]使用同步加速X-CT在冷冻草莓中直接观察冰晶,并指出较高的冰成核率并不一定能防止冷冻食品质量的下降。VICENT等[51]采用X-CT成像可视化了贮存过程中的3D冰晶生长,指出在动态温度下,冰晶尺寸随着贮存时间的延长而增加,冰晶的数量在贮存一段时间内减少,并通过3D图像分析,量化了贮存期间胡萝卜组织中的冰晶变化(图4)。随后,相继有研究人员采用类似方法通过X-CT描述了实验样品冷冻过程形成的冰晶的大小[12,52]。然而,X-CT的设备成本高、数据处理复杂,且高能X射线虽然可以提供高分辨率图像并允许重建样品的3D结构,但需要仔细设计实验设置和测量参数,以避免样品变形或光束损坏。
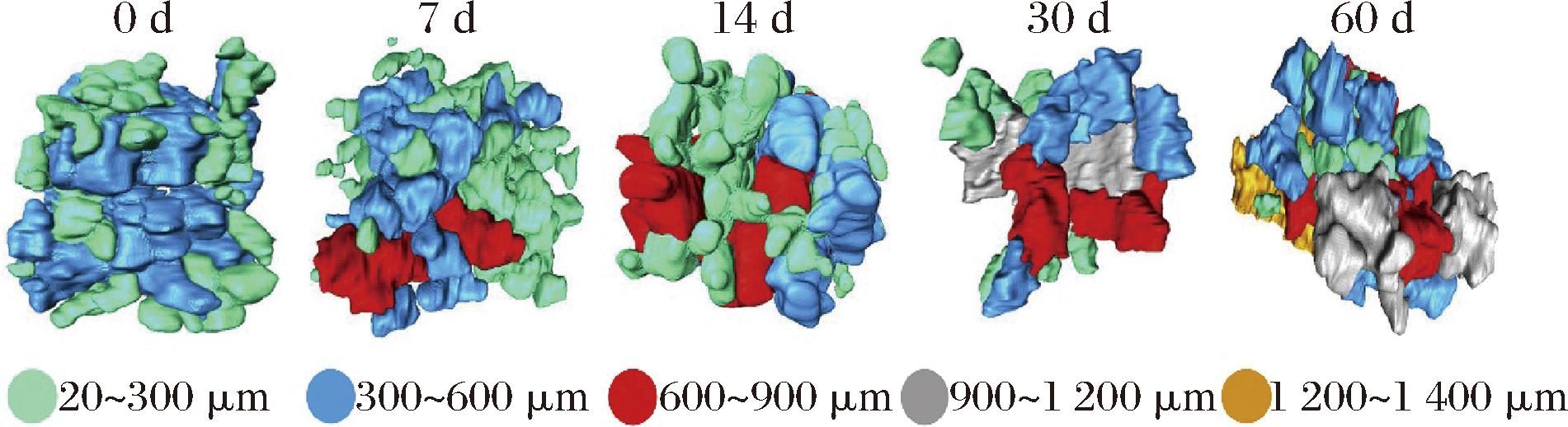
图4 在2个月的贮存期内,在动态变化温度下贮藏的同一胡萝卜组织样品的不同冰晶数据的3D体积渲染
Fig.4 3D volume renderings of the isolated ice crystal data of the same carrot tissue sample stored under dynamically changing temperature scenarios over a two-month storage period
3.3 基于电学方法的新型冰晶检测技术
在冷冻过程中,食品中水分从液态转变为固态冰,而水和冰在电学特性上具有很大的差异,冰比液态水具有更高的电阻抗和更低的电导率,且冰晶形成越快,阻抗增加越快,电导率降低越快,所以冷冻过程中通常伴随着阻抗的增加和电导率的降低[52],只是具体的变化规律可能会因不同的食品类型和处理方式而有所不同。基于此,食品的电学特性在质量监测和过程控制方面受到越来越多的关注[53]。基于对不同食品成分特性的响应差异,电阻抗分析已被报道用于无损检测为提高鱼体质量以获得更高经济价值而向未冷冻金枪鱼样品中添加的注射水[54]、橘子或葡萄柚的冻害[55-56],以及评估冻融过程中猪肉样品细胞的损伤[57]等。CRUZ等[58]采用自行搭建的测量装置,通过检测冷冻蔗糖溶液的电导率实现了对冰含量的测定。与基于光学特性的新型冰晶检测技术不同,目前基于电学特性的冰晶检测技术缺少在不同类型食品方面的大量实验探究。利用电阻抗或电导率等电学特性检测冰晶的形成和生长具有便捷、非破坏性、实时在线和高灵敏度等优点,但是其数据解释复杂、应用可能会受食品类型的限制,与其他类型的检测和分析方法结合使用可能会极大提高冰晶检测的准确性和效率。
3.4 基于磁学方法的新型冰晶检测技术
磁学特性在冷冻食品加工中的应用主要是低场核磁共振(low-field nuclear magnetic resonance, LF-NMR)和磁共振成像(magnetic resonance imaging, MRI)。LF-NMR是一种新兴工具,可用于无损检测食品加工和贮存过程中的水分含量[59]、水分迁移[60],以及水分状态和分布[61]。MRI是一种伪彩色成像,可以显示水中氢质子的密度,用于反映食品的水分含量、分布及质地,并且可以呈现食品的不同水相(游离水/结合水)的信号[62]。LF-NMR和MRI具有非侵入性、快速等特点,其在线监测可以及时提供食品加工质量参数信息,从而改善操作流程,提高产品质量,增强食品领域的生产经济性[63]。冷冻过程中冰晶的形成或水分的减少很容易观察到核磁共振信号强度的变化[64]。MAHDJOUB等[65]通过MRI监测了蔗糖溶液冷冻过程中冰的形成,并通过高分辨率MRI观察了冷冻基质的空间冰分布。KERR等[66]根据冰的形成会导致空间位置上核磁共振信号强度的降低这一特征,采用相应的食品冷冻监测设备,通过MRI监测了土豆、胡萝卜、豌豆、玉米和鸡腿等冷冻过程中冰的形成和变化,但并没有对所形成的冰晶的含量和大小及其监测的准确性和精度进行量化分析。HINDMARSH等[67]使用非侵入性二维MRI图像跟踪了成核的空间位置和液滴的晶体生长,并实现了对晶体生长速率和光学不透明冷冻液滴的未冻结液体质量分数的量化。总之,核磁共振已被证明是监测冷冻过程冰晶形成和生长的有效方法,但其不够灵敏,且空间分辨率有限,需要针对不同的实际应用进行专门的开发[68]。
3.5 基于声学方法的新型冰晶检测技术
声学检测主要基于声波在不同介质中的传播特性不同。在冷冻过程中,食品中的水分从液态到固态通常会伴随着声波速度和声衰减的增加。利用声波的传播特性进行超声波检测或声学成像或许能够检测冰晶的形成、生长和分布状态。超声等声学方法在食品领域的应用已经很普遍,特别是应用于冷冻加工食品品质的提高[69]。对于冰晶的检测,YUCEL等[70]研究指出,超声波衰减测量有可能应用于测量复杂食品基质中的结晶动力学并实现在线应用。APARICIO等[71]利用测量通过给定样品的声速可以确定具有代表性的食物的总温度和冰含量,并测定鳕鱼的温度与声速以及温度与冰含量的对应关系,其实验测得的鳕鱼的冰含量与声速的对应值与理论计算值有很好的一致性。声学检测具有非破坏性、实时在线等优点[72],但其数据解释复杂、设备成本高。与基于电学方法的冰晶检测一样,目前利用声学方法进行冰晶检测还缺少在不同类型食品方面的大量实验探究,但其无损、在线和便捷的优势使其在冰晶的高效智能检测中具有很大的应用前景。
3.6 其他潜在的冰晶检测技术
除此之外,还有一些其他潜在技术在冷冻食品的冰晶检测方面表现出了巨大的潜力,这些技术主要包括激光雷达、热成像和差示扫描量热法(differential scanning calorimetry, DSC)等。
激光雷达通常用于远程感测,通过发射激光脉冲并测量其反射光来获取对象的信息,广泛用于检索卷云的微观物理学。目前可利用激光雷达实现对卷云中冰晶形状和尺寸[73]以及冰晶粒子数浓度[74]的测量或评估,但是其穿透能力、安全性以及数据处理的复杂性和成本可能使其不太适合用于食品中冰晶的检测。热成像是一种非接触式的温度测量技术,它通过捕捉物体表面的红外辐射来生成温度分布的图像,具有非接触性、实时直观等优点。在冷冻过程中,食品的温度变化和冰晶的形成可以通过热成像技术捕捉和分析。热成像已被用于以低空间分辨率提供冰传播的定性描述,并被证明可以实现对冰生长的高质量成像,从而为定量测量固体材料中的冰生长动力学和冰成核提供了可能[75],但其测量的通常只是样品表面的温度分布、受环境因素影响大,对于食品内部冰晶的准确检测和分析可能需要结合其他的冰晶检测方法。DSC是通过测量样品在加热或冷却过程中与参考物质相比所吸收或释放的热量来分析物质的热性质,具有高灵敏度、量化分析和小样本量等优点。CHEN等[76]采用DSC研究了不同配方的小麦面包冷冻时冰的形成和分布。然而,DSC一般不适合生产线上的实时监控,且设备成本较高,通常用于实验室分析。
4 挑战与趋势
冷冻食品中冰晶检测技术面临的挑战主要体现在技术、样品多样性和数据分析等方面。首先是技术挑战,当前的冰晶检测技术,尤其是传统冰晶检测方法,虽然准确但操作复杂,难以实现实时和在线监测。而基于物理方法的新型冰晶检测技术,尽管具有无损在线检测的优势,但仍面临着成本高、数据处理复杂等问题。再者是样品多样性挑战,不同类型的冷冻食品在冰晶形成和生长的特性上存在差异,这就要求冰晶检测技术能够适应不同样品的特性,提高其普适性和准确性。最后是数据分析挑战,随着技术的进步,冰晶检测产生的数据量急剧增加。如何准确、高效地处理和分析这些数据,成为当前的重要挑战之一。
在食品科学与工程领域,冷冻食品中冰晶检测技术的发展趋势正朝着几个关键方向发展。首先是技术融合,预计将出现更多跨学科技术的结合,特别是人工智能、机器学习与传统检测技术的结合,以提高检测的准确性和效率。其次,设备的小型化和便携化将成为未来的重要发展方向,这将使冰晶检测技术更适用于现场快速检测。最后,技术的发展将更加重视实时和在线监测的能力,这对于更有效地控制冷冻过程和提高食品品质至关重要。这些发展趋势共同推动了冷冻食品品质控制领域的进步。
5 总结与展望
冷冻食品冰晶检测技术的研究和应用旨在提高食品冷冻过程的效率和质量控制。本文介绍了冷冻食品中冰晶检测技术的原理、特点和应用实例。总体而言,传统检测技术相对直观准确,但样品处理过程复杂,可以作为开发新型高效冰晶检测技术的重要参考。相对而言,基于光学、电学、磁学和声学方法的新型检测技术可以从多个角度去表征冰晶,具有实时、在线和无损检测的优势,并且其通常可以结合人工智能方法极大地提高冰晶检测的准确性和效率。冰晶检测技术的挑战和趋势显著地指示了这一技术在未来冷冻食品品质控制和技术创新方面的重要性。未来,期望开发出能够根据不同食品种类和性质的差异而自动适配最佳冰晶检测技术的方法,并借助人工智能技术自动调节该方法对于冰晶检测的最佳参数设置。实时、在线、无损和快速的冰晶智能化感知与控制技术,将在很大程度上提高冷冻食品的品质,并有望成为冷冻食品加工领域未来的一个重要研究方向。
[1] JIA G L, CHEN Y M, SUN A D, et al. Control of ice crystal nucleation and growth during the food freezing process[J]. Comprehensive Reviews in Food Science and Food Safety, 2022, 21(3):2433-2454.
[2] KANG T, YOU Y, JUN S. Supercooling preservation technology in food and biological samples: A review focused on electric and magnetic field applications[J]. Food Science and Biotechnology, 2020, 29(3):303-321.
[3] DALVI-ISFAHAN M, JHA P K, TAVAKOLI J, et al. Review on identification, underlying mechanisms and evaluation of freezing damage[J]. Journal of Food Engineering, 2019, 255:50-60.
[4] TAN M T, YE J X, CHU Y M, et al. The effects of ice crystal on water properties and protein stability of large yellow croaker (Pseudosciaena crocea)[J]. International Journal of Refrigeration, 2021, 130:242-252.
[5] WANG Y, LIANG H, XU R Y, et al. Effects of temperature fluctuations on the meat quality and muscle microstructure of frozen beef[J]. International Journal of Refrigeration, 2020, 116:1-8.
[6] TAN M T, MEI J, XIE J. The formation and control of ice crystal and its impact on the quality of frozen aquatic products: A review[J]. Crystals, 2021, 11(1):68.
[7] MOUSAZADEHKASIN M, MITCHELL N, ASENATH-SMITH E, et al. Ice nucleation promotion impact on the ice recrystallization inhibition activity of polyols[J]. Biomacromolecules, 2023, 24(2):678-689.
[8] GERBER D, WILEN L A, POYDENOT F, et al. Stress accumulation by confined ice in a temperature gradient[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(31): e2200748119.
[9] BAI Y, GUO Y P, DING D M, et al. Investigation of the effect of pork compositions on freezing points in different pork cuts by measuring thermal properties and water mobility and distribution[J]. Animal Science Journal=Nihon Chikusan Gakkaiho, 2021, 92(1): e13659.
[10] SUN Q X, ZHAO X X, ZHANG C, et al. Ultrasound-assisted immersion freezing accelerates the freezing process and improves the quality of common carp (Cyprinus carpio) at different power levels[J]. LWT, 2019, 108:106-112
[11] YUN X Y, ZHANG X Y, SARULA, et al. Change of the frozen storage quality of concentrated Mongolian milk curd under the synergistic action of ultra-high pressure and electric field[J]. LWT, 2023, 177:114462.
[12] SADOT M, CURET S, CHEVALLIER S, et al. Microwave assisted freezing part 2: Impact of microwave energy and duty cycle on ice crystal size distribution[J]. Innovative Food Science &Emerging Technologies, 2020, 62:102359.
[13] XIE Y, ZHOU K, CHEN B, et al. Applying low voltage electrostatic field in the freezing process of beef steak reduced the loss of juiciness and textural properties[J]. Innovative Food Science &Emerging Technologies, 2021, 68:102600.
[14] SUN Q X, ZHANG H H, YANG X Q, et al. Insight into muscle quality of white shrimp (Litopenaeus vannamei) frozen with static magnetic-assisted freezing at different intensities[J]. Food Chemistry: X, 2023, 17:100518.
[15] ZHU H S, LI J H, SU Y J, et al. Sugar alcohols as cryoprotectants of egg yolk: Inhibiting crystals and interactions[J]. Journal of Food Engineering, 2023, 342:111360.
[16] SAKI N, GHAFFARI M, NIKOO M. Effect of active ice nucleation bacteria on freezing and the properties of surimi during frozen storage[J]. LWT, 2023, 176:114548.
[17] SHANG S, WANG Y Y, JIANG P F, et al. Progress in the application of novel cryoprotectants for the stabilization of myofibrillar proteins[J]. Critical Reviews in Food Science and Nutrition, 2024,64(27):9756-9770.
[18] LIBBRECHT K G. Physical dynamics of ice crystal growth[J]. Annual Review of Materials Research, 2017, 47:271-295.
[19] WEI P Y, ZHU K X, CAO J, et al. The inhibition mechanism of the texture deterioration of Tilapia fillets during partial freezing after treatment with polyphenols[J]. Food Chemistry, 2021, 335:127647.
[20] JIA H, ROY K, PAN J F, et al. Icy affairs: Understanding recent advancements in the freezing and frozen storage of fish[J]. Comprehensive Reviews in Food Science and Food Safety, 2022, 21(2):1383-1408.
[21] HARTEL R W. Advances in food crystallization[J]. Annual Review of Food Science and Technology, 2013, 4:277-292.
[22] LUAN L L, WANG L P, WU T T, et al. A study of ice crystal development in hairtail samples during different freezing processes by cryosectioning versus cryosubstitution method[J]. International Journal of Refrigeration, 2018, 87:39-46.
[23] CHOI E J, PARK H W, CHUNG Y B, et al. Effect of tempering methods on quality changes of pork loin frozen by cryogenic immersion[J]. Meat Science, 2017, 124:69-76.
[24] YANG Z K, YE G S, YANG D Z, et al. Observation on the ice crystal formation process of large yellow croaker (Pseudosciaena crocea) and the effect of multiple cryoprotectants pre-soaking treatments on frozen quality[J]. Cryobiology, 2023, 113:104580.
[25] TAO Y, GUO Y P, LI J W, et al. Effect of temperature fluctuation during superchilling storage on the microstructure and quality of raw pork[J]. Meat Science, 2023, 198:109096.
[26] EVANS J, ADLER J, MITCHELL J, et al. Use of confocal laser scanning microscope in conjunction with a conduction heat transfer stage in order to observe dynamically the freeze-thaw cycle in an autofluorescent substance and to measure ice crystal size in situ[J]. Cryobiology, 1996, 33(1):27-33.
[27] LIU X, DENG Z Y, ZOU Y, et al. Preparation of high freeze-thaw stable wheat gluten-based emulsions by incorporated deep eutectic solvents[J]. Food Hydrocolloids, 2020, 98:105280.
[28] DAWSON P, AL-JEDDAWI W, RIECK J. The effect of different freezing rates and long-term storage temperatures on the stability of sliced peaches[J]. International Journal of Food Science, 2020, 2020:9178583.
[29] ZHANG C, LI Y X, XIA X F, et al. Changes in muscle quality and physicochemical characteristics of chicken breast subjected to ultrasound-assisted immersion freezing during long-term frozen storage[J]. International Journal of Refrigeration, 2022, 142:10-18.
[30] ZHANG R J, DING F Y, ZHANG Y, et al. Freezing characteristics and relative permittivity of rice flour gel in pulsed electric field assisted freezing[J]. Food Chemistry, 2022, 373:131449.
[31] MEZIANI S, IOANNOU I, JASNIEWSKI J, et al. Effects of freezing treatments on the fermentative activity and gluten network integrity of sweet dough[J]. LWT-Food Science and Technology, 2012, 46(1):118-126
[32] YOON K S. Texture and microstructure properties of frozen chicken breasts pretreated with salt and phosphate solutions[J]. Poultry Science, 2002, 81(12):1910-1915.
[33] SU T C, DU W K, DENG B Y, et al. Effects of sodium carboxymethyl cellulose on storage stability and qualities of different frozen dough[J]. Heliyon, 2023, 9(8): e18545.
[34] MATSUMURA K, KAWASE K, TAKEYA K. Observation of sublimation of ice using terahertz spectroscopy[J]. Royal Society Open Science, 2020, 7(9):192083.
[35] WANG J Y, ZHANG M, GAO Z X, et al. Smart storage technologies applied to fresh foods: A review[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(16):2689-2699.
[36] GIUSSANI B, GORLA G, RIU J. Analytical chemistry strategies in the use of miniaturised NIR instruments: An overview[J]. Critical Reviews in Analytical Chemistry, 2024, 54(1):11-43.
[37] CARAM S E T D S, BAQUETA M R, CONCEIÇ
S E T D S, BAQUETA M R, CONCEIÇ O D A, et al. Near infrared spectroscopy and smartphone-based imaging as fast alternatives for the evaluation of the bioactive potential of freeze-dried açai[J]. Food Research International, 2021, 140:109792.
O D A, et al. Near infrared spectroscopy and smartphone-based imaging as fast alternatives for the evaluation of the bioactive potential of freeze-dried açai[J]. Food Research International, 2021, 140:109792.
[38] PRESKAR M, KORASA K, VRBANEC T, et al. Applicability of Raman and near-infrared spectroscopy in the monitoring of freeze-drying injectable ibuprofen[J]. Drug Development and Industrial Pharmacy, 2021, 47(5):758-769.
[39] 赵洪涛, 孙岩, 郭一畅, 等. 近红外光谱用于低温水结构的分析[J]. 高等学校化学学报, 2020, 41(9):1968-1974.ZHAO H T, SUN Y, GUO Y C, et al. Near infrared spectroscopy for low-temperature water structure analysis[J]. Chemical Journal of Chinese Universities, 2020, 41(9):1968-1974.
[40] BOLLIGER S, CLOSS C, ZENG Y, et al. In-line use of near infrared spectroscopy to measure structure parameters of frozen model sorbet[J]. Journal of Food Engineering, 1998, 38(4):455-467.
[41] DO G, ARAKI T, BAE Y, et al. Three-dimensional measurement of ice crystals in frozen materials by near-infrared imaging spectroscopy[J]. Drying Technology, 2015, 33(13):1614-1620.
[42] REICHARDT J, KNIST C, KOUREMETI N, et al. Accurate absolute measurements of liquid water content (LWC) and ice water content (IWC) of clouds and precipitation with spectrometric water Raman lidar[J]. Journal of Atmospheric and Oceanic Technology, 2022, 39(2):163-180.
[43] HUEN J, WEIKUSAT C, BAYER-GIRALDI M, et al. Confocal Raman microscopy of frozen bread dough[J]. Journal of Cereal Science, 2014, 60(3):555-560.
[44] ZHANG W Y, MA J, SUN D W. Raman spectroscopic techniques for detecting structure and quality of frozen foods: Principles and applications[J]. Critical Reviews in Food Science and Nutrition, 2021, 61(16):2623-2639.
[45] SCHOEMAN L, WILLIAMS P, DU PLESSIS A, et al. X-ray micro-computed tomography (μCT) for non-destructive characterisation of food microstructure[J]. Trends in Food Science &Technology, 2016, 47:10-24.
[46] YU S K, WANG N, DING X Y, et al. Detection of pear freezing injury by non-destructive X-ray scanning technology[J]. Postharvest Biology and Technology, 2022, 190:111950.
[47] MASSELOT V, BOSC V, BENKHELIFA H. Influence of stabilizers on the microstructure of fresh sorbets: X-ray micro-computed tomography, cryo-SEM, and focused beam reflectance measurement analyses[J]. Journal of Food Engineering, 2021, 300:110522.
[48] ![]() A, GONDEK E,
A, GONDEK E,  ABA S, et al. Characteristics of instrumental methods to describe and assess the recrystallization process in ice cream systems[J]. Foods, 2019, 8(4):117.
ABA S, et al. Characteristics of instrumental methods to describe and assess the recrystallization process in ice cream systems[J]. Foods, 2019, 8(4):117.
[49] MOUSAVI R, MIRI T, COX P W, et al. Imaging food freezing using X-ray microtomography[J]. International Journal of Food Science &Technology, 2007, 42(6):714-727.
[50] KOBAYASHI R, SUZUKI T. Effect of supercooling accompanying the freezing process on ice crystals and the quality of frozen strawberry tissue[J]. International Journal of Refrigeration, 2019, 99:94-100.
[51] VICENT V, NDOYE F T, VERBOVEN P, et al. Effect of dynamic storage temperatures on the microstructure of frozen carrot imaged using X-ray micro-CT[J]. Journal of Food Engineering, 2019, 246:232-241.
[52] LOCHAN POUDYAL R, MAEKAWA R, REDO M A, et al. Effect of supercooled freezing on the quality of pork tenderloin meat under different thawing conditions[J]. Food Control, 2023, 144:109331.
[53] GROSSI M, LANZONI M, LAZZARINI R, et al. Automatic ice-cream characterization by impedance measurements for optimal machine setting[J]. Measurement, 2012, 45(7):1747-1754.
[54] MELADO-HERREROS  , NIETO-ORTEGA S, OLABARRIETA I, et al. Comparison of three rapid non-destructive techniques coupled with a classifier to increase transparency in the seafood value chain: Bioelectrical impedance analysis (BIA), near-infrared spectroscopy (NIR) and time domain reflectometry (TDR)[J]. Journal of Food Engineering, 2022, 322:110979.
, NIETO-ORTEGA S, OLABARRIETA I, et al. Comparison of three rapid non-destructive techniques coupled with a classifier to increase transparency in the seafood value chain: Bioelectrical impedance analysis (BIA), near-infrared spectroscopy (NIR) and time domain reflectometry (TDR)[J]. Journal of Food Engineering, 2022, 322:110979.
[55] ALBELDA APARISI P, FORTES S NCHEZ E, CONTAT RODRIGO L, et al. A rapid electrochemical impedance spectroscopy and sensor-based method for monitoring freeze-damage in tangerines[J]. IEEE Sensors Journal, 2021, 21(10):12009-12018.
NCHEZ E, CONTAT RODRIGO L, et al. A rapid electrochemical impedance spectroscopy and sensor-based method for monitoring freeze-damage in tangerines[J]. IEEE Sensors Journal, 2021, 21(10):12009-12018.
[56] ROMERO FOGUÉ D, MASOT PERIS R, IB
 EZ CIVERA J, et al. Monitoring freeze-damage in grapefruit by electric bioimpedance spectroscopy and electric equivalent models[J]. Horticulturae, 2022, 8(3):218.
EZ CIVERA J, et al. Monitoring freeze-damage in grapefruit by electric bioimpedance spectroscopy and electric equivalent models[J]. Horticulturae, 2022, 8(3):218.
[57] ABIE S M, MARTINSEN Ø G, EGELANDSDAL B, et al. Feasibility of using electrical impedance spectroscopy for assessing biological cell damage during freezing and thawing[J]. Sensors, 2021, 21(12):4129.
[58] CRUZ C, FONTE C P, DE SIMONE A, et al. Study of fast in-line measurement techniques for water ice characterization[J]. Journal of Food Engineering, 2023, 353:111550.
[59] JIANG Q Y, ZHANG M, MUJUMDAR A S, et al. Effects of electric and magnetic field on freezing characteristics of gel model food[J]. Food Research International, 2023, 166:112566.
[60] SUN Q X, SUN F D, XIA X F, et al. The comparison of ultrasound-assisted immersion freezing, air freezing and immersion freezing on the muscle quality and physicochemical properties of common carp (Cyprinus carpio) during freezing storage[J]. Ultrasonics Sonochemistry, 2019, 51:281-291.
[61] 赵雪, 陈超, 王文博, 等. 低场核磁共振分析乳酸菌细胞中水分分布及其变化[J]. 食品与发酵工业, 2023, 49(7):133-139.ZHAO X, CHEN C, WANG W B, et al. Water distribution and variation in lactic acid bacteria using low-field nuclear magnetic resonance[J]. Food and Fermentation Industries, 2023, 49(7):133-139.
[62] LUO H B, GUO C X, LIN L, et al. Combined use of rheology, LF-NMR, and MRI for characterizing the gel properties of hairtail surimi with potato starch[J]. Food and Bioprocess Technology, 2020, 13(4):637-647.
[63] EZEANAKA M C, NSOR-ATINDANA J, ZHANG M. Online low-field nuclear magnetic resonance (LF-NMR) and magnetic resonance imaging (MRI) for food quality optimization in food processing[J]. Food and Bioprocess Technology, 2019, 12(9):1435-1451.
[64] LEE S Y, MOON S, SHIM J Y, et al. Freezing behaviors of frozen foods determined by H NMR and DSC[J]. Food Science and Biotechnology, 2008, 17(1):102-105.
[65] MAHDJOUB R, CHOUVENC P, SEURIN M J, et al. Sucrose solution freezing studied by magnetic resonance imaging[J]. Carbohydrate Research, 2006, 341(4):492-498.
[66] KERR W L, KAUTEN R J, MCCARTHY M J, et al. Monitoring the formation of ice during food freezing by magnetic resonance imaging[J]. LWT-Food Science and Technology, 1998, 31(3):215-220.
[67] HINDMARSH J P, BUCKLEY C, RUSSELL A B, et al. Imaging droplet freezing using MRI[J]. Chemical Engineering Science, 2004, 59(10):2113-2122.
[68] KIANI H, SUN D W. Water crystallization and its importance to freezing of foods: A review[J]. Trends in Food Science &Technology, 2011, 22(8):407-426
[69] DAS K, ZHANG M, BHANDARI B, et al. Ultrasound generation and ultrasonic application on fresh food freezing: Effects on freezing parameters, physicochemical properties and final quality of frozen foods[J]. Food Reviews International, 2023, 39(7):4465-4495
[70] YUCEL U, COUPLAND J N. Ultrasonic characterization of lactose crystallization in gelatin gels[J]. Journal of Food Science, 2011, 76(1): E48-E54.
[71] APARICIO C, OTERO L, GUIGNON B, et al. Ice content and temperature determination from ultrasonic measurements in partially frozen foods[J]. Journal of Food Engineering, 2008, 88(2):272-279.
[72] BAHRAM-PARVAR M. A review of modern instrumental techniques for measurements of ice cream characteristics[J]. Food Chemistry, 2015, 188:625-631.
[73] KUSTOVA N, KONOSHONKIN A, SHISHKO V, et al. Depolarization ratio for randomly oriented ice crystals of cirrus clouds[J]. Atmosphere, 2022, 13(10):1551.
[74] BÜHL J, SEIFERT P, RADENZ M, et al. Ice crystal number concentration from lidar, cloud radar and radar wind profiler measurements[J]. Atmospheric Measurement Techniques, 2019, 12(12):6601-6617.
[75] ZALAZAR M, ZYPMAN F, DRORI R. Micro-thermography for imaging ice crystal growth and nucleation inside non-transparent materials[J]. Review of Scientific Instruments, 2023, 94(5):054903.
[76] CHEN G, JANSSON H, LUSTRUP K F, et al. Formation and distribution of ice upon freezing of different formulations of wheat bread[J]. Journal of Cereal Science, 2012, 55(3):279-284.