血红素(heme)是一种由Fe2+和原卟啉组成的卟啉衍生物[1]。它是在几乎所有的原核和真核细胞中发现的血红蛋白的一个必要组成部分,在氧气运输、活性氧消除和电子转移等方面发挥重要作用[2]。目前,血红素作为一种有效的生物补铁剂被广泛应用于医疗保健和膳食补充剂行业[3]。在生物体内血红素主要由存在于真菌、动物中的C4合成途径和存在于细菌、植物中的C5合成途径合成[4]。2种途径通过不同的催化步骤,将葡萄糖转化为相同的前体物质5-氨基乙酰丙酸[5],然后经过相同的催化步骤与亚铁离子结合生成血红素。虽然可以使用有机萃取或酶水解[6]的方法从生物样品(如植物组织和动物血液)中获取血红素,但这些方法存在着步骤复杂、产量低、耗时且不环保等问题。为了解决上述问题并满足医疗保健和食品工业的需求,生物发酵法受到关注,其中大肠杆菌生产血红素已经得到实现[7]。然而,该方法存在着宿主具有内毒素、质粒遗传不稳定等问题。因此,需要寻找一种新的宿主代替大肠杆菌生产血红素以满足医疗保健和食品工业的需求。
巴斯德毕赤酵母(Pichia pastoris)作为真核生物,对小分子化合物的表达水平较高,具有较强的翻译后修饰能力[8],更有利于外源蛋白的表达[9],且比普通酵母具有更强的产物耐受力[10]。毕赤酵母作为甲醇营养型酵母,能够以甲醇为唯一碳源和能源快速生长,具有高密度发酵、培养成本低的优势[11],从而具有较大的生产潜力。另外,毕赤酵母也是公认安全、无毒且无致病性风险的菌株,此前已有相应的重组毕赤酵母菌株被美国FDA认定为安全菌株(generally recognized as safe, GRAS) [12]。同时,在毕赤酵母中外源基因通常通过同源重组的方式整合到毕赤酵母基因组上,具有较高的遗传稳定性。
在前期研究过程中,利用毕赤酵母高密度发酵的特点,通过敲除血红素降解基因等方法,成功构建了一株高产血红素的毕赤酵母HEME-9[13],在摇瓶水平上,血红素产量达到2.93 mg/L,较出发菌株提升了37.58倍。但是,摇瓶水平发酵过程难以控制pH、溶解氧等参数,摇瓶阶段的发酵条件也不能应用于规模化生产。为了实现摇瓶发酵到规模化生产的过渡,以及得到一种适合毕赤酵母工业化生产血红素的发酵方法,本研究在发酵罐水平上考察了pH值、亚铁离子添加量、温度以及溶氧水平对血红素积累的影响。通过探索不同的发酵条件,最终强化了在5 L发酵罐水平上血红素的生产,为实现发酵法工业化生产血红素提供了一定的参考。
1 材料与方法
1.1 实验材料
1.1.1 菌株
毕赤酵母Pichia Pastoris X33 Heme-9为本研究室在前期的工作中构建[13]。
1.1.2 主要试剂
蛋白胨、酵母提取物,Oxoid公司;卡那霉素,上海生工生物工程有限公司;葡萄糖、甘油、氨水、K2SO4、MgSO4·7H2O、CaSO4、H3PO4,上海国药集团;氯化血红素标品,上海源叶生物科技有限公司。PTM1微量元素,北京酷来搏科技有限公司。
1.1.3 培养基
YPD培养基(g/L):葡萄糖 20,115 ℃灭菌20 min,蛋白胨 20,酵母提取物 1.0;固体培养基中加入20 g/L琼脂,121 ℃灭菌15 min。
5 L发酵罐发酵培养基(BSM培养基,g/L):甘油 40,硫酸钾 18,硫酸钙 0.948,七水硫酸镁 14.9,磷酸27,121 ℃、15 min灭菌后加入PTM1微量元素 4 mL/L。补料培养基:50%甘油,121 ℃、15 min灭菌后加入PTM1微量元素12 mL/L。
1.2 仪器与设备
摇床,上海知楚仪器有限公司;5 L发酵罐,迪必尔生物工程(上海)有限公司;高效液相色谱仪,美国Agilent公司;Nanodrop ND-2000分光光度计,美国Thermo公司;离心机,美国Eppendorf公司;超声破碎仪,美国SONICS &MATERIALS公司。
1.3 实验方法
1.3.1 培养方法
种子液培养:从30 ℃培养48 h的YPD平板上挑选单菌落接种于装有50 mL YPD培养基的250 mL摇瓶中,30 ℃,220 r/min培养24 h(一级活化);将摇瓶中培养好的种子液以10%(体积分数)的接种量转接至250 mL的摇瓶中,装液量50 mL,30 ℃,220 r/min培养24 h(二级活化)。
发酵罐培养:将活化后的种子液以10%(体积分数)接种量接种于装有1.8 L发酵培养基的5 L发酵罐中,分别改变pH值、亚铁离子添加量、温度及补料速度等条件发酵培养156 h。
1.3.2 液相检测条件
血红素的提取:使用超纯水,将发酵液稀释至OD600=10,取0.5 mL稀释的发酵液于1.5 mL的EP管中,与0.5 mL提取液(0.1 mL超纯水+0.1 mL的氨水原液+0.8 mL纯乙腈)混合。使用超声破碎仪破碎酵母细胞,超声破碎(Ampl=40%,10 min),工作5 s,停5 s。将破碎后的溶液以14 000 r/min,4 ℃,离心20 min,取上清液过膜。
血红素的检测:色谱柱:Diamonsil 5 μm C18 150 mm×4.6 mm,检测条件:流速0.4 mL/h;A相:超纯水+0.1%三氟乙酸,B相:乙腈+0.1%三氟乙酸,程序为0~1 min:30%乙腈;1~15 min:30%~100%乙腈;15~19 min:100%乙腈;柱温40 ℃;检测器波长 400 nm;进样量 10 μL。
1.3.3 动力学模型
使用Origin软件对细胞生长的动力学模型进行了模拟,并且发酵过程曲线符合Logistic模型,因此采用该模型进行生长动力学拟合,如公式(1)所示:

(1)
式中:X代表生物量(OD600值);t代表发酵时间;A1、A2、t0、p代表经验参数。
在批量补充发酵过程中,生产血红素的整体趋势与DoseResp模型一致,因此将该模型用于生产动力学拟合。该模型如公式(2)所示:
(2)
式中:Y代表血红素的产量;t代表发酵时间;A3、A4、t1、p代表经验参数[14]。
1.3.4 生物量的测定
紫外-可见分光光度法:吸取适量发酵液稀释到适当的浓度,使用紫外-可见分光光度计测定波长600 nm 处的吸光度值。使用去离子水作为空白对照。OD600=测量值×稀释倍数。
细胞干重法:取1 mL发酵液至预先称重的1.5 mL离心管,室温下12 000 r/min离心5 min,弃上清液,于烘箱中烘干至恒重,计算细胞干重。
1.4 数据处理
所有试验进行3次平行,结果以平均值表示。
2 结果与分析
2.1 发酵pH对血红素产量的影响
研究表明,毕赤酵母适宜生长的pH值范围较广,在3~7均表现出良好的生长趋势,但为了更有利于异源蛋白的高效表达,其发酵pH值通常控制在5~6[15]。因此,本研究将开始补料前的阶段视作生长阶段,控制pH值为5不变;开始补料后视作发酵阶段,控制该阶段pH值为5和6进行发酵验证。当控制发酵阶段pH值为6时,菌株生长状态良好,整个发酵过程持续156 h,血红素产量最高为37.6 mg/L。当控制发酵阶段pH值为5时,在该条件下血红素的产量最高达到42.3 mg/L。由此,毕赤酵母发酵生产血红素更适应于在低pH的条件下进行,进一步考察了降低发酵阶段pH值至4和3对血红素积累的影响。结果表明,在控制pH值为4时,血红素的产量进一步提高,达到57.1 mg/L。然而,当进一步降低pH值至3时,血红素的产量下降了26.6%,仅有41.9 mg/L,与此同时,OD600值出现了明显下降,细胞干重降低至110.0 g/L,约下降14.1%,表明在该pH条件下毕赤酵母的生长受到了抑制。基于此,在后续实验中,将pH值控制为4用作毕赤酵母在发酵阶段生产血红素的发酵条件。
2.2 FeSO4·7H2O添加量对血红素产量的影响
血红素在生物体中的合成途径主要是C4和C5合成途径。在这2种合成途径中,血红素前体物5-氨基乙酰丙酸都需要经过相同的催化步骤生成原卟啉Ⅸ,原卟啉Ⅸ再与亚铁离子结合生成血红素[16],因此,亚铁离子的含量在血红素的生物合成途径中起着相当重要的作用。在前期每日添加2 mL FeSO4·7H2O溶液(50 mg/L)的基础上(图1-C),又优化了亚铁离子的添加量,将添加的FeSO4·7H2O质量浓度分别提高至100 mg/L与150 mg/L,考察毕赤酵母在亚铁离子含量更为充裕时的发酵情况。结果如图2所示,当FeSO4·7H2O添加质量浓度为100 mg/L时,菌株在144 h时达到最大生长量,此时血红素浓度提高了180.3%,达到160.1 mg/L。当FeSO4·7H2O添加质量浓度为150 mg/L时,菌株在156 h时达到最大生长量,血红素最高质量浓度为157.7 mg/L,与前者浓度相当,说明在添加的FeSO4·7H2O质量浓度为100 mg/L时,亚铁离子的含量已经能充分满足毕赤酵母合成血红素的需求,此时亚铁离子的含量已经不再是限制血红素合成的外界因素。同时研究也发现,虽然此时的血红素浓度相较之前有了较大的提升,但是菌株的OD600值却大幅度降低,细胞干重从120.8 g/L分别降低至107.0、104.8 g/L,分别下降11.4%、13.2%,这表明菌株的生长受到了较为明显的抑制,这可能是由于该浓度的血红素超过了毕赤酵母对血红素的耐受区间,导致了血红素对毕赤酵母产生了毒性,从而抑制了毕赤酵母生长。通过加大亚铁离子的供应能够有效地提升毕赤酵母发酵生产血红素的能力。因此,在后续实验中将添加的FeSO4·7H2O质量浓度提升至为100 mg/L。

A-pH值为6;B-pH值为5;C-pH值为4;D-pH值为3
图1 pH对Pichia pastoris X33 HEME-9血红素产量的影响
Fig.1 Effect of pH on HEME-9 titer of Pichia pastoris X33
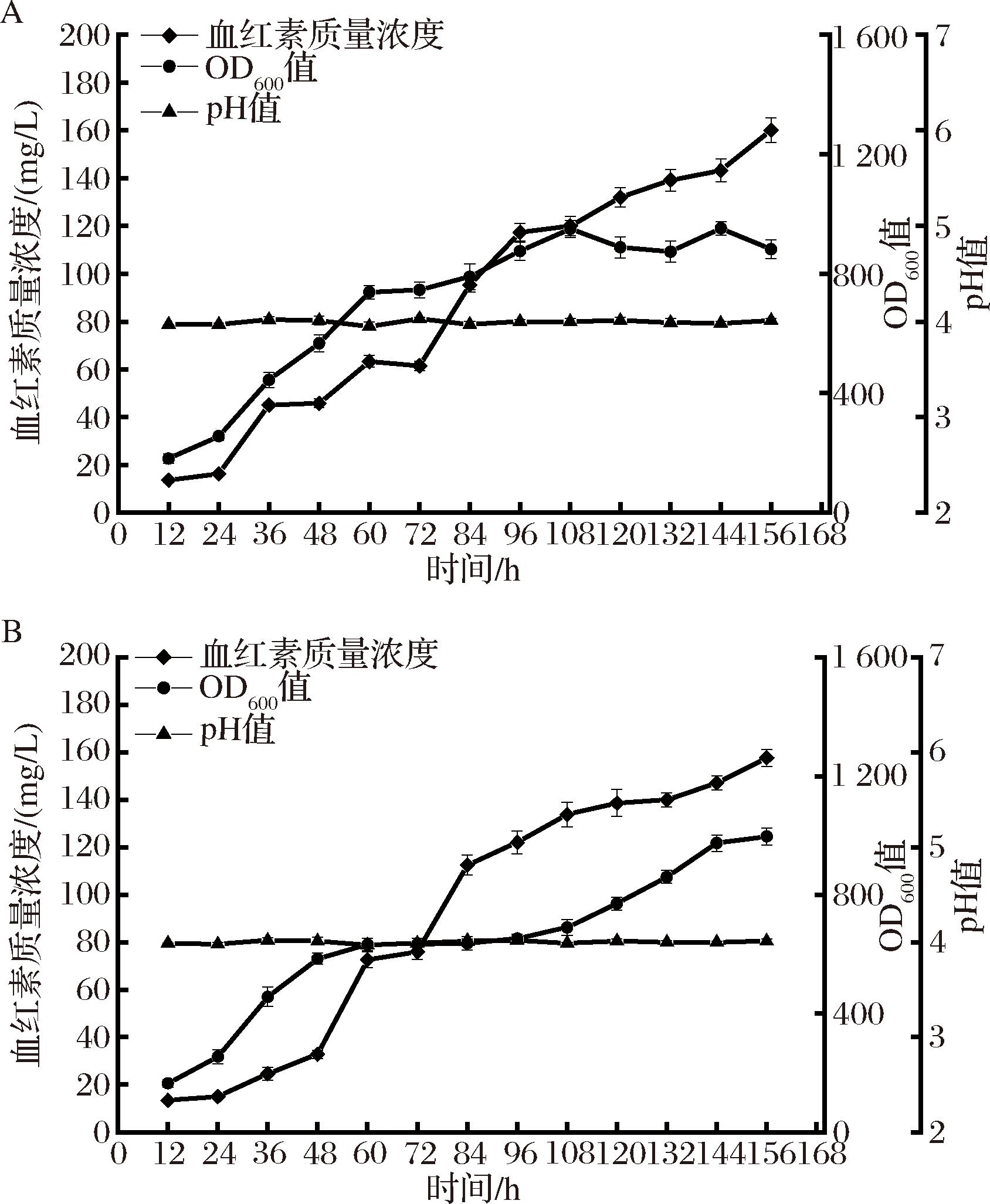
A-添加100 mg/L FeSO4·7H2O;B-添加150 mg/L FeSO4·7H2O
图2 FeSO4·7H2O添加量对Pichia pastoris X33 HEME-9血红素产量的影响
Fig.2 Effect of FeSO4·7H2O on titer of HEME-9 by Pichia Pastoris X33
2.3 发酵温度对血红素产量的影响
温度对毕赤酵母的生长和细胞代谢有着重要的影响,研究表明,在较低温度下对毕赤酵母进行发酵培养时,可以降低细胞死亡率[17-18]。毕赤酵母的最适生长温度为28~30 ℃,但正如先前研究所示,最适宜的生长pH条件并不是最适宜的发酵生产血红素的pH条件,毕赤酵母发酵生产血红素的最适宜温度也有可能并不在28~30 ℃。在毕赤酵母的表达过程中,一般认为温度>32 ℃时就会对蛋白表达有不利影响,并造成细胞死亡。因此,本研究不再考虑在高于30 ℃的条件下进行发酵培养。在毕赤酵母的甲醇诱导体系中,诱导温度在20 ℃左右时,甲醇代谢流的分布会发生改变,从而使毕赤酵母的异源蛋白表达效果达到最佳水平[19]。为探究毕赤酵母在利用甘油进行血红素发酵时是否存在相似特点,本研究对比了25 ℃与20 ℃对发酵生产血红素的影响(图3)。为了前期毕赤酵母的良好生长,菌体生长阶段的温度仍设置为30 ℃,在后续发酵过程中再分别将温度降低至25 ℃和20 ℃,考察后期降低温度对毕赤酵母生产血红素能力的影响。结果表明,在降低温度至25 ℃和20 ℃后,血红素的产量出现了明显下降。在25 ℃时,血红素质量浓度从30 ℃时的160.1 mg/L降低至110.5 mg/L,而20 ℃时血红素质量浓度仅有97.0 mg/L。与血红素浓度降低的结果相反,在2种温度下菌株整体OD600值都明显回升,细胞干重分别达到122.0 g/L和140.3 g/L,与FeSO4·7H2O添加质量浓度为50 mg/L时的水平相当(图1-C),这表明血红素的高积累量确实在一定水平上抑制了菌株的生长。总之,降低温度后单位量菌体发酵生产血红素的能力明显下降,且下降的强度随着温度的降低而增加。因此,后续实验仍选择恒定控制30 ℃作为毕赤酵母的生长与发酵温度。

A-20 ℃;B-25 ℃
图3 发酵温度对Pichia pastoris X33 HEME-9血红素产量的影响
Fig.3 Effect of temperature on HEME-9 titer of Pichia pastoris X33
2.4 溶氧水平对血红素产量的影响
溶氧水平在生物发酵中是一个重要参数,但在实验室水平的发酵罐上准确控制溶氧水平比较困难,在其他研究当中,存在通过改变搅拌转速和通风比作为控制溶氧水平的方法[20]。但是,该方法在本研究中并不十分适用,这是由毕赤酵母自身的高密度发酵特性决定的,即在发酵过程中毕赤酵母会因为菌体密度太大从而导致溶氧水平降低。在前期实验中发现,虽然使用了改变搅拌转速和通风比的方法,以期将发酵罐中的溶氧水平控制在30%,然而,在96 h前后溶氧值会降低至10%左右,随着发酵时间的延长,溶氧值最终会降低至0.1%左右,形成低溶氧水平的发酵环境。因此,本研究通过降低甘油补料速度的方法(从38 mL/h降低至25 mL/h)来限制毕赤酵母的生长速度,进而控制发酵罐中的溶氧水平,最终将溶氧值稳定在20%和30%左右。结果如图4所示,在提高溶解氧水平后,血红素浓度在溶氧值为20%时达到161.9 mg/L,在溶氧值为30%时达到164.9 mg/L,这与低溶解氧条件下发酵生产血红素的水平相当(160.1 mg/L)。在高溶解氧条件下,在发酵后期毕赤酵母的生物量未出现明显下降。这说明高浓度的血红素对菌株的生长抑制是有限的,但可以通过提升溶解氧水平进行缓解,可能是此时的溶氧条件更适宜菌株生长。然而,提高溶氧后单位菌株生产血红素的能力有所下降。
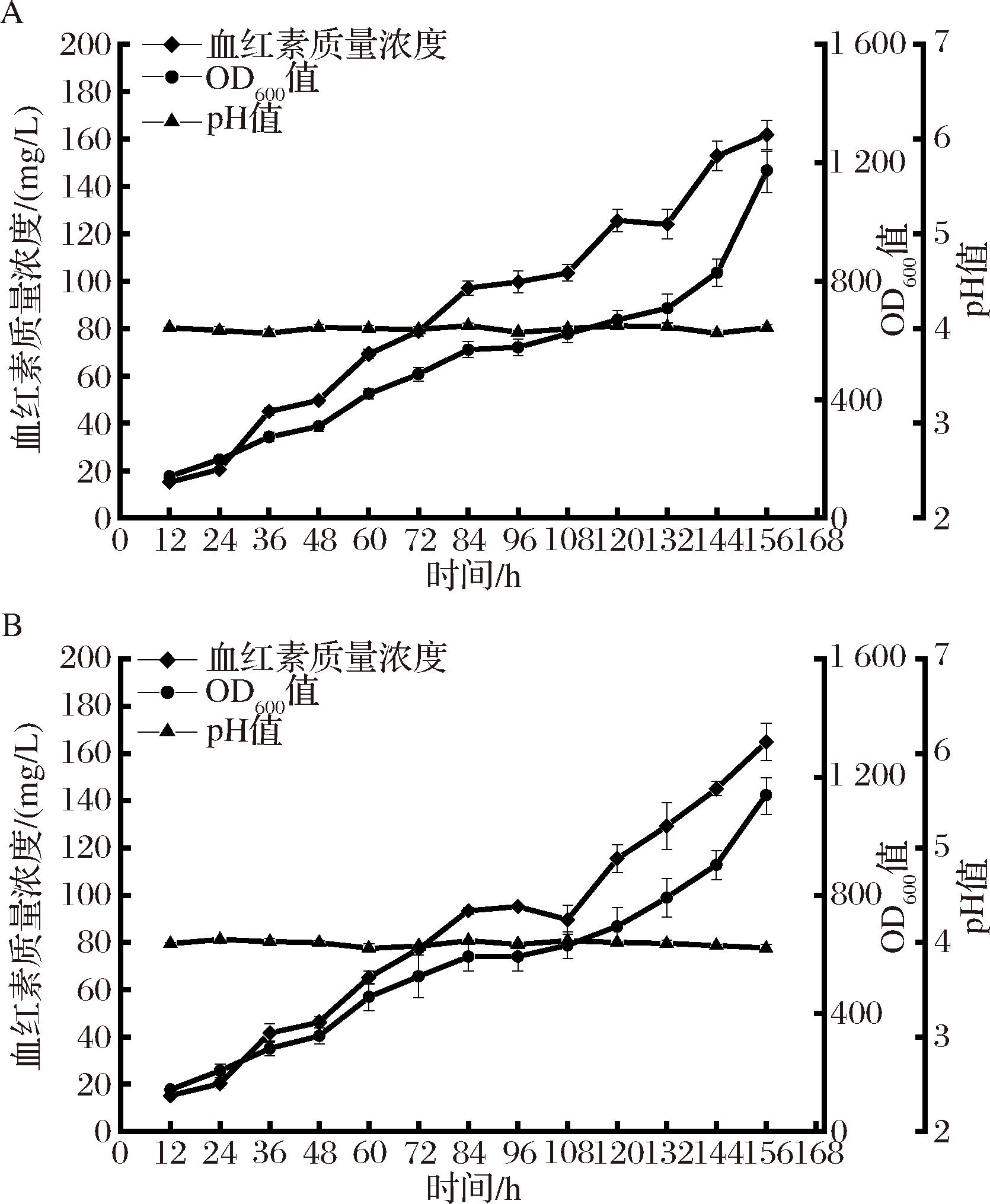
A-溶氧值为20%;B-溶氧值为30%
图4 溶解氧对Pichia pastoris X33 HEME-9血红素产量的影响
Fig.4 Effect of dissolved oxygen on HEME-9 titer of Pichia pastoris X33
2.5 补料分批发酵动力学模型
使用Origin软件对一组补料分批发酵结果(图2-A)进行了动力学分析,将经验参数分别输入上述的公式(1)和公式(2)中。细胞生长和血红素产生的动力学模型分别由公式(3)和公式(4)描述,表明生长和产量的动力学成功拟合。
(3)
(4)
成功拟合的生长和血红素产量的动力学曲线的R2值分别为0.978和0.963(图5),表明这2个模型拟合良好。这2个拟合方程能很好地描述在分批发酵过程中的细胞生长和血红素产量。研究结果显示,在发酵过程中血红素的积累与细胞生长是耦合的。因此,需要保证重组菌株有较高的生物量才能使血红素有更高的积累量[14]。

A-生长动力学模型;B-生产动力学模型
图5 Pichia pastoris X33 HEME-9产血红素动力学模型
Fig.5 Kinetic Models of HEME-9 production by Pichia pastoris X33
3 讨论
血红素是一类具有重要功能的卟啉类化合物,在呼吸、电子传递链中起到重要作用。在工业上一般采用化学合成、有机萃取、酶水解等方法获取血红素,但这些方法存在劳动强度大、效率低、成本高的问题[21]。目前,通过合成生物学、代谢工程改造等策略在一定水平上强化了血红素的合成。在大肠杆菌中,通过过表达血红素生物合成相关基因,产生了3.3 μmol/L的血红素[18],通过过表达C5途径血红素合成基因和敲除竞争途径的基因,产生了51.5 mg/L的血红素,进一步通过血红素分泌途径的代谢工程和补料培养中底物的补料控制优化的方法将血红素的产量提高到239 mg/L[7]。在酿酒酵母中,ISHCHUK等[22]通过基因组规模的建模,将血红素产量提升了70倍,在摇瓶水平产量达到53.5 mg/L。但是,实现工业化生产仍存在一定难度。本研究基于前期构建的一株高产血红素的毕赤酵母菌株,在5 L发酵罐上对pH值、亚铁离子添加量、温度和溶氧值进行了发酵条件优化,并对生长动力学和生产动力学进行了拟合。最终,在生长阶段pH值为5,发酵阶段pH值为4,温度全程控制在30 ℃,每日添加2 mL的FeSO4·7H2O溶液(100 mg/L),溶氧值为30%的条件下,血红素达到最大质量浓度164.9 mg/L,产量比未优化发酵条件时提高了180.3%,但溶氧值的改变并没有对最终的血红素浓度产生显著影响。另外,发酵温度的降低和溶氧值的升高会降低单位菌株生产血红素的水平,但是较高的溶氧值可以在一定程度上减弱高浓度血红素对菌株的生长抑制作用。
近年来,针对毕赤酵母的基因编辑方法日趋成熟,在后续研究中,可以通过结合代谢组学的方法调控毕赤酵母细胞内的代谢流向进一步提升血红素的产量。另外,本研究通过优化发酵条件,使得毕赤酵母在5 L发酵罐上的产量有了一定的提升,但是在发酵过程中存在着起泡现象,这可能导致了氧传递系数的降低,从而使菌株的生长能力减弱。今后的研究可以在控制起泡程度、使用氧载体等方面进行优化,从而进一步强化血红素的积累。本研究相关过程优化对利用毕赤酵母生产血红素的方法实验和工业化具有一定的参考意义。
[1] SHIMIZU T, HUANG D Y, YAN F, et al.Gaseous O2, NO, and CO in signal transduction:Structure and function relationships of heme-based gas sensors and heme-redox sensors[J].Chemical Reviews, 2015, 115(13):6491-6533.
[2] REBELLO S, ABRAHAM A, MADHAVAN A, et al.Non-conventional yeast cell factories for sustainable bioprocesses[J].FEMS Microbiology Letters, 2018, 365(21).DOI:10.1093/femsle/fny222.
[3] ANDERSON K E, COLLINS S.Open-label study of hemin for acute Porphyria:Clinical practice implications[J].The American Journal of Medicine, 2006, 119(9):801.e19-801.e24.
[4] FRASER R Z, SHITUT M, AGRAWAL P, et al.Safety evaluation of soy leghemoglobin protein preparation derived from Pichia pastoris, intended for use as a flavor catalyst in plant-based meat[J].International Journal of Toxicology, 2018, 37(3):241-262.
[5] 康振, 张俊丽, 杨森, 等.微生物发酵生产5-氨基乙酰丙酸研究进展[J].生物工程学报, 2013, 29(9):1214-1222.KANG Z, ZHANG J L, YANG S, et al.Advances in microbial production of 5-aminolevulinic acid[J].Chinese Journal of Biotechnology, 2013, 29(9):1214-1222.
[6] DAILEY H A, DAILEY T A, GERDES S, et al.Prokaryotic heme biosynthesis:Multiple pathways to a common essential product[J].Microbiology and Molecular Biology Reviews:MMBR, 2017, 81(1):e00048-e00016.
[7] ZHAO X R, CHOI K R, LEE S Y.Metabolic engineering of Escherichia coli for secretory production of free haem[J].Nature Catalysis, 2018, 1(9):720-728.
[8] BARRERO J J, PAGAZARTAUNDUA A, GLICK B S, et al.Bioreactor-scale cell performance and protein production can be substantially increased by using a secretion signal that drives co-translational translocation in Pichia pastoris[J].New Biotechnology, 2021, 60:85-95.
[9] WANG J J, WANG X L, SHI L, et al.Methanol-independent protein expression by AOX1 promoter with trans-acting elements engineering and glucose-glycerol-shift induction in Pichia pastoris[J].Scientific Reports, 2017, 7:41850.
[10] ZHAO X R, ZHOU J W, DU G C, et al.Recent advances in the microbial synthesis of hemoglobin[J].Trends in Biotechnology, 2021, 39(3):286-297.
[11] CHOBY J E, SKAAR E P.Heme synthesis and acquisition in bacterial pathogens[J].Journal of Molecular Biology, 2016, 428(17):3408-3428.
[12] KARBALAEI M, REZAEE S A, FARSIANI H.Pichia pastoris:A highly successful expression system for optimal synthesis of heterologous proteins[J].Journal of Cellular Physiology, 2020, 235(9):5867-5881.
[13] YU F, ZHAO X R, ZHOU J W, et al.Biosynthesis of high-active hemoproteins by the efficient heme-supply Pichia pastoris chassis[J].Advanced Science, 2023, 10(30):e2302826.
[14] LI L H, LI N, WANG X L, et al.Metabolic engineering combined with enzyme engineering for overproduction of ectoine in Escherichia coli[J].Bioresource Technology, 2023, 390:129862.
[15] 郑华亮, 贾小峰, 马鲁南, 等.发酵条件对毕赤酵母高密度表达地特胰岛素前体DesB30的影响[J].生物加工过程, 2021, 19(2):193-198.ZHENG H L, JIA X F, MA L N, et al.Effects of fermentation conditions on high density expression of DesB30 in Pichia pastoris[J].Chinese Journal of Bioprocess Engineering, 2021, 19(2):193-198.
[16] 翁焕娇, 丁雯雯, 石雅南, 等.基于模块化优化策略强化大肠杆菌合成血红素[J].食品与生物技术学报, 2019, 38(6):86-94.WENG H J, DING W W, SHI Y N, et al.Enhancement of heme synthesis pathway in Escherichia coli via a modular optimization strategy[J].Journal of Food Science and Biotechnology, 2019, 38(6):86-94.
[17] JAHIC M, WALLBERG F, BOLLOK M, et al.Temperature limited fed-batch technique for control of proteolysis in Pichia pastoris bioreactor cultures[J].Microbial Cell Factories, 2003, 2(1):6.
[18] HONG F, MEINANDER N Q, JÖNSSON L J.Fermentation strategies for improved heterologous expression of laccase in Pichia pastoris[J].Biotechnology &Bioengineering, 2002, 79(4):438-449.
[19] 汪汇慧, 金虎, 高敏杰, 等.甲醇/山梨醇共混流加诱导改变毕赤酵母生产猪α干扰素过程的代谢产能途径强化发酵性能[J].生物工程学报, 2012, 28(2):164-177.WANG H H, JIN H, GAO M J, et al.Enhanced porcine interferon-α production by Pichia pastoris by methanol/sorbitol co-feeding and energy metabolism shift[J].Chinese Journal of Biotechnology, 2012, 28(2):164-177.
[20] 房峻, 周景文, 曾伟主.高产α-酮戊二酸解脂亚洛酵母的选育及其发酵过程优化[J].食品与发酵工业, 2021, 47(2):137-144.FANG J, ZHOU J W, ZENG W Z.Breeding and process optimization of Yarrowia lipolytica for high-yield α-ketoglutaric acid production[J].Food and Fermentation Industries, 2021, 47(2):137-144.
[21] ESPINAS N A, KOBAYASHI K, TAKAHASHI S, et al.Evaluation of unbound free heme in plant cells by differential acetone extraction[J].Plant and Cell Physiology, 2012, 53(7):1344-1354.
[22] ISHCHUK O P, DOMENZAIN I, S NCHEZ B J, et al.Genome-scale modeling drives 70-fold improvement of intracellular heme production in Saccharomyces cerevisiae[J].Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(30):e2108245119.
NCHEZ B J, et al.Genome-scale modeling drives 70-fold improvement of intracellular heme production in Saccharomyces cerevisiae[J].Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(30):e2108245119.