我国是水产品产出大国,近年来随着水产品产业的快速发展,全国水产品产量也在快速增长。2022年,全国水产品总产量6 865.91万t,同比增长2.62%,其中鱼类产量占比超过50%[1]。鳜鱼属于鲈形目、鳜属,别名桂鱼等,是我国特有的名贵淡水经济鱼类,近年来,由于养殖技术的突破和旺盛的市场需求,鳜鱼总产量逐年提升,据统计,2022年鳜鱼总产量达到38万t[1]。
鳜鱼肉质鲜美细嫩,鱼体肉多刺少、营养丰富[2]。在鳜鱼加工产品中,发酵鳜鱼占有较大的比例。发酵鳜鱼,俗称臭鳜鱼和腌鲜鳜鱼等,是以新鲜鳜鱼为原料,配以食盐、花椒等辅料,经过乳酸菌等发酵而制得的鱼制品。发酵鳜鱼不仅营养价值高,而且经过熟化后具有独特的“蒜瓣肉”和微臭风味,有较高的市场接受度[3]。此外,以鳜鱼鱼蛋白为原料,开发成功能性鱼蛋白凝胶食品,也已经逐步进入消费市场[4]。
肌原纤维蛋白(myofibrillar protein, MP)是鱼蛋白凝胶形成的重要功能性蛋白[2]。“蒜瓣肉”是一种蒜瓣状蛋白凝胶(garlic-cloves shaped protein gel, GSPG),前期研究证实,鳜鱼在发酵过程中其肌原纤维蛋白保留了结构和功能的完整性,是形成GSPG的重要基础[5]。此外,鳜鱼发酵过程中,乳酸菌是主要的优势菌[3]。有研究指出,乳酸菌的产酸作用,尤其是产乳酸和乙酸,会导致肌原纤维蛋白微环境的pH值发生降低现象[5]。此外,肌原纤维蛋白在开发成功能性凝胶食品的过程中,pH值是影响其凝胶功能特性的重要因素之一。有较多的研究者报道了pH值对肌原纤维蛋白的影响,屈莎等[6]研究了不同pH值下蛋白氧化对牦牛肉肌原纤维蛋白凝胶特性的影响,周心雅等[7]研究了酸碱度对兔肉肌原纤维蛋白功能性质的影响,ZHENG等[8]研究了pH对大黄鱼肌原纤维蛋白胶凝特性的影响,KIM等[9]研究了pH值变化对猪肌原纤维蛋白凝胶与可食用昆虫蛋的影响。
目前,针对鳜鱼肌原纤维蛋白凝胶特性的研究相对较少,本团队前期开展了乳酸菌[3,5]、TG酶[10]、加热温度[2]和花椒提取物[4]对鳜鱼蛋白热诱导凝胶性质的影响,但未见pH值对鳜鱼肌原纤维蛋白凝胶性质影响的报道。
因此,本研究以鳜鱼肌原纤维蛋白为研究对象,通过测定鳜鱼肌原纤维蛋白热诱导凝胶的凝胶强度、质构和巯基含量等指标,以及运用SDS-PAGE、低场核磁和拉曼光谱、扫描电镜等技术手段,探究不同pH值(9.0~4.0)对鳜鱼肌原纤维蛋白热诱导凝胶的物性、水分状态、结构特征的影响,揭示pH对臭鳜鱼肌原纤维蛋白的影响规律,以期为拓展鳜鱼加工制品的产业化应用提供技术依托。
1 材料与方法
1.1 材料与试剂
实验原料:新鲜鳜鱼,安徽省池州市东至县大联圩农业开发有限公司。
氯化钠、尿素、EDTA、双缩脲、无水乙醇、过硫酸铵、甘油、冰醋酸(分析纯),上海阿拉丁生化科技股份有限公司;氯化钾、氯化镁、氯化钙、50%戊二醛、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、5,5′-二硫双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB]、30%聚丙烯酰胺/甲叉双丙烯酰胺溶液(体积比29∶1)、二硫苏糖醇、甘氨酸、考马斯亮蓝R-250(分析纯或电泳级),上海麦克林生化科技有限公司;伯乐BIO-RAD精准双色蛋白Marker标准品,Bio-Rad公司。
1.2 仪器与设备
Y25数显型高剪切分散均质乳化机,上海约迪机械设备有限公司;H1750R离心机,湖南湘仪实验室仪器开发有限公司;TA.XT Plus质构仪,英国Stable Micro System公司;MesoMR23-060H-I纽迈低场核磁共振分析仪,上海纽迈电子科技有限公司;SU8010扫描电子显微镜,株式会社日立制作所;LabRAM HR Evolution拉曼光谱仪,日本堀场株式会社;JY600C电泳仪,北京君意东方电泳设备有限公司。
1.3 实验方法
1.3.1 鳜鱼肌原纤维蛋白的提取和凝胶制备
参照WANG等[11]提出的方法并稍作修改。以新鲜鳜鱼为试验原料,取新鲜鳜鱼的背部肌肉放置于绞肉机中,低速搅碎30 s后得到鳜鱼碎肉,加入4倍体积的缓冲溶液(2 mmol/L MgCl2、100 mmol/L NaCl、50 mmol/L NaH2PO4/Na2HPO4、1 mmol/L EDTA,pH 6.8)于高速匀浆机中匀浆2 min,并在4 ℃条件下以3 500×g的速度离心15 min,保留沉淀,重复该操作2次。在沉淀物中加入4倍体积的盐溶液(100 mmol/L NaCl)并匀浆2 min,在4 ℃条件下以3 500×g的速度离心15 min,重复该操作1次,在最后一次洗涤中匀浆液通过4层滤布过滤以除去结缔组织,离心前将其pH值分别调节至9.0、8.0、7.0、6.0、5.0、4.0,在4 ℃下以3 500×g的速度离心15 min,所得沉淀即为肌原纤维蛋白。
参考张顺治等[12]提出的方法并稍作修改。将上述蛋白质收集并向其中加入2%(质量分数)NaCl,调节水分含量为76%,然后搅拌均匀,灌入50 mL离心管中,然后将其于40 ℃条件下加热30 min,然后立即转移至80 ℃条件下加热30 min,加热结束后立即置于冰水中快速冷却至室温,放置于4 ℃冰箱中保存过夜后进行相关指标测定。
1.3.2 凝胶强度的测定
将鳜鱼凝胶样品切成高度为2.0 cm的圆柱体,置于质构仪上,使用直径5 mm的球形探针(p/5 s)测定其破断力(g)和破断距离(cm),凝胶强度(g·cm)为两者的乘积。
1.3.3 质构的测定
参考周迎芹等[13]的方法并稍作修改。将凝胶样品切成高度为1.5 cm的圆柱体,使用直径35 mm的圆柱形探头(p/50)放在质构仪上测定,具体参数设定:触发类型Auto(Force)、触发力5.0 g,测试前速度1.0 mm/s,测试中速度5.0 mm/s,测试后速度5.0 mm/s,变形量10 mm。
1.3.4 巯基含量的测定
巯基含量测定参考YAN等[14]所提出的方法并稍作修改。称取2.0 g凝胶样品,切碎后与10 mL 0.6 mol/L氯化钠+8 mol/L尿素充分混合,高速匀浆2 min,于4 ℃条件下静置1 h,10 000×g离心15 min,测定上清液中蛋白质的含量。取0.5 mL(4 mg/mL)上述上清液加入到4.5 mL 0.2 mol/L Tris-HCl缓冲液[pH 8.0, 8 mol/L尿素、5 mmol/L EDTA、1%(质量分数)SDS]中,混合均匀。取4 mL上述混合物向其中添加0.4 mL的10 mmol/L DTNB(溶解在10 mmol/L Tris-HCl中,pH 8.0),于40 ℃条件下加热30 min。测定其在412 nm处的吸光度值(空白为0.6 mol/L KCl)。巯基含量的计算如公式(1)所示:
巯基含量![]()
(1)
式中:73.53由106/13 600(13 600为Ellman试剂的摩尔消光系数)计算得出;A412为412 nm处的吸光度;D为稀释倍数,C为蛋白质浓度。结果表达为mol/105 g蛋白。
1.3.5 SDS-PAGE的测定
取2.0 g凝胶样品并向其中加入18 mL 5%(质量分数)SDS,均质2 min,80 ℃条件下加热1 h,冷却至室温,4 ℃条件下以8 000×g的速度离心20 min,保留上清液弃去沉淀,取10 μL 5×上样缓冲液、20 μL上清液,95 ℃条件下加热10 min,5 000 r/min离心2 min,样品制备完成。然后选用15%(质量分数)的分离胶和5%(质量分数)的浓缩胶进行电泳实验,电泳电压参数为250 V,当溴酚蓝到达底部时电泳结束。取下电泳胶板置于摇床上用考马斯亮蓝R250染色过夜,然后用醋酸-乙醇混合脱色液脱色4 h,脱色完成后采集电泳图像。
1.3.6 拉曼光谱的测定
拉曼光谱的测定方法参考FENG等[15]所提出的方法并稍作修改。称取约1.5 g样品置于载玻片上,并设置相关参数如下,激光器波长:532 nm,激光功率:100 mW,扫描范围:3 300~400 cm-1,光谱分辨率:2.0 cm-1,扫描样本次数:3次,曝光次数:60次,采集数据:1 cm-1,速度:120 cm-1/min。测试完成后以苯丙氨酸(1 003 cm-1)为标准进行归一化。使用Peakfit 4.12进行蛋白质酰胺 Ⅰ 带(1 600~1 700 cm-1)的分析,依次进行基线校正、去卷积、二阶导数拟合,根据各子峰面积计算肌原纤维蛋白二级结构相对含量。
1.3.7 微观结构的测定
扫描电子显微镜(scanning electron microscope, SEM)参考NI等[16]所提出的方法并稍作修改。从肌原纤维蛋白凝胶的中心区域切除立方体样品(3 mm×3 mm×3 mm),使用2.5%(质量分数)戊二醛4 ℃条件下固定过夜,取出后用0.1 mol/L,pH 7.0的磷酸缓冲液漂洗3次,每次15 min,以去除戊二醛流体;然后依次用30%、50%、70%、80%、90%(体积分数)的乙醇进行梯度脱水,各梯度脱水时间均为15 min,最后再使用无水乙醇脱水30 min。将脱水后的样品进行CO2临界点干燥,镀膜后置于扫描电子显微镜下观察。
1.3.8 低场核磁水分分布的测定
参考GUO等[17]提出的方法并稍作修改。使用低场核磁共振分析仪测定凝胶的弛豫时间(T2)。取2.0 g鳜鱼肌原纤维蛋白凝胶样品并平衡至室温,然后放置于核磁管中进行测定。T2的测量主要参数包括:共振频率20 MHz,TW (ms)=4 500,TE (ms)=0.5,NS=4,NECH=18 000。
1.4 数据统计与分析
每个实验测量3次。采用Excel 2016软件处理数据,OriginPro 2021软件绘图,SPSS 2020软件中的Duncan方法进行方差显著性分析(P<0.05表示具有显著性差异)。
2 结果与分析
2.1 pH对鳜鱼肌原纤维蛋白凝胶强度的影响
凝胶强度是衡量凝胶性能的重要指标,不同的pH条件会影响肌原纤维蛋白的胶凝化程度[18]。如图1所示,随着pH的降低(pH 8~pH 4),鳜鱼MP凝胶强度呈现先增强后减弱的趋势。其中,pH 6.0至pH 4.0时的凝胶强度变化剧烈,呈现先剧增再骤减的;pH 5.0时的凝胶强度值最大,分别是pH 4.0和pH 6.0时凝胶强度的2.42倍和4.16倍。不同pH处理组之间两两比较时,均具有显著性差异(P<0.05)。pH 9.0时,使用仪器探头无法测出肌原纤维蛋白凝胶强度值。如图2所示,在pH 4.0时鳜鱼MP凝胶的表观非常粗糙,探头挤压时严重破碎;而在pH 5.0时鳜鱼MP凝胶的表观略微粗糙,但是此时的凝胶强度最高;在pH 6.0时凝胶则致密光滑,而且,在图1中,pH 6.0时凝胶强度也比pH 7.0、8.0时明显增加(P<0.05),间接证明pH 6.0时凝胶较好。LIU等[18]研究pH对鲢鱼蛋白凝胶特性的影响时也得出相似的结论,在pH 9.0~5.5时,随着pH的降低,鲢鱼蛋白的胶凝速率和凝胶强度增加。pH的降低增加了MP分子所带电荷的数量和密度,进而影响了蛋白质-蛋白质、蛋白质-水之间相互作用的平衡,有利于形成更加紧密的凝胶蛋白结构,因此,增加了MP凝胶的凝胶强度[19]。

图1 不同pH值对鳜鱼肌原纤维蛋白凝胶强度的影响
Fig.1 Effects of different pH values on gel strength of mandarin fish myofibrillar protein
注:不同小写字母表示具有显著性差异(P<0.05)(下同)。

图2 不同pH的鳜鱼肌原纤维蛋白凝胶表观图
Fig.2 Apparent map of mandarin fish myofibrillar protein gel with different pH values
2.2 pH对鳜鱼肌原纤维蛋白凝胶质构的影响
凝胶的硬度是探头在第一次下压凝胶时压力的最大值,弹性是指组织在外力作用下的变形和恢复程度,黏聚性是指当探针下降一次时将探针从样品中拉出所需的能量,胶黏性表示咀嚼半固体食品至可吞咽状态时所需要的能量,咀嚼性表明吞咽时将固体样品咀嚼至稳定状态所需的能量,回弹性是指从压缩引起的变形中快速恢复的能力[2]。
如图3所示,肌原纤维蛋白凝胶的硬度随着pH的降低先增加后减小,并在pH值为5.0时为最大值,pH值为9.0~4.0的硬度值分别为182.81、716.03、1 776.48、2 808.52、4 509.46、3 604.78 g,pH 5.0时的最大值是pH 9.0时最小值的24.77倍,说明了pH值对凝胶的硬度有很大的影响;弹性、黏聚性、胶黏性和咀嚼性都与硬度有相似的“先增加后降低”的变化规律,这可能是因为pH改变了MP分子的氨基酸残基的侧链电荷分布,从而影响了蛋白质之间的静电相互作用和蛋白质的疏水相互作用。田金河等[20]研究鲢鱼蛋白凝胶强度也得到了相似的结论,pH降低可以显著提升凝胶硬度,对凝胶弹性有所改善。

a-硬度;b-弹性;c-黏聚性;d-胶黏性;e-咀嚼性;f-回弹性
图3 不同pH值对鳜鱼肌原纤维蛋白凝胶质构的影响
Fig.3 Effects of different pH values on the texture of mandarin fish myofibrillar protein gel
2.3 pH对鳜鱼肌原纤维蛋白凝胶巯基含量的影响
巯基是MP分子中关键的活性官能团,微环境的变化诱导蛋白质结构的去折叠,半胱氨酸残基中的巯基暴露出来,最终导致二硫键的形成,所以肌原纤维蛋白凝胶巯基含量的变化可以直观反映二硫键含量的变化。二硫键的含量或状态影响加热过程中的蛋白质交联模式,并且对蛋白质凝胶特性至关重要[21]。
如图4所示,随着pH值的降低,肌原纤维蛋白凝胶的巯基含量先升高后降低再升高,pH 6.0时达到最大值36.5 mol/105 g,pH 9.0时达到最小值10.09 mol/105 g,前者是后者的3.62倍,不同pH处理组之间两两比较时,均具有显著性差异(P<0.05)。随着pH的下降,蛋白分子的结构发生改变,使埋藏于蛋白分子内部的巯基暴露出来,而暴露的活性巯基容易发生氧化反应或—SH/—S—S交换反应,从而增强蛋白的凝胶强度,所以鳜鱼在发酵过程中随着pH值的降低,凝胶强度也会相应增加。

图4 不同pH值对鳜鱼肌原纤维蛋白凝胶巯基含量的影响
Fig.4 Effects of different pH values on the sulfhydryl content of mandarin fish myofibrillar protein gel
2.4 pH对鳜鱼肌原纤维蛋白凝胶SDS-PAGE的影响
运用SDS-PAGE方法分析凝胶体系中MP成分的变化,如图5所示。依据蛋白质分子质量的大小可以得出肌原纤维蛋白的条带:分子质量为17~20 kDa和25 kDa的肌球蛋白轻链、分子质量为33 kDa的肌原蛋白的一个亚基(原肌球蛋白结合亚基)、分子质量为36 kDa的原肌球蛋白、分子质量为43 kDa的肌动蛋白、分子质量为220 kDa的肌球蛋白重链6条条带,这与LAMETSCH等[22]的研究大黄鱼SDS-PAGE结果较一致。其中肌球蛋白和肌动蛋白的电泳条带较宽,表明MP的主要成分是肌球蛋白和肌动蛋白,这与常海霞等[23]的研究结果一致。肌原蛋白和肌动蛋白在pH 4.0时条带变浅甚至消失,随着pH值的升高条带变深后保持不变,这表明在此期间也发生了蛋白的降解。由于实验过程中使用了变性剂处理以及经过高温加热处理,破坏了离子键、氢键以及疏水相互作用等次级键作用,而蛋白条带的减弱表明肌原蛋白和肌动蛋白在pH降低过程中分子间共价交联键作用减弱,蛋白聚集作用减弱,蛋白降解使条带变浅或是消失[22]。
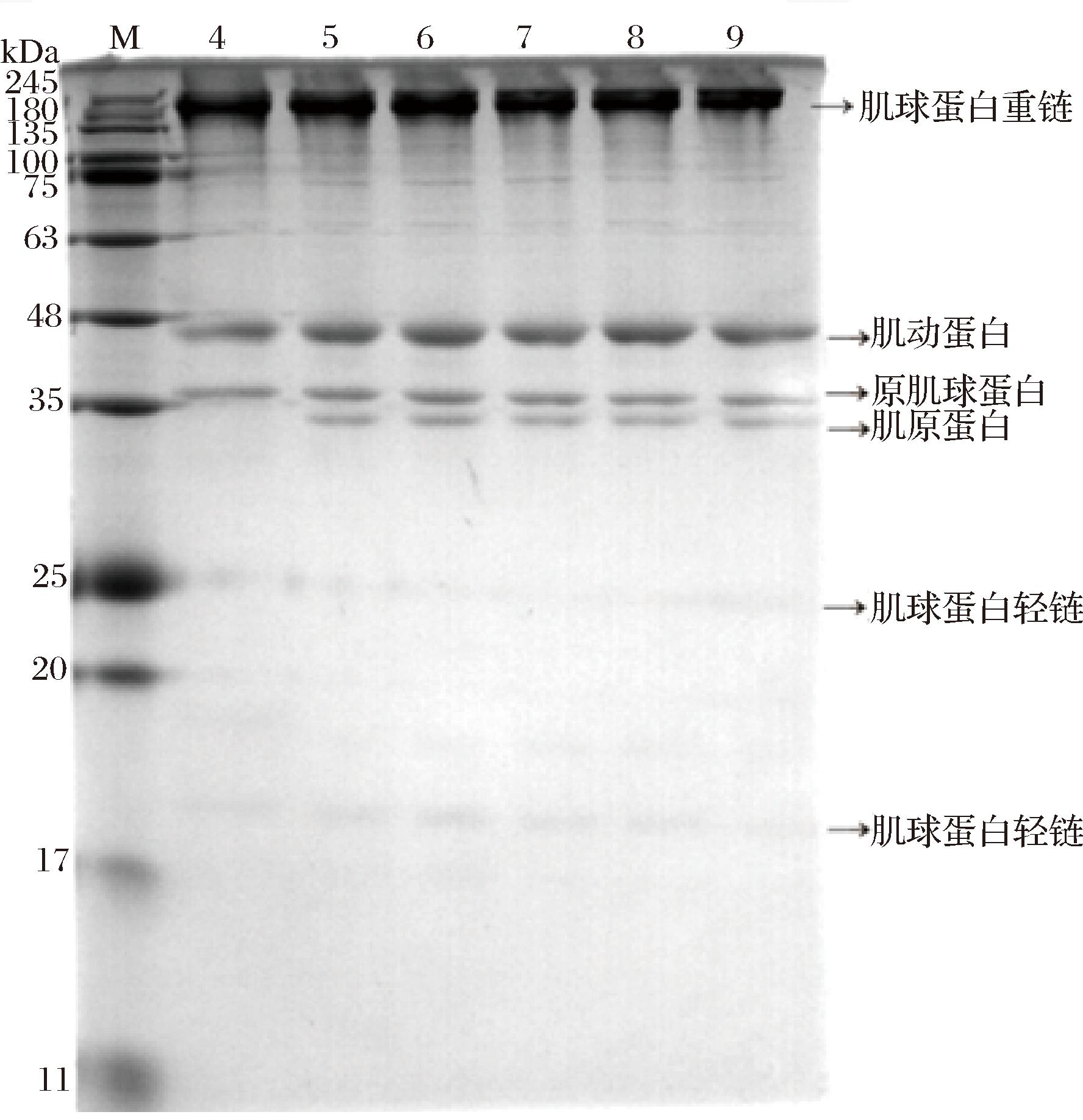
图5 不同pH值对鳜鱼肌原纤维蛋白凝胶SDS-PAGE的影响
Fig.5 Effects of different pH values on mandarin fish myofibrillar protein gel SDS-PAGE
注:M为标准蛋白Marker;4~9分别为pH 4.0、5.0、6.0、7.0、8.0、9.0。
2.5 pH对鳜鱼肌原纤维蛋白凝胶二级结构的影响
基于与以往研究报道的拉曼光谱数据的比较收集并分析谱带的分配情况[15],酰胺I区(1 600~1 700 cm-1)的变化通常用来表示蛋白质二级结构的变化。这一区域主要与肽链中N—H基团的面内弯曲、C![]() O基团的伸缩振动以及肽键中C—N的伸缩振动有关[24]。酰胺I谱带由1 650~1 660 cm-1、1 660~1 665 cm-1、1 665~1 680 cm-1和1 680 cm-1附近的重叠谱带组成,分别代表α-螺旋结构、无规则卷曲结构、β-折叠结构和β-转角结构。图6展示了由酰胺I谱图计算的经过不同pH处理的鳜鱼MP凝胶中二级结构组分的相对含量。在pH 7.0~4.0内,MP凝胶的β-折叠含量升高,α-螺旋含量降低。α-螺旋含量pH 7.0时达到最高值,为46.02%;pH 4.0时达最低值,为16.87%;即当pH值从7.0降低到4.0时,α-螺旋组分降低,伴随着β-折叠和无规则卷曲含量的升高。这意味着蛋白质二级结构的展开和转化受阻,造成这些差异的原因可能是环境的酸性增强导致MP凝胶中多肽链的展开和转化受到阻碍,从而使MP凝胶基质在凝胶形成过程中变成无序结构。当pH值从9.0降低到8.0时,α-螺旋结构含量减少,主要转化为β-折叠和β-转角;随着pH值从7.0降低到4.0,α-螺旋含量从46.02%显著降低到16.87%(P<0.05);调整到pH 9.0时,α-螺旋含量下降到34.63%。相比之下,当pH值从7.0调整到4.0和9.0时,鳜鱼MP的α-螺旋含量分别下降了29.15%和11.39%。结果表明,酸处理对α-螺旋含量的降低比碱处理更明显。LIU等[18]研究pH值对鱼肌球蛋白凝胶性质和二级结构的影响也得出了相似的结论。
O基团的伸缩振动以及肽键中C—N的伸缩振动有关[24]。酰胺I谱带由1 650~1 660 cm-1、1 660~1 665 cm-1、1 665~1 680 cm-1和1 680 cm-1附近的重叠谱带组成,分别代表α-螺旋结构、无规则卷曲结构、β-折叠结构和β-转角结构。图6展示了由酰胺I谱图计算的经过不同pH处理的鳜鱼MP凝胶中二级结构组分的相对含量。在pH 7.0~4.0内,MP凝胶的β-折叠含量升高,α-螺旋含量降低。α-螺旋含量pH 7.0时达到最高值,为46.02%;pH 4.0时达最低值,为16.87%;即当pH值从7.0降低到4.0时,α-螺旋组分降低,伴随着β-折叠和无规则卷曲含量的升高。这意味着蛋白质二级结构的展开和转化受阻,造成这些差异的原因可能是环境的酸性增强导致MP凝胶中多肽链的展开和转化受到阻碍,从而使MP凝胶基质在凝胶形成过程中变成无序结构。当pH值从9.0降低到8.0时,α-螺旋结构含量减少,主要转化为β-折叠和β-转角;随着pH值从7.0降低到4.0,α-螺旋含量从46.02%显著降低到16.87%(P<0.05);调整到pH 9.0时,α-螺旋含量下降到34.63%。相比之下,当pH值从7.0调整到4.0和9.0时,鳜鱼MP的α-螺旋含量分别下降了29.15%和11.39%。结果表明,酸处理对α-螺旋含量的降低比碱处理更明显。LIU等[18]研究pH值对鱼肌球蛋白凝胶性质和二级结构的影响也得出了相似的结论。

图6 不同pH条件下鳜鱼肌原纤维蛋白凝胶的二级结构
Fig.6 Secondary structure of mandarin fish myofibrillar protein gel under different pH conditions
蛋白质分子间的相互作用易受pH影响,pH值的作用是由于它影响蛋白质表面的带电氨基酸和α-羧基和α-氨基端基的质子化状态,通过改变带电残基的质子化状态,影响蛋白质的相互作用[25]。当pH接近PI时,蛋白质的静电排斥力相对较弱,由于氢键与水结合困难,不易形成分子内氢键。相比之下,此时很容易形成分子间氢键。总的来说,静电斥力的变化是导致蛋白质分子内和分子间氢键数量变化的主要原因,最终导致α-螺旋和β-折叠含量的变化[26]。同时,蛋白质-蛋白质交联增强引起的聚集也是合理的解释[27],静电作用和氢键稳定性的变化会依次引起在酸性条件下α-螺旋的丢失[26]。LEE等[28]也提出,更多的α-螺旋结构可以导致更有序的蛋白三维网络结构。此外,pH 4.0时蛋白质β-折叠结构增加较多,这也表明在酸性条件下蛋白质的聚集程度较大。
2.6 pH对鳜鱼肌原纤维蛋白凝胶微观结构的影响
图7为不同pH下MP凝胶网络的微观结构及其相应的二值化图像,电镜图片放大倍数40 000倍,电压2 kV。白色区域代表肌原纤维蛋白凝胶网络,黑色区域代表二值化图像中网络的孔隙。表1所示分形维数是表征不规则凝胶网络复杂性的物理量[29],在描述蛋白网状结构的时候,它详细描述了空穴的分布和均匀性,这可能是一些宏观性质如持水能力的原因,是定量描述不规则几何结构(包括凝胶系统)的有力工具,有助于分析食品[30]。分形维数越小,反应性蛋白质凝胶网络之间的交联越弱,网络结构越松散[31-32]。
表1 不同pH条件下鳜鱼肌原纤维蛋白凝胶的分形维数
Table 1 Fractal dimensions of mandarin fish myofibrillar protein gels under different pH conditions

pH9.08.07.06.05.04.0分形维数2.760 32.775 52.790 92.824 12.804 02.789 6

a-鳜鱼肌原纤维蛋白凝胶的微观结构图;b-鳜鱼肌原纤维蛋白凝胶的二值化图
图7 不同pH值对鳜鱼肌原纤维蛋白凝胶微观结构的影响
Fig.7 Effects of different pH values on the microstructure of mandarin fish myofibrillar protein gel
pH 9.0时,凝胶的孔隙大,蛋白结构稀疏不均匀。随着pH值降低到6.0时,凝胶颗粒之间相互靠近,蛋白质分子之间的相互作用加强,从而产生新的连接,凝胶结构趋于有序,形成多孔且孔径均匀的致密结构。同时随着pH值从9.0降低到6.0时分形维数也逐步升高,在pH 6.0时达到最大值2.824 1,凝胶形态的有序性与分形维数的结果呈正相关。随着pH值继续降低,在pH 5.0时,孔隙周围有略厚的蛋白丝状聚集体,凝胶孔径不均匀,酸性条件下的凝胶网状结构比较粗糙、无序;在pH 4.0时,MP热诱导凝胶具有很多实心棒球状或颗粒状聚集体,凝胶胶束粗糙、形状不规则、孔径大而不均匀,可能是在pH 4.0时,肌原纤维蛋白中电荷分布较少的基团使得蛋白质分子的聚集速度快于变性速度。蛋白质聚集和展开的相对速度是影响MP凝胶中微观结构形成质量的关键因素。聚集速度慢,形成的凝胶微观结构均匀有序;聚集速度越快,形成的凝胶微观结构粗糙无序,持水性下降[33]。根据XU等[34]的研究,pH值降低会逐渐诱导蛋白质的聚集,从而导致蛋白质网络的有序形成,不溶性蛋白的增加是形成良好凝胶的基础,但是过于酸性的环境会导致凝胶劣化。这与本研究结果相符,MP凝胶在pH 6.0时分形维数最大,结构相对于pH 9.0~7.0时和pH 5.0~4.0时来说也比较均匀。
蛋白分子间的作用力以及蛋白质分子与水分子结合的能力受pH值的影响,主要是因为pH值会影响蛋白分子的电离和静电荷值。酸性条件下(pH 4.0时)凝胶有序性低、聚合物较多,原因可能是当凝胶接近等电点时,蛋白质分子间静电斥力的减小有利于蛋白质分子间疏水相互作用的增强以及蛋白质与水相互作用的减弱。在热诱导变性和聚集之前,蛋白质已经部分解聚,随后的热处理促进解聚分子重组,从而使蛋白质分子混乱无序。然而,接近中性条件的蛋白质在适当的热作用下发生变性和聚集,形成致密的蛋白结构。但随着pH逐渐趋于碱性,凝胶结构逐渐混乱,原因可能是在过高pH下蛋白变性速率加快,HERMANSSON[35]认为,蛋白质凝胶微观结构的质量取决于蛋白质展开和聚集的相对速度,所以变性速率加快可能导致凝胶微观网状结构变得不均匀,孔洞变大,持水性下降,分形维数在pH 7.0~9.0逐步降低也进一步验证了这个结果。
2.7 pH对鳜鱼肌原纤维蛋白凝胶水分分布的影响
低场核磁共振弛豫时间和相对峰面积的测定是基于低场核磁共振的原理。通过测量MP凝胶的弛豫时间,可以获得关于MP凝胶内部水分状态、水分分布以及水与大分子的结合状态[36]。对鳜鱼MP凝胶0~10 000 ms水分分布进行检测,如图8所示为不同pH下鳜鱼MP凝胶的T2弛豫时间,表2为T21、T22、T23的弛豫时间变化,以及相应的MP凝胶峰面积比(PT21、PT22和PT23),即各水分的百分比。由图8可知鳜鱼肌原纤维蛋白凝胶中具有T21(0.01~1 ms)、T22(9~300 ms)和T23(400~5 000 ms)3个峰,分别代表结合水、不易流动水和自由水。不易流动水峰面积比(PT22)在pH 8.0~4.0时,随着pH值的降低而降低,从99.566%降低到94.797%,其中,在pH 5.0~4.0降低的幅度最大,降低了3.77%,反映了MP远离等电点的净电荷增加更显著,净电荷增加使肌原纤维蛋白凝胶之间的静电相互作用增加以及蛋白凝胶和水之间的水合作用增强,所以不易流动水的含量增加。同时,在pH 9.0时不易流动水的含量降低,原因是pH 9.0时,凝胶的整体水分含量很高,但是其保水锁水能力很差,凝胶外部还有许多水分,整体质地很软,自由水含量增加,所以不易流动水含量降低。结果同时也表明了pH 4.0时PT22不易流动水面积比最小,其凝胶质量最差。有研究表明,更短的弛豫时间能使水和大分子之间更容易结合[37],而pH 4.0时T21弛豫时间是其他pH的4~5倍,表明pH 4.0时水与大分子不易结合,凝胶质量较差。而pH 4.0时出现了自由水原因可能是其析出的水分残留在凝胶外部(表面)造成的。所以,总体来说,pH 4.0时的凝胶质量较差,而pH 5.0时的凝胶结构致密均匀可以锁住水分,质量有了极大的改善,但是在pH 9.0时,凝胶中的不易流动水含量降低,自由水含量增加,蛋白质与水的结合作用降低,凝胶内部的锁水能力降低,整体凝胶质量变差,由此得出,极端的酸碱环境不利于优质凝胶的形成。
表2 不同pH值下鳜鱼肌原纤维蛋白凝胶的T2峰面积比
Table 2 T2 peak area ratio of mandarin fish myofibrillar protein gel with different pH values

pH峰面积/%弛豫时间/msPT21PT22PT23T21T22T239.00.44398.7510.8060.78244.9673 838.0928.00.43499.56600.727234.37307.00.7999.2100.679228.99206.00.89699.10400.728231.77605.01.43698.56400.728156.12404.03.65594.7971.5493.397168.6841 352.648

图8 不同pH值下鳜鱼肌原纤维蛋白凝胶的弛豫时间
Fig.8 Relaxation time of mandarin fish myofibrillar protein gel with different pH values
3 结论
pH对蛋白质凝胶的形成有显著的影响作用,它通过改变氨基酸的电荷分布,从而影响蛋白质的结合力和稳定性,甚至可能导致蛋白质结构的破坏。随着pH值(9.0~4.0)的降低,鳜鱼MP凝胶强度、硬度、弹性、黏聚性、胶黏性、咀嚼性先升高再降低,在pH 5.0时达到最大值,并且此时的热诱导MP凝胶特性最好;SDS-PAGE结果表明,pH值从5.0降低到4.0时,肌原蛋白和肌动蛋白发生降解,但从凝胶表观图上来看,pH 6.0的MP凝胶表面更光滑均匀;二级结构结果表明,当pH值从7.0降低到4.0时,MP的多肽链受酸性增强作用而阻碍其展开和转化,从而使MP凝胶基质在凝胶形成过程中逐渐变成无序结构;在pH 6.0时,凝胶结构趋于有序,形成多孔且孔径均一的细致结构。疏水相互作用与巯基含量在pH 6.0时达到最大值。维持热诱导MP凝胶蛋白结构稳定性的主要作用力是疏水相互作用。综合分析表明,鳜鱼MP热诱导凝胶在pH 6.0时凝胶状态最好。这些研究结果既为揭示GSPG形成机理提供了参考数据,又为开发新型鳜鱼MP功能性凝胶食品提供了技术参考。
[1] 刘新忠, 崔利锋, 李书民, 等.2022中国渔业统计年鉴[M].北京:中国农业出版社, 2022.LIU X Z, CUI L F, LI S M, et al.2022 China Fisheries Statistical Yearbook[M].Beijing:China Argiculture Press, 2022.
[2] 李苓, 杨明柳, 周迎芹, 等.加热温度对鳜鱼肌原纤维蛋白凝胶特性的影响[J].食品与发酵工业, 2023, 49(19):242-248.LI L, YANG M L, ZHOU Y Q, et al.Effects of heating temperature on gel properties of mandarin fish (Siniperca chuatsi) myofibrillar protein[J].Food and Fermentation Industries, 2023, 49(19):242-248.
[3] 周迎芹, 孙子怡, 黄晶晶, 等.臭鳜鱼源清酒乳杆菌的分离鉴定及其在臭鳜鱼发酵中的应用[J].食品科学, 2022, 43(12):194-202. ZHOU Y Q, SUN Z Y, HUANG J J, et al.Isolation and identification of Lactobacillus sakei from fermented mandarin fish and its application in fermented mandarin fish[J].Food Science, 2022, 43(12):194-202.
[4] 韦海秋, 杨明柳, 周迎芹, 等.花椒水提物对鳜鱼鱼糜凝胶特性的影响[J].食品工业科技, 2023, 44(6):113-120.WEI H Q, YANG M L, ZHOU Y Q, et al.Effects of aqueous extract of Zanthoxylum bungeanum on gel properties of mandarin fish (Siniperca chuatsi) surimi gel[J].Science and Technology of Food Industry, 2023, 44(6):113-120.
[5] ZHOU Y Q, YANG M L, YIN J F, et al.Physicochemical characteristics and gel-forming properties of mandarin fish (Siniperca chuatsi) protein during the fish fermentation with Lactobacillus sake SMF-L5:The formation of garlic-cloves shaped protein gel[J].Food Chemistry, 2023, 409:135282.
[6] 屈莎, 胡婷, 唐善虎, 等.不同pH值下蛋白氧化对牦牛肉肌原纤维蛋白凝胶特性的影响[J].现代食品科技, 2024,40(1): 121-127.QU S, HU T, TANG S H, et al.Effects of protein oxidation at different pH values on thermogel properties of myofer fibroin in yak beef[J].Modern Food Science and Technology, 2024,40(1): 121-127.
[7] 周心雅, 贺稚非, 李洪军, 等.酸碱度对兔肉肌原纤维蛋白功能性质的影响[J].食品与发酵工业, 2017, 43(11):172-179.ZHOU X Y, HE Z F, LI H J, et al.Effect of pH on the functional properties of rabbit myofibrillar protein[J].Food and Fermentation Industries, 2017, 43(11):172-179.
[8] ZHENG S Y, CHEN X T, WU J N, et al.Effect of pH on gelling properties of myofibrillar protein in large yellow croaker (Pseduosciaena croeca)[J].Journal of Biobased Materials and Bioenergy, 2019, 13(2):264-268.
[9] KIM T K, LEE M H, YONG H I, et al.Porcine myofibrillar protein gel with edible insect protein:Effect of pH-shifting[J].LWT, 2022, 154:112629.
[10] 杨明柳, 周迎芹, 方旭波, 等.谷氨酰胺转氨酶对鳜鱼鱼糜凝胶的品质影响[J].食品科学, 2021, 42(12):37-44.YANG M L, ZHOU Y Q, FANG X B, et al.Effect of transglutaminase on the quality of mandarin fish (Siniperca chuatsi) surimi gel[J].Food Science, 2021, 42(12):37-44.
[11] WANG L M, XIA M Q, ZHOU Y H, et al.Gel properties of grass carp myofibrillar protein modified by low-frequency magnetic field during two-stage water bath heating[J].Food Hydrocolloids, 2020, 107:105920.
[12] 张顺治, 郑文栋, 安玥琦, 等.不同漂洗方式的白鲢鱼糜品质比较[J].现代食品科技, 2022, 38(6):160-168;279.ZHANG S Z, ZHENG W D, AN Y Q, et al.Quality of silver carp (Hypophthalmichthys molitrix) surimi rinsed using different methods[J].Modern Food Science and Technology, 2022, 38(6):160-168;279.
[13] 周迎芹, 杨明柳, 殷俊峰, 等.臭鳜鱼低温发酵过程中品质及挥发性物质的变化[J].中国食品学报, 2020, 20(4):179-186.ZHOU Y Q, YANG M L, YIN J F, et al.Changes of quality and volatile compounds in stinky mandarin fish during low-temperature fermentation[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(4):179-186.
[14] YAN B W, JIAO X D, ZHU H P, et al.Chemical interactions involved in microwave heat-induced surimi gel fortified with fish oil and its formation mechanism[J].Food Hydrocolloids, 2020, 105:105779.
[15] FENG J H, CAO A L, CAI L Y, et al.Effects of partial substitution of NaCl on gel properties of fish myofibrillar protein during heating treatment mediated by microbial transglutaminase[J].LWT, 2018, 93:1-8.
[16] NI N, WANG Z Y, HE F, et al.Gel properties and molecular forces of lamb myofibrillar protein during heat induction at different pH values[J].Process Biochemistry, 2014, 49(4):631-636.
[17] GUO J J, ZHOU Y H, YANG K, et al.Effect of low-frequency magnetic field on the gel properties of pork myofibrillar proteins[J].Food Chemistry, 2019, 274:775-781.
[18] LIU R, ZHAO S M, LIU Y M, et al.Effect of pH on the gel properties and secondary structure of fish myosin[J].Food Chemistry, 2010, 121(1):196-202.
[19] 李亚楠. 鸭肉中肌原纤维蛋白的提取及凝胶特性的研究[D].天津:天津商业大学, 2012.LI Y N.Researches on the extraction of myofibrillar proteins of the duck muscle and the gelation properties[D].Tianjin:Tianjin University of Commerce, 2012.
[20] 田金河, 张艳芳, 王艳婕, 等.酸溶条件及高强度超声波对鲢鱼肉分离蛋白的提取及凝胶特性的影响[J].现代食品科技, 2019, 35(12):232-240.TIAN J H, ZHANG Y F, WANG Y J, et al.Recovery and gelation property of protein isolate from silver carps (Hypophthal michthys molitrix) as affected by pH and high intensity ultrasonic treatment[J].Modern Food Science and Technology, 2019, 35(12):232-240.
[21] LIU Q, CHEN Q, KONG B H, et al.The influence of superchilling and cryoprotectants on protein oxidation and structural changes in the myofibrillar proteins of common carp (Cyprinus carpio) surimi[J].LWT-Food Science and Technology, 2014, 57(2):603-611.
[22] LAMETSCH R, ROEPSTORFF P, MØLLER H S, et al.Identification of myofibrillar substrates for μ-calpain[J].Meat Science, 2004, 68(4):515-521.
[23] 常海霞, 石燕, 王辉, 等.超声波对草鱼肌肉肌原纤维蛋白溶液理化特性的影响[J].食品科学, 2015, 36(5):56-60.CHANG H X, SHI Y, WANG H, et al.Effect of ultrasonic treatment on physico-chemical properties of myofi brillar protein from grass carp[J].Food Science, 2015, 36(5):56-60.
[24] SHARIFIAN A, SOLTANIZADEH N, ABBASZADEH R.Effects of dielectric barrier discharge plasma on the physicochemical and functional properties of myofibrillar proteins[J].Innovative Food Science &Emerging Technologies, 2019, 54:1-8.
[25] DUMETZ A C, CHOCKLA A M, KALER E W, et al.Effects of pH on protein-protein interactions and implications for protein phase behavior[J].Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2008, 1784(4):600-610.
[26] LIU R, ZHAO S M, XIONG S B, et al.Role of secondary structures in the gelation of porcine myosin at different pH values[J].Meat Science, 2008, 80(3):632-639.
[27] ZHOU F B, ZHAO M M, CUI C, et al.Influence of linoleic acid-induced oxidative modifications on physicochemical changes and in vitro digestibility of porcine myofibrillar proteins[J].LWT-Food Science and Technology, 2015, 61(2):414-421.
[28] LEE S H, LEF VRE T, SUBIRADE M, et al.Changes and roles of secondary structures of whey protein for the formation of protein membrane at soy oil/water interface under high-pressure homogenization[J].Journal of Agricultural and Food Chemistry, 2007, 55(26):10924-10931.
VRE T, SUBIRADE M, et al.Changes and roles of secondary structures of whey protein for the formation of protein membrane at soy oil/water interface under high-pressure homogenization[J].Journal of Agricultural and Food Chemistry, 2007, 55(26):10924-10931.
[29] D VILA E, PARÉS D.Structure of heat-induced plasma protein gels studied by fractal and lacunarity analysis[J].Food Hydrocolloids, 2007, 21(2):147-153.
VILA E, PARÉS D.Structure of heat-induced plasma protein gels studied by fractal and lacunarity analysis[J].Food Hydrocolloids, 2007, 21(2):147-153.
[30] KAL B M, ALLAN-WOJTAS P, MILLER S S.Microscopy and other imaging techniques in food structure analysis[J].Trends in Food Science &Technology, 1995, 6(6):177-186.
B M, ALLAN-WOJTAS P, MILLER S S.Microscopy and other imaging techniques in food structure analysis[J].Trends in Food Science &Technology, 1995, 6(6):177-186.
[31] KIM J H, VARANKOVICH N V, STONE A K, et al.Nature of protein-protein interactions during the gelation of canola protein isolate networks[J].Food Research International, 2016, 89:408-414.
[32] XING T, ZHAO X, CAI L L, et al.Effect of salt content on gelation of normal and wooden breast myopathy chicken pectoralis major meat batters[J].International Journal of Food Science &Technology, 2017, 52:2068-2077.
[33] ZHANG Z Y, REGENSTEIN J M, ZHOU P, et al.Effects of high intensity ultrasound modification on physicochemical property and water in myofibrillar protein gel[J].Ultrasonics Sonochemistry, 2017, 34:960-967.
[34] XU Y S, XIA W S, YANG F, et al.Physical and chemical changes of silver carp sausages during fermentation with Pediococcus pentosaceus[J].Food Chemistry, 2010, 122(3):633-637.
[35] HERMANSSON A M.Aggregation and Denaturation Involved in Gel Formation[M].Washington, D.C.: American Chemical Society, 1979:81-103.
[36] XIA M Q, CHEN Y X, GUO J J, et al.Water distribution and textual properties of heat-induced pork myofibrillar protein gel as affected by sarcoplasmic protein[J].LWT, 2019, 103:308-315.
[37] ZHUANG X B, HAN M Y, BAI Y, et al.Insight into the mechanism of myofibrillar protein gel improved by insoluble dietary fiber[J].Food Hydrocolloids, 2018, 74:219-226.