百合(Lilium spp.)是百合科(Liliaceae)多年生草本球茎植物,具有重要的观赏、食用和药用价值。全世界共知的百合种类约有110种,其中近一半来自于中国[1]。百合鳞茎在中国被广泛用作食品和中药,因为它们含有丰富的营养成分,如淀粉、蛋白质、多糖、维生素和秋水仙碱,并且具有抗炎、抗肿瘤、抗氧化、抗衰老和降血糖的作用[2]。兰州百合(Lilium davidii var. unicolor)是中国可食用百合中唯一的甜百合,其鳞茎洁白如玉、肉质饱满、味道甘甜、营养丰富,具有广阔的应用前景和良好的经济价值[3-4]。近年来,鲜切水果和蔬菜因其便利性而越来越受到消费者的青睐,颜色的改变对于鲜切食品的品质来说至关重要,产品表面变色会严重影响产品的感官品质,是制约鲜切产品保存的主要因素[5]。然而,鲜切百合鳞茎在加工和贮藏过程中通常会出现紫红色变化和褐变,导致其商业价值的极大损失。
迄今为止,百合鳞茎的酶促褐变已被广泛研究,而对其紫红色变化的研究较少。一般认为,当果实在异常条件下出现瘀伤、切割、剥落、患病或生理紊乱时,在受伤部位容易发生酶促褐变,而健康的果实由于天然阻氧系统的存在,内部褐变较少[6]。百合鳞茎的酶促褐变反应归因于内源性褐变酶,包括多酚氧化酶(polyphenol oxidase, PPO)和过氧化物酶(peroxidase, POD)引起的多酚氧化。PPO能将多酚氧化成醌,其后续反应导致黑色素的积累。POD可以在H2O2存在下氧化酚类物质以产生褐色色素聚合物,导致组织褐变[7]。百合鳞茎在采后贮藏过程中的另一种变色现象是紫红色变化,主要集中在没有机械损伤的位置。据报道,百合鳞茎的紫红色变化可能是由无色花青素氧化转化为着色花青素引起的[8]。在最近的研究中,百合鳞茎的紫红色变化可能是由于花青素的积累[9]。花青素是一类植物类黄酮,通常通过类黄酮生物合成途径合成,花青素生物合成中的主要酶包括苯丙氨酸解氨酶(phenylalanine ammonia lyase, PAL)、查尔酮合成酶(chalcone synthase, CHS)、查尔酮异构酶(chalcone isomerase, CHI)、黄烷酮 3-羟化酶(flavone 3-hydroxylase, F3H)、二氢黄酮醇还原酶(dihydroflavonol reductase, DFR)和花青素合成酶(anthocyanin synthase, ANS)[10]。温度被认为是控制鲜切果蔬品质的主要因素之一,已有研究表明一些植物中花青素的积累受温度影响[11-12]。然而,温度变化对百合鳞茎片中花青素生物合成的影响知之甚少。
本研究旨在确定不同贮藏温度对鲜切百合鳞茎片颜色变化的影响,特别是对鲜切百合鳞茎片紫红色变化的影响,为进一步研究百合鳞茎片紫红色变化的分子机制提供理论依据。
1 材料与方法
1.1 材料与试剂
从兰州市七里河区西果园街道购买的兰州百合样本,选取第4层和第5层的无病害无损伤、大小一致的百合鳞片,蒸馏水清洗后在1 g/L的次氯酸钠水溶液浸泡1 min,消除潜在的微生物,最终将其作为后续实验的植物材料[7]。
分析纯次氯酸钠、甲醇、盐酸、磷酸二氢钾、磷酸二氢钠,天津市化工三厂有限公司;植物花青素ELISA试剂盒、植物酶活ELISA试剂盒,上海远慕生物科技有限公司。
1.2 仪器与设备
色差仪WR,深圳市威福光电科技有限公司;台式低温冷冻离心机TDZ6-WS,湖南赫西仪器装备有限公司;紫外分光光度计UV-6100,上海元析仪器有限公司;酶标仪318M,上海赫冠仪器有限公司。
1.3 实验方法
1.3.1 植物材料处理
鲜切百合鳞茎片均贮藏在黑色PE密封袋中进行遮光处理,平均分为3组:组1(G1)置于(35±2) ℃、组2(G2)置于(20±2) ℃,以及组3(G3)置于(4±2) ℃。贮藏过程中分别在0、1、3、6、9、12 d随机选择百合鳞茎片样品,以供后续分析。
1.3.2 表观的测定
使用色差仪测量百合鳞茎片的表面颜色,并用白色标准板校准(L*=95.28,a*=-0.9,b*=0.68)。
1.3.3 褐变度的测定
参照KAN等[13]的研究,确定百合鳞茎片的褐变度,但有一些修改。简言之,将约2 g的百合鳞茎片粉碎在12 mL蒸馏水中,并在冰浴上进行该步骤。通过在4 ℃下以9 000×g离心20 min分离混合物。取上清液于420 nm下测定吸光度,褐变度表示为10×A420。
1.3.4 总酚含量的测定
根据刘程惠等[14]提出的方法,对总酚含量(total phenol content, TPC)的测定方法稍作修改。随机收集约3 g百合鳞茎片,与20 mL甲醇混合,在冰浴中均化并用纱布过滤。然后,将滤液在4 ℃下以15 000×g离心15 min,并在320 nm处测量上清液的吸光度。
1.3.5 花青素含量的测定
参照AN等[15]的甲醇-盐酸法提取花青素。将大约1 g百合鳞茎片浸泡在5 mL的1%(体积分数)甲醇-HCl 中,并在室温下避光孵育过夜。将约1 g百合鳞茎片与5 mL 1%(体积分数)甲醇-盐酸混合,并在室温下遮光培养12 h。采用ELISA试剂盒检测花青素含量(total anthocyanin content, TAC),试剂盒检测步骤如下:
a)在经过20 min的室内恒温处理之后,将所有的板材取下,并将其装入一个专门的密闭容器,以便将其冷却至4 ℃;
b)将50 μL标准品分别放入2个孔中,并分别添加不同浓度的样品;
c)先在样本孔中加入10 μL的待测样本,然后加入40 μL的样本稀释液,空白孔不加;
d)除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的检测抗体100 μL,用封板膜封住反应孔,37 ℃的水浴锅或者恒温箱,经过60 min的温度培养;
e)将溶解的液体抛出,吸水纸上拍干,每孔加满洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,如此反复清洁5次;
f)每孔加入底物A、B各50 μL,37 ℃避光孵育15 min。
g)每孔加入终止液50 μL,15 min内,在450 nm波长处测定各孔的OD值。
通过将标准品浓度与OD值相关联,构建一条线性回归曲线,从而根据曲线的形式来计算每个样本的浓度值。
1.3.6 褐变相关酶活力的测定
1.3.6.1 PPO活力的测定
粗酶溶液的制备可参考HUANG等[7]的方法。将约1 g百合鳞茎片粉碎在9 mL PBS(0.01 mol/L,pH 7.4)中,并在冰浴上进行该步骤。在4 ℃下以4 000×g离心15 min分离混合物,收集上清液用于进一步的酶分析。鲜切百合鳞茎片贮藏过程中PPO活力的测定采用ELISA试剂盒,检测步骤参照1.3.5节。
1.3.6.2 POD活力的测定
百合鳞茎片贮藏过程中POD的提取以及测定与PPO相同,采用ELISA试剂盒,检测步骤参照1.3.5节。
1.3.7 花青素合成相关酶活力的测定
花青素合成相关酶(PAL、CHS、CHI、F3H、DFR、ANS)的提取以及测定与PPO相同,采用ELISA试剂盒,检测步骤参照1.3.5节。
1.4 数据处理
所有实验均随机取样,至少重复3次。所有数据均使用SPSS 21.0统计软件进行单因素方差分析,LSD多范围测试检验数据之间差异显著性(P<0.05),并使用Origin 2021进行图形绘制。
2 结果与分析
2.1 温度对鲜切百合鳞茎片表观指标的影响
兰州百合鳞茎片在采后贮藏过程中易发生颜色变化,严重影响其外观质量。如图1所示,最初百合鳞茎片的表面颜色为亮白色,随着贮存时间的延长,3组百合鳞茎片的表面颜色在12 d都没有呈现紫红色。如图1所示,G1组鳞茎片的表面颜色自6 d发生变色,最终在12 d颜色更深,并且变色部位主要为剥落时造成机械损伤的边缘。然而,G3组百合鳞茎片表面颜色在贮存结束时仍未出现明显的颜色变化。

图1 不同组鲜切百合鳞茎片贮藏期间表观变化
Fig.1 Apparent changes of fresh-cut lily bulb scales in different groups during storage
本次关于温度对百合鳞茎片表面颜色的研究发现,百合鳞茎片颜色易受贮藏温度的影响,35 ℃时的变色情况最严重,但未观察到明显的紫红色。相比之下,当贮藏温度为20 ℃时,百合鳞茎片的颜色变化更小。以上结果表明,贮藏温度的改变会影响百合鳞茎片表面的颜色变化,但未引起百合鳞茎片表面紫红色变化。
如图2所示,百合鳞茎片的L*值随着贮藏时间的延长而下降。在6、9、12 d,与20 ℃和4 ℃相比,35 ℃处理显著加速了百合鳞茎片L*值的降低。在不同温度条件下,a*值在总体趋势上没有显著差异。与a*值不同,随着贮藏温度的升高,G1组的b*值增加速率最快,在G3组中增速最小。如图2-d所示,低温下鲜切百合鳞茎片的褐变度变化不明显,而G1组中鳞茎片的褐变度显著高于G2和G3组。

a-L*值;b-a*值;c-b*值;d-褐变度
图2 不同组鲜切百合鳞茎片色差L*、a*、b*以及褐变度的变化
Fig.2 Dynamics of different groups on chromaticity L*, a*, b*, and browning degree of fresh-cut lily bulb scales
注:不同小写字母表示差异显著(P<0.05)(下同)。
在不同温度处理兰州百合鳞茎片的研究中,鳞茎片表面的L*值随着贮存时间的延长而降低,这解释了鳞茎片表面颜色的加深,温度的升高也加剧了L*值的降低。此外,a*值表示红绿色差,a*值越大,表明红色越深[11],贮藏温度的改变并没有显著改变a*值的总体趋势。百合鳞茎的b*值随贮藏时间的延长而增加,并且b*值随贮藏温度的上升显著增加。本研究结果中L*、a*、b*值的变化与其他研究者关于鲜切百合鳞茎的研究结果呈现相同的趋势[13,16]。此外,GAO等[17]研究发现,水果和蔬菜的褐变度与L*值的降低和a*、b*值的增加有关。以上结果表明,温度对百合鳞茎表面颜色与褐变度的影响较大,但并使百合鳞茎表面呈现紫红色。
2.2 温度对鲜切百合鳞茎片变色相关物质的影响
2.2.1 温度对鲜切百合鳞茎片总酚含量的影响
如图3所示,百合鳞茎片中的TPC随着贮存时间的延长呈上升趋势。TPC在百合鳞茎片中的积累率随温度的升高而显著增加。在整个贮藏过程中,G1组中TPC的增加速率显著高于G2和G3组,G3组中的增速最低。
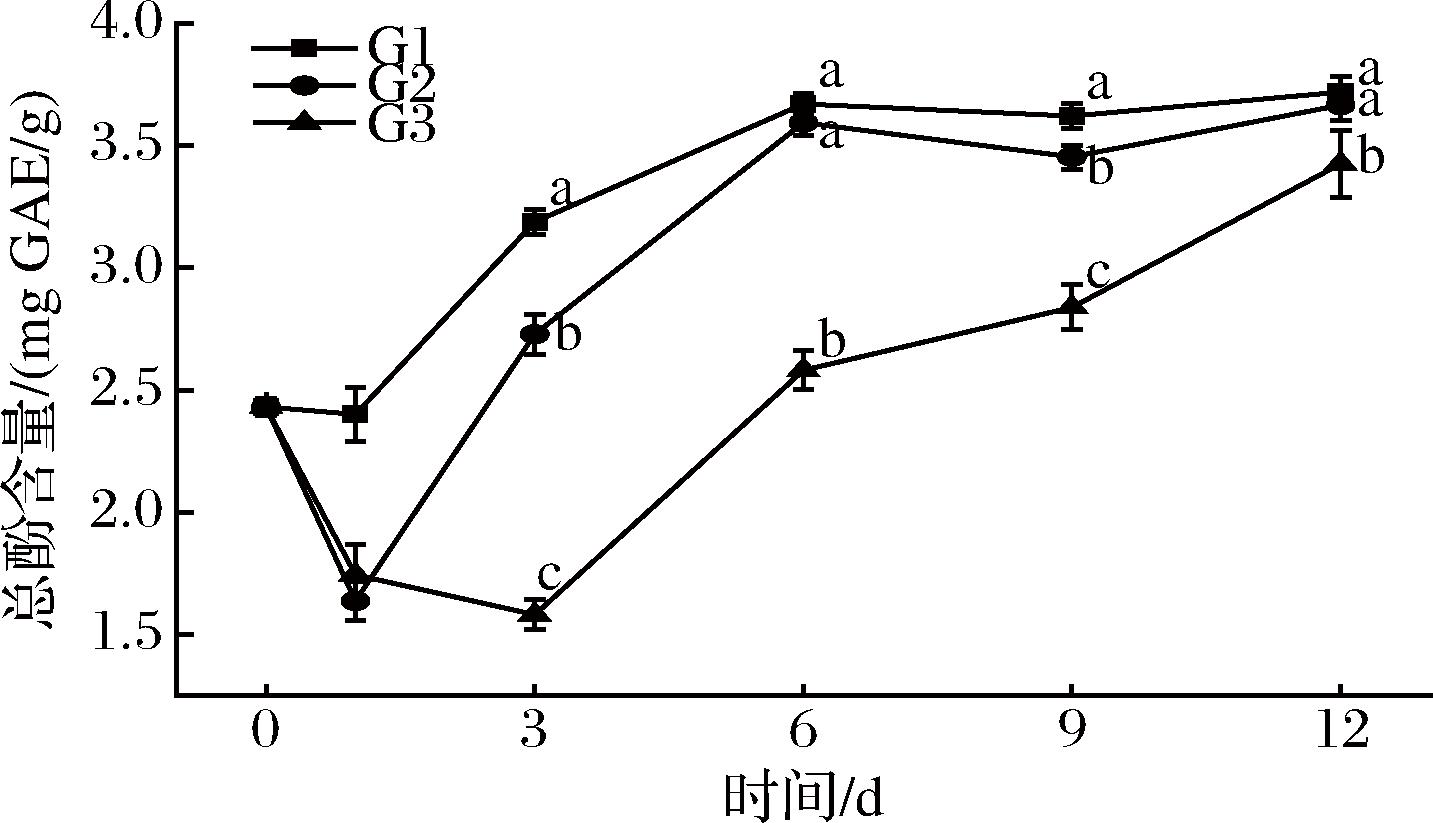
图3 不同组鲜切百合鳞茎片总酚含量的变化
Fig.3 Effect of different groups on the TPC in fresh-cut lily bulb scales
TPC作为底物在酶促褐变中起主要作用。本研究发现,所有处理组中百合鳞茎的TPC都随着贮藏时间的延长而增加,并且温度的升高能够提高鲜切百合鳞茎中TPC积累。对鲜切嘎啦苹果的研究表明,较高的贮藏温度会促进总酚的积累[18]。TPC在G3组中最低,因为低温抑制了酚类化合物的合成。
2.2.2 温度对鲜切百合鳞茎片总花青素含量的影响
如图4所示,在不同温度处理条件下,TAC表现出显著差异,但变化趋势相似。在每个检测时间,G2组中TAC最高,12 d达到5.99 g/L,在G3组中最低,12 d仅有1.66 g/L。
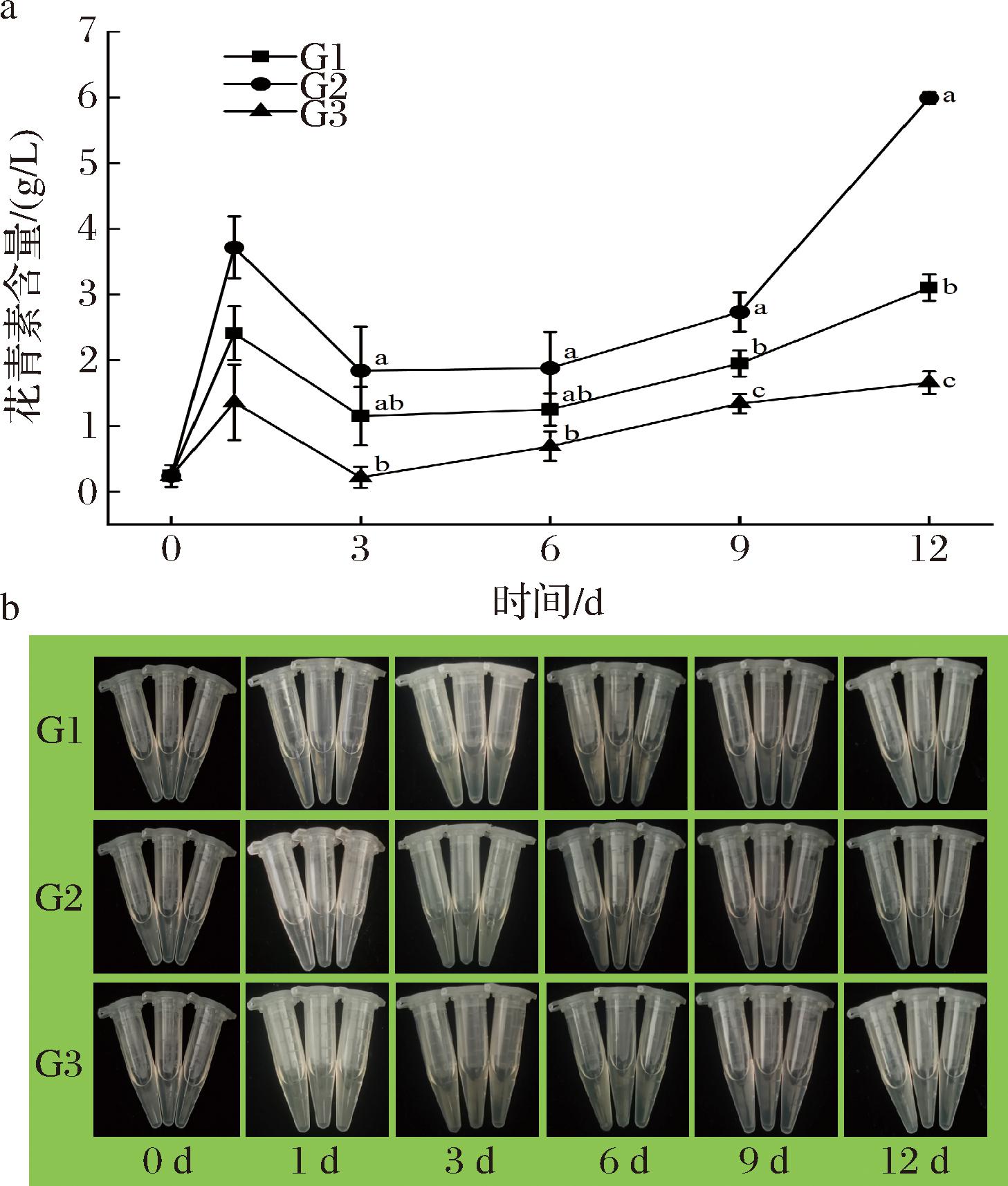
a-花青素含量;b-花青素提取液
图4 不同组鲜切百合鳞茎片花青素含量与花青素提取液的变化
Fig.4 Effect of different groups on the TAC and anthocyanin extract in fresh-cut lily bulb scales
花青素是植物中重要的色素成分, 它能使植物的根、叶、花、果实和其他组织呈现出红色、紫色和蓝色。与4 ℃和35 ℃相比,20 ℃的贮藏温度可以显著促进百合鳞茎中花青素的积累,原因可能涉及花青素在高温条件下降解。类似的研究中发现在高温胁迫的影响下,茄子中花青素的积累受到抑制[19];李子果实花青素的研究中发现Ⅲ类过氧化物酶在35 ℃下催化花青素的降解[20];这与本研究中35 ℃处理组花青素含量低于20 ℃处理组的结果相近。
2.3 温度对鲜切百合鳞茎片褐变相关酶活力的影响
褐变会影响果蔬的营养质量及其商业价值,百合鳞茎中的PPO及POD是催化其发生褐变的重要原因[21]。百合鳞茎片中的PPO活力如图5-a所示。不同温度处理组百合鳞茎片PPO活力在1 d均急剧下降,可能是由于百合鳞茎实验前长期冷藏[(0±0.5) ℃],在实验初期温度突变引起的细胞应激反应所导致。在1~12 d,不同组的PPO活力均呈现先升高后降低的趋势,G2和G3组PPO活力的拐点出现在3 d,而G1组的拐点则出现在6 d。在9 d时,不同温度处理组的PPO活力存在显著差异,其中G1组最高,G3组最低。
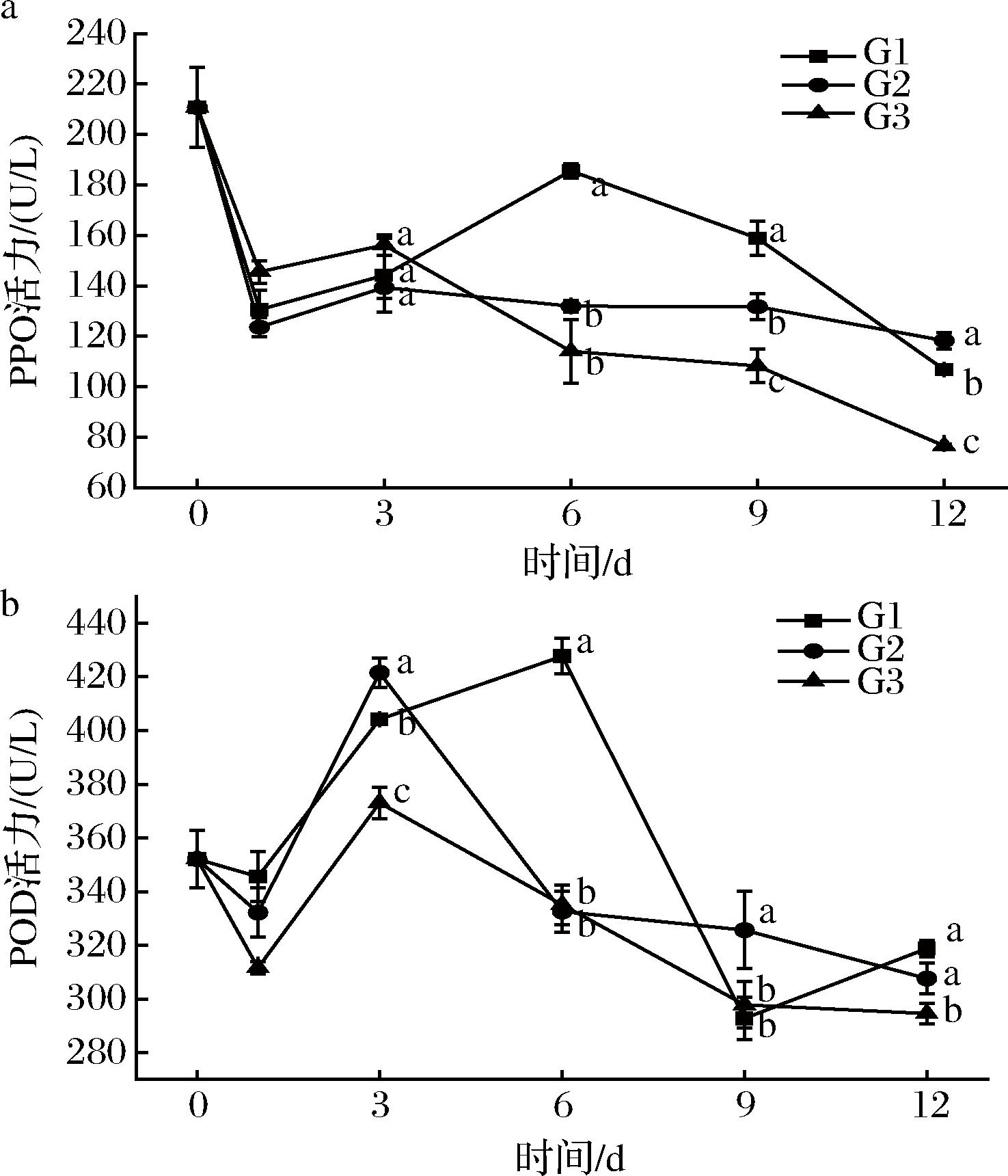
a-PPO活力;b-POD活力
图5 不同组鲜切百合鳞茎片PPO和POD活力的变化
Fig.5 The enzyme activities of PPO and POD in fresh-cut lily bulb scales
百合鳞茎片中的POD活力如图5-b所示。与PPO相似,不同温度处理组百合鳞茎片POD活力同样在1 d下降。在1~12 d,G2和G3组POD活力呈现先升高后降低的趋势,且贮藏至3 d时POD活力达到最大值。在贮藏时间为6 d时,G1组POD活力达到最大值,G1组中百合鳞茎片POD活力显著高于G2和G3组。在贮藏后期(9 d和12 d)百合鳞茎POD活力的降低,可能是由于褐变产物积累抑制PPO活力或密封袋中缺氧。在先前关于槟榔仁[22]褐变的研究中发现了类似的结果。以上结果表明,温度通过影响PPO和POD的活力来影响百合鳞茎中的褐变程度。
2.4 温度对鲜切百合鳞茎片花青素合成相关酶活力的影响
PAL是一种重要的限速酶,它能够促进苯丙氨酸的氧化,从而产生反式肉桂酸,这对于酚类化合物的生产具有极其重要的意义[23]。此外,PAL能够使苯丙氨酸脱氨基为对香豆酰辅酶A,开始花青素的生物合成。如图6-a所示,百合鳞茎片中PAL的活力先升高后降低。仅在6 d,不同温度处理组之间的PAL活力存在显著差异,G1组中活力最高,G3组活力最低。
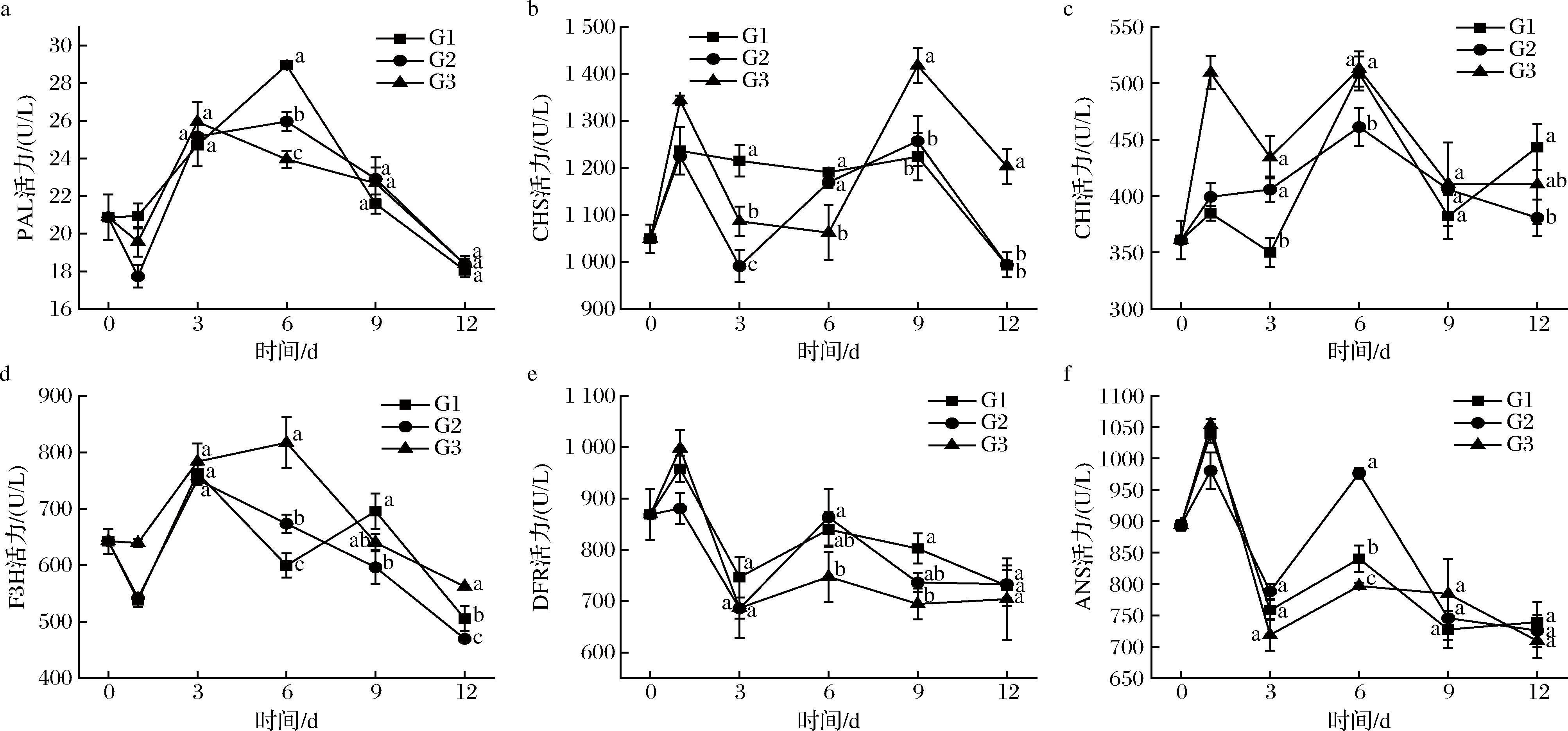
a-PAL活力;b-CHS活力;c-CHI活力;d-F3H活力;e-DFR活力;f-ANS活力
图6 不同组鲜切百合鳞茎片PAL,CHS,CHI,F3H,DFR和ANS活力的变化
Fig.6 The enzyme activities of PAL, CHS, CHI, F3H, DFR, and ANS in fresh-cut lily bulb scales
花青素合成相关酶在植物体内扮演着至关重要的角色,其中CHS、CHI、F3H、DFR以及ANS是最常见的[10]。F3H的活力变化(图6-d)与PAL的活力趋势相似,但在6 d,G3组的活力最高,G1组的活力最低。在6 d时,G1和G2组之间的CHS(图6-b)和DFR(图6-e)活力没有显著差异,但高于G3组。3组之间的ANS活力在6 d存在显著差异(图6-f),G2组的活力最高,G3组的活力最低。此外,在6 d,G1和G3组的CHI活力显著高于G2组。
2.5 数据相关性分析
在本研究中,3组中的百合鳞茎片表面均没有出现明显的紫红色变化,但G2组中花青素的积累量最大。因此,对G2组中的每个指标进行皮尔逊相关系数分析,以进一步探讨温度对百合鳞茎片紫红色变化的影响。
图7显示,在20 ℃条件下,花青素的含量与其他指标没有显示出明显的相关性。这一结果证明,温度对百合鳞茎片中花青素的积累没有显著影响。植物中花青素的积累取决于生物合成和降解之间的转换,并且这种转换在高温条件下会增强[20]。在对葡萄着色的研究中也发现了类似的结果,光诱导了葡萄花青素的积累,这种诱导现象与温度无关[24]。

图7 百合鳞茎鳞片花青素相关指标的相关分析
Fig.7 Correlation analysis of anthocyanin-related indices of lily bulb scales
3 结论与讨论
兰州百合鳞茎因其色泽洁白、味道甘甜,含有丰富的营养物质而受到广泛的关注。本研究对鲜切兰州百合鳞茎片在遮光条件下进行不同温度贮藏,当贮藏温度升高时,百合鳞茎片表面会出现严重的颜色变化,但3组百合鳞茎片表面均未发现紫红色。果蔬的酶促褐变是由PPO和部分POD氧化酚类化合物引起的[21],在本研究中,使用长期冷藏[(0±0.5) ℃]的兰州百合作为植物材料,通过测定PPO、POD活力发现,研究初期(0 d和1 d)百合鳞茎片PPO和POD活力急剧变化,可能是由于百合鳞茎片实验前后温度突变引起的细胞应激反应所致。在贮藏中期(3 d和6 d),较高温度促进了PPO与POD活力的增加。在贮藏后期(9 d和12 d)百合鳞茎片PPO和POD活力的降低,可能是由于褐变产物积累造成的抑制作用或密封袋中氧耗尽。在百合鳞茎片的膜脂质过氧化研究中也有类似的发现[25]。同时,本文中百合鳞茎片中总酚含量在35 ℃条件下高于4 ℃和20 ℃,说明高温既促进了PPO和POD活力的增加,也提高了总酚含量,这解释了35 ℃处理组中百合鳞茎片表面的褐变度最高。冯雨等[11]探究了贮藏温度对‘Tarocco’血橙花色苷积累及抗氧化活力的影响,实验结果表明,低温贮藏抑制了果实中POD和PPO活力,并减缓了血橙果肉中酚类物质的氧化。
本研究还检测了6种花青素合成相关酶活力,如图6所示,在研究初期(0 d和1 d),各个酶活力出现急剧变化,可能是由于百合鳞茎片实验前后温度差异引起的细胞应激反应所致。花青素合成相关酶的活力受到温度的影响,特别是贮藏至6 d时,不同温度处理组间百合鳞茎片PAL、F3H、ANS活力均存在显著差异,4 ℃条件下CHS和DFR活力均低于35 ℃。在贮藏后期(9 d和12 d),与花青素合成相关的酶的活力呈下降趋势,这与HUANG等[7]的发现相似。通过研究温度对鲜切百合鳞茎片总花青素含量的影响,发现在20 ℃条件下百合鳞茎片花青素积累量最高,在12 d最高达到5.99 g/L,但数据相关性分析结果显示,花青素含量变化趋势与酶活力变化趋势没有显著相关性。
3组处理百合鳞茎片表面均未出现紫红色变化,可能是由于20 ℃处理组中百合鳞茎片花青素部分积累并不足以使表面呈现紫红色。35 ℃处理组中花青素在高温下可能存在降解现象[20],ICHIMURA等[26]探究了温度和光照强度对金鱼草花青素生物合成的影响,研究结果表明,高温对金鱼草花瓣色素沉着相关的花青素积累有抑制作用,并且在高温条件下花青素含量的降低与花青素生物合成相关基因的抑制有关。4 ℃处理组中低温抑制了细胞各项生理活性,因此各组百合鳞茎片均未出现紫红色。
综上所述,温度影响了鲜切百合鳞茎片的TPC及PPO和POD的活力,进而影响了表面的褐变度。但温度对TAC和花青素相关酶活力的影响并未导致鲜切百合鳞茎片表面呈现紫红色变化。
[1] 郎利新, 窦晓莹, 孔滢, 等.不同(品)种及产地的百合鳞茎营养成分分析[J].食品工业科技, 2022, 43(10):339-350.LANG L X, DOU X Y, KONG Y, et al.Analysis of nutrient components of lily bulbs from different origins[J].Science and Technology of Food Industry, 2022, 43(10):339-350.
[2] LI W M, WANG Y J, WEI H L, et al.Structural characterization of Lanzhou lily (Lilium davidii var.unicolor) polysaccharides and determination of their associated antioxidant activity[J].Journal of the Science of Food and Agriculture, 2020, 100(15):5603-5616.
[3] SHANG Q H, ZHAO X, LI Y Y, et al.First report of Fusarium tricinctum causing stem and root rot on Lanzhou lily (Lilium davidii var.unicolor) in China[J].Plant Disease, 2014, 98(7):999.
[4] 马莹, 张萍, 杨英, 等.钾对兰州百合鳞茎中多酚类物质积累代谢及其抗氧化活性的影响[J].西北植物学报, 2023, 43(5):781-793.MA Y, ZHANG P, YANG Y, et al.Effects of potassium on accumulation and metabolism of polyphenols and antioxidant activity in bulbs of Lilium davidii var.unicolor[J].Acta Botanica Boreali-Occidentalia Sinica, 2023, 43(5):781-793.
[5] 韩晨瑞, 申靖, 刘航, 等.鲜切果蔬物理保鲜技术研究进展[J].食品科技, 2022, 47(11):17-23.HAN C R, SHEN J, LIU H, et al.Research progress on physical preservation technologies of fresh-cut fruits and vegetables[J].Food Science and Technology, 2022, 47(11):17-23.
[6] LI Z H, ZHANG Y X, GE H B.The membrane may be an important factor in browning of fresh-cut pear[J].Food Chemistry, 2017, 230:265-270.
[7] HUANG D J, LI W T, DAWUDA M M, et al.Hydrogen sulfide reduced colour change in Lanzhou lily-bulb scales[J].Postharvest Biology and Technology, 2021, 176:111520.
[8] 蒋益虹. 影响百合色泽变化因素的研究[J].中国食品学报, 2004, 4(3):25-28.JIANG Y H.Studies on factors affecting color change of lily[J].Journal of Chinese Institute of Food Science and Technology, 2004, 4(3):25-28.
[9] FAN W G, LI B Y, TIAN H, et al.Metabolome and transcriptome analysis predicts metabolism of violet-red color change in Lilium bulbs[J].Journal of the Science of Food and Agriculture, 2022, 102(7):2903-2915.
[10] 肖伟, 张铭芳, 张秀海, 等.百合花青素合成调控的研究进展[J].北方园艺, 2018, (20):154-162.XIAO W, ZHANG M F, ZHANG X H, et al.Research progress of anthocyanin synthesis regulation of lily[J].Northern Horticulture, 2018, (20):154-162.
[11] 冯雨, 贺明阳, 王晶, 等.贮藏温度对 ‘Tarocco’ 血橙花色苷积累及抗氧化活性的影响[J].食品与发酵工业, 2020, 46(4):211-218.FENG Y, HE M Y, WANG J, et al.Effects of storage temperature on anthocyanin accumulation and antioxidant activity of ‘Tarocco’ blood orange[J].Food and Fermentation Industries, 2020, 46(4):211-218.
[12] MOVAHED N, PASTORE C, CELLINI A, et al.The grapevine VviPrx31 peroxidase as a candidate gene involved in anthocyanin degradation in ripening berries under high temperature[J].Journal of Plant Research, 2016, 129(3):513-526.
[13] KAN J, XIE W J, WAN B, et al.Heat-induced tolerance to browning of fresh-cut lily bulbs (Lilium lancifolium Thunb.) under cold storage[J].Journal of Food Biochemistry, 2019, 43(5):e12816.
[14] 刘程惠, 胡文忠, 王艳颖, 等.不同贮藏温度下鲜切甘薯的生理生化变化[J].食品工业科技, 2012, 33(17):342-345;349.LIU C H, HU W Z, WANG Y Y, et al.Changes of physiology and biochemistry of fresh-cut sweet potato at different storage temperatures[J].Science and Technology of Food Industry, 2012, 33(17):342-345;349.
[15] AN X H, TIAN Y, CHEN K Q, et al.MdMYB9 and MdMYB11 are involved in the regulation of the JA-induced biosynthesis of anthocyanin and proanthocyanidin in apples[J].Plant and Cell Physiology, 2015, 56(4):650-662.
[16] ZHAO K H, XIAO Z P, ZENG J G, et al.Effects of different storage conditions on the browning degree, PPO activity, and content of chemical components in fresh Lilium bulbs (Liliumbrownii F.E.Brown var.viridulum Baker.)[J].Agriculture, 2021, 11(2):184.
[17] GAO H, CHAI H K, CHENG N, et al.Effects of 24-epibrassinolide on enzymatic browning and antioxidant activity of fresh-cut lotus root slices[J].Food Chemistry, 2017, 217:45-51.
[18] 魏敏, 周会玲, 徐义杰, 等.贮藏温度对鲜切嘎啦苹果褐变的影响[J].北方园艺, 2011, (17):160-163.WEI M, ZHOU H L, XU Y J, et al.Effects of storage temperature on browning of fresh-cut ‘Gala’ apples[J].Northern Horticulture, 2011, (17):160-163.
[19] LI S H, HE Y J, LI L Z, et al.New insights on the regulation of anthocyanin biosynthesis in purple Solanaceous fruit vegetables[J].Scientia Horticulturae, 2022, 297:110917.
[20] NIU J P, ZHANG G J, ZHANG W T, et al.Anthocyanin concentration depends on the counterbalance between its synthesis and degradation in plum fruit at high temperature[J].Scientific Reports, 2017, 7(1):7684.
[21] 万冰. 微加工百合鳞茎褐变机制及其调控研究[D].扬州:扬州大学, 2018.WAN B.Study on browning mechanism and regulation of microprocessed lily bulb[D].Yangzhou:Yangzhou University, 2018.
[22] 郭宇婷, 刘帅民, 宋汉良, 等.贮藏温度对槟榔果仁褐变的影响[J].食品工业, 2019, 40(7):62-65.GUO Y T, LIU S M, SONG H L, et al.Effect of storage temperature on browning of betel nut kernel[J].The Food Industry, 2019, 40(7):62-65.
[23] NYBAKKEN L, KESKI-SAARI S, FALCK M A, et al.Restoration of secondary metabolism in birch seedlings relieved from PAL-inhibitor[J].Trees, 2007, 21(3):273-281.
[24] AZUMA A, YAKUSHIJI H, KOSHITA Y, et al.Flavonoid biosynthesis-related genes in grape skin are differentially regulated by temperature and light conditions[J].Planta, 2012, 236(4):1067-1080.
[25] 阚娟, 万冰, 解王晶, 等.百合鳞片褐变过程中膜脂过氧化研究[J].食品科学, 2019, 40(1):9-15.KAN J, WAN B, XIE W J, et al.Membrane lipid peroxidation during browning of lily bulbs [J].Food Science, 2019, 40(1):9-15.
[26] ICHIMURA K, NIKI T, MATOH M, et al.High temperature under low light conditions suppresses anthocyanin biosynthesis in snapdragon petals associated with decreased sugar levels[J].Scientia Horticulturae, 2021, 290:110510.