燃料乙醇以清洁、可持续发展的优点成为广受各国关注的能源[1-2],但其生产成本较高,价格相较于汽油并无明显差异,同步糖化发酵(simultaneous saccharification and fermentation,SSF)是以纤维原料为底物,加入纤维素酶复合物及酵母菌,让酶水解糖化和发酵在一个反应器同时反应,不会有糖的大量积累,且乙醇产量高,可有效解决燃料乙醇生产成本较高的问题,是被普遍关注的燃料乙醇生产技术之一。而SSF存在水解与发酵最适温度不匹配问题,故耐高温菌株是达成SSF生产乙醇目标的基础。目前利用生物质生产燃料乙醇的菌株主要是酿酒酵母,但其最适发酵温度(30~35 ℃)与纤维素酶最适酶活温度(50 ℃)相差较大。与酿酒酵母相比,马克斯克鲁维酵母具备高温耐受能力强、碳谱广泛、生长速度快等能力,其最适发酵温度(40 ℃)更加适配纤维素酶的最适温度,避免酶活力损失,工业生产中利用马克斯克鲁维酵母进行高温发酵可以大大降低冷却费用,从而节约能源,逐渐被燃料乙醇研究者所重视[3],而诱变筛选出更耐高温且稳定的马克斯克鲁维酵母生产燃料乙醇是关键,为探究影响其高温耐受能力的关键因素和进一步改造酿酒酵母提供依据。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术的突变率高、传代稳定性好、快速安全等特点[4],使其普遍应用于诱变选育中。例如,WANG等[5]利用ARTP诱变结合基因组重排获得了菌株E-158分批发酵产生的乙醇浓度比菌株KF-7高10.14%~81.02%。洪霞等[6]通过ARTP诱变及含乙醇培养基筛选,最终获得5株在45 ℃下乙醇产量提高37.9%~47.5%的突变体。
代谢物组学可以将生物体细胞或组织中任意生理时期的小分子代谢物进行定性和定量分析,利用非靶向代谢组学检测高温胁迫后的菌株代谢产物。相比于转录组学的基因变化未必会引起马克斯克鲁维酵母耐热性代谢物改变这一现象,代谢组学能够更为直观准确的筛选出与耐热性相关的关键物质,从而分析差异代谢产物的代谢通路以及功能,可与后续转录组学研究基因变化作呼应。且目前的研究报道对马克斯克鲁维酵母耐热性的代谢机制相关内容较少,阻碍了对马克思克鲁维酵母菌株的改造和调控,无法进一步提高产量而实现工业化应用。为此本研究利用ARTP技术诱变处理马克斯克鲁维酵母菌株GX-UN120,提高其耐高温能力进而提高乙醇产量,并结合代谢组学对其高耐热机制进行解析,为马克斯克鲁维酵母SSF产乙醇提供理论技术支持。
1 材料与方法
1.1 材料与试剂
马克斯克鲁维酵母GX-UN120,实验室保藏菌株;马克斯克鲁维酵母菌株GX-UN127,诱变所得耐高温菌株。
YPD培养基(g/L):酵母粉,蛋白胨20,葡萄糖20,琼脂粉20,pH自然,高压灭菌(115 ℃,20 min)。
发酵培养基:麸皮100 g/L,pH自然,高压灭菌(115 ℃,20 min)后加入纤维素酶(500 U/g)进行发酵。
蛋白胨、酵母粉,英国Oxoid;葡萄糖,上海沪试试验器材股份有限公司;琼脂粉、PBS缓冲液,北京索莱宝科技有限公司;甲醇、2-氯-L-苯丙氨酸、乙腈,成都超九八生物科技有限公司;麸皮,海兴牧丰源饲料有限公司。
1.2 仪器与设备
FYL-YS-430L恒温培养箱,北京福意电器有限公司;MQL-61R振荡培养箱,上海晏泉仪器有限公司;HH-4数显恒温水浴锅,常州国华电器有限公司;Centrifuge 5810R冷冻离心机,Eppendorf公司;MINIC-1001金属浴,杭州米欧仪器有限公司;MF3 ARTP诱变仪,杭州迅数科技有限公司;GC-2014C高效气相色谱仪,苏州岛津仪器有限公司;XO-400SD超声细胞破碎仪,南京先欧仪器有限公司;Q-EXACTIVE液相色谱质谱联用仪,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 等离子体诱变
在已灭菌的载片表面均匀涂布对数生长期的马克斯克鲁维酵母菌液10 μL,将载片置于ARTP凹槽中,功率120 W,距离2 mm处进行照射,气量调节至10 SLM,处理时间为0、20、40、60、80、100、120、140 s。致死率曲线根据计算菌株致死率结果绘制。致死率计算如公式(1)所示[6]:
致死率![]()
(1)
式中:m,ARTP诱变处理后平均菌落数;n,未经ARTP诱变处理后平板菌落数。
1.3.2 高耐热诱变菌株的筛选
突变株的初筛,将诱变所得菌液涂布于YPD固体平板上,46 ℃培养72 h后挑单菌落接种于YPD液体培养基(50/100 mL)中,46 ℃培养72 h后测定OD600值。
突变株的复筛,根据初筛结果,将OD600值高的菌株涂布于YPD固体平板上,40 ℃倒置培养24 h,选取单菌落接种于YPD液体培养基(50/100 mL)中,分别于40、46 ℃培养24 h后测定OD600值。将传代性能稳定的突变菌株作为后续研究菌株。
1.3.3 高温发酵产乙醇能力对比分析
将原始菌株与诱变菌株分别培养至对数期,以2%接种量至于发酵培养基中,于50 ℃和200 r/min条件下培养60 h,每12 h取样,以异丁醇为内标物,利用气相色谱法测定发酵液中的乙醇含量。
SE-40色谱柱(60 m×0.32 mm×0.25 mm)升温程序:初温60 ℃,维持1 min;以15 ℃/min升至110 ℃,维持0.2 min;40 ℃/min升温至220 ℃。气化室温度:200 ℃;恒流模式:1.0 mL/min;进样量:1 μL;分流比:40∶1。氢火焰离子化检测器(flame ionization detector,FID)温度220 ℃进行检测[7]。
1.3.4 马克斯克鲁维酵母响应高温胁迫的代谢组学分析
样本制备:取培养至对数期的出发菌株GX-UN120和诱变菌株GX-UN127离心(4 000 r/min,5 min),无菌水重悬3次,液氮速冻,剩余菌液热胁迫(54 ℃、200 r/min)1 h后重复上述步骤。
经胁迫的菌株胞内代谢物的提取:菌体经液氮猝灭后,添加800 μL提取液[V(甲醇)∶V(水)=4∶1],20 μL标准溶液(L-2-氯-苯丙氨酸,溶于甲醇,0.3 mg/mL)。冷冻研磨(-10 ℃,50 Hz)6 min,超声(4 ℃,40 Hz)提取30 min后静置(-20 ℃)30 min,离心(12 000 r/min,4 ℃)15 min保留上清液待测。实验设置5个生物学重复。高温胁迫后出发菌株GX-UN120简写为1201,诱变菌株GX-UN127简写为1271。
色谱条件:HSS T3色谱柱(100 mm×2.1 mm,1.8 μm);柱温40 ℃;进样量2 μL;流动相A为0.1%(体积分数)甲酸-水,流动相B为V(乙腈)∶V(异丙醇)=1∶1,含0.1%体积分数甲酸,流速0.4 mL/min。
质谱条件:采集信号方式为正负离子扫描,质量扫描范围m/z 70~1 050;电喷雾电离源,正离子电压3 500 V,负离子电压2 800 V,鞘气压力40 psi,辅助加热气体压力10 psi,离子源加热温度400 ℃,循环碰撞能量20~60 eV[8]。
1.4 数据处理
以受监督的正交偏最小二乘判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)模型为标准区别各组间代谢特性的整体差异,以变量投影重要性(variable importance projection,VIP)大于1和P<0.05为标准筛选差异代谢物,同时为获得差异代谢物参与的通路,选用京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库完成对代谢通路的注释。主成分分析(principal component analysis,PCA)使用R软件包ropls,使用Python包scipy.stats作通路富集分析。
2 结果与分析
2.1 马克斯克鲁维酵母等离子体诱变条件的确定
由图1可知,马克斯克鲁维酵母GX-UN120的致死率随ARTP诱变时间的增加而增大。当诱变时间是100 s时,致死率为90.3%,而当诱变时间增加到120 s时,致死率达到100%。致死率>90%时,菌株正突变率较高,且突变幅度较大。因此,以最佳诱变时间100 s进行诱变。
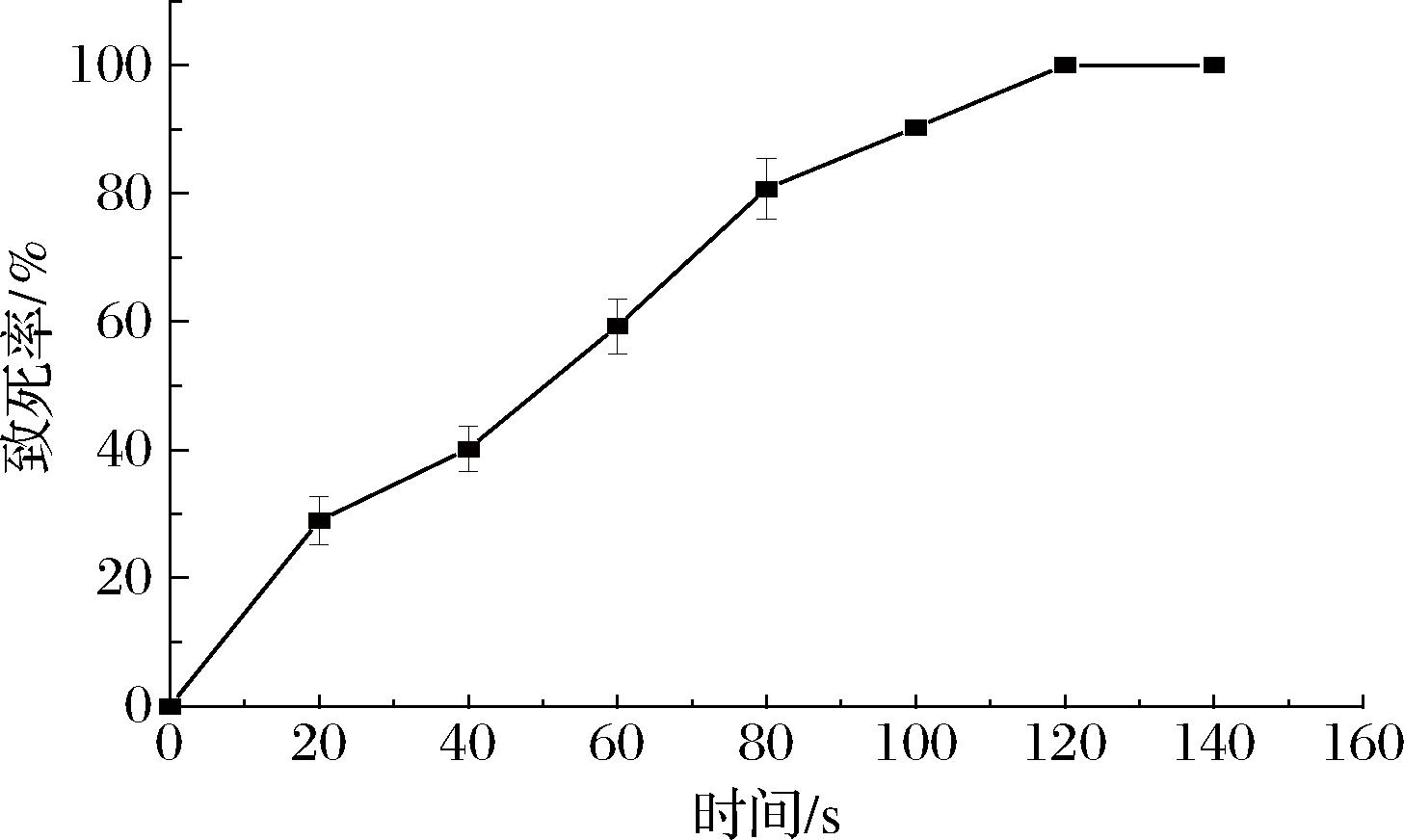
图1 诱变时间对马克斯克鲁维酵母GX-UN120致死率的影响
Fig.1 Effect of mutagenesis time on the lethality of GX-UN120
2.2 高耐热马克斯克鲁维酵母的筛选
初筛结果如图2-a所示,通过对马克斯克鲁维酵母GX-UN120进行ARTP诱变,挑取单菌落于46 ℃培养72 h后获得2株下生长性能较好的菌株,OD600值分别为0.91和1.12,命名为GX-UN127和GX-UN1211。复筛结果如图2-b所示,40 ℃下培养24 h时GX-UN120、GX-UN127,GX-UN1211的OD600值分别为1.12、0.91和0.83,46 ℃下培养24 h后GX-UN127、GX-UN1211的OD600值分别为0.29、0.25,较GX-UN120(OD600=0.17)分别提高了70.1%和47.1%。最后,对诱变菌株GX-UN127、GX-UN1211的传代稳定性实验结果如图2-c、图2-d所示,GX-UN127菌株GX-UN1211菌株和在连续传代5次后OD600值分别为1.32和1.13。上述结果可知,GX-UN127耐高温能力更强且传代更稳定,故选用GX-UN127作为后续研究菌株。

a-初筛;b-复筛;c-GX-127突变稳定性;d-GX-1211突变稳定性
图2 高温筛选马克斯克鲁维酵母诱变菌株及其突变稳定性
Fig.2 High temperature screening of K.marxianus mutagenesis strains and its mutation stability
2.3 诱变菌株发酵能力的研究
为探究诱变菌株的发酵能力是否得到提升,将出发菌株和诱变菌株高温下SSF情况进行对比,结果如图3所示,出发菌株和诱变菌株在40、43、50 ℃下无明显差异分别为5.1、5.6、0、5.5、5.9、0 g/L;而在45 ℃时GX-UN127的乙醇产量为7.6 g/L较GX-UN120的6.6 g/L提升了15.2%;48 ℃时出发菌株不能正常生长,诱变菌株发酵24 h时乙醇产量达到最大值2.2 g/L。诱变菌株的耐高温生长能力强于出发菌株,在45 ℃和48 ℃高温下的乙醇产量高于出发菌株,更具有SSF产乙醇的优势。
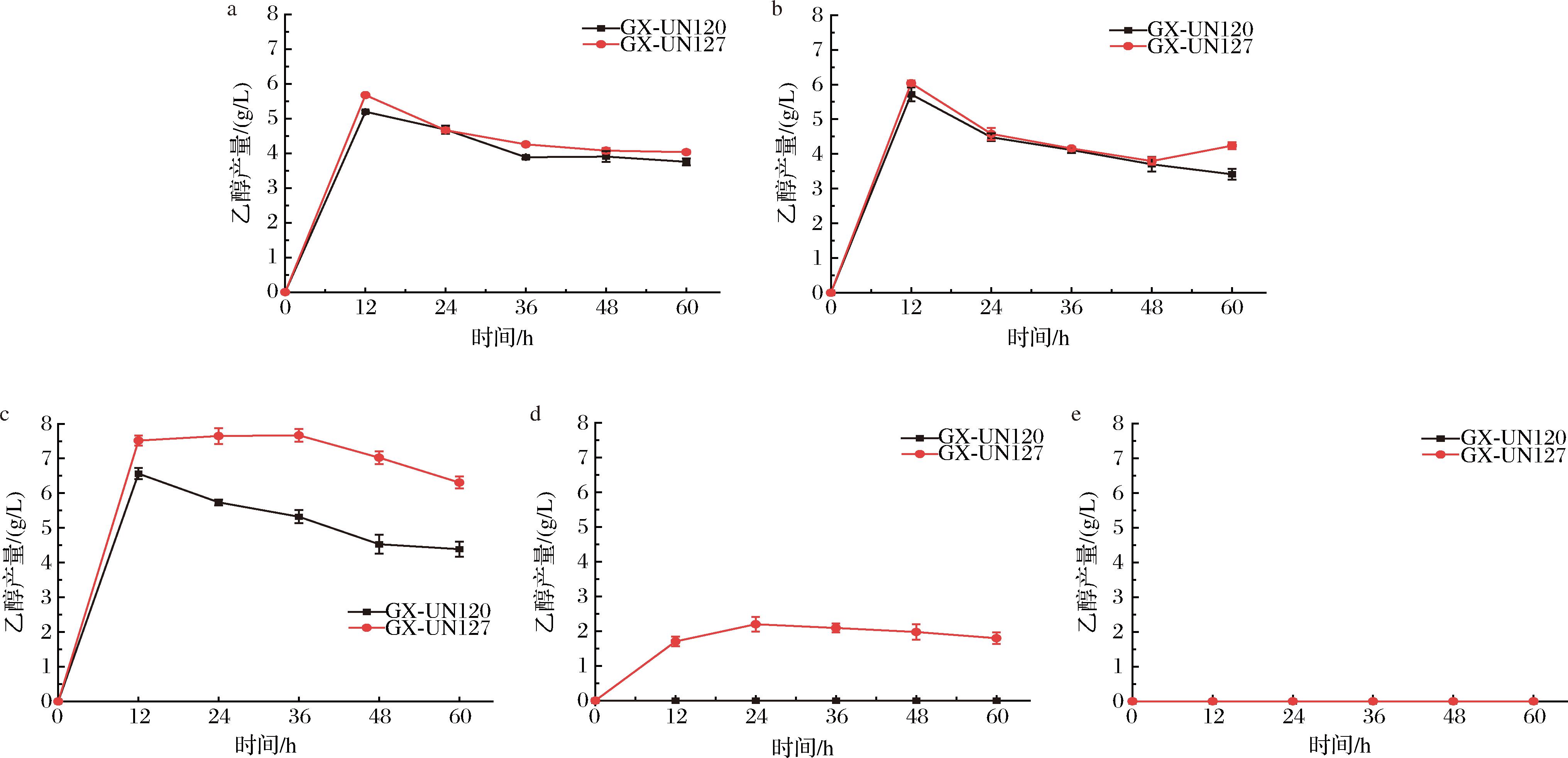
a-40 ℃;b-43 ℃;c-45 ℃;d-47 ℃;e-50 ℃
图3 出发菌株与诱变菌株高温SSF能力对比
Fig.3 comparison of the SSF ability at high temperature between the parental strain and the mutagenized strain
2.4 基于代谢组学分析马克斯克鲁维酵母对高温胁迫的响应
2.4.1 高温胁迫对马克斯克鲁维酵母胞内代谢产物的影响
初步筛选差异代谢物是以OPLS-DA模型的VIP>1,P<0.05作筛选标准。结果如图4所示,出发菌株GX-UN120(简称1201)和诱变菌株GX-UN127(简称1271)共有569个差异显著的代谢物,519个代谢物显著上调,50种代谢物显著下调。对能鉴定具体物质的差异代谢物绘制热图(图5),1271中S-腺苷半胱氨酸(100倍)、硫胺素(66.7倍)、胆碱(38.5倍)、泛酸(20倍)、精胺(16.4倍)甘油磷酸胆碱(14.9倍)、次黄嘌呤(12.7倍)、谷氨酸(11.2倍)等物质含量明显高于亲本菌株。
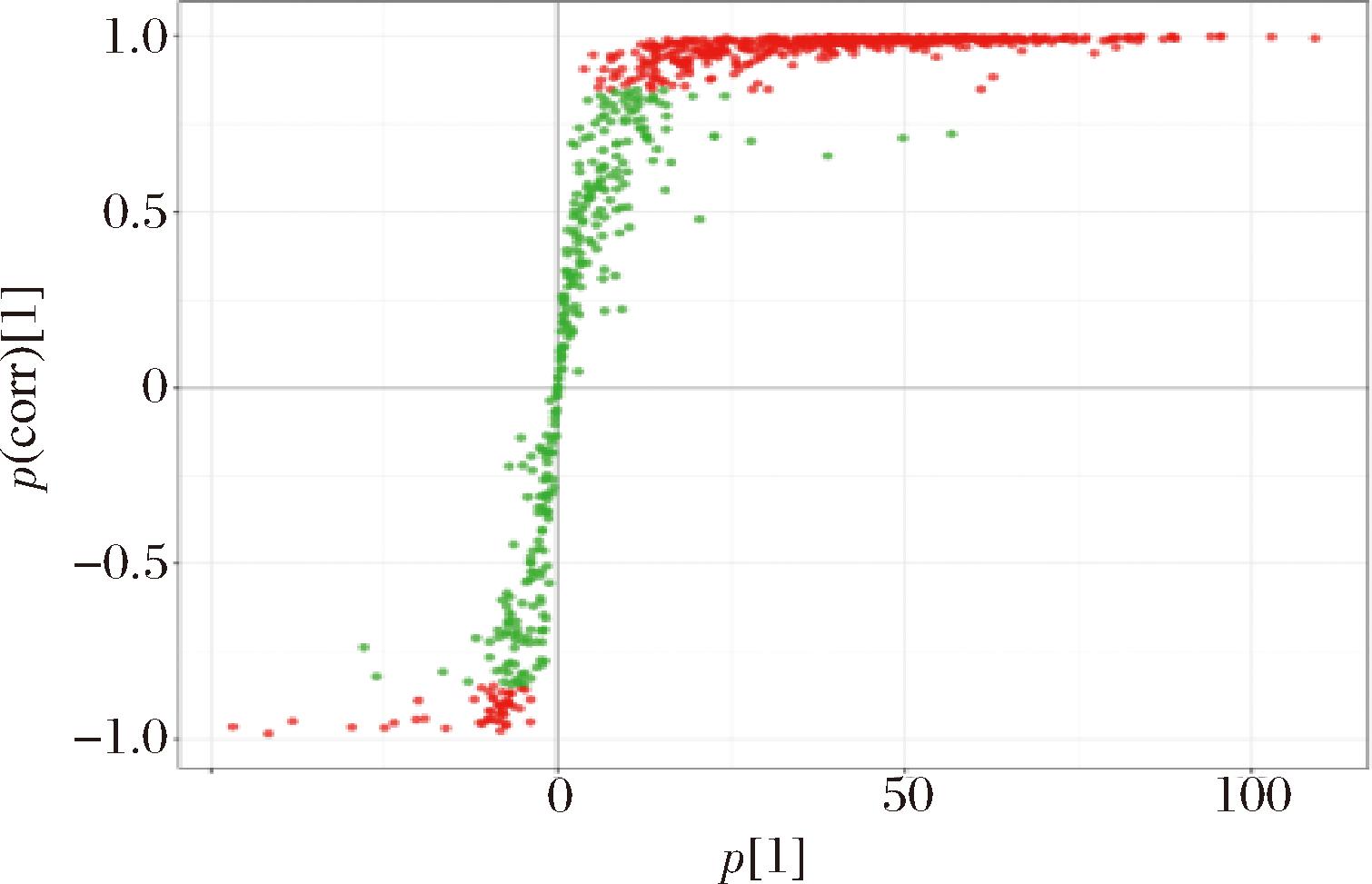
图4 正交偏最小二乘判别分析
Fig.4 OPLS-DA

图5 出发和诱变菌株中已鉴定代谢产物的热图
Fig.5 Heat map of identified metabolites in the parental and mutant srains
2.4.2 高温胁迫后马克斯克鲁维酵母胞内代谢通路富集
对高温胁迫后出发菌株与诱变菌株的差异代谢物进行KEGG功能富集分析(图6)。根据P<0.05为指标,对高温胁迫后富集的通路进行筛选(表1)。高温胁迫后,出发菌株与耐受菌株的生物标志物最显著的调节途径为:精氨酸和脯氨酸代谢,谷胱甘肽代谢,氨酰tRNA的生物合成,β-丙氨酸代谢,半胱氨酸和蛋氨酸代谢,甘油磷脂代谢,丙氨酸、天冬氨酸和谷氨酸代谢,嘌呤代谢。
表1 高温胁迫后样本差异代谢物的KEGG功能富集
Table 1 KEGG function enrichment of different compounds in samples after high temperature stress
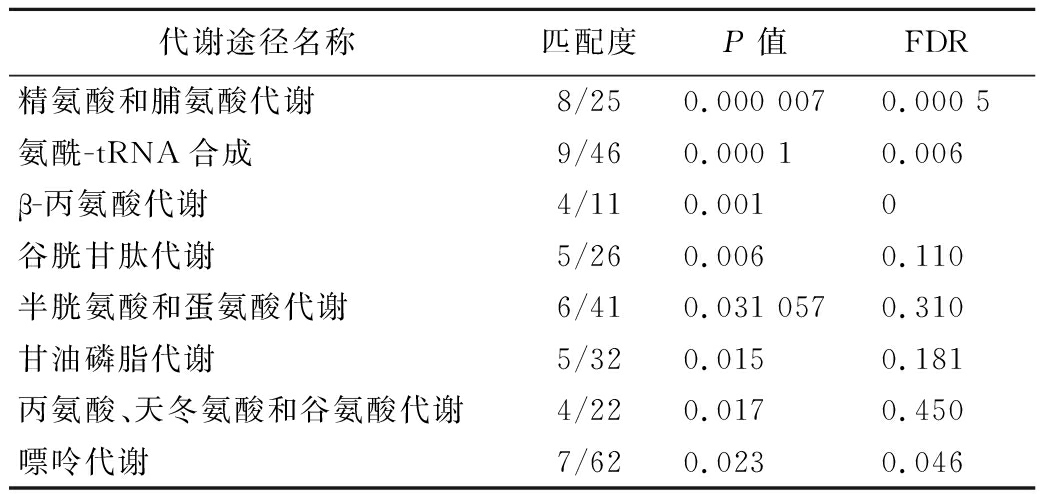
代谢途径名称匹配度P值 FDR精氨酸和脯氨酸代谢8/250.000 0070.000 5氨酰-tRNA合成9/460.000 10.006β-丙氨酸代谢4/110.0010谷胱甘肽代谢5/260.0060.110半胱氨酸和蛋氨酸代谢6/410.031 0570.310甘油磷脂代谢5/320.0150.181丙氨酸、天冬氨酸和谷氨酸代谢4/220.0170.450嘌呤代谢7/620.0230.046
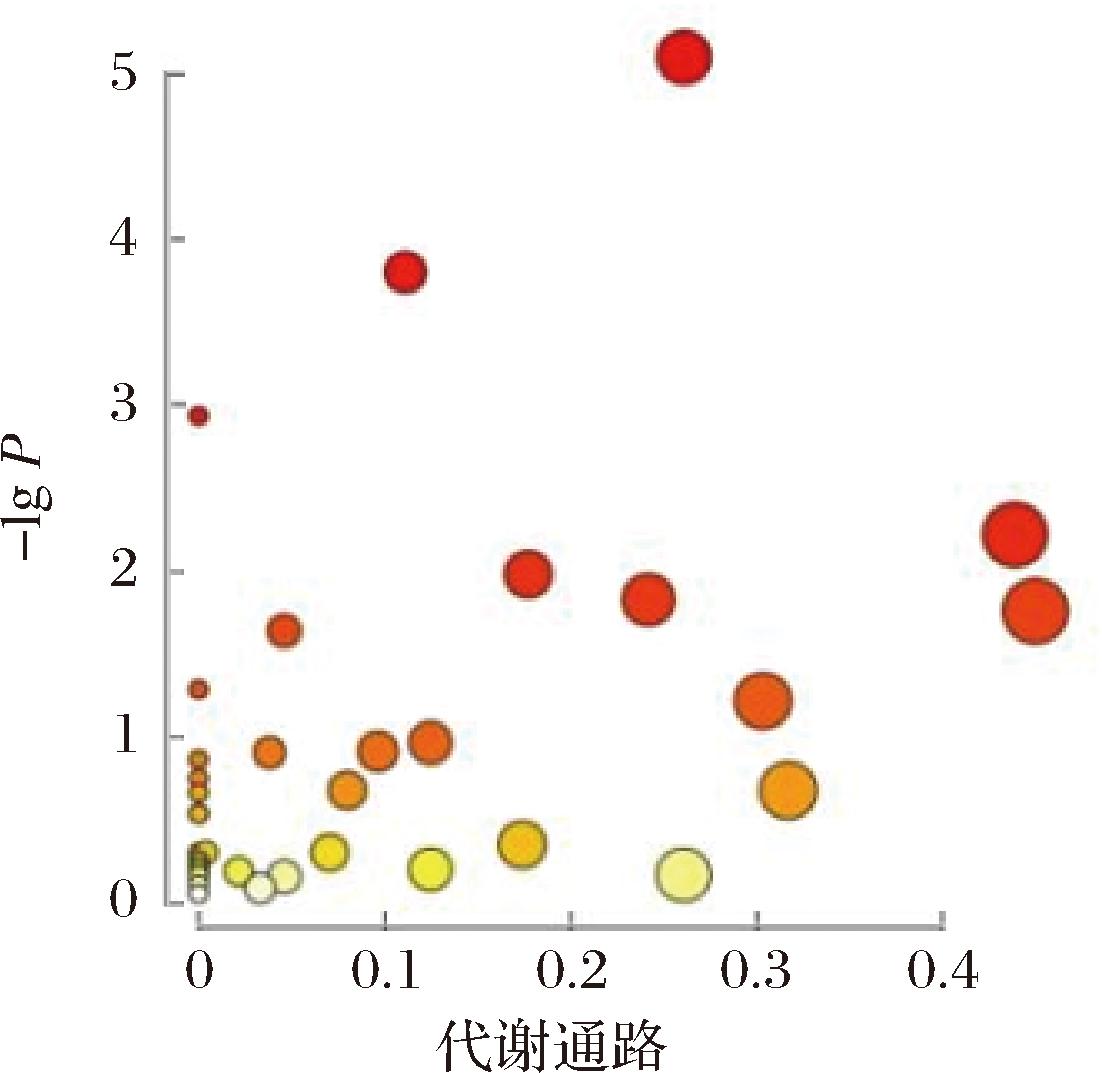
图6 出发和诱变菌株中已鉴定代谢物的KEGG富集分析
Fig.6 KEGG function enrichment of identified metabolites in the parental and mutant strains
2.4.3 高温胁迫对马克斯克鲁维酵母菌株代谢的影响
结合图7选取高温胁迫后P值较小的代谢通路进行分析。
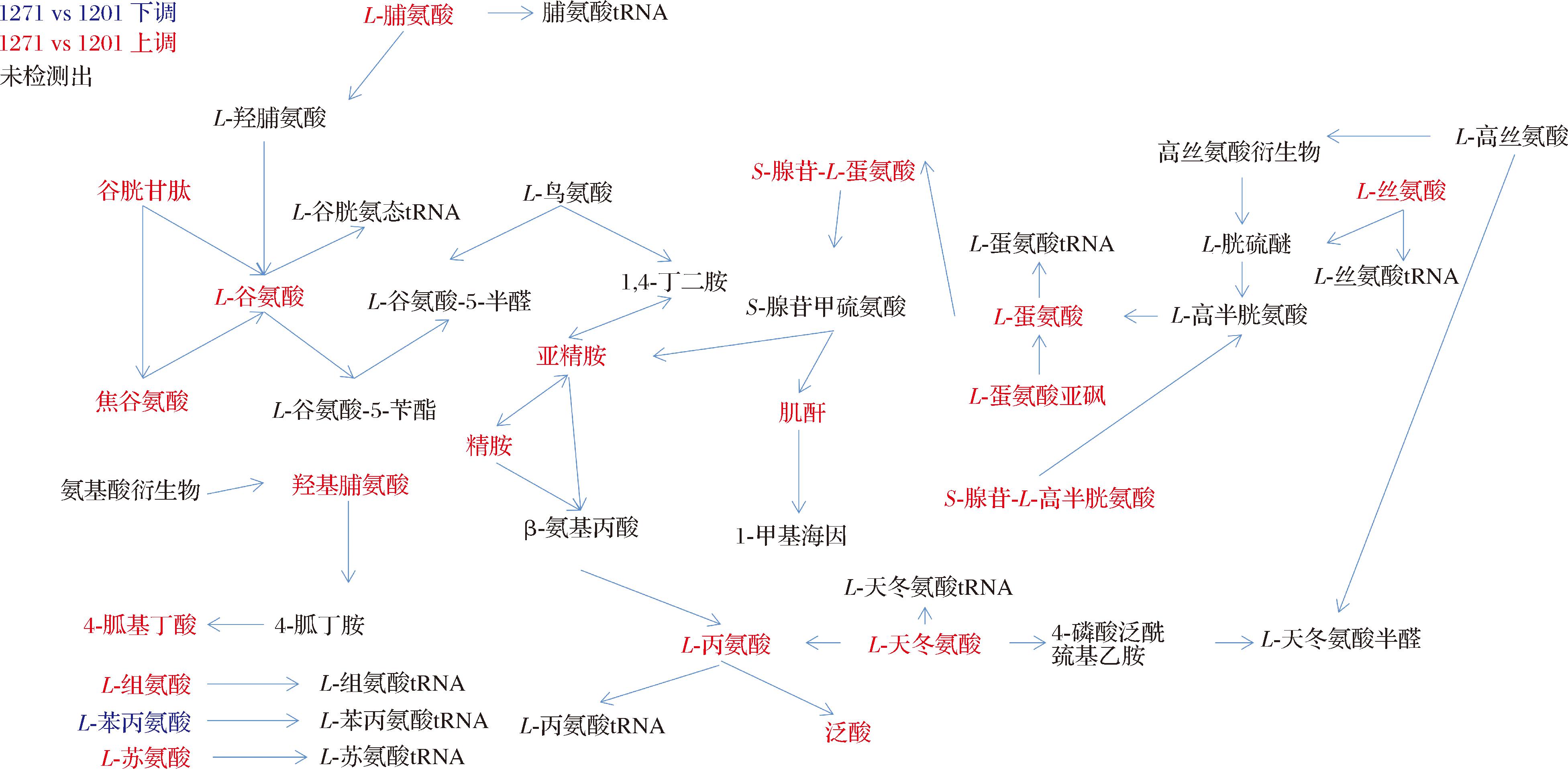
图7 样本差异代谢物显著富集的代谢通路图
Fig.7 Metabolic pathway map with significant enrichment of differentially compound in samples
注:红色、蓝色和黑色分别代表1271组与1201组相比明显增加、减少和无明显差异。
谷氨酸通过参与多种代谢通路为酵母提供能量[9],谷氨酸的增加表明诱变菌株能量代谢活跃,而充足的能量供应可能是细胞耐热性增强的基础。作为所有生物体数条代谢通路(精氨酸和脯氨酸代谢通路等)重要中间代谢物的S-腺苷半胱氨酸,活性一旦下降或被抑制,会极大的影响酵母中蛋白质、磷脂以及核酸等物质的正常代谢,1271中S-腺苷半胱氨酸的含量高达1201的100倍,可见S-腺苷半胱氨酸可能通过保障细胞代谢从而使菌株适应高温环境。精氨酸和脯氨酸在维持线粒体的正常功能方面具有重要地位[10],而1271中精氨酸和脯氨酸的含量分别是1201的18.2倍和4.7倍,这或许对诱变菌株高温耐受性更强起重要作用。
甘油磷脂和鞘脂都是细胞膜脂质的主要成分,甘油磷脂在酵母维持细胞膜的稳定性和流动性起到了重要作用[11],鞘脂主要是通过嵌入到细胞膜中,对维持细胞膜的完整性至关重要[12]。1271中的甘油磷酸胆碱含量高达1201的14.9倍。推测诱变菌株细胞膜完整性、通透性、流动性是其耐热性提高的重要原因。
高温胁迫能够诱导活性氧的积累[13],谷胱甘肽代谢可以避免细胞遭受重金属离子与活性氧(reactive oxygen species,ROS)的伤害[14],在本研究中,1271中谷胱甘肽含量为1201的3.4倍,且1271中多种谷胱甘肽代谢的中间体(谷氨酸、甘氨酸、羟脯氨酸等)含量均高于1201,进一步证实诱变菌株有更强的抗氧化能力。
作为酵母细胞的合成、分解代谢提供氧化还原载体和能量传递媒介的辅因子,可以强化线粒体的功能,调节细胞周期[15]。烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)及烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)广泛作为细胞内最重要的辅因子,直接参与细胞中糖类、脂肪和蛋白质三类物质的代谢,在酵母细胞中的新陈代谢起着至关重要的作用[16]。而泛酸是辅因子生物合成的重要前体物质[17],1271中泛酸的含量是1201的20倍,表明诱变菌株在高温胁迫时依然可以保持一定水平的酶促反应效率,这对酵母在应对高温胁迫时具有重要意义[18]。
酵母细胞中的多胺主要体现为腐胺、亚精胺、精胺等形式,大多通过参与DNA、RNA和蛋白质合成及稳定性调节、维持胞内pH稳定或作为氮源参与细胞生理活动[19]。1271中亚精胺、精胺的含量分别是1201的37和16.4倍。研究表明增强抗氧化酶系统活性,缓解高温胁迫对细胞的损害可以通过外源添加亚精胺来实现[20]。而抑制相关细胞凋亡mRNA转录进而减轻细胞凋亡[21],抑制真核反应起始因子2α(eukaryotic translation initiation factor,eIF2α)减轻内质网应激主要依靠精胺[22-23]。诱变菌株中多胺物质的积累是其高温耐受性提高的重要原因之一。
3 结论与讨论
高温SSF生产燃料乙醇对实现减少生产成本并提高生产经济效益起重要作用。以使发酵菌株耐高温高产乙醇为目标,以高产乙醇马克斯克鲁维酵母菌株GX-UN120为出发菌株,研究了ARTP诱变提升其高温耐受性的可行性。结果表明,ARTP技术对菌株GX-UN120高温耐受性的提升有效,诱变后获得一株能在48 ℃培养72 h OD600值达到1.27的诱变菌株GX-UN127。以100 g/L麸皮为底物,45 ℃下SSF 12 h乙醇产量为7.6 g/L,较出发菌株提升15.2%;48 ℃下SSF 24 h乙醇产量为2.2 g/L。
代谢组学分析推测半胱氨酸和蛋氨酸代谢,精氨酸和脯氨酸代谢,甘油磷脂代谢,谷胱甘肽代谢等代谢途径与诱变菌株的高温耐受性密切相关。本研究所得菌株为后续高温SSF生产燃料乙醇提供了基础,为探究马克斯克鲁维酵母耐热性代谢机制和马克思克鲁维酵母菌株的进一步改造提供了理论依据。
[1] FUERST R, WAGNER R P.An analysis of the free intracellular amino acids of certain strains of Neurospora[J].Archives of Biochemistry and Biophysics, 1957, 70(2):311-326.
[2] BENT K J, MORTON A G.Amino acid composition of fungi during development in submerged culture[J].Biochemical Journal, 1964, 92(2):260-269.
[3] NARRA M, MACWAN K, VYAS B, et al.A bio-refinery concept for production of bio-methane and bio-ethanol from nitric acid pre-treated corncob and recovery of a high value fuel from a waste stream[J].Renewable Energy, 2018, 127:1-10.
[4] 张雪, 张晓菲, 王立言, 等.常压室温等离子体生物诱变育种及其应用研究进展[J].化工学报, 2014,65(7):2676-2684.ZHANG X, ZHANG X F, WANG L Y, et al.Recent progress on atmospheric and room temperature plasma mutation breeding technology and its applications[J].CIESC Journal, 2014, 65(7):2676-2684.
[5] WANG L, LI B, WANG S P, et al.Improving multiple stress-tolerance of a flocculating industrial Saccharomyces cerevisiae strain by random mutagenesis and hybridization[J].Process Biochemistry, 2021, 102:275-285.
[6] 洪霞, 苟敏, 汤岳琴.基于常压室温等离子体诱变提高马克斯克鲁维酵母的乙醇耐受性[J].当代化工研究, 2022(24):60-63.HONG X, GOU M, TANG Y Q.ARTP mutagenesis to improve ethanol tolerance of Kluyveromyces marxianus[J].Modern Chemical Research, 2022(24):60-63.
[7] EDGARDO A, CAROLINA P, MANUEL R, et al.Selection of thermotolerant yeast strains Saccharomyces cerevisiae for bioethanol production[J].Enzyme and Microbial Technology, 2008, 43(2):120-123.
[8] 曾令杰, 丰丕雪, 黄锦翔, 等.基于非靶向代谢组学分析酿酒酵母甲酸胁迫的响应和耐受性机制[J].食品科学, 2022, 43(4):95-104.ZENG L J, FENG P X, HUANG J X, et al.Non-targeted metabolomic analysis of response and tolerance mechanism of Saccharomyces cerevisiae to formic acid stress[J].Food Science, 2022, 43(4):95-104.
[9] HAZELWOOD L A, DARAN J M, VAN MARIS A J A, et al.The Ehrlich pathway for fusel alcohol production:A century of research on Saccharomyces cerevisiae metabolism[J].Applied and Environmental Microbiology, 2008, 74(8):2259-2266.
[10] RAZA M F, WANG Y C, CAI Z H, et al.Gut microbiota promotes host resistance to low-temperature stress by stimulating its arginine and proline metabolism pathway in adult Bactrocera dorsalis[J].PLoS Pathogens, 2020, 16(4):e1008441.
[11] YAMASHITA A, HAYASHI Y, NEMOTO-SASAKI Y, et al.Acyltransferases and transacylases that determine the fatty acid composition of glycerolipids and the metabolism of bioactive lipid mediators in mammalian cells and model organisms[J].Progress in Lipid Research, 2014, 53:18-81.
[12] SEZGIN E, LEVENTAL I, MAYOR S, et al.The mystery of membrane organization:Composition, regulation and roles of lipid rafts[J].Nature Reviews Molecular Cell Biology, 2017, 18(6):361-374.
[13] YU H, HUANG Y Y, WANG P, et al.RNA interference (RNAi) of 2-Cys Prx gene enhances PSII photoinhibition but does not affect PSI activity in tobacco leaves under high-temperature stress[J].Journal of Plant Interactions, 2022, 17(1):873-883.
[14] SCHMACHT M, LORENZ E, SENZ M.Microbial production of glutathione[J].World Journal of Microbiology &Biotechnology, 2017, 33(6):106.
[15] WANG Y P, SAN K Y, BENNETT G N.Cofactor engineering for advancing chemical biotechnology[J].Current Opinion in Biotechnology, 2013, 24(6):994-999.
[16] 张姗姗, 王彦, 李德东, 等.NADH和NADPH代谢和功能的研究进展[J].第二军医大学学报, 2011, 32(11):1239-1243.ZHANG S S, WANG Y, LI D D, et al.Metabolism and function of NADH and NADPH[J].Academic Journal of Second Military Medical University, 2011, 32(11):1 239-1 243.
[17] SCOTT L N, FIUME M, BERGFELD W F, et al.Safety assessment of panthenol, pantothenic acid, and derivatives as used in cosmetics[J].International Journal of Toxicology, 2022, 41(3_suppl):77-128.
[18] OLZHAUSEN J, GRIGAT M, SEIFERT L, et al.Increased biosynthesis of acetyl-CoA in the yeast Saccharomyces cerevisiae by overexpression of a deregulated pantothenate kinase gene and engineering of the coenzyme A biosynthetic pathway[J].Applied Microbiology and Biotechnology, 2021, 105(19):7321-7337.
[19] 姚响文, 周密, 曹颖瑛, 等.多胺在微生物中的研究进展[J].中国真菌学杂志, 2014, 9(2):114-118.YAO X W, ZHOU M, CAO Y Y, et al.Recent progress of polyamines in microorganisms[J].Chinese Journal of Mycology, 2014, 9(2):114-118.
[20] 李书涵, 韩莹琰, 郝敬虹, 等.高温胁迫下外源亚精胺对生菜抗氧化酶系统的影响[J].北京农学院学报, 2020, 35(4):63-67.LI S H, HAN Y Y, HAO J H, et al.Effects of exogenous spermidine on antioxidant enzyme system of lettuce under high temperature stress[J].Journal of Beijing University of Agriculture, 2020, 35(4):63-67.
[21] LIU X M, YANG Z M, LIU X K.Fas/FasL induces myocardial cell apoptosis in myocardial ischemia-reperfusion rat model[J].European Review for Medical and Pharmacological Sciences, 2017, 21(12):2913-2918.
[22] WEI C, WANG Y H, LI M X, et al.Spermine inhibits endoplasmic reticulum stress-induced apoptosis:A new strategy to prevent cardiomyocyte apoptosis[J].Cellular Physiology and Biochemistry, 2016, 38(2):531-544.
[23] 赵苗, 韩雅茹, 贺翼飞, 等.PERK/eIF2α 信号通路在心肌保护中的研究进展[J].世界最新医学信息文摘, 2018, 18(A2):169-171.ZHAO M, HAN Y R, HE Y F, et al.Research progress of the PERK/eIF2α signaling pathway in myocardial protection[J].World Latest Medicine Information, 2018, 18(A2):169-171.