大豆分离蛋白(soy protein isolate, SPI)是一种高纯度的植物蛋白产品,通过溶解、分离、沉淀等工艺提取而成[1]。SPI具有乳化性和凝胶性,可用于制作肉制品的替代品,如豆制肉、素肉、豆腐等[2],也可用于制作乳制品的替代品,如豆奶、豆浆等[3]。大米粉(rice flour, RF)是将大米研磨成粉末状的食品原料,它是一种常见的面粉替代品,可以被用于制作米糕、米粥、糕点等食品,具有无麸质、营养丰富、胶凝性好等特点[4]。
蛋白凝胶是一种具备出色性能的材料,可以通过加热、酸碱调节和添加凝固剂等实现SPI的凝胶化反应,进而形成凝胶物质[5]。然而,SPI存在力学性能不佳、溶解性差等问题,限制了其在食品领域的应用[6]。加热适量水中的RF,同样可以形成凝胶状态[7]。将SPI和RF复合加热,可形成均匀且致密的凝胶结构[8]。复合后的凝胶使SPI蛋白质之间的非共价相互作用增强,导致分子内疏水区域显露,与此同时,RF中的淀粉分子链变得松散,水分子也更易渗透到淀粉颗粒内部导致淀粉膨胀,形成紧密有序的三维网络结构,从而形成复合凝胶[9]。在加热处理过程中,这种复合凝胶可以实现交联反应,并具有比单一凝胶更好的强度和韧性[10]。由SPI-RF复合凝胶制成的食品,其口感和质感因此得到提升[11]。
目前,对于SPI-RF复合凝胶的研究鲜有报道。本研究通过添加不同量的RF制备SPI-RF复合凝胶,研究胶凝特性及形成机理,考察其宏观、介观和微观结构。通过持水力评价SPI-RF复合凝胶的水分保持能力及RF对凝胶持水性能的影响;凝胶强度分析中,研究复合凝胶的质构特性,以了解其力学特性;利用红外光谱和荧光光谱技术进一步探究复合凝胶的结构特征,了解凝胶内分子的移动和排列方式,揭示RF与SPI之间的相互作用;利用分子对接研究RF与SPI之间的结合方式,通过计算和模拟,了解复合凝胶形成的机制;用原子力显微镜(atomic force microscope,AFM)观察复合凝胶的微观结构,提供凝胶表面的高分辨率图像,揭示凝胶的结构。本研究深入了解SPI-RF复合凝胶的胶凝机制,为进一步应用和优化该复合凝胶提供科学依据。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(蛋白质干基≥90%,水分≤7.0%,灰分≤6.0%),临沂山松生物制品有限公司;大米粉(大米淀粉≥75%,水分≤15%,蛋白质≤10%),北京金禾绿源商贸有限公司。
1.2 仪器与设备
TG16G型离心机,常州金坛精达仪器制造有限公司;FA2004B型电子天平,上海佑科仪器仪表有限公司;DZKW-D-1型电热恒温水浴锅,北京永光明医疗仪器厂;TA.XT Plus型物性分析仪,英国Stable Micro System公司;HYM-5280型快速黏度分析仪,上海沪粤明科学仪器有限公司;Dimension Lcon型原子力显微镜,美国布鲁克公司;Spec-trum100型傅里叶红外光谱仪,美国珀金埃尔默公司;FLS1000型稳态/瞬态荧光光谱仪,英国爱丁堡公司;DSC-3型差示扫描量热仪,瑞士梅特勒-托利多公司。
1.3 实验方法
1.3.1 黏度特性测定
参照GB/T 24853—2010《小麦、黑麦及其粉类和淀粉糊化特性测定》的方法,稍作修改。将0、1、2、3、4、5 g的RF分别和10 g的SPI混合好后称量4 g,RVA测试专用铝桶中加入25 mL的蒸馏水和样品,使用搅拌器搅拌均匀,进行测试。测试的流程:在50 ℃下加热1 min,再匀速加热225 s升温至90 ℃,最后升温到95 ℃时候持续150 s,再匀速降温225 s到50 ℃,并保持90 s后结束,起止转速分别设置为960、160 r/min。最后通过对数据处理得到复合凝胶的加热温度、黏度和回生值等黏度特性参数。
1.3.2 SPI-RF复合凝胶的制备
经黏度特性测定预实验,确定了SPI-RF复合凝胶的制备方法如下:烧杯中称取0、1、2、3、4、5 g的RF,使用玻璃棒分别与10 g的SPI搅拌干混后加入20 mL水,同时不断搅拌,直到形成均匀的混合物。将烧杯放入的水浴锅中70 ℃加热并进行持续搅拌330 s,使其充分胶凝化,直到形成复合凝胶,方可进行热凝胶特性的测定。将制备的凝胶分别命名为SPI 100%、SPI-RF 10%、SPI-RF 20%、SPI-RF 30%、SPI-RF 40%、SPI-RF 50%。
1.3.3 持水性测定
参照FOEGEDING等[12]方式,并进行改动。复合凝胶样品称量1 g放入10 mL的离心管中,离心机参数设置:4 500 r/min、15 min,离心完成后,吸出上层液体后称重。每个样品测试3次,取平均值。持水性的计算如公式(1)所示:
持水性![]()
(1)
式中:M为离心管质量,g;M1为离心前样品和离心管质量,g;M2为离心后样品和离心管质量,g。
1.3.4 凝胶强度的测定
将复合凝胶切成2 cm正方体,运用质构仪对复合凝胶的凝胶强度实验。探头选用P/0.5柱型探头;测试前、中、后速率是1 mm/s;形变为50%;触发力5 g。
1.3.5 热特性测定
样品取5 mg放置在测试专用的铝盒中,按料液比1∶2(g∶mL)加入蒸馏水,密封后于冰箱上层保存。以空铝盒作参照,进行热特性的测定。吹扫氮气50 mL/min,升温速率5 ℃/min,温度范围30~120 ℃。
1.3.6 红外光谱分析
复合凝胶样品取0.5 mg于玛瑙研钵中研磨成粉末,按1∶50(质量比)加入溴化钾粉末,混合均匀后制片,扫描波数范围为400~4 000 cm-1,选择1 600~1 700 cm-1的酰胺Ⅰ带对蛋白质二级结构进行分析。
1.3.7 荧光光谱分析
利用荧光光谱仪测定发射波长300~500 nm下的荧光光谱。激发波长280 nm,扫描速率600 nm/min,狭缝宽度5 nm。
1.3.8 荧光淬灭分析
通过Stern-Volmer方程如公式(2)所示,判断复合凝胶的猝灭类型:
(2)
式中:F0为未添加RF时的荧光强度,nm;F为添加RF时的荧光强度,nm;[Q]为淬灭剂的浓度,mol/L;Kq为双分子淬灭速率常数,L/(mol·s);τ0为未添加淬灭剂时荧光分子的平均荧光寿命,10-8 s。
1.3.9 分子对接
对NADA等[13]的方法稍作修改,使用Schrödinger (2021)的Glide模块进行分子对接。从PubChem(https://pubchem.ncbi.nlm.nih.gov/)网站获取RF的3D结构(SID:24836924)并使用Chem3D 20.0对其进行能量最小化。从蛋白质PDB数据库RCSB Protein Data Bank database (https://www.rcsb.org/)中获取7S (PDB ID:3AUP)的晶体结构,并使用Maestro 12.7的Protein Preparation模块对其进行加氢、除水以及能量最小化等预处理。将处理好的目标蛋白与配体导入Glide,探测活性位点并定义对接口袋,通过SP方法分子对接和筛选。根据计算的GlideScore记录最终的结合构象,使用PyMOL将结果可视化。
1.3.10 微观结构分析
将SPI-RF 40%复合凝胶切块处理后使用AFM观察复合凝胶表面形态结构并计算表面粗糙度等信息。参数设置:扫描范围:2.0 μm×2.0 μm、3.0 μm×3.0 μm、5.0 μm×5.0 μm,扫描频率0.8 Hz,微悬臂长235 μm,弹性参数12 N/m。
1.4 数据统计
所有实验重复3次,数据表示为平均值±标准差。使用SPSS 21对数据进行显著性分析(P<0.05)。使用Origin作图。
2 结果与分析
2.1 RF添加量对复合凝胶黏度特性的影响
使用快速黏度分析仪对样品的黏度特性测定,可以精确得出加热温度、峰值黏度、回生值等。SPI对照组和SPI-RF复合凝胶样品的黏度特性参数见表1。
表1 复合凝胶的黏度特性参数
Table 1 Viscosity characteristic parameters of composite gel
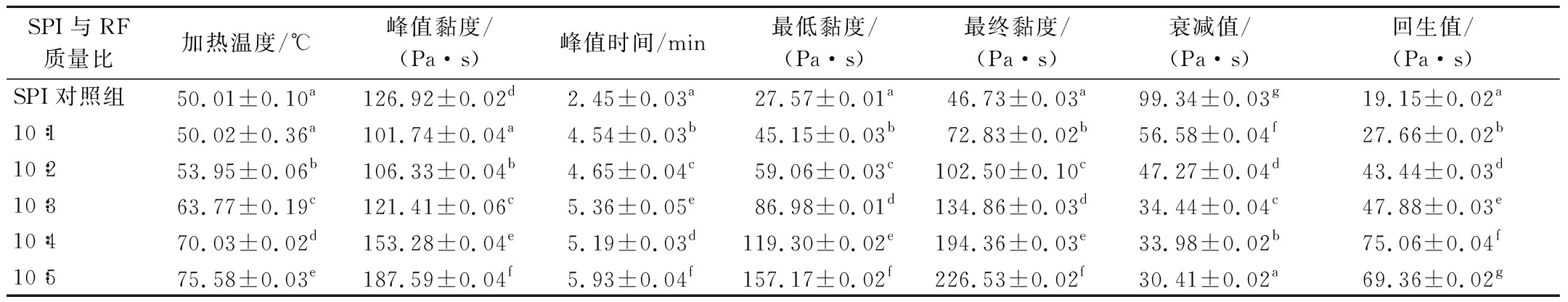
SPI与RF质量比加热温度/℃峰值黏度/(Pa·s)峰值时间/min最低黏度/(Pa·s)最终黏度/(Pa·s)衰减值/(Pa·s)回生值/(Pa·s)SPI对照组50.01±0.10a126.92±0.02d2.45±0.03a27.57±0.01a46.73±0.03a99.34±0.03g19.15±0.02a10∶150.02±0.36a101.74±0.04a4.54±0.03b45.15±0.03b72.83±0.02b56.58±0.04f27.66±0.02b10∶253.95±0.06b106.33±0.04b4.65±0.04c59.06±0.03c102.50±0.10c47.27±0.04d43.44±0.03d10∶363.77±0.19c121.41±0.06c5.36±0.05e86.98±0.01d134.86±0.03d34.44±0.04c47.88±0.03e10∶470.03±0.02d153.28±0.04e5.19±0.03d119.30±0.02e194.36±0.03e33.98±0.02b75.06±0.04f10∶575.58±0.03e187.59±0.04f5.93±0.04f157.17±0.02f226.53±0.02f30.41±0.02a69.36±0.02g
注:表中同一列数据不同上标字母代表差异显著(P<0.05)(下同)。
由表1可知,SPI对照组的加热温度为50.01 ℃,随着RF添加量的增加,复合凝胶的加热温度显著上升,峰值时间也显著延长(P<0.05)。SPI-RF样品在加热下大米淀粉颗粒膨胀使复合凝胶的黏度增加,相较于对照组黏度增加差异明显(P<0.05)。在RF添加量为4 g时回生值最高,达到75.06;RF添加量为5 g时黏度达到最大;RF与SPI交联后吸水膨胀,RF糊化更彻底的同时形成复合凝胶,也使复合凝胶的峰值黏度、最终黏度增加。这与TAO等[14]研究去除表面蛋白只保留大麦淀粉可使黏度特性增加的结果类似。同时,添加RF提高了复合凝胶的峰值黏度、耐热性并且衰减值降低,表明淀粉分子与蛋白发生相互作用,复合凝胶在加热条件下能够保持其凝胶网状结构的完整性和更稳定。
2.2 RF添加量对复合凝胶持水性的影响
对复合凝胶的持水性进行评价,以便更好地了解复合凝胶对水的吸附和结合能力,复合凝胶的持水性见表2。
表2 复合凝胶的持水性参数 单位:%
Table 2 Water-holding capacity parameters of composite gel
SPI 100%SPI-RF 10%SPI-RF 20%SPI-RF 30%SPI-RF 40%SPI-RF 50%61.67±0.02a73.67±0.03b74.00±0.02b81.00±0.04c87.33±0.03e86.67±0.02e
由表2可知,复合凝胶的持水性有一定的差异,SPI 100%的持水性最低,随着RF添加量的增加,复合凝胶样品持水性显著高于对照组(P<0.05),SPI-RF 40%的持水性最高(87.33±0.03)%。通过添加RF可以改变SPI单一凝胶的结构,使其形成更为致密的复合凝胶,并增强与水分子之间的作用力。因此,添加RF能够提高SPI凝胶的持水性,并形成更为紧密的复合凝胶网络,从而与更多的水结合。这与潘泓杉等[15]的研究结果一致,在SPI中添加金针菇多糖,提高了其水凝胶的持水性和稳定性。这也在一定程度上表明,在添加RF后,增强了复合凝胶对水的保留效果,提高了复合凝胶的稳定性和抗干扰能力。
2.3 RF添加量对复合凝胶强度的影响
SPI中添加RF形成复合凝胶对与植物基产品有较好的感官和质地是十分重要的。由表3可知,SPI-RF组的硬度、弹性、胶黏性、咀嚼性显著高于SPI对照组(P<0.05)。随着RF添加量的增加,SPI-RF复合凝胶的硬度、弹性、胶黏性和咀嚼性呈现先增加后减少的趋势。在RF添加量为40%时达到最大硬度(1 739.491 g)、弹性(0.230)、胶黏性(1 104.656)和咀嚼性(1 084.008),其复合凝胶结构达到最佳状态。SPI-RF 40%复合凝胶网络结构具有最佳的硬度和弹性,这是由于疏水作用下氢键作用力的增强所致。这与ZOU等[16]研究热处理后通过打浆、搅拌可以显著增强蛹虫草中蛋白质和多糖之间的相互作用,形成凝胶强度更强产品的结论相似。因此,与单独使用SPI形成的凝胶相比,SPI-RF复合凝胶具有更好的凝胶强度。可以推测,在植物基产品中添加RF会使口感得到改善。
表3 RF添加量对复合凝胶强度的影响
Table 3 Effect of RF addition on texture characteristics of composite gel
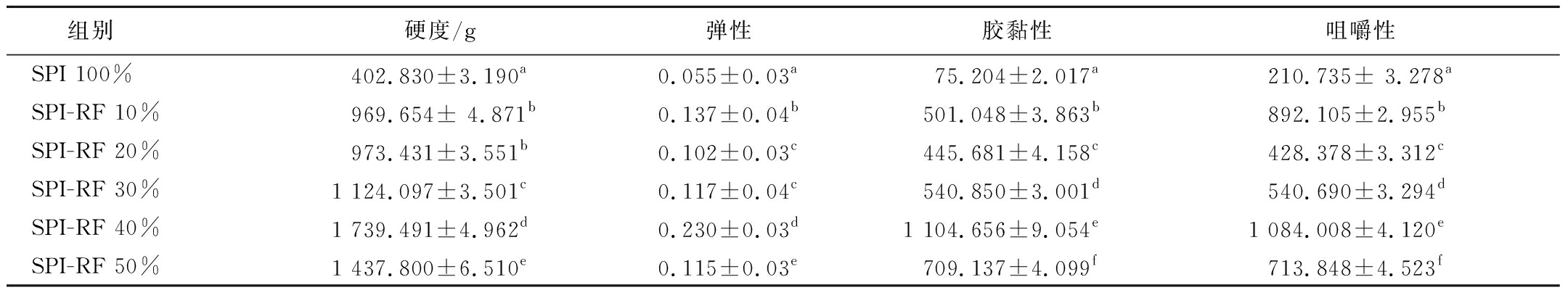
组别 硬度/g弹性胶黏性咀嚼性SPI 100%402.830±3.190a0.055±0.03a75.204±2.017a210.735± 3.278aSPI-RF 10%969.654± 4.871b0.137±0.04b501.048±3.863b892.105±2.955bSPI-RF 20%973.431±3.551b0.102±0.03c445.681±4.158c428.378±3.312cSPI-RF 30%1 124.097±3.501c0.117±0.04c540.850±3.001d540.690±3.294dSPI-RF 40%1 739.491±4.962d0.230±0.03d1 104.656±9.054e1 084.008±4.120eSPI-RF 50%1 437.800±6.510e0.115±0.03e709.137±4.099f713.848±4.523f
2.4 RF添加量对复合凝胶热特性的影响
通过差示扫描量热仪探究复合凝胶吸热峰、起止温度和时间对其耐热性和相变温度的影响,结果如图1 所示。
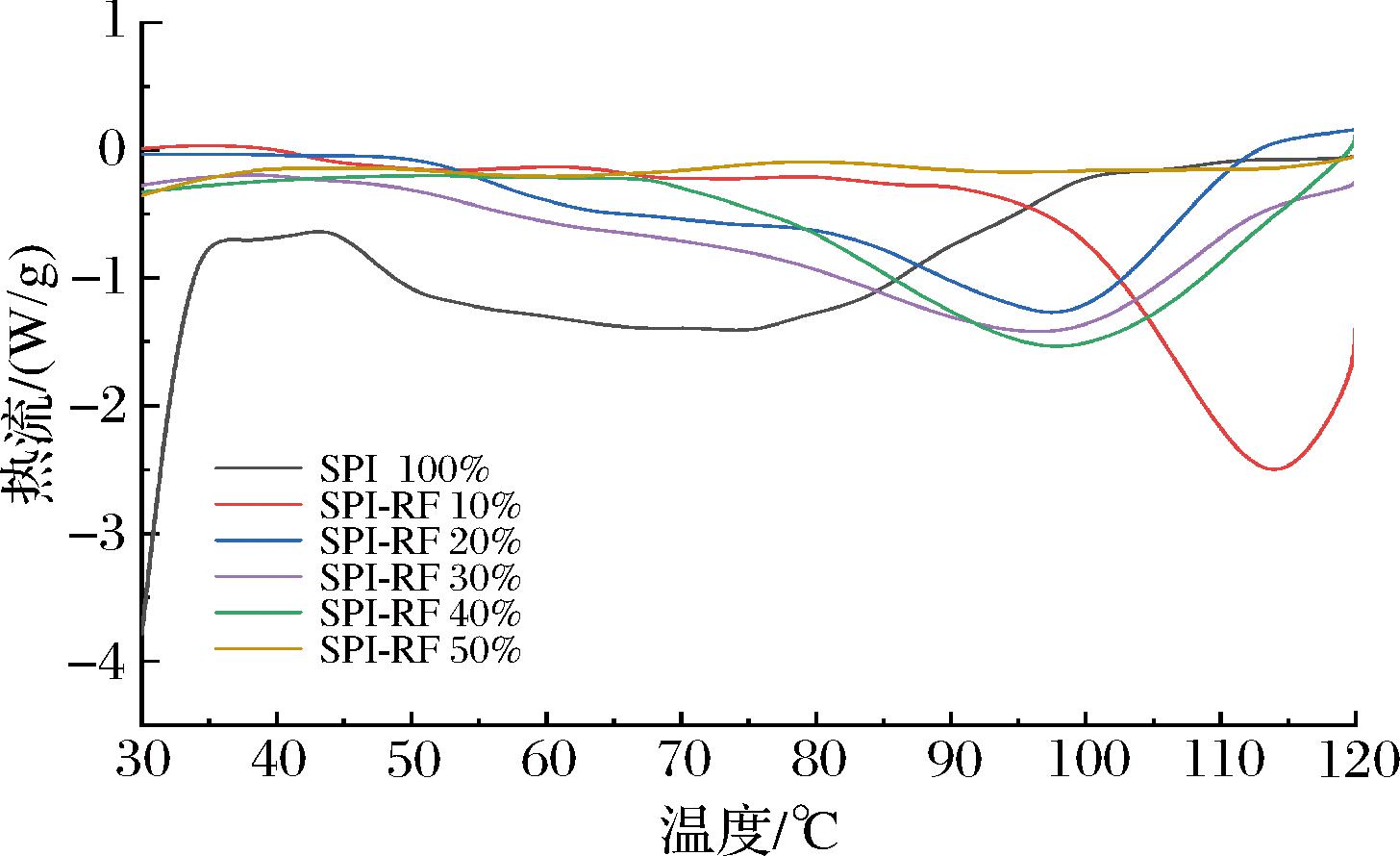
图1 RF添加量对复合凝胶热特性的影响
Fig.1 Effect of RF addition on thermal characteristics of composite gel
由图1可知,样品SPI 100%中出现2个特征峰,在较低加热温度时,SPI吸热的同时蛋白质发生聚集形成SPI凝胶,在100 ℃以上时蛋白质发生热解;其他添加RF的样品均出现了一个短程有序的螺旋结构解旋形成的典型吸热峰。因此,RF的添加提高了SPI凝胶的耐热性,相变温度升高,使其在高温条件下更加稳定。样品SPI-RF 50%无明显吸热峰,可能还没有达到相变温度。SPI-RF 40%中SPI变性形成的交联网状结构妨碍了RF颗粒吸水发生相变,同时交联后可能引入交联键增加分子的束缚力,因此,SPI和RF需要更多的能量以发生相变使其形成更稳定和结构更紧密的复合凝胶[17]。样品SPI-RF 10%、SPI-RF 20%、SPI-RF 30%变化规律相似,随着RF添加量的增加吸热峰面积变大,与复合凝胶的黏度分析的峰值时间的延长相互验证。分子间的作用对SPI相变的焓值产生了影响。同时,添加RF能够显著提升SPI凝胶的耐热性和热稳定性。此外,SPI与RF分子之间形成的氢键和疏水作用减少了RF热相变所需的热量,促使它们更紧密地结合在一起。
2.5 RF添加量对复合凝胶二级结构的影响
用红外光谱分析不同RF添加量下SPI分子间的结构和分子内作用力的变化,通过不同波段复合凝胶吸收峰的等图谱信息进行分析,并通过分峰拟合对蛋白质二级结构进一步分析。复合凝胶红外图谱结果如图2所示,二级结构含量值见表4。

图2 RF添加量对复合凝胶的红外谱图
Fig.2 FTIR spectrum of composite gel tripe at addition amount of RF
表4 RF添加量对复合凝胶的二级结构的影响 单位:%
Table 4 Effects of addition amount RF on secondary structure of composite gel

二级结构 SPI 100%SPI-RF 10%SPI-RF 20%SPI-RF 30%SPI-RF 40%SPI-RF 50%β-折叠32.5331.0332.6332.3735.2438.28β-转角13.0515.9016.4615.7717.8916.20α-螺旋24.0022.3522.8224.0724.4219.71无规则卷曲30.4226.5128.0927.7926.6625.81
如图2所示,对复合凝胶相关的官能团进行分析。SPI 100%的红外光谱图中,3 258 cm-1处是N—H和O—H的伸缩振动吸收峰,1 625 cm-1处是酰胺Ⅰ带(—CO—NH—)吸收峰,1 538 cm-1处是酰胺Ⅱ带(N—H弯曲振动和C—N伸缩振动)吸收峰,1 241 cm-1处是酰胺Ⅲ带(C—O)吸收峰,C—H的面内弯曲振动吸收峰在1 058 cm-1。5种复合凝胶的红外峰的位置大致一致,在交联中没有显著的新官能团生成。与SPI 100%相比,复合凝胶样品的N—H和O—H的伸缩振动吸收峰从3 258 cm-1移动到3 266 cm-1,2 930 cm-1处是C—H的伸缩振动吸收峰。酰胺Ⅰ带(—CO—NH—)吸收峰从1 625 cm-1移动到1 640 cm-1,酰胺 Ⅱ 带(N—H)吸收峰从1 538 cm-1移动到1 533 cm-1,说明蛋白质二级结构发生了变化,可能与RF通过疏水作用与SPI的基团结合,也从3 258~3 266 cm-1的蓝移得到证实。这与ZHAO等[18]对大豆分离蛋白和甜菜色素的红外图谱分析中得到相似的结果。1 241 cm-1处是酰胺Ⅲ带(C—O)吸收峰,1 150 cm-1处是淀粉的C—O和C—C的伸缩振动吸收峰,1 077 cm-1处是C—H的弯曲振动吸收峰,1 012 cm-1处是C—O键的伸缩振动吸收峰和C—OH的弯曲振动吸收峰,930 cm-1处的吸收峰归属为淀粉的非对称环模式[α-1,4糖苷键(C—O—C)]的骨架振动;857 cm-1附近吸收峰归属为C—H摇摆吸收峰;570 cm-1附近的吸收峰归属为淀粉的骨架模式振动[19]。因此,在复合凝胶结构中可以看出SPI与RF的作用力主要通过氢键和疏水作用相结合。
酰胺Ⅰ带(1 600~1 700 cm-1)是能灵敏表达多种结构蛋白质与多肽振荡频率变化规律的特征谱带,经常被用来解析蛋白质的二级结构。利用Peakfit软件将这段谱带进行分峰模型拟合,拟合后根据各子峰的面积计算出蛋白质二级结构含量。解卷积过程显示酰胺Ⅰ带由许多子峰组成。通过计算子峰的面积,定量评估了对复合凝胶二级结构的复合效应。由表4可知,与SPI 100%相比,SPI-RF 50%的β-折叠结构含量增加了5.76%,α-螺旋结构含量减少了4.29%。同时,无规则卷曲结构含量减少,β-转角结构含量增加。这表明分子内的氢键是维持蛋白质二级结构的主要作用力。在SPI中添加RF并经过加热处理后形成的复合凝胶导致了α-螺旋的展开,形成了β-折叠结构。其中,SPI-50%的β-折叠含量最高,提高了复合凝胶的强度和持水性,有利于形成稳定的凝胶结构。同时,α-螺旋的含量降低促进了SPI结构的展开,使疏水基团暴露,增加了表面的疏水性,说明在二级结构高度有序的肽链中,破坏α-螺旋所需的能量较少[20]。因此,这也可能是导致复合凝胶强度和持水性优于SPI 100%的原因之一。
2.6 RF添加量对复合凝胶三级结构的影响
利用荧光光谱仪对复合凝胶的结构进行分析,通过三级结构进一步对复合凝胶进行探究。复合凝胶的二维荧光图谱结果如图3所示。

图3 RF添加量对复合凝胶的荧光谱图
Fig.3 Addition of RF affects the fluorescence spectrum of the composite gel
在280 nm的紫外线照射下,蛋白质中芳香族氨基酸残基会产生明显的荧光,色氨酸的荧光强度最大。如图3所示,SPI的最大荧光发射波长(λmax)约为359 nm,均大于330 nm,这表明SPI中的色氨酸处于极性微环境中[21]。当RF添加到SPI中时,SPI-RF 50%时的凝胶荧光强度最小,随着RF添加量的增加,荧光强度明显下降,并伴有蓝移[22]。总的来说,通过添加RF和热处理改变了复合凝胶的三级结构,随着体系中RF浓度的增加,SPI的荧光强度明显下降(P<0.05),并且最大波长(λmax)呈现先红移再蓝移(P<0.05)趋势。这些现象表明,在RF添加量为10%~40%时,SPI和RF之间存在相互作用。随着RF添加量的增加,蛋白质分子中的色氨酸残基向疏水环境转移,当RF添加量增至50%时,出现明显的蓝移。这可能是由于RF添加过量,使色氨酸残基向亲水环境转移[23]。此外,蛋白质构象发生变化,导致复合凝胶的荧光光谱也会受到影响,包括荧光强度的改变[24]。
2.7 复合凝胶的荧光淬灭分析
通过荧光光谱研究SPI与RF的相互作用,并提供结合作用的详细信息,结果如图4所示。

图4 复合凝胶的Stern-Volmer图
Fig.4 Stern-Volmer diagram of composite gel
为确定SPI与RF之间的相互作用机制,采用Stern-Volmer方程对荧光光谱结果进行线性拟合并得出Ksv=1.15×105 L/mol,Kq=1.15×1013 L/(mol·s),R2=0.97;RF的浓度与F0/F之间有很强的线性关系(R2>0.96)。Kq的值远高于最大扩散碰撞淬灭常数2.0×1010 L/(mol·s)[25],表明RF诱导SPI产生的荧光淬灭为静态淬灭[26]。
2.8 复合凝胶的可视化分析
分子对接是一种可视化小分子与蛋白质相互作用的结合力、结合位点和结合能的新型研究手段。图5是复合凝胶的最佳对接结果。

a-分子对接局部图;b-分子对接2D图;c-分子对接整体图
图5 分子对接结果
Fig.5 molecular docking diagrams
蛋白质的结合位点实际上是疏水性氨基酸组成的活性口袋,选取得分1.091分的最佳结合位点进行对接。SPI与RF的对接得分为-5.85,结合能为4.790 kJ/mol,主要相互作用力为氢键。如图5-b所示,SPI活性口袋中,SER315、ARG329、SER331、GLY332、GLU333、ASP334、SER383、SER386通过氢键与RF结合。
这说明复合凝胶氢键和疏水作用具有更好的结合活性和稳定性,使得疏水性的残基或分子相互靠近,减少其与水分子的接触,从而调节凝胶网络孔隙的大小。这与YE等[27]研究的通过芦丁和SPI以疏水作用力相结合的结果相似。由此推断,RF和SPI的相互作用主要是由于氢键和疏水作用引起的,参与氢键反应,氢键相互作用与疏水相互作用为凝胶生成的主要作用力。复合凝胶分子间更紧密的结合在一起,从而增加稳定性、黏性和黏度,即增强了复合凝胶的凝胶网络结构。
2.9 复合凝胶的微观结构
采用AFM观察复合凝胶的微观形貌,并通过Gwyddion软件进行图像处理并计算表面粗糙度,结果如图6所示。

a-2.0 μm×2.0 μm 3D图像;b-3.0 μm×3.0 μm 3D图像;c-5.0 μm×5.0 μm 3D图像
图6 复合凝胶微观结构的AFM图像
Fig.6 AFM images of microstructure of composite gel
图6为复合凝胶的三维立体微观结构。在3D立体图上可以观察到,复合凝胶表面有2种不同形态的结构,并且有不同的高度值。观察到图6-a、图6-b有较为明显的条带状结构,表面高度为60~120.0 nm、107.5~215.0 nm,细链条多呈现出无规则的弯曲状态,具有一定的韧性。图6观察到RF中的淀粉分子堆积聚集形成的点状结构,RF起到黏性补丁的作用。可以推测出淀粉分子单条链、蛋白质和淀粉分子多条链通过相互作用形成具有螺旋结构的复合体,这与张红运等[28]观察到的大豆种皮多糖构象有相似之处。因此,在加热状态下复合凝胶多条链由无序变成有序的螺旋状态、点状结构,由此形成三维凝胶网状结构。
3 结论与讨论
本研究证明了添加RF可以显著提高SPI胶凝特性。相较于单一的SPI凝胶,RF能够增强SPI的凝胶强度,提高SPI凝胶的稳定性,并形成新的三维复合凝胶网状结构。通过黏度分析和热特性分析可得出,SPI-RF 50%复合凝胶的黏度达到最大值。持水力和质构分析研究则表明,RF的添加显著提高了复合凝胶的持水力,SPI-RF 40%的凝胶强度最佳。红外光谱和荧光光谱的研究显示,RF的添加导致了α-螺旋和β-转角向β-折叠发生转变,改变了SPI凝胶的网状结构;致密复合凝胶网络的形成,主要受到氢键和疏水作用的影响。通过AFM对复合凝胶进行观察,发现凝胶中不仅存在多条链通过相互作用形成具有螺旋结构的复合体,还有淀粉分子堆积聚集形成的点状结构。分子对接分析了RF和SPI结合的可能构象,结果发现它们之间存在许多氢键结合位点和疏水作用,促进了复合凝胶的形成。本研究为SPI-RF复合凝胶的开发利用提供了一定的理论基础。
[1] SCHREUDERS F K G, DEKKERS B L, BODN R I, et al.Comparing structuring potential of pea and soy protein with gluten for meat analogue preparation[J].Journal of Food Engineering, 2019, 261:32-39.
R I, et al.Comparing structuring potential of pea and soy protein with gluten for meat analogue preparation[J].Journal of Food Engineering, 2019, 261:32-39.
[2] KERSLAKE E, KEMPER J A, CONROY D.What′s your beef with meat substitutes? Exploring barriers and facilitators for meat substitutes in omnivores, vegetarians, and vegans[J].Appetite, 2022, 170:105864.
[3] ESTELL M, HUGHES J, GRAFENAUER S.Plant protein and plant-based meat alternatives:Consumer and nutrition professional attitudes and perceptions[J].Sustainability, 2021, 13(3):1478.
[4] CHEN Q L, ZHANG J C, ZHANG Y J, et al.Rheological properties of pea protein isolate-amylose/amylopectin mixtures and the application in the high-moisture extruded meat substitutes[J].Food Hydrocolloids, 2021, 117:106732.
[5] BI C H, LI D, WANG L J, et al.Effect of LBG on the gel properties of acid-induced SPI gels[J].LWT, 2017, 75:1-8.
[6] JUNG A H, HWANG J H, JUN S, et al.Application of ohmic cooking to produce a soy protein-based meat analogue[J].LWT, 2022, 160:113271.
[7] 周凤超,林国荣,汪秀妹,等.改性马铃薯淀粉对肌原纤维蛋白凝胶特性的影响[J].食品科学,2020,41(4):86-95.
[8] CHOI H W, RYOO C, HAHN J, et al.Development of a novel technology for high-moisture textured soy protein using a vacuum packaging and pressurized heat (vacuum-autoclaving) treatment[J].Food Chemistry, 2023, 399: 133887.
[9] HU T, ZHANG Z, HU H, et al.A comprehensive study on self-assembly and gelation of C13-dipeptides-from design strategies to functionalities[J].Biomacromolecules, 2020, 21(2):670-679.
[10] PALANISAMY M, TÖPFL S, AGANOVIC K, et al.Influence of iota carrageenan addition on the properties of Soya protein meat analogues[J].LWT, 2018, 87:546-552.
[11] YANG C H, ZHONG F, DOUGLAS GOFF H, et al.Study on starch-protein interactions and their effects on physicochemical and digestible properties of the blends[J].Food Chemistry, 2019, 280:51-58.
[12] FOEGEDING E A.Functional properties of turkey salt-soluble proteins[J].Journal of Food Science, 1987, 52(6):1495-1499.
[13] NADA H, LEE K, GOTINA L, et al.Identification of novel discoidin domain receptor 1 (DDR1) inhibitors using E-pharmacophore modeling, structure-based virtual screening, molecular dynamics simulation and MM-GBSA approaches[J].Computers in Biology and Medicine, 2022, 142:105217.
[14] TAO H, LU F, ZHU X F, et al.Removing surface proteins promote the retrogradation of wheat starch[J].Food Hydrocolloids, 2021, 113:106437.
[15] 潘泓杉, 马高兴, 裴斐, 等.金针菇多糖对大豆分离蛋白凝胶的增强作用及其结构表征[J].食品科学, 2022, 43(20):102-108.PAN H S, MA G X, PEI F, et al.Enhancing effect of Flammulina velutipes polysaccharide on gelation properties of soybean protein isolate and structural characterization of mixed gels[J].Food Science, 2022, 43(20):102-108.
[16] ZOU Y, YU X Y, ZHENG Q W, et al.Effect of beating process on the physicochemical and textural properties of meat analogs prepared with Cordyceps militaris fruiting body[J].International Journal of Food Engineering, 2022, 18(2):153-160.
[17] XING J J, LI D, WANG L J, et al.Relationship between biphasic endotherms and multi-stage gelatinization of corn starch in excess water[J].LWT-Food Science and Technology, 2017, 81:335-342.
[18] ZHAO H S, MA Z, JING P.Interaction of soy protein isolate fibrils with betalain from red beetroots:Morphology, spectroscopic characteristics and thermal stability[J].Food Research International, 2020, 135:109289.
[19] 费贵强, 谢萍浩, 王海花, 等.磺酸盐型高分子表面活性剂的制备及性能研究[J].应用化工, 2020, 49(1):114-119.FEI G Q, XIE P H, WANG H H, et al.Preparation and properties of sulfonate high polymer surfactants[J].Applied Chemical Industry, 2020, 49(1):114-119.
[20] RUSSELL P L.Gelatinisation of starches of different amylose/amylopectin content.A study by differential scanning calorimetry[J].Journal of Cereal Science, 1987, 6(2):133-145.
[21] VIVIAN J T, CALLIS P R.Mechanisms of tryptophan fluorescence shifts in proteins[J].Biophysical Journal, 2001, 80(5):2093-2109.
[22] DING F, BORREGUERO J M, BULDYREY S V, et al.Mechanism for the α-helix to β-hairpin transition[J].Proteins:Structure, Function, and Bioinformatics, 2003, 53(2):220-228.
[23] CUI Z M, KONG X Z, CHEN Y M, et al.Effects of rutin incorporation on the physical and oxidative stability of soy protein-stabilized emulsions[J].Food Hydrocolloids, 2014, 41:1-9.
[24] 赵钜阳, 袁惠萍, 姚恒喆, 等.pH值对儿茶素-大豆分离蛋白复合物结构与乳化性的影响[J].食品科学技术学报, 2023, 41(3):127-138.ZHAO J Y, YUAN H P, YAO H Z, et al.Effects of pH on structure and emulsibility of catechin-soy protein isolate complex[J].Journal of Food Science and Technology, 2023, 41(3):127-138.
[25] 关曼. 壳聚糖/大豆分离蛋白复合膜的制备、性能及应用[D].上海:上海海洋大学, 2016.GUAN M.Preparation, properties and application of chitosan/soy protein isolate composite membrane[D].Shanghai:Shanghai Ocean University, 2016.
[26] 陈兴. 槲皮素-食品乳液体系的构建及其生物可利用性[D].南昌:南昌大学, 2020.CHEN X.Fabrication and bioavailability of quercetin-food emulsion systems[D].Nanchang:Nanchang University, 2020.
[27] YE J P, DENG L P, WANG Y R, et al.Impact of rutin on the foaming properties of soybean protein:Formation and characterization of flavonoid-protein complexes[J].Food Chemistry, 2021, 362:130238.
[28] 张红运, 杨立娜, 朱丹实, 等.基于原子力显微图像和流变学特性的大豆种皮多糖构象分析[J].中国食品学报, 2020, 20(9):38-46.ZHANG H Y, YANG L N, ZHU D S, et al.Conformational analysis of polysaccharide from soybean hull based on atomic force microscope and rheological properties[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(9):38-46.