近年来随着人们环保意识的增强以及出于对食品质量安全的考虑,安全无毒且可生物降解的食品包装材料越来越受到关注[1]。胶原蛋白是动物体内含量最多的蛋白质,约占总蛋白质含量的1/3,主要存在于皮肤、肌腱及骨骼等部位中[2]。目前商业化生产的胶原蛋白肽大多是可溶性胶原蛋白肽,它们是通过酶解动物皮肤或骨骼的方法得到,具有优良的胶体保护性、表面活性、成膜性和稳定性[3]。胶原蛋白肽可在特定条件下进行体内自组装,形成有序且结构稳定的胶原蛋白纤维网络结构,极大提高热稳定性和机械性能,因此可广泛应用于生物材料、成膜基质和缓释制剂中[4]。但是,胶原蛋白肽成膜后机械性能、抑菌效果较差,且对湿度敏感。为改善这些缺点,常用化学、物理、酶法等方法对胶原蛋白进行改性处理,或加入其他高分子聚合物(如蛋白质、多糖、淀粉、纤维素等)来提高其复合材料性能[5-6]。
纤维素来源广泛,是自然界中最易获取的天然高分子[7]。纤维素通过化学、物理、生物手段处理可得到直径小于100 nm,长度可到微米的纳米纤维素(cellulose nanocrystals,CNC)[8]。由于其优异的特性,如丰度、高纵横比、更好的机械性能、可再生性和生物相容性,可作为增强复合材料应用到药物载体、纸浆造纸、包装等领域[9-10]。刘忠明等[11]将CNC添加到壳聚糖膜中,当复合膜中CNC质量分数为5%时,纳米纤维素-壳聚糖(CNC-chitosan,CNC-CS)的拉伸强度比纯CS膜提高了30%,CNC-CS的透湿量比纯CS膜降低了24%。然而,CNC并不具有抑菌性,为了解决这一问题,通常会在CNC复合材料中加入具有广谱效力、耐热性和耐久性等优点的无机抗菌剂[12]。纳米银(Ag NPs)是天然无机抗菌剂,对革兰氏阳性和革兰氏阴性菌都有较好的抑制作用,但Ag NPs制备时易发生团聚,降低其抑菌活性[13]。通常将Ag NPs负载到CNC上,降低团聚,可实现持久稳定抑菌[14]。
然而,以载银纳米纤维素(Ag/CNC)强化自组装胶原蛋白复合膜罕有报道。本研究以胶原蛋白肽为基材,Ag NPs为抑菌剂,CNC为增强剂,旨在制备一种新型的纳米复合膜,为牛皮胶原蛋白肽的利用提供一种新途径。
1 材料与方法
1.1 材料与试剂
牛皮胶原蛋白肽,广州东姿生物科技有限公司;微晶纤维素、过硫酸铵、聚乙烯吡咯烷酮、抗坏血酸,上海源叶生物科技有限公司;AgNO3,国药集团化学试剂有限公司。所用试剂均为分析纯级。
1.2 仪器与设备
PHS-3C电子分析天平,沃特世有限公司;CMT-8102微机控制电子万能试验机,深圳市新三思材料检测有限公司;JSM-7800F扫描电子显微镜,日本电子株式会社捷欧陆科技有限公司;FTIR-650傅里叶变换红外光谱仪,天津港东科技发展股份有限公司;ULTIMA IV X射线衍射仪,日本理学公司。
1.3 Ag/CNC的制备
1.3.1 CNC制备
参考WANG等[15]的方法略作修改,称取5.00 g的微晶纤维素,按1∶100加入现配的1.0 mol/L过硫酸铵溶液,在室温放置3 h,然后在70 ℃水浴条件下持续搅拌反应14 h;待溶液冷却,将溶液在6 000 r/min下离心10 min,重复离心洗涤直至上清液开始泛蓝光,收集上清液并将悬浮液倒入透析袋(12 000~14 000)中,在去离子水中放置6 d,直至内外pH值保持不变。取出悬浮液超声30 min,制得分散均匀稳定的泛蓝光CNC悬浮液。将一部分CNC悬浮液浓缩备用,另一部分冻干储存于干燥器中用以后续的检测表征。
1.3.2 Ag/CNC的制备
参考樊丽[16]的方法并略作修改,称取一定量的AgNO3,溶于蒸馏水中,制得0.1 mol/L的AgNO3水溶液,避光保存备用。向50.00 mL 1.0%(质量分数)的CNC悬浮液中加入0.30 g聚乙烯吡咯烷酮,加入NaOH溶液,调整溶液的pH值至8.0,加入3.00 g的抗坏血酸,迅速升温至80 ℃,在转速为250 r/min条件下滴加定量的AgNO3溶液,继续反应3 h,得到含银CNC溶液。
1.3.3 紫外可见光谱分析
参考YU等[17]的方法略做修改,量取2 mL的悬浮液于小试管用20 mL去离子水稀释至一定浓度,将该溶液放在超声波装置中超声30 min,之后量取一定分散后的溶液和纯水空白组置于石英比色皿中,紫外扫描波长范围200~800 nm。
1.3.4 透射电子显微镜分析
参考DONG等[18]的方法并略作修改,将Ag/CNC悬浮液分散于无水乙醇中并进行超声处理,吸取一滴Ag/CNC悬浮液涂在铜网上并让水蒸发,制备Ag/CNC的透射电子显微镜样品。在80 kV的电压运行下进行观察。
1.4 复合膜的制备
1.4.1 制膜工艺流程
称取6 g牛皮胶原蛋白肽溶于30 mL水中,向其中加入一定量的NaCl,调节溶液pH值。在一定温度下水浴加热1 h,再加入一定量的CNC和25%(以牛皮胶原蛋白肽质量计)的甘油,搅拌加热0.5 h。将膜液静置消泡后流延于PE塑料平板中(13 cm×13 cm),置于45 ℃电热恒温培养箱中干燥24 h,揭膜,存放于干燥器中。
1.4.2 单因素试验
设置反应NaCl添加量为5%(以牛皮胶原蛋白肽质量计,下同),溶液pH值为7,水浴温度40 ℃,CNC添加量分别为1%、2%、3%、4%、5%;设置CNC添加量为3%,溶液pH值为7,水浴温度40 ℃,NaCl添加量分别为1%、3%、5%、7%、9%;设置NaCl添加量为5%,水浴温度40 ℃,CNC添加量为5%,溶液pH值分别为5、6、7、8、9;设置NaCl添加量为5%,CNC添加量为5%,溶液pH值为7,水浴温度分别为20、30、40、50、60 ℃。
1.4.3 响应面试验
使用Design-Expert.12 进行响应面试验设计,探究pH、反应温度、CNC和NaCl的添加量对CNC-胶原蛋白复合膜拉伸强度的影响。
1.5 复合膜性能测定
1.5.1 机械性能
参考GB/T 1040.1—2018《塑料 拉伸性能的测定第1部分:总则》和GB/T 1040.3—2006《塑料 拉伸性能的测定 第3部分:薄膜和薄片的试验条件》。将所有待测复合膜裁剪成150 mm×20 mm,测试参数:实际测量长度70 mm,测试速率200 mm/min。拉伸强度计算如公式(1)所示,断裂伸长率如公式(2)所示:
(1)
(2)
式中:T,拉伸强度,MPa;F,样品膜断裂时的负荷,N;h,样品膜厚度,mm;b,样品膜宽度,mm;E,断裂伸长率,%;L1,样品膜测量初始标距,mm;L2,样品膜断裂时的标距,mm。
1.5.2 不透明度
参照SOLTANI等[19]方法。将所有待测复合膜裁剪成100 mm×40 mm,测试参数:Abs=600。不透明度的计算如公式(3)所示:
样品膜不透明度![]()
(3)
式中:Abs600,样品膜在600 nm处的吸光度;d,样品膜的厚度,mm。
1.5.3 水蒸气透过系数
参考GB/T 1037—2021《塑料薄膜与薄片水蒸气透过性能测定 杯式增重与减重法》并稍作修改。在室温下,将样品膜覆盖在装有20 mL蒸馏水的锥形瓶上,置于干燥器中,每3 h称重1次,直到相邻测量之间的质量差不超过5%。样品膜的水蒸气透过系数的计算如公式(4)所示:
样品膜水蒸气透过系数![]()
(4)
式中:Δm,锥形瓶前后质量变化,g;d,样品膜厚度,mm;A,样品膜面积,m2;Δt,时间间隔,h;Δp,样品膜两侧水蒸气气压差,2.915 kPa,25 ℃。
1.6 复合膜结构表征
1.6.1 傅立叶变换红外光谱分析
参考ZHANG等[20]的方法并略有改进,测定参数:波段范围400~4 000 cm-1,分辨率2 cm-1。
1.6.2 扫描电镜分析
参考赵喜亚等[21]的方法,测定参数:喷金时间30 s,平面放大倍数×2 000,截面放大倍数×200。
1.6.3 X-射线衍射分析
参考张昊等[22]的方法。将所有待测复合膜裁剪成20 mm×20 mm,测试参数:铜靶,扫描速度为5 °/min,扫描范围5~90 °,管内电流为40 mA,管内压力为40 kV。
1.7 数据分析
利用Origin 2018、Design-Expert 12、SPSS进行数据处理,使用方差分析(ANOVA)对结果进行显著性分析,试验数据以“平均值±标准差”表示。
2 结果与分析
2.1 Ag/CNC性能表征
2.1.1 Ag/CNC紫外光谱分析
图1为Ag/CNC中Ag NPs粒子理论质量占CNC不同质量分数的紫外光谱图。Ag NPs粒子在420 nm左右有一特征吸收峰,由图1可知,当m(Ag)/m(CNC)=2%,吸收峰强度较低,且半峰宽较宽,表明CNC表面吸附的银纳米粒子较少,且粒径分布较广。当m(Ag)/m(CNC)=6%,吸收峰最大吸收波长位于404 nm,发生明显蓝移,且半峰宽变窄,表明Ag NPs粒子粒径减小,且粒径分布更为集中。因为对于金属胶体,其特征吸收峰半峰宽越窄,说明粒子粒径分布范围越小。当m(Ag)/m(CNC)=8%,吸收峰最大吸收波长位于446 nm,发生明显红移,且半峰宽变宽,说明Ag NPs粒子发生团聚,使粒径增大[23]。

图1 Ag/CNC紫外光谱图
Fig.1 UV spectra of silver-loaded nanocellulose
2.1.2 Ag/CNC透射电镜分析
由图2-a可知,所制备CNC粒径大概在100~200 nm,呈短棒状。m(Ag)/m(CNC)=4%,Ag NPs粒子直径在15~50 nm,且分布不均匀。m(Ag)/m(CNC)=6%,Ag NPs粒子直径在25 nm左右,且粒径分布均匀。m(Ag)/m(CNC)=8%,Ag NPs粒子发生一定团聚,直径在50~100 nm,且分布不均匀。这与紫外光谱研究结果相一致。
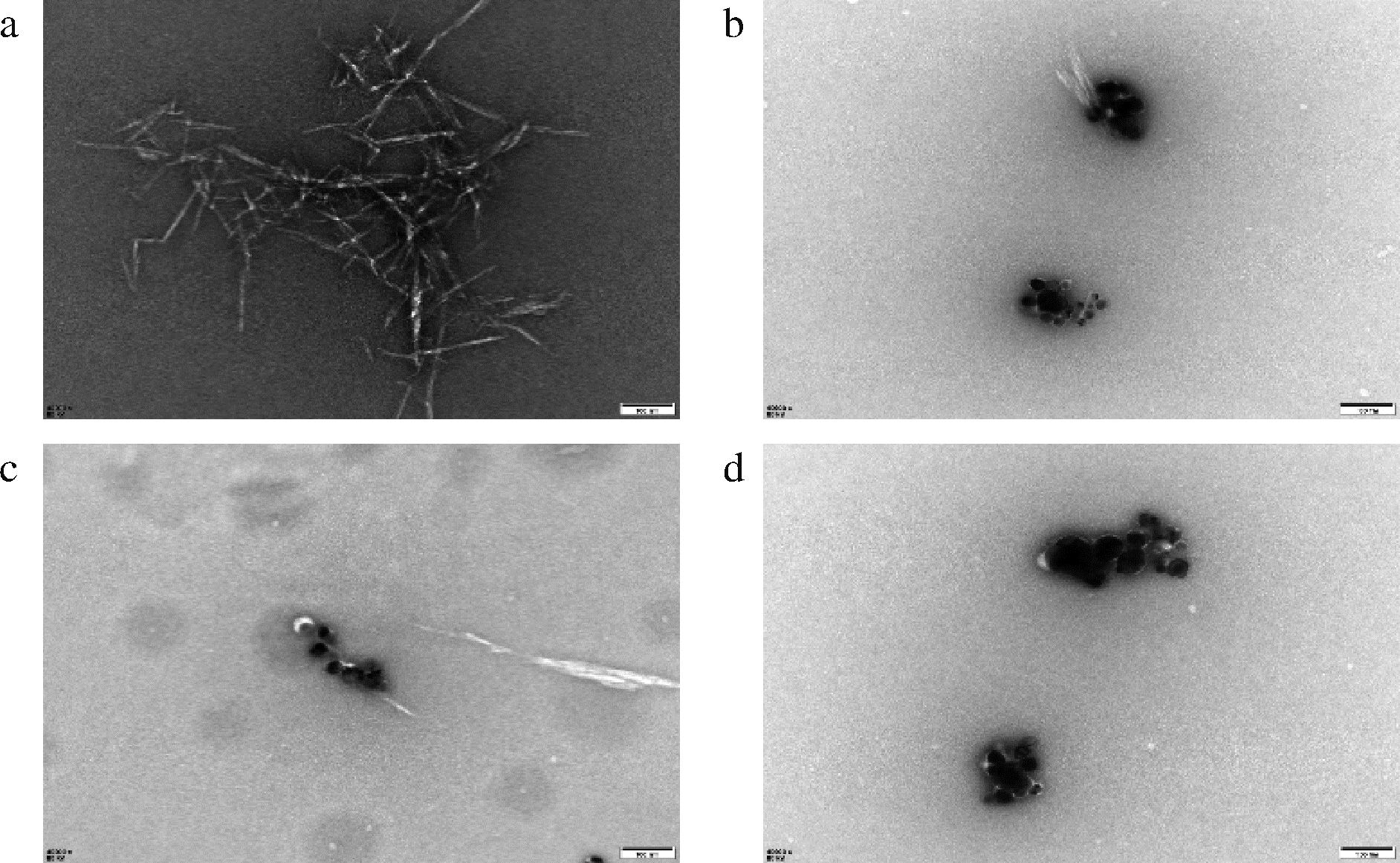
a-CNC透射电镜图;b~d-m(Ag)/m(CNC)=4%~8%的Ag/CNC的透射电子显微镜图
图2 Ag/CNC透射电子显微镜图
Fig.2 Transmission electron micrograph of silver-loaded nanocellulose
2.2 单因素试验
2.2.1 CNC添加量
由图3可知,当CNC添加量为3%时,复合膜拉伸强度最大,为11.97 MPa,断裂伸长率为68.58%。随CNC添加量持续增大,拉伸强度开始降低。这可能是因为CNC与胶原蛋白发生相互作用从而增强整体的网络结构,但过多的加入并不能持续增强膜的拉伸强度,可能归因于CNC的团聚产生了应力集中点[24]。综上,选择CNC添加量为3%。
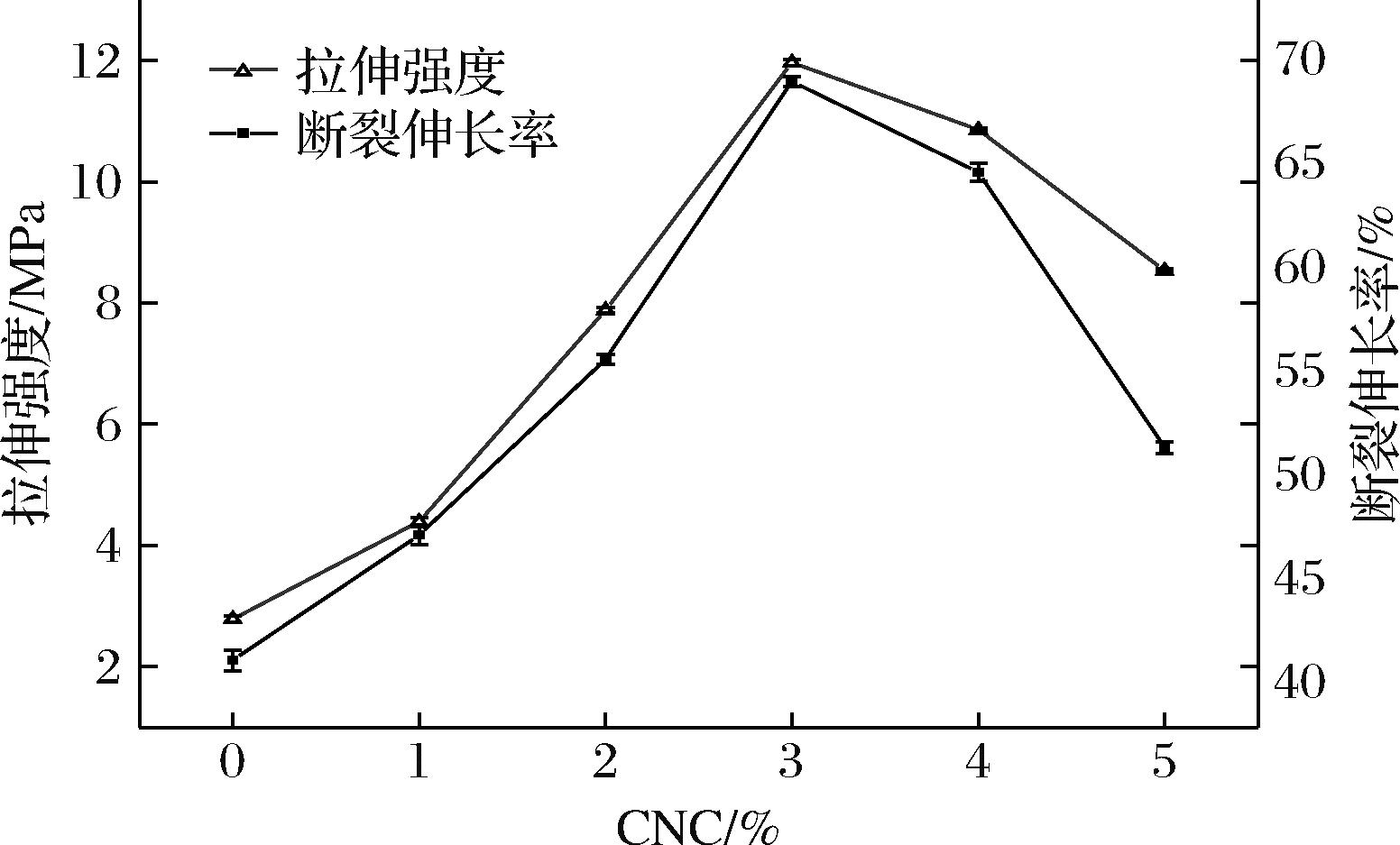
图3 CNC添加量对复合膜拉伸强度和断裂伸长率的影响
Fig.3 Effect of nanocellulose additions on tensile strength and elongation at break of composite films
2.2.2 NaCl添加量
由图4可知,当NaCl添加量为5%时,复合膜拉伸强度最大,为11.98 MPa,断裂伸长率为68.76%。随NaCl添加量的持续增大,拉伸强度开始降低。这可能是因为适量Na+强度在胶原蛋白肽自组装过程中起到屏蔽电荷作用,使得胶原蛋白肽自组装结合成为紧密的纤维,但过度的Na+加入会入引入了静电斥力,静电斥力阻隔了胶原蛋白肽分子之间进一步谛合,从而形成较为松散的胶原蛋白肽凝胶结构,因此复合膜机械性能降低[25]。综上,选择NaCl添加量为5%。
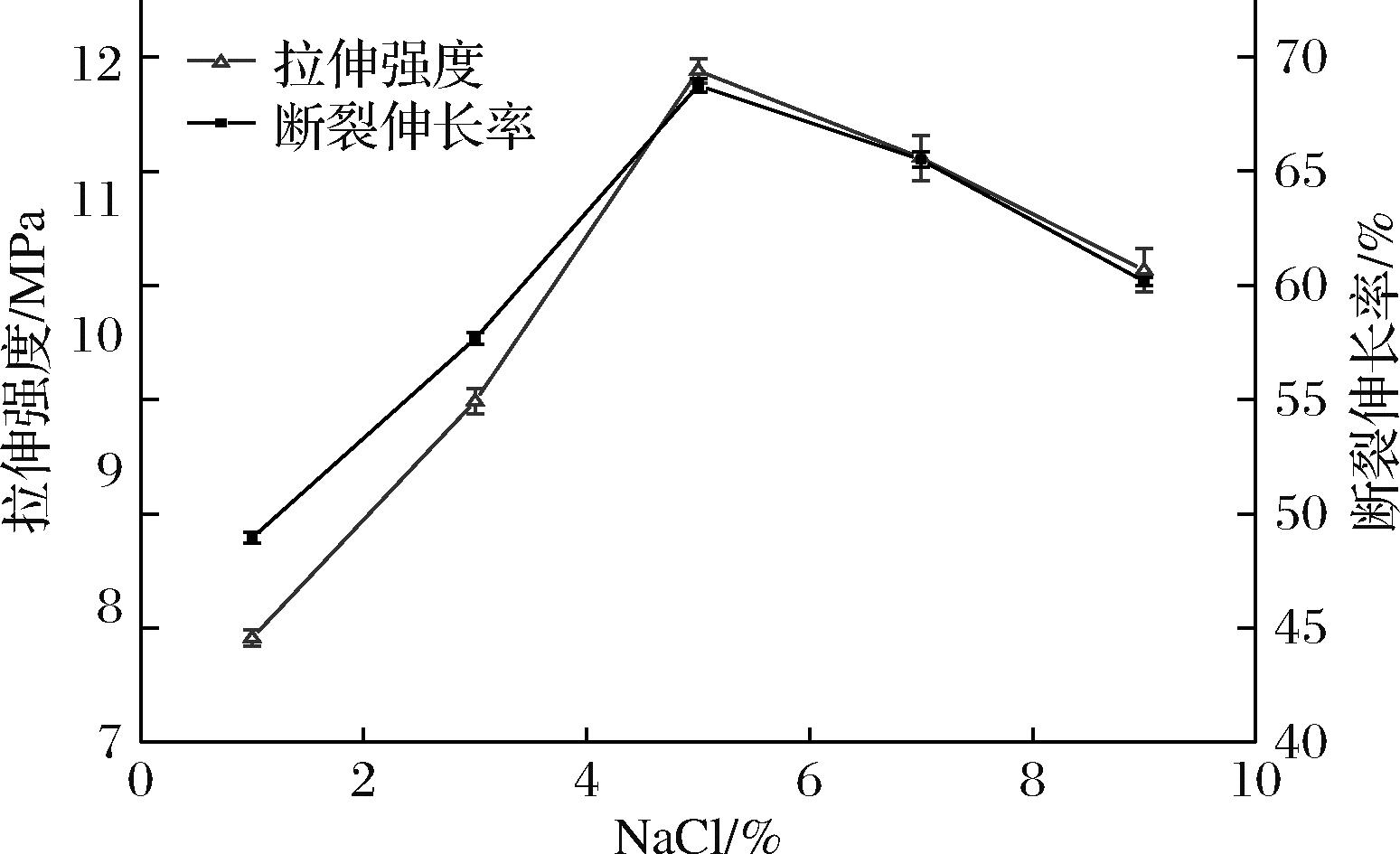
图4 NaCl添加量对复合膜拉伸强度和断裂伸长率的影响
Fig.4 Effect of NaCl addition on tensile strength and elongation at break of composite film
2.2.3 溶液pH
由图5可知,当溶液pH值为7时,复合膜拉伸强度最大,为11.85 MPa,断裂伸长率为67.98%。表明过酸或过碱的条件下都不利于牛皮胶原蛋白肽自组装的进行,说明牛皮胶原蛋白肽的等电点在7左右,由于胶原蛋白肽在等电点附近所带电荷趋向于零,使得胶原分子端肽的电荷达到最大程度的屏蔽,胶原肽分子之间的排斥力最弱,更容易使牛皮胶原蛋白肽发生自组装[26],因此复合膜机械性能最佳。综上,选择溶液pH值为7。
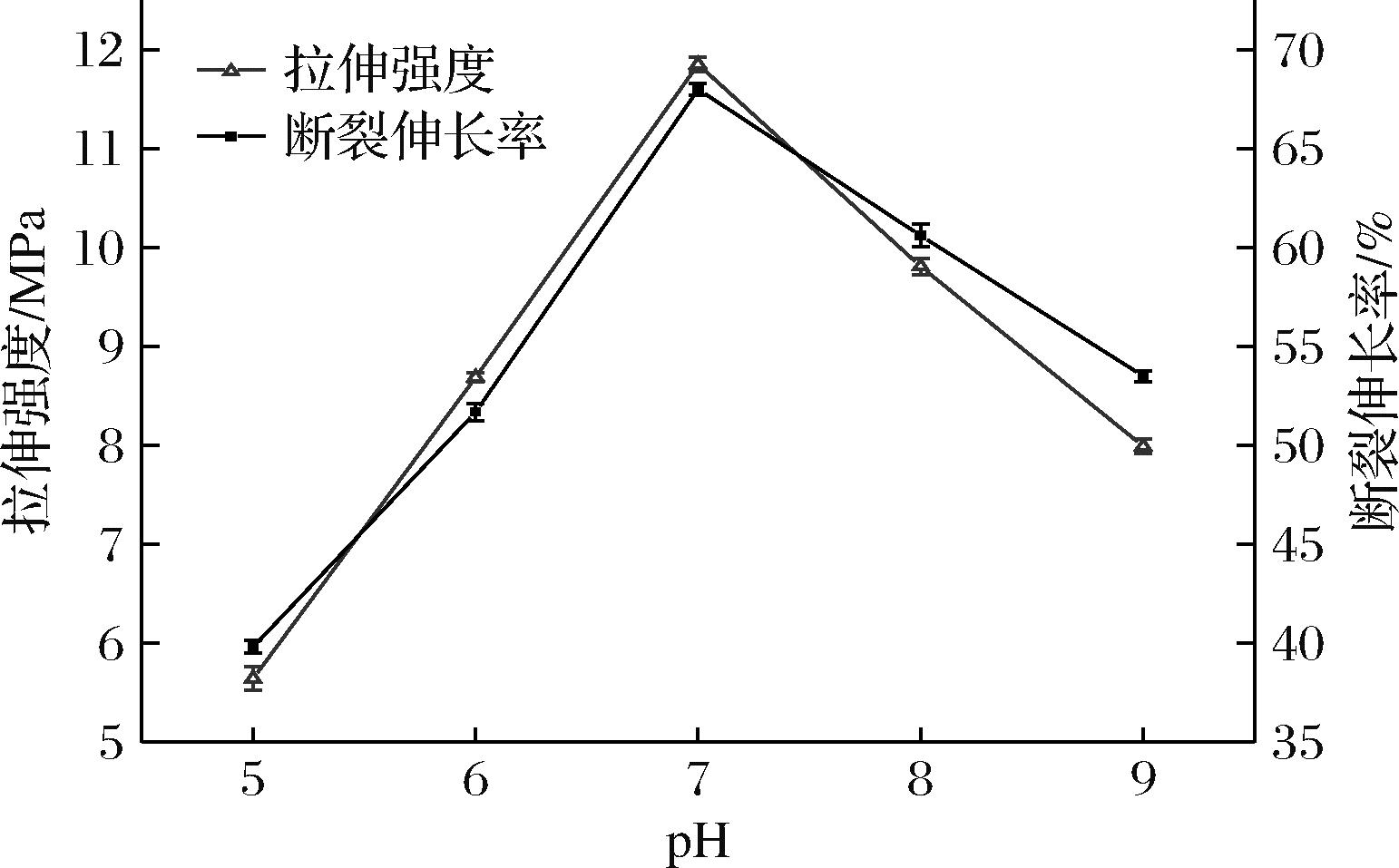
图5 pH对复合膜拉伸强度和断裂伸长率的影响
Fig.5 Effect of pH on tensile strength and elongation at break of composite films
2.2.4 温度
由图6可知,当温度为40 ℃时,复合膜拉伸强度最大,为12.28 MPa,断裂伸长率为68.02%。然而,随后复合膜的机械强度随处理温度的提高反而降低。这可能是因为适宜的温度条件可以增强胶原肽分子的运动能力,使其突破水合层,有助于纤维间氢键、二硫键等次级结构的进一步形成,提高组装效率的同时,还能提高结构的紧密性,而温度过低不利于与胶原组装体的形成,过高的温度则会使纤维崩解,因此复合膜机械性能降低[27]。综上,选择处理温度为40 ℃。
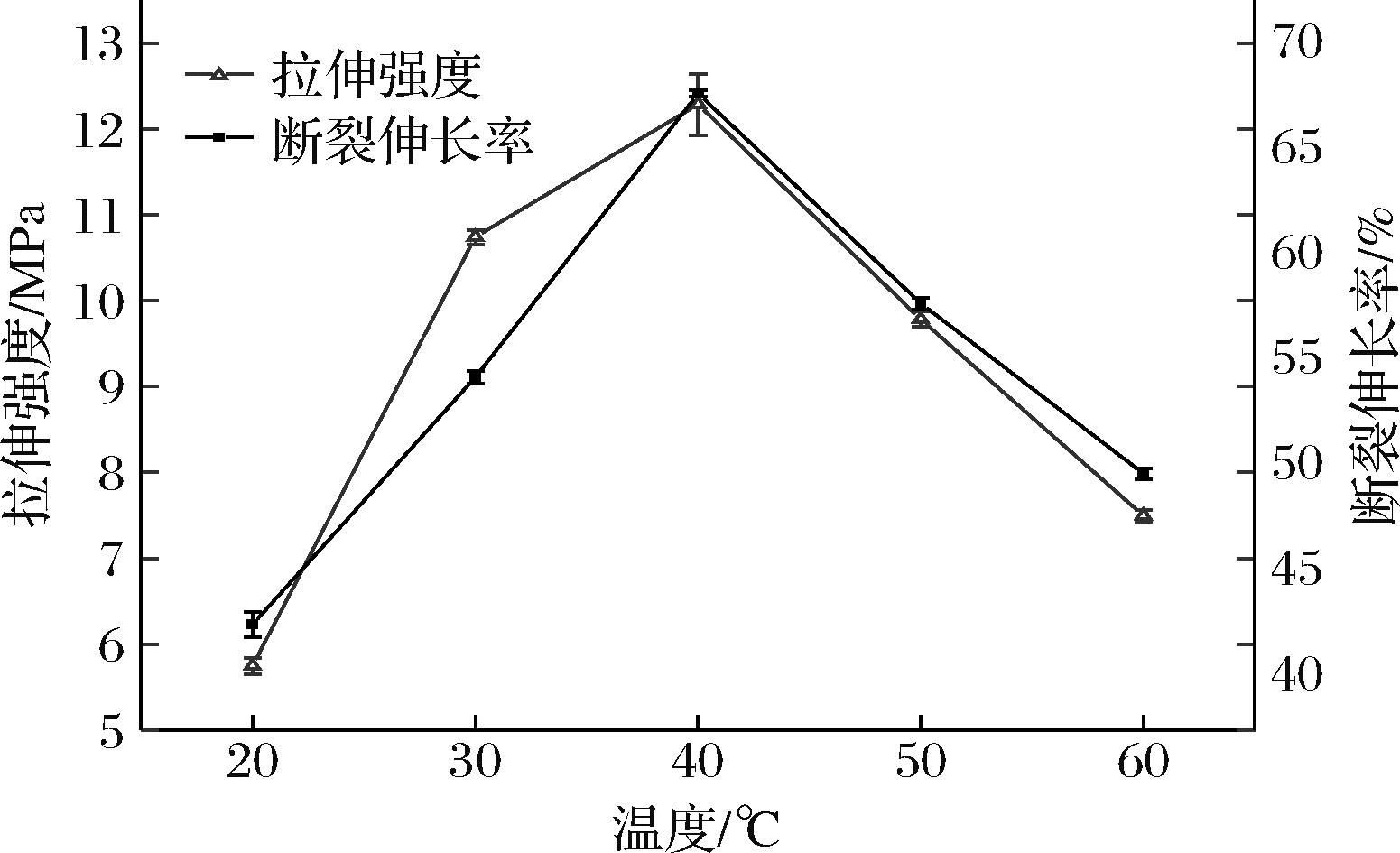
图6 温度对复合膜拉伸强度和断裂伸长率的影响
Fig.6 Effect of temperature on tensile strength and elongation at break of composite film
2.3 响应面试验
2.3.1 试验结果
依据单因素试验结果,选取各因素合适水平进行响应面试验,结果如表1和表2所示。
表1 实验设计因素与水平
Table 1 Experimental design factors and levels

水平因素A(CNC)/%B(NaCl)/%C(pH)D(温度)/℃-123630035740147850
表2 试验设计及结果
Table 2 Experimental design and results
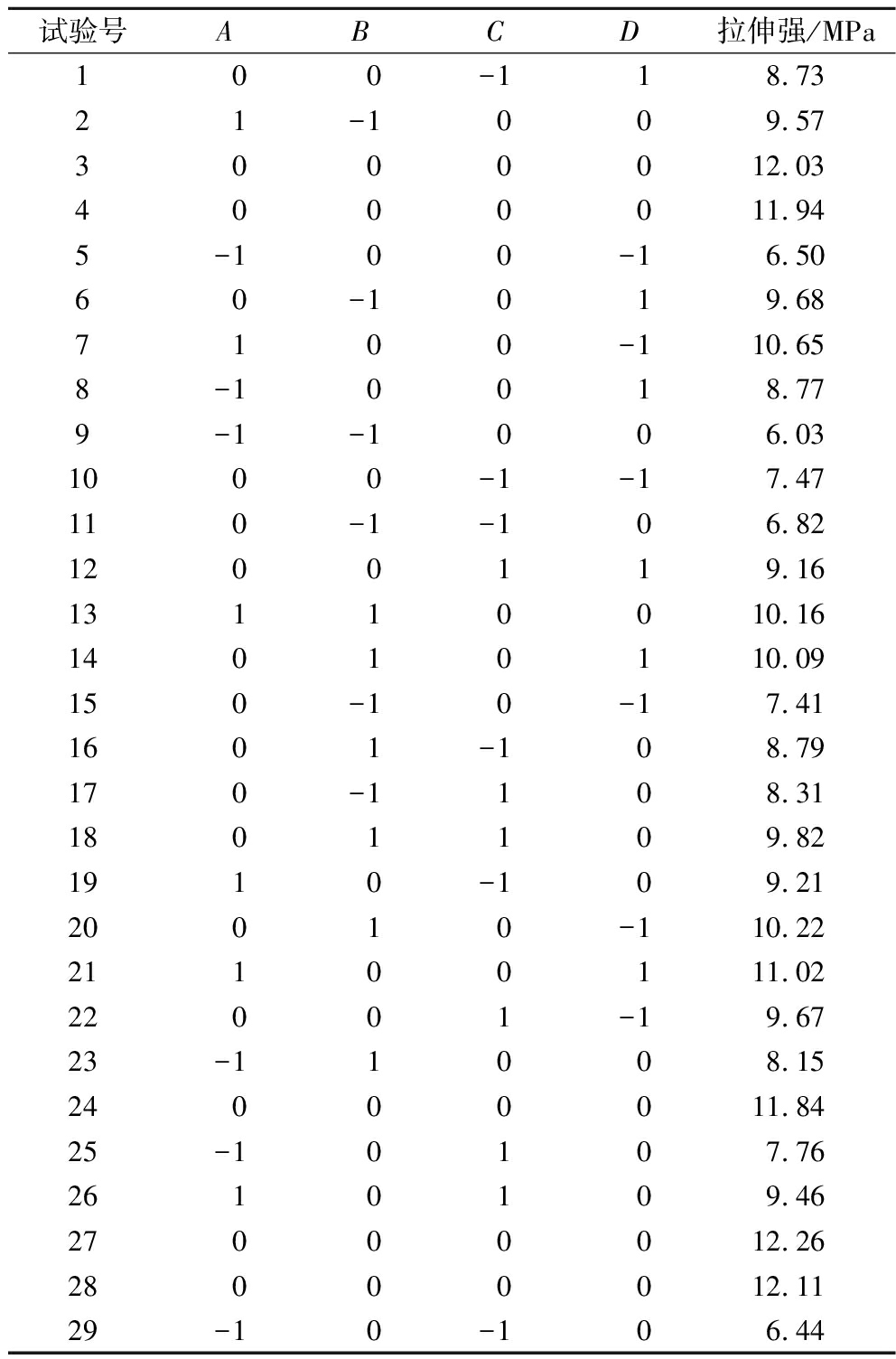
试验号ABCD拉伸强/MPa1 0 0-1 18.7321-1009.573000012.034000011.945-100-16.5060-1019.687100-110.658-10018.779-1-1006.031000-1-17.47110-1-106.821200119.1613110010.1614010110.09150-10-17.411601-108.79170-1108.311801109.821910-109.2120010-110.2221100111.0222001-19.6723-11008.1524000011.8425-10107.762610109.4627000012.2628000012.1129-10-106.44
对模型进行方差分析及显著性检验,结果如表3所示,回归模型P<0.000 1,表明模型差异极显著;失拟项P=0.076 1>0.05,表明失拟不显著。本试验模型的决定系数R2=0.985 6,说明该模型与实际试验拟合程度较好,因此该模型能够很好地对响应值进行分析和预测。回归方程为:Y=12.04+1.37A+0.78B+0.60C+0.50D-0.38AB-0.27AC-0.48AD-0.11BC-0.60BD-0.32CD-1.82A2-1.65B2-2.02C2-1.05D2。由表3可知,各因素对拉伸强度影响主次顺序为:CNC添加量>NaCl添加量>pH>加热温度。回归方程各项显著性表明,一次项A、B、C、D,交互项AD、BD,二次项A2、B2、C2、D2对复合膜拉伸强度影响极显著(P<0.01);交互项AB对复合膜的拉伸强度影响显著(P<0.05)。试验预测结果:CNC添加量3.34%、NaCl添加量5.35%、pH为7.12、温度40.96 ℃时,复合膜拉伸强度为12.40 MPa。
表3 实验设计分析
Table 3 Experimental design analysis
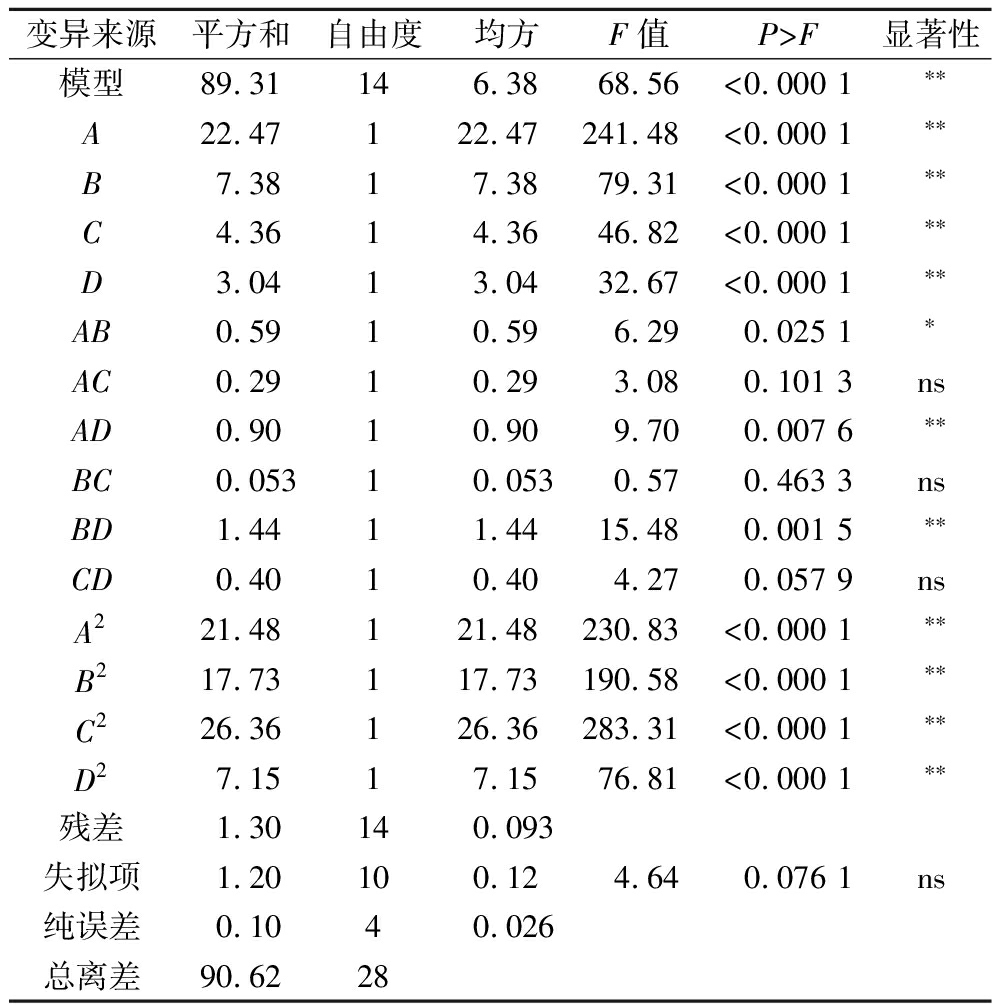
变异来源平方和自由度均方F值P>F显著性模型89.31146.3868.56<0.000 1∗∗A22.47122.47241.48<0.000 1∗∗B7.3817.3879.31<0.000 1∗∗C4.3614.3646.82<0.000 1∗∗D3.0413.0432.67<0.000 1∗∗AB0.5910.596.290.025 1∗AC0.2910.293.080.101 3nsAD0.9010.909.700.007 6∗∗BC0.05310.0530.570.463 3nsBD1.4411.4415.480.001 5∗∗CD0.4010.404.270.057 9nsA221.48121.48230.83<0.000 1∗∗B217.73117.73190.58<0.000 1∗∗C226.36126.36283.31<0.000 1∗∗D27.1517.1576.81<0.000 1∗∗残差1.30140.093失拟项1.20100.124.640.076 1ns纯误差0.1040.026总离差90.6228
注:**差异极显著(P<0.01);*差异显著(P<0.05)。
各因素三维响应曲面图如图7所示。由图7-a、图7-c和图7-e可知,CNC添加量与NaCl添加量、CNC添加量与温度、NaCl添加量与温度的三维响应曲面坡度陡峭,且等高线分布呈椭圆形,表示CNC添加量、NaCl添加量和温度两两交互作用显著(P<0.05)。而图7-b、图7-d和图7-f中,等高线椭圆形不明显,表明pH与CNC添加量、NaCl添加量和温度有一定交互作用,但交互作用不显著(P>0.05)。

a-CNC添加量与NaCl添加量;b-CNC添加量与pH;c-CNC添加量与温度;d-NaCl添加量与pH;e-NaCl添加量与温度;f-pH与温度
图7 各因素三维响应曲面图
Fig.7 Three-dimensional response surface plots for each factor
2.3.2 验证试验
按试验预测结果制备CNC-胶原蛋白肽复合膜,实际试验按CNC添加量3.5%、NaCl添加量5.5%、pH值为7.1、加热温度41 ℃操作,重复3次操作。测得复合膜的拉伸强度为(12.25±1.43) MPa,与12.40 MPa基本相似。
2.4 Ag NPs对CNC胶原蛋白膜物理性质的影响
如表4所示,复合膜拉伸强度随Ag NPs含量增多,呈先上升后下降的趋势。这是因为Ag NPs不断填补复合膜间隙,使膜质地更加紧密,从而拉伸强度增大,但过多Ag NPs会发生团聚,在复合膜中形成应力集中点,容易使膜断裂,拉伸强度降低。不透明度随Ag NPs含量增多而增大,水蒸气透过系数随Ag NPs含量增多而减小,这是因为CNC与Ag NPs填充了胶原纤维间隙,使复合膜结构更加紧密,从而影响光与水蒸气通过,造成不透明度增大,水蒸气透过系数减小[28]。
表4 不同复合膜物理性质
Table 4 Physical properties of different composite films
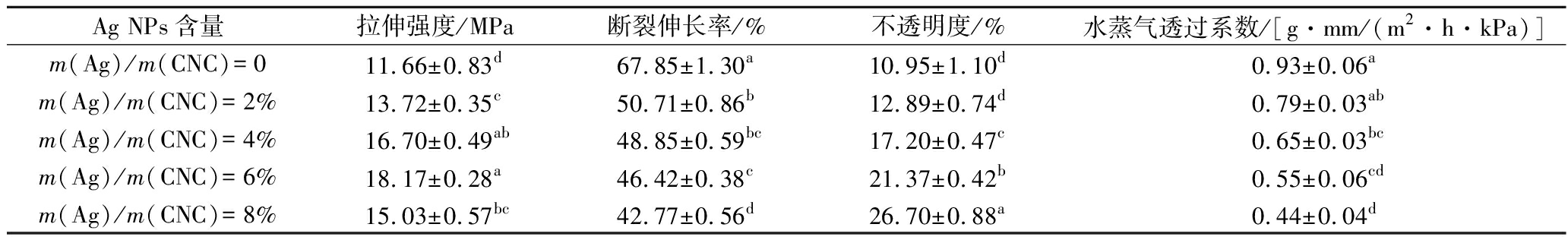
Ag NPs含量拉伸强度/MPa断裂伸长率/%不透明度/%水蒸气透过系数/[g·mm/(m2·h·kPa)]m(Ag)/m(CNC)=011.66±0.83d67.85±1.30a10.95±1.10d0.93±0.06am(Ag)/m(CNC)=2%13.72±0.35c50.71±0.86b12.89±0.74d0.79±0.03abm(Ag)/m(CNC)=4%16.70±0.49ab48.85±0.59bc17.20±0.47c0.65±0.03bcm(Ag)/m(CNC)=6%18.17±0.28a46.42±0.38c21.37±0.42b0.55±0.06cdm(Ag)/m(CNC)=8%15.03±0.57bc42.77±0.56d26.70±0.88a0.44±0.04d
注:同一列不同上标字母表示差异显著(P<0.05)。
2.5 复合膜红外光谱分析
如图8所示,CNC在3 334.32 cm-1和1 054.38 cm-1处有O—H和C—O伸缩振动产生的特征吸收峰。胶原蛋白膜有5个特征吸收峰,3 270.68 cm-1处为酰胺A的N—H和O—H伸缩振动,2 920.66 cm-1和2 875.26 cm-1处为酰胺B的CH2不对称伸缩振动和CH2对称伸缩振动,1 632.99 cm-1处为酰胺I的C![]() O伸缩振动,1 536.50 cm-1处为酰胺II的N—H弯曲振动、C—H伸缩振动,1 241.54 cm-1处为酰胺III的C—N伸缩振动[29]。当添加CNC后,胶原蛋白肽膜对应吸收峰波数转移至3 272.12、2 925.96、2 879.68、1 632.44、1 536.50、1 241.93 cm-1处,这些峰发生位移可能是因为CNC的羟基和胶原纤维的羧基发生强烈的反应,生成氢键使伸缩振动谱带强度加强。而不同Ag NPs含量复合膜吸收峰位置没发生位移,说明Ag NPs未与官能团发生反应。
O伸缩振动,1 536.50 cm-1处为酰胺II的N—H弯曲振动、C—H伸缩振动,1 241.54 cm-1处为酰胺III的C—N伸缩振动[29]。当添加CNC后,胶原蛋白肽膜对应吸收峰波数转移至3 272.12、2 925.96、2 879.68、1 632.44、1 536.50、1 241.93 cm-1处,这些峰发生位移可能是因为CNC的羟基和胶原纤维的羧基发生强烈的反应,生成氢键使伸缩振动谱带强度加强。而不同Ag NPs含量复合膜吸收峰位置没发生位移,说明Ag NPs未与官能团发生反应。
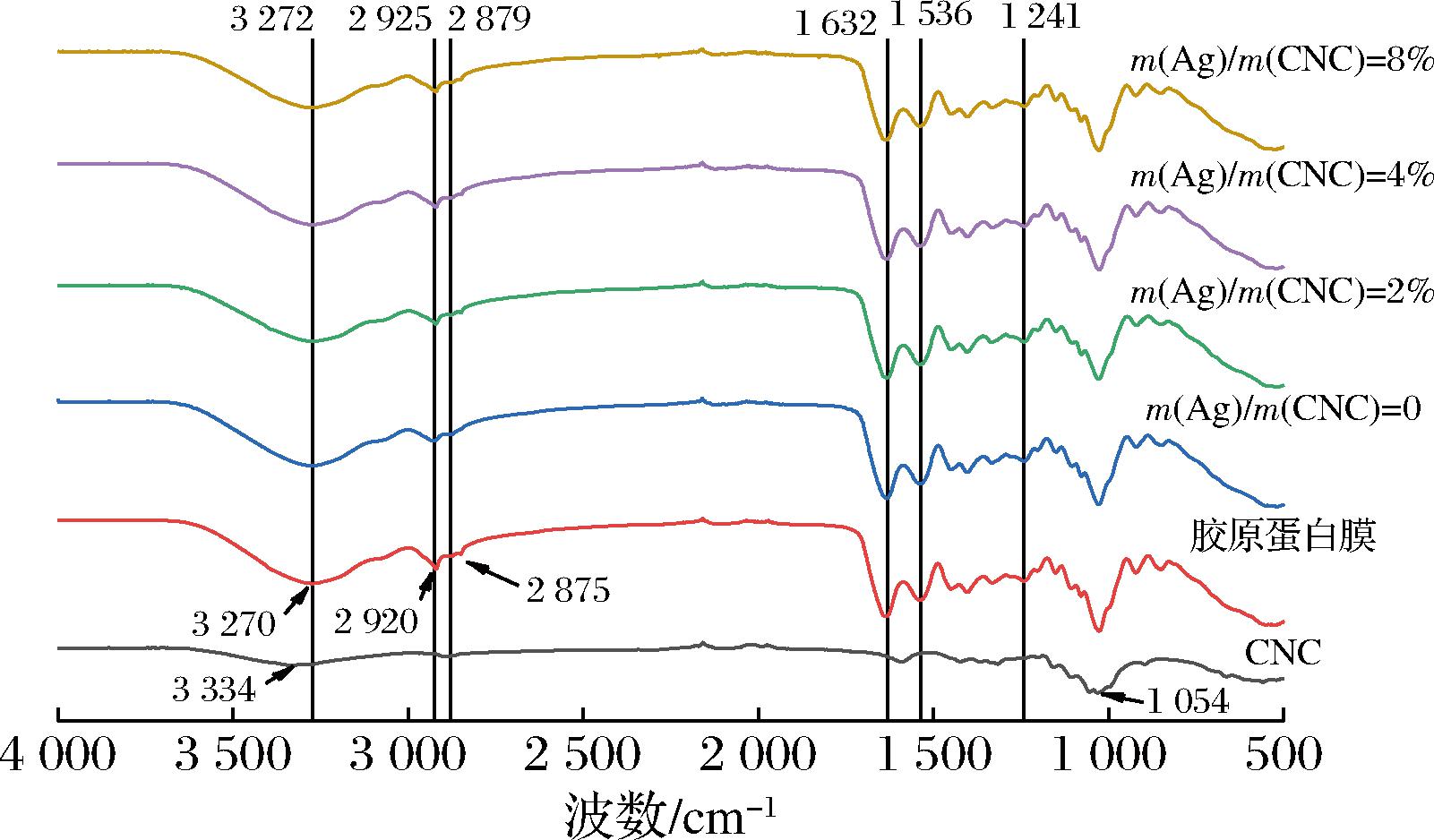
图8 不同复合膜红外光谱图
Fig.8 Infrared spectra of different composite films
2.6 复合膜扫描电镜分析
由图9-a~图9-f可知,胶原蛋白肽膜表面光滑平整,加入CNC后膜变粗糙,而随Ag NPs添加量的增多,复合膜表面出现小白点,即为Ag NPs,m(Ag)/m(CNC)=8%时,复合膜表面出现不均匀白点,可能是团聚的Ag NPs。由图9-A~图9-F可知,胶原蛋白肽膜断面致密光滑,而随CNC的加入,也变得粗糙。随Ag NPs添加量的增大,断面越来越不平整,出现斑点状痕迹,可能是因为Ag/CNC上负载的Ag NPs过多,造成团聚,在膜中出现应力集中点。这也是造成拉伸强度降低的原因。

a-胶原蛋白肽膜表面图;b-CNC-胶原蛋白肽膜表面图;c~f:m(Ag)/m(CNC)=2%~8%复合膜表面图
A-胶原蛋白肽膜断面图;B-CNC-胶原蛋白肽膜断面图;C~F:m(Ag)/m(CNC)=2%~8%复合膜断面图
图9 不同复合膜扫描电镜图
Fig.9 Scanning electron micrographs of different composite membranes
2.7 复合膜X射线衍射分析
如图10所示,CNC的特征衍射峰在2θ=15.3°、22.6°、34.6°处,分别对应纤维素(101)、(002)、(040)晶面的衍射峰,图中还显示Ag/CNC在2θ=38.1°、44.3°、64.5°、78.5°、81.5°处有5个明显的衍射峰,这与JCPDS卡编号04-0783上数值描述相符,其分别对应Ag(111)、Ag(200)、Ag(220)、Ag(311)和Ag(222)晶面的衍射峰[30]。Ag-CNC曲线Ag NPs衍射峰尖锐,表明Ag NPs的结晶度较好。而与胶原蛋白肽混合后,m(Ag)/m(CNC)=2%的复合膜未出现Ag NPs的特征衍射峰,可能是Ag NPs添加量太低所导致,而m(Ag)/m(CNC)=8%的复合膜在2θ=38.1°、44.1°、64.5°、77.5°处有较弱的Ag NPs衍射峰,表明复合膜中含有Ag NPs。
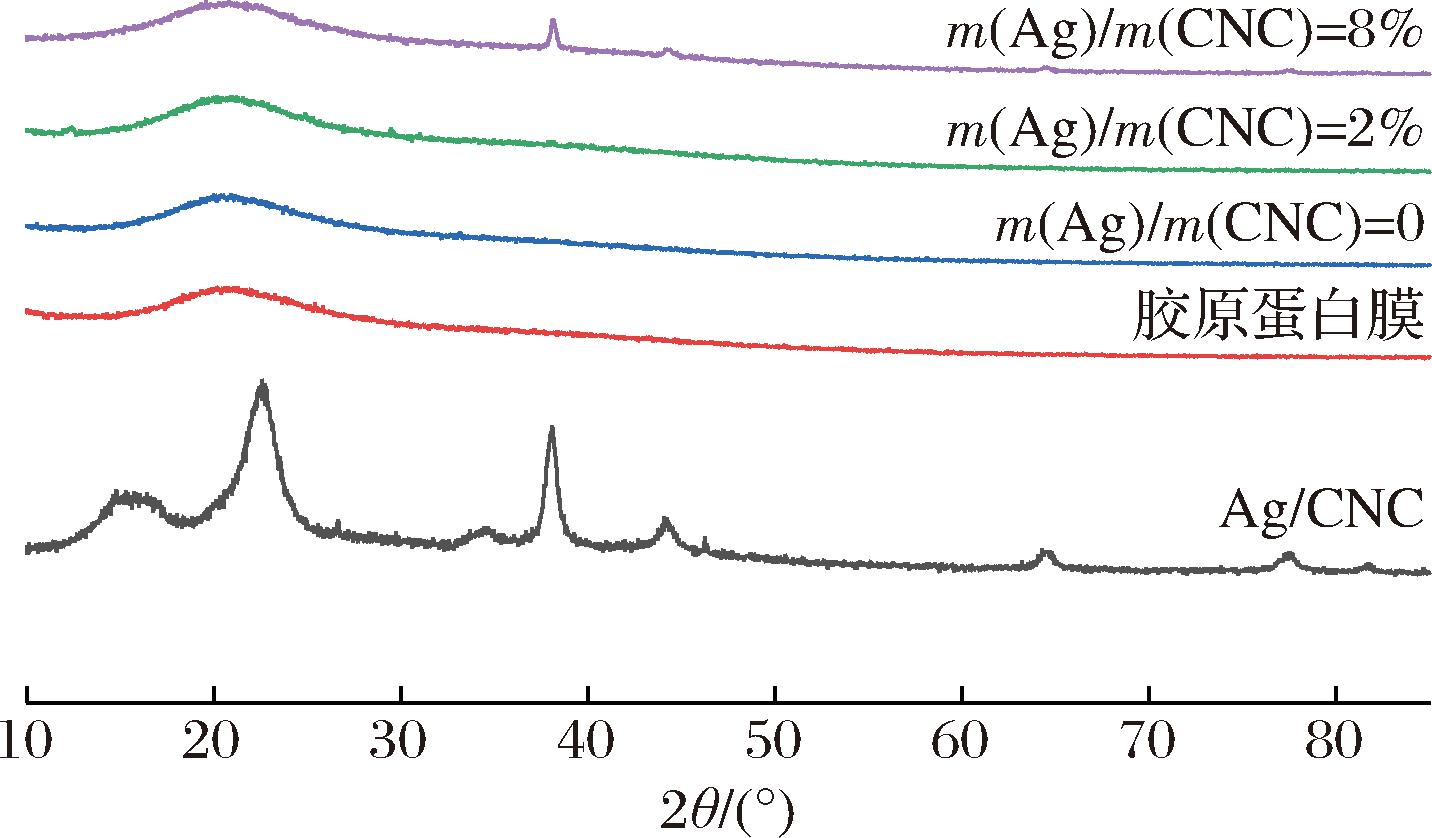
图10 不同复合膜X射线衍射图
Fig.10 X-ray diffractograms of different composite membranes
3 结论
本试验研究了CNC添加量,NaCl添加量,pH,反应温度对CNC-胶原蛋白肽复合膜机械性能的影响,并探讨了CNC中Ag NPs的含量对Ag/CNC-胶原蛋白肽复合膜性能的影响。结果表明:CNC-胶原蛋白肽复合膜的最佳制备工艺为CNC添加量3.34%、NaCl添加量5.35%、pH 7.1、加热温度41 ℃,在此条件下复合膜拉伸强度为12.25 MPa。通过对Ag/CNC-胶原蛋白肽复合膜物理性质测定,当m(Ag)/m(CNC)=6%时,复合膜拉伸强度达到最大值18.17 MPa,断裂伸长率为46.62%,不透明度为21.37%,水蒸气透过系数为0.55 g·mm/(m2·h·kPa)。红外光谱结果表明,CNC与胶原蛋白肽之间存在氢键,这可能是改善膜性能的原因之一,而随Ag NPs添加量增多,红外光谱图基本没有变化,说明Ag NPs不与官能团发生反应。扫描电镜结果表明,随CNC的加入,复合膜变粗糙,而随Ag NPs添加量的增多,复合膜表面出现白色点状Ag NPs颗粒。X射线衍射结果表明,复合膜X射线衍射图谱中有Ag NPs衍射峰,证明复合膜中含有Ag NPs。综上,Ag/CNC能有效改善胶原蛋白肽膜的综合性能。这对于评估Ag/CNC-胶原蛋白肽复合膜在食品包装领域的适用性十分重要。
[1] 刘妍靖, 李西月, 刘跃洲, 等.可食用抗菌膜在食品包装领域的应用及研究进展[J].食品科学, 2023, 44(9):331-339.
LIU Y J, LI X Y, LIU Y Z, et al.Application of edible antibacterial film in food packaging field:A review[J].Food Science, 2023, 44(9):331-339.
[2] 宫萱, 包建强, 黄可承, 等.鱼骨胶原蛋白提取、纯化工艺及应用的研究进展[J].食品与发酵工业, 2022, 48(24):346-351.
GONG X, BAO J Q, HUANG K C, et al.Progress on extraction, purification, and application of fish bone collagen[J].Food and Fermentation Industries, 2022, 48(24):346-351.
[3] WU W M, HE L C, LIANG Y H, et al.Preparation process optimization of pig bone collagen peptide-calcium chelate using response surface methodology and its structural characterization and stability analysis[J].Food Chemistry, 2019, 284:80-89.
[4] 赵丹丹, 胡俊, 陈文烜.自组装胶原蛋白复合膜对鱿鱼冷藏品质的影响[J].中国食品学报, 2022, 22(2):263-270.
ZHAO D D, HU J, CHEN W X.Effect of self-assembled collagen composite membrane on the quality of grass carp (Ctenopharyngodon idella) during cold storage[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(2):263-270.
[5] JIN S C, LI K, GAO Q, et al.Development of conductive protein-based film reinforced by cellulose nanofibril template-directed hyperbranched copolymer[J].Carbohydrate Polymers, 2020, 237:116141.
[6] KARIMI N, ALIZADEH A, ALMASI H, et al.Preparation and characterization of whey protein isolate/polydextrose-based nanocomposite film incorporated with cellulose nanofiber and L.plantarum:A new probiotic active packaging system[J].LWT, 2020, 121:108978.
[7] JIN T, YAN L, LIU W, et al.Preparation and physicochemical/antimicrobial characteristics of Asparagus cellulose films containing quercetin[J].Food Science and Human Wellness, 2021, 10(2):251-257.
[8] 杨丹, 方芳, 杨建安, 等.纳米纤维素的制备及应用研究进展[J].化工新型材料, 2022, 50(12):275-278.
YANG D, FANG F, YANG J A, et al.Advances in applications of cellulose nanocrystals[J].New Chemical Materials, 2022, 50(12):275-278.
[9] 张子俊, 杨桂花, 蒋启蒙, 等.纳米纤维素基复合膜的制备及其在食品保鲜领域的应用研究进展[J].食品科学, 2023, 44(17):312-320.
ZHANG Z J, YANG G H, JIANG Q M, et al.Research progress in the preparation of nanocellulose-based composite films and their application in food preservation[J].Food Science, 2023, 44(17):312-320.
[10] 栾夏雨, 郝站华, 卢家慧, 等.纳米纤维素复合材料在食品包装中的应用研究进展[J].食品与发酵工业, 2023, 49(22):341-347.
LUAN X Y, HAO Z H, LU J H, et al.Research progress of nanocellulose composites in food packaging[J].Food and Fermentation Industries, 2023, 49(22):341-347.
[11] 刘忠明, 董峰, 王小林, 等.纳米纤维素/壳聚糖复合膜的制备和性能[J].包装工程, 2016, 37(17):75-79.
LIU Z M, DONG F, WANG X L, et al.Preparation and properties of nanocrystalline cellulose/chitosan composite films[J].Packaging Engineering, 2016, 37(17):75-79.
[12] 张帆, 陶浩然, 毛钺程, 等.纳米纤维素基无机复合抗菌膜材料的研究进展[J].精细化工, 2022, 39(6):1081-1088.
ZHANG F, TAO H R, MAO Y C, et al.Research progress on nanocellulose-based inorganic composite antibacterial film materials[J].Fine Chemicals, 2022, 39(6):1081-1088.
[13] LIN G Z, LI X, ZHAO C S.Preparation and application of in situ loaded silver nanoparticles antibacterial fresh-keeping composite paper[J].Polymers, 2022, 14(18):3798.
[14] 陈佳豪. 纳米银溶液的绿色制备及对棉织物的抗菌整理[D].上海:东华大学, 2023.
CHEN J H.Green preparation of nanosilver solution and antimicrobial finishing of cotton fabrics [D].Shanghai:Donghua University, 2023.
[15] WANG H, PUDUKUDY M, NI Y H, et al.Synthesis of nanocrystalline cellulose via ammonium persulfate-assisted swelling followed by oxidation and their chiral self-assembly[J].Cellulose, 2020, 27(2):657-676.
[16] 樊丽. 载银纤维素纳米晶体的制备及在PVA中的应用[D].天津:天津科技大学, 2019.
FAN L.Preparation of silver loaded cellulose nanocrystals and their applications in PVA[D].Tianjin:Tianjin University of Science &Technology, 2019.
[17] YU Z L, WANG W, DHITAL R, et al.Antimicrobial effect and toxicity of cellulose nanofibril/silver nanoparticle nanocomposites prepared by an ultraviolet irradiation method[J].Colloids and Surfaces B:Biointerfaces, 2019, 180:212-220.
[18] DONG M, WANG W, WEI W, et al.Understanding the ensemble of growth behaviors of sub-10-nm silver nanorods using in situ liquid cell transmission electron microscopy[J].The Journal of Physical Chemistry C, 2019, 123(34):21257-21264.
[19] SOLTANI Z, TAVAKOLIPOUR H, TABARI M.The influence of chitosan and titanium dioxide nanoparticles incorporated with polylactic acid on prolonging rye bread shelf life[J].Journal of Food Measurement and Characterization, 2023, 17(2):1806-1816.
[20] ZHANG S H, OU Q M, XIN P K, et al.Polydopamine/puerarin nanoparticle-incorporated hybrid hydrogels for enhanced wound healing[J].Biomaterials Science, 2019, 7(10):4230-4236.
[21] 赵喜亚, 杨伟, 潘胜山, 等.纳米SiO2-马铃薯氧化羟丙基淀粉复合膜的制备及性能表征[J].食品与发酵工业, 2023, 49(1):116-123.
ZHAO X Y, YANG W, PAN S S, et al.Preparation and performance characterization of nano-silica-potato hydroxypropyl starch composite film[J].Food and Fermentation Industries, 2023, 49(1):116-123.
[22] 张昊, 刘叶, 张毅, 等.L-精氨酸改性淀粉的制备及其抗菌薄膜的性能[J].精细化工, 2018, 35(2):303-311.
ZHANG H, LIU Y, ZHANG Y, et al.Preparation of L-arginine modified starch and properties of its antibacterial films[J].Fine Chemicals, 2018, 35(2):303-311.
[23] 王海英, 孟围, 刘志明.纳米纤维素/银纳米粒子的制备和表征[J].功能材料, 2013, 44(5):677-681.
WANG H Y, MENG W, LIU Z M.Preparation and characterization of nanocrystalline cellulose/silver nanoparticles[J].Journal of Functional Materials, 2013, 44(5):677-681.
[24] 徐金龙. 胶原纤维可食用膜的机械性能改善策略及相关机制[D].无锡:江南大学, 2021.
XU J L.Improvement strategy and related mechanism of mechanical properties of collagen fiber edible film[D].Wuxi:Jiangnan University, 2021.
[25] SHEN L R, BU H H, YANG H, et al.Investigation on the behavior of collagen self-assembly in vitro via adding sodium silicate[J].International Journal of Biological Macromolecules, 2018, 115:635-642.
[26] 刘炜熹. 乌鳢胶原蛋白肽自组装及其缓释研究[D].南宁:广西大学, 2020.
LIU W X.Study on self-assembly and sustained release of collagen peptide from snakehead[D].Nanning:Guangxi University, 2020.
[27] 马明思, 张宇昊, 马良, 等.兔皮胶原蛋白的微观结构及不同因素对其聚集特性的影响[J].食品与机械, 2017, 33(2):11-16.
MA M S, ZHANG Y H, MA L, et al.Microstructure of rabbit-skin collagen and influences of different factors on its aggregation[J].Food &Machinery, 2017, 33(2):11-16.
[28] 程珊, 王稳航, 滕安国, 等.羧甲基纤维素强化胶原纤维膜的制备及其性能分析[J].食品科学, 2019, 40(3):194-201.
CHENG S, WANG W H, TENG A G, et al.Preparation and property analysis of carboxymethyl cellulose-reinforced collagen fiber film[J].Food Science, 2019, 40(3):194-201.
[29] 高玲玲, 王振宇, 饶伟丽, 等.骨胶原蛋白-壳聚糖共混膜中分子间作用红外光谱分析[J].农业工程学报, 2018, 34(3):285-291.
GAO L L, WANG Z Y, RAO W L, et al.Molecular interaction analysis between collagen and chitosan blend film based on infrared spectroscopy[J].Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(3):285-291.
[30] 苟琴, 张振.臭常山内生真菌绿色合成纳米银的优化、表征及催化活性研究[J].食品与发酵工业, 2023, 49(23):149-155.
GOU Q, ZHANG Z.Optimization, characterization, and catalytic activity of green synthesis of silver nanoparticles by endophytic fungus from Orixa japonica[J].Food and Fermentation Industries, 2023, 49(23):149-155.