鸽蛋是我国传统滋补佳品,具有益气补血、补肝壮肾、清热解毒等多种生理功效,鸽蛋销量逐年升高[1],但关于鸽蛋中功能性蛋白质的开发研究较少。卵转铁蛋白(ovotransferrin,OVT)是鸽蛋清中主要蛋白质之一,分子质量范围在78 k~80 kDa,属于转铁蛋白家族。OVT可通过结合Fe3+,控制细胞内铁的摄入量,调节铁离子平衡,同时具有抗菌、抗氧化性、抗病毒活性及增强机体免疫力等多种生物学特性[2]。IBRAHIM等[3]发现,OVT结合Fe3+、Cu2+、Zn2+等金属离子后,抗氧化能力可增强10%~60%。国内外对鸡蛋清OVT的结构、转铁机理等方面均有报道[4],但鸽蛋清中OVT的相关研究较少。
蛋白质的结构与其功能密切相关,分子结构变化会导致其生物活性改变。来源于鸡蛋的OVT结构磷酸化可以提高蛋白的热稳定性、乳化性和抑菌活性[5];氧化处理会导致OVT溶解度下降,总巯基含量减少,羰基含量显著升高,影响其自由基清除作用[6];高温处理能够改变OVT的二级结构,降低其溶解性[7],明确鸽蛋来源OVT结构与生物活性关系有助于后续开发。体外模拟消化是快速评价蛋白质消化率、产物多肽分子质量及其生物活性的方法[8]。鸡蛋清OVT的小分子肽具有良好的生物活性,如降血压、抗氧化、抗病毒、抗菌、抗癌[9-11]等,而鸽蛋清OVT消化产物及其小分子肽的生物活性尚不清楚。
本文采用分步醇沉法从鸽蛋清中提取OVT,利用LC-MS、红外光谱、圆二色谱、扫描电镜(scanning electron microscope,SEM)、原子力显微镜(atomic force microscope,AFM)等方法对OVT进行结构表征,探究OVT的热稳定性和pH稳定性,将鸽蛋OVT进行体外模拟消化,确定其消化产物分子质量分布,并比较鸽蛋、鸡蛋来源OVT小肠消化产物的抗氧化性。本文为鸽蛋的深加工和鸽蛋OVT功能的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
FeCl3·6H2O、NaHCO3、NaCl、乙醇、三氟乙酸、盐酸,均为分析纯级,国药集团化学试剂有限公司;鲜鸽蛋,江苏翠谷鸽业有限公司提供。α-淀粉酶(37 U/mg)、猪胃蛋白酶(250 U/mg)、胰脂肪酶(15 U/mg),上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
Mikro220R台式高速冷冻离心机,德国Hettich公司;LGJ - 12立式真空冷冻干燥机,北京松源华兴生物有限公司;1260 Infinity II Prime高效液相色谱仪,美国Agilent公司;Nicolet iS20红外光谱仪、Verios XHR SEM电子显微镜、Easy - nLC1200液相色谱仪、QEactive质谱仪,美国Thermo Fisher公司;NanoWizard 4 XP原子力显微镜,德国Bruker公司。
1.3 实验方法
1.3.1 OVT的提取
鸽蛋清20 g按体积比1∶1加入去离子水,振荡60 min后,8 000 r/min离心10 min取上清液。随后加入FeCl3·6H2O、NaHCO3、NaCl(质量比为1∶0.78∶1.622,试剂总质量为上清液质量的5%),磁力搅拌60 min后,加入无水乙醇,使乙醇体积分数达到43%。充分混匀后静置60 min,离心,进一步加入无水乙醇,使乙醇体积分数达到59%,静置过夜,离心后取沉淀复溶于43%(体积分数)乙醇溶液中,搅拌2 h后8 000 r/min离心10 min,沉淀即为OVT[12],用于后续实验。鸡蛋清OVT提取方法与鸽蛋清相同。
1.3.2 SDS-PAGE电泳
将1.3.1节中制备的OVT配制成OVT蛋白溶液(1.0 g/mL),使用质量分数4%~12%聚丙烯酰胺凝胶进行SDS-PAGE电泳,分别取20 μL的鸽蛋清(0.5 g/mL)、OVT蛋白溶液与5 μL上样缓冲液混合,100 ℃加热5 min,冷却后取20 μL上样,进行电泳,电泳条件为电压90 V,30 min,随后调至120 V直至结束。使用考马斯亮蓝染色液染色30 min,脱色后观察电泳条带,使用Image J软件计算OVT纯度。
1.3.3 LC-MS鉴定
1.3.3.1 胶内酶解
将OVT电泳条带切胶后进行质谱鉴定,前处理参考KATAYAMA等[13]的方法进行。使用体积分数50%乙腈(含25 mmol/L NH4HCO3)将条带脱色至透明,加入10 mmol/L二硫苏糖醇溶液,56 ℃孵育50 min后,加入55 mmol/L碘乙酰胺溶液,室温下避光反应15 min。使用50 mmol/L NaHCO3溶液清洗,纯度为100%乙腈脱水至胶块变为白色,加入0.01 μg/μL胰蛋白酶于冰上充分反应,加入25 mmol/L NH4HCO3(含体积分数10%乙腈),37 ℃过夜酶解,反应结束后离心收集液体,冻干备用。
1.3.3.2 质谱分析及数据库检索
将前处理后的样品复溶于流动相A(含体积分数0.1%甲酸,5%乙腈的水溶液),使用C18反相色谱柱(75 μm × 15 cm C18,ChromXPEksigent)进行分析,梯度洗脱条件为:0~10 min流动相B(含体积分数0.1%甲酸,95%乙腈的水溶液)由5%升高至40%。
质谱采用QEactive系统(Thermo Scientific)结合纳升喷雾III离子源(Thermo Scientific),喷雾电压为2.3 kV,气帘气压为30 Psi,雾化气压为14 Psi,加热温度为150 ℃,质谱扫描方式为IDA。蛋白鉴定采用Mascot(V2.3.02)软件和Uniprot-Fungi数据库对采集到的数据进行检索。
1.3.4 OVT结构表征
1.3.4.1 紫外光谱测定
将OVT配制成1 mg/mL溶液,紫外分光光度计在190~350 nm的波长范围内扫描。
1.3.4.2 红外光谱测定
取适量OVT与KBr按质量比1∶400混合,研磨压片,红外光谱仪在400~4 000 cm-1范围内扫描,光谱分辨率为4 cm-1。
1.3.4.3 圆二光谱测定
将OVT溶于去离子水中配制成0.5 mg/mL待测溶液,以去离子水为空白,使用0.1 cm的石英比色皿,在190~240 nm远紫外区对蛋白溶液进行圆二光谱扫描。带宽为1 nm,扫描速度为500 nm/min,使用DichroWeb网站分析蛋白二级结构。
1.3.4.4 扫描电镜分析
取适量OVT固体样品,经喷金制样后,使用电子显微镜扫描加速电压为15 kV,观察OVT表面形态,分别采集放大倍数为1 000和10 000倍的图片。
1.3.4.5 原子力显微镜分析
将10 μL OVT蛋白溶液(10 μg/mL)滴加至新解离的云母片上,干燥后使用原子力显微镜轻敲模式扫描,范围分别为1 μm × 1 μm、2.5 μm × 2.5 μm,使用Nanoscope 1.9分析软件对图像进行处理。
1.3.5 OVT的热稳定性和pH稳定性测定
1.3.5.1 热稳定性测定
将OVT溶于去离子水配制成1 mg/mL待测溶液,分别在20、40、60、80 ℃水浴加热30 min。冷却至室温后离心(6 000 r/min,5 min),取上清液进行SDS-PAGE电泳和圆二色谱分析[14],参照1.3.2节和1.2.4.3节方法进行。
1.3.5.2 pH稳定性测定
将OVT溶于去离子水中配制成1 mg/mL待测溶液,分别将pH值调至5.0、7.0、9.0、11.0,室温下静置1.5 h后将pH值调回7.0,离心(6 000 r/min,5 min)后取上清液,进行SDS-PAGE电泳和圆二色谱分析[14],参照1.3.2节和1.3.4.3节方法进行。
1.3.5.3 内源荧光测定
将不同温度、pH处理后的上清液用去离子水稀释至0.5 mg/mL,取1 mL加入光程20 mm的石英比色皿中,使用荧光分光光度计在25 ℃扫描,激发波长为280 nm,发射光谱范围为250~480 nm。狭缝宽度为2.5 nm,扫描速度为120 0 nm/min。
1.3.6 体外模拟消化
参考INFOGEST 2.0进行静态体外模拟消化,并略作改动[15]。配制5 mg/mL的样品溶液,加入等量模拟唾液(含37 U/mg α-淀粉酶),37 ℃恒温振荡10 min,在反应5、10 min时取样,沸水浴5 min终止反应。剩余口腔消化液调节pH值至3.0,加入模拟胃液(含250 U/mg猪胃蛋白酶),37 ℃恒温振荡1 h,在反应5、10、20、30、60 min时取样,沸水浴5 min终止反应。将剩余胃消化液pH调至7.0后加入模拟肠液(含15 U/mg胰脂肪酶、250 U/mg胰蛋白酶),37 ℃恒温振荡1 h,在反应5、10、20、30、60 min时取样,沸水浴5 min终止反应。消化产物的电泳参照1.3.2节的方法进行。
1.3.7 小肠消化产物组成测定
小肠消化产物组成参考ZHONG等[16]的方法,使用HPLC串联紫外检测器和Inertsil WP300 C18(5 μm,4.6×250 mm)色谱柱进行分析。流动相为乙腈(A)和含体积分数0.1%三氟乙酸的水溶液(B),梯度洗脱程序为:0~15 min,3%~53% A;15~20 min,53%~3% A;20~30 min,3% A。流速为1 mL/min,柱温30 ℃,检测波长为280 nm。
1.3.8 小肠消化产物抗氧化性测定
1.3.8.1 ABTS阳离子自由基清除率测定
将鸽蛋清OVT小肠消化产物(GOVT-D)和鸡蛋清OVT小肠消化产物(JOVT-D)分别配成5 mg/mL的待测溶液,其中JOVT-D按1.3.6节的实验方法制备。将ABTS二铵盐(0.35 mL,7.4 mmol/L)与过硫酸钾(0.35 mL,2.6 mmol/L)混合,混合物在暗室中静置15 h后,稀释40倍,作为ABTS阳离子溶液使用。将0.1 mL待测溶液与1 mL ABTS阳离子溶液混合,静置20 min,734 nm测定吸光度(A样品)。以去离子水分别代替ABTS阳离子溶液和待测溶液,作为空白(A空白)和对照(A对照),样品清除能力的计算如公式(1)所示:
ABTS阳离子自由基清除率![]()
(1)
1.3.8.2 DPPH自由基清除率测定
配制0.2 mmol/L的DPPH乙醇溶液,将待测溶液与DPPH乙醇溶液按照1∶1体积比混合,反应30 min后在517 nm处测量吸光值(B样品),以无水乙醇为对照(B对照),去离子水为空白(B空白),DPPH自由基清除率的计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
1.3.9 数据分析与处理
所有实验均重复3次,数据结果以“平均值±标准差”(Mean±SD)表示,采用SPSS 26进行显著性分析(P<0.05),利用Origin 2018软件对数据进行分析及绘图。
2 结果与分析
2.1 OVT的提取和鉴定
图1为鸽蛋清和OVT的SDS-PAGE电泳图。由图可知鸽蛋清主要由卵转铁蛋白和卵白蛋白组成,OVT在鸽蛋清中的含量为(20.70±0.42)%,高于在鸡蛋清中的含量(12%)[17]。本研究所得OVT条带清晰,无其他杂蛋白,OVT回收率为(13.53±0.11)%,纯度为(98.60±1.96)%。

M-蛋白Marker;1-鸽蛋清;2-OVT
图1 鸽蛋清和OVT的SDS-PAGE电泳图
Fig.1 SDS-PAGE electrophoretograms of pigeon egg white and OVT
分析质谱原始数据,共鉴定到64条肽段。将所得肽段与数据库中的蛋白氨基酸序列进行比对,发现鉴定到的氨基酸序列与XP_005501624.1(Ovotransferrin,Columba livia)蛋白相比序列覆盖率达55%,因此确定该蛋白是卵转铁蛋白。蛋白相关信息如表1所示,蛋白登录号为XP_005501624.1,分子质量79 kDa,等电点为7.95。鸽蛋清OVT与鸡蛋清OVT(蛋白登录号CAA26040.1)的分子质量相差不大,但鸽蛋清OVT具有更高的等电点,同时疏水性氨基酸含量更多,鸽蛋清OVT可能具有更强的抗氧化活性[18]。
表1 OVT电泳条带的质谱鉴定结果
Table 1 Results of mass spectrometry identification of OVT electrophoretic bands

蛋白登录号;蛋白描述氨基酸序列XP_005501624.1;Ovotransferrin [Columba livia]分子质量等电点序列覆盖率79 kDa7.9555%MKLLLSTVLSFGIVALCLAAPQKASVRWCTISSAEENKCNNLRELMQQESVALSCLQKSTYLDCIKAISVSGQQILISVLGTGDVSAAWGRLGFPLSHWLVPVIPHTSSSTISYYAVALVKKGTDFTIDNLQGKTSCHTGLGRSAGWNVPIGTLVRRGNIQWDGKDSGSIEQAVANFFSASCVPGATTEQKLCRQCKGDAKTKCSRTGPYSGYSGAFHCLKDGKGDIAFVKHTTVQENAPEEKNEYELLCLDGTRQPVDNYKSCHWARVPAHAVVARDDSKVDDIWTFLSKAQERFGVGTSSSFHLFGPPGKKEPALKDLLFKDSAIGLKRIPSLMDSQLYLGFEYYSAIQSLQKDQLSSNHREKKMRWCAVGKNEKSKCDLWSVVSNGEVECTVADDTKSCIVKIMKGEADAISLDGGFVYTAGVCGLVPVIGESYDDERECSKAAGEPASYFAVAVVKKSDGDITWNNLQGKKSCHTAVGRTAGWNIPMGLIHNKTGNCNFDEYFSEGCAPGSPPNSRLCQLCQGSGGLPPEKCVASSHEKYYGYTGALRCLVERGDVAFIKHSIVEENVDGKNKEDWAKDLKMDQFELLCTDGRRANVMAYRECHLAKVPTHAVVTRPEKAKKVRELLERQEKLF-GTKGVDTDRFKMFESETKDLLFKDLTKCLVKLREGITYKEFLGDQYYASVASLNTCNPSDLLQVCTFLEDK
2.2 OVT 性质分析
2.2.1 结构表征
OVT的紫外光谱图(图2-a)具有典型的蛋白质特征。OVT的红外光谱图(图2-b)表明,OVT由酰胺A带和酰胺Ⅰ、Ⅱ带组成,其中3 303 cm-1的强吸收峰是由酰胺A带的N—H伸缩振动所引起的,是蛋白质特殊吸收峰;1 652 cm-1处的强吸收峰是由酰胺I带的C![]() O伸缩振动所引起的,1 534、1 400 cm-1处的吸收峰是由酰胺I带的C—N伸缩振动、N—H弯曲振动和CH2弯曲共同引起的[19]。1 232、1 065 cm-1处是蛋白的酰胺Ⅱ带,主要是N—H弯曲振动和C—H伸缩振动所引起的[20]。OVT的圆二色谱图见图2-c,远紫外区是肽键的吸收范围,能够反映肽链结构[21]。分析OVT的圆二色谱可知常温下OVT二级结构组成(表2),OVT的α-螺旋和无规则卷曲含量低,主要由β-折叠和β-转角组成,柔性结构占比较多,OVT可能具有较好的乳化性能[22]。
O伸缩振动所引起的,1 534、1 400 cm-1处的吸收峰是由酰胺I带的C—N伸缩振动、N—H弯曲振动和CH2弯曲共同引起的[19]。1 232、1 065 cm-1处是蛋白的酰胺Ⅱ带,主要是N—H弯曲振动和C—H伸缩振动所引起的[20]。OVT的圆二色谱图见图2-c,远紫外区是肽键的吸收范围,能够反映肽链结构[21]。分析OVT的圆二色谱可知常温下OVT二级结构组成(表2),OVT的α-螺旋和无规则卷曲含量低,主要由β-折叠和β-转角组成,柔性结构占比较多,OVT可能具有较好的乳化性能[22]。
表2 OVT二级结构组成随温度、pH的变化
Table 2 The secondary structure of OVT varies with temperature and pH
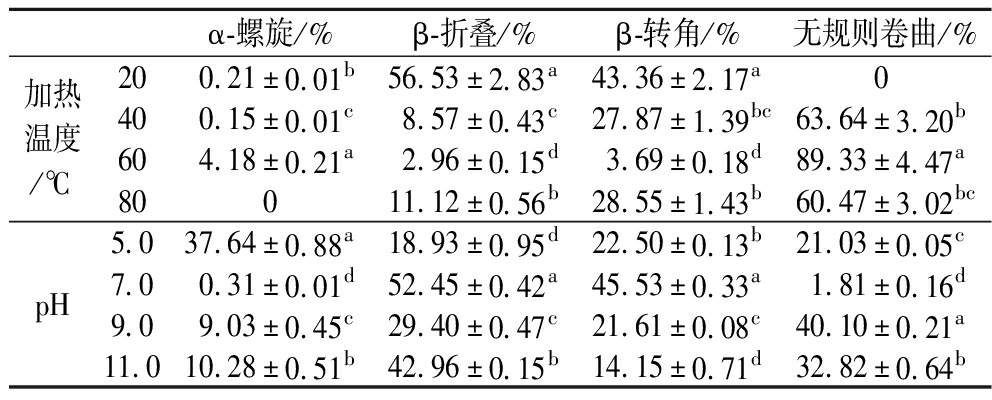
α-螺旋/%β-折叠/%β-转角/%无规则卷曲/%加热温度/℃200.21±0.01b56.53±2.83a43.36±2.17a0400.15±0.01c8.57±0.43c27.87±1.39bc63.64±3.20b604.18±0.21a2.96±0.15d3.69±0.18d89.33±4.47a80011.12±0.56b28.55±1.43b60.47±3.02bcpH5.037.64±0.88a18.93±0.95d22.50±0.13b21.03±0.05c7.00.31±0.01d52.45±0.42a45.53±0.33a1.81±0.16d9.09.03±0.45c29.40±0.47c21.61±0.08c40.10±0.21a11.010.28±0.51b42.96±0.15b14.15±0.71d32.82±0.64b
注:同列数据肩标的小写字母完全不同表示差异显著(P<0.05),含有相同字母或无肩标表示差异不显著(P>0.05)。
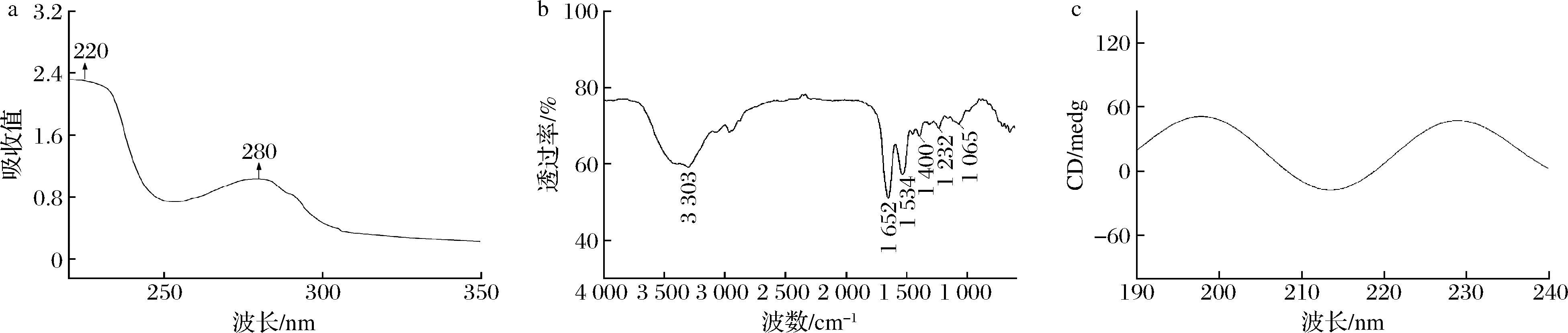
a-OVT的紫外光谱图;b-OVT的红外光谱图;c-OVT的圆二色谱图
图2 OVT的结构表征
Fig.2 Structural characterization of OVT
2.2.2 微观结构分析
原子力显微镜观察OVT溶液的微观结构(图3-a、图3-b)发现鸽蛋清OVT呈球状,空间分布均匀,统计得分子平均高度为(2.55±0.08) nm,平均直径为(10.47±0.31) nm,而鸡蛋清OVT直径小于10 nm[23]。大多数食物蛋白质和植物蛋白都是球状蛋白质,肽链通过非极性疏水作用或二硫键被包含在蛋白质内部。球状蛋白的生理功能多种多样,例如降低胆固醇、抗肿瘤和改善心血管功能等[24]。对比分子直径发现,鸽蛋清OVT的分子直径大于鸡蛋清OVT,表明鸽蛋清OVT溶液可能具有较大的蛋白质黏度,有利于食品体系的稳定及产品口感的改善[25]。从图3-c可知,OVT经冷冻干燥脱水形成不规则片状,表面较平整,提高放大倍数至10 000×时,观察到片状固体表面有较多圆形的突起,结合AFM图像可以推测是部分OVT分子脱水时保持球状聚集后形成。

a-OVT的AFM图像,1 μm × 1 μm;b-OVT的AFM图像,2.5 μm × 2.5 μm;c-OVT的SEM图像,放大倍数为1 000×;d-OVT的SEM图像,放大倍数为10 000×
图3 OVT的微观结构图像
Fig.3 Microstructure image of OVT
2.3 蛋白稳定性分析
2.3.1 热稳定性分析
从图4-a可知,温度从20 ℃升高到80 ℃过程中,OVT条带保持稳定,无新的条带生成。芳香族氨基酸,如色氨酸、酪氨酸、苯丙氨酸可吸收荧光,通过荧光强度可以有效反映出蛋白三级结构的变化。OVT由20 ℃加热至40 ℃后,荧光强度减弱,温度继续升高至60 ℃和80 ℃时,荧光强度逐渐增强。这表明OVT在加热温度较低时,蛋白结构可能发生部分聚集,导致发色基团被包埋,荧光强度有所下降。而高温加热后,OVT分子结构逐渐伸展,蛋白内部的疏水区域暴露,荧光强度明显增强[26]。
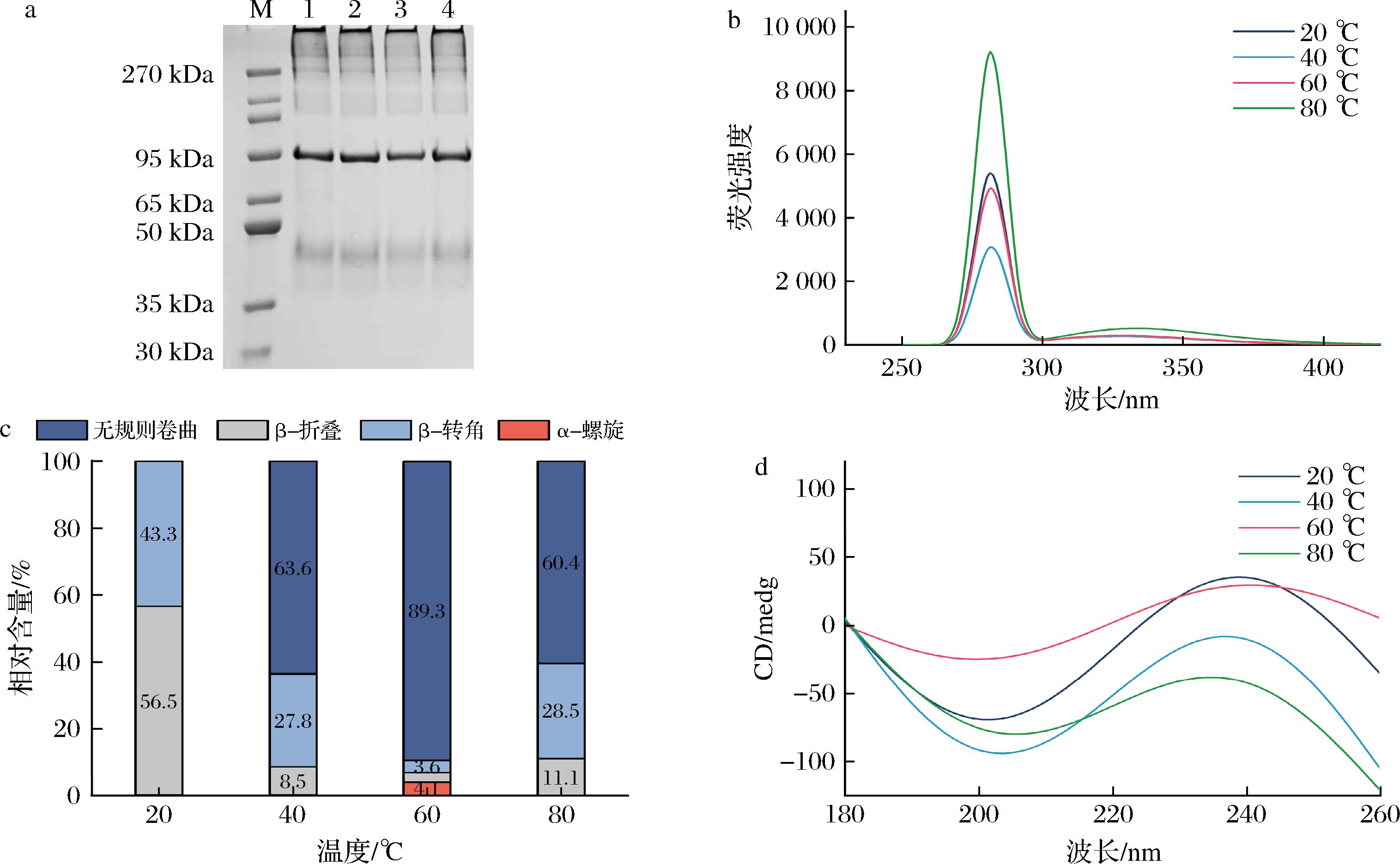
M-蛋白Marker;1~4-20、40、60、80 ℃时的OVT溶液
a-电泳图;b-内源荧光光谱图;c-二级结构相对含量;d-圆二色谱图
图4 OVT在热稳定性测定中的电泳图、内源荧光光谱图、二级结构相对含量和圆二色谱图
Fig.4 Electrophoretogram, endogenous fluorescence spectrogram, relative content of secondary structure, and circular dichrogram of OVT in thermal stability determination
图4-d的圆二色谱结果表明,热处理使OVT的二级结构发生明显变化(表2)。从20 ℃加热到40 ℃时,β-折叠和β-转角相对含量减少,无规则卷曲相对含量增多,加热至60 ℃时,β-折叠和β-转角含量进一步降低,无规则卷曲含量增多,同时出现少量α-螺旋结构,加热至80 ℃时,无规则卷曲含量有所降低,β-折叠和β-转角含量有一定恢复,加热过程中的二级结构变化可能有助于提升OVT的乳化性能[27]。
2.3.2 pH稳定性分析
从图5-a可知,pH值为5.0、7.0、9.0、11.0时,OVT条带保持稳定。结合蛋白质加工及应用的常用条件,本研究选取pH值为5.0~11.0范围的OVT内源荧光及二级结构变化进行分析,由图5-b可知,pH值为5.0、7.0时荧光强度相近,pH值升高至9.0和11.0时,荧光强度下降。碱性环境时,OVT可能发生部分变性聚集,导致暴露的荧光基团变少,同时有部分蛋白质结构伸展,内部疏水基团暴露于酸性环境中,使蛋白质侧链中的荧光基团淬灭,导致荧光强度下降[28]。

M-蛋白marker;1~4-pH 5.0、7.0、9.0、11.0
a-电泳图;b-内源荧光光谱图;c-二级结构相对含量;d-圆二色谱谱图
图5 OVT在pH稳定性测定中的电泳图、内源荧光光谱图、二级结构相对含量、圆二色谱谱图
Fig.5 Electrophoretogram, endogenous fluorescence spectrogram, relative content of secondary structure, and circular dichrogram of OVT in pH stability determination
从圆二色谱图可知,pH值由7.0向酸、碱变化时,CD曲度下降,蛋白构象发生改变。与pH值7.0时相比,在酸性环境下,β-折叠和β-转角含量下降,出现无规则卷曲,且α螺旋结构含量增加,pH值9.0时,同样出现了无规则卷曲和α螺旋结构。pH值继续升高至11.0时,无规则卷曲含量下降,β-折叠含量有所恢复。β-折叠含量升高有利于增加蛋白质的柔韧性和扩展性,使分子结构更具柔性化,同时降低OVT的表面疏水性[29]。
2.4 OVT体外模拟消化
如图6-a可知,口腔消化阶段OVT未被降解。胃消化阶段,原有OVT条带消失,新的条带集中在5 k~15 kDa,且条带颜色随消化时间增加而变浅,说明OVT在胃消化阶段逐渐被降解。小肠消化阶段,泳道无条带,表明OVT消化产物分子质量小于5 kDa,因此采用液相进一步分析产物分子质量,结果如图6-b所示,发现10.97 min处的峰面积随时间增长逐渐减小,16.20、18.48 min处的峰面积随时间增加逐渐增大,表明OVT在小肠中的消化程度随时间增加而提高,消化1 h时降解已经基本完成,产物分子质量集中在600~1 000 Da。
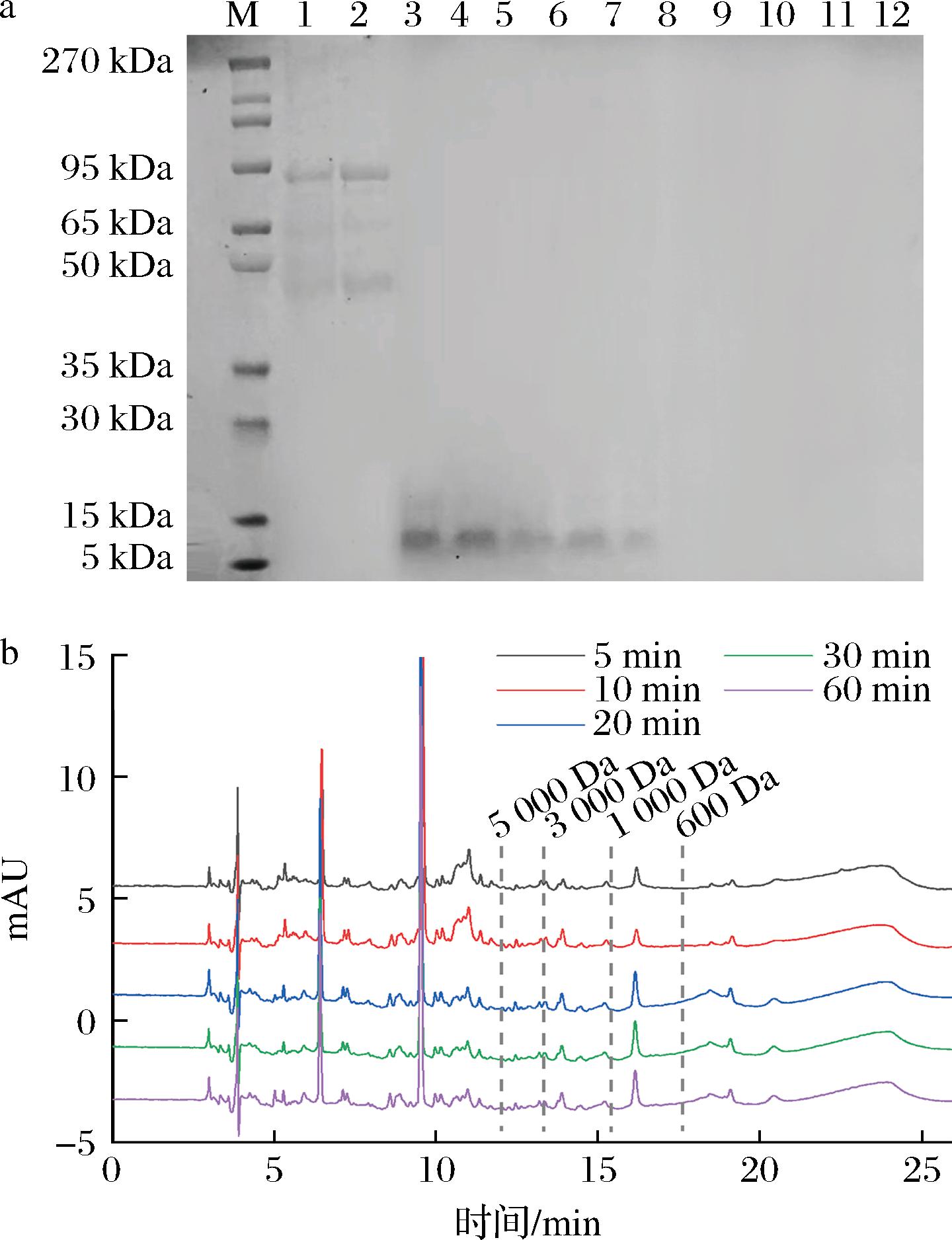
a-电泳图(M-蛋白Marker;1~2-口腔模拟消化5、10 min的样品;3~7-胃模拟消化5、10、20、30、60 min的样品;8~12-小肠模拟消化5、10、20、30、60 min的样品);b-色谱图
图6 OVT模拟消化后的的电泳图和小肠模拟消化的液相色谱图
Fig.6 Electrophoretic image of OVT after simulated digestion and liquid chromatographic image of small intestine simulation digestion
2.5 OVT小肠消化产物抗氧化性分析
从图7可知,GOVT-D对ABTS阳离子和DPPH自由基清除率最高分别达到(78.96±2.24)%和(32.29±1.60)%,均高于JOVT-D。从结构上看,鸽蛋、鸡蛋OVT的糖基化位点和糖链结构均有差异,鸽蛋清糖蛋白具有更多的糖基化位点,且末端特有的糖链Galα1-4Gal可以抑制尿路致病性大肠杆菌的黏附[30]。鸽蛋清、鸡蛋清OVT结构上的差异使其消化产物具有不同的氨基酸种类、排列方式和糖链结构,进而导致其消化产物抗氧化能力的不同,来源于鸽蛋清OVT的消化肽具有更强的抗氧化性。目前,关于鸽蛋OVT的研究还较少,尚不清楚鸽蛋OVT的结构与其生理活性的关系,鸽蛋OVT与鸡蛋OVT相比,在其他生理活性是否具有优势还需进一步深入研究。
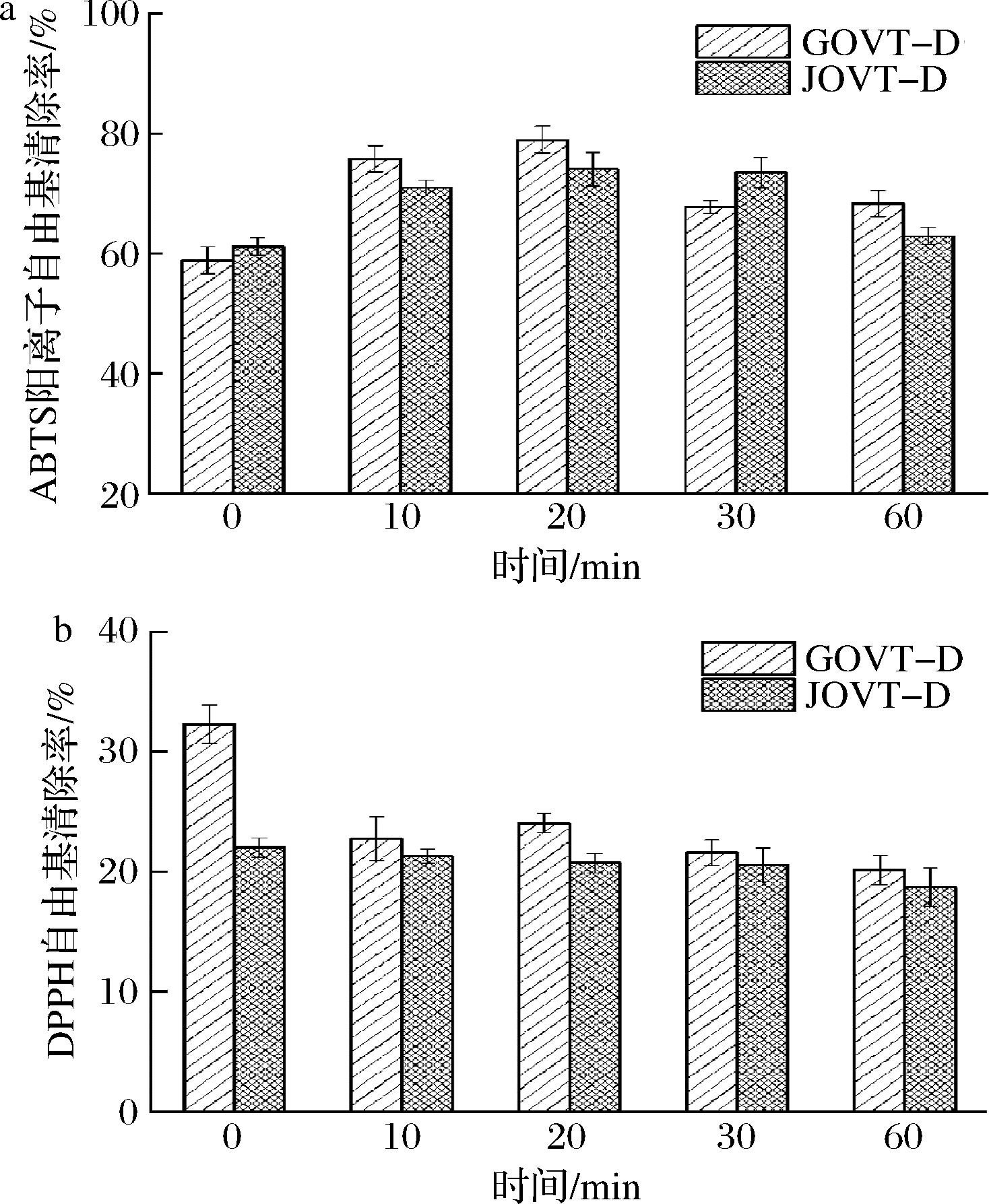
a-ABTS阳离子自由基清除率;b-DPPH自由基清除率
图7 ABTS阳离子自由基和DPPH自由基清除率对比图
Fig.7 Comparison diagram of ABTS cation free radical clearance and DPPH free radical clearance
3 结论
本研究以鸽蛋清为原料,采用分步醇沉法分离纯化OVT,回收率为(13.53±0.11)%,纯度为(98.60±1.96)%。利用超高效液相色谱-质谱联用对其进行分析,确定该蛋白为卵转铁蛋白(XP_005501624.1;Ovotransferrin),分子质量79 kDa。由AFM图像可知OVT是球状,平均高度为(2.55±0.08) nm,平均直径为(10.47±0.31) nm;SEM观察其微观结构为不规则片状,表面有圆形突起,与AFM观察的分子形态一致。常温下,OVT二级结构主要由β-折叠和β-转角构成,OVT溶液加热至80 ℃时出现无规则卷曲结构,其含量先增高后减少;OVT溶液pH由中性向酸、碱性变化时,部分构像转变为α-螺旋和无规则卷曲结构。模拟消化结果表明,OVT胃消化产物分子质量在5~15 kDa之间,小肠消化产物分子质量小于5 kDa。对比鸽蛋清、鸡蛋清来源OVT小肠消化产物的抗氧化性,发现GOVT-D对ABTS阳离子和DPPH自由基清除率最高分别达(78.96±2.24)%和(32.29±1.60)%,均高于JOVT-D。本研究为鸽蛋OVT在功能食品开发方面的应用提供理论基础。
[1] 常玲玲, 卜柱, 付胜勇, 等.不同透明度鸽蛋蛋白质构、微观结构及营养成分差异分析[J].食品安全质量检测学报, 2017, 8(1):177-181.
CHANG L L, BU Z, FU S Y, et al.Variance analysis of texture, microstructure and nutrition composition between pigeon egg albumen with different transparencies[J].Journal of Food Safety &Quality, 2017, 8(1):177-181.
[2] YOU J, LUO Y K, WU J P.Conjugation of ovotransferrin with catechin shows improved antioxidant activity[J].Journal of Agricultural and Food Chemistry, 2014, 62(12):2581-2587.
[3] IBRAHIM H R, HOQ M I, AOKI T.Ovotransferrin possesses SOD-like superoxide anion scavenging activity that is promoted by copper and manganese binding[J].International Journal of Biological Macromolecules, 2007, 41(5):631-640.
[4] BOU ABDALLAH F, EL HAGE CHAHINE J M.Transferrins.Hen ovo-transferrin, interaction with bicarbonate and iron uptake[J].European Journal of Biochemistry, 1998, 258(3):1022-1031.
[5] 黄蓉, 徐明生, 吴磊燕, 等.卵转铁蛋白磷酸化修饰工艺条件优化[J].江西农业大学学报, 2013, 35(4):864-869.
HUANG R, XU M S, WU L Y, et al.Optimization of phosphorylation modification technology for ovotransferrin[J].Acta Agriculturae Universitatis Jiangxiensis, 2013, 35(4):864-869.
[6] 黎庆, 刘建垒, 景浩.卵转铁蛋白和乳铁蛋白的氧化稳定性的比较研究[J].食品工业科技, 2016, 37(5):91-97.
LI Q, LIU J L, JING H.Comparison of ovotransferrin and lactoferrin in oxidative stability[J].Science and Technology of Food Industry, 2016, 37(5):91-97.
[7] 黎庆, 景浩.卵转铁蛋白和乳铁蛋白的热处理稳定性的比较研究[J].食品工业科技, 2016, 37(19):101-106.
LI Q, JING H.Comparison of thermal stability of ovotransferrin and lactoferrin[J].Science and Technology of Food Industry, 2016, 37(19):101-106.
[8] 李归燕, 李晋祯, 杨文, 等.海洋源活性物质乳液运载体系体外模拟消化吸收研究进展[J].食品科技, 2022, 47(7):10-17.
LI G Y, LI J Z, YANG W, et al.Research progress on in vitro-simulated digestion of emulsion systems embedded marine source active substances[J].Food Science and Technology, 2022, 47(7):10-17.
[9] LEE N Y, CHENG J T, ENOMOTO T, et al.One peptide derived from hen ovotransferrin as pro-drug to inhibit angiotensin converting enzyme[J].Journal of Food and Drug Analysis, 2020, 14(1):31-35.
[10] GIANSANTI F, MASSUCCI M T, GIARDI M F, et al.Antiviral activity of ovotransferrin derived peptides[J].Biochemical and Biophysical Research Communications, 2005, 331(1):69-73.
[11] IBRAHIM H R, SUGIMOTO Y, AOKI T.Ovotransferrin antimicrobial peptide (OTAP-92) kills bacteria through a membrane damage mechanism[J].Biochimica et Biophysica Acta, 2000, 1523(2-3):196-205.
[12] 姜宽. 两种不同来源的卵转铁蛋白N-糖链的质谱分析与比较[D].西安:西北大学, 2014.
JIANG K.Mass spectrometry analysis and comparison of N-sugar chains of ovotransferrin from two different sources[D].Xi’an:Northwest University, 2014.
[13] KATAYAMA H, NAGASU T, ODA Y.Improvement of in-gel digestion protocol for peptide mass fingerprinting by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J].Rapid Communications in Mass Spectrometry, 2001, 15(16):1416-1421.
[14] 王珊, 刘瑶, 刘柯欣, 等.南极磷虾原肌球蛋白纯化鉴定、理化特性及模拟表位肽预测[J].食品科学, 2022, 43(24):117-128.
WANG S, LIU Y, LIU K X, et al.Purification, physicochemical properties, and mimotope peptide prediction of tropomyosin from Antarctic krill(Euphausia superba)[J].Food Science, 2022, 43(24):117-128.
[15] ZHANG Z P, ZHANG R J, MCCLEMENTS D J.Control of protein digestion under simulated gastrointestinal conditions using biopolymer microgels[J].Food Research International, 2017, 100:86-94.
[16] ZHONG H, ABDULLAH, ZHANG Y P, et al.Exploring the potential of novel xanthine oxidase inhibitory peptide (ACECD) derived from Skipjack tuna hydrolysates using affinity-ultrafiltration coupled with HPLC-MALDI-TOF/TOF-MS[J].Food Chemistry, 2021, 347:129068.
[17] 傅冰, 季秀玲, 俞汇颖, 等.鸡蛋清中卵转铁蛋白的分离提取研究[J].河南农业科学, 2014, 43(3):158-160.
FU B, JI X L, YU H Y, et al.Preliminary study on the separation of ovotransferrin from egg white[J].Journal of Henan Agricultural Sciences, 2014, 43(3):158-160.
[18] CHEISON S C, WANG Z, XU S Y.Preparation of whey protein hydrolysates using a single- and two-stage enzymatic membrane reactor and their immunological and antioxidant properties:Characterization by multivariate data analysis[J].Journal of Agricultural and Food Chemistry, 2007, 55(10):3896-3904.
[19] DZWOLAK W, KATO M, TANIGUCHI Y.Fourier transform infrared spectroscopy in high-pressure studies on proteins[J].Biochimica et Biophysica Acta, 2002, 1595(1-2):131-144.
[20] 蔡路昀, 史航, 曹爱玲, 等.鲽鱼骨胶原蛋白的结构及流变学特性[J].中国食品学报, 2020, 20(3):66-73.
CAI L Y, SHI H, CAO A L, et al.The structure and rheological characteristics of collagen from flounder bone[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(3):66-73.
[21] IKEDA S, NISHINARI K.Structural changes during heat-induced gelation of globular protein dispersions[J].Biopolymers, 2001, 59(2):87-102.
[22] 孙乾, 张爱琴, 薛雨菲, 等.化学改性对核桃谷蛋白结构表征及功能特性的影响[J].食品科学, 2019, 40(20):87-93.
SUN Q, ZHANG A Q, XUE Y F, et al.Effect of chemical modification on structural characteristics and functional properties of walnut glutenin[J].Food Science, 2019, 40(20):87-93.
[23] WEI Z H, ZHU P, HUANG Q R.Investigation of ovotransferrin conformation and its complexation with sugar beet pectin[J].Food Hydrocolloids, 2019, 87:448-458.
[24] 唐传核, 杨晓泉, 彭志英, 等.微生物转谷氨酰胺酶(MTGase)的蛋白质底物催化特性及其催化机理研究—(Ⅱ)MTGase催化球状蛋白质的聚合机理[J].食品科学, 2003, 24(6):23-27.
TANG C H, YANG X Q, PENG Z Y, et al.Study on catalytic characteristics of microbial transglutaminase (MTGase) towards protein substrate and its catalytic mechanism——(Ⅱ) catalytic mechanism of mtgase against globular proteins[J].Food Science, 2003, 24(6):23-27.
[25] WAGONER T B, ÇAK R-FULLER E, SHINGLETON R, et al.Viscosity drives texture perception of protein beverages more than hydrocolloid type[J].Journal of Texture Studies, 2020, 51(1):78-91.
R-FULLER E, SHINGLETON R, et al.Viscosity drives texture perception of protein beverages more than hydrocolloid type[J].Journal of Texture Studies, 2020, 51(1):78-91.
[26] 冯旸旸, 王浩, 于栋, 等.乙醇诱导改性对乳清分离蛋白结构及乳化特性的影响[J].食品工业科技, 2020, 41(23):1-7.
FENG Y Y, WANG H, YU D, et al.Effects of ethanol-induced modification on the structural and emulsifying properties of whey protein isolates[J].Science and Technology of Food Industry, 2020, 41(23):1-7.
[27] 孙领鸽, 王丹丹, 毛晓英, 等.丙烯醛氧化修饰对核桃蛋白结构和乳化特性的影响[J].食品科学, 2018, 39(20):43-48.
SUN L G, WANG D D, MAO X Y, et al.Influence of oxidative modification with acrolein on structural and emulsifying properties of walnut protein[J].Food Science, 2018, 39(20):43-48.
[28] CHEN W M, CHEN Q Z, ZHOU H Z, et al.Structure and allergenicity of α-lactalbumin:Effects of ultrasonic prior to glycation and subsequent phosphorylation[J].Food Science and Human Wellness, 2023, 12(3):825-831.
[29] 康雪帆, 李海明, 陈丹洁, 等.糖接枝玉米醇溶蛋白包埋虾青素[J].食品科学, 2018, 39(7):168-173.
KANG X F, LI H M, CHEN D J, et al.Encapsulation of astaxanthin in zein-saccharide graft reaction products[J].Food Science, 2018, 39(7):168-173.
[30] SUZUKI N, KHOO K H, CHEN H C, et al.Isolation and characterization of major glycoproteins of pigeon egg white:Ubiquitous presence of unique N-glycans containing Galalpha1-4Gal[J].Journal of Biological Chemistry, 2001, 276(26):23221-23229.