人参(Panax ginseng Mey)是具有四千年使用历史的名贵中药,具有补五脏、安精神、定魂魄、止惊悸、除邪气、明目开心益智等药用功效[1],久服延年益寿。人参主要功效成分是皂苷。人参植物中已发现150余种皂苷,其中80%~90%的皂苷为Rg1、Re、Rb1、Rb2、Rc和Rd等[2-3]。人参在成熟后多以根入药,然而人参茎叶利用比较少[4]。有研究表明,人参茎叶皂苷含量5%左右,主要皂苷种类与根部相似[2-3],且成本低,易获得,是很好的人参皂苷生产原料[5]。
人参茎叶的主要皂苷带3~4个糖基,生理活性较低,人体不能直接吸收利用,口服后在肠道被逐步降解为C-K等稀有皂苷吸收起药效,但在人体内这种转化很弱[6],所以药用价值不高。使用酶法可以在体外将人参皂苷转化为C-K等生理活性高、易吸收的稀有皂苷,从而提高其利用率,且人参皂苷C-K具有抗癌[7]、抗血栓[8]、抗糖尿、抗炎和提高免疫的功能[9]。
目前关于人参叶皂苷体外转化生产稀有皂苷的研究较少,马丽媛等[10]利用酸水解法对人参茎叶进行处理后得到Rh1、Rh2等多种化合物,该方法可能会存在废液较难处理等问题。王丹等[11]使用甘蔗镰孢(Fusarium sacchari)转化人参茎叶皂苷后,鉴定得到C-K、Rh1、F1及Rg1等10种化合物,该方法生成的稀有人参皂苷种类较多,只是趋向生物转化成分的鉴定及理论研究,并未提出批量生产稀有皂苷的工艺方法。本课题组的前期研究中已利用黑曲霉agl-84(Aspergillus sp.agl-84)所产酶转化西洋参叶皂苷制备C-K和C-Mx[12];利用黑曲霉g.848(Aspergillus niger g.848)所产酶转化三七茎叶皂苷制备稀有人参皂苷C-K、C-Mc、C-Mx和R7等[13],但还未见使用微生物所产酶转化人参叶二醇皂苷生产稀有人参皂苷的研究。因此本文利用A.niger g.848菌所产的人参皂苷酶Ⅰ型,进行了催化转化人参茎叶二醇类皂苷制备稀有皂苷C-K的研究。研究结果有助于提高人参叶的开发利用。
1 材料与方法
1.1 材料与试剂
产人参皂苷酶I型A. niger g.848菌由本实验室从传统大曲中分离得到[13];人参茎叶来源于吉林抚松一带;AB-8大孔吸附树脂、D-280离子交换树脂,南开大学化工厂;薄层层析硅胶板60-F254,德国Merck公司。
人参皂苷Rg1、Re、Rf、Rb1、Rb2、C-Mc1、Rc、Rd、C-K、C-Y、C-Mc、C-O、F2、C-K标准品,大连三参生物科技有限公司;色谱甲醇、色谱乙腈,德国Merck公司;分析甲醇,天津大茂化学试剂厂;无水乙醇,天津科密欧化学试剂有限公司;正丁醇,天津富宇精细化工有限公司。
Waters 2695高效液相色谱分析仪、Waters 2996二极管阵列检测器,Waters Associates公司;Unitary C18色谱柱(5 μm,4.6 mm×250 mm ),大连中汇达科学仪器有限公司;AVANCE 600超导核磁共振波谱仪,瑞士Bruke公司。
1.2 人参茎和叶的总皂苷含量的测定及酶反应底物的制备
人参茎和叶总皂苷含量的测定:分别切碎人参叶和茎,各称取50 g,分别加入500 mL甲醇,浸出皂苷4次。分别合并浸出液,减压浓缩,干燥,分别得到人参叶和茎的粗总皂苷。用少量的石油醚脱脂3次,烘干后溶解于水中,经300 mL的AB-8柱反复吸附皂苷,用1 500 mL水洗掉柱上的杂质。用体积分数为95%左右乙醇洗脱柱上的人参皂苷,其洗脱液经300 mL 的D-280脱色柱除去色素,减压浓缩、干燥,分别得到人参叶和茎的总皂苷。各称取相同适宜质量,使用HPLC分析人参叶和茎中各组分皂苷含量,选择其中皂苷含量较高的作为酶反应底物的制备原料。
酶反应底物的制备(人参叶二醇皂苷的制备):取500 g人参叶加入9倍质量体积甲醇,偶尔搅拌过夜提取皂苷,重复3次,合并皂苷提取液,减压浓缩,用少量的石油醚脱脂3次,溶于水,经1.2 L的AB-8柱吸附皂苷(5~10次),用5~8倍柱体积的超纯水除去杂质,用2.5~3 L的体积分数为30%~40%乙醇溶液梯度洗脱人参三醇类皂苷Rg1和Re,经薄层层析(thin-layer chromatography,TLC)检测将Rg1和Re全部洗脱完毕后,用5 L的体积分数为83%乙醇洗脱柱上的二醇皂苷;其洗脱液经1.2 L的D-280脱色柱脱色,减压浓缩、干燥得到人参叶二醇皂苷。用HPLC方法,确定人参叶二醇皂苷中Rb1、Rc、Rb2和Rd皂苷的含量比例。
1.3 人参皂苷酶I型粗酶液的发酵制备
参考文献[13]所述方法制备。将A.niger g.848菌在无菌条件下接种入含5 g/L人参叶粉末的5.0 °P麦汁培养基中,在29~30 ℃发酵培养6~7 d。8 000 r/min离心15 min取上清液,加入3倍体积的甲醇室温静置15~24 h,离心除去上清液,收集酶蛋白沉淀,除掉酶发酵液中来源于酶诱导剂的干扰产物分离的杂质。收集酶沉淀,加入1/10发酵液体积的0.02 mol/L、适宜pH的柠檬酸缓冲液,离心收集上清液,即为人参皂苷酶Ⅰ型粗酶液。
1.4 酶活力的测定
用0.02 mol/L、适宜pH的柠檬酸缓冲液配制5 g/L人参皂苷Rd溶液;取0.1 mL底物和0.1 mL酶液混合均匀后,置于适宜温度的恒温混匀仪中,反应3 h,加入0.4 mL水饱和正丁醇摇晃均匀以终止反应,12 000 r/min离心1 min,取上清液,如此萃取3~5次;将上清液集中到一起,浓缩、干燥,以1 mL色谱甲醇溶解,经过0.22 μm滤膜过滤入色谱瓶中,进行HPLC检测,并根据稀有人参皂苷C-K浓度—峰面积拟合曲线分析产物稀有人参皂苷C-K的生成情况。
酶活力定义:在最适条件下,单位体积粗酶液每小时水解人参叶二醇皂苷生成稀有皂苷C-K的量(μmol)为一个酶活力单位(U),计算如公式(1)所示:
(1)
式中:U,粗酶液的酶活力,U;S,稀有皂苷C-K的浓度,μmol/mL;T,酶反应时间,h;V,粗酶液的体积,mL。
配制质量浓度分别为0.5、1.0、1.5、2.0、2.5 mg/mL的人参皂苷C-K标准品,经HPLC分析得到对应浓度的峰面积值,以浓度为横轴,峰面积为纵轴绘制出拟合曲线,以此获得拟合方程为:y=9 069 301.2x+923 046,R2=0.999 79。
1.5 酶反应最适条件的分析
为了得到酶反应最适温度和pH,以人参皂苷Rd为底物,测定A.niger g.848菌所产的人参皂苷酶Ⅰ型的最适温度和最适pH。
以0.02 mol/L、适宜pH的柠檬酸缓冲液配制5 g/L人参皂苷Rd溶液;取0.1 mL和相应pH的0.1 mL酶液混合,在30、35、40、45、50、60、70 ℃反应3 h,以0.4 mL水饱和正丁醇萃取反应产物(3次)浓缩干燥,按照2.4节所述方法得出酶活力,并以酶活力最高的一组为100%,绘制温度—相对酶活力曲线。
取0.1 mL pH值(0.02 mol/L)分别为3.0、4.0、5.0、6.0、7.0、8.0和9.0的5 g/L柠檬酸缓冲液配制Rd底物溶液,分别与相应pH的0.1 mL酶液混合均匀,在最适温度条件下反应3 h,以0.4 mL水饱和正丁醇萃取反应产物(3次)浓缩干燥,按照2.4节所述方法得出酶活力,并以酶活力最高的一组为100%,绘制pH—相对酶活力曲线。
1.6 人参叶二醇皂苷水解途径初步分析
将0.1 mL酶与分别0.1 mL的、用0.02 mol/L、最适pH的柠檬酸缓冲液配制的10 g/L的Rb1或Rb2或Rc或Rd皂苷液混合,在最适温度下反应1.5~2 h,加入0.2 mL水饱和正丁醇摇晃均匀以终止反应,12 000 r/min离心1 min,取上清液,以TLC法分析人参皂苷反应产物。
1.7 稀有人参皂苷C-K的制备
在最适条件下,将人参叶二醇皂苷与0.02 mol/L、pH 5.0柠檬酸缓冲液混合均匀,制备50 g/L底物液;加入等体积酶液,在50 ℃搅拌反应24 h,经TLC检测大部分底物转化为C-K后,加入3倍体积甲醇静置15~24 h,离心取上清液,减压浓缩,干燥,用少量的石油醚脱脂3次;溶解于体积分数为30%~40%的乙醇溶液中,反复吸附于20倍质量体积的AB-8柱,经TLC检测C-K几乎全部吸收后,用3倍柱体积体积分数为30%的乙醇除去杂质,然后用8倍柱体积体积分数为84%的乙醇洗脱柱上所吸附的C-K;其C-K洗脱液,经与AB-8柱同等体积D-280脱色柱脱色,加压浓缩,干燥得到粗C-K干粉。
用硅胶柱法从粗C-K静止稀有皂苷C-K[12-13]。即,将6.1 g粗C-K溶解于25 mL氯仿甲醇混合液中,加入16 g的80~120目硅胶搅拌干燥的样品硅胶,放于230 g的300~400目硅胶上部,用氯仿通开柱,然后用氯仿∶甲醇=9∶1(v/v)的溶剂洗脱硅胶柱上的C-K,每瓶收集150~200 mL。经TLC检测,全部洗脱C-K,合并C-K的收集瓶,减压浓缩,干燥,经HPLC检测其纯度。
1.8 酶反应产物的分析方法
采用TLC法对人参茎叶皂苷和酶反应产物进行定性分析。硅胶板为60-F254,展开剂为V(氯仿)∶V(甲醇)∶V(水)=7∶2.5∶0.5,置于体积分数为10%硫酸溶液中浸泡5~10 s后,加热显色。根据标准品和人参叶二醇皂苷对反应产物进行定性分析。
采用HPLC法对人参茎、叶皂苷及反应产物进行定量分析。检测器为Waters 2996 Photodiode Array Detector(Waters, Milford, Massachusetts, USA)。色谱柱为Unitary C18(5 μm,4.6 mm×250 mm)。测定波长为203 nm;进样量为10 μL;流速为1.0 mL/min;色谱柱温度为35 ℃。(a)测定人参茎叶皂苷流动相:乙腈(A)和水的梯度洗脱程序为0~35 min,19.0%A;35~55 min,19.0%~29.0%A;55~65 min,29.0%~40.0%A;65~80 min,40.0%~100.0%A。(b)测定酶反应产物稀有皂苷C-K流动相:乙腈(A)和水的梯度洗脱程序为0~20 min,20.0%A;20~31 min,20.0%~32.0%A;31~40 min,32.0%~43.0%A;40~70 min,43.0%~100.0%A。
人参皂苷C-K的结构用核磁共振(nuclear magnetic resonance,NMR)法检测,探头为5 mm BBO,溶剂为氘代吡啶(Pyridine-d5)。测定了1H,600 MHz;C13,150 MHz图谱。
1.9 数据处理
实验过程中以Origin 2019和Office 2018完成数据统计及绘图。
2 结果与分析
2.1 人参叶和茎的总皂苷的测定及酶反应底物的制备
从50 g人参叶得到7.17 g总皂苷,叶的皂苷含量为14.3%;从50 g人参茎得到0.63 g总皂苷,茎的皂苷含量为1.25%。经HPLC检测,人参叶和茎主要含Rg1、Re、Rf、Rb1、Rb2、Rc和Rd等皂苷(图1-c,图1-d)。人参茎叶各皂苷的HPLC积分面积比,近似认为各皂苷含量比(表1)。人参叶总皂苷中Rg1为16.8%,Re为32.2%,Rf为4.48%,Rb1为7.44%,Rc为6.49%,Rb2为6.65%,Rd为26.0%。人参茎总皂苷中中Rg1为21.4%,Re为30%,Rf为10.1%,Rb1为7.35%,Rc为5.03%,Rb2为3.52%,Rd为21.9%。
表1 人参叶和茎的人参皂苷及其各皂苷含量比例
Table 1 Proportion of ginsenosides in ginseng leaves and stems
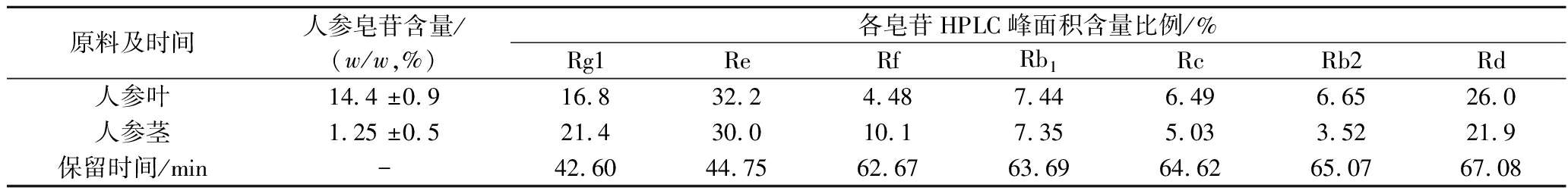
原料及时间人参皂苷含量/(w/w,%)各皂苷HPLC峰面积含量比例/%Rg1ReRfRb1RcRb2Rd人参叶14.4 ±0.916.832.24.487.446.496.6526.0人参茎1.25 ±0.521.430.010.17.355.033.5221.9保留时间/min-42.6044.7562.6763.6964.6265.0767.08

a-稀有人参皂苷标准品;b-人参皂苷标准品;c-人参叶总皂苷;d-人参茎总皂苷
图1 人参叶和茎的总皂苷HPLC检测图
Fig.1 HPLC plot of total ginsenosides in ginseng leaves and stems
注:a,1-人参皂苷C-Mc1,2-人参皂苷C-O,3-人参皂苷F2,4-人参皂苷C-Mc,5-人参皂苷C-Y,6-人参皂苷C-K标准品;b,1-人参皂苷Rg1,2-人参皂苷Re,3-人参皂苷Rf,4-人参皂苷Rb1,5-人参皂苷Rc,6-人参皂苷Rb2,7-人参皂苷Rd。
从表1可以得出,人参叶部位的皂苷含量为14.4%,茎部位的皂苷含量为1.25%,即叶部位总皂苷含量远高于茎的皂苷含量,因此本文从人参叶部分提取分离二醇类皂苷作为酶反应底物。从500 g人参叶中提取得到人参叶二醇皂苷31.5 g,其人参叶二醇皂苷组成为16.0%Rb1、13.9%Rc、14.3%Rb2、55.8%Rd,质量得率为6.3%。
2.2 酶反应最适温度和pH
人参叶二醇类皂苷主要皂苷为Rd,其含量比例为55.8%,因此为了得到酶反应最适温度和pH,以人参皂苷Rd为底物,测定了A.niger g.848菌所产的人参皂苷酶Ⅰ型的最适温度和最适pH。结果如图2-a、图2-b所示,该酶的最适温度为50 ℃,最适pH为5.0。用Rb1或Rb2或Rc为底物,测定酶的最适温度和pH,结果与Rd的结果一致。由此可见,A.niger g.848菌所产人参皂苷酸I型最适温度为50 ℃,最适pH值为5.0。
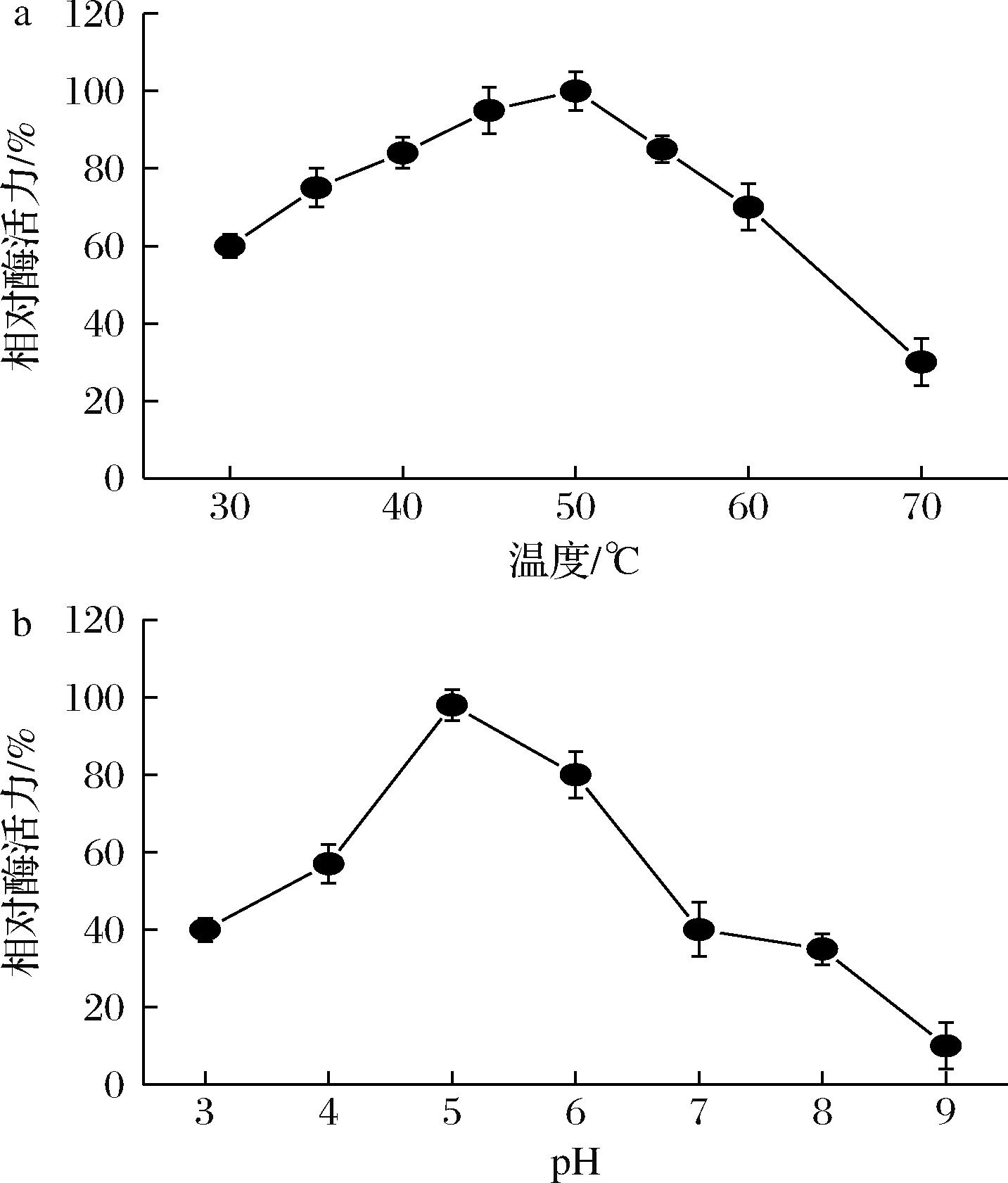
a-最适温度;b-最适pH
图2 人参皂苷水解酶Ⅰ型最适反应温度和pH
Fig.2 The optimal temperature and pH of ginsenoside enzyme type I
注:0.5%的Rd酶反应3 h;3次实验平均结果。
2.3 人参皂苷酶I型对人参二醇皂苷水解途径的初步分析
以人参皂苷Rb1、Rb2、Rc、Rd标准品为底物,分别和酶液反应,从TLC结果(图3)推断可能的水解途径是A.niger g.848菌所产的人参皂苷酶Ⅰ型均能水解人参二醇皂苷,且水解效果较好。图中可以初步得出:人参皂苷酶I型水解Rb1过程为先水解Rb1的20-O-β-D-葡萄糖基生成Rd,进一步水解Rd的末端3-O-β-D-葡萄糖基生成F2,水解F2的3-O-β-D-葡萄糖基生成稀有皂苷C-K。酶水解Rb2的过程为先水解末端3-O-β-D-葡萄糖基生成C-O,再水解C-O的3-O-β-D-葡萄糖基生成C-Y,进一步水解C-Y的20-O-β-L-吡喃阿拉伯糖基生成C-K。酶水解Rc的过程为先水解末端3-O-β-D-葡萄糖基生成C-Mc1,水解C-Mc1的3-O-β-D-葡萄糖基生成C-Mc,进一步水解C-Mc的20-O-β-L-呋喃阿拉伯糖基生成C-K。Rd的酶解过程为水解Rd的末端3-O-β-D-葡萄糖基生成F2,水解F2的3-O-β-D-葡萄糖基生成稀有皂苷C-K。各皂苷水解途径示意图如图4所示。
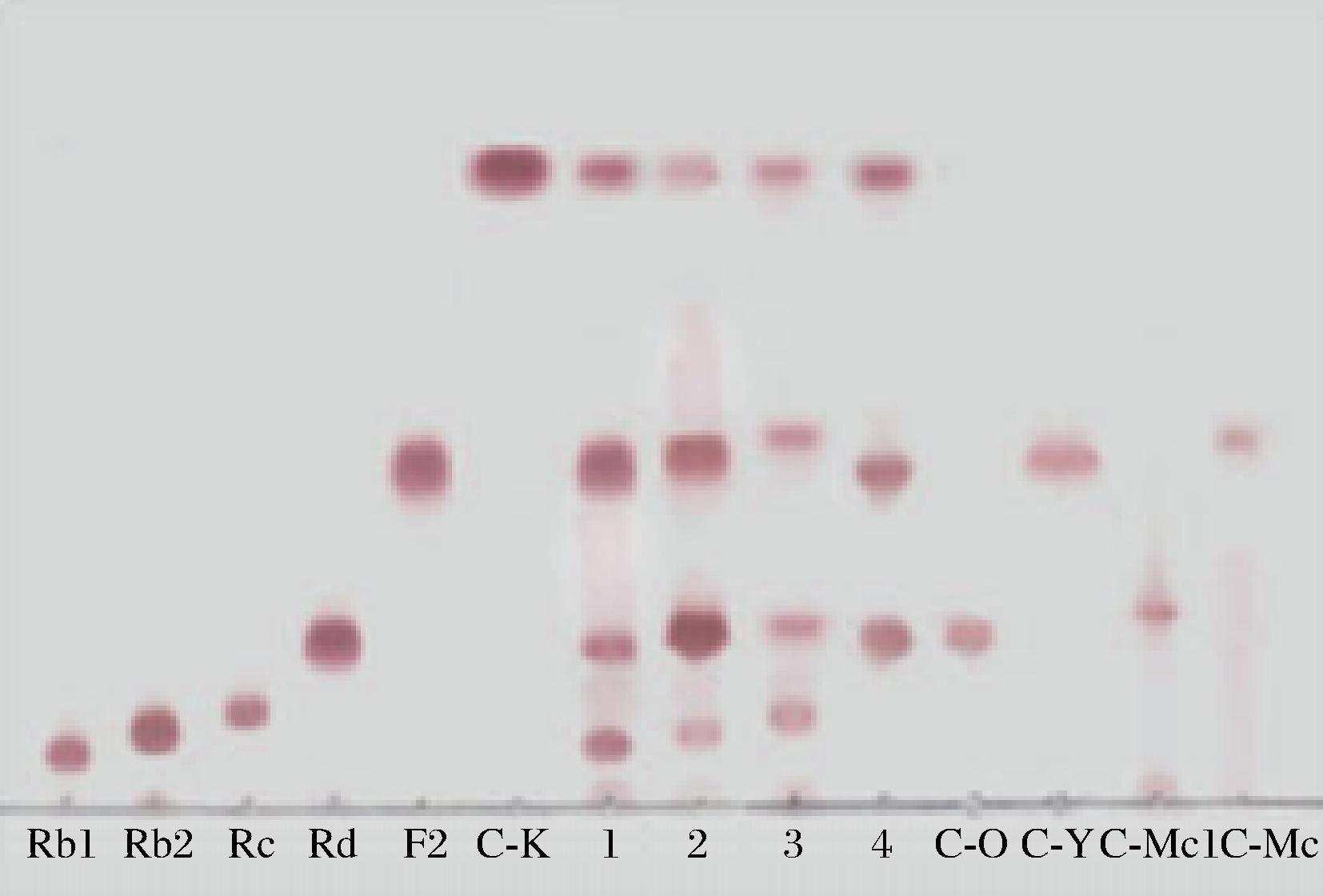
图3 人参皂苷水解酶Ⅰ型水解人参叶主要二醇皂苷Rb1、Rb2、Rc和Rd的TLC图
Fig.3 TLC plot of PPD-gimsemosides (Rb1, Rb2, Rc, and Rd) of ginseng-leaf hydrolyzed by ginsenoside enzyme type Ⅰ
注:Rb1、Rb2、Rc、Rd、F2、C-K、C-Y、C-O、C-Mc1和C-Mc,人参皂苷标准品。1,Rb1的反应后样品;2,Rb2的反应后样品;3,Rc的反应后样品;4,Rd的反应后样品。分别1.0%人参皂苷在50 ℃反应1.5~2 h。展开剂:V(氯仿)∶V(甲醇)∶V(水)= 7∶2.5∶0.5;用体积分数 为10%H2SO4加热显色。

图4 人参皂苷水解酶Ⅰ型水解人参皂苷Rb1、Rb2、Rc和Rd的反应式
Fig.4 The reaction of the hydrolysis of ginsenosides Rb1, Rb2, Rc, and Rd by ginsenoside enzyme type Ⅰ
注:Glc,葡萄糖基;Ara(p),吡喃阿拉伯糖基;Ara(f),呋喃阿拉伯糖基。
2.4 以人参叶二醇类皂苷为底物酶转化制备C-K
为了得到稀有皂苷C-K,以10 g人参叶二醇皂苷(组成为16.0%的Rb1,1.44 mmol;13.9%的Rc,1.28 mmol;14.3%的Rb2,1.33 mmol;55.8%的Rd,5.89 mmol;共9.94 mmol)(来源于约160 g人参叶)为底物,经过人参皂苷酶Ⅰ型催化后,干燥得到6.1 g粗C-K干粉,然后经硅胶柱纯化得到纯度93%(图5)以上的3.9 g的C-K,理论摩尔得率为58.6%。经3次试验结果基本一致,即从500 g人参叶共制备了11.7 g的稀有皂苷C-K;质量得率为2.3%。
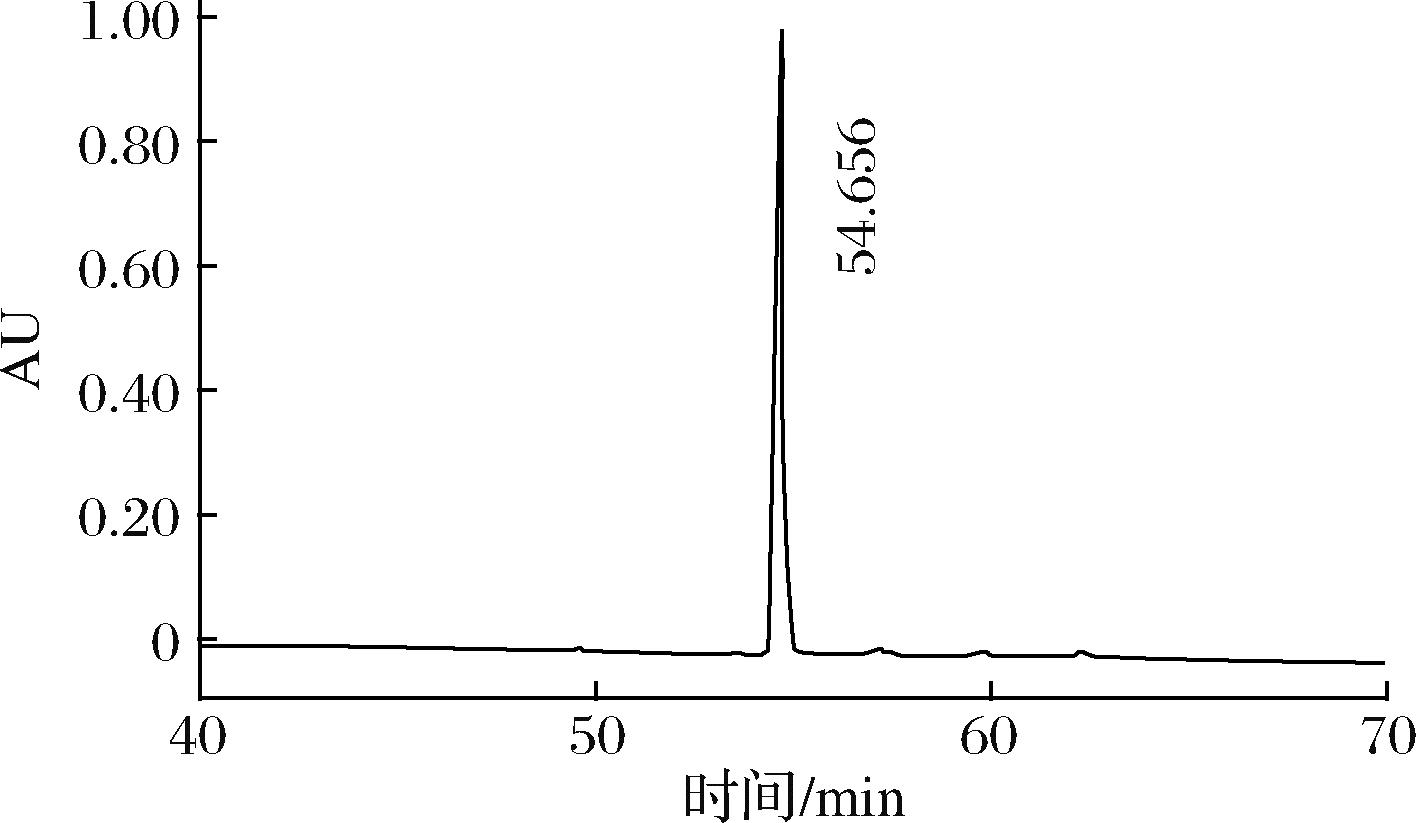
图5 酶转化人参叶二醇类皂苷得到的稀有人参皂苷C-K的HPLC图
Fig.5 HPLC plot of rare ginsenoside C-K obtained by enzymatic conversion of ginseng leaf PPD-gimsemosides
进一步通过核磁共振检测了酶转化得到的C-K制品的结构。结果证实,酶转化得到的C-K图谱与参考文献一致[13](表2),确定用A.niger g.848菌酶转化人参叶二醇皂苷得到的产品是稀有人参皂苷C-K,即20-O-β-D-吡喃葡萄糖基-20(S)原人参二醇苷元,分子式为C36H62O8,分子质量为622.4。其结构如图6所示。
表2 酶转化得到的C-K与参考文献C-K的C13 NMR化学移位的比较表
Table 2 C13 NMR chemical shifts of C-K in this paper and references
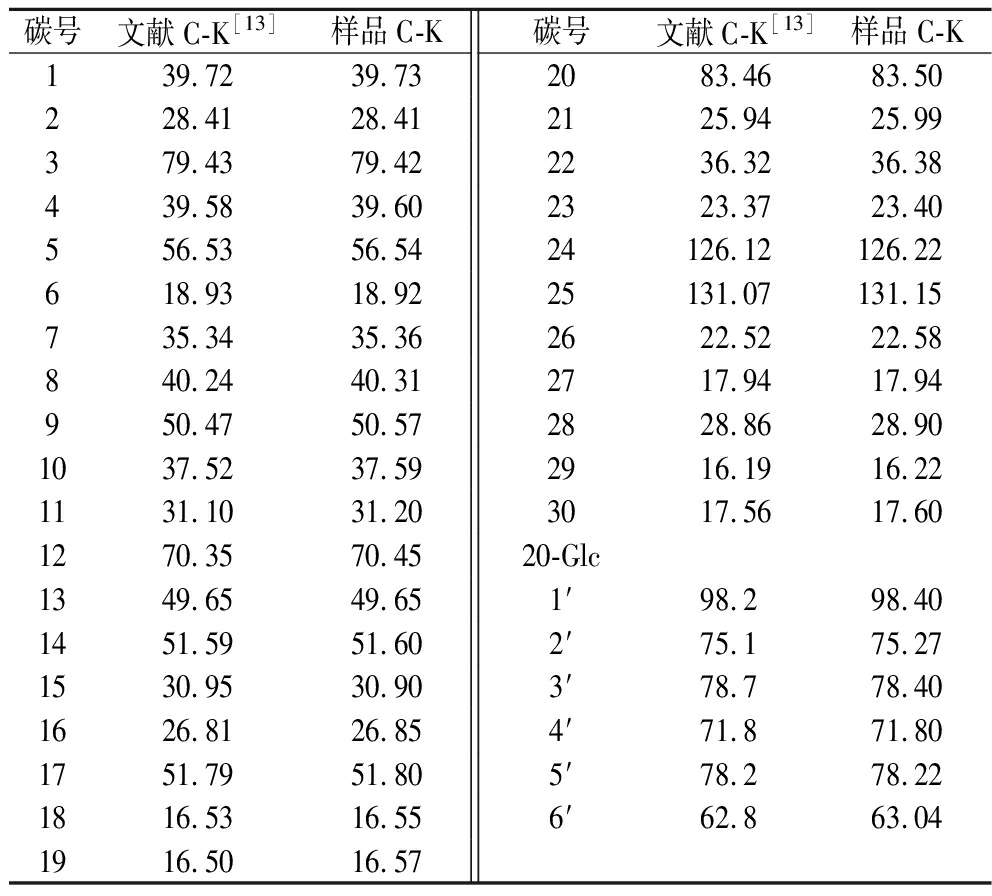
碳号文献C-K[13]样品C-K碳号文献C-K[13]样品C-K139.7239.732083.4683.50228.4128.412125.9425.99379.4379.422236.3236.38439.5839.602323.3723.40556.5356.5424126.12126.22618.9318.9225131.07131.15735.3435.362622.5222.58840.2440.312717.9417.94950.4750.572828.8628.901037.5237.592916.1916.221131.1031.203017.5617.601270.3570.4520-Glc1349.6549.651′98.298.401451.5951.602′75.175.271530.9530.903′78.778.401626.8126.854′71.871.801751.7951.805′78.278.221816.5316.556′62.863.041916.5016.57
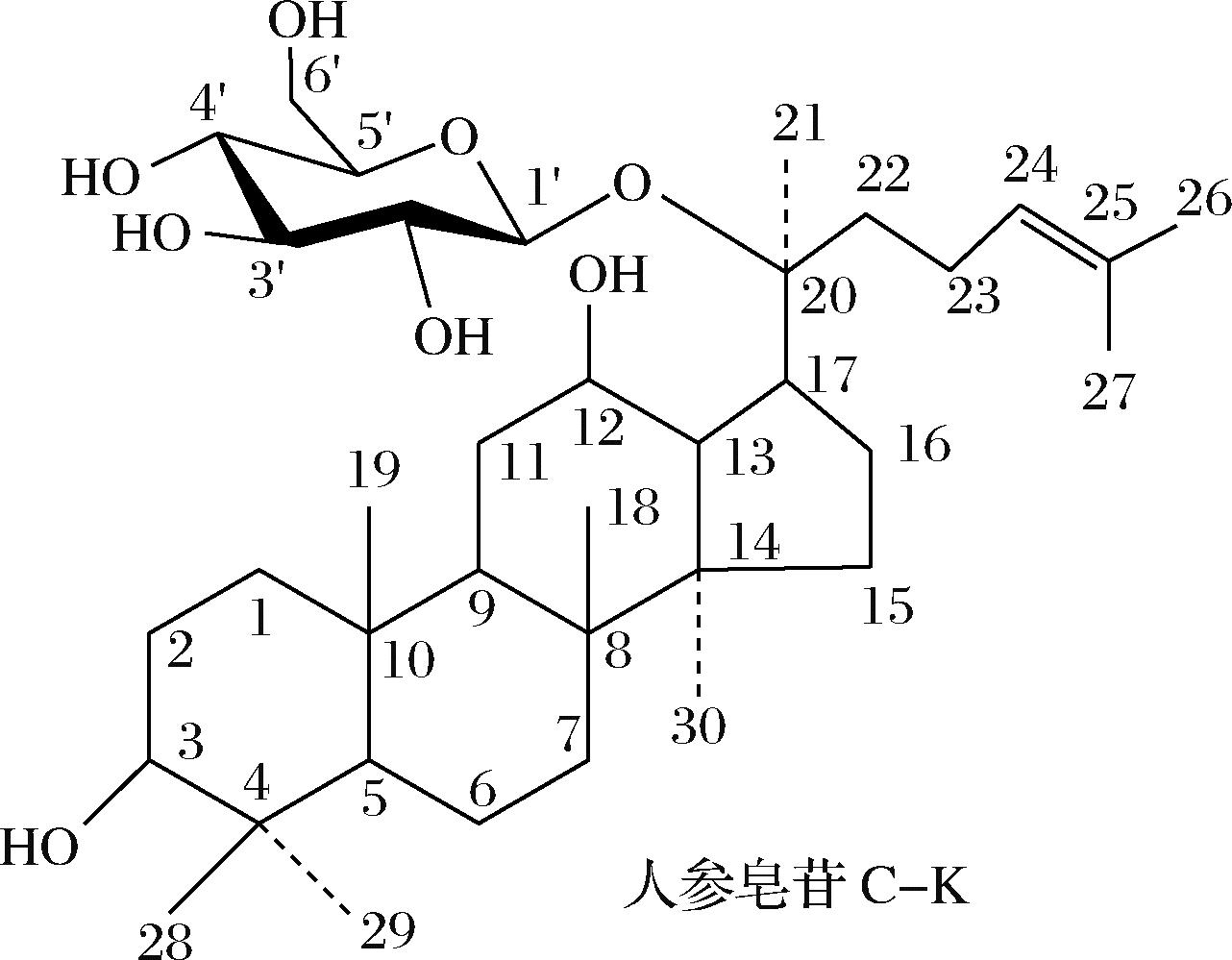
图6 稀有人参皂苷C-K制品的化学结构式
Fig.6 Chemical structure of rare ginsenoside C-K
3 结论
本文开展了利用A.niger g.848菌所产的人参皂苷酶Ⅰ型,转化人参叶二醇类皂苷制备稀有皂苷C-K的研究。成功从500 g人参叶中分离得到了31.5 g人参叶二醇皂苷,得率为6.3%。且发现A.niger g.848菌所产的人参皂苷酶I型能逐步水解人参叶二醇皂苷中的Rb1、Rc、Rb2和Rd最终生成C-K;最适反应温度为50 ℃,最适反应pH为5.0。最终制备出11.7 g纯度为93%的C-K,质量得率为2.3%。本方法可以利用人参叶大量生产稀有人参皂苷C-K,有助于促进其在食品保健、化妆品和药物领域的应用。
[1] 孔洋洋, 袁红霞.《神农本草经》与经方应用之人参篇[J].山东中医药大学学报, 2023, 47(2):127-131.
KONG Y Y, YUAN H X.Renshen(ginseng Radix et rhizoma) in Shennong’s classic of materia Medica and classical formulas[J].Journal of Shandong University of Traditional Chinese Medicine, 2023, 47(2):127-131.
[2] 金凤燮. 天然产物生物转化[M].北京:化学工业出版社, 2009:74-113.
JIN F X.Biotransformation of Natural Products[M].Beijing: Chemical Industry Press, 2009:74-113.
[3] CHRISTENSEN L P.Ginsenosides chemistry, biosynthesis, analysis, and potential health effects[J].Advances in Food and Nutrition Research, 2009, 55:1-99.
[4] LEE H J, LEE H S, CHO H J, et al.Utilization of hydrolytic enzymes for the extraction of ginsenosides from Korean ginseng leaves[J].Process Biochemistry, 2012, 47(3):538-543.
[5] 李鹏飞, 刘春莹, 郭俊莹, 等.不同种类人参茎叶中皂苷成分的比较[J].安徽农业科学, 2010, 38(24):13077-13079.
LI P F, LIU C Y, GUO J Y, et al.Comparison of the saponin composition in the stem and leaf of different type of ginseng[J].Journal of Anhui Agricultural Sciences, 2010, 38(24):13077-13079.
[6] TAWAB M A, BAHR U, KARAS M, et al.Degradation of ginsenosides in humans after oral administration[J].Drug Metabolism and Disposition, 2003, 31(8):1065-1071.
[7] ZHANG J M, WANG Y J, JIANG Y Y, et al.Enhanced cytotoxic and apoptotic potential in hepatic carcinoma cells of chitosan nanoparticles loaded with ginsenoside compound K[J].Carbohydrate Polymers, 2018, 198:537-545.
[8] ZHOU L, ZHENG Y, LI Z Y, et al.Compound K attenuates the development of atherosclerosis in ApoE (-/-) mice via LXRα activation[J].International Journal of Molecular Sciences, 2016, 17(7):1054.
[9] KIM E, KIM D, YOO S, et al.The skin protective effects of compound K, a metabolite of ginsenoside Rb1 from Panax ginseng[J].Journal of Ginseng Research, 2018, 42(2):218-224.
[10] 马丽媛, 杨秀伟.人参茎叶总皂苷酸水解产物化学成分研究[J].中草药, 2015, 46(17):2522-2533.
MA L Y, YANG X W.Chemical constituents in acid hydrolysates of total saponins from stems and leaves of Panax ginseng[J].Chinese Traditional and Herbal Drugs, 2015, 46(17):2522-2533.
[11] 王丹, 赵余庆.人参茎叶皂苷的Fusarium sacchari转化产物成分研究[J].中草药, 2017, 48(4):648-652.
WANG D, ZHAO Y Q.Chemical constituents in transformation product of Fusarium sacchari from leaves saponin of Panax ginseng[J].Chinese Traditional and Herbal Drugs, 2017, 48(4):648-652.
[12] YUE H L, LIU C Y, HAN Y T, et al.Preparation of minor ginsenosides C-K and C-Mx from protopanaxadiol ginsenosides of American ginseng leaves by a enzyme from Aspergillus sp.agl-84 strain[J].Process Biochemistry, 2021, 103:50-59.
[13] XIAO Y K, LIU C Y, IM W T, et al.Dynamic changes of multi-notoginseng stem-leaf ginsenosides in reaction with ginsenosidase type-I[J].Journal of Ginseng Research, 2019, 43(2):186-195.