生物活性肽通常是由2~20个氨基酸分子组成,分子质量介于蛋白质和氨基酸之间的小分子聚合物[1]。生物活性肽除去其营养价值外,往往还具有抗氧化[2]、抗菌[3]、抗炎症[4]、降血压[5]、降血脂[6]、改善皮肤[7]、提高免疫力[8]等多种生物活性,对于人体生理健康状态具有重要意义,在健康食品和营养保健等产业方面极具发展潜力。然而,生物活性肽在生产加工及贮运期间会不可避免的暴露在各种环境条件下,其稳定性易受到pH、金属离子等多种因素影响[9]。同时,生物活性肽在口服进入体内后,消化吸收稳定性差,生物利用率低[10]。霍艳姣等[11]以鳕鱼鱼肉蛋白肽为研究对象,构建体外胃肠消化模型,模拟连续的胃肠消化,结果显示经过胃肠消化后,鱼肉蛋白肽胃肠消化产物分子质量分布发生变化,分子质量大的肽比例减少,低于500 Da的肽比例增加。同样的,张佩等[12]探究了体外模拟胃肠消化对牡蛎肽抗氧化和降糖活性的影响,结果表明经体外模拟消化结束后,牡蛎肽的短肽和游离氨基酸含量显著增加,而DPPH自由基清除率、α-淀粉酶和α-葡萄糖苷酶的抑制率显著下降,说明胃肠消化会降解牡蛎肽并影响其消化稳定性,进而显著降低其抗氧化和降糖活性。递送系统的发展为生物活性肽的稳态化提供了新思路。研究发现,通过对生物活性肽进行合理的包埋,能够有效保护和递送生物活性肽,解决胃肠道消化吸收稳定性差的问题[13]。AUWAL等[14]以三聚磷酸钠( tripolyphosphate,TPP)交联壳聚糖纳米颗粒为载体,对石鱼源生物活性肽进行包封,被纳米颗粒包封后的生物活性肽在体外物理、化学稳定性显著增强。袁靖琳等[15]通过锐孔法制备海藻酸钠-壳聚糖微胶囊,用于包埋水牛乳活性肽,研究证实微胶囊能保护生物活性肽的活性、提高其稳定性,具有良好的耐酸和缓释效果。
壳聚糖(chitosan,CS)是天然的阳离子多聚糖,具有生物降解性、生物相容性、抑菌、增强免疫等多种生理功能;CS酸溶性溶液富含阳离子电荷,可以与带负电的交联剂、多糖、蛋白等物质通过分子间静电吸引,进而实现生物活性成分的包埋递送[16]。基于CS的特殊性状和功能,目前已被广泛应用于食品添加剂、美容保健、化妆品、药物缓释材料等领域[17]。郑昌亮等[18]利用CS和TPP成功制备了负载鳙鱼肽的CS/TPP复合纳米颗粒,负载率可达79.6%,并且探究了模拟消化和贮藏时间对制备的CS/TPP纳米颗粒的影响,研究结果表明被包封后的鳙鱼肽的消化保留率和贮藏稳定性均得到显著的提升。果胶(pectin,PEC)是一类天然杂多糖,可以与多价阳离子或相反电荷的聚电解质凝聚交联生成三维网络聚合物[19]。PEC具有良好的生物相容性、生物黏附性和安全无毒的特性[20],并且胃肠道稳定性高,可以作为结肠靶向定位药物递送载体,控制药物的释放[21]。刘烨等[22]成功使用玉米醇溶蛋白-果胶纳米颗粒负载白藜芦醇,通过小鼠急性炎症实验表明负载白藜芦醇的玉米醇溶蛋白-果胶纳米颗粒提高了白藜芦醇在小鼠体内的抗炎能力。
由于PEC分子链带有负电荷,CS具有正电荷,因此利用PEC和CS分子间的相互静电作用,有望制备一种具有pH响应型纳米载体。因此,本研究以CS和PEC作为壁材,以牛骨胶原肽为芯材,以牛骨胶原肽的包埋率为指标,通过单因素实验和响应面实验优化CS/PEC-牛骨胶原肽纳米颗粒的制备工艺,旨在通过PEC和CS的包埋作用提高牛骨胶原肽的体外稳定性,本研究将为牛骨胶原肽口服递送生物利用度的提升及其在营养保健品生产加工方面的应用研究提供理论指导。
1 材料与方法
1.1 材料与试剂
牛骨明胶,罗赛洛明胶有限公司;碱性蛋白酶(Alcalase 2.4 L),诺维信生物技术有限公司;CS、PEC,上海阿拉丁生化科技股份有限公司;胃蛋白酶、胰蛋白酶,北京索莱宝科技有限公司;BCA(bicinchoninic acid assay)蛋白定量试剂盒,上海雅酶生物医药科技有限公司。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器,豪沃生物科技(上海)有限公司;FD-1A-50冷冻干燥机,上海比朗仪器制造有限公司;TGL-16D冷冻高速离心机,美国Agilent公司;JXH-100恒温混匀仪,上海净信实业发展有限公司;XHF-DY高速分散器,宁波新芝生物科技股份有限公司;352型酶标仪,芬兰Labsystems Multiskan MS公司。
1.3 实验方法
1.3.1 牛骨胶原肽的制备
参考CAO等[23]的方法并略作修改。称取40 g牛骨明胶在55 ℃水浴条件下溶解于500 mL去离子水中,用2 mol/L NaOH调节溶液pH至9.0。加入Alcalase 2.4 L(7 500 U/g)1.25 mL,在55 ℃温度条件下磁力搅拌水解6.5 h,再用沸水浴灭活20 min。将冷却后的明胶水解液用2 mol/L HCl溶液调节pH至7.0。采用分子质量为1 kDa的超滤膜分离明胶水解液,收集分子质量小于1 kDa的小分子牛骨胶原肽溶液冷冻干燥后放置于-80 ℃冰箱待用。
1.3.2 CS/PEC载体的制备
基于赵雪[24]方法制备并稍作修改。称取一定量的CS溶解在10 g/L乙酸溶液中,配制不同质量浓度的CS,超声波处理30 min,然后磁力搅拌24 h使溶液澄清透明,CS完全溶解。准确移取10 mL CS溶液于烧杯中,并加入一定质量的牛骨胶原肽,搅拌1 h使其溶液澄清透明,用6 mol/L NaOH溶液调节其pH值至4.0,然后慢慢滴加一定浓度的PEC水溶液,使CS/PEC呈一定质量比,滴加完毕后使用均质机将混合物均质10 min,形成包含牛骨胶原肽的CS/PEC纳米颗粒(W牛骨胶原肽∶VCS/PEC=1∶100)。
1.3.3 包埋率的计算
参考DU等[25]的方法并稍作修改。将1.3.2节混合溶液注入分子质量为3 kDa的超滤离心管中离心,在10 000 r/min条件下离心20 min,未被包埋的牛骨胶原肽通过滤膜被分离至滤过液中。使用BCA试剂盒计算过滤液中未被包覆牛骨胶原肽的含量,并计算该体系包埋牛骨胶原肽的包埋率,计算如公式(1):
包埋率![]()
(1)
式中:m1,添加总肽的质量,mg;m2,未包覆的肽的质量,mg。
1.3.4 单因素试验
为考察单一因素对牛骨胶原肽包埋率的影响,在其他条件相同的情况下,分别选择不同CS质量浓度(1、5、10、15、20 g/L)、PEC质量浓度(20、30、40、50、60 g/L)、CS∶PEC质量比(2∶1、3∶2、1∶1、2∶3、1∶2)和pH值(2.0、4.0、6.0、8.0)进行研究。
1.3.5 响应面试验设计
采用SPSS 26.0对单因素试验结果进行分析,选出对CS/PEC纳米颗粒包埋率影响较大3个因素:CS质量浓度(A)、CS∶PEC质量比(B)和pH值(C)。选择3因素3水平,每个变量水平分别以-1、0、1进行编码,具体因素和水平见表1,以Box-Behnken设计安排进行试验。采用Design Expert 13.0.5.0对试验数据进行回归分析,对CS/PEC纳米颗粒牛骨胶原肽包埋率的影响因素进行深入研究和条件优化,并做出响应面图,对响应值受多个变量影响的问题进行建模及分析预测。
表1 响应面试验因素水平设计
Table 1 Response surface test factor level design
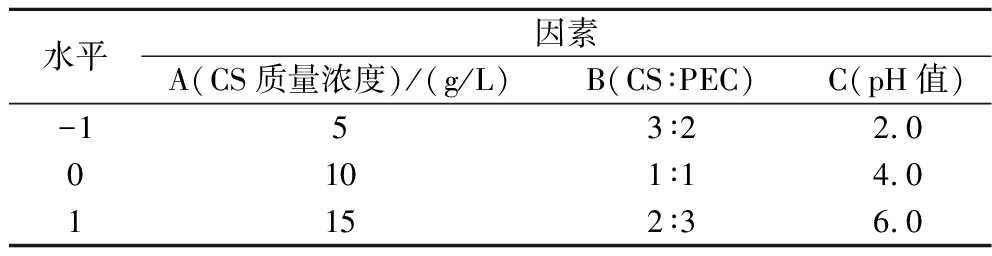
水平因素A(CS质量浓度)/(g/L)B(CS∶PEC)C(pH值)-15 3∶22.00101∶14.01152∶36.0
1.3.6 CS/PEC-牛骨胶原肽纳米颗粒缓释行为研究
参考黄芳丽[26]的方法配制体外模拟胃肠道模拟消化液。模拟胃液(simulated gastric fluid,SGF)的配制:将2 g NaCl充分溶于900 mL蒸馏水中,调节pH至1.2后加3.2 g胃蛋白酶,最后定容至1 000 mL。模拟肠液(simulated gastric fluid, SIF):将6.8 g KH2PO4溶于800 mL蒸馏水中,使用磁力搅拌器使其充分溶解,用0.1 mol/L NaOH溶液调节pH至7.0,加入10 g胰蛋白酶,最后定容至1 000 mL,置于4 ℃下保存,溶液必须现用现配,防止酶失活,从而影响实验结果。
体外模拟消化实验:称取5 g CS/PEC纳米颗粒包埋的牛骨胶原肽加入50 mL SGF溶液,在37 ℃水浴恒温振荡仪中振荡2 h,模拟胃消化。在模拟胃液消化结束后,调节pH至6.8使胃蛋白酶失活,随后添加50 mL SIF溶液,在同一条件下模拟肠消化2 h。整个消化过程中,每隔0.5 h从混合液中取样,并用BCA法测定样品的浓度,以监测消化过程中牛骨胶原肽的保留情况,并按下公式(2)计算保留率[27]:
保留率![]()
(2)
1.4 数据分析
所有实验均设置3个平行组,数据以“平均值±标准差”表示,采用SPSS 26和Design Expert 13.0.5.0软件对实验数据进行统计分析,采用t检验,P<0.05,差异显著;P<0.01,差异极显著。采用Origin 2023软件绘图。
2 结果与分析
2.1 单因素实验
2.1.1 CS质量浓度对CS/PEC-牛骨胶原肽纳米颗粒包埋率的影响
选取1、5、10、15、20 g/L五个不同的CS质量浓度,在PEC质量浓度50 g/L、CS∶PEC质量比为1∶1、pH值为4.0的条件下对牛骨胶原肽进行包埋实验。实验结束后测定牛骨胶原肽包埋率,实验结果如图1-a所示。随着CS质量浓度的增大,牛骨胶原肽包埋率呈先增高后降低的趋势,这与DU等[28]的研究结果类似。当CS质量浓度为10 g/L时,包埋率达最大值(87.4±1.23)%,这意味着体系中CS增多时,CS/PEC纳米颗粒具有更多的与牛骨胶原肽结合的空间位点,表现为增加的包埋率。之后随CS质量浓度的持续增高,牛骨胶原肽包埋率出现降低趋势,这是因为随着CS质量浓度的增大,CS/PEC纳米颗粒产生絮凝[29],同时CS质量浓度过高时,溶液黏度变大,阻碍牛骨胶原肽在CS分子周围的分散运动,最终导致牛骨胶原肽包封率的下降[30]。因此选择CS质量浓度10 g/L进行下一步的实验研究。
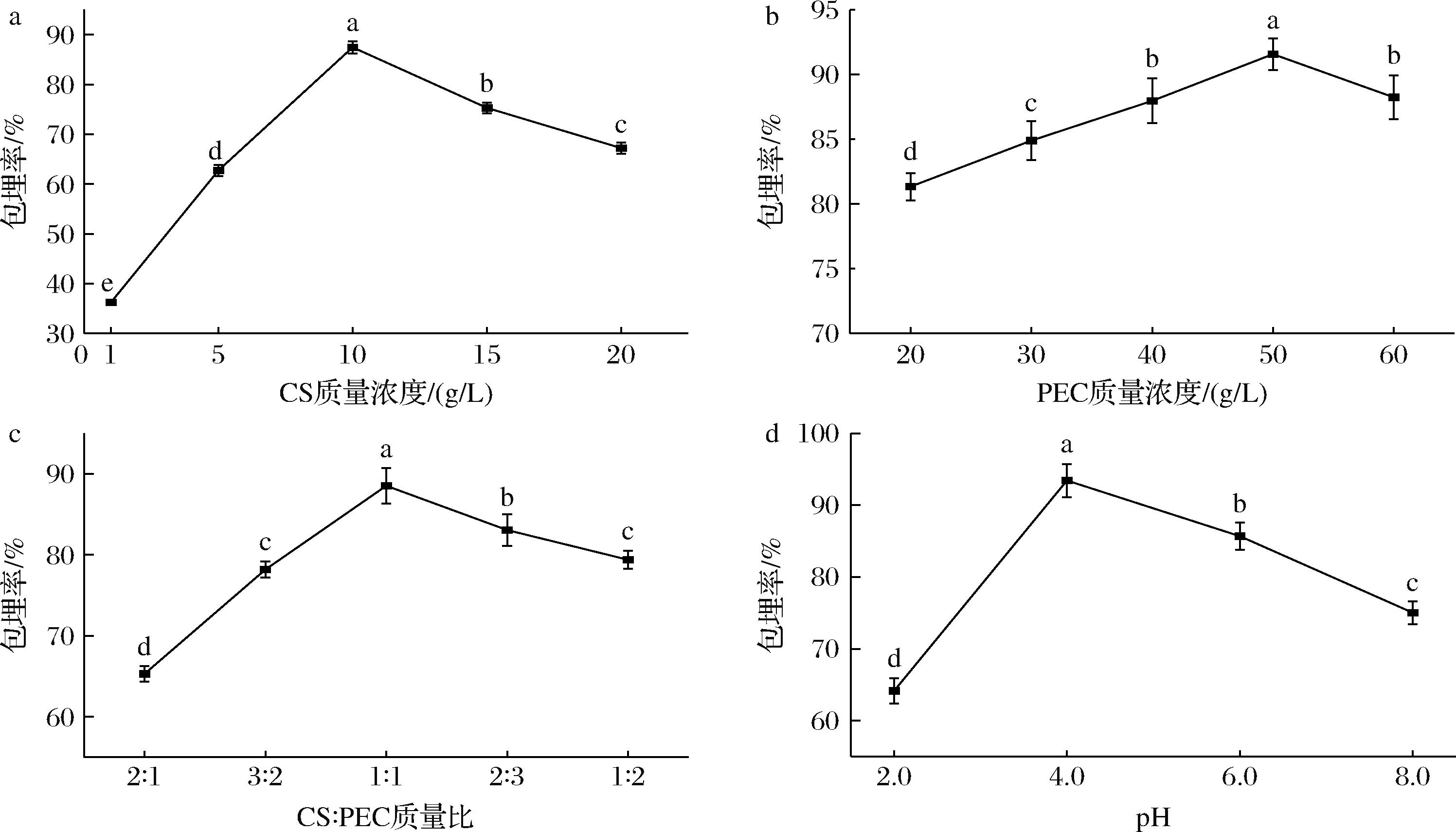
a-CS质量浓度;b-PEC质量浓度;c-CS∶PEC质量比;d-pH
图1 包埋条件对牛骨胶原肽包埋率的影响
Fig.1 Effect of embedding conditions on the embedding rate of bovine bone collagen peptides
注:小写字母表示不同单因素条件下包埋率存在显著性差异(P<0.05)。
2.1.2 PEC质量浓度对CS/PEC牛骨胶原肽纳米颗粒包埋率的影响
设置5个不同的PEC质量浓度(20、30、40、50、60 g/L),在CS质量浓度10 g/L、CS∶PEC质量比为1∶1、pH为4.0的条件下进行牛骨胶原肽的包埋实验。包埋实验结束后测定牛骨胶原肽包埋率,实验结果如图1-b。随着PEC质量浓度增大,牛骨胶原肽包埋率呈先增高后降低的趋势,PEC质量浓度增大至50 g/L时,包埋率达到最大值(91.56±1.21)%。之后随PEC质量浓度的持续增高,牛骨胶原肽包埋率出现降低趋势,这是因为溶液黏度过大,阻碍牛骨胶原肽在溶液中的运动,最终导致牛骨胶原肽包封率的下降。因此选择PEC质量浓度50 g/L进行下一步的实验研究。
2.1.3 CS∶PEC质量比对CS/PEC牛骨胶原肽纳米颗粒包埋率的影响
选取2∶1、3∶2、1∶1、2∶3、1∶2五个不同的CS∶PEC质量比,在CS质量浓度10 g/L、PEC质量浓度为50 g/L、pH为4.0的条件下进行包埋实验。实验结束后测定牛骨胶原肽包埋率,实验结果如图1-c,随着CS∶PEC质量比的增大,包埋率呈现先升高后下降的趋势,在CS∶PEC质量比为1∶1时包埋率达到最大,为(88.93±2.20)%,这是因为此时体系内存在的氨基和羧基能够完全交联,合适的CS∶PEC质量比能提高2种壁材离子交联的强度和稳定性,直接影响纳米颗粒对牛骨胶原肽的包埋率和纳米颗粒性能[31]。
2.1.4 pH值对CS/PEC-牛骨胶原肽纳米颗粒包埋率的影响
选取2.0、4.0、6.0、8.0四个不同的pH值,在CS质量浓度10 g/L、PEC质量浓度为50 g/L、CS∶PEC质量比1∶1的条件下进行包埋实验。pH对包埋率的影响结果如图1-d所示,包埋率随着pH值的升高呈现先升后降的趋势,在pH 4.0时包埋率最高,可达(93.44±2.31)%,这与郑昌亮等[30]的实验结果类似。这是因为随着pH的增大,CS中—NH3+去质子化程度逐渐增大,PEC和牛骨胶原肽通过竞争结合剩余带正电的壳聚糖,在pH值为4.0时所形成的纳米颗粒表面电荷相对稳定,有利于CS和PEC通过离子交联,当pH继续增大时,所形成的交联聚合物表面电荷降低,凝聚影响包埋率的大小[32]。
单因素的实验结果显示,PEC质量浓度对包埋率的影响相对较小,而CS质量浓度、CS∶PEC质量比及pH对包埋率影响更加显著,因此,后续实验选择PEC质量浓度50 g/L作为固定参数,以牛骨胶原肽包埋率为指标,通过改变CS质量浓度、CS∶PEC质量比及pH值对其包埋条件进行响应面优化。
2.2 响应面优化试验
2.2.1 实验设计及实验结果
根据单因素试验结果,以CS质量浓度(A)、CS∶PEC质量比(B)、pH值(C)为自变量,包埋率为因变量进行响应面试验,设计三因素三水平的Box-Behnken实验来寻求制备CS/PEC-牛骨胶原肽纳米颗粒的最优工艺参数。试验设计及结果见表2,方差分析结果见表3。
表2 响应面试验设计及结果
Table 2 Response surface test design and results
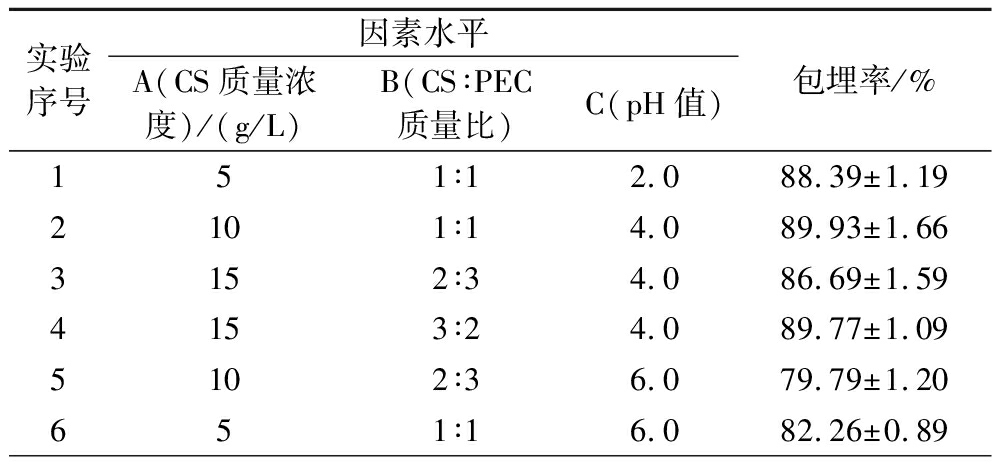
实验序号因素水平A(CS质量浓度)/(g/L)B(CS∶PEC质量比)C(pH值)包埋率/%151∶12.088.39±1.192101∶14.089.93±1.663152∶34.086.69±1.594153∶24.089.77±1.095102∶36.079.79±1.20651∶16.082.26±0.89
续表2
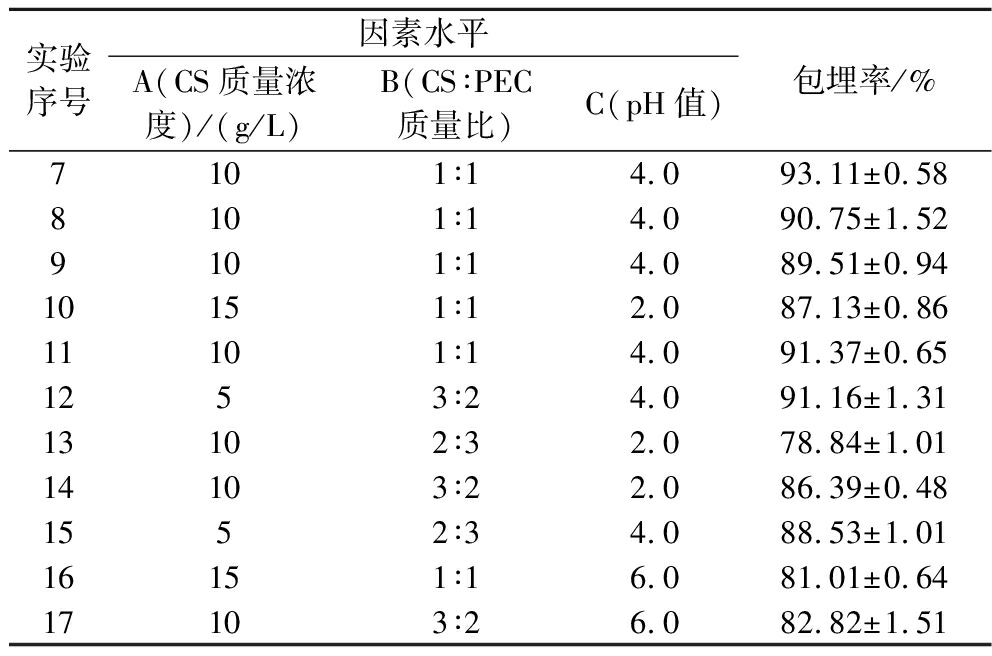
实验序号因素水平A(CS质量浓度)/(g/L)B(CS∶PEC质量比)C(pH值)包埋率/%7101∶14.093.11±0.588101∶14.090.75±1.529101∶14.089.51±0.9410151∶12.087.13±0.8611101∶14.091.37±0.651253∶24.091.16±1.3113102∶32.078.84±1.0114103∶22.086.39±0.481552∶34.088.53±1.0116151∶16.081.01±0.6417103∶26.082.82±1.51
表3 独立变量响应面模型方差分析
Table 3 Independent variable response surface model ANOVA
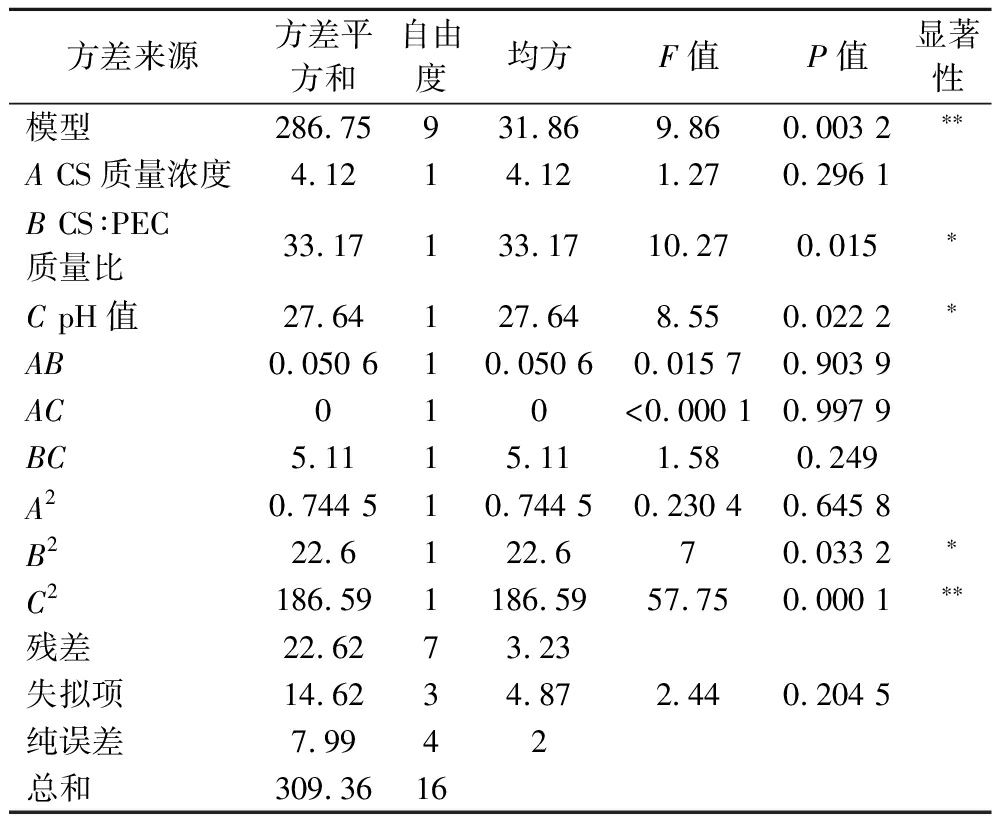
方差来源方差平方和自由度均方F值P值显著性模型286.75931.869.860.003 2∗∗A CS质量浓度4.1214.121.270.296 1B CS∶PEC质量比33.17133.1710.270.015∗C pH值27.64127.648.550.022 2∗AB0.050 610.050 60.015 70.903 9AC010<0.000 10.997 9BC5.1115.111.580.249A20.744 510.744 50.230 40.645 8B222.6122.670.033 2∗C2186.591186.5957.750.000 1∗∗残差22.6273.23失拟项14.6234.872.440.204 5纯误差7.9942总和309.3616
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
2.2.2 模型拟合与方差分析
采用Design Expert13.0.5.0软件中的ANOVA程序对表2中的试验数据进行多元回归拟合,得到CS质量浓度(A)、CS∶PEC质量比(B)和pH值(C)与包埋率(Y)的二次多项回归模型方程:Y=90.93-0.717 5A-2.04B-1.86C-0.112 5AB+0.002 5AC+1.13BC+0.420 5A2-2.32B2-6.66C2。
方差分析(表3)表明,回归模型极显著(F值=9.86,P<0.01),失拟项不显著(F=2.44,P>0.05),拟合系数R2=0.926 9,模型拟合程度比较好,试验误差较小,将此模型和方程用于拟合3因素与牛骨胶原肽的包埋率之间的关系是可行的。
结合显著性检验,比较响应曲面(图2),各因素对包埋率影响程度大小排序依次为B>C>A,即CS∶PEC质量比>pH值>CS质量浓度。CS∶PEC质量比(B)和pH值(C)均与CS/PEC-牛骨胶原肽纳米颗粒的包埋率存在显著的相关性(P<0.05),二次项B2与CS/PEC-牛骨胶原肽纳米颗粒的包埋率存在显著的相关性(P<0.05),二次项C2与CS/PEC-牛骨胶原肽纳米颗粒的包埋率存在极显著的相关性(P<0.01)。以上结果表明,各实验因素与包埋率之间不仅仅是简单的线性关系,而是二次性和交互性关系,3个因素对包埋率均产生影响。
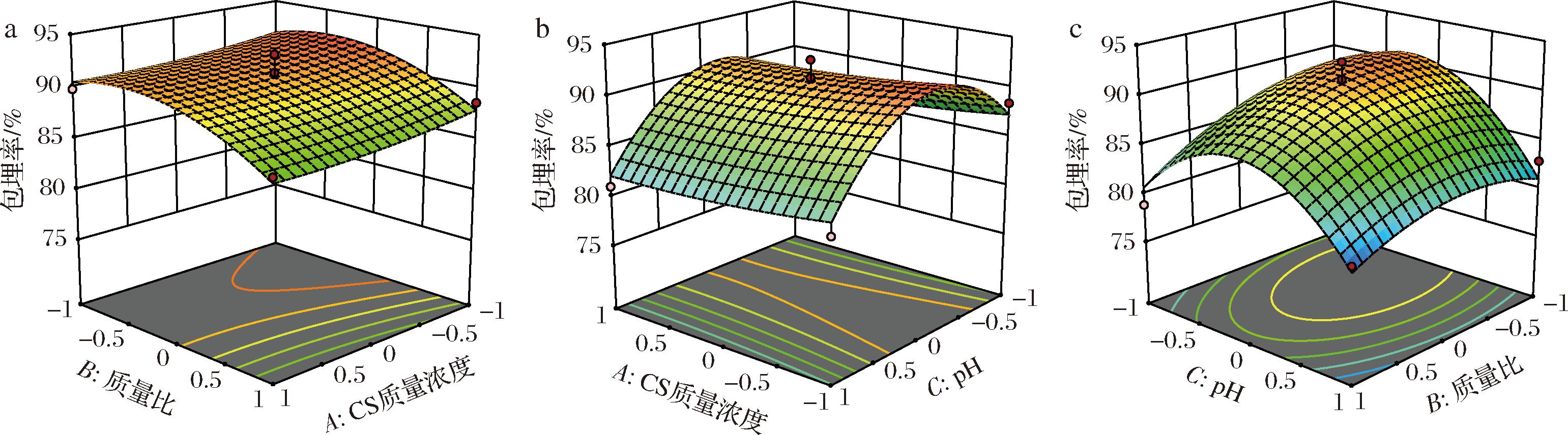
a-CS质量浓度和CS∶PEC质量比;b-CS质量浓度和pH;c-CS∶PEC质量比和pH
图2 响应面图为两两因素交互对包埋率的综合影响
Fig.2 Response surface plots for the combined effect of two-two factor interactions on encapsulation rates
2.2.3 响应面模型验证
Design Expert 13.0.5.0软件分析结果拟给出的制备CS/PEC-牛骨胶原肽纳米颗粒的最优条件为:CS质量浓度13.1 g/L、PEC质量浓度50 g/L、CS∶PEC质量比4∶3和pH值为2.71。考虑到实际操作方便,为验证响应面法所得结果的准确性和可靠性,将工艺参数修正为CS质量浓度13 g/L、PEC质量浓度50 g/L、CS∶PEC质量比4∶3和pH值为3。为了验证模型的有效性,在最优条件进行试验预测,试验重复3次。所得制备载药纳米颗粒的包埋率为(92.56±1.76)%。预测值与实验值之间的误差均小于5%。以上结果说明基于响应面法优化得到的制备CS/PEC-牛骨胶原肽纳米颗粒的工艺参数具有良好的可靠性。
2.3 CS/PEC-牛骨胶原肽纳米颗粒体外缓释性研究
缓释实验能够模拟生物活性物质在人体消化道中的释放情况,可用于衡量生物活性物质在胃肠液中的释放率,这对研究生物活性物质的运送及代谢至关重要,也是衡量纳米颗粒性能及稳定性的评价标准之一[33]。根据肽类易被体内酶水解,在消化系统中停留时间短的特点,本研究选择4 h作为研究时间,采用响应面实验优化后的工艺制备CS/PEC-牛骨胶原肽纳米颗粒,对经CS/PEC纳米颗粒包埋后的牛骨胶原肽进行胃肠液缓释作用研究,结果如图3所示。在体外模拟胃肠消化过程中,相比于相同时间内模拟胃液消化阶段,模拟肠液消化阶段牛骨胶原肽保留率更低,这表明纳米颗粒受模拟肠液影响更大。模拟胃液和模拟肠液消化结束后牛骨胶原肽保留率分别为(96.16±0.76)%和(73.11±1.08)%,在模拟胃液中牛骨胶原肽的保留率显著高于在模拟肠液中。以上实验结果表明,由CS和PEC通过静电离子作用形成的聚合物纳米颗粒,在模拟胃液中对牛骨胶原肽的保护作用显著高于模拟肠液中,有明显的pH响应性。

图3 纳米颗粒包埋的牛骨胶原肽在模拟胃肠道消化中牛骨胶原肽的保留率
Fig.3 Retention of nanoparticle-embedded bovine collagen peptides in simulated gastrointestinal digestion of bovine collagen peptides
注:小写字母表示胃肠道消化过程中牛骨胶原肽保留率存在显著性差异(P<0.05)。
3 结论
本研究以牛骨胶原肽的包埋率为指标,通过单因素试验和响应面试验优化了CS-PEC包埋牛骨胶原肽的工艺,确定了制备CS/PEC-牛骨胶原肽纳米颗粒的最佳制备工艺为CS质量浓度13 g/L、PEC质量浓度50 g/L、CS∶PEC质量比4∶3和pH值为3.0,在此条件下,所得CS/PEC复合纳米材料对牛骨胶原肽的包埋率达(92.56±1.76)%。模拟胃肠缓释实验显示,制备CS/PEC-牛骨胶原肽纳米颗粒显著提高了牛骨胶原肽的胃肠道消化稳定性,并且能够在模拟胃液中较好地保护牛骨胶原肽,并且在模拟肠液中释放,这表明所制备的纳米颗粒缓释性能较好,且具有pH响应型,研究结果为牛骨胶原肽体内递送提供了一定的理论参考。
[1] JIA W, LIU W Y, MI S, et al.Comparison of six methylation methods for fatty acid determination in yak bone using gas chromatography[J].Food Analytical Methods, 2017, 10(11):3496-3507.
[2] KU S K, SEO D W, KIM S I, et al.Antioxidant activities and nutritional properties of Jeonyak prepared with beef bone stock and gelatin[J].Food Science and Biotechnology, 2014, 23(1):81-87.
[3] 张顺亮, 潘晓倩, 成晓瑜, 等.牛骨胶原蛋白源抑菌肽的分离纯化及成分分析[J].肉类研究, 2013, 27(11):33-36.
ZHANG S L, PAN X Q, CHENG X Y, et al.Isolation, purification and compositional analysis of antibacterial peptides from bovine bone collagen[J].Meat Research, 2013, 27(11):33-36.
[4] PEIGHAMBARDOUST S H, KARAMI Z, PATEIRO M, et al.A review on health-promoting, biological, and functional aspects of bioactive peptides in food applications[J].Biomolecules, 2021, 11(5):631.
[5] FU Y, YOUNG J F, RASMUSSEN M K, et al.Angiotensin I-converting enzyme-inhibitory peptides from bovine collagen:Insights into inhibitory mechanism and transepithelial transport[J].Food Research International, 2016, 89:373-381.
[6] 杨玉英. 蚕蛹蛋白源降血脂功能肽的制备及其构效关系研究[D].雅安:四川农业大学, 2014.
YANG Y Y.Preparation and structure-activity relationship of hypolipidemic functional peptides from silkworm Pupa protein[D].Yaan:Sichuan Agricultural University, 2014.
[7] ELAM M L, JOHNSON S A, HOOSHMAND S, et al.A calcium-collagen chelate dietary supplement attenuates bone loss in postmenopausal women with osteopenia:A randomized controlled trial[J].Journal of Medicinal Food, 2015, 18(3):324-331.
[8] GAO S, HONG H, ZHANG C Y, et al.Immunomodulatory effects of collagen hydrolysates from yak (Bos grunniens) bone on cyclophosphamide-induced immunosuppression in BALB/c mice[J].Journal of Functional Foods, 2019, 60:103420.
[9] 李迎楠, 刘文营, 张顺亮, 等.牛骨咸味肽氨基酸分析及在模拟加工条件下功能稳定性分析[J].肉类研究, 2016, 30(1):11-14.
LI Y N, LIU W Y, ZHANG S L, et al.Amino acid composition and stability analysis of salty peptides derived from bovine bone under simulated processing conditions[J].Meat Research, 2016, 30(1):11-14.
[10] SARABANDI K, GHAREHBEGLOU P, JAFARI S M.Spray-drying encapsulation of protein hydrolysates and bioactive peptides:Opportunities and challenges[J].Drying Technology, 2020, 38(5-6):577-595.
[11] 霍艳姣, 王波, 郭珊珊, 等.鱼肉蛋白肽在模拟胃肠消化吸收过程中的抗氧化活性和生物利用度[J].食品工业科技, 2016, 37(6):174-178;186.
HUO Y J, WANG B, GUO S S, et al.Antioxidant activity and bioavailability of the Pacific cod meat peptides during simulated gastrointestinal digestion and absorption[J].Science and Technology of Food Industry, 2016, 37(6):174-178;186.
[12] 张佩, 陈忠琴, 曹文红, 等.牡蛎抗氧化及降糖肽的结构特征及其体外模拟消化特性[J].食品与发酵工业, 2022, 48(21):196-203.
ZHANG P, CHEN Z Q, CAO W H, et al.Structural characteristics of antioxidant and hypoglycemic peptides from oyster (Crassostrea hongkongensis) and their simulated digestive properties in vitro[J].Food and Fermentation Industries, 2022, 48(21):196-203.
[13] WUSIGALE, LIANG L, LUO Y C.Casein and pectin:Structures, interactions, and applications[J].Trends in Food Science &Technology, 2020, 97:391-403.
[14] AUWAL S M, ZAREI M, TAN C P, et al.Enhanced physicochemical stability and efficacy of angiotensin I-converting enzyme (ACE) - inhibitory biopeptides by chitosan nanoparticles optimized using Box-Behnken design[J].Scientific Reports, 2018, 8(1):10411.
[15] 袁靖琳, 陈燏, 韦翠兰, 等.锐孔法制备水牛乳活性肽微胶囊工艺优化及体外释放研究[J].食品工业科技, 2017, 38(8):227-232;238.
YUAN J L, CHEN Y, WEI C L, et al.Optimization of preparation process of buffalo milk active peptides microspheres by piercing method and in vitro releasing behavior of the microcapsules[J].Science and Technology of Food Industry, 2017, 38(8):227-232;238.
[16] LI Z Y, PAULSON A T, GILL T A.Encapsulation of bioactive salmon protein hydrolysates with chitosan-coated liposomes[J].Journal of Functional Foods, 2015, 19:733-743.
[17] 宋丽洁, 郭谦, 李想, 等.两亲性胆酸化壳聚糖微胶囊包埋VA[J].食品科学, 2018, 39(5):121-127.
SONG L J, GUO Q, LI X, et al.Amphiphilic cholic acid-modified chitosan microcapsules as vitamin A carrier[J].Food Science, 2018, 39(5):121-127.
[18] 郑昌亮, 陈梦婷, 汪兰, 等.负载鳙鱼肽的壳聚糖/三聚磷酸钠和壳聚糖/亚麻籽胶复合纳米颗粒的稳定性和生物相容性评价[J].食品科学, 2023, 44(24):34-40.
ZHENG C L, CHEN M T, WANG L, et al.Evaluation of stability and biocompatibility of chitosan/sodium tripolyphosphate and chitosan/flaxseed gum composite nanoparticles loaded with bighead carp peptides[J].Food Science, 2023, 44(24):34-40.
[19] DAS S.Pectin based multi-particulate carriers for colon-specific delivery of therapeutic agents[J].International Journal of Pharmaceutics, 2021, 605:120814.
[20] 裴雪静. 交联叶酸-果胶纳米粒用于胰岛素靶向口服递送的研究[D].长春:东北师范大学, 2019.
PEI X J.Study on cross-linked folic acid-pectin nanoparticles for targeted oral delivery of insulin[D].Changchun:Northeast Normal University, 2019.
[21] MUNARIN F, TANZI M C, PETRINI P.Advances in biomedical applications of pectin gels[J].International Journal of Biological Macromolecules, 2012, 51(4):681-689.
[22] 刘烨, 彭雅琦, 邹艳, 等.负载白藜芦醇的玉米醇溶蛋白-果胶纳米粒抗氧化活性及其对急性炎症小鼠的抗炎作用[J].现代食品科技, 2020, 36(5):7-13.
LIU Y, PENG Y Q, ZOU Y, et al.Antioxidant activity and anti-inflammatory effect on acute inflammatory mice of resveratrol-loaded zein-pectin nanoparticles[J].Modern Food Science and Technology, 2020, 36(5):7-13.
[23] CAO S M, WANG Y, HAO Y J, et al.Antihypertensive effects in vitro and in vivo of novel angiotensin-converting enzyme inhibitory peptides from bovine bone gelatin hydrolysate[J].Journal of Agricultural and Food Chemistry, 2020, 68(3):759-768.
[24] 赵雪. 越橘花色苷稳态化载体的构建及靶向递送研究[D].大连:大连工业大学, 2021.
ZHAO X.Study on the construction of steady-state vectors of Vaccinium uliginosum anthocyanin and its targeted delivery[D].Dalian:Dalian Polytechnic University, 2021.
[25] DU Z Y, LIU J B, ZHANG H, et al.L-Arginine/l-lysine functionalized chitosan-casein core-shell and pH-responsive nanoparticles:Fabrication, characterization and bioavailability enhancement of hydrophobic and hydrophilic bioactive compounds[J].Food &Function, 2020, 11(5):4638-4647.
[26] 黄芳丽. 蒜头果油微胶囊的制备及其性质研究[D].柳州:广西科技大学, 2021.
HUANG F L.Preparation and properties of garlic fruit oil microcapsules[D].Liuzhou:Guangxi University of Science and Technology, 2021.
[27] 王梓郡, 刘慧慧, 麻志刚, 等.糖基化β-伴大豆球蛋白负载提高姜黄素抗氧化及缓释特性[J].食品科学, 2023, 44(8):23-29.
WANG Z J, LIU H H, MA Z G, et al.Enhanced antioxidant activity and sustained-release property of curcumin encapsulated in glycated soy β-conglycinin nanoparticles[J].Food Science, 2023, 44(8):23-29.
[28] DU Z Y, LIU J B, ZHANG T, et al.A study on the preparation of chitosan-tripolyphosphate nanoparticles and its entrapment mechanism for egg white derived peptides[J].Food Chemistry, 2019, 286:530-536.
[29] MARRAS A E, TING J M, STEVENS K C, et al.Advances in the structural design of polyelectrolyte complex micelles[J].The Journal of Physical Chemistry B, 2021, 125(26):7076-7089.
[30] 郑昌亮, 孙洁, 陈梦婷, 等.鳙鱼肽壳聚糖纳米颗粒的制备及体外性质研究[J].食品与发酵工业, 2023, 49(12):17-22.
ZHENG C L, SUN J, CHEN M T, et al.Preparation and in vitro properties of bighead carp peptide chitosan nanoparticles[J].Food and Fermentation Industries, 2023, 49(12):17-22.
[31] NORKAEW O, THITISUT P, MAHATHEERANONT S, et al.Effect of wall materials on some physicochemical properties and release characteristics of encapsulated black rice anthocyanin microcapsules[J].Food Chemistry, 2019, 294:493-502.
[32] CHEN Y H, XUE J Y, WUSIGALE, et al.Carboxymethylation of phytoglycogen and its interactions with caseinate for the preparation of nano complex[J].Food Hydrocolloids, 2020, 100:105390.
[33] 魏显峰, 王海华, 单俊伟, 等.海洋多糖BTH缓释微球的制备及释放特性研究[J].中国海洋药物, 2018, 37(2):52-56.
WEI X F, WANG H H, SHAN J W, et al.Research on preparation and release characteristics of marine polysaccharide BTH sustained release microspheres[J].Chinese Journal of Marine Drugs, 2018, 37(2):52-56.