人口年龄结构对一个国家的经济、社会等多方面具有重大影响,其中人口老龄化已成为全球关注的热点问题之一。预计到2050年,年龄在60岁以上的人口将占世界总人口的22%,为了解决人力资源溃乏和老人医药费用难题,抗衰老和抗氧化功能性成分研究成为了食药领域的研究热点[1]。研究显示,各种天然植物的黄酮类提取物因具有抗衰老和抗氧化活性效果,且其成分安全,已受到了广泛研究。
银杏(Ginkgo biloba L.)是一种古老的重要经济树木,在我国资源丰富,广范分布于我国22个省、自治区和直辖市[2]。目前,对银杏的功能性成分研究主要集中在叶和果实,银杏叶产量大,且研究发现富含黄酮类化合物、萜内酯化合物、甾类化合物和多糖等多种生物活性成分,具有很高的食药开发利用价值[3]。已有许多学者研究发现,银杏叶黄酮类化合物可有效清除DPPH自由基等抗氧化活性,但有关利用模式生物秀丽线虫全面评价银杏叶黄酮提取物对线虫抗氧化和抗衰老作用效果的研究报道较少[4]。
秀丽隐杆线虫作为一种理想的典型模式生物,具有成本低、易培养、世代短、子代多,信号通路和基因同人类高度相似等诸多优点,被广泛应用于遗传生物学、基因功能、衰老、药物筛选、食品营养评价等众多领域[5]。本文在对银杏叶进行黄酮提取和成分分析的基础上,通过测定银杏叶黄酮提取物对模式生物秀丽线虫的寿命、运动能力、生殖能力、吞咽能力、急性热应激能力、急性氧化应激能力、体内活性氧(reactive oxygen species,ROS)和脂褐素积累等指标的影响,全面评价银杏叶黄酮提取物对线虫抗衰老和抗氧化作用效果,以期为全面认识银杏叶黄酮类物质的功效作用和深入开发利用提供科学基础。
1 材料与方法
1.1 材料与试剂
N2野生型秀丽隐杆线虫和大肠杆菌OP50尿嘧啶合成缺陷菌株由东南大学提供。
银杏叶,安徽名枕生物科技有限公司;NaCl、MgSO4,成都市科隆化学品有限公司;NaClO,重庆博艺化学试剂有限公司;NaOH,成都市科龙化工试剂厂;芦丁标准品(纯度≥98%),北京北方伟业计量技术研究院;色谱柱ACQUITY UPLCTM BEH C1(8 100 mm×2.1 mm, 1.8 μm),美国沃特世公司。
1.2 仪器与设备
CLF-04密封型手提式中药粉碎机,浙江省温岭市创立药材机械厂;YRE-2000 A旋转蒸发器,巩义市予华仪器有限责任公司;Xevo TQ-ST三重四级杆质谱仪,美国沃特世公司;UV-1200紫外可见分光光度计,上海美谱达仪器有限公司;BX51荧光显微镜,日本奥林巴斯公司;FD-1A-50真空冷冻干燥机,博医康(北京)仪器有限公司。
1.3 实验方法
1.3.1 黄酮提取物的制备
将银杏叶60 ℃干燥24 h,粉碎后60目过筛,所得干粉常温保存。取20 g银杏叶干粉,加入200 mL体积分数为70%的乙醇溶液,在圆底烧瓶中80 ℃回流2 h,然后6 000 r/min离心10 min,上清液于60 ℃旋转蒸发至原体积的1/10[6]。浓缩滤液置-80 ℃冷冻12 h,然后真空冷冻干燥获得粉末状银杏叶黄酮提取物,称量计算得率。
1.3.2 提取物总黄酮的测定
取50 mg黄酮提取物于100 mL容量瓶中,加适量蒸馏水,超声波溶解,定容。取0.1 mL溶解液于5 mL比色管中,先加0.2 mL 50 g/L的NaNO2溶液,混匀静置6 min,再加0.2 mL 100 g/L的Al(NO3)3溶液,混匀静置6 min,最后加2 mL 40 g/L的NaOH溶液,用蒸馏水定容至5 mL,混匀静置15 min。用紫外分光光度法测其510 nm波长的吸光度[7]。
取25 mg芦丁标准品溶于适量无水甲醇中,超声溶解,转移至50 mL容量瓶中,定容避光保存。分别取0.1、0.2、0.3、0.4 mL芦丁标准溶液于5 mL比色管中,按照上述方法进行测定,得芦丁标准曲线回归方程,并计算提取物中总黄酮的含量。
1.3.3 黄酮提取物成分分析
采用超高效液相色谱串联三重四级杆质谱法(ultra-high performance liquid chromatography tandem triple quadrupole mass spectrometry,UPLC-MS/MS)[8]。以甲醇作为溶剂,以0.1%甲酸乙腈(A)-0.1%甲酸水(B)为流动相,流速为0.6 mL/min,进样量为1.0 μL,柱温为40 ℃,多反应监测模式测定银杏叶黄酮提取物的组成成分。
1.3.4 提取物体外抗氧化活性的测定
以维生素C为阳性对照,采用分光光度法、ABTS法和邻二氮菲-Fe2+氧化法分别测定银杏叶黄酮提取物对DPPH自由基、ABTS阳离子自由基和羟自由基的清除能力,具体测定方法见参考文献[9-10]。
1.3.5 秀丽线虫的培养
挑取一块线虫保存培养基,倒扣于有大肠杆菌OP50的新NGM培养基上,20 ℃倒置培养24 h,收获线虫。
1.3.6 秀丽线虫的同步化
将线虫培养至产卵期,用适量M9缓冲液将线虫洗下收集于1.5 mL离心管,自然沉降5 min,吸去上清液,再用M9缓冲液洗涤3次。向离心管加1 mL线虫裂解液(100 g/L NaClO与1 mol/L NaOH 1∶1(mL∶mL)混合),裂解5~8 min,用M9缓冲液冲洗3次。将洗涤后的虫卵置于M9缓冲液中20 ℃孵化48 h,即得同步化的L4期线虫。
1.3.7 寿命的测定
将银杏叶黄酮提取物配制成高(800 mg/mL)、中(500 mg/mL)、低(200 mg/mL)3个质量浓度,以蒸馏水为空白对照。
将30条同步化的L4期线虫置于加有200 μL不同质量浓度银杏叶黄酮提取物和空白对照的食物板(加有200 μL OP50的NGM培养基)上,倒置,20 ℃作用24 h。将暴露后的线虫挑至寿命板(加有20 μL OP50的NGM培养基)上,每组设3个重复。此时记为第0天,后每24 h转板1次,并记录线虫数量,直至线虫全部死亡。
1.3.8 运动行为的测定
用500 mg/mL的中质量浓度银杏叶黄酮提取物饲喂线虫,暴露方法同上。将暴露后的线虫挑至加有适量M9缓冲液的空白NGM培养基上,再转板至另一空白NGM培养基上,以线虫身体完成一次正弦S型曲线为身体弯曲1次,头部从一侧摆至另一侧为头部摆1次,测定20 s内弯曲和摆动次数[11]。
1.3.9 生殖能力的测定
以世代时间、后代数目和子宫内卵数3个指标作为线虫生殖能力的衡量标准[12]。按1.3.6节的方法将3个不同质量浓度银杏叶黄酮提取物作用后的线虫挑至新的NGM培养基,用体式显微镜观察和记录第一颗卵产下的时间,以及由第一颗卵发育成的线虫产下第一颗卵的世代时间;记录线虫产卵数目时,每12 h换1次板,直至产卵完毕,统计后代数;记录子宫内卵数时,需加入线虫裂解液,静置5~7 min,统计裂解出的卵数量。
1.3.10 吞咽能力的测定
按1.3.6节方法将线虫在3个不同浓度银杏叶黄酮提取物中培养24 h,然后将其挑至寿命板,此时记为第0天,以后每24 h换1次板,分别在第2、4、6、8、10天观察和记录线虫在30 s内的吞咽次数[13]。
1.3.11 急性热应激的测定
取500 μg/mL的银杏叶黄酮提取物溶液200 μL于食物板上,对照组加等量蒸馏水,在超净台内吹干,挑取30条同步化的L 4期线虫放入培养基,20 ℃培养24 h后,转入35 ℃培养箱进行急性热应激,每隔1 h统计线虫死亡数,直至全部死亡[14]。
1.3.12 急性氧化应激的测定
用H2O2测定线虫的急性氧化应激能力[15]。取500 μg/mL的银杏叶黄酮提取物溶液200 μL于食物板上,空白组加等量蒸馏水,挑取30条同步化的L 4期线虫放入培养基,20 ℃培养24 h后,向培养基中加入200 μL 30 mmol/L的H2O2,每隔1 h统计线虫死亡数量,直至全部死亡。
1.3.13 体内活性氧水平的测定
ROS水平的测定采用2,7-二氯二氢荧光素乙酰乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针法[16]。按1.3.6节方法将线虫在3个不同浓度银杏叶黄酮提取物中培养24 h,后收集于EP管中。用M9缓冲液洗涤并弃上清液,每管加入0.1 μL的活性氧DCFH-DA溶液,置于37 ℃培养箱反应3 h。用荧光显微镜测定荧光值(激发波长488 nm,发射波长525 nm),用Image-Pro Plus 6.0软件分析荧光强度,每组随机抽取20只线虫进行成像。
1.3.14 体内脂褐素积累的测定
秀丽线虫体内脂褐素积累的测定参照文献[17]进行,按1.3.6节方法将线虫在3个不同质量浓度银杏叶黄酮提取物中20 ℃培养5 d,用2 g/L叠氮化钠溶液麻醉线虫,并将其放置在20 g/L琼脂糖垫上。用荧光显微镜在520 nm/600 nm(激发/发射)处测肠道脂褐素荧光,用Image-Pro Plus 6.0软件分析荧光强度,每组随机抽取20只线虫进行成像。
1.3.15 数据处理与分析
用SPSS 23.0进行数据处理和分析,用ANOVA方差分析进行显著性分析,*P<0.05,**P<0.01,***P<0.001。
2 结果与分析
2.1 银杏叶黄酮提取物的得率与含量
经测得银杏叶黄酮提取物平均得率为(8.02±1.35)%,芦丁标准曲线回归方程为Y=1.922x+0.033(R2=0.994 8),总黄酮的平均含量为(73.68±17.19) mg/g。
2.2 银杏叶黄酮提取物的主要成分
用UPLC-MS/MS从银杏叶黄酮提取物中共检测出107种黄酮类化合物,归属10种不同类型的黄酮,见表1。
表1 UPLC-MS/MS鉴定出的银杏叶黄酮组成成分
Table 1 Flavonoid components of Ginkgo biloba leaves identified by UPLC-MS/MS

序号分类种数物质名称1黄酮醇43杨梅素-3-O-葡萄糖苷∗、异鼠李素-3-O-芸香糖苷-4′-O-葡萄糖苷∗、山奈酚-3-O-新橙皮糖苷-7-葡萄糖苷、3,5,7,4′四羟基-8-甲氧基黄酮-3-葡萄糖苷-7-鼠李糖苷∗、槲皮素-3-O-新橘皮糖苷∗、异鼠李素-7-O-葡萄糖苷(蔓菁苷)∗、鼠李素3-O-葡萄糖苷∗、6-羟基山奈酚-7,6-O-二葡萄糖苷、华良姜素∗、异鼠李素-3-O-[6″-对香豆酰葡萄糖基-(1->2)-O-鼠李糖苷]、异鼠李素-3,7-O-二葡萄糖苷、槲皮素-O-鼠李糖苷-O-葡萄糖苷-O-鼠李糖苷-O-葡萄糖苷、槲皮素-O-鼠李糖苷-O-葡萄糖苷-O-戊糖苷、槲皮素∗、山奈酚-3-O-刺槐糖苷-7-O-鼠李糖苷(刺槐苷)∗、山奈酚-3-O-新橙皮糖苷∗、异鼠李素-3-O-新橙皮糖苷∗、柽柳素∗、山奈酚-3-O-(6″-丙二酰)半乳糖苷∗、山奈酚-3-O-(6″-丙二酰)葡萄糖苷∗、槲皮素-O-芸香苷-葡萄糖苷∗、3,7-二-O-甲基槲皮素、山奈酚、山奈酚-3-O-(6″-O-乙酰)葡萄糖苷、6-甲氧基槲皮素∗、6-羟基山奈酚-3,6-O-二葡萄糖苷、西伯利亚落叶松黄酮∗、杨梅素-3-O-半乳糖苷∗、槲皮素-3-O-半乳糖-(2→1)-芹糖苷∗、槲皮素-3-O-桑布双糖苷∗、槲皮素-3-O-木糖基-(1→2)-半乳糖苷∗、槲皮素-3-O-(6″-O-乙酰)-半乳糖苷、槲皮素-O-阿魏酰戊糖苷、丁香亭、8-甲氧基山奈酚-7-O-鼠李糖苷∗、槲皮素-7-O-(6″-O-丙二酰基)-葡萄糖苷、桔皮素、异鼠李素-3-O-(6″-乙酰葡萄糖苷)、山奈酚-3-O-槐三糖苷∗、槲皮素-3-O-阿拉伯糖苷(番石榴苷)、槲皮素-3-O-(2″-O-乙酰基)-葡萄糖醛酸、槲皮素-3-O-甲醚、槲皮素-5-O-葡萄糖醛酸苷2黄酮33槲皮素-3-O-(2-O-鼠李糖酰)-半乳糖苷∗、金合欢素∗、芹菜素∗、苜蓿素(麦黄酮)∗、棕矢车菊素∗、3,5-二甲基槲皮素、槲皮素-3-O-葡萄糖苷、木犀草素-7-O-葡萄糖苷(木犀草苷)∗、木犀草素∗、山奈酚-4′-O-葡萄糖苷∗、木犀草素-3′-O-葡萄糖苷∗、金合欢素-7-O-半乳糖苷∗、山奈酚-3-O-[6″″-对香豆酰葡萄糖基-(1→2)-鼠李糖苷]、槲皮素-3-O-[6‴-O-对酰基-β-D-葡萄糖基-(1→2)-α-L-鼠李糖苷]、西伯利亚落叶松黄酮-3-O-葡萄糖苷、五羟黄酮、芹菜素-7,4′-二甲醚、木犀草素-7-O-芸香糖苷-5-O-鼠李糖苷、杨芽黄素、山奈酚-3-O-(6‴-鼠李糖基-2‴-葡萄糖基-葡萄糖苷)(山茶苷 A)、牡荆素-2″-O-(6‴-(E)-对香豆酰基)葡萄糖苷-4′-O-葡萄糖苷异构体1、木犀草素-7-O-(2″-鼠李糖基)芸香糖苷∗、川陈皮素、苜蓿素-O-葡萄糖二酸、苜蓿素-7-O-葡萄糖苷、香叶木素-7-O-半乳糖苷、香叶木苷∗、橙皮素-7-O-葡萄糖苷、槲皮素-3-O-葡萄糖醛酸苷、泽兰黄酮、4-羟基黄酮-7-O-葡萄糖醛酸苷、香叶木素-7-O-葡萄糖醛酸苷∗、3,5-二甲基槲皮素
续表1

序号分类种数物质名称3花青素10矢车菊素-3-O-对-香豆酰基槐糖苷-7-O-葡萄糖苷、飞燕草素-3-O-对香豆酰芸香糖苷-5-O-葡萄糖苷∗、矢车菊素-3-O-对香豆酰芸香糖苷-5-O-葡萄糖苷、矢车菊素-3-O-芸香糖苷、矢车菊素-O-丁香酸、牵牛花素-3-O-对香豆酰鼠李糖苷-5-O-葡萄糖苷、飞燕草素-3-O-(6″-对香豆酰葡萄糖苷)、牵牛花素-3-O-对香豆酰芸香糖苷-7-O-葡萄糖苷、天竺葵素-3-O-芸香糖苷、锦葵色素3-O-葡萄糖苷4黄烷醇类7表儿茶素、儿茶素、没食子儿茶素∗、表没食子酸儿茶素∗、阿夫儿茶精、没食子儿茶素-没食子儿茶素、表儿茶素苷5异黄酮5鹰嘴豆素7-O-葡萄糖苷(印度黄檀苷)∗、5,7,4′-三羟基-6,8-二甲氧基异黄酮-7-O-半乳糖苷∗、5,4′-二羟基异黄酮-7-O-半乳糖苷∗、5,7,4′-三羟基异黄酮-7-O-半乳糖苷∗、次野鸢尾黄素6二氢黄酮3柚皮素∗、桃皮素(5,3′-二羟基-7,4′-二甲氧基黄烷酮)、3,3′,5-三羟基-4′,7-二甲氧基黄烷酮、圣草酚-7-O-葡萄糖苷7双黄酮2金松双黄酮、罗汉松黄酮8黄酮碳糖苷2异柚葡萄糖苷∗、橙皮素-6-C-葡萄糖苷-7-O-葡萄糖苷9二氢黄酮醇1二氢山奈酚(香橙素)10查耳酮1根皮素
注:*为主要成分。
2.3 提取物体外抗氧化活性的测定
相同质量浓度下,银杏叶黄酮提取物的DPPH自由基清除效果与阳性对照维生素C相当,对ABTS阳离子自由基的清除效果略弱于阳性对照维生素C(P<0.01),而对羟自由基的清除效果要高于维生素C(P<0.001),见表2。结果表明,银杏叶黄酮具有较强的体外抗氧化能力。
表2 银杏叶黄酮提取物的自由基清除率
Table 2 Free radical clearance of flavonoids from G. biloba leaves
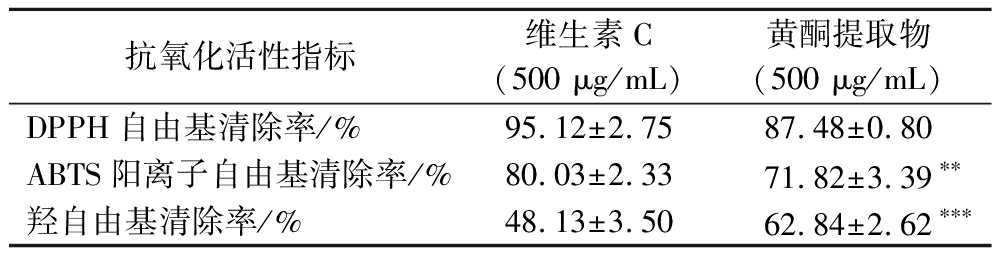
抗氧化活性指标维生素C(500 μg/mL)黄酮提取物(500 μg/mL)DPPH自由基清除率/%95.12±2.75 87.48±0.80 ABTS阳离子自由基清除率/%80.03±2.33 71.82±3.39∗∗羟自由基清除率/%48.13±3.50 62.84±2.62∗∗∗
注:**,***表示与阳性对照(维生素C)相比,有显著性差异(**P<0.01,***P<0.001)。
2.4 银杏叶黄酮提取物对线虫寿命的影响
寿命实验发现,对照组线虫平均寿命为11 d,而实验组线虫平均寿命能达到15 d。500 mg/mL和800 mg/mL的银杏叶黄酮提取物对线虫的寿命均有显著的延长作用(P<0.001),寿命平均延长了36.3%,且延长时间与黄酮提取物质量浓度呈正相关,见图1。

a-线虫寿命曲线;b-线虫的平均寿命
图1 银杏叶黄酮提取物对线虫寿命的影响
Fig.1 Effects of flavonoid extracts from G. biloba leaves on the longevity of nematodes
注:*表示差异显著(*为P<0.05,**为P<0.01和***为P<0.001)(下同)。
2.5 银杏叶黄酮提取物对线虫运动能力的影响
对线虫身体弯曲和头部摆动次数测定发现,实验组线虫的身体弯曲和头部摆次数显著高于对照组(P<0.001),分别提高了33.3%和6.3%,见图2。结果表明,500 mg/mL银杏叶黄酮提取物能显著提高线虫的运动能力。
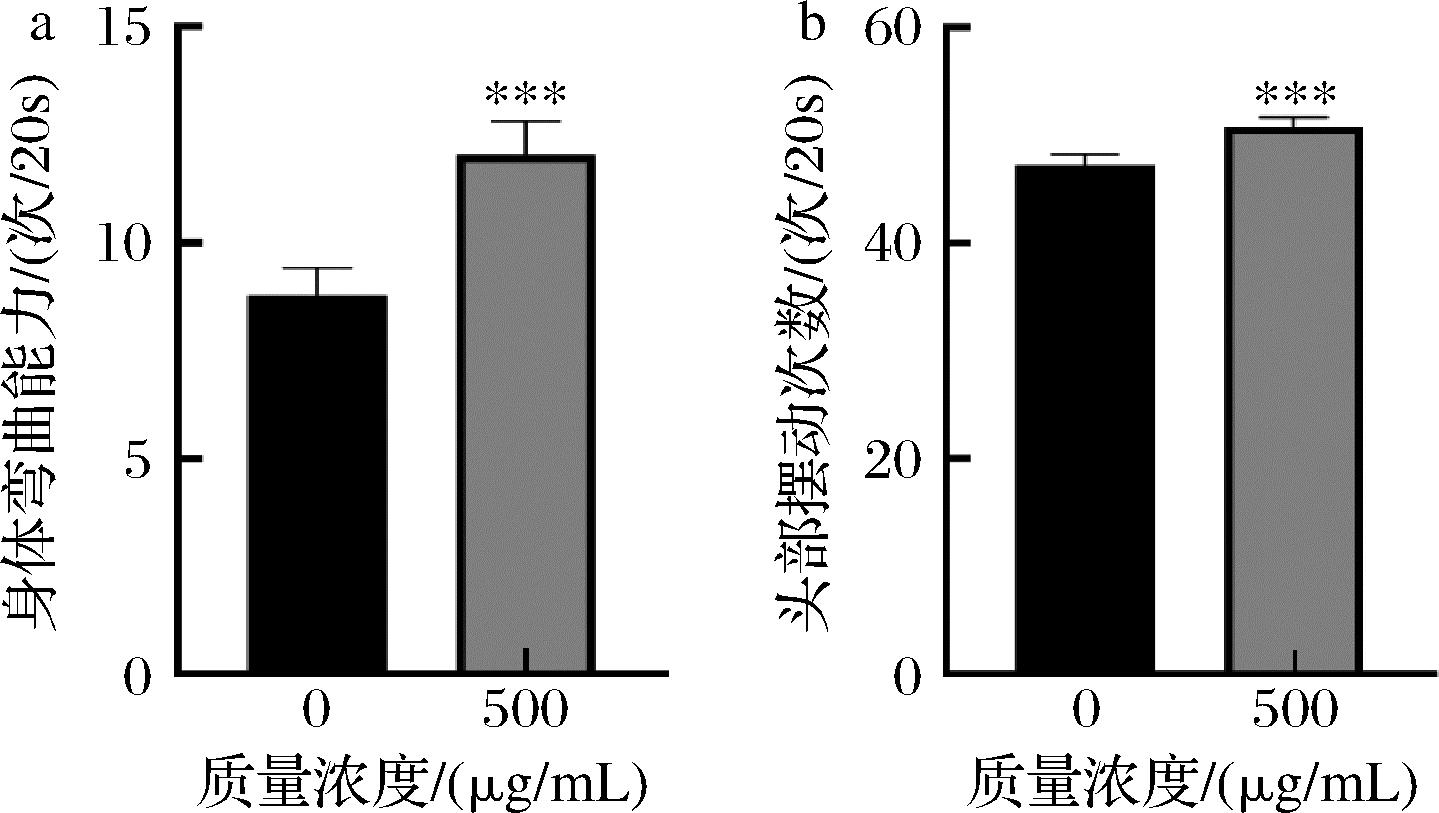
a-提取物对线虫身体弯曲次数的影响;b-提取物对线虫头部摆动次数的影响
图2 银杏叶黄酮提取物对线虫运动行为的影响
Fig.2 Effects of flavonoid extracts from G. biloba leaves on motor behavior of nematodes
2.6 银杏叶黄酮提取物对线虫生殖能力的影响
生殖能力的测定主要是通过判断黄酮提取物对线虫子代的影响,从而来评判样品在发挥抗氧化作用的同时是否会对秀丽隐杆线虫的子代产生抑制作用。
与对照组相比,银杏叶黄酮提取物能显著缩短线虫亲本(P0)和子代(F1)的世代时间(P<0.001),显著增加线虫亲本(P0)和子代(F1)的后代数目和子宫卵数目(P<0.001),且中高质量浓度更加明显,见图3。结果表明,银杏叶黄酮提取物能显著降低线虫世代时间和增强线虫的繁殖能力,且呈一定浓度依赖性。
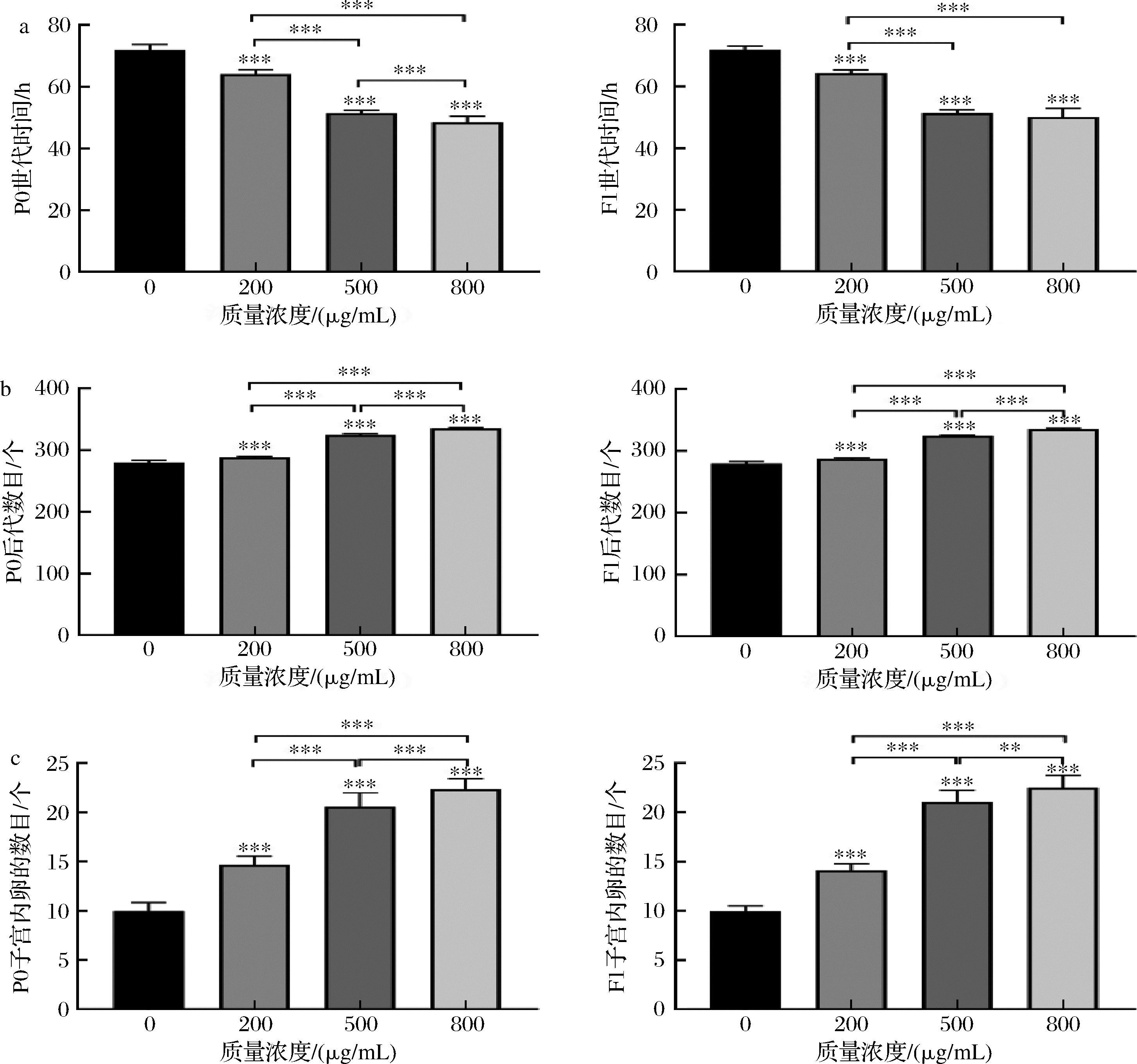
a-提取物对线虫世代时间的影响;b-提取物对线虫后代数目的影响;c-提取物对线虫子宫内卵的数目的影响
图3 银杏叶黄酮提取物对线虫生殖能力的影响
Fig.3 Effects of flavonoid extracts from G. biloba leaves on reproductive ability of nematodes
2.7 银杏叶黄酮提取物对线虫吞咽能力的影响
较对照组,不同质量浓度的银杏叶黄酮提取物能显著提高线虫的吞咽频率(P<0.001),不同质量浓度间差异不显著(P>0.05),见图4。结果表明,银杏叶黄酮提取物能显著提高线虫摄食能力。
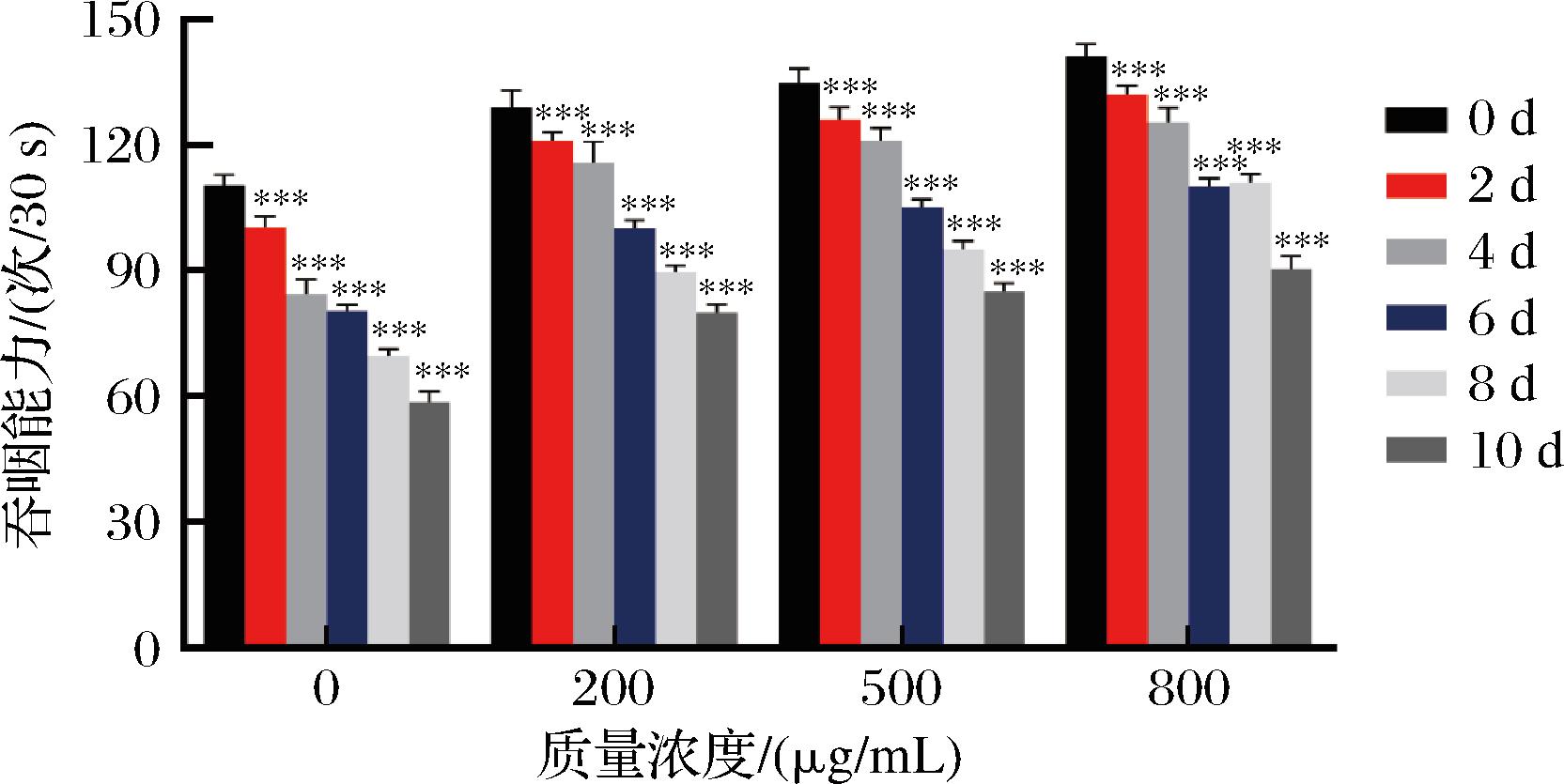
图4 银杏叶黄酮提取物对线虫吞咽能力的影响
Fig.4 Effect of flavonoid extracts from G. biloba leaves on the swallowing ability of nematodes
2.8 银杏叶黄酮提取物对线虫急性热应激的影响
线虫的衰老受遗传、环境等多种因素影响,异常的环境条件可能会使线虫体内各种代谢失衡,从而加速线虫的衰老甚至死亡。与对照组相比,500 mg/mL银杏叶黄酮提取物能提高线虫在35 ℃下的存活率(图5),平均寿命时间可延长18.8%(P<0.001),说明银杏叶黄酮提取物能增强线虫的急性热应激能力。
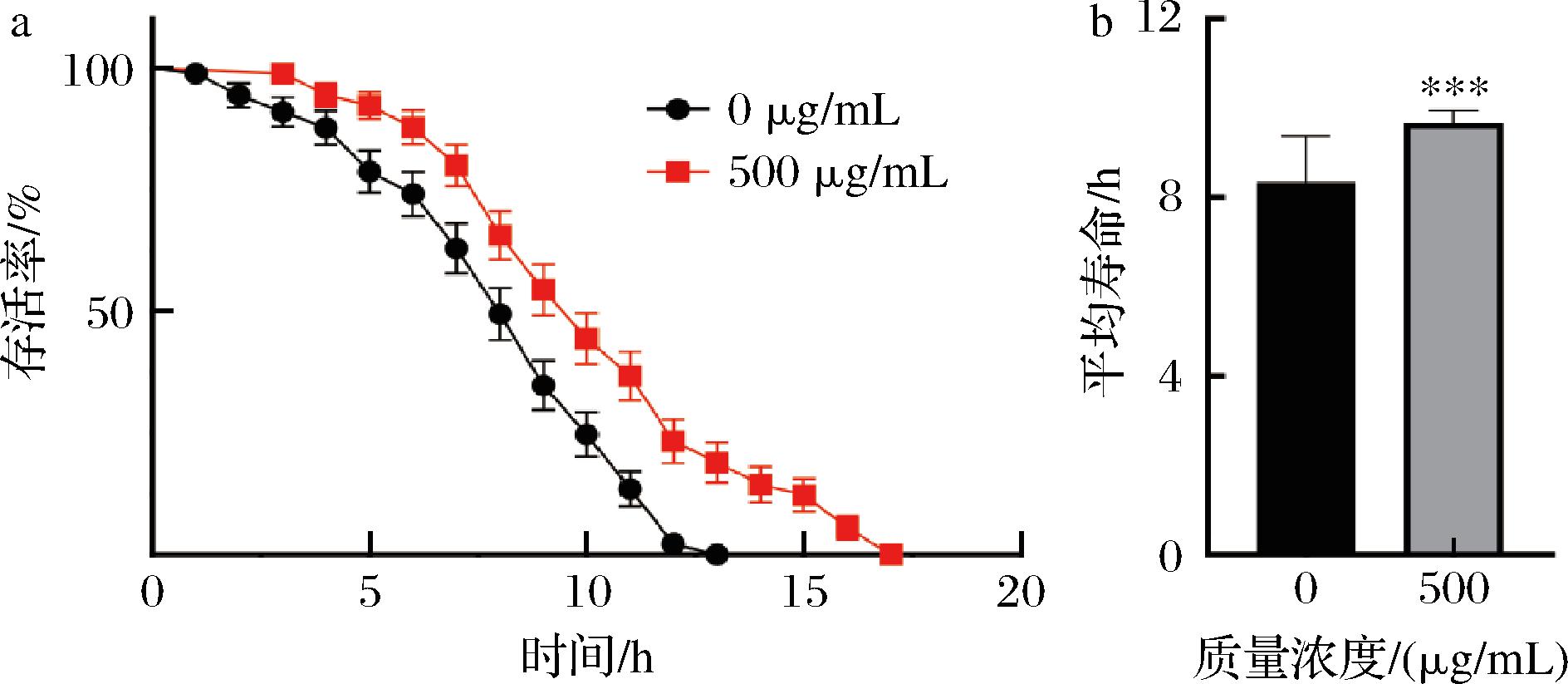
a-线虫在急性热应激下的寿命曲线;b-线虫在急性热应激下的平均寿命
图5 银杏叶黄酮提取物对线虫急性热应激能力的影响
Fig.5 Effects of flavonoid extracts from G. biloba leaves on acute heat stress of nematodes
2.9 银杏叶黄酮提取物对线虫急性氧化应激的影响
在30 mmol/L的H2O2溶液中急性暴露下,对照组线虫于8 h后全部死亡,平均寿命为5 h,而实验组线虫于11 h后全部死亡,平均寿命为6 h。实验组平均寿命较对照组延长了20%,见图6。结果表明,银杏叶黄酮提取物能显著提高线虫抗急性氧化能力(P<0.001)。
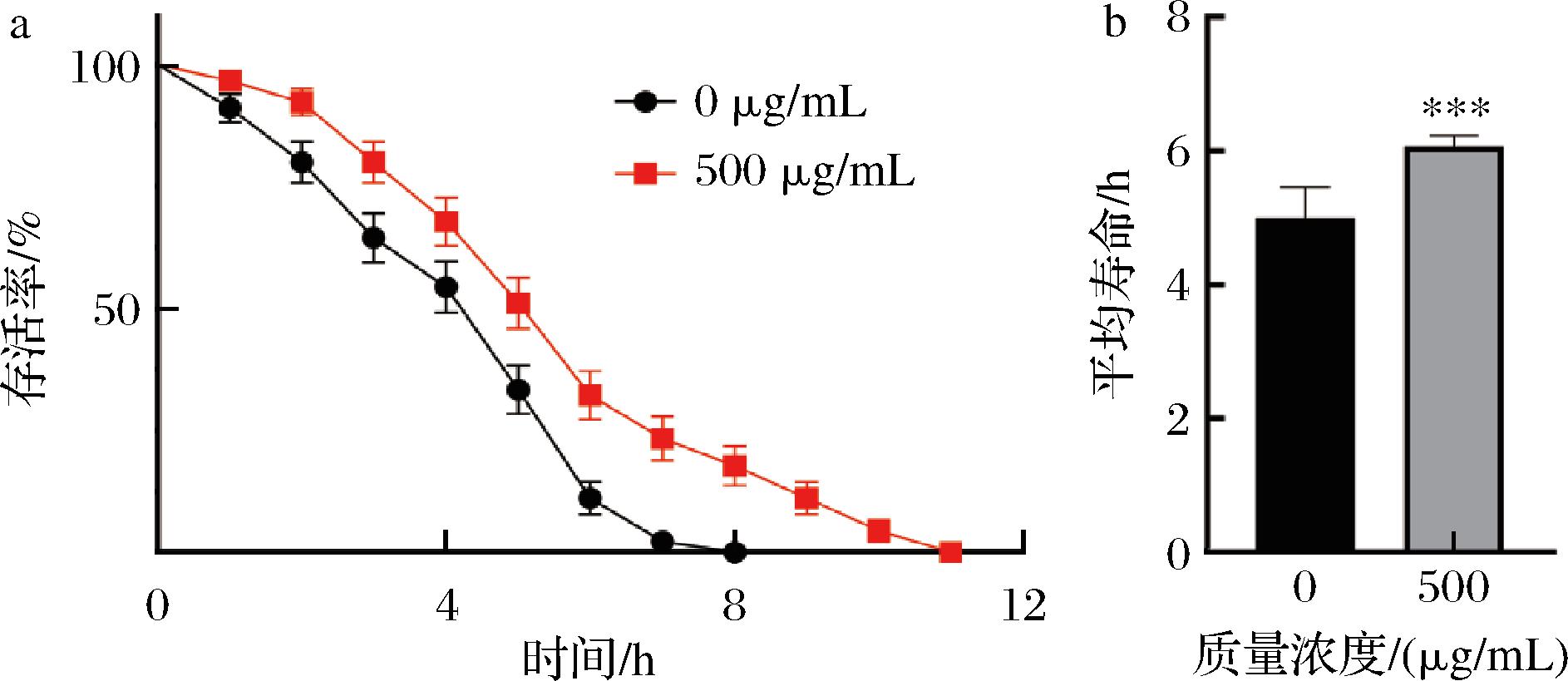
a-线虫在急性氧化应激下的寿命曲线;b-线虫在急性氧化应激下的平均寿命
图6 银杏叶黄酮提取物对线虫急性氧化应激能力的影响
Fig.6 Effects of flavonoid extracts from G. biloba leaves on acute oxidative stress of nematodes
2.10 银杏叶黄酮提取物对线虫体内ROS水平的影响
与对照组相比,200、500和800 mg/mL的银杏叶黄酮提取物能显著降低线虫体内ROS水平(P<0.001),中高质量浓度的效果更明显,见图7。结果表明,银杏叶黄酮提取物可显著减少线虫体内ROS积累,且与质量浓度呈正相关。

a-线虫ROS积累荧光图;b-线虫ROS荧光水平
图7 银杏叶黄酮提取物对线虫体内活性氧水平的影响
Fig.7 Effects of flavonoid extracts from G. biloba leaves on reactive oxygen species in nematodes
2.11 银杏叶黄酮提取物对线虫体内脂褐素积累情况的影响
与对照组相比,200、500和800 mg/mL的银杏叶黄酮提取物能显著降低体内脂褐素水平(P<0.001),中高质量浓度的降低效果更明显,见图8。结果表明,银杏叶黄酮提取物能显著抑制线虫体内脂褐素的积累。
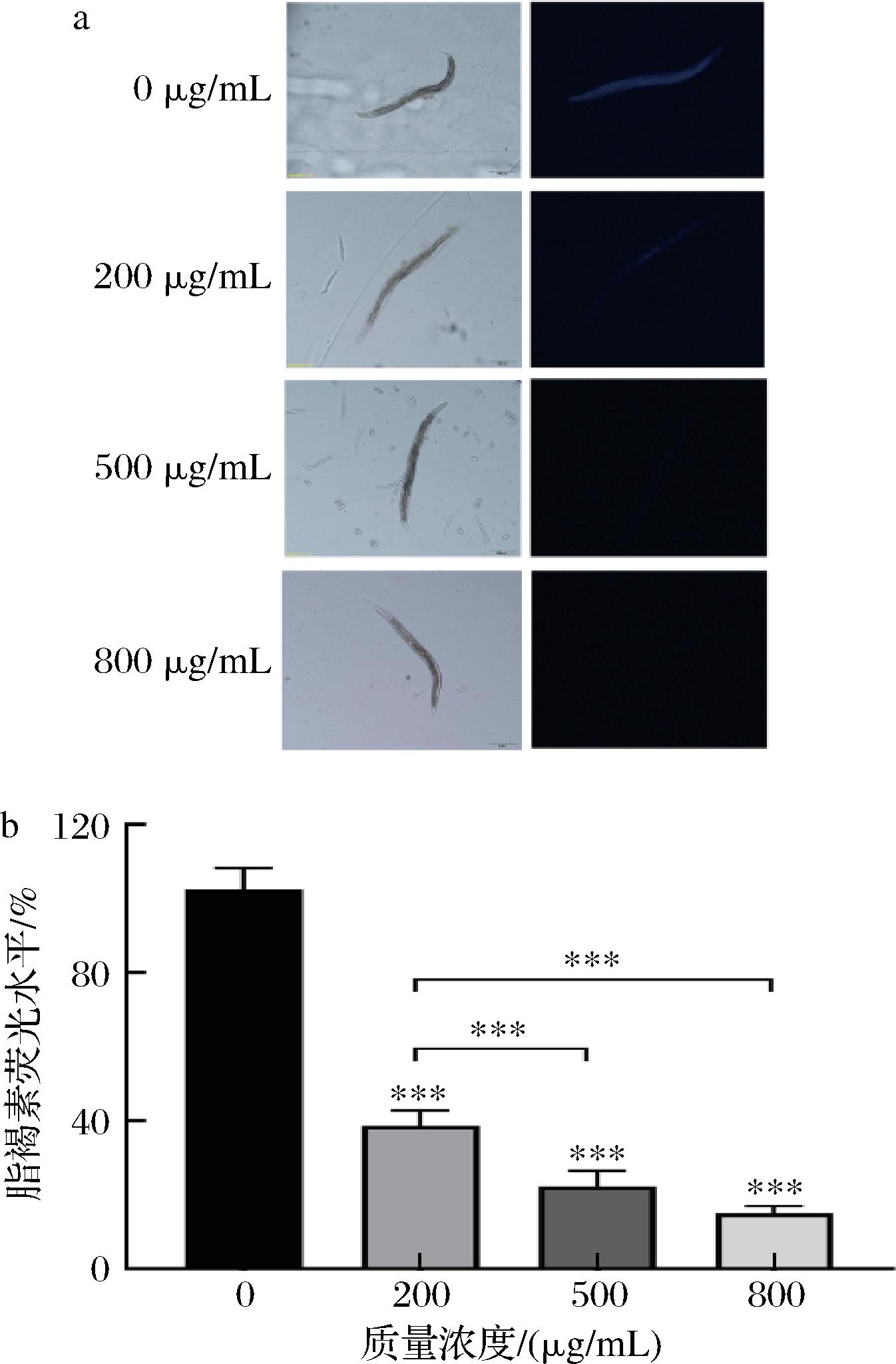
a-线虫脂褐素积累荧光图;b-线虫脂褐素荧光水平
图8 银杏叶黄酮提取物对线虫体内脂褐素积累情况的影响
Fig.8 Effects of flavonoid extracts from G. biloba leaves on lipofuscin accumulation in nematodes
3 讨论
抗衰老研究被认是解决因人口老龄化问题引起的人力资源缺乏和医疗费用增加的有效途径。而植物天然产物可以通过调控衰老基因、调节氧化应激水平、减少蛋白沉积等多方面抗衰老及治疗衰老相关疾病。研究显示,银杏叶中的黄酮类化合物具有抗炎、抗氧化、神经保护和心血管保护等多种生物活性,其黄酮提取物对阿尔茨海默症有一定的预防和治疗作用[18]。因此,银杏叶逐渐被开发成保健品、化妆品和药品等多种产品。有关银杏叶活性成分的提取和分离纯化已有较多报道[19],但用模式生物秀丽线虫多指标综合评价银杏叶黄酮提取物的功效相对较少。研究发现,银杏叶黄酮提取物具有良好的体外抗氧化效果,并且能显著提高秀丽线虫的寿命,还能显著提高线虫的运动、吞咽、生殖、急性热应激和急性氧化应激能力,显著抑制线虫体内ROS和脂褐素的积累,表明银杏叶黄酮提取物对线虫具有明显的抗氧化和抗衰老效果,对银杏叶开发利用具有重要科学意义。
秀丽线虫作为抗衰老实验的常用模式动物,其寿命长短能直观反应天然产物的抗衰老效果。实验发现,与对照组相比,银杏叶黄酮提取物平均延长线虫33%的寿命,其抗衰老效果明显好于前期报道的银杏叶提取物(EGb 761C)和银杏叶单一黄酮物质柽柳黄素,这可能与提取物中的主要成分和浓度不同有关[20]。从银杏叶黄酮提取物中共鉴定出107种黄酮类化合物,分属10种不同黄酮类型,其主要成分包括槲皮素、山奈酚、异鼠李素等15种黄酮类物质,提取物的成分丰富,各成分的功效有待进一步验证。
线虫的衰老受遗传和环境等多种因素影响,其中氧化应激是导致细胞衰老的重要原因[21],过量ROS的积累会导致线虫衰老或死亡,细胞内的氧化降解和自噬又会促进脂褐素积累[22],脂褐素积累又是衰老的重要表征。目前证实,银杏叶提取物能减轻线虫氧化应激和延长其平均寿命,降低小鼠大脑中ROS水平,通过增加神经元中的三磷酸腺苷对大龄小鼠发挥保护效果,提高线粒体酶活性,从而减轻氧化应激和提高线粒体呼吸,可能对预防和减缓阿尔茨海默症进展有益,但提取物中的黄酮类化合物、白果内酯和银杏苦内酯等多成分的作用效果有差异[23]。银杏叶黄酮提取物不仅能显著提高线虫的急性热应激和急性氧化应激能力,还能显著抑制线虫体内ROS和脂褐素的积累(P<0.001),从而达到抗衰老的效果。
实验发现,银杏叶黄酮提取物还能显著提高线虫运动和吞咽能力(P<0.001)。运动和摄食能力能够反应线虫神经系统的基本功能,与寿命也有直接联系,也被作为评价线虫抗氧化和衰老情况的重要指标。研究还发现高浓度黄酮提取物能提高线虫亲代和子代的繁殖能力,显著缩短线虫亲本和子代的世代时间,增加后代数目和子宫卵数目(P<0.001,图3),但有报道银杏叶黄酮提取物能降低线虫的应急敏感性、ROS积累、过氧化氢酶和谷胱甘肽s-转移酶表达,延缓秀丽线虫衰老,对线虫繁殖无影响,也有报道砂生槐种子多糖能够延长线虫寿命的同时并增强生殖能力[24],说明天然产物生物活性与成分差异有关。
综上,银杏叶黄酮提取物能显著提高秀丽线虫运动、吞咽、生殖、抗急性热应激和急性氧化应激能力、以及抑制线虫ROS和脂褐素的积累等,显著延长线虫的寿命。结果更全面地反映了银杏叶黄酮提取物对秀丽线虫具有明显的抗氧化和抗衰老作用,为银杏叶的深入开发利用提供了科学依据,但黄酮提取物为多成分混合物,具体的单一有效成分的功效,需要进一步分离与验证。
[1] WEI Y G, WANG Z C, WANG H W, et al.Predicting population age structures of China, India, and Vietnam by 2030 based on compositional data[J].PLoS One, 2019, 14(4):e0212772.
[2] 朱梦莹, 任佳妮, 沈娜, 等.银杏外种皮化学成分、生物活性和资源利用的研究进展[J].华西药学杂志, 2022, 37(5):587-593.
ZHU M Y, REN J N, SHEN N, et al.Progress on active components, bioactivity and resource utilization of Ginkgo biloba exocarp[J].West China Journal of Pharmaceutical Sciences, 2022, 37(5):587-593.
[3] 肖斯婷, 曹春然, 刘红艳, 等.银杏叶提取物的药学研究进展[J].中国药事, 2022, 36(4):429-443.
XIAO S T, CAO C R, LIU H Y, et al.Advances in pharmaceutical research of extracts from Ginkgo biloba leaves[J].Chinese Pharmaceutical Affairs, 2022, 36(4):429-443.
[4] 李思佳, 耿剑亮, 张悦, 等.银杏药理作用研究进展[J].药物评价研究, 2017, 40(6):731-741.
LI S J, GENG J L, ZHANG Y, et al.Advances in pharmacological research of Ginkgo biloba[J].Drug Evaluation Research, 2017, 40(6):731-741.
[5] 杨番, 夏程程, 钟晓凌, 等.秀丽隐杆线虫模型在食品营养评价中的应用研究进展[J].食品科学, 2019, 40(11):268-276.
YANG F, XIA C C, ZHONG X L, et al.Food nutritional evaluation:Caenorhabditis elegans as a model organism[J].Food Science, 2019, 40(11):268-276.
[6] SHENG Z L, JIANG Y M, LIU J M, et al.UHPLC-MS/MS analysis on flavonoids composition in Astragalus membranaceus and their antioxidant activity[J].Antioxidants, 2021, 10(11):1852.
[7] 赵文龙. 从银杏叶中提取精制银杏黄酮的研究[D].北京:北京化工大学, 2018.
ZHAO W L.Study on extraction and purification of Ginkgo flavonoids from Ginkgo Biloba leaves[D].Beijing:Beijing University of Chemical Technology, 2018.
[8] ZHANG K H, WANG M Q, YAO Y F, et al.Pharmacokinetic study of seven bioactive components of Xiaoyan Lidan Formula in cholestatic and control rats using UPLC-MS/MS[J].Biomedicine &Pharmacotherapy, 2021, 139:111523.
[9] 陈璇. 黄酮类化合物(槲皮素、木犀草素)与类胡萝卜素(番茄红素、叶黄素)协同抗氧化作用及分子机制[D].南昌:南昌大学, 2022.
CHEN X.Synergistic antioxidant effect and mechanisms of flavonoids (quercetin, luteolin) and carotenoids (lycopene, lutein)[D].Nanchang:Nanchang University, 2022.
[10] 张冰洁. 金银花叶中黄酮类化合物的提取、纯化及抗氧化研究[D].洛阳:河南科技大学, 2017.
ZHANG B J.Research on extraction, purification and antioxidant activities of flavonoids from Honeysuckle leaves[D].Luoyang:Henan University of Science and Technology, 2017.
[11] WANG H L, LIU J, LI T, et al.Blueberry extract promotes longevity and stress tolerance via DAF-16 in Caenorhabditis elegans[J].Food &Function, 2018, 9(10):5273-5282.
[12] JIANG S Q, DENG N, ZHENG B S, et al.Rhodiola extract promotes longevity and stress resistance of Caenorhabditis elegans via DAF-16 and SKN-1[J].Food &Function, 2021, 12(10):4471-4483.
[13] XIAO M, CHEN B C, NIU K, et al.Alpiniae oxyphylla fructus extract promotes longevity and stress resistance of C.elegans via DAF-16 and SKN-1[J].Frontiers in Pharmacology, 2022, 13:1034515.
[14] 王亚超. 以秀丽隐杆线虫为模型对水果发酵液在抗衰老等生理功效方面的研究[D].长春:吉林大学, 2022.
WANG Y C.Study on the physiological effects of fruit fermentation broth on anti-aging with Caenorhabditis elegans as model[D].Changchun:Jilin University, 2023.
[15] YANG T T, FANG L L, LIN T T, et al.Ultrasonicated sour Jujube seed flavonoids extract exerts ameliorative antioxidant capacity and reduces Aβ-induced toxicity in Caenorhabditis elegans[J].Journal of Ethnopharmacology, 2019, 239:111886.
[16] HU Q, LIU Z G, GUO Y J, et al.Antioxidant capacity of flavonoids from Folium Artemisiae Argyi and the molecular mechanism in Caenorhabditis elegans[J].Journal of Ethnopharmacology, 2021, 279:114398.
[17] SHEN N, ZENG W, LENG F, et al.Ginkgo seed extract promotes longevity and stress resistance of Caenorhabditis elegans[J].Food &Function, 2021, 12(24):12395-12406.
[18] RUANGCHUAY S, WANG Q Q, WANG L Y, et al.Antioxidant and antiaging effect of traditional Thai rejuvenation medicines in Caenorhabditis elegans[J].Journal of Integrative Medicine, 2021, 19(4):362-373.
[19] 蒋瑶, 孔荔, 童杰, 等.银杏药妆品的美容历史、机制及应用概况[J].中国药房, 2015, 26(16):2279-2280.
JIANG Y, KONG L, TONG J, et al.Cosmetic history, mechanism and application of Ginkgo cosmeceuticals[J].China Pharmacy, 2015, 26(16):2279-2280.
[20] 刘芮. 银杏叶黄酮的分离纯化及抑菌活性研究[D].合肥:合肥工业大学, 2022.
LIU R.Isolation, purification and antibacterial activity of flavonoids from Ginkgo biloba leaves[D].Hefei:Hefei University of Technology, 2022.
[21] 许继业, 郁万文, 曹福亮, 等.不同雄株银杏叶提取液抗氧化能力及主要功能成分含量差异[J].食品与发酵工业, 2022, 48(5):142-149.
XU J Y, YU W W, CAO F L, et al.The differential analysis of antioxidant capacity and main functional components content of leaf extraction from different Ginkgo biloba male plants[J].Food and Fermentation Industries, 2022, 48(5):142-149.
[22] 周溦, 林敬明, 王素丽, 等.半枝莲总黄酮对延缓秀丽隐杆线虫和人脐静脉内皮细胞衰老的影响[J].南方医科大学学报, 2017, 37(6):821-826.
ZHOU W, LIN J M, WANG S L, et al.Effect of Herba Scutellariae Barbatae flavonoids in delaying aging of Caenorhabditis elegans and human umbilical vein endothelial cells in vitro[J].Journal of Southern Medical University, 2017, 37(6):821-826.
[23] KAARNIRANTA K, BLASIAK J, LITON P, et al.Autophagy in age-related macular degeneration[J].Autophagy, 2023, 19(2):388-400.
[24] 张媛. 砂生槐种子多糖成分分析及对秀丽隐杆线虫寿命、行为、应激、生殖和抗菌能力的影响[D].兰州:兰州大学, 2017.
ZHANG Y.Analysis of polysaccharides from Sophoramoorcroftiana seeds and effects on life, behavior, stress, reproduction and antibacterial ability of Caenorhabditis elegans[D].Lanzhou:Lanzhou University, 2018.