高脂症是由遗传、饮食、运动、压力等多种因素共同作用所导致的脂质代谢异常的病症。随着经济的快速发展和人们生活方式的改变,高脂症人群比例急剧增加,与之密切相关的慢性疾病如肥胖、高血压、糖尿病、心脑血管病的发病也随之增加。常见的降脂药物主要为贝特类和他汀类,但长期服用会导致肝肾和胃肠功能方面的副作用,导致诸多不良反应。因此,功效明确、无副作用的降脂药物是目前的研究热点。诸多研究报道,植物资源中的很多天然产物具有调节血脂的作用,且安全性高。
岩藻黄素(fucoxanthin,Fu)是一种来源于海洋植物的天然类胡萝卜素,主要存在于褐藻和微藻中。体内外研究表明,Fu具有减肥降脂作用[1],能够减弱大鼠肝脏中的脂质积累[2],消除脂肪、显著降低大鼠体重的增加[3],且安全性高,但进一步的作用机制和靶点还有待研究。
秀丽隐杆线虫因其繁殖速度快、生命周期短、模型易建立且有丰富的基因突变体株,成为近年来的理想模式动物,由于其脂肪合成分解途径的许多方面与人类相比高度保守,因此被广泛用于抗衰老[4]、脂肪累积遗传调控和肥胖研究的体内模型[5]。因此,本研究以秀丽隐杆线线虫为模型,探讨Fu对线虫的生长发育、寿命以及脂肪累积的影响,并通过基因转录水平的表达初步阐明作用机制,促进Fu在降脂减肥产品方面的研究与开发。
1 材料与方法
1.1 材料与试剂
N2野生型秀丽隐杆线虫和大肠杆菌E.coli OP50,福建上源生物科学技术有限公司;岩藻黄素,上海皓元生物医药科技有限公司;葡萄糖、二甲基亚砜、NaCl、KH2PO4、NaH2PO4、NaClO(分析纯),广东光华科技股份有限公司;NaOH、异丙醇,分析纯,西陇科学股份有限公司;MgSO4(分析纯),上海易恩化学技术有限公司;油红O染色剂、曲拉通X-100,广州市齐云生物技术有限公司;总甘油三酯(triglyceride,TG)试剂盒、总蛋白定量(total protein,TP)试剂盒、还原性谷胱甘肽(glutathione,GSH)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒,南京建成生物工程研究所有限公司;5-氟-2-脱氧尿苷(floxuridine,FudR),上海麦克林生化科技有限公司;生理盐水,广西裕源药业有限公司;LB肉汤,青岛高科技工业园海博生物技术有限公司;线虫NGM培养基,石家庄西默科技有限公司;NGM培养基添加剂,山东拓普生物工程有限公司。
1.2 仪器与设备
Varioskan LUX多功能酶标仪,美国赛默飞世尔科技公司;SW-CJ-2F工作台,广州吉迪仪器有限公司;SZX-6745体视显微镜,北京天诺翔科学仪器有限公司;SPX-250B-Z生化培养箱,上海博讯实业有限公司;TU-1901双光束紫外可见光分光光度计,北京普析通用仪器有限责任公司;SCIENTZ-IID超声波细胞粉碎机,宁波新芝生物科技股份有限公司。
1.3 实验方法
1.3.1 秀丽隐杆线虫的培养和同期化
参考文献[6]并稍作修改:配制NGM培养基、LB培养液、M9缓冲液、裂解液(NaOH溶液、NaClO溶液、蒸馏水体积为1∶1∶8),进行高温灭菌,倒入60 mm的培养皿中,冷却凝固后得到新鲜培养板。挑取少量大肠杆菌于LB肉汤中,在37 ℃下170 r/min的摇床下振荡6~8 h,形成浑浊的菌液。
线虫的裂解参考文献[7],主要步骤如下:将3日龄的线虫用M9缓冲液冲洗至1.5 mL EP管中,静置2 min,去上清液,沉淀的虫体继续用M9缓冲液冲洗2遍,加入1 mL线虫裂解液,充分摇晃5 min直至线虫裂解完全,常温下3 000 r/min离心30 s,弃上清液留沉淀,用M9缓冲液重复清洗3次,将虫卵置于涂有OP50的培养基中,20 ℃培养48 h后得到同期化秀丽隐杆线虫。
1.3.2 线虫的分组与给药
经同期化培养至L4期的线虫[8],以50 mmol/L的葡萄糖处理48 h诱导建立高脂模型,作为模型组,模型建立后再分别给予50、75和100 mg/L的 Fu处理,分为低中高浓度处理组,以Fu的配制试剂为空白组,每组设3个平行。
1.3.3 线虫TG含量的测定
分组给药后的线虫培养48 h后,用M9缓冲溶液清洗得线虫沉淀。1 mL线虫沉淀加入9倍体积的0.9%(体积分数,下同)生理盐水,在冰水浴下超声波破碎匀浆后,2 500 r/min离心10 min,取上清液按照TG试剂盒内的说明书进行测定。
1.3.4 油红O染色
收集分组处理的线虫,用M9缓冲液清洗,加入 500 μL 60%异丙醇使线虫脱水,5 000 r/min离心3 min,弃上清液,加入500 μL 0.5%(体积分数)油红O染色液,室温避光染色12 h,离心去上清液[9],再用M9缓冲液清洗3遍。加入250 μL 0.01%(体积分数)曲拉通-X100,滴加至载玻片上,在显微镜下观察并拍照。
1.3.5 线虫体长体宽的测定
随机挑选5条线虫于载玻片上,加入1%(体积分数)盐酸四咪唑麻醉线虫,待线虫身体僵直后,在显微镜下面观察拍照记录,测量秀丽隐杆线虫的体长和体宽。
1.3.6 线虫运动行为的测定
1.3.6.1 线虫头部摆动的频率
随机挑取各处理组线虫1条于显微镜下观察。头部摆动频率的标准是计算在10 s内线虫的头部从一侧摆动至另一侧再摆回原位置的次数[10]。平行测定3次。
1.3.6.2 身体弯曲频率测定
挑取10 d左右的线虫到空白的NGM培养基上,待线虫恢复稳定后,在体视显微镜下观察并记录10 s内线虫身体弯曲的次数,每个组5条为1个平行,设置3个平行。
1.3.7 寿命实验
参考文献[9]并稍作修改:按照1.3.2节分组,每组取30条线虫于含有150 mmoL/L FudR的NGM培养基中,20 ℃恒温培养。从挑取线虫之日开始统计死亡数,挑取线虫当天记为寿命实验第0天。线虫死亡判定标准为用挑针触碰虫体无任何反应并出现整体僵直状态,即可断为死亡。直至线虫全部死亡,停止计数,绘制寿命曲线。
1.3.8 线虫体内氧化还原水平的测定
线虫分组处理后培养2 d,收集线虫根据试剂盒说明操作,进行线虫体内SOD和GSH含量的测定[11]。
1.3.9 实时荧光定量PCR
采用RNA提取试剂盒提取线虫总RNA,反转录后进行实时荧光定量PCR,引物序列见表1。扩增条件为:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火、延伸34 s,共40个循环。以actin-1为内参基因,结果以2-ΔΔCt进行数据处理[12]。
表1 实时荧光定量PCR引物
Table 1 Real-time fluorescent quantitative PCR primers

基因上游引物序列 (5′ to 3′)下游引物序列 (5′ to 3′)fat-5TGAACTGGACCCGAGTATTGAACAGCCGAACTTCTTGCACTlipl-4CGGCTCATCGAGCAATGTGGGGAACATCCGCAATACCTGacs-2CTTGTAAGAGAGGAATGGCTCAGTGAGACTTGACAGTTCCGdaf-2CAATGCAGACGATTGGGAGCAGATTCTCAGTCGACGCTGGcpt-2AACGATTGAGCCAACCAACTCCAGCAATACCGAATCCATCTTGCACAACTGactinCGGAGACGAGGCCCAATCGCCTTTGGATTGAGTGGGGC
1.4 数据处理
采用SPSS 26 软件进行显著性分析,结果以“平均值±标准差”表示,并采用LSD多重检验进行比较,P<0.05表示差异显著。数据分析采用 GraphPad Prism 9 作图。
2 结果与分析
2.1 Fu对线虫TG含量的影响
本研究以葡萄糖诱导秀丽隐杆线虫高脂模型的建立,结果表明,与空白组相比,模型组线虫体内的TG含量显著增加(P<0.05),为(1.12±0.044) mmol/g prot,增加了73.64%,表明模型建立成功;与模型组相比,经50~100 mg/L的Fu处理后各组线虫的TG含量显著降低(P<0.05),并呈浓度梯度型,高浓度处理组下降33.04%,与空白组接近(表2)。
表2 Fu对线虫体内TG含量的影响
Table 2 Effect of different administration methods on C.elegan lipid deposition
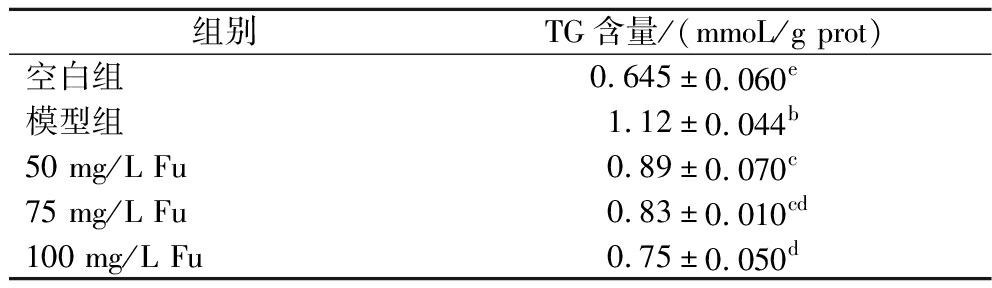
组别TG含量/(mmoL/g prot)空白组0.645±0.060e模型组1.12±0.044b50 mg/L Fu0.89±0.070c75 mg/L Fu0.83±0.010cd100 mg/L Fu0.75±0.050d
注:不同字母代表有显著性差异(P<0.05)(下同)。
表3 Fu对秀丽隐杆线虫体长体宽和运动行为的影响
Table 3 Effect of Fu on the length, width and the locomotion behavior of C.elegan
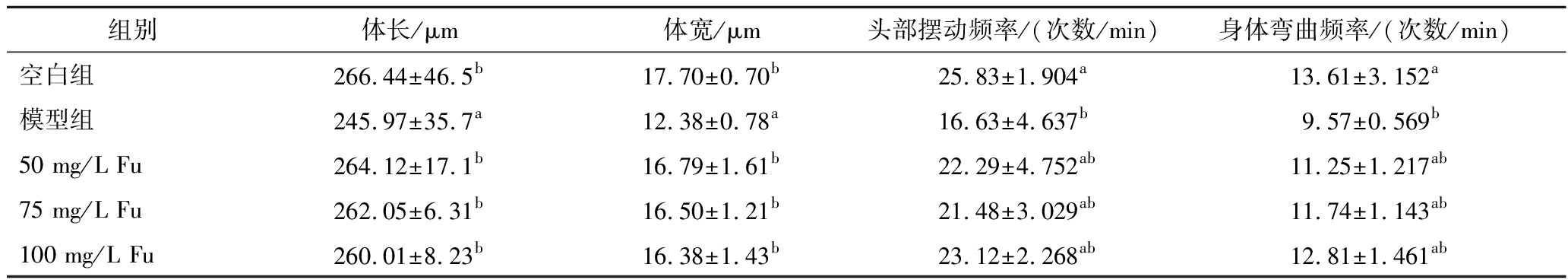
组别体长/μm体宽/μm头部摆动频率/(次数/min)身体弯曲频率/(次数/min)空白组266.44±46.5b17.70±0.70b25.83±1.904a13.61±3.152a模型组245.97±35.7a12.38±0.78a16.63±4.637b9.57±0.569b50 mg/L Fu264.12±17.1b16.79±1.61b22.29±4.752ab11.25±1.217ab75 mg/L Fu262.05±6.31b16.50±1.21b21.48±3.029ab11.74±1.143ab100 mg/L Fu260.01±8.23b16.38±1.43b23.12±2.268ab12.81±1.461ab
2.2 Fu对线虫脂肪沉积的抑制作用
通过油红O染色进一步观察Fu对线虫体内脂肪沉积的影响,结果如图1所示,50、75和100 mg/LFu处理均能明显减少线虫体内的油脂滴,高浓度的作用效果最好,体内的脂肪滴与空白组接近,与TG检测结果一致。相关的研究报道也表明,Fu可显著降低鼠体重,降低脂肪在小鼠肝脏组织中的沉积,其机制可能与PPARγ和 UCP1的表达和活性有关,但还待进一步证实。

a-空白组;b-模型组;c-50 mg/L Fu组;d-75 mg/L Fu组;e-100 mg/L Fu组
图1 秀丽隐杆线虫的油红O染色图
Fig.1 Oil red O staining diagram of C.elegan
2.3 Fu对线虫体长体宽和运动行为的影响
为了考察不同浓度Fu对线虫的基础生理指标是否有影响,对线虫的体长体宽和运动能力进行评估,结果如图3所示,与空白组相比,模型组线虫的体长体宽均显著降低(P<0.05),分别为(245.97±35.7)μm和(12.38±0.78)μm,经不同浓度Fu(50~100 mg/L)处理后,线虫体长体宽与空白组无显著差异性(P<0.05),不同处理组线虫头部摆动频率和身体弯曲频率的变化趋势与体长体宽相似,说明高糖饮食导致的高脂对线虫体长体宽和运动行为有抑制作用,线虫体长体宽的减少可能与其独特的代谢适应性和生长发育调控机制有关。高糖高脂环境可能触发了线虫体内复杂的代谢途径变化,如脂质代谢的重新编程、能量分配的调整以及细胞生长速率的抑制,从而导致体型缩小。此外,高脂饮食可能加剧了线虫的氧化应激水平,影响了细胞结构和功能的完整性,进一步抑制了其生长发育[13]。而Fu处理可缓解高脂饮食对其生长发育和运动能力的不利影响。
2.4 Fu对野生型线虫寿命的影响
为了观察Fu对线虫自然衰老的影响,对线虫的寿命进行了测定,结果显示,与空白组相比,模型组的寿命曲线向左移;与模型组相比,50~100 mg/L Fu处理后线虫的寿命曲线均向右移,尤以100 mg/L的右移效果明显(图2),但低中浓度处理组线虫的平均寿命延长不显著,高浓度处理组的平均寿命最大为(13.95±0.489 1) d,与空白组和模型组相比均有显著增加(P<0.05),寿命延长10.28%,线虫的最长寿命也有了较大的提升(表4)。上述结果表明,长期的高糖培养可能会导致线虫产生应激损伤,从而影响寿命,而Fu不但可以降低脂肪积累,还可以延长线虫的寿命。有研究表明,脂质代谢与寿命密切相关,如食品中的某些功能成分可以降低脂肪沉积来延长线虫寿命,如苦瓜皂苷在抑制线虫体内脂肪酸合成的同时延长了线虫自然寿命[14]。
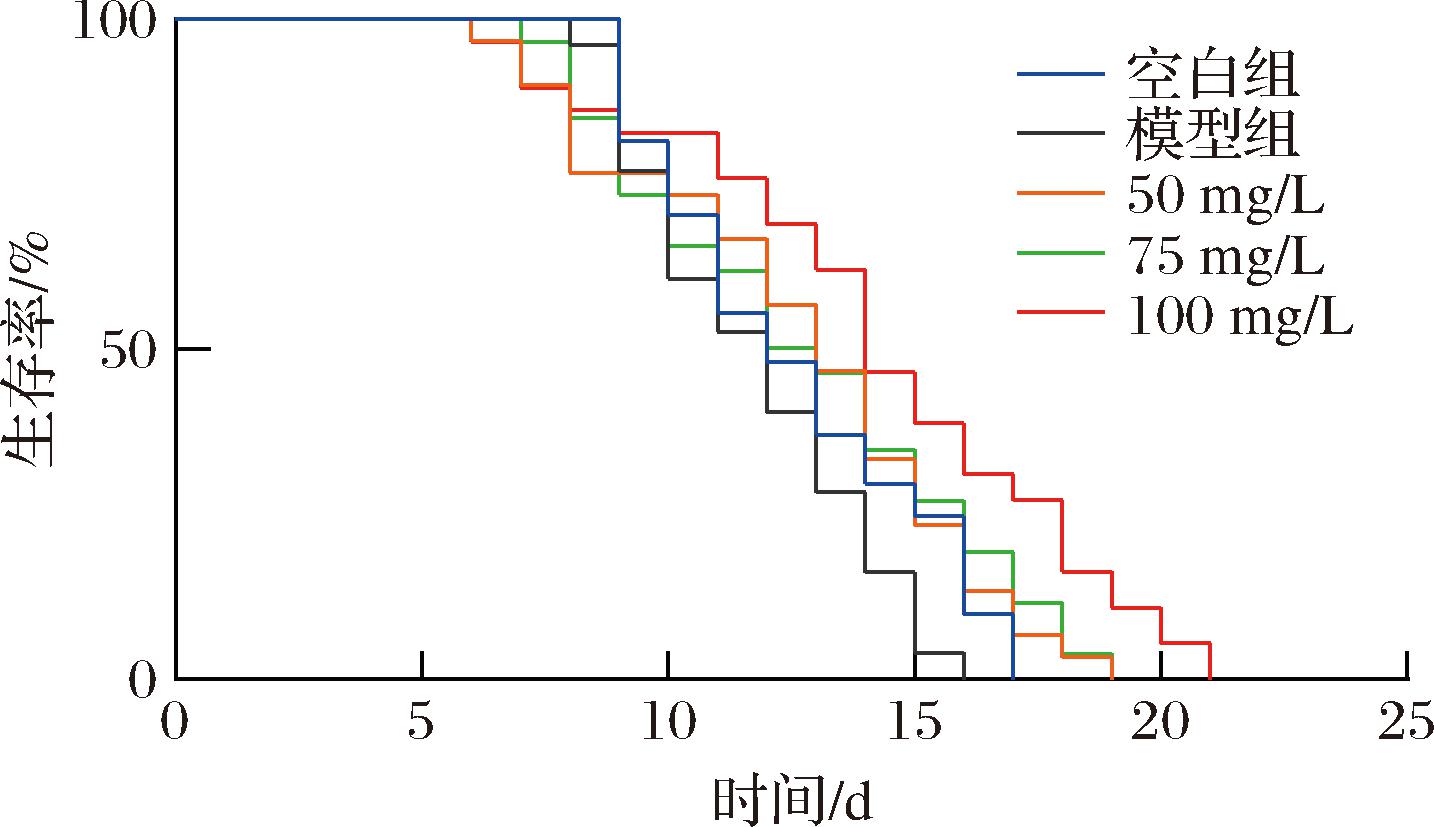
图2 Fu对秀丽隐杆线虫寿命曲线的影响
Fig.2 Effect of Fu on the longevity curves of C.elegans
表4 Fu对秀丽隐杆线虫寿命的影响
Table 4 Effect of Fu on the longevity of C.elegan
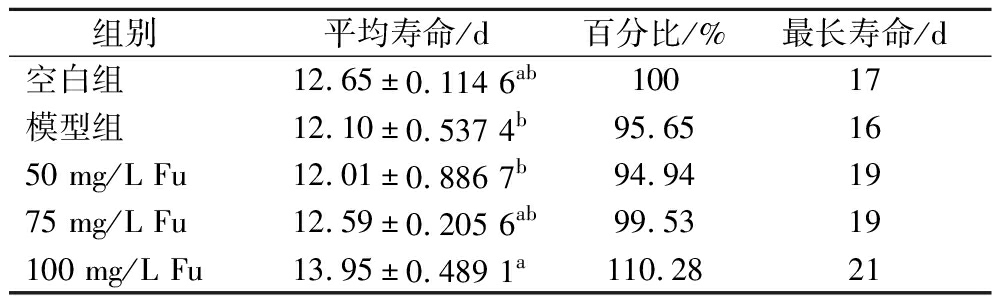
组别平均寿命/d百分比/%最长寿命/d空白组12.65±0.114 6ab10017模型组12.10±0.537 4b95.651650 mg/L Fu12.01±0.886 7b94.941975 mg/L Fu12.59±0.205 6ab99.5319100 mg/L Fu13.95 ±0.489 1a110.2821
2.5 Fu对线虫体内SOD活性和GSH含量的影响
高糖诱导线虫高脂的同时,会对线虫产生损伤以及体内脂质过氧化水平的增加。本研究对线虫体内的抗氧化酶SOD和GSH测定结果表明,模型组中的SOD活性和GSH含量显著低于空白组,分别为(65.47±6.86) U/mg prot和(894.37±120.3) μmoL/g prot,低、中、高浓度Fu(50~100 mg/L)的处理均可显著增加两者含量(P<0.05),并呈浓度梯度依赖型,与模型组相比,SOD活性分别提高了53.08%、93.77%和127.17%,GSH含量分别提高了98.61%、158.96%和265.14%(表5),高浓度组的GSH含量[(3 265.67±214.14) μmoL/g prot]增加至与空白组[(3 462.57±385.10) μmoL/g prot]无显著差异,说明Fu在降脂的同时还能通过增加体内抗氧化酶的活性和含量来缓解高脂造成的氧化应激损伤,具有显著的抗氧化作用。齐佳等[15]的研究结果表明,1~20 μmol/L Fu能够清除H2O2诱发的胞内ROS,提高细胞GSH含量,降低细胞 LDH的释放,提高细胞活力,具有良好的抗氧化作用,这些研究结果与本实验的结果一致。
表5 Fu对线虫体内SOD和GSH含量的影响
Table 5 Effect of Fu on SOD and GSH contents in C.elegan
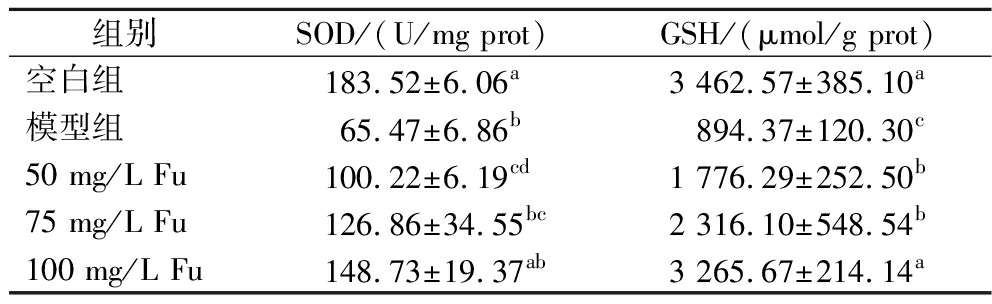
组别SOD/(U/mg prot)GSH/(μmol/g prot)空白组183.52±6.06a3 462.57±385.10a模型组65.47±6.86b894.37±120.30c50 mg/L Fu100.22±6.19cd1 776.29±252.50b75 mg/L Fu126.86±34.55bc2 316.10±548.54b100 mg/L Fu148.73±19.37ab3 265.67±214.14a
2.6 Fu对线虫脂代谢相关基因表达的影响
线虫脂质代谢涉及脂肪酸氧化、合成和分解等过程,由很多关键基因参与和多个信号通路调控,如胰岛素/胰岛素样生长因子(insulin/IGF-like signaling,IIS)信号通路和转化生长因子(transforming growth factor β,TGF-β)信号通路就是脂肪积累的核心调控通路。为了探讨Fu对线虫脂代谢的调节机制,筛选了多个关键基因采用实时荧光定量PCR进行检测。根据上述结果,选择中剂量组进行实验。结果如图3所示,与模型组比较,75 mg/L的Fu干预可以导致fat-5、acs-2、daf-2、daf-16、cpt-2、mdt-15、spb-1、tph-1等基因转录水平发生显著变化,尤其是acs-2、tph-1、fat-5和cpb-2变化比例超过100%,而daf-7、lipl-4、pod-2和cpt-1基因转录变化不显著(P<0.05)。由于daf-2和daf-16是IIS信号通路中的关键因子,而DFA-7是TGF-β的配体,说明Fu的降脂作用与IIS信号通路密切相关,而与 TGF-β信号通路关系不大。spb-1/mdt-15介导的信号通路在线虫的脂肪积累及脂肪酸组成调控中非常重要,spb-1是固醇反应元件结合蛋白(sterol response element binding protein,SREBP)家族的同源物,其表达量的变化会显著影响线虫肠道脂肪的积累。acs-2主要参与线粒体β氧化的关键酶,其表达降低可使线虫脂肪积累增加,本研究中,空白组和给药处理组的acs-2没有显著变化,但模型组中其表达显著上升,推测可能是由于高糖诱导线虫产生高脂后,机体自我保护的一种代偿机制,而Fu的干预能够降低脂肪积累,从而减弱了这种代偿效应。fat-5也是参与脂肪酸合成代谢的重要基因,能够编码Δ-9脂肪酸去饱和酶,Fu的处理可能改变了线虫体内多种脂肪酸的比率,其变化趋势与陈龙[16]的研究一致。tph-1基因编码色氨酸羟化酶,在5-羟色氨的生物合成中发挥重要作用,主要通过影响咽泵运动速率改变脂肪积累,由此可见,Fu是通过多种途径来调控脂肪的合成代谢过程,暗示了其机制的复杂性。
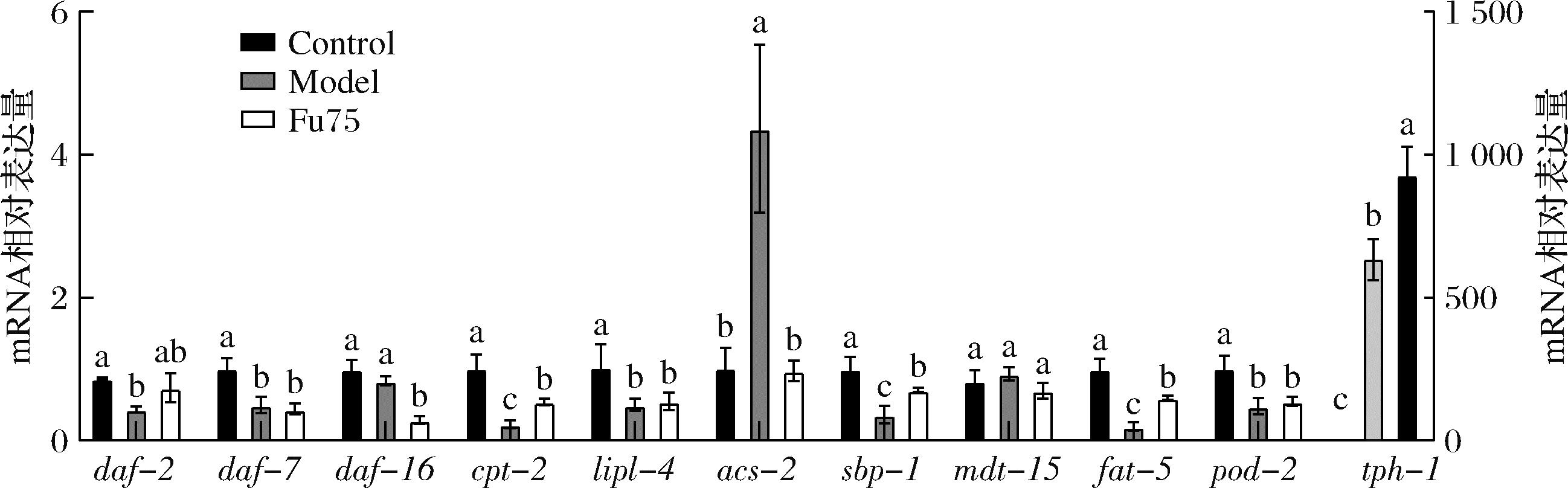
图3 Fu对秀丽隐杆线虫体内脂肪相关基因mRNA的表达
Fig.3 The expression of Fu on the mRNA of fat-related genes in C.elegan
注:不同字母表示差异性显著(P<0.05)。
3 结论
本研究以秀丽隐杆线虫为实验动物,通过葡萄糖建立高脂模型,探讨Fu对高脂线虫的降脂作用,结果表明,50~100 mg/L的Fu可以显著降低线虫体内的TG含量和脂肪沉积,高浓度Fu(100 mg/L)的作用效果最强;同时考察了Fu对线虫的生长发育、运动状态和寿命的影响,发现与空白组相比,高脂模型组的体长体宽、头部摆动频率和身体弯曲频率均显著降低,寿命也有一定程度的缩短,Fu处理能够显著改善这些指标,75 mg/L Fu甚至能够延长线虫寿命10%以上,而体内的抗氧化酶水平测定结果显示,模型组线虫体内的SOD和GSH与空白组相比显著下降,Fu处理显著增加了抗氧化酶含量,且呈浓度梯度依赖型。实时定量荧光PCR分析与脂肪代谢相关的多个关键基因,转录水平发生显著变化的基因有fat-5、acs-2、daf-2、daf-16、cpt-2、spb-1、tph-1、mdt-15等,涉及了脂肪的氧化、合成和分解多个途径,与IIS信号通路和spb-1/mdt-15介导的信号通路密切相关,初步推测Fu对脂肪的影响是多途径多信号的调控模式。综上所述,Fu具有显著降脂作用,并能够改善高脂带来的机体伤害。本研究为Fu在降脂的研究和应用领域提供了参考,为开发相关的食品药品提供理论基础。
[1] 潘东进, 李嘉英, 梁莉芬, 等.岩藻黄素降脂活性及其作用机制研究进展[J].广西科学, 2021, 28(6):588-598.
PAN D J, LI J Y, LIANG L F, et al.Research progress on lipid lowering activity and mechanism of fucoxanthin[J].Guangxi Sciences, 2021, 28(6):588-598.
[2] OLIYAEI N, TANIDEH N, MOOSAVI-NASAB M, et al.Development and characterization of a fucoidan-based nanoemulsion using Nigella sativa oil for improvement of anti-obesity activity of fucoxanthin in an obese rat model[J].International Journal of Biological Macromolecules, 2023, 235:123867.
[3] QIANG X, GUO C L, GU W H, et al.The complex of phycobiliproteins, fucoxanthin, and krill oil ameliorates obesity through modulation of lipid metabolism and antioxidants in obese rats[J].Nutrients, 2022, 14(22):4815.
[4] 杨文清. 秀丽隐杆线虫模型在抗衰老领域的研究进展[J].工业微生物, 2024, 54(3):71-73.
YANG W Q.Research progress of the application of C.elegans model in the field of anti-aging[J].Industrial Microbiology, 2024, 54(3):71-73.
[5] 冯亚芳, 米生权.秀丽隐杆线虫在降脂类生物活性物质功能评价中的应用研究进展[J].食品工业科技, 2017, 38(19):346-351.
FENG Y F, MI S Q.Research progress on application of Caenorhabditis elegans in function evaluation of lipid-lowering bioactive substances[J].Science and Technology of Food Industry, 2017, 38(19):346-351.
[6] 张培丽, 陈雪香, 王群, 等.桑葚多糖T3-3分离及秀丽隐杆线虫抗衰老活性研究[J].天津中医药大学学报, 2017, 36(2):136-141.
ZHANG P L, CHEN X X, WANG Q, et al.Optimization of the extracting parameters of mulberry polysaccharide and its anti-aging activity study[J].Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(2):136-141.
[7] 安苗青, 徐雅囡, 卓倩婷, 等.龟鹿二仙胶对秀丽隐杆线虫体内抗衰老作用研究[J].广州中医药大学学报, 2022, 39(8):1863-1870.
AN M Q, XU Y N, ZHUO Q T, et al.Study on the anti-aging effect of Guilu Erxian Jiao on Caenorhabditis elegans in vivo[J].Journal of Guangzhou University of Traditional Chinese Medicine, 2022, 39(8):1863-1870.
[8] 魏润霞, 卢虹玉, 秦小明, 等.牡蛎提取物对秀丽隐杆线虫的抗衰老作用研究[J].食品与发酵工业, 2024, 50(1):52-58.
WEI R X, LU H Y, QIN X M, et al.Anti-aging effects of oyster extracts on Caenorhabditis elegans[J].Food and Fermentation Industries, 2024, 50(1):52-58.
[9] 姜璠. 火麻油中大麻素及其生物活性研究[D].无锡:江南大学, 2021.
JIANG F.Study on cannabinoids and their bioactivities in hemp oil[D].Wuxi:Jiangnan University, 2021.
[10] DENG L, DENHAM J, ARYA C, et al.Inhibition underlies fast undulatory locomotion in C.elegans[J].eNeuro, 2020,8(2).
[11] 蔡佳琦, 秦小明, 卢虹玉, 等.鲍鱼肌肉酶解产物对秀丽隐杆线虫的抗衰老作用研究[J].食品与发酵工业, 2023, 49(12):106-112.
CAI J Q, QIN X M, LU H Y, et al.Anti-aging effect of Abalone muscle enzymatic hydrolysate on Caenorhabditis elegans[J].Food and Fermentation Industries, 2023, 49(12):106-112.
[12] 张晓寒, 赵江, 韩英, 等.根皮素对秀丽隐杆线虫寿命的影响[J].食品科学, 2021, 42(1):187-196.
ZHANG X H, ZHAO J, HAN Y, et al.Effect of phloretin on lifespan of Caenorhabditis elegans[J].Food Science, 2021, 42(1):187-196.
[13] RAJENDRAN P, ALZAHRANI A M.Fucoxanthin suppresses OxLDL-induced inflammation via activation of Nrf2 and inhibition of NF-κB signaling[J].Asian Pacific Journal of Tropical Biomedicine, 2022, 12(5):207-215.
[14] 白娟, 张金富, 张佩熙, 等.苦瓜皂苷对秀丽隐杆线虫寿命的影响及其机制研究[J].食品科学, 2022, 43(7):165-173.
BAI J, ZHANG J F, ZHANG P X, et al.Effect of saponin from bitter melon (Momordica charantia) on the lifespan of Caenorhabditis elegans and its mechanism[J].Food Science, 2022, 43(7):165-173.
[15] 齐佳, 崔艳君, 王广策, 等.岩藻黄素对H2O2诱导BNL CL.2细胞氧化损伤保护作用研究[J].中国海洋大学学报(自然科学版), 2019, 49(1):63-68.
QI J, CUI Y J, WANG G C, et al.Protective effect of fucoxanthin against H2O2-induced oxidative damage in BNL CL.2 cells[J].Periodical of Ocean University of China, 2019, 49(1):63-68.
[16] 陈龙. 反式肉桂醛降低秀丽线虫脂质累积及对衰老影响[D].南京:南京大学, 2021.
CHEN L.Reduction of lipid accumulation and effects on senescence by trans-cinnamaldehyde in Hidradenitis elegans[D].Nanjing:Nanjing University, 2021.