活性包装是一种创新的食品包装技术,通过将活性物质与聚合物基质分散或乳化来制备[1],由于较高的加工温度、活性物质与聚合物链的热力学不相容性,导致活性物质在加工过程中损失。因此,确保活性物质在基材中的有效负载和功能保持是制备活性包装材料的关键要求。纳米材料具有高封装效率和缓释特性[2],为封装活性物质提供新方法。静电纺丝是一步封装技术,通过静电力克服表面张力,将溶液液滴喷涂、拉伸、分裂和固化形成纤维,可在无高温条件下保持活性物质的化学稳定性。静电纺丝纤维具有高比表面积和高孔隙率[3],与自组装、纳米光刻、熔融纤化等方法相比,静电纺丝技术是一种直接、经济、高效且简单的纳米材料开发技术[4]。
玉米醇溶蛋白(zein)是玉米加工的副产品,是一种安全、无毒、可降解的物质,被公认为安全天然生物大分子(generally recognized as safe,GRAS)[5]。基于Zein在乙醇/水二元溶剂体系中的溶解性质以及氨基酸序列的同源性,Zein分为α-Zein、β-Zein、γ-Zein和δ-Zein[6],其中α-Zein占总Zein含量的80%以上。Zein富含非极性和中性氨基酸残基,包括脯氨酸、亮氨酸、丙氨酸和谷氨酰胺,为Zein提供天然的疏水性和油脂耐受性[7]。Zein具有良好的成膜性能和生物相容性,通常作为制作纳米纤维薄膜和纳米颗粒的基础材料。纤维素是通过β-(1,4)糖苷键聚合的葡萄糖单体聚合物,在常温下不溶于水和普通有机溶剂[8]。乙基纤维素是将纤维素主链的羟基部分被乙醚基团取代,从而能够溶解于乙醇、氯仿、乙酸乙酯等有机溶剂中[9]。WU等[10]使用体积分数为20%的乙醇溶液制备魔芋葡甘露聚糖(konjac glucomannan,KGM)/EC薄膜,发现薄膜表现出较高的拉伸强度和断裂伸长率。乙基纤维素具有安全性、生物相容性、疏水性、水稳定性和无毒性等特点,其出色的成膜能力被广泛应用于制药、化妆品和食品包装等领域。香芹酚(carvacrol,CRV)是牛至和百里香精油的主要成分之一。多项研究表明,CRV具有显著的抗氧化[11]、抗细菌和抗真菌特性[12]。程萌等[13]采用溶剂浇铸法制备了CRV/海藻酸钠膜,当CRV体积分数为0.8%时,对丰孢木霉菌的抑菌率为65.79%。然而,CRV存在挥发性高、易被氧化以及刺激性异味等缺点,限制了CRV在食品工业领域的广泛应用。
为了提高CRV的稳定性和生物活性,实现对CRV的精确控制和释放,减少刺激性异味。本研究通过静电纺丝工艺将CRV负载于Zein/EC基质中,制备Zein/EC/CRV纤维垫,研究CRV添加量对纺丝液性质和纤维垫性能的影响。通过黏度和电导率测试对纺丝液进行表征,通过傅里叶变换红外光谱(Fourier transform infrared,FTIR)、扫描电子显微镜(scanning electron microscope,SEM)、水接触角表征纤维垫的物理结构,分析纤维垫的包埋率、负载率、抗氧化性、抑菌性能、释放性能。将纤维垫应用于蛋糕包装中,评价纤维垫对蛋糕外观品质、酸价和菌落总数的影响,为延长蛋糕货架期提供新型手段和参考依据。
1 材料与方法
1.1 材料
玉米醇溶蛋白(Zein),分子质量24 kDa、乙基纤维素(ethyecellulose,EC),上海麦克林生化科技股份有限公司;无水乙醇、营养琼脂、营养肉汤、马铃薯葡萄糖琼脂培养基、NaCl、石油醚(30~60 ℃)、无水乙醚、异丙醇、三氯甲烷、冰乙酸、NaOH、可溶性淀粉、酚酞,国药集团化学试剂有限公司;CRV,上海阿拉丁生化科技股份有限公司;DPPH,北京沃凯生物科技股份有限公司;大肠杆菌(Escherichia coli ATCC6538)、金黄色葡萄球菌(Staphylococcus aureus ATCC25922),上海保藏生物计数中心;饱和碘化钾、硫代硫酸钠,广州和为医药科技股份有限公司;去离子水,实验室自制。
1.2 仪器与设备
DP-30型静电纺丝机,天津云帆科技有限公司;AB204-N电子分析天平,梅特勒-托利多仪器有限公司;WH-220HT型磁力搅拌器,德国韦根斯公司;NDJ-5S型数字旋转黏度计,上海力辰邦西仪器科技有限公司;DDS-11C型电导率仪、LC-LX-HR154A型高速冷冻离心机,上海精密科学仪器有限公司;DZF-6050型真空干燥箱、SHP-250型生化培养箱,上海精宏试验仪器有限公司;SU-8100冷场发射扫描电子显微镜,日本日立公司;ALPHA型傅里叶变换红外光谱,德国布鲁克公司;JC-200D1型接触角测量仪,上海中晨数字计数设备有限公司;ZQLY-300型振荡培养箱,上海知楚仪器有限公司;UV-1800型紫外分光光度计,日本岛津公司;HCB-1300V型垂直层流洁净工作台,海尔生物医疗有限公司;ZM-100G型立式压力蒸汽灭菌锅,上海申安医疗器械厂;RV-3型旋转蒸发仪,苏州赛恩斯仪器有限公司。
1.3 实验方法
1.3.1 Zein/EC/CRV活性纺丝溶液的配制
称取m(Zein)∶m(EC)=1∶3的Zein和EC粉末,溶解于体积分数80%的乙醇溶液中,25 ℃下磁力搅拌1 h至溶质全部溶解,制得10 g/L的Zein/EC溶液。将CRV添加到Zein/EC溶液中,m(CRV)∶m(Zein/EC)=0∶1、0.05∶1、0.075∶1、0.1∶1、0.125∶1、0.15∶1,25 ℃下磁力搅拌30 min,使CRV与Zein/EC溶液充分混合,配制出不同CRV添加量的Zein/EC/CRV的纺丝液。
1.3.2 Zein/EC/CRV活性纤维垫的制备
用两个带有20 G不锈钢平口针头的10 mL注射器分别移取6 mL Zein/EC/CRV活性纺丝溶液,置于微量双头注射泵上。纺丝电压15~20 kV,推速0.004 mm/s,针尖到收集装置的距离为11 cm,收集装置为包裹于滚轴上的铝箔。注射泵左右摆幅为80 mm,滚轴转速为300 r/min。静电纺丝实验环境温度为(25±2) ℃,相对湿度为(50±5)%。随后将各组纤维垫置于25 ℃真空干燥箱中干燥8 h,去除残留溶剂,密封保存。
1.3.3 Zein/EC/CRV纺丝溶液电导率和黏度测试
由数字旋转黏度计测定Zein/EC/CRV活性纺丝溶液的黏度。根据溶液性质选用2#或3#转子,转速为12~30 r/min。待数据稳定后,记录数据。
将电导率仪探头预热1 h后没入去离子水中并调零,然后将探头浸没于各组Zein/EC/CRV活性纺丝溶液中测定电导率,纺丝溶液温度为25 ℃,电导常数为1.0。待数据稳定后,记录数据。
1.3.4 纤维垫形貌测试
分别对5组纤维垫进行喷金处理,用导电胶粘贴在样品台上,通过SEM观察纤维垫表面形貌。加速电压2 kV,每组样品分别放大5 000倍和20 000倍。
1.3.5 纤维垫FTIR测试
对Zein、EC粉末、Zein/EC、Zein/EC/CRV纤维垫进行FTIR测试,扫面前需以空气为背景并扣除,扫描范围400~4 000 cm-1,分辨率为4 cm-1,光谱扫描频率为32次。
1.3.6 纤维垫接触角测试
将纤维垫平整固定于载玻片上,测试采用座滴法,采集液滴与纤维垫刚接触时的图像并测量接触角。
1.3.7 纤维垫中CRV包埋率和负载率测试
称取5 mg纤维垫于5 mL无水乙醇的离心管中,将其在10 000 r/min转速下离心30 min。然后,将离心后的上清液适当稀释,并于275 nm处测定CRV的吸光度,并用香芹酚标准曲线y=0.014 3x+0.001 8(R2=0.999 6)计算实际浓度,通过纤维垫的质量和精油的比例计算其理论浓度。包埋率和负载率的计算如公式(1)和公式(2)所示:
包埋率![]()
(1)
负载率![]()
(2)
式中:X1,纤维垫中CRV的实际计算值,mg;X2,纤维垫中CRV的理论计算值,mg;X3,纤维垫的总质量,mg。
1.3.8 纤维垫抗氧化性实验
称取25 mg的纤维垫,置于5 mL无水乙醇中,超声溶解30 min,4 h和24 h后,取1 mL活性纤维样品提取液与2 mL浓度为1×10-4 mol/L的DPPH乙醇溶液混合稀释[14]。25 ℃避光反应60 min,用紫外-可见光分光光度计测试溶液在517 nm处的吸光度。根据公式(3)计算纤维垫的DPPH自由基清除活性:
DPPH自由基清除率![]()
(3)
式中:Asample,稀释后纤维垫中DPPH乙醇溶液的吸光度;ADPPH,稀释后空白DPPH乙醇溶液的吸光度。
1.3.9 纤维垫气相抑菌实验
采用微气氛扩散抑菌试验评估纤维垫对E.coli和S.aureus的生长抑制率。取菌株于营养肉汤中,在37 ℃振荡培养箱以175 r/min速度振荡培养16 h,最终营养肉汤中的菌密度达到1×108 CFU/mL。依次做10倍递增稀释液,选择菌液浓度为1×105CFU/mL的稀释液作为试验用菌液。取10 μL的细菌/生理盐水溶液滴在固体营养琼脂培养基的中心,用涂布棒涂布均匀,使用双面胶带将50 mm×50 mm大小的纤维垫粘贴到培养皿盖中心,确保薄膜和琼脂之间不接触[15]。用封口膜密封培养皿,在37 ℃培养箱中倒置培养24 h。此外,用不添加CRV的纤维垫作为空白对照样品。纤维垫抑菌率的计算如公式(4)所示:
抑制率![]()
(4)
式中:CK24 h,空白对照组培养24 h后的菌落总数,CFU/mL;C24 h,Zein/EC/CRV组培养24 h后的菌落总数,CFU/mL。
1.3.10 纤维垫CRV释放性能实验
将纤维垫裁剪成50 mm×50 mm大小的方形,置于密闭螺口顶空瓶中,于23 ℃,50% RH恒温恒湿箱中保存。于第1、2、3、4、5、6、8、10、12天为时间点取样,带入标准曲线计算材料中CRV的剩余量,从而求出CRV的释放量[16]。
1.3.11 蛋糕包装处理
为了评估Zein/EC/CRV纳米纤维垫在无防腐剂蛋糕贮藏保鲜中的保鲜效果,挑选大小、克重相近、形状规整、无塌陷或隆起的蛋糕,实验组使用含5% CRV的纤维垫,裁成面积为4 cm×7 cm的长方形,分别粘贴于PP材质的塑料盒(183 mm×132 mm×45 mm)内壁。每盒装入2块蛋糕(80±5) g,以聚对苯二甲酸乙二醇酯/聚丙烯(PET/PP)聚合膜(243 cm2)进行热封(纤维垫不与蛋糕直接接触)。空白对照组CK为未粘贴纤维垫的蛋糕包装。
在进行蛋糕贮藏保鲜试验之前,需将蛋糕及其包装在超净台环境下进行30 min的紫外照射杀菌处理。随后置于环境温度23 ℃、相对湿度50%条件下贮藏10 d,在贮藏的第0、3、5、8、10天测试蛋糕的品质指标。
1.3.11.1 蛋糕新鲜度变化
对贮藏0、5、10 d的蛋糕使用放大镜观察蛋糕表面菌丝生长情况,用相机记录蛋糕表面霉变情况,当蛋糕表面出现菌丝判定产品为不合格。
1.3.11.2 蛋糕酸价测试
参考GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》。将蛋糕粉碎后与2倍蛋糕体积的石油醚混合,静置12 h后经装有无水Na2SO4的漏斗过滤。将滤液于40 ℃水浴中旋转蒸干石油醚,残留物为待测油脂。取2~3 g油脂,加入乙醚-异丙醇溶液和酚酞指示剂,用NaOH标准液滴定至溶液初现微红色且0.5 min内不褪色,记录NaOH标准液的用量。蛋糕的酸价计算如公式(5)所示:
(5)
式中:Xav,酸价,mg/g;V,NaOH标准液的用量,mL;c,NaOH标准液的摩尔浓度,mol/L;m,油脂的质量,g。
1.3.11.3 蛋糕微生物指标测试
参考GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》。将蛋糕于无菌生理盐水中拍打混匀,并对样品匀液进行10倍稀释,选择适宜梯度的稀释液与无菌培养基混合均匀,待琼脂凝固后于37 ℃培养箱中倒置培养48 h,测定并计算菌落总数。
1.3.12 统计分析
每组实验重复3次,数据以“平均数±标准差”(standard deviation,SD)表示,采用SPSS 27对蛋糕指标测试进行数据统计分析,通过独立样本T检验比较2组均值差异,P<0.05表示差异显著,用Origin 2021作图。
2 结果与分析
2.1 Zein/EC/CRV纺丝溶液黏度和电导率分析
纺丝溶液的黏度和电导率对纤维的形貌和尺寸至关重要[17]。Zein/EC/CRV纺丝溶液的黏度和电导率如图1所示,在添加不同比例的CRV时,纺丝液的黏度和电导率发生了变化。当CRV添加量为5%、7.5%、10%、12.5%和15%(以Zein/EC质量计,下同)时,纺丝液的黏度分别为1 482、1 430、1 361、1 323和1 299 mPa·s,均低于未添加CRV时纺丝液的黏度1 569 mPa·s。此外,纺丝液的电导率分别为57.6、56.7、56.3、55.9和55.2 nS/cm,同样低于未添加CRV时纺丝液的电导率61.9 nS/cm。纺丝溶液的黏度会随CRV添加量的增加而呈现下降趋势,原因是CRV具有表面活性作用,可以与EC中的羟基形成氢键,有效抑制EC和Zein的团聚,减小Zein和EC分子间的作用力[18],从而降低纺丝溶液的黏度。电导率的变化也随CRV添加量升高而降低,这是由于低酸性CRV的加入使聚合物分散体pH降低,从而导致纺丝溶液可电离部分减少[19-20]。此外,CRV中苯环非极性的部分会抵消羟基的极性部分,从而削弱了整个CRV的极性,因此随着CRV添加量的增加,纺丝溶液电导率降低。
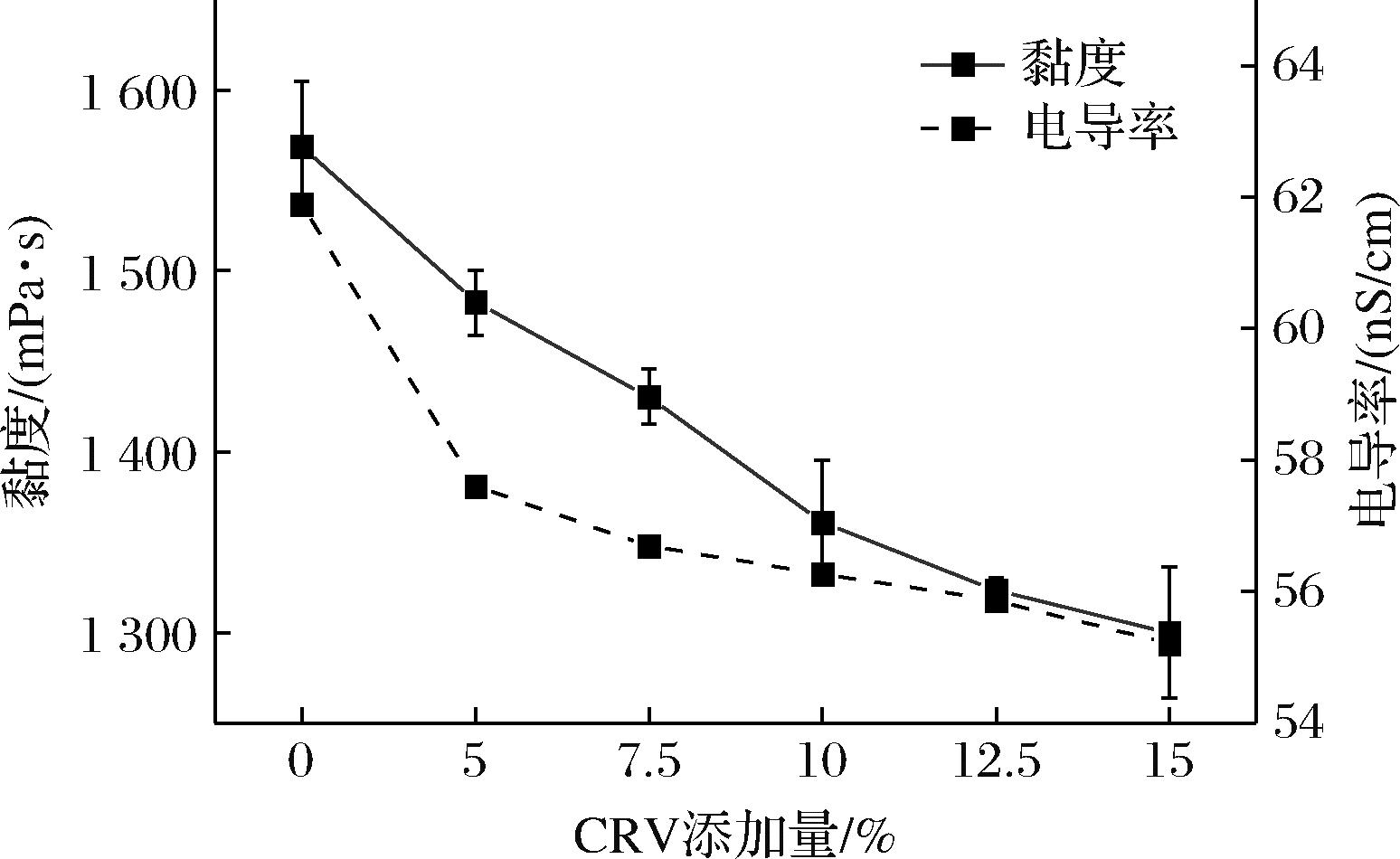
图1 不同CRV添加量纺丝溶液的黏度和电导率
Fig.1 Viscosity and conductivity of spinning solution with different CRV addition
2.2 纤维垫形貌测试
Zein/EC/CRV活性纤维垫的微观形貌如图2所示。整体上看,纺丝垫表面较光滑无串珠,说明纺丝效果良好。但是,CRV的添加量对纤维的平均直径具有一定的影响。由图2-g~图2-l可知,含有0% CRV、5% CRV、7.5% CRV、10% CRV、12.5% CRV和15% CRV纺丝垫的纤维平均直径从(648.0±28.0) nm下降至(385.6±14.5) nm。这是由于CRV的添加会降低纺丝液的黏度,导致Zein/EC聚合物应力松弛时间变短,射流的拉伸力下降,使得纤维在电场中的延展性能较差,从而得到直径更小的纳米纤维[21]。电导率较高的溶液具有更大的电荷承载能力,使得纤维射流在电场作用下承受更大的牵引力,形成均匀的纤维[22]。如图2-a~图2-f所示,CRV的添加会导致纺丝液电导率的降低,减少链缠结现象,但会形成非均匀的纺丝纤维。

a、g-0%CRV;b、h-5%CRV;c、i-7.5%CRV;d、j-10%CRV;e、k-12.5%CRV;f、l-15%CRV
图2 不同CRV含量制备的Zein/EC/CRV的SEM图(a、b、c、d、e、f)及直径频数分布(g、h、i、j、k、l)图
Fig.2 SEM images of Zein/EC/CRV and frequency distribution of diameter prepared with different CRV content
2.3 FTIR分析
图3为Zein、EC、CRV、Zein/EC和Zein/EC/CRV的FTIR谱图。Zein粉末1 527、1 644 cm-1分别为N—H弯曲振动、C—N伸缩振动和C![]() O伸缩振动,2 923和2 961 cm-1为C—H伸缩振动,3 293 cm-1为O—H伸缩振动。EC粉末中1 052和1 375 cm-1处特征峰为C—H弯曲振动,2 870和2 973 cm-1分别为C—H对称和不对称伸缩振动,3 473 cm-1为O—H伸缩振动[23]。CRV中810和865 cm-1为芳香环C
O伸缩振动,2 923和2 961 cm-1为C—H伸缩振动,3 293 cm-1为O—H伸缩振动。EC粉末中1 052和1 375 cm-1处特征峰为C—H弯曲振动,2 870和2 973 cm-1分别为C—H对称和不对称伸缩振动,3 473 cm-1为O—H伸缩振动[23]。CRV中810和865 cm-1为芳香环C![]() C伸缩振动,1 252 cm-1为C—O伸缩振动,1 620~1 523 cm-1为CRV芳香环C—C伸缩振动,2 870 和2 960 cm-1分别为C—H对称和不对称伸缩振动,3 370 cm-1为CRV分子间O—H伸缩振动[24]。Zein/EC复合纤维垫中1 050和1 536 cm-1为EC的特征峰,1 641 cm-1为Zein的特征峰,即Zein/EC纤维垫中存在C—H和N—H弯曲振动。Zein/EC/CRV纤维垫810 cm-1为CRV的特征峰,CRV分子中1 620~1 523 cm-1处C—C与Zein中1 644~1 527 cm-1 处C
C伸缩振动,1 252 cm-1为C—O伸缩振动,1 620~1 523 cm-1为CRV芳香环C—C伸缩振动,2 870 和2 960 cm-1分别为C—H对称和不对称伸缩振动,3 370 cm-1为CRV分子间O—H伸缩振动[24]。Zein/EC复合纤维垫中1 050和1 536 cm-1为EC的特征峰,1 641 cm-1为Zein的特征峰,即Zein/EC纤维垫中存在C—H和N—H弯曲振动。Zein/EC/CRV纤维垫810 cm-1为CRV的特征峰,CRV分子中1 620~1 523 cm-1处C—C与Zein中1 644~1 527 cm-1 处C![]() O和C—N伸缩振动重叠,Zein/EC/CRV纤维垫FTIR光谱中CRV的特征峰不明显,CRV被均匀分散在Zein/EC内部。Zein/EC和Zein/EC/CRV均没有出现新的特征峰,可认为Zein、EC和Zein、EC、CRV之间仅发生物理混合,并不发生化学反应。
O和C—N伸缩振动重叠,Zein/EC/CRV纤维垫FTIR光谱中CRV的特征峰不明显,CRV被均匀分散在Zein/EC内部。Zein/EC和Zein/EC/CRV均没有出现新的特征峰,可认为Zein、EC和Zein、EC、CRV之间仅发生物理混合,并不发生化学反应。
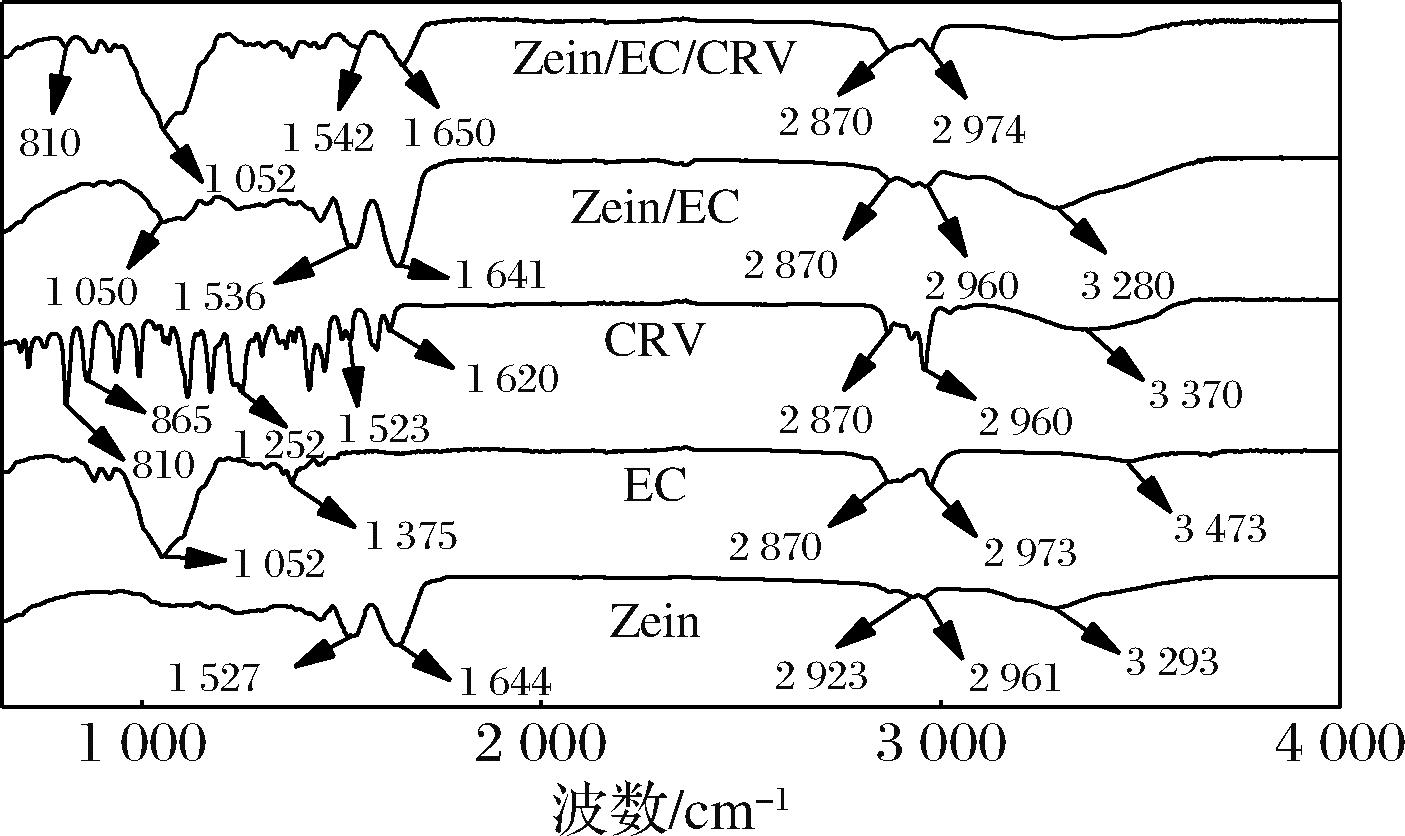
图3 Zein、EC、CRV、Zein/EC和Zein/EC/CRV的FTIR谱图
Fig.3 FTIR spectra of Zein, EC, CRV, Zein/EC and Zein/EC/CRV
2.4 纤维垫接触角分析
如图4所示,Zein分子含有大量的疏水氨基酸,能够与其他疏水性较强的物质形成疏水键[25],EC含有大量具有疏水性能的乙基基团,因此Zein/EC纤维垫具有很强的疏水性[26],接触角高达113.6°。在添加不同比例的CRV后,Zein/EC/CRV纤维垫显示出更高的疏水行为,这是由于CRV中包含疏水基团苯环,使得CRV在疏水环境中可能表现出较强的亲和力,阻止了水滴进入到纤维垫的内部。随着CRV的添加量从5%增加至15%,Zein/EC/CRV纤维垫的水接触角从128.9°下降至119.8°,这可能是因为过量的CRV会提供更多的亲水基团酚羟基,随着CRV添加量的增加,纤维垫表面的极性基团数量增加,从而提高亲水性,降低接触角。在纤维垫干燥过程中,大量CRV的蒸发以及CRV液滴在纺丝材料侧和空气侧的不同取向也有可能是导致接触角减小的原因。
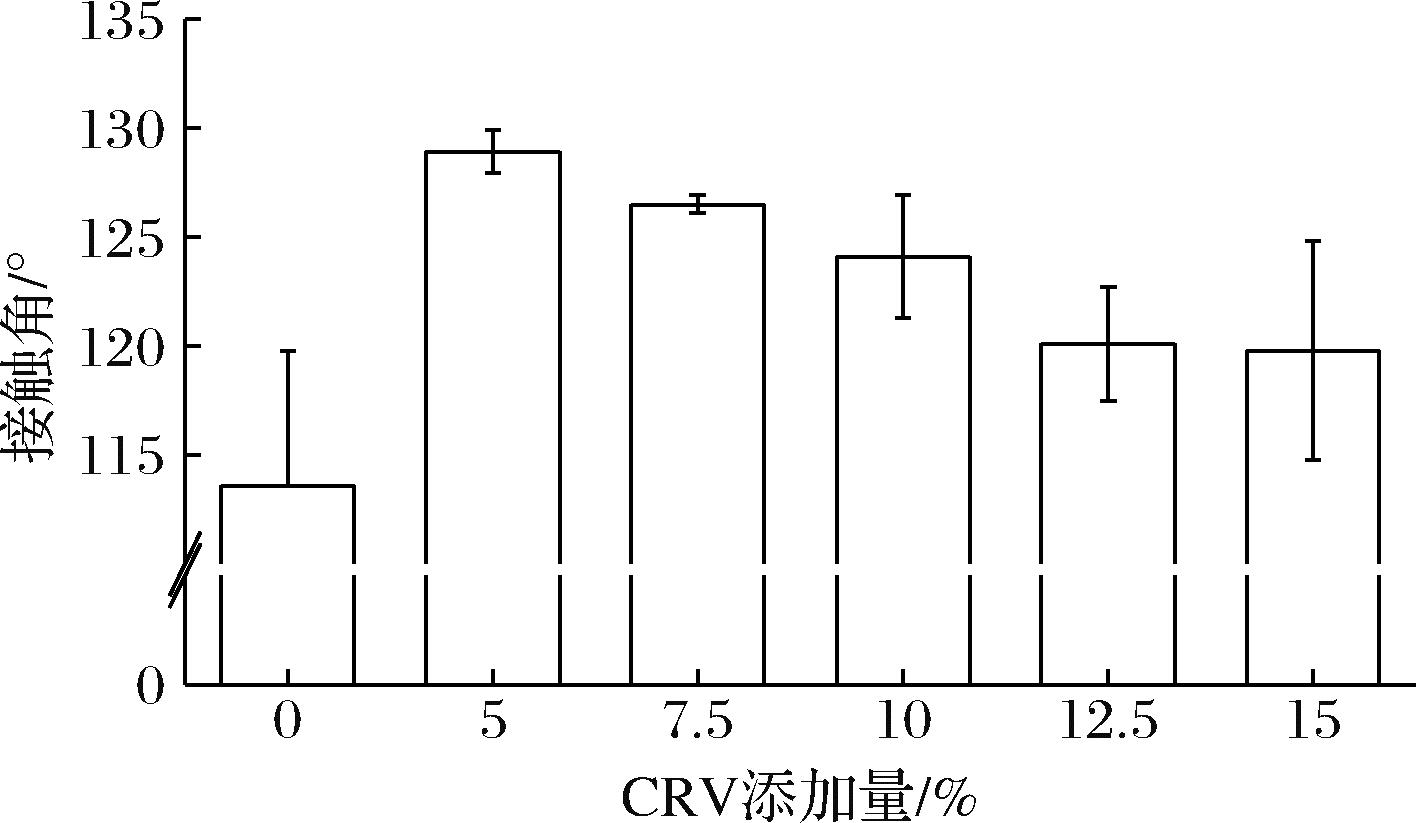
图4 Zein/EC/CRV的接触角
Fig.4 Contact angle of Zein/EC/CRV
2.5 CRV包埋率和负载率分析
由于静电纺丝过程中不存在任何热反应,有利于实现活性功能材料良好的包埋与负载。如图5所示,所有纤维垫中CRV的包埋率均大于80%,表明CRV在Zein/EC中实现优异的包埋。一般来说,不同的基材和精油浓度会直接影响最终包埋率,Zein/EC基材具有高孔隙率,能够有效作为CRV包埋和输送的载体[27]。随着CRV添加量的增加,包埋率呈现下降趋势,原因可能是较高添加量的CRV在纺丝过程中挥发速度较快,从而导致CRV质量的损失。CRV的负载率从4.66%升高至12.56%,可能是因为CRV与EC或Zein发生相互作用形成氢键,从而增加CRV与Zein/EC的结合能力,从而提高了材料中CRV的负载率。
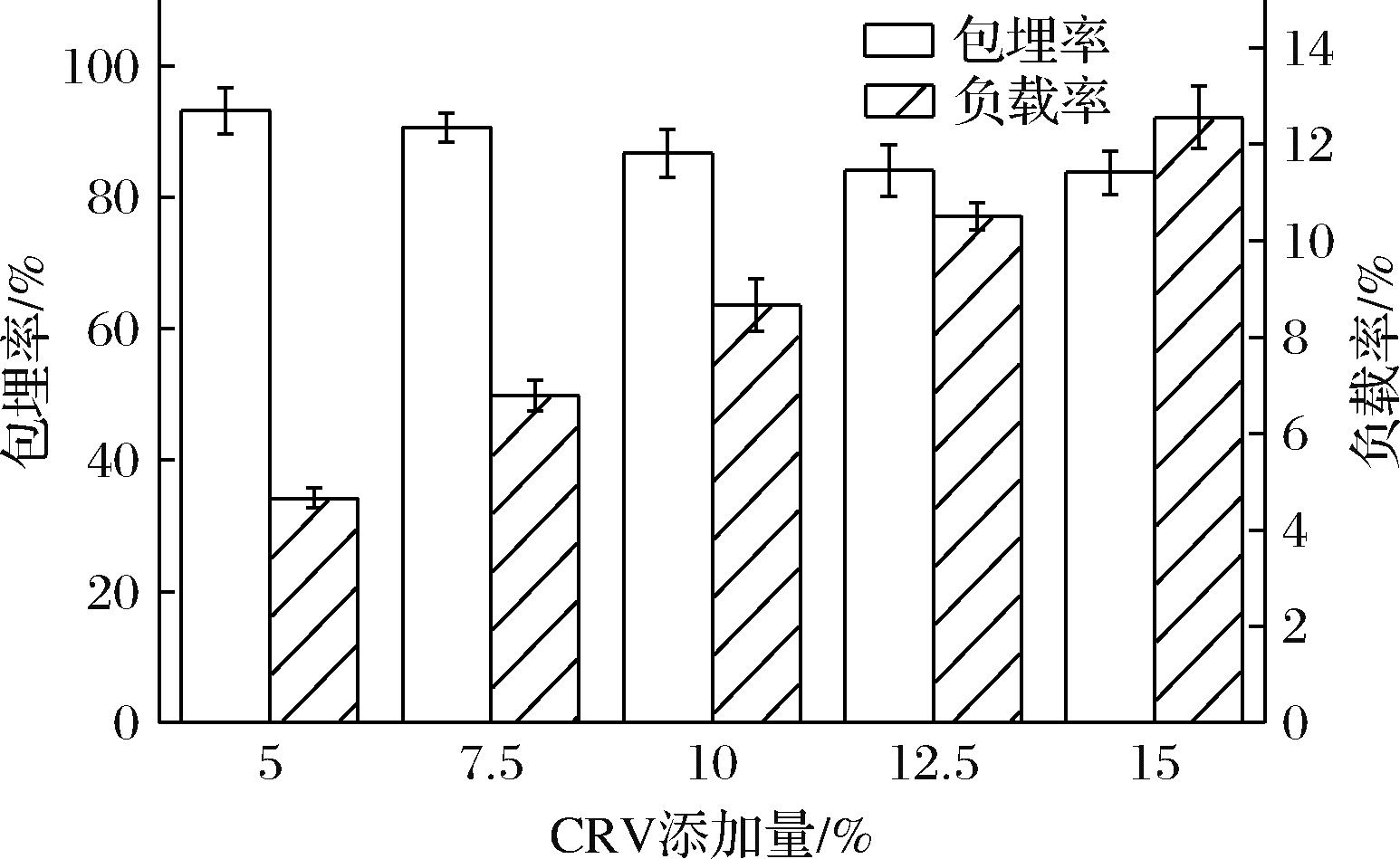
图5 Zein/EC/CRV中CRV包埋率和负载率
Fig.5 Encapsulation efficiency and loading capacity of CRV in Zein/EC/CRV
2.6 纤维垫抗氧化性分析
如图6所示,纯Zein/EC纤维垫具有较强的抗氧化能力,在4 h和24 h时DPPH分别为28.9%和36.3%,这是由于Zein的谷氨酸短肽表现出很强的抗氧化活性,加速了DPPH自由基的清除[6]。CRV添加量的增加提高了纤维垫的抗氧化能力,当CRV添加量为15%时,24 h时纤维垫DPPH自由基清除率为70.4%,比CRV添加量为5%时提高了17.3%,这主要是由于CRV具有强大的供氢能力[12],可以降低或去除自由基活性。此外,从4 h到24 h,DPPH自由基清除率持续增加,表明CRV在Zein/EC纤维垫中持续释放,Zein/EC有良好的包埋和缓释效果。

图6 Zein/EC/CRV的DPPH自由基清除率
Fig.6 Scavenging rates of Zein/EC/CRV DPPH free radical
2.7 纤维垫气相抑菌性能分析
如图7所示,由于Zein和EC本身不具有抑菌活性,CK组对E.coli和S.aurues的生长无显著抑制作用。随着CRV添加量从5%增加至15%,Zein/EC/CRV对E.coli的生长抑制率从16.5%提高至76%,对S.aurues的生长抑制率从18.9%提高至93.4%。一般来说,含有疏水性化合物的精油和植物提取物可以与细菌、线粒体细胞膜和其他细胞内化合物的脂质结构相互作用,导致细胞结构破坏、离子交换。而由于CRV具有疏水性,可诱导微生物膜渗透性改变,从而导致质子、磷酸盐和钾离子泄漏,影响其流动性、完整性和功能性[28]。细胞活性下降,从而抑制微生物的生长。从抑菌效果发现CRV对S.aurues的抑菌率高于E.coli,由此推测ZE/EC/CRV纤维垫对革兰氏阳性细菌的抑菌性强于革兰氏阴性菌,这是由于革兰氏阴性菌细胞膜中富含亲水性脂多糖和蛋白质,限制酚类物质与细菌内部蛋白结合。而革兰氏阳性细菌没有外膜屏障,CRV更容易穿过细菌细胞壁,直接作用于细胞内部[29]。
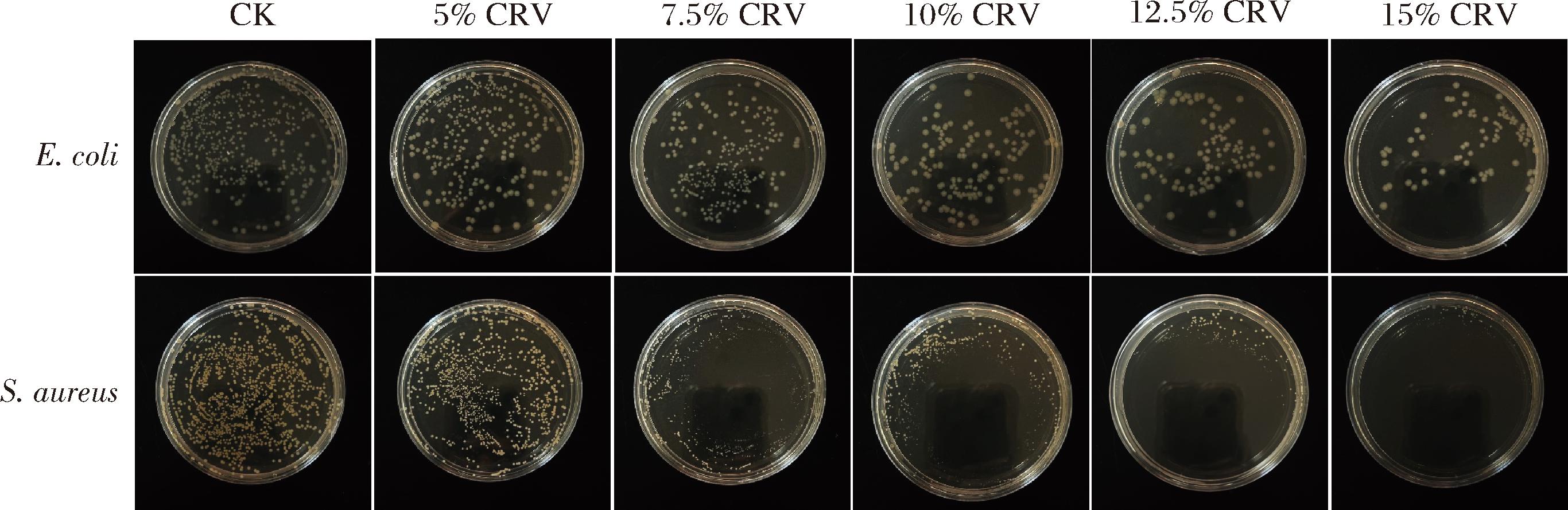
图7 Zein/EC/CRV对E.coli和S.aurues的气相抑菌活性
Fig.7 Gas-phase antimicrobial activity of Zein/EC/CRV against E.coli and S.aurues
2.8 纤维垫CRV释放性能分析
如图8所示,随着时间的推移,纤维垫中CRV的释放量呈递增趋势,到第10天后释放速率逐渐趋于稳定。这是由于被吸收或束缚在纤维表面的CRV会优先释放,包埋在纤维垫内部的CRV会逐渐释放,导致释放速率降低,表明纤维垫对CRV的挥发性释放有良好的控释作用。5% CRV、7.5% CRV、10% CRV、12.5% CRV、15% CRV纤维垫平衡前的累计释放百分比分别为38.0%、42.5%、45.3%、54.5%、59.0%。同时,Zein/EC/CRV纤维垫中CRV的释放量和释放速率与CRV的添加量成正比关系,即CRV添加量越高,CRV的释放量和释放速率也依次增加。

图8 23 ℃下Zein/EC/CRV累计释放曲线
Fig.8 Cumulative release curve of Zein/EC/CRV at 23 ℃
2.9 贮藏期间蛋糕新鲜度评价
未添加防腐剂的蛋糕在无特定保存条件下的货架期受限于微生物生长,通常仅为3~5 d。图9显示,CK组包装的蛋糕表皮在贮存第5天开始出现菌丝的生长,这表明蛋糕的表观品质已经发生劣变,货架期终止。进一步对CK组进行跟踪观察后发现,第10天时蛋糕表皮的菌丝直径和数量呈现逐渐增加的趋势。包装含有5% CRV纤维垫的蛋糕,在贮藏期10 d内未观察到表皮出现菌丝生长的现象。该现象可归因于CRV在较高脂肪的蛋糕基质中具备较高的溶解度,使其在包装过程中产生更多的释放,并导致蛋糕对CRV的吸收程度加剧[30],进一步证明Zein/EC/CRV纤维垫具有有效抗真菌活性包装的特性。
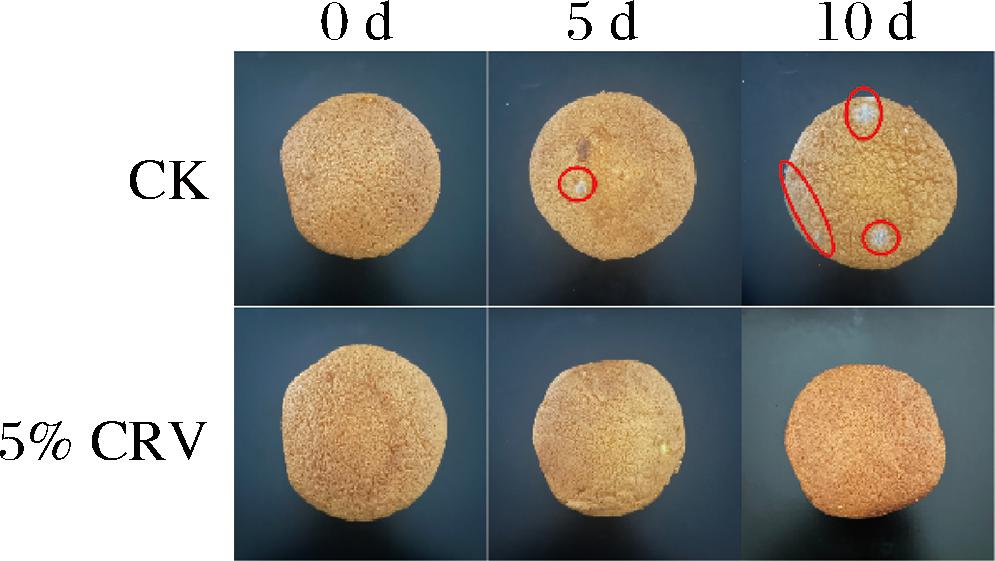
图9 两种不同包装的蛋糕在贮藏过程中的表观图
Fig.9 Appearance of cakes in two different packages during storage
2.10 蛋糕的酸价分析
酸价是衡量游离脂肪酸数量的标准,可作为油脂酸败的指标。酸价越低,油脂的新鲜度和精炼程度越高。如图10所示,随着贮藏天数的增加,蛋糕的酸价在不断升高。贮藏10 d后,CK组蛋糕的酸价从0.55 mg/g增加到3.27 mg/g,说明蛋糕在加速氧化;而含5% CRV纤维垫包装的蛋糕酸价曲线呈缓慢增长趋势,其酸价值为1.40 mg/g,显著低于CK组(P<0.05),这是由于CRV具有良好的油脂抗氧化活性,有效减少蛋糕中游离脂肪酸的生成。表明静电纺丝工艺在实现CRV包埋的同时,也提高CRV释放的稳定性。在两种包装条件下,蛋糕的酸价均未超过GB 7099—2015《食品安全国家标准 糕点、面包》所规定的酸价国标限5 mg/100 g,但CK组蛋糕表面在第5天已经出现菌丝,说明在评估蛋糕货架期的终点时,不能仅仅依赖于单一氧化指标的结果。

图10 两种不同包装的蛋糕在贮藏过程中的酸价变化
Fig.10 Changes of acid value of cakes with two different packages during storage
2.11 蛋糕微生物指标测试
如表1所示,在0~10 d的贮藏期间,CK组和CRV纤维垫组蛋糕中菌落总数呈现递增趋势,CK组在第8天和第10天时菌落总数分别达到3.09 lg CFU/g和3.67 lg CFU/g,接近国标限4 lg CFU/g,显著高于纤维垫组(P<0.05)。第10天,5% CRV组菌落总数为1.87 lg CFU/g,仍低于国标限4 lg CFU/g,说明Zein/EC/CRV纤维垫对蛋糕中的细菌具有较强的抑制作用。
表1 两种不同包装的蛋糕在贮藏过程中的菌落总数变化
Table 1 Changes in the aerobic plate count of cakes in two different packages during storage

贮藏时间/d菌落总数/(lg CFU/g)CK5% CRV0--32.32±0.050.77±0.0752.51±0.071.46±0.0183.09±0.011.72±0.03103.67±0.051.87±0.05
注:“-”表示未检出菌落总数。
3 结论与讨论
静电纺丝技术因加工工艺简单、经济高效、能提高活性物质的稳定性等优点受到广泛关注。本研究采用静电纺丝工艺制备了Zein/EC/CRV活性纤维垫,并研究了不同CRV添加量对包埋率、负载率、抗氧化、抑菌以及释放性能的影响。结果表明,Zein/EC/CRV各组分之间未发生化学反应;CRV的添加削弱了纤维在电场中的延展性能,降低了纤维直径。Zein/EC的高孔隙率使CRV在Zein/EC基质中得到优异的包埋效果,CRV的负载率随其含量的增加而逐渐升高。CRV强大的供氢能力降低了自由基活性,使纤维垫具有抗氧化性能;纤维垫通过气相释放CRV来实现抑菌效果,CRV改变了微生物膜的渗透性,降低了细胞活性,从而抑制了微生物的生长,且纤维垫的抗氧化性能和抑菌性能存在“剂量-效应”关系;纤维垫中CRV的释放量和释放速率与CRV的添加量成正比关系。蛋糕贮藏保鲜实验发现,添加了5% CRV的纤维垫能够显著抑制蛋糕的脂质氧化和微生物生长,在10 d内蛋糕表面未出现菌丝生长。本研究中Zein和EC是安全且可降解的物质,CRV为天然的抗菌抗氧化活性剂。综上所述,Zein/EC/CRV纤维垫具有良好的物理结构和功能特性,在食品保鲜领域有广阔的应用潜力。
[1] MAHMOOD K, KAMILAH H, ALIAS A K, et al.Functionalization of electrospun fish gelatin mats with bioactive agents:Comparative effect on morphology, thermo-mechanical, antioxidant, antimicrobial properties, and bread shelf stability[J].Food Science &Nutrition, 2022, 10(2):584-596.
[2] ALEHOSSEINI E, JAFARI S M.Micro/nano-encapsulated phase change materials (PCMs) as emerging materials for the food industry[J].Trends in Food Science &Technology, 2019, 91:116-128.
[3] WEN P, WEN Y, ZONG M H, et al.Encapsulation of bioactive compound in electrospun fibers and its potential application[J].Journal of Agricultural and Food Chemistry, 2017, 65(42):9161-9179.
[4] MELE E.Electrospinning of essential oils[J].Polymers, 2020, 12(4):908.
[5] KASAAI M R.Zein and zein-based nano-materials for food and nutrition applications:A review[J].Trends in Food Science &Technology, 2018, 79:184-197.
[6] GAO Z M, CHEN G T, LU W, et al.Interfacial and emulsion-stabilizing properties of zein nanoparticles:Differences among zein fractions (α-, β-, and γ-zein)[J].Food &Function, 2021, 12(3):1361-1370.
[7] WEI Y X, YAO J R, SHAO Z Z, et al.Water-resistant zein-based adhesives[J].ACS Sustainable Chemistry &Engineering, 2020, 8(20):7668-7679.
[8] RAO J S, SHEN C Y, YANG Z C, et al.Facile microfluidic fabrication and characterization of ethyl cellulose/PVP films with neatly arranged fibers[J].Carbohydrate Polymers, 2022, 292:119702.
[9] AHMADI P, JAHANBAN-ESFAHLAN A, AHMADI A, et al.Development of ethyl cellulose-based formulations:A perspective on the novel technical methods[J].Food Reviews International, 2022, 38(4):685-732.
[10] WU K, YAN X, ZHU D D, et al.Formation and characterization of konjac glucomannan/ethyl cellulose films by using ethanol and water as the solvents[J].International Journal of Biological Macromolecules, 2023, 241:124629.
[11] LU L J, SU Y J, XU J, et al.Development of gas phase controlled-release antimicrobial and antioxidant packaging film containing carvacrol loaded with HNT-4M(halloysite nanotubes etched by 4 mol/L hydrochloric acid)[J].Food Packaging and Shelf Life, 2022, 31:100783.
[12] YILDIZ S, TURAN S, KIRALAN M, et al.Antioxidant properties of thymol, carvacrol, and thymoquinone and its efficiencies on the stabilization of refined and stripped corn oils[J].Journal of Food Measurement and Characterization, 2021, 15(1):621-632.
[13] 程萌, 张荣飞, 逯文倩, 等.香芹酚/海藻酸钠生物复合膜的制备及性能[J].精细化工, 2019, 36(9):1896-1902;1955.
CHENG M, ZHANG R F, LU W Q, et al.Preparation and properties of carvacrol/sodium alginate composite films[J].Fine Chemicals, 2019, 36(9):1896-1902;1955.
[14] SUN L N, LU L X, QIU X L, et al.Development of low-density polyethylene antioxidant active films containing α-tocopherol loaded with MCM-41(Mobil Composition of Matter No.41) mesoporous silica[J].Food Control, 2017, 71:193-199.
[15] LI Z Y, LIN S B, AN S Y, et al.Preparation, characterization and anti-aflatoxigenic activity of chitosan packaging films incorporated with turmeric essential oil[J].International Journal of Biological Macromolecules, 2019, 131:420-434.
[16] 曾少甫, 胡长鹰, 匡衡峰, 等.肉桂醛在壳聚糖复合活性包装膜中的释放及在鲜猪肉冷藏中的应用[J].食品科学, 2018, 39(9):182-189.
ZENG S F, HU C Y, KUANG H F, et al.Release of cinnamaldehyde from active chitosan composite packaging films and its application in quality preservation of fresh pork[J].Food Science, 2018, 39(9):182-189.
[17] CHINNAPPAN B A, KRISHNASWAMY M, XU H Z, et al.Electrospinning of biomedical nanofibers/nanomembranes:Effects of process parameters[J].Polymers, 2022, 14(18):3719.
[18] MILOVANOVIC S, ADAMOVIC T, AKSENTIJEVIC K, et al.Cellulose acetate based material with antibacterial properties created by supercritical solvent impregnation[J].International Journal of Polymer Science, 2017, 2017(1):8762649.
[19] M![]() CZKA W, TWARDAWSKA M, GRABARCZYK M, et al.Carvacrol-a natural phenolic compound with antimicrobial properties[J].Antibiotics, 2023, 12(5):824.
CZKA W, TWARDAWSKA M, GRABARCZYK M, et al.Carvacrol-a natural phenolic compound with antimicrobial properties[J].Antibiotics, 2023, 12(5):824.
[20] HOMAYOUNI H, KAVOOSI G, NASSIRI S M.Physicochemical, antioxidant and antibacterial properties of dispersion made from tapioca and gelatinized tapioca starch incorporated with carvacrol[J].LWT, 2017, 77:503-509.
[21] GUO Y J, WANG X Y, SHEN Y, et al.Research progress, models and simulation of electrospinning technology:A review[J].Journal of Materials Science, 2022, 57(1):58-104.
[22] 刘毅, 李柏良, 高宝善, 等.香芹酚/明胶/聚乙烯醇纤维膜的制备及其抗氧化性能[J].精细化工, 2023, 40(9):1910-1918.
LIU Y, LI B L, GAO B S, et al.Fabrication and antioxidant properties of carvacrol/gelatin/polyvinyl alcohol fibrous membranes[J].Fine Chemicals, 2023, 40(9):1910-1918.
[23] LU H Y, WANG Q Q, LI G H, et al.Electrospun water-stable zein/ethyl cellulose composite nanofiber and its drug release properties[J].Materials Science and Engineering:C, 2017, 74:86-93.
[24] 詹俊杰, 周星海, 张晋豪, 等.香芹酚/β-环糊精包合物制备及熏蒸防治白菜根肿病的研究[J].江西农业大学学报, 2023, 45(3):663-672.
ZHAN J J, ZHOU X H, ZHANG J H, et al.Study on preparation of carvacrol/β-cyclodextrin inclusion complex and fumigation to control cabbage clubroot[J].Acta Agriculturae Universitatis Jiangxiensis, 2023, 45(3):663-672.
[25] YAN X J, LI M T, XU X F, et al.Zein-based nano-delivery systems for encapsulation and protection of hydrophobic bioactives:A review[J].Frontiers in Nutrition, 2022, 9:999373.
[26] WU K, ZHU Q, QIAN H, et al.Controllable hydrophilicity-hydrophobicity and related properties of konjac glucomannan and ethyl cellulose composite films[J].Food Hydrocolloids, 2018, 79:301-309.
[27] ZAHABI N, GOLMAKANI M T, FAZAELI M, et al.Electrospinning of glutelin-hordein incorporated with Oliveria decumbens essential oil:Characterization of nanofibers[J].Colloids and Surfaces B:Biointerfaces, 2021, 208:112058.
[28] ZHANG D, GAN R Y, GE Y Y, et al.Research progress on the antibacterial mechanisms of carvacrol:A mini review[J].Bioactive Compounds in Health and Disease, 2018, 1(6):71.
[29] 张群利, 罗灏, 崔琳琳, 等.鱼鳞明胶/壳聚糖/薰衣草精油抗菌复合膜的制备及性能[J].精细化工, 2022, 39(11):2259-2267.
ZHANG Q L, LUO H, CUI L L, et al.Preparation and performance of fish scale gelatin/chitosan/lavender essential oil antibacterial composite film[J].Fine Chemicals, 2022, 39(11):2259-2267.
[30] WANG L, HEISING J, FOGLIANO V, et al.Fat content and storage conditions are key factors on the partitioning and activity of carvacrol in antimicrobial packaging[J].Food Packaging and Shelf Life, 2020, 24:100500.