类胡萝卜素是一类脂溶性四萜类色素,构成人类饮食中的必需营养素[1]。目前已发现1 100多种类胡萝卜素,其特殊的分子结构中包括多个共轭双键和非共轭双键,具有抗衰老、抗癌、抗菌、抗氧化和护眼等功能,广泛应用于水产养殖、食品、饲料添加剂和化妆品等行业[2-5]。动物和人不能合成类胡萝卜素,需要通过摄取食物或其他补充剂吸收类胡萝卜素[6]。然而目前80%~90%的类胡萝卜素是化学合成的,化学合成类胡萝卜素不仅具有挑战性且成本高昂,还很可能导致一些有毒物质的形成,引起人们对其所产生的不良副作用如毒性、致畸性和致癌性的担忧[7-9]。因此,寻找天然来源的类胡萝卜素具有重要的意义。
红毛藻(Bangia fusco-purpurea)作为一种高营养价值的可食用经济海藻,是人类饮食中类胡萝卜素的天然来源之一。自20世纪90年代以来,在福建省大量种植,年产量约为80~100 t(干重)[10-12]。红毛藻中的类胡萝卜素主要包括玉米黄素、叶黄质、α-胡萝卜素及β-胡萝卜素等,具有增强免疫力、降血压、降血脂和防止心血管疾病等功效[13-17]。目前,对红毛藻的研究主要集中在多糖和藻红蛋白等生物活性物质上[13, 18-19],对其类胡萝卜素的研究较少。
溶剂萃取法是从天然物质中获得高价值的生物分子的有效手段之一,影响因素少、成本低、不用复杂的设备[20-22]。通过混料设计来优化溶剂配比能够快速准确地找到最优方案,且能很好地分析不同因素之间的相关性和目标值,该设计具有参数预测精度高、多目标同步优化的特点。因此,本研究以红毛藻为研究对象,以类胡萝卜素提取量为评价指标,采用混料设计中的单纯形质心方法对提取溶剂(正己烷、丙酮和乙醇)的组成比例进行设计,通过分析实验结果建立回归模型,考察各组分对红毛藻类胡萝卜素提取效果的影响规律,得到提取溶剂的最优配比。并在此基础上,对温度、液料比和提取次数进行优化,得到提取类胡萝卜素的最佳工艺条件,旨在为红毛藻类胡萝卜素的高效提取提供理论依据和技术支持。
1 材料与方法
1.1 材料和试剂
红毛藻,福建莆田市;二氯甲烷、正己烷、丙酮、无水乙醇,分析纯,国药集团上海化学试剂有限公司;β-胡萝卜素标准品,美国Sigma-Aldrich公司。
1.2 仪器与设备
BS233S型电子天平,德国赛多利斯科学仪器厂;UV1920型紫外-可见分光光度计,上海棱光技术有限公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂。
1.3 红毛藻中类胡萝卜素的提取
参考CER N-GARC
N-GARC A等[23]的方法,并略作修改。将红毛藻除杂后于60 ℃的烘箱中干燥3 h,用超微粉碎机粉碎并过100目筛得到红毛藻粉。精密称取1 g的红毛藻粉于50 mL离心管,加入一定量的提取溶剂后涡旋30 s;再将离心管浸入水浴中提取5 min并于室温下避光冷却30 min;最后在4 ℃ 8 000 r/min的条件下离心5 min,收集上清液,沉淀则用等量提取溶剂重复提取一定次数,合并所有上清液并旋蒸浓缩至干,用二氯甲烷溶解,得到质量浓度为10 mg/mL的母液,于-20 ℃冰箱保存。
A等[23]的方法,并略作修改。将红毛藻除杂后于60 ℃的烘箱中干燥3 h,用超微粉碎机粉碎并过100目筛得到红毛藻粉。精密称取1 g的红毛藻粉于50 mL离心管,加入一定量的提取溶剂后涡旋30 s;再将离心管浸入水浴中提取5 min并于室温下避光冷却30 min;最后在4 ℃ 8 000 r/min的条件下离心5 min,收集上清液,沉淀则用等量提取溶剂重复提取一定次数,合并所有上清液并旋蒸浓缩至干,用二氯甲烷溶解,得到质量浓度为10 mg/mL的母液,于-20 ℃冰箱保存。
1.4 类胡萝卜素最大吸收波长的确定
按照1.3节的方法,称取0.1 mg β-胡萝卜素标准品于离心管,再加入1 mL二氯甲烷将其配制成质量浓度为100 μg/mL的标准品样液,于波长范围为350~550 nm的紫外-可见分光光度计进行全波长扫描,最大吸收峰处的波长即为最适检测波长。
1.5 标准曲线绘制
取适量β-胡萝卜素标准品用二氯甲烷溶解并稀释成质量浓度为0、2、4、6、8、10 μg/mL的标准品样液,在1.4节得到的最适波长450 nm下测定不同样液的吸光度。将标准品样液的浓度为横轴,所测得的吸光度值为纵轴,绘制β-胡萝卜素标准品的标准曲线,所得标准曲线为:y=0.112 2x+0.116 2(R2=0.998 4),在有效浓度范围内该曲线存在良好的线性关系。
1.6 类胡萝卜素提取量的测定
将红毛藻提取的母液用二氯甲烷稀释并于450 nm处测定吸光值,即A450。用二氯甲烷溶液于紫外-可见分光光度计调零,每组试验做3个平行。参考李灵等[24]的方法,带入标准曲线计算质量浓度,提取物中总类胡萝提取量X(单位mg/g DW,即每克干重提取物中所含的总类胡萝素毫克数)按公式(1)计算:
(1)
式中:X,类胡萝卜素的提取量,mg/g;C,样品溶液的类胡萝卜素质量浓度,μg/mL;V,母液溶剂体积,mL;N,稀释倍数;m,红毛藻样品的质量,g。
1.7 混料实验设计
本实验采用单纯形质心设计,根据Minitab 19软件生成的设计方案进行实验,建立实验结果的数学模型和优化参数。工艺条件参考胡建中[25]并略作修改,初始条件设为水浴温度40 ℃、提取次数3和液料比20∶1 (mL/g),以正己烷(A)、乙醇(B)和丙酮(C)试剂配比比例为自变量,类胡萝卜素提取量为因变量,对提取溶剂(正己烷、乙醇和丙酮)按照体积比例进行配方设计,利用选取的实验点组成11个实验组合提取类胡萝卜素,从而确定最佳试剂组合比例。
1.8 单因素试验
1.8.1 液料比的选择
采用1.3节的方法提取,以混料实验得到的最优溶剂组合提取红毛藻中的类胡萝卜素,在初始条件为水浴温度40 ℃、离心5 min和提取次数3,考察提取液料比[5∶1、10∶1、15∶1、20∶1、25∶1 (mL∶g)]对类胡萝卜素提取量的影响。
1.8.2 提取温度的选择
采用1.3节的方法提取,以混料实验得到的最优溶剂组合作为提取溶剂,在初始条件为液料比20∶1(mL/g)、离心时间5 min和提取次数3,考察水浴温度(20、30、40、50、60 ℃)对类胡萝卜素提取量的影响。
1.8.3 提取次数的选择
采用1.3节的方法提取,以混料实验得到的最优溶剂组合作为提取溶剂,在初始条件为液料比20∶1(mL/g)、水浴温度40 ℃和离心时间5 min,考察提取次数(1、2、3、4、5)对类胡萝卜素提取量的影响。
1.9 数据处理
采用Excel 2021 整理数据,用GraphPad Prism 8进行作图,显著性分析采用SPSS 26.0软件,混料设计采用Minitab19软件,实验数据重复测定3次。
2 结果与分析
2.1 检测波长的确定
用紫外-可见分光光度计对β-胡萝卜素标准品样液进行波长扫描,如图1所示,β-胡萝卜素在450 nm处有吸收峰,在420、480 nm出现典型峰,根据文献[22],符合类胡萝卜素的特征吸收。因此,确定450 nm为红毛藻中类胡萝卜素的测定波长。
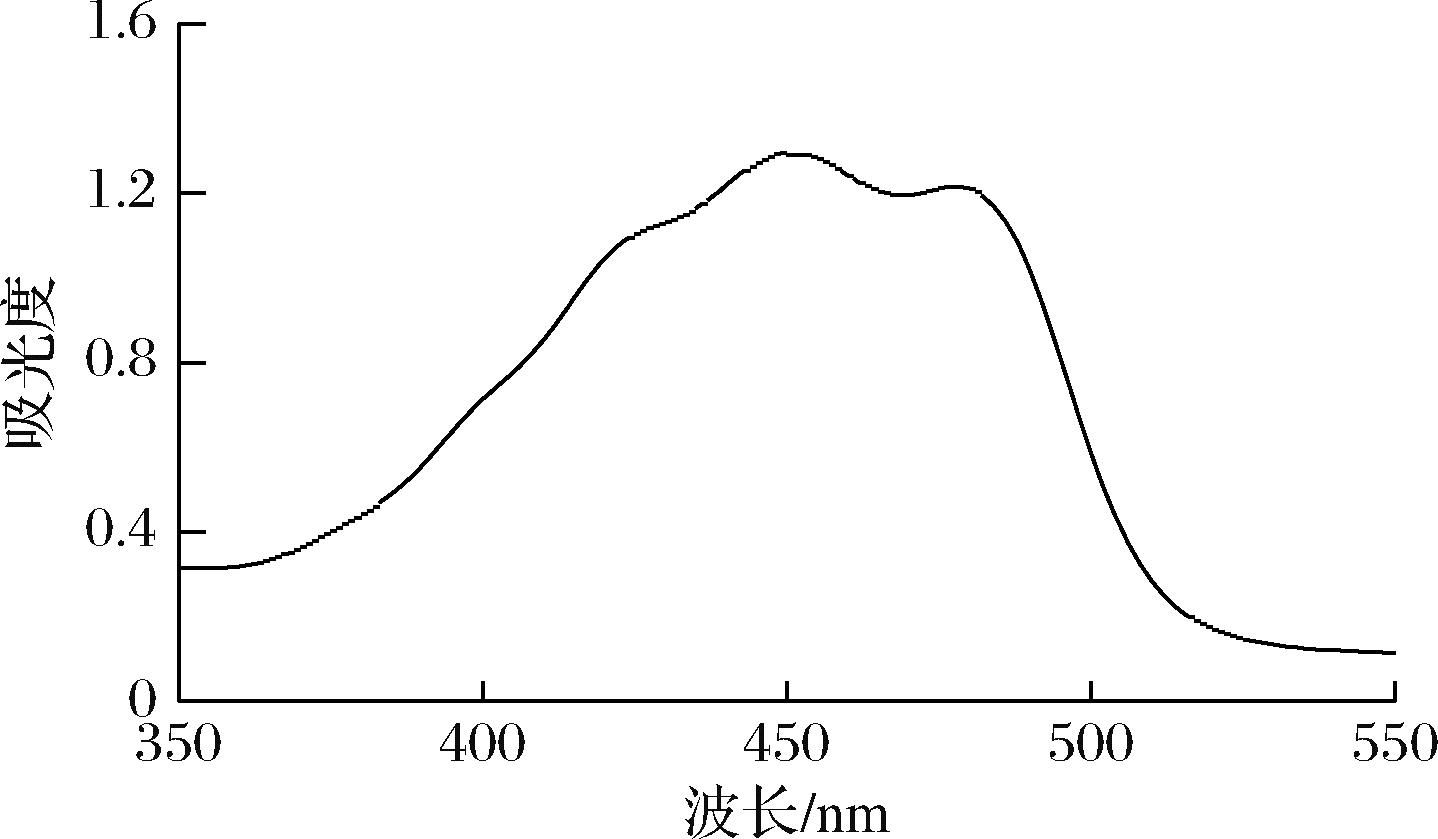
图1 β-胡萝卜素紫外-可见分光光度吸收光谱图
Fig.1 UV-Visible spectrum of the β-carotenoid
2.2 混料实验验证
2.2.1 模型的建立与显著性分析
应用混料设计进行优化实验,混料设计方案见表1。运用Minitab 19软件分析最优混料设计结果,获得红毛藻中类胡萝卜素提取量(Y)与正己烷(A)、乙醇(B)和丙酮(C)之间的关系,建立回归模型如下:Y=1.55A+1.72B+1.73C+0.06AB-0.52AC-1.47ABC。
表1 混料配方设计
Table 1 Design of mixed substrate

序号试剂比例ABC110021/31/31/331/201/2401/21/2501061/21/2070018100901010001111/31/31/3
注:A、B和C分别表示混料设计中正己烷、乙醇和丙酮体积比例。
如表2所示,由不同试剂配比对红毛藻类中胡萝卜素提取量影响的模型发现,线性混合和二次模型都达到了的极显著水平(P<0.01),且失拟项P值为0.135 7>0.05,表明失拟项相对于误差不显著,说明此模型的回归方程对实验表现出较好的拟合度和较小的误差。此外,综合方程相关系数R2为0.981 0,说明类胡萝卜素提取量Y的变异至少有98.1%是由变量A、B、C引起的,只有1.9%不能用该模型解释。校正后的相关系数![]() 为0.962 1,说明该模型与试验组拟合良好且能较好地考察指标与配方之间的关系。
为0.962 1,说明该模型与试验组拟合良好且能较好地考察指标与配方之间的关系。
表2 方差分析结果
Table 2 Results of analysis of variance

方差来源自由度平方和均方FP显著性模型50.362 80.362 851.758 90.000 3∗∗线性20.105 90.040 214.354 70.008 5∗∗二次30.256 90.256 961.076 90.000 2∗∗AB10.003 50.000 00.035 60.857 7AC10.036 00.020 514.646 20.012 3∗BC10.217 30.217 3155.044 80.000 1∗∗残差50.007 00.007 0失拟项10.003 30.003 33.475 80.135 7纯误差40.003 80.003 8总离差100.369 8R20.981 0R2Adj0.962 1
注:*P<0.05为差异显著,**P<0.01为差异极显著,***P<0.000 1为差异极其显著。
2.2.2 三元等高线图分析
利用Minitab 19软件在完成回归方程模型的基础上,做出正己烷(A)、乙醇(B)、丙酮(C) 3个混料因子之间相互作用对红毛藻类中胡萝卜素提取量影响的3D响应面曲线图和等高线图。
如图2所示,越接近B(乙醇)和C(丙酮)的等高线越密集,表现为曲线交陡,说明乙醇和丙酮对于红毛藻中类胡萝卜素的提取影响大且交互作用显著(P<0.05)。
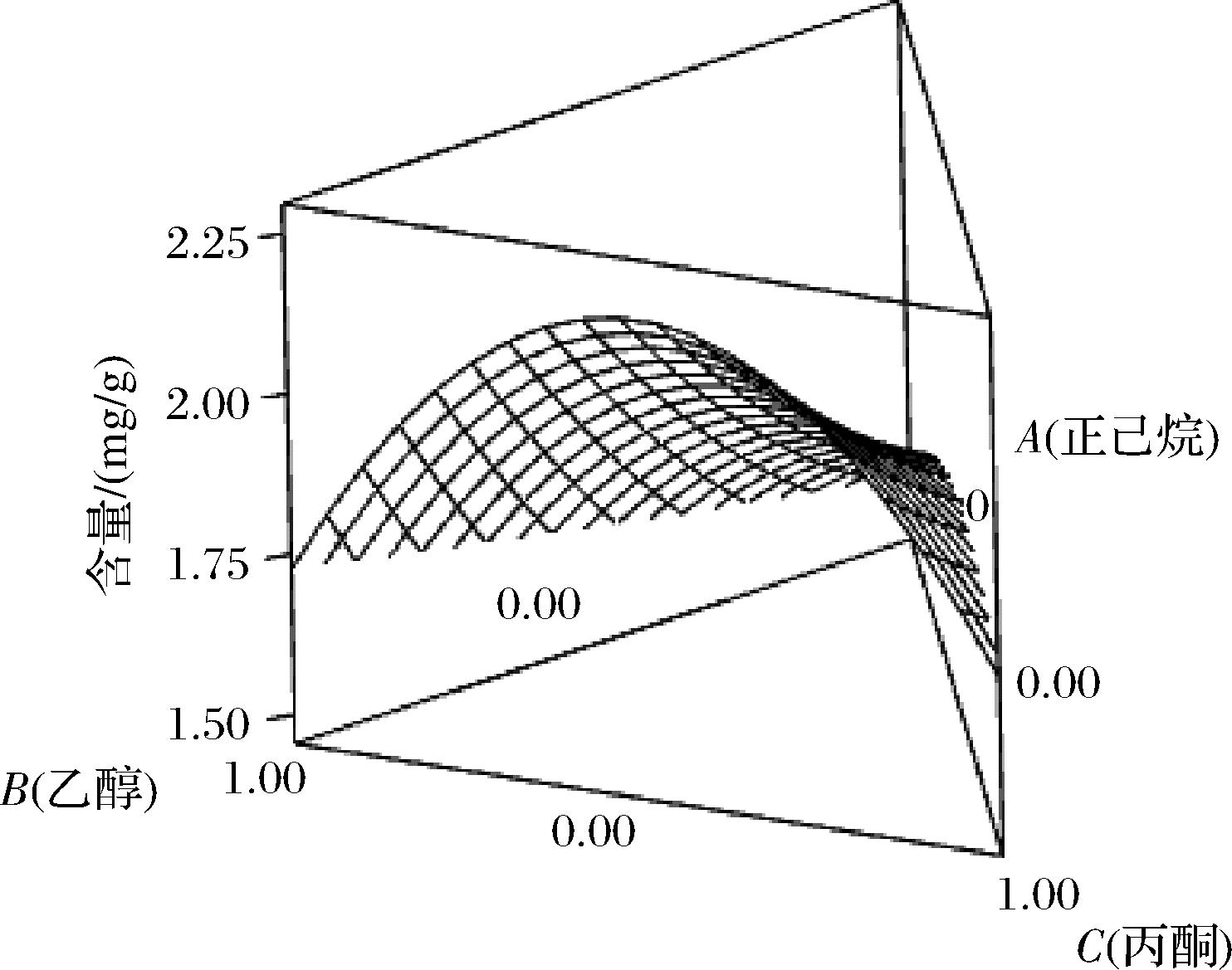
图2 试剂比例变化对类胡萝卜素提取量影响的3D响应面图
Fig.2 3D response surface plot of the influence of changes in reagent ratios on carotenoids content
3个变量(A、B、C)交互作用对类胡萝卜素提取量所形成的等高线图如图3所示。等高线的形状越趋近于椭圆形,表明3个混料因子之间的交互作用对类胡萝卜素提取量的影响越显著(P<0.05),其形状越趋近圆形则与之相反[26]。图3结果可以看出因子B(乙醇)和C(丙酮)之间的等高线呈椭圆形,说明两者的交互作用显著(P<0.05)。相比较而言,正己烷(A)和B(乙醇)之间,以及正己烷(A)和C(丙酮)之间的交互作用较小。
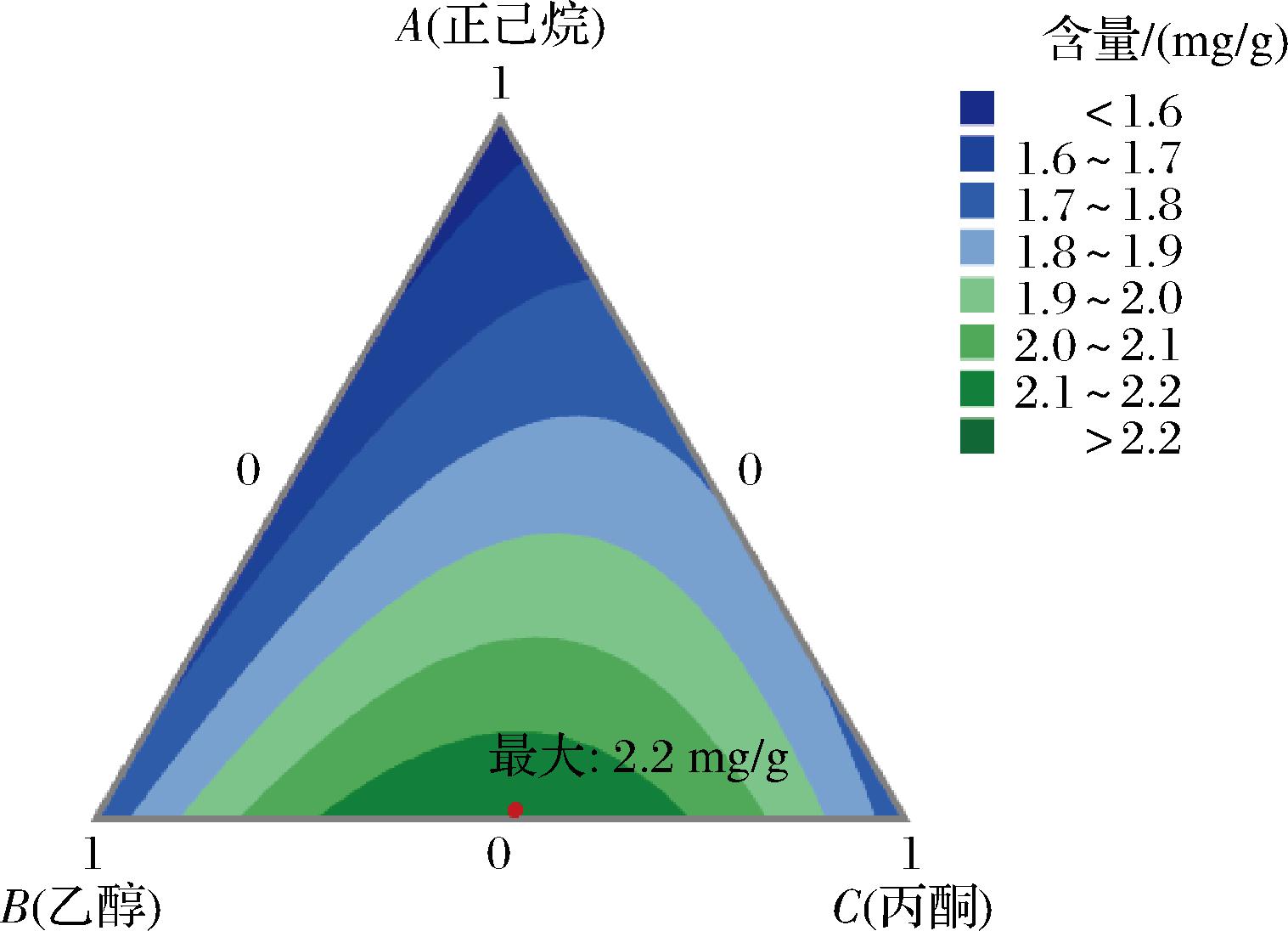
图3 混料设计因素对类胡萝卜素提取影响的等高线图
Fig.3 Contour plot of the effect of mix design factors on carotenoids content
通过上述对模型的拟合分析,并根据Minitab 19软件响应优化器得到的提取类胡萝卜素的最优试剂组合B(乙醇)∶C(丙酮)的比例为1∶1,混料模型得到预测类胡萝卜素的最大提取量为2.202 mg/g。
2.2.3 混料最优试剂组合的验证
采用上述最优试剂组成V(乙醇)∶V(丙酮)=1∶1进行3组平行验证试验,结果如表3所示。红毛藻中类胡萝卜素的平均提取量为2.192 mg/g,实测值和预测值的偏差率小于5%,能充分说明混料设计的过程变量对类胡萝卜素提取量的影响,所得到的最佳组合可信、可靠,进一步说明混料模型能很好地优化红毛藻中类胡萝卜素提取的试剂组成,混料过程变量的设计具有科学性和可行性。
表3 验证结果
Table 3 Validation results
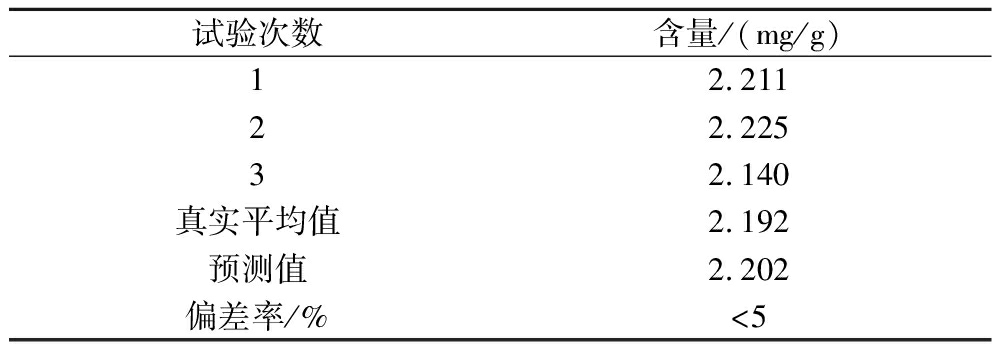
试验次数含量/(mg/g)12.21122.22532.140真实平均值2.192预测值2.202偏差率/%<5
2.3 单因素试验
为确定红毛藻中类胡萝卜素的最佳提取工艺,在混料模型得到的最优溶剂组成V(乙醇)∶V(丙酮)=1∶1的基础上,进一步分析提取温度、液料比和提取次数对红毛藻中类胡萝卜素提取的影响。
2.3.1 液料比对红毛藻中类胡萝卜提取的影响
不同液料比对红毛藻中类胡萝卜素提取的影响如图4所示。当液料比在5∶1(mL/g)到20∶1(mL/g)之间时,类胡萝卜素提取量随着液料比的增加而增加,并在液料比为20∶1(mL/g)时达到最高(2.161 mg/g);而当液料比超过20∶1(mL/g)时,类胡萝卜素提取量显著下降(P<0.05)。造成这种现象的原因可能是,红毛藻液料比的升高使得细胞浓度降低导致细胞破碎更彻底,从而提取出更多的类胡萝卜素;然而,提取溶剂的过量可能引起细胞中非色素部分溶出,导致红毛藻类胡萝卜素的提取液不够纯,吸光度值下降,类胡萝卜素提取量也随之减少[27]。因此,确定红毛藻中提取类胡萝卜素的最佳液料比为20∶1(mL/g)。
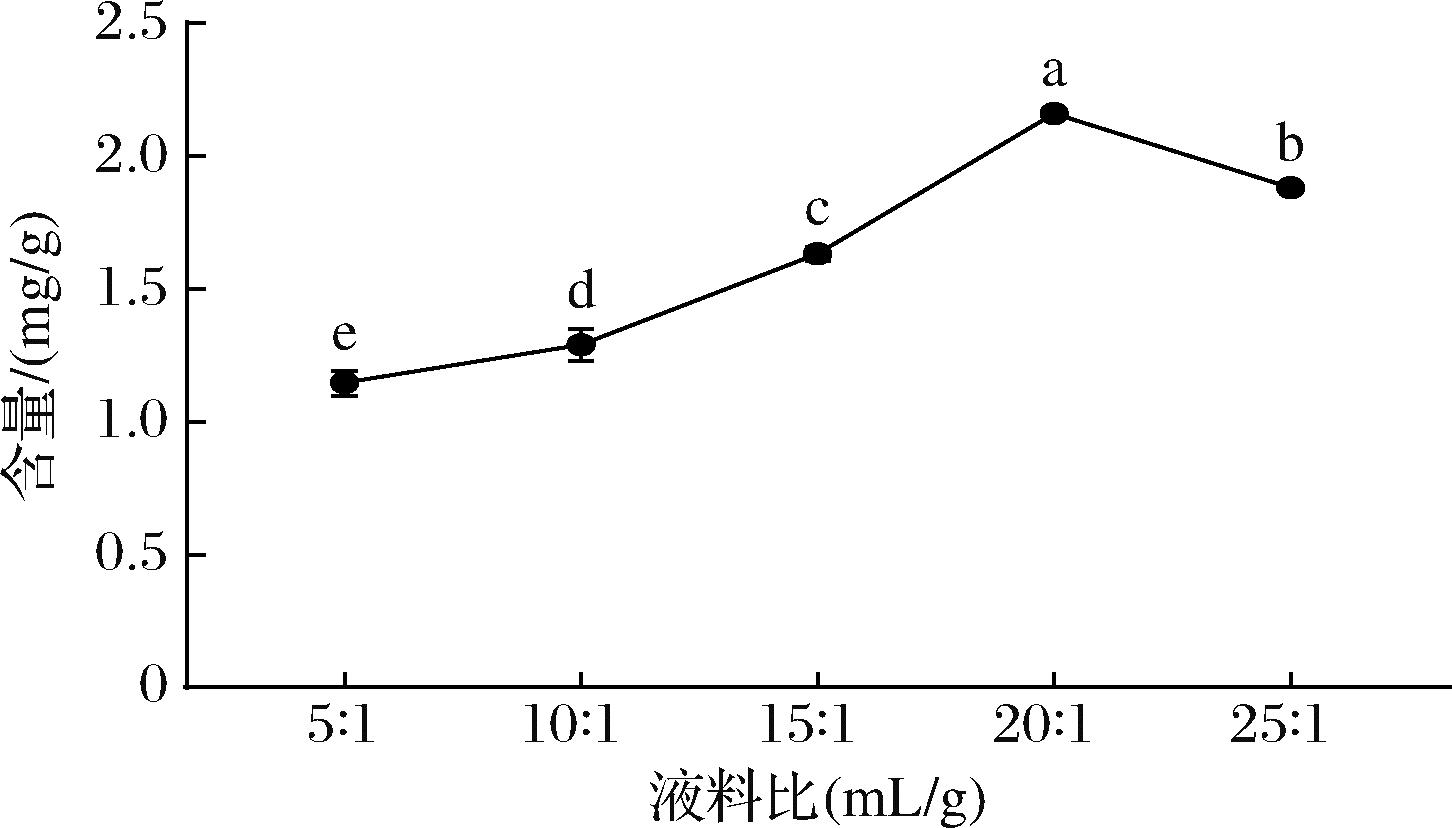
图4 液料比对类胡萝卜素的提取影响
Fig.4 Effect of liquid-material ratio on the extraction of carotenoids
注:不同字母表示具有显著性差异(P<0.05)(下同)。
2.3.2 温度对红毛藻中类胡萝卜提取的影响
不同水浴温度对红毛藻中类胡萝卜素提取的影响如图5所示。类胡萝卜素提取量随着水浴温度的升高呈现先升高后降低的趋势。类胡萝卜素的提取量在20~40 ℃范围时,随温度升高而逐渐升高,40 ℃时达到最高值2.150 mg/g。但温度高于40 ℃时,类胡萝卜素提取量明显降低。高温影响类胡萝卜素的稳定性导致类胡萝卜素发生降解,这就是为什么类胡萝卜素的提取量在40~60 ℃显著下降的原因[28]。因此,确定红毛藻中提取类胡萝卜素的最佳提取温度为40 ℃。
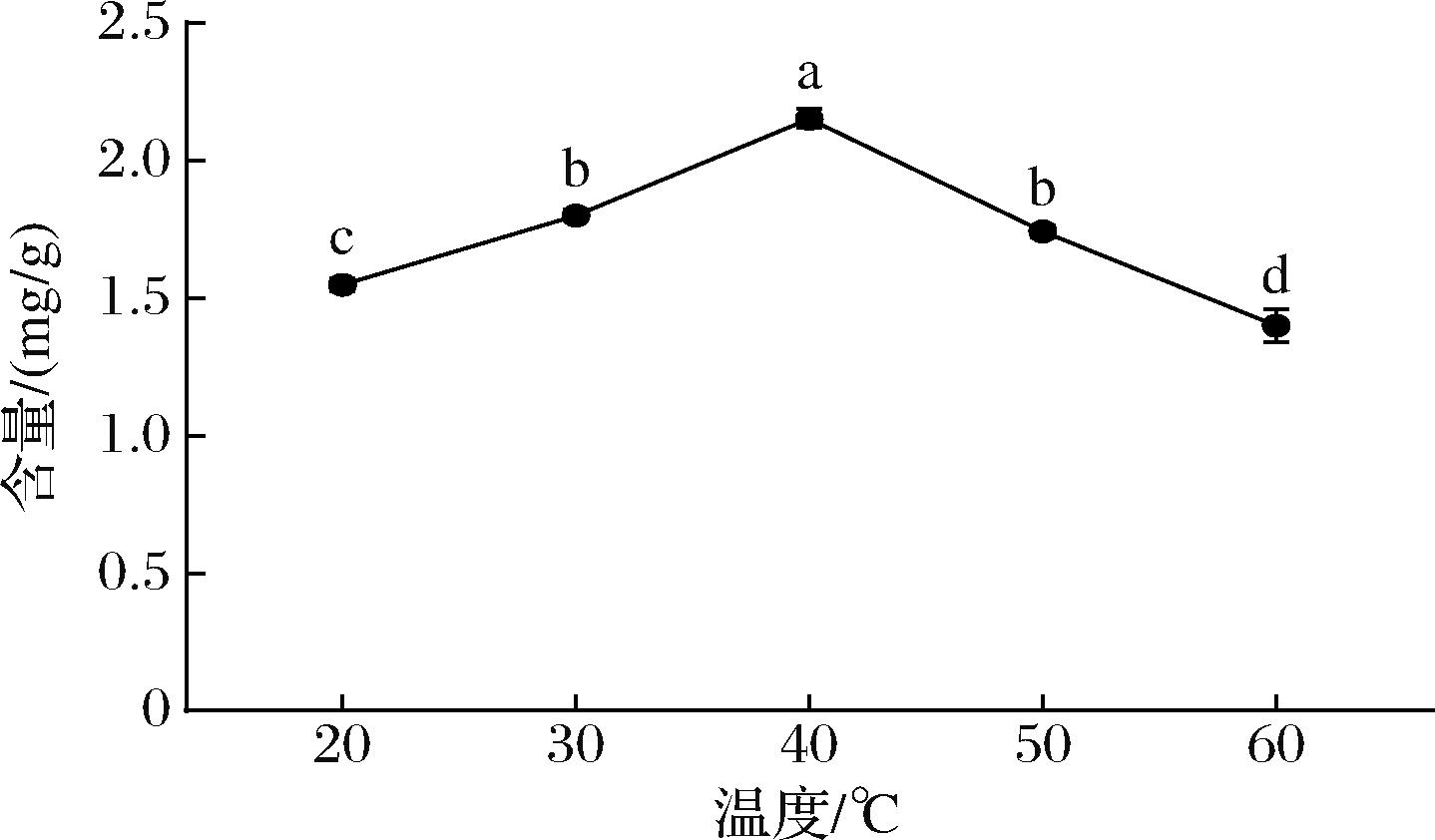
图5 温度对类胡萝卜素的提取影响
Fig.5 Effect of temperature on the extraction of carotenoids
2.3.3 提取次数对红毛藻中类胡萝卜提取的影响
不同提取次数对红毛藻中类胡萝卜素提取的影响如图6所示。结果显示,提取一次的类胡萝卜素提取量较少,并在提取次数为3时达到最高(2.199 mg/g),在3次提取之后,类胡萝卜素提取量显著降低(P<0.05)。造成这种现象的原因可能是,在3次提取之前,红毛藻中的类胡萝卜素随着离心次数的增多使其细胞破碎更彻底,从而提取出更多的类胡萝卜素;而红毛藻经过3次提取之后提取量逐渐降低,由于提取次数的增加将会延长旋转蒸发的时间致使部分类胡萝卜素降解而损失[29]。提取次数的增多不但浪费溶剂也增加了成本,因此,确定提取3次作为最佳提取次数。
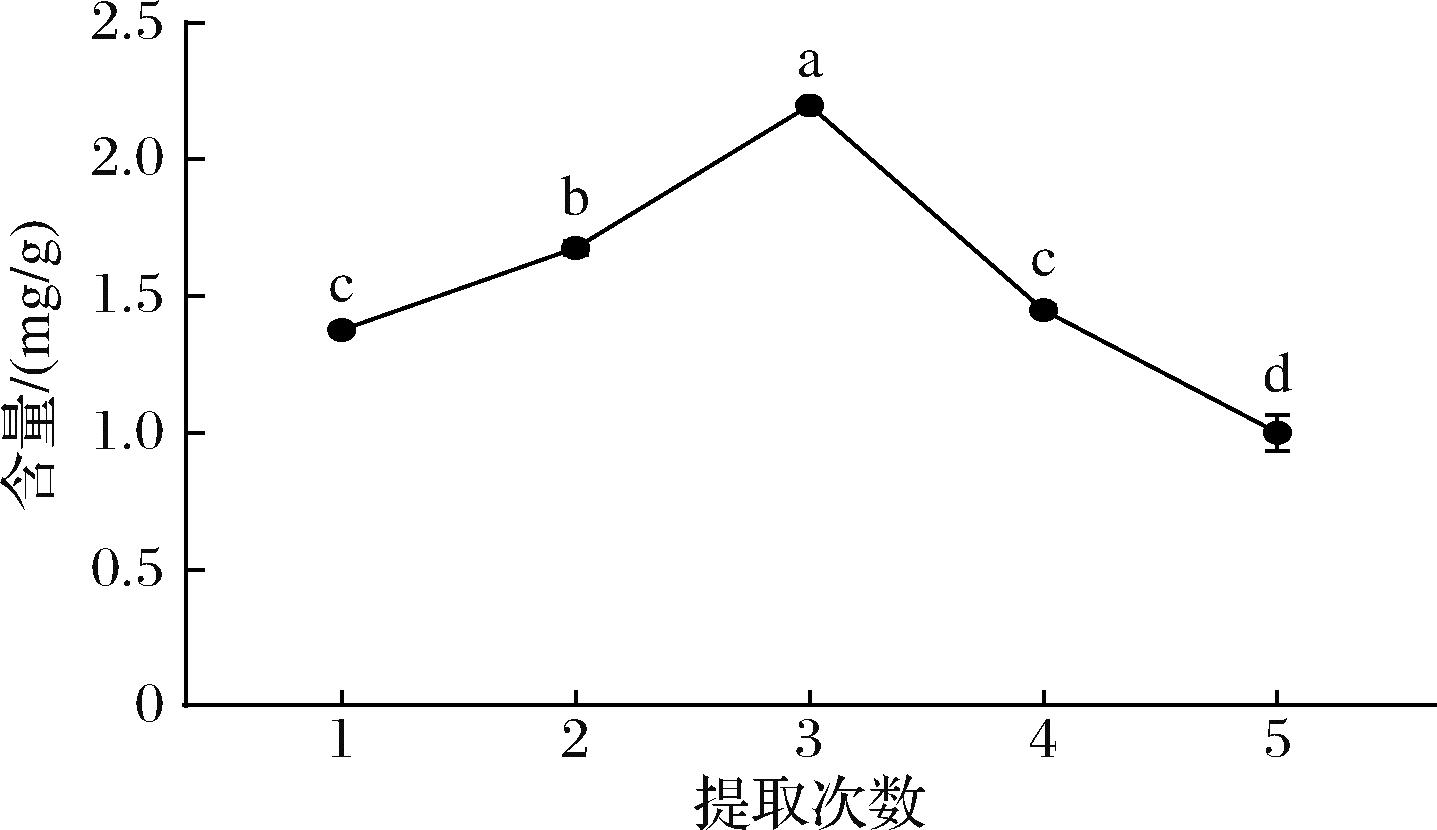
图6 提取次数对类胡萝卜素的提取影响
Fig.6 Effect of the number of extractions on the extraction of carotenoids
2.3.4 配方的验证
为验证该配比的可靠性,在混料模型得到的最优试剂组成V(乙醇)∶V(丙酮)=1∶1的基础上,结合单因素优化的提取最适条件:提取温度40 ℃、液料比20∶1 (mL/g)、提取3次,按照1.3节的方法进行5次验证试验。
验证结果如图7所示,经5次验证试验,计算得到红毛藻中类胡萝卜素的平均提取量为2.264 mg/g。优化后的类胡萝卜素提取量与预测值(2.202 mg/g)十分接近,与预测值的偏差率小于5%,体现了混料设计对本研究的良好预测性以及实用性和可靠性[30]。
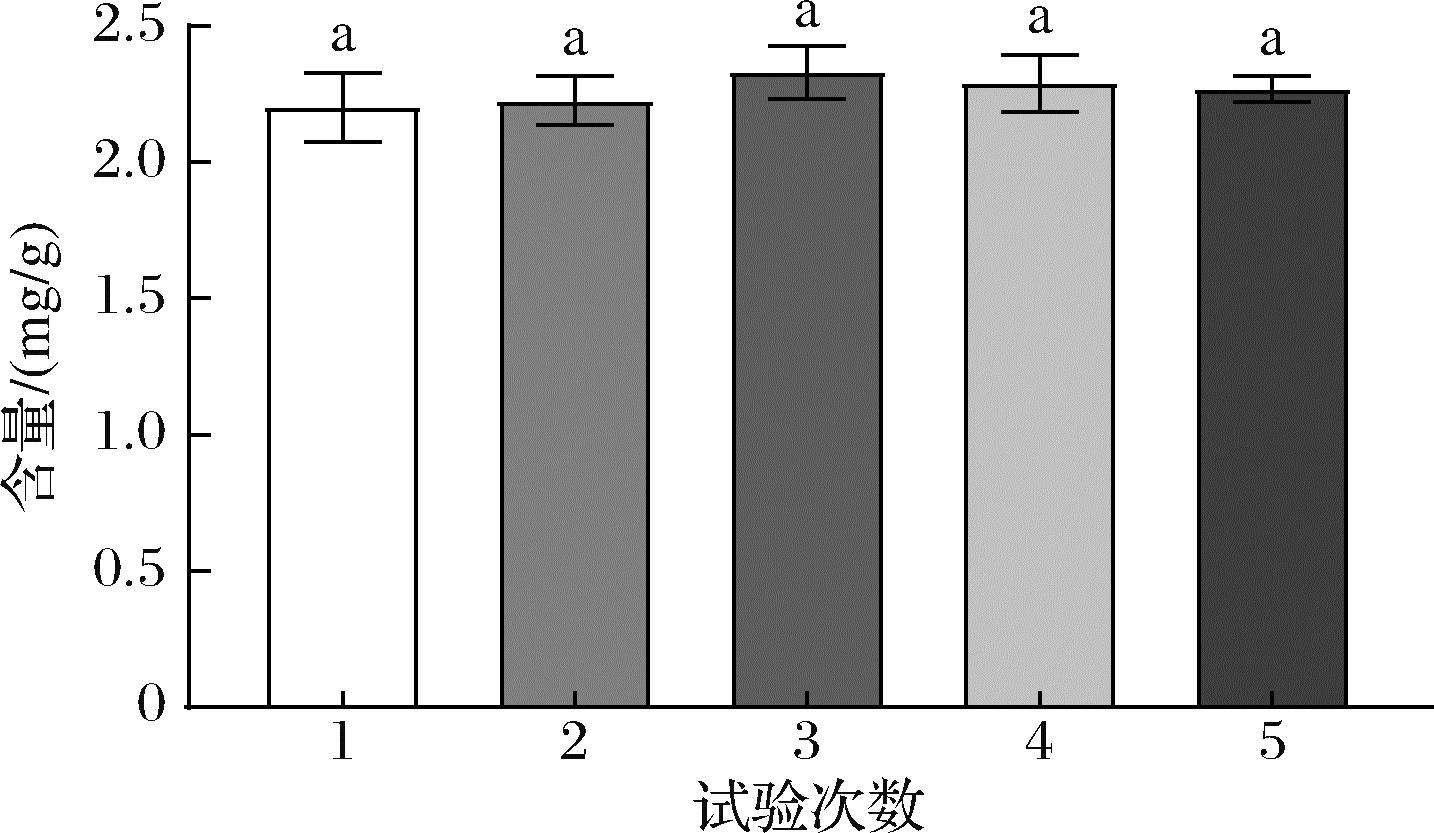
图7 配方验证结果
Fig.7 Formulation validation results
3 结论
本研究通过混料实验设计得出红毛藻中类胡萝卜素提取的最优配方为V(乙醇)∶V(丙酮)=1∶1,并在此条件下对红毛藻中类胡萝卜素的提取温度、液料比和提取次数进行优化,确定了红毛藻中类胡萝卜素的提取最适条件为:提取温度40 ℃、液料比20∶1(mL/g)、提取3次,类胡萝卜素提取量可达到2.264 mg/g。本文混料过程变量的设计准确性较高、合理可行,研究结果不仅为红毛藻开发利用提供了理论依据和技术支持,还为其他天然类胡萝卜素的研究提供了参考。
[1] RODR GUEZ-SU
GUEZ-SU REZ C, REQUENA-RAM
REZ C, REQUENA-RAM REZ M D, HORNERO-MÉNDEZ D, et al.Towards carotenoid biofortification in wheat:Identification of XAT-7A1, a multicopy tandem gene responsible for carotenoid esterification in durum wheat[J].BMC Plant Biology, 2023, 23(1):412.
REZ M D, HORNERO-MÉNDEZ D, et al.Towards carotenoid biofortification in wheat:Identification of XAT-7A1, a multicopy tandem gene responsible for carotenoid esterification in durum wheat[J].BMC Plant Biology, 2023, 23(1):412.
[2] KUSMITA L, NUR PRASETYO EDI A, DWI FRANYOTO Y, et al.Sun protection and antibacterial activities of carotenoids from the soft coral Sinularia sp.symbiotic bacteria from Panjang Island, North Java Sea[J].Saudi Pharmaceutical Journal, 2023, 31(8):101680.
[3] MAPELLI-BRAHM P, G MEZ-VILLEGAS P, GONDA M L, et al.Microalgae, seaweeds and aquatic bacteria, Archaea, and yeasts:Sources of carotenoids with potential antioxidant and anti-inflammatory health-promoting actions in the sustainability era[J].Marine Drugs, 2023, 21(6):340.
MEZ-VILLEGAS P, GONDA M L, et al.Microalgae, seaweeds and aquatic bacteria, Archaea, and yeasts:Sources of carotenoids with potential antioxidant and anti-inflammatory health-promoting actions in the sustainability era[J].Marine Drugs, 2023, 21(6):340.
[4] MATA-G MEZ L C, MAPELLI-BRAHM P, MELÉNDEZ-MART
MEZ L C, MAPELLI-BRAHM P, MELÉNDEZ-MART NEZ A J, et al.Microbial carotenoid synthesis optimization in goat cheese whey using the robust taguchi method:A sustainable approach to help tackle vitamin A deficiency[J].Foods, 2023, 12(3):658.
NEZ A J, et al.Microbial carotenoid synthesis optimization in goat cheese whey using the robust taguchi method:A sustainable approach to help tackle vitamin A deficiency[J].Foods, 2023, 12(3):658.
[5] YABUZAKI J.Carotenoids database:Structures, chemical fingerprints and distribution among organisms[J].Database, 2017, 2017(1):bax004.
[6] MORELLI L, RODRIGUEZ-CONCEPCION M.Open avenues for carotenoid biofortification of plant tissues[J].Plant Communications, 2023, 4(1):100466.
[7] CA IZARES-VILLANUEVA R O, R
IZARES-VILLANUEVA R O, R OS-LEAL E, OLVERA RAM
OS-LEAL E, OLVERA RAM REZ R, et al.Microbial sources of pigments[J].Revista Latinoamericana de Microbiologia, 1998, 40(1-2):87-107.
REZ R, et al.Microbial sources of pigments[J].Revista Latinoamericana de Microbiologia, 1998, 40(1-2):87-107.
[8] CHENG Q.Recent patents on carotenoid production in microbes[J].Recent Patents on Biotechnology, 2007, 1(3):202-211.
[9] JOSHI K, KUMAR P, KATARIA R.Microbial carotenoid production and their potential applications as antioxidants:A current update[J].Process Biochemistry, 2023, 128:190-205.
[10] HUANG S Y, WANG H M D, KE J H, et al.Two cosmetic properties of an ethanol extract of a cultured and edible red macroalga, Bangia fuscopurpurea:Moisturizing and whitening effects[J].Natural Product Communications, 2020, 15(8):1-8.
[11] JIANG Z D, YU G, LIANG Y, et al.Inhibitory effects of a sulfated polysaccharide isolated from edible red Alga Bangia fusco-purpurea on α-amylase and α-glucosidase[J].Bioscience, Biotechnology, and Biochemistry, 2019, 83(11):2065-2074.
[12] YAO H Q, WANG W J, CAO Y, et al.Interaction network construction and functional analysis of the plasma membrane H+-ATPase in Bangia fuscopurpurea (rhodophyta)[J].International Journal of Molecular Sciences, 2023, 24(8):7644.
[13] JIANG Z D, HE P P, WU L, et al.Structural characterization and pro-angiogenic property of a polysaccharide isolated from red seaweed Bangia fusco-purpurea[J].International Journal of Biological Macromolecules, 2021, 181:705-717.
[14] XIE Z T, MI B Q, LU Y J, et al.Research progress on carotenoid production by Rhodosporidium toruloides[J].Applied Microbiology and Biotechnology, 2024, 108(1):7.
[15] LI Z P, DONG Y T, ZHANG Y F, et al.Lactobacillus-fermentation enhances nutritional value and improves the inhibition on pancreatic lipase and oral pathogens of edible red seaweed Bangia fusco-purpurea[J].LWT, 2023, 179:114643.
[16] WU J N, CHEN X T, QIAO K, et al.Purification, structural elucidation, and in vitro antitumor effects of novel polysaccharides from Bangia fuscopurpurea[J].Food Science and Human Wellness, 2021, 10(1):63-71.
[17] ZHENG M J, ZHENG Y J, ZHANG Y F, et al.In vitro fermentation of Bangia fusco-purpurea polysaccharide by human gut microbiota and the protective effects of the resultant products on Caco-2 cells from lipopolysaccharide-induced injury[J].International Journal of Biological Macromolecules, 2022, 222:818-829.
[18] 董乐, 李小琴, 王芳, 等.红毛藻抗氧化肽的菠萝蛋白酶酶解制备工艺优化及其活性评价[J].内蒙古民族大学学报(自然科学版), 2019, 34(6):493-500.
DONG L, LI X Q, WANG F, et al.Optimization of preparation of antioxidant peptides from Bangia fuscopurpurea (dillw.) lyngb.enzymolysised by bromelain and evaluation of its activity[J].Journal of Inner Mongolia University for Nationalities (Natural Sciences), 2019, 34(6):493-500.
[19] 郑江, 高亚辉, 王文星, 等.红毛藻藻红蛋白的粗提方法比较及不同光照条件下藻胆蛋白变性机制的初步探讨[J].厦门大学学报(自然科学版), 2003, 42(1):117-122.
ZHENG J, GAO Y H, WANG W X, et al.Studies on crude extraction methods of phycoerythrin from Bangia fusco-purpurea and denaturalization mechanism of phycobiliprotein in different irradiation conditions[J].Journal of Xiamen University (Natural Science), 2003, 42(1):117-122.
[20] GAN S L, LIANG S J, ZOU Q M, et al.Optimization of carotenoid extraction of a halophilic microalgae[J].PLoS One, 2022, 17(8):e0270650.
[21] HIDALGO G I, ALMAJANO M P.Red fruits:Extraction of antioxidants, phenolic content, and radical scavenging determination:A review[J].Antioxidants, 2017, 6(1):7.
[22] TOFOLI R J, FERREIRA A L, FERN NDEZ N
NDEZ N
 EZ E G, et al.Effects of solvent extraction on phenolic concentration and antioxidant capacity of the Oedogonium sp.(Chlorophyta) using a simplex-centroid mixture design[J].Acta Scientiarum Technology, 2022, 45:e61471.
EZ E G, et al.Effects of solvent extraction on phenolic concentration and antioxidant capacity of the Oedogonium sp.(Chlorophyta) using a simplex-centroid mixture design[J].Acta Scientiarum Technology, 2022, 45:e61471.
[23] CER N-GARC
N-GARC A M C, GONZ
A M C, GONZ LEZ-L
LEZ-L PEZ C V, CAMACHO-RODR
PEZ C V, CAMACHO-RODR GUEZ J, et al.Maximizing carotenoid extraction from microalgae used as food additives and determined by liquid chromatography (HPLC)[J].Food Chemistry, 2018, 257:316-324.
GUEZ J, et al.Maximizing carotenoid extraction from microalgae used as food additives and determined by liquid chromatography (HPLC)[J].Food Chemistry, 2018, 257:316-324.
[24] 李灵, 熊芸, 张钰瑶, 等.响应面法优化猕猴桃类胡萝卜素提取工艺[J].四川大学学报(自然科学版), 2022, 59(5):162-168.
LI L, XIONG Y, ZHANG Y Y, et al.Optimization of carotenoid extraction process of Kiwifruit by response surface methodology[J].Journal of Sichuan University (Natural Science Edition), 2022, 59(5):162-168.
[25] 胡建中. 柑橘中类胡萝卜素的提取、分离、鉴定及其稳定性研究[D].武汉:华中农业大学, 2006.
HU J Z.Study on extraction, separation, identification and stability of carotenoid in orang(owari)[D].Wuhan:Huazhong Agricultural University, 2006.
[26] 国蓉, 李剑君, 国亮, 等.采用响应曲面法优化甘草饮片中甘草酸的超声提取工艺[J].西北农林科技大学学报(自然科学版), 2006, 34(9):187-192.
GUO R, LI J J, GUO L, et al.Optimization of the ultrasonic extraction technique of glycyrrhizic acid by using response surface methodology[J].Journal of Northwest Sci-Tech University of Agriculture and Forestry (Natural Science Edition), 2006, 34(9):187-192.
[27] 王岁楼, 谢雯丽.红辣椒中类胡萝卜素提取方法及工艺条件优化研究[J].农产品加工, 2020(21):39-41;48.
WANG S L, XIE W L.Study on the optimization of extraction method and technological conditions of carotenoid in red pepper[J].Farm Products Processing, 2020(21):39-41;48.
[28] ORD
 EZ-SANTOS L E, MART
EZ-SANTOS L E, MART NEZ-GIR
NEZ-GIR N J.Thermal degradation kinetics of carotenoids, vitamin C and provitamin A in tree tomato juice[J].International Journal of Food Science &Technology, 2020, 55(1):201-210.
N J.Thermal degradation kinetics of carotenoids, vitamin C and provitamin A in tree tomato juice[J].International Journal of Food Science &Technology, 2020, 55(1):201-210.
[29] 黄晨. 万寿菊中类胡萝卜素的分离及性质研究[D].天津:天津商业大学, 2008.
HUANG C.Extraction and characterization of carotenoids from marigold flower[D].Tianjin:Journal of Tianjin University, 2008.
[30] 张大翰, 李萌, 王新悦, 等.最优混料设计优化肉苁蓉速溶咖啡加工工艺[J].食品安全质量检测学报, 2021, 12(23):9233-9241.
ZHANG D H, LI M, WANG X Y, et al.Design the formulation of instant Cistanche deserticola coffee and optimize its manufacturing process[J].Journal of Food Safety &Quality, 2021, 12(23):9233-9241.