皮蛋是我国著名的传统蛋制品,又叫松花蛋、彩蛋或变蛋等,于室温下含有NaOH、NaCl、红茶和金属盐的腌制溶液中浸泡4~6周来制备[1]。其既保持了蛋类原有的营养成分,又是蛋白质、必需氨基酸和矿物质(如Ca、Mg、Fe、Zn、Cu、K、Na)的极好来源[2]。蛋清中蛋白质质量分数为11%~13%,主要包括卵白蛋白、卵转铁蛋白和卵类黏蛋白等[3]。丰富的蛋白质为蛋清凝胶的形成提供了物质基础。蛋清蛋白的凝胶化是变性蛋白质分子在一定的作用力下有序聚合,最终形成连续网络结构的过程[4]。外部因素如pH、离子强度、压力和温度能影响疏水、静电相互作用和二硫键进而影响凝胶网络结构的形成[5]。
茶多酚(tea polyphenol,TP)是茶叶中含有的一类羟基化合物,主要包括儿茶素、花青素、类黄酮和酚酸[6]。在采用浸泡法加工皮蛋的过程中,红茶末中的TP穿过蛋壳和膜进入蛋清中,在使蛋清变为棕色或棕褐色的同时对其凝固也有一定的促进作用。而NaCl在减少皮蛋辛辣味的同时还能促进蛋清凝固和蛋黄形成溏心,主要通过诱导疏水相互作用或离子相互作用来改变蛋清蛋白的聚集状态和凝胶外观。近年来,NaCl和TP对蛋清凝胶的影响得到了广泛关注。LI等[7]研究了NaCl对鸡蛋清凝胶特性和持水性的影响。WAN等[8]研究了TP和磷酸化对蛋清凝胶化行为的协同作用。周绪霞等[9]研究了不同添加量的TP改性对蛋清蛋白凝胶特性的影响。然而,直接将TP与NaCl添加到碱诱导蛋清凝胶中的研究却鲜见报道。
为了更有效地探索碱诱导蛋清凝胶的自组装过程,本研究以鸡蛋清为主要原料,将NaCl和TP加入到碱性环境中,以未添加NaCl和TP的蛋清凝胶为空白对照,测定蛋清凝胶的色差、pH值、浊度、质构特性、流变学特性、热稳定性和圆二色谱图,对比NaCl、TP以及两者组合对碱诱导鸡蛋清凝胶特性及蛋清蛋白结构的影响,以期为鸡蛋皮蛋凝胶形成机制研究提供数据,进一步丰富和完善相关蛋白质凝胶化的理论体系。
1 材料与方法
1.1 材料与试剂
鲜鸡蛋,河南省洛阳市大张超市;TP(纯度98%),阿达玛斯贝塔(上海)化学试剂有限公司;NaOH(分析纯),天津市德恩化学试剂有限公司;NaCl(分析纯),江苏强盛功能化学股份有限公司;KBr(分析纯),天津化工研究所。
1.2 仪器与设备
HH-2数显恒温水浴锅,常州朗越仪器制造有限公司;85-2A型数显恒温测速磁力搅拌器,常州荣华仪器制造有限公司;CM-5型色差仪,深圳市三恩驰科技公司;UV-2600型紫外可见分光光度计,日本岛津公司;SMS TA.XT Epress Enhanced食品物性分析仪,英国Surface Measurement Systems公司;DHR-1流变仪,美国TA公司;Chirascan型圆二色光谱仪,英国应用光物理公司;Q10型差示扫描热量仪,上海田枫实业有限公司。
1.3 试验方法
1.3.1 EW凝胶样品的制备
参考邵瑶瑶[10]的方法并依据前期预实验,制备50 g/L的NaOH溶液、40 g/L的NaCl溶液和3 g/L的TP溶液。分离蛋清和蛋黄,将蛋清置于磁力搅拌器上于1 000 r/min搅拌10 min待用。按照表1分别将其添加到烧杯中混合均匀,在25 ℃条件下水浴1 h至凝胶形成,然后在4 ℃下静置24 h,待测。
表1 凝胶配制配方 单位:mL
Table 1 Formula of gel preparation
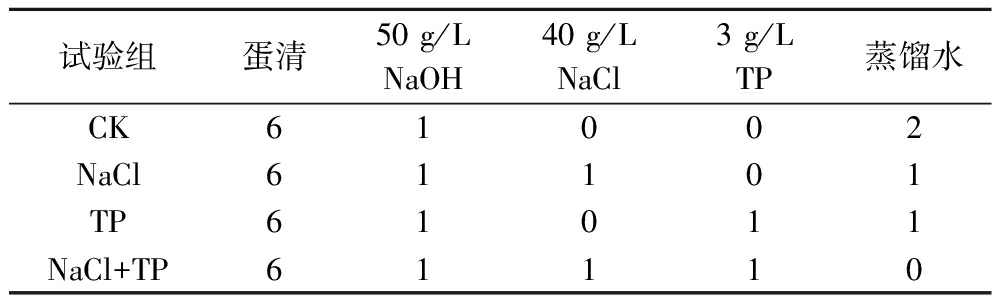
试验组蛋清50 g/L NaOH40 g/L NaCl3 g/L TP蒸馏水CK61002NaCl61101TP61011NaCl+TP61110
1.3.2 色差的测定
将样品切成20 mm×20 mm×20 mm的立方体,用色差仪测定蛋清凝胶的色差,记录L*值(亮度)、a*值(红-绿)和b*值(黄-蓝),总色差ΔE的计算如公式(1)所示:
(1)
式中:L0、a0、b0为对照组的颜色参数。
1.3.3 pH值的测定
参考LI等[11]的方法并稍作修改。取一定质量的凝胶样品用去离子水稀释10倍,先使用均质机在10 000 r/min下均质2 min,再用离心机在4 000 r/min下离心15 min。取上清液调整蛋白质质量浓度为1.50 mg/mL左右,测定凝胶样品的pH值。
1.3.4 浊度的测定
取1.3.3节的上清液,调整蛋白质质量浓度为0.15 mg/mL左右,使用紫外可见分光光度计在600 nm处测得的吸光度值即为样品的浊度。
1.3.5 凝胶质构特性测定
参考郑赵敏等[12]的方法并稍作修改。将凝胶样品切成直径25 mm、高20 mm的圆柱体,测定模式为全质构分析模式,探头为P/36R。测试前、中、后的速率分别为5、2、2 mm/s,压缩比45%,触发力5.0 g。
1.3.6 流变学特性测定
参考鲁金佩等[13]和AI等[14]的方法并稍作修改。使用40 mm平板夹具,间距为1 mm。按照表1将蛋清与其他溶液混合后,立即用一次性滴管将其滴在平台上,并将平板外多余样品去除。
1.3.6.1 静态流变测定
在1~300 s-1剪切速率下扫描,测定黏度。使用Power law模型对数据进行拟合,如公式(2)所示:
τ=k(γ)n
(2)
式中:τ,剪切应力,Pa;k,稠度系数,Pa·sn;γ,剪切速率,s-1;n,流动行为指数。
1.3.6.2 动态频率测定
在线性黏弹性范围内进行动态频率扫描(0.1~10 Hz),使用Power law模型对数据进行拟合,计算如公式(3)所示:
G′=k(ω)n
(3)
式中:G′,储能模量,Pa;k,稠度系数,Pa·sn;ω,振荡频率,rad/s;n,流动行为指数。
1.3.6.3 动态温度扫描测定
温度以5 ℃/min从25 ℃升高到90 ℃,扫描应变值1%(在线性黏弹性范围内),扫描频率1 Hz。
1.3.6.4 时间扫描测试
持续2 h,设定应变为1%,扫描频率1 Hz,设定温度为25 ℃。获得的时间扫描结果模拟如公式(4)所示:
G′t=kgelln(tgel)+C
(4)
式中:G′t,t(s)时刻G′的值;tgel,凝胶时间;kgel,凝胶速率;C,常数。
使用仅添加NaOH的蛋清凝胶作为模型,以获得在25 ℃下胶凝2 h后的目标储能模量(G′C)。凝胶体系达到G′C所需的时间(tmodel)计算如公式(5)所示:
tmodel=e(G′C-C)/kgel
(5)
1.3.7 差示扫描量热(differential scanning calorimetry,DSC)分析
参考范盛玉等[15]的方法并稍作修改。称取20 mg凝胶样品置于铝坩埚中并密封,从20 ℃加热到200 ℃,升温速率为10 ℃/min。
1.3.8 圆二色谱(circular dichroism,CD)分析
参考张晓洁等[16]的方法并稍做修改。将样品中蛋白质量浓度调整至0.5 mg/mL,使用圆二色谱仪测定,扫描范围180~260 nm,谱带宽度1 nm,重复扫描3次。
1.4 数据处理
每个试验重复3次,结果以“平均值±标准差”表示。用SPSS 17.0软件进行显著性分析,差异显著性为P<0.05。并用Origin 2021作图。
2 结果与分析
2.1 NaCl和TP对碱诱导蛋清凝胶色差的影响
蛋清凝胶的色差测定结果如表2所示。与对照组相比,NaCl组蛋清凝胶的L*值、a*值、b*值均略有升高。TP组和NaCl+TP组蛋清凝胶的L*值显著降低(P<0.05),a*和b*值显著升高(P<0.05)。其中NaCl+TP组的ΔE值最大。这是由于添加NaCl使蛋清凝胶透光率下降,凝胶白度增加。NaCl使蛋清凝胶的L*值显著增加,这可能是由于离子强度增加,凝胶中的蛋白质聚集体的光散射特性发生改变,NaCl通过减少蛋白质分子之间的静电排斥而使蛋白质分子聚集在一起,由于凝胶更加致密,折射率增加,产生更强的光散射;蛋清凝胶的a*和b*值随着NaCl的添加而略微增加,这表明光波的选择性吸收也发生了一些变化[17]。而TP水溶液本身为红棕色,在碱性条件下可氧化转变成醌类物质,促使红棕色进一步加深[18]。TP的添加能显著降低凝胶的亮度,并加深红色和黄色,改变凝胶的原始颜色,从而最终导致TP组与NaCl+TP组的ΔE值较大。
表2 NaCl和TP对碱诱导蛋清凝胶色差的影响
Table 2 Effects of NaCl and TP on the color difference of alkali-induced egg white gels

试验组L∗值a∗值b∗值ΔE值对照组34.77±1.04a-0.82±0.07a4.13±0.16a—NaCl35.10±1.16a-0.63±0.04a4.30±0.52a1.33±0.16aTP20.53±1.38b2.10±0.47b7.86±0.45b15.03±1.27bNaCl+TP20.90±1.75b3.51±0.17c8.72±0.11b15.26±1.60b
注:同列不同小写字母表示组间差异显著(P<0.05)(下同)。
2.2 NaCl和TP对碱诱导EW凝胶pH和浊度的影响
由表3可知,与对照组(pH 11.91)相比,NaCl、TP和NaCl+TP组pH的变化表现为:分别降至11.76、11.63和11.50。这是由于NaCl中和了蛋白质表面的电荷,而蛋白质表面带电荷的氨基中的H+被NaCl释放到溶液中[19]。TP本身呈弱酸性,TP中的酚基和羧基进入蛋清蛋白凝胶中降低了凝胶的pH值。此外,羧基可能与蛋白质中氨基酸的氨基,如赖氨酸和精氨酸发生反应,导致氨基数量减少,从而使蛋清蛋白凝胶的pH值降低[20]。
表3 NaCl和TP对碱诱导蛋清凝胶pH和浊度的影响
Table 3 Effects of NaCl and TP on pH and turbidity of alkali-induced egg white gels

试验组pH浊度对照组11.91±0.02a0.19±0.01aNaCl11.76±0.04b0.23±0.01abTP11.63±0.04c0.27±0.03bNaCl+TP11.50±0.03d0.40±0.02c
与对照组相比,3组凝胶样品的浊度均有不同程度的增加。可能是由于当添加NaCl时,Na+与带负电荷的蛋白质分子产生相互作用,中和了部分负电荷,从而减少了蛋白质分子之间的排斥作用,使蛋白质分子更容易聚集,导致浊度升高[21]。蛋白质氨基酸残基侧链与TP之间产生多重相互作用(包括疏水相互作用和氢键)形成TP-蛋白质复合物。这些复合物逐渐形成大的胶体颗粒并散射光线,导致浊度增加[22]。
2.3 NaCl和TP对碱诱导EW凝胶质构特性的影响
由图1可知,NaCl组的硬度和咀嚼度较对照组显著增加了6.08%和38.19%(P<0.05)。TP组的弹性显著增加了0.16%(P<0.05),回复性增加了9.80%。这是由于一方面,NaCl离子能够形成盐桥,从而增加蛋清凝胶硬度。另一方面,NaCl可以通过降低蛋白质分子间的静电斥力使蛋白质聚集度增加,从而提高蛋清凝胶硬度[19]。在碱性环境中多酚氧化后形成的醌类物质可与某些蛋白质侧链氨基酸的亲核基团如—SH、—NH2等发生反应形成加和物促进蛋白质凝胶的性能[23]。
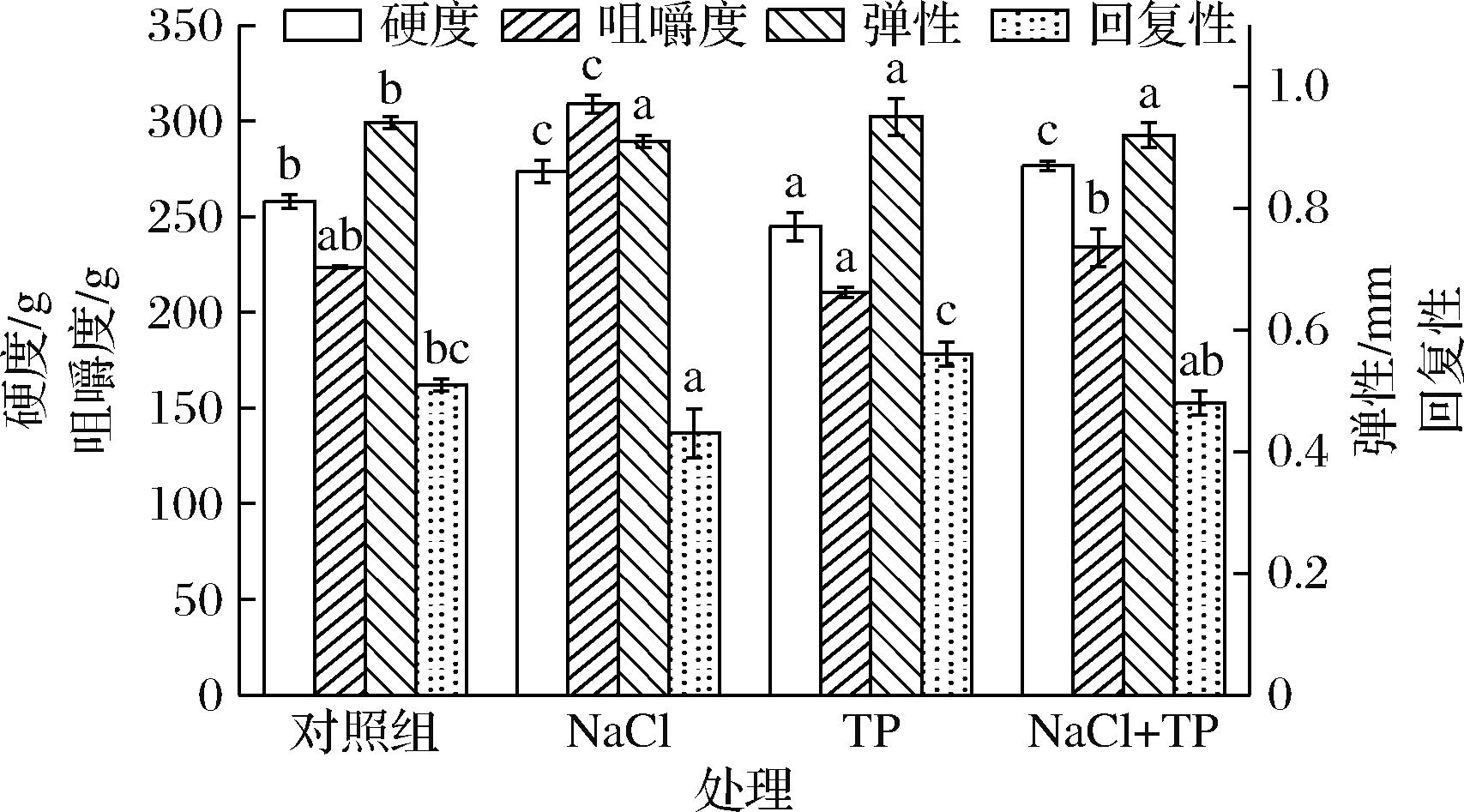
图1 NaCl和TP对碱诱导蛋清凝胶质构特性的影响
Fig.1 Effects of NaCl and TP on the texture properties of alkali-induced egg white gels
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.4 NaCl和TP对碱诱导EW凝胶流变特性的影响
2.4.1 静态流变分析
黏度是对溶液中蛋白质聚集变化敏感的一个指标。如图2显示了聚集体的表观黏度随剪切速率的变化情况。从图2可以看出,所有样品均表现出剪切变稀的非牛顿假塑性流体行为,这可能是因为剪切速率的增加破坏了聚集体之间的结构从而导致其黏度降低。与对照组相比,NaCl组的黏度增大,NaCl+TP组黏度降低,TP组的黏度最低。影响蛋白质流体黏度的主要因素为分散蛋白质分子或颗粒的表现直径,表现直径根据蛋白质与溶剂分子间的相互作用情况而变化。NaCl能够增强蛋白质与溶剂之间的相互作用,因而使蛋清聚集体黏度增大[21]。当多酚与蛋白质表面结合时,蛋白质之间的相互作用很可能被蛋白质上带电基团的部分屏蔽作用所削弱,并且容易在低剪切速率下被破坏,从而导致黏度降低;再者因为聚合物溶质的黏度主要通过聚合物链的缠结来控制:延伸的或无规则卷曲分子具有高黏度,而折叠的分子具有较低黏度。由于多酚同时与蛋白质的几个位点结合导致蛋白质链围绕多酚分子卷曲,黏度降低[24]。孟甘露等[25]在探究自由基法多酚共价结合对大豆蛋白基乳液凝胶特性的影响中也得出了相似的结果,即与多酚共价结合后,大豆分离蛋白乳液黏度降低。

图2 NaCl和TP对碱诱导蛋清凝胶黏度的影响
Fig.2 Effect of NaCl and TP on viscosity of alkali-induced egg white gels
由表4可得R2均为0.99,表明拟合精度较高。所测样品的流体指数均<1,再次证明所有凝胶样品均为典型的非牛顿假塑性流体。稠度系数K为流体稠度的量度,K值越高则流体的稠度越大,4个样品的稠度系数大小也与上述黏度大小相对应。
表4 各凝胶静态流变特性的拟合分析
Table 4 Fitting parameters for static rheological properties of different gels
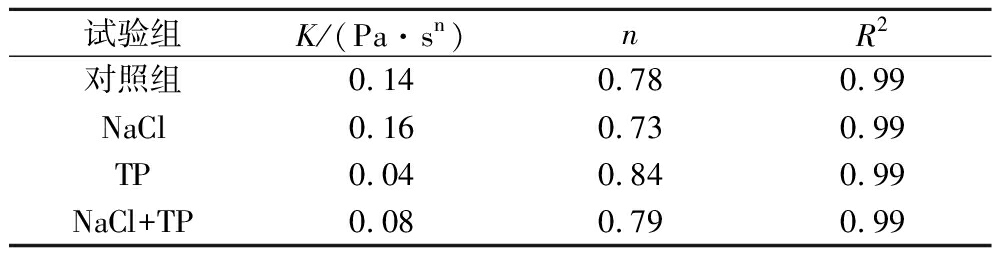
试验组K/(Pa·sn)nR2对照组0.140.780.99NaCl0.160.730.99TP0.040.840.99NaCl+TP0.080.790.99
2.4.2 动态频率分析
由图3-a和图3-b可知,所有样品的G′始终大于G″,且在频率扫描范围内G′与G″变化曲线没有交点,说明样品的弹性特征在黏弹性中更突出。与对照组相比,NaCl组的凝胶样品的G′和G″显著提高,TP组的凝胶样品的G′和G″显著降低。NaCl+TP组的G′和G″也得到了提升。可能是由于NaCl存在时,蛋白质分子间没有足够的高负电荷来提供静电斥力,因而形成了高刚性凝胶[11]。这一结果和样品质构测定结果一致。而TP与蛋白质发生了交联反应,减少了蛋白质分子之间的作用力,因而形成了较弱的凝胶[26]。
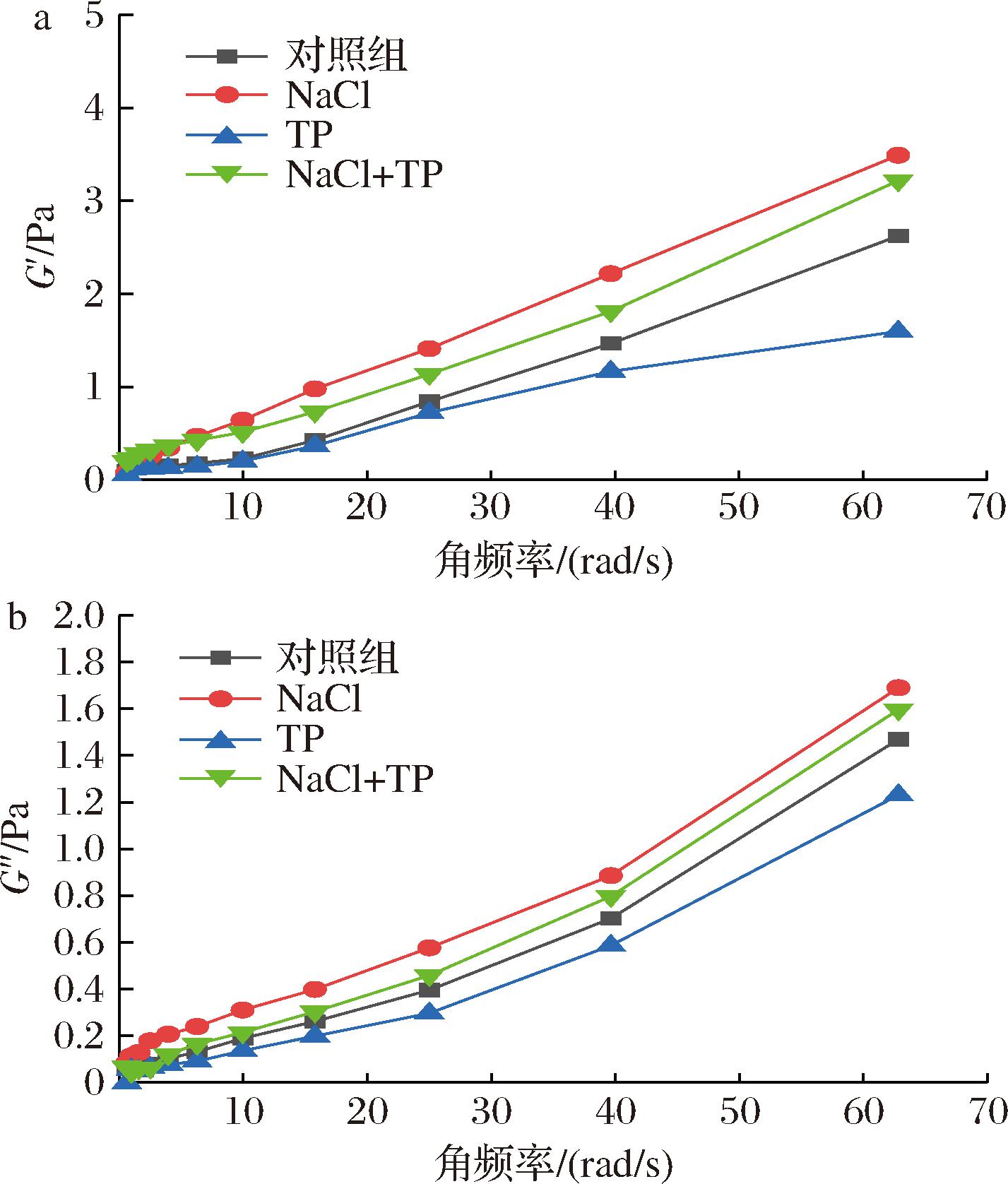
a-G′;b-G″
图3 NaCl和TP对碱诱导蛋清凝胶G′和G″的影响
Fig.3 Effects of NaCl and TP on G′ and G″ of alkali-induced egg white gels
由表5可得,各凝胶样品的频率依赖行为符合幂律模型,相关系数≥0.97。K值用于反映形成凝胶的刚性,n值表示共价键,较低的n值表示形成的凝胶中较高比例的共价键[27]。各样品的流动行为指数n>0,表明凝胶初期并未产生共价交联,为物理凝胶。
表5 各凝胶储能模量拟合分析
Table 5 Fitting parameters for storage modulus of different gels
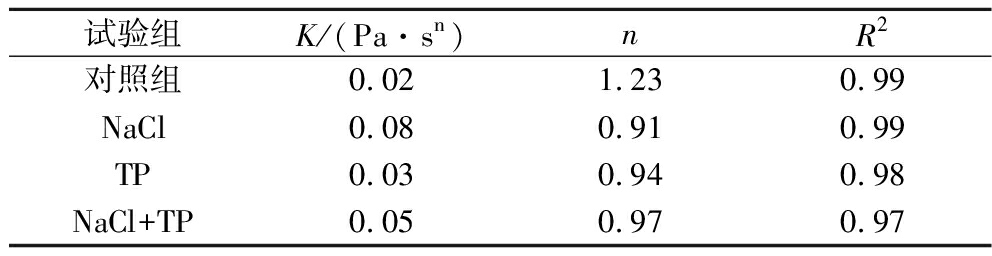
试验组K/(Pa·sn)nR2对照组0.021.230.99NaCl0.080.910.99TP0.030.940.98NaCl+TP0.050.970.97
2.4.3 动态温度扫描分析
卵转铁蛋白和卵白蛋白的变性温度分别为60~65 ℃和80~85 ℃[28]。由图4可知,4组样品中卵转铁蛋白和卵白蛋白变性温度均提前。该结果可能是由于在热聚集之前发生强碱诱导的蛋白展开。碱性环境更有利于蛋白质发生变性,使凝胶点提前(成胶温度降低)。在升温期间,NaCl组表现出较高的G′,可能由于NaCl促进更多的蛋白质分子参与蛋白质-水氢键的形成[29]。TP组的变性温度出现了延后的现象,表明TP组提高了蛋清蛋白的热稳定性。可能由于TP组的活性羟基与蛋清蛋白多个位点结合,使凝胶结构更加致密,不易被破坏[9]。
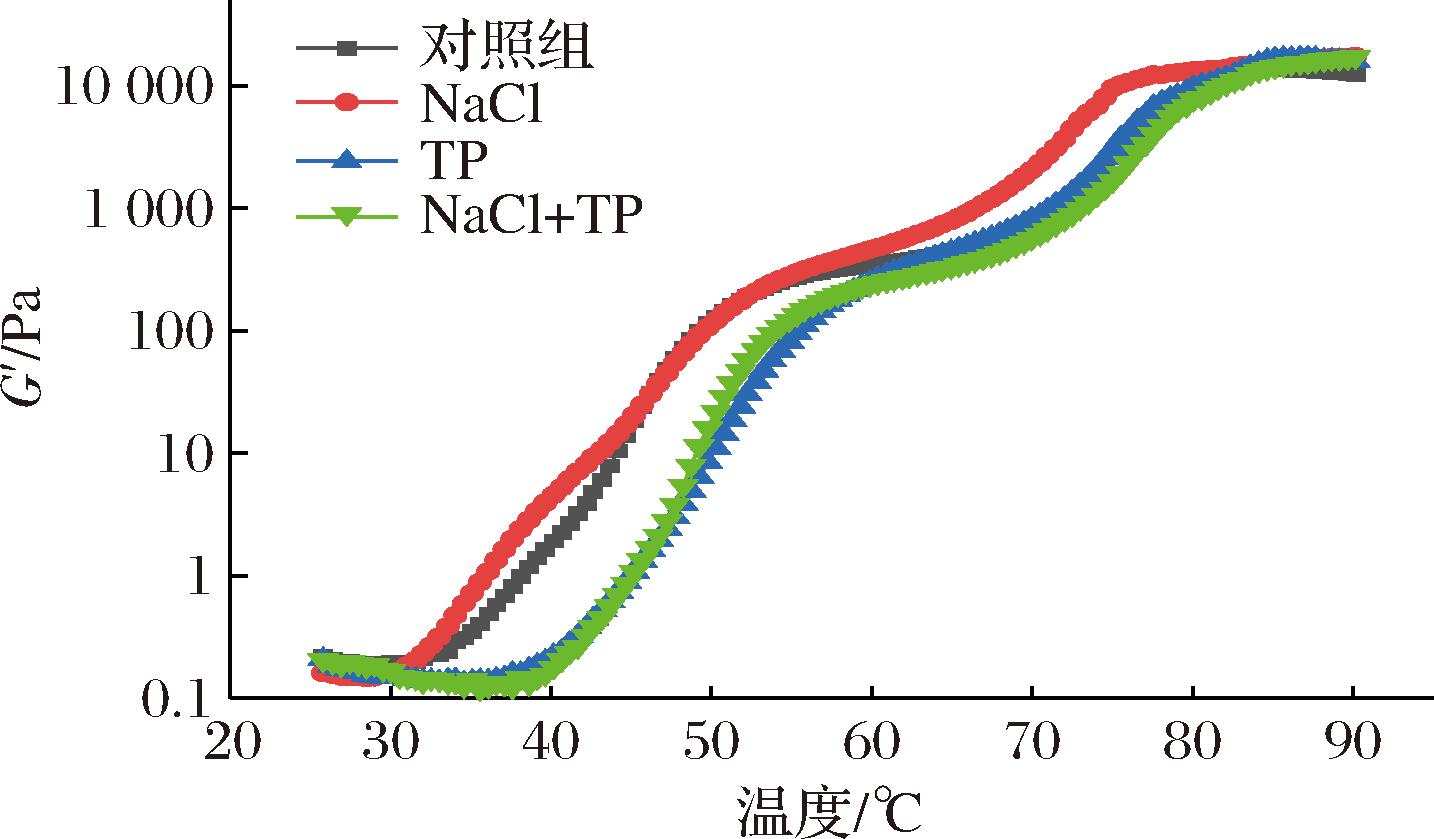
图4 不同凝胶体系G′随温度变化曲线
Fig.4 Curve of energy storage modulus of different gel systems with temperature
2.4.4 时间扫描分析
为了研究NaCl和TP对碱诱导蛋清凝胶化过程的影响,采用时间扫描法研究了凝胶化过程中G′和G″的变化,以评价凝胶形成动力学和凝胶机械稳定性。如图5所示,在7 200 s的测试过程中,始终存在G′和G″,表明该体系的弹性特征在黏弹性中更突出。
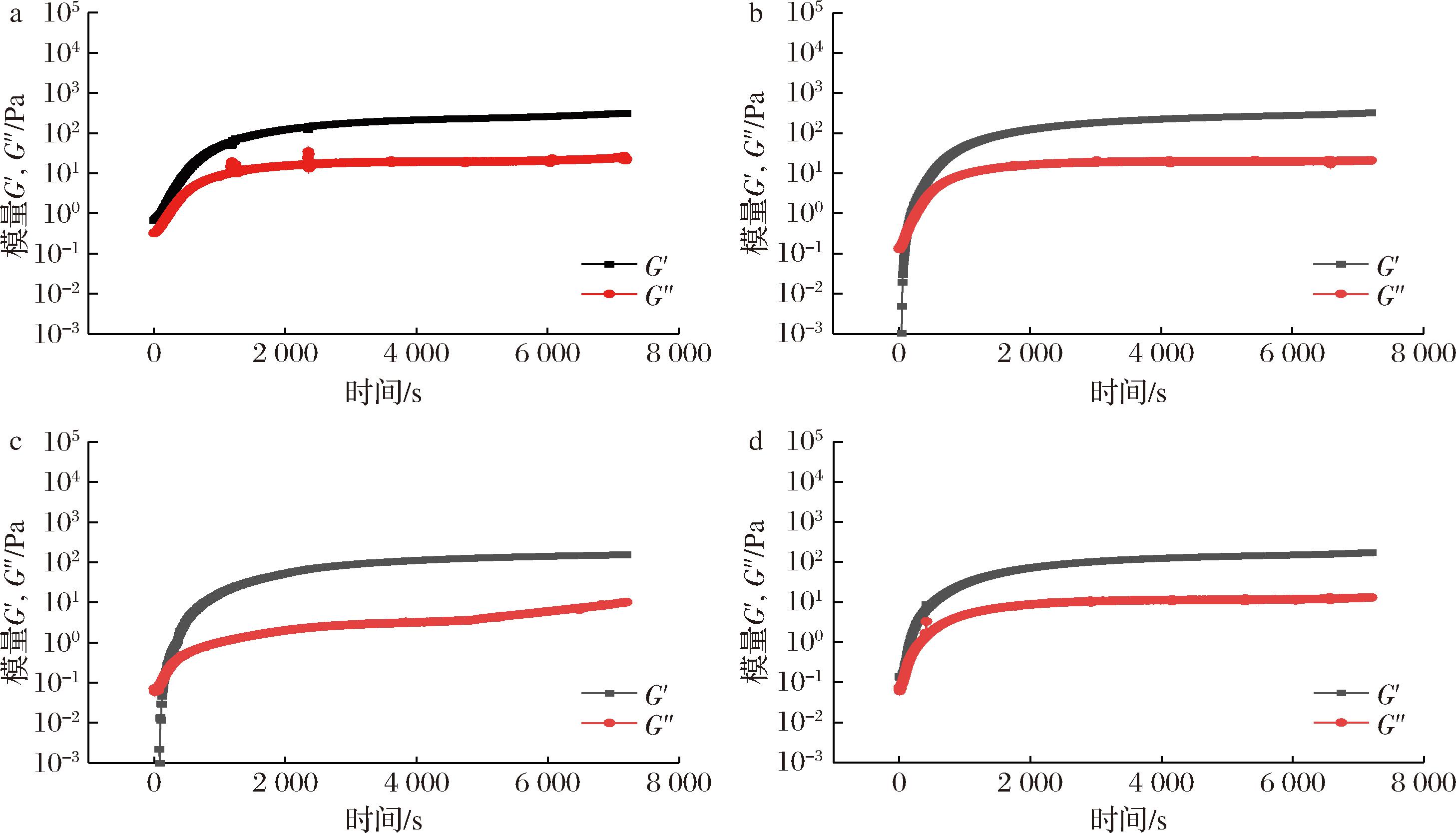
a-对照组;b-NaCl;c-TP;d-NaCl+TP
图5 不同凝胶体系的凝胶动力学分析
Fig.5 Gelation kinetic analysis of different gelling systems
由表6可知,4组样品的凝胶速率大小:NaCl>对照组>NaCl+TP>TP。这可能是由于NaCl可以通过降低蛋白质电双层的厚度(静电屏蔽)和增强非特异性电荷的中和作用来减少蛋白质分子间的静电排斥,降低蛋清蛋白分子间的静电排斥力会促进蛋清蛋白分子的聚集,从而使凝胶形成速率得到了提高[30]。而TP富含活性酚羟基且呈弱酸性,其稳定pH值范围为4.0~8.0,在高碱性环境中不稳定,容易发生自氧化并与蛋白质结合,从而限制了蛋清蛋白质之间的相互作用。由于蛋清蛋白质之间的相互作用的减少,可能会对蛋清蛋白的聚集产生影响,使凝胶形成速率降低[26]。
表6 用于拟合不同凝胶体系的凝胶化曲线的对数模型参数
Table 6 Parameters for the logarithmic model used to fit the gelation profiles of different gelling systems
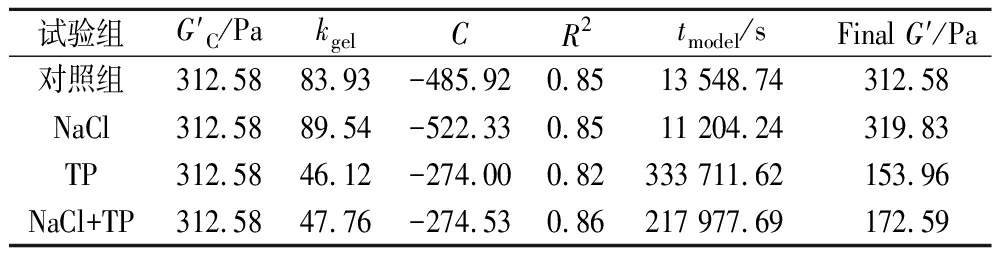
试验组G′C/PakgelCR2tmodel/sFinal G′/Pa对照组312.5883.93-485.920.8513 548.74312.58NaCl312.5889.54-522.330.8511 204.24319.83TP312.5846.12-274.000.82333 711.62153.96NaCl+TP312.5847.76-274.530.86217 977.69172.59
2.5 DSC分析结果
由图6可知,4组蛋清凝胶样品热稳定性大小NaCl+TP>TP>对照组>NaCl。可能是由于NaCl通过与蛋白质多肽链上的负电荷相互作用形成双层离子集团,降低蛋白质分子之间的静电斥力,显著增强蛋白质与蛋白质、蛋白质与水之间的相互作用,从而加速了蛋白质的展开,使蛋白质更容易发生热变性[31]。而TP与蛋清蛋白之间的相互作用导致了更强的交联作用,构建了稳定的网络结构,有利于提高凝胶的热稳定性。PHAM等[32]研究发现,亚麻籽分离蛋白在酚类化合物(包括亚麻籽多酚、阿魏酸和羟基酪醇)修饰下热稳定性也得到了提高。
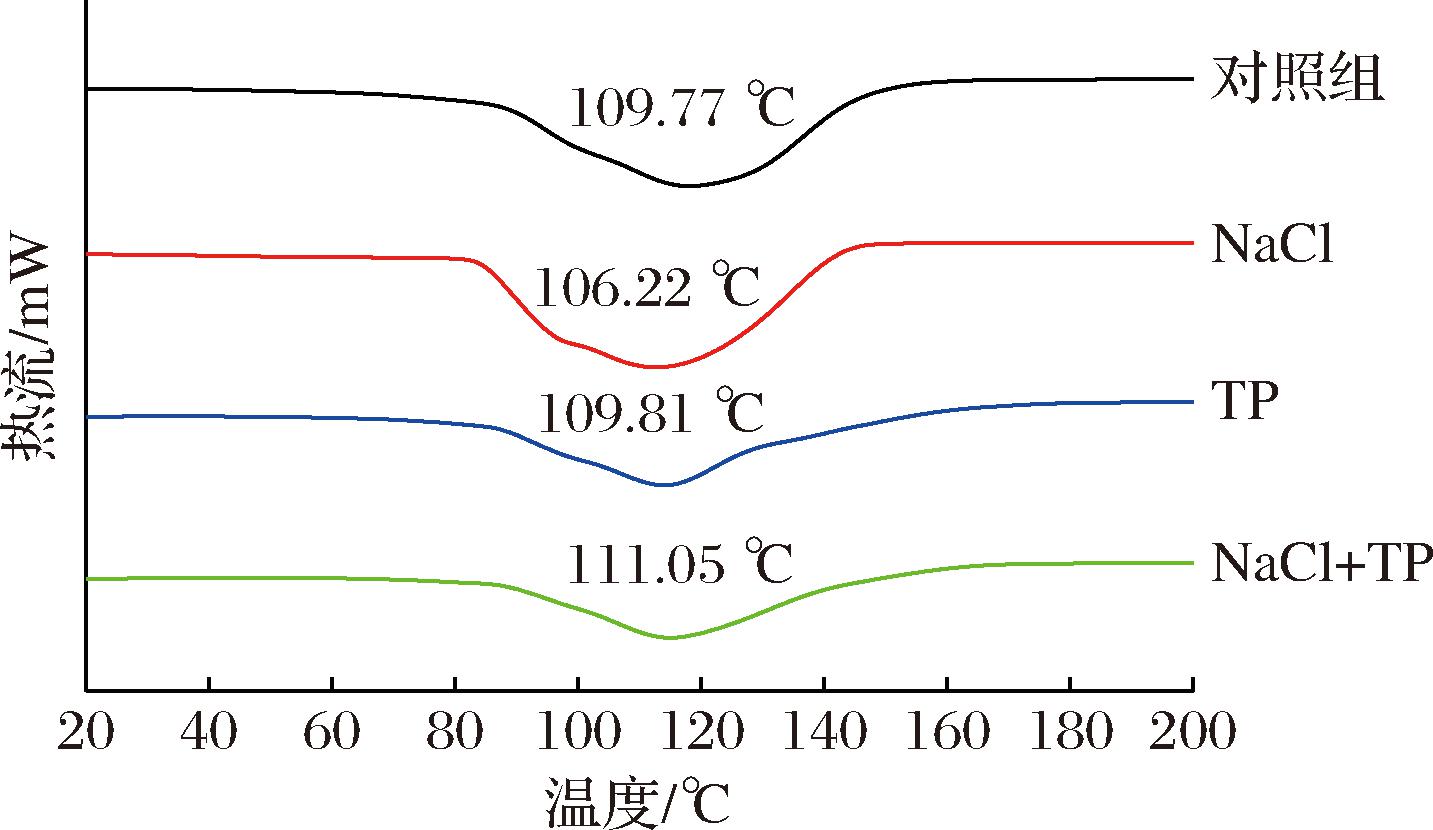
图6 不同蛋清凝胶样品的差示扫描量热图
Fig.6 Differential scanning calorigrams of different egg white gel samples
2.6 CD分析结果
二级结构是蛋白质最基本的构象,是蛋白质结构变化的重要指标[33]。如图7所示,4组峰的位置和强度存在差异,说明NaCl和TP影响了蛋白质的二级结构。与对照组相比,NaCl与NaCl+TP组在208和222 nm处的峰强度显著降低。负椭圆率的降低可能是由于蛋白质部分展开而导致α-螺旋的贡献降低,β-折叠的贡献增加,这最终导致蛋白质整体构象的变化[34]。
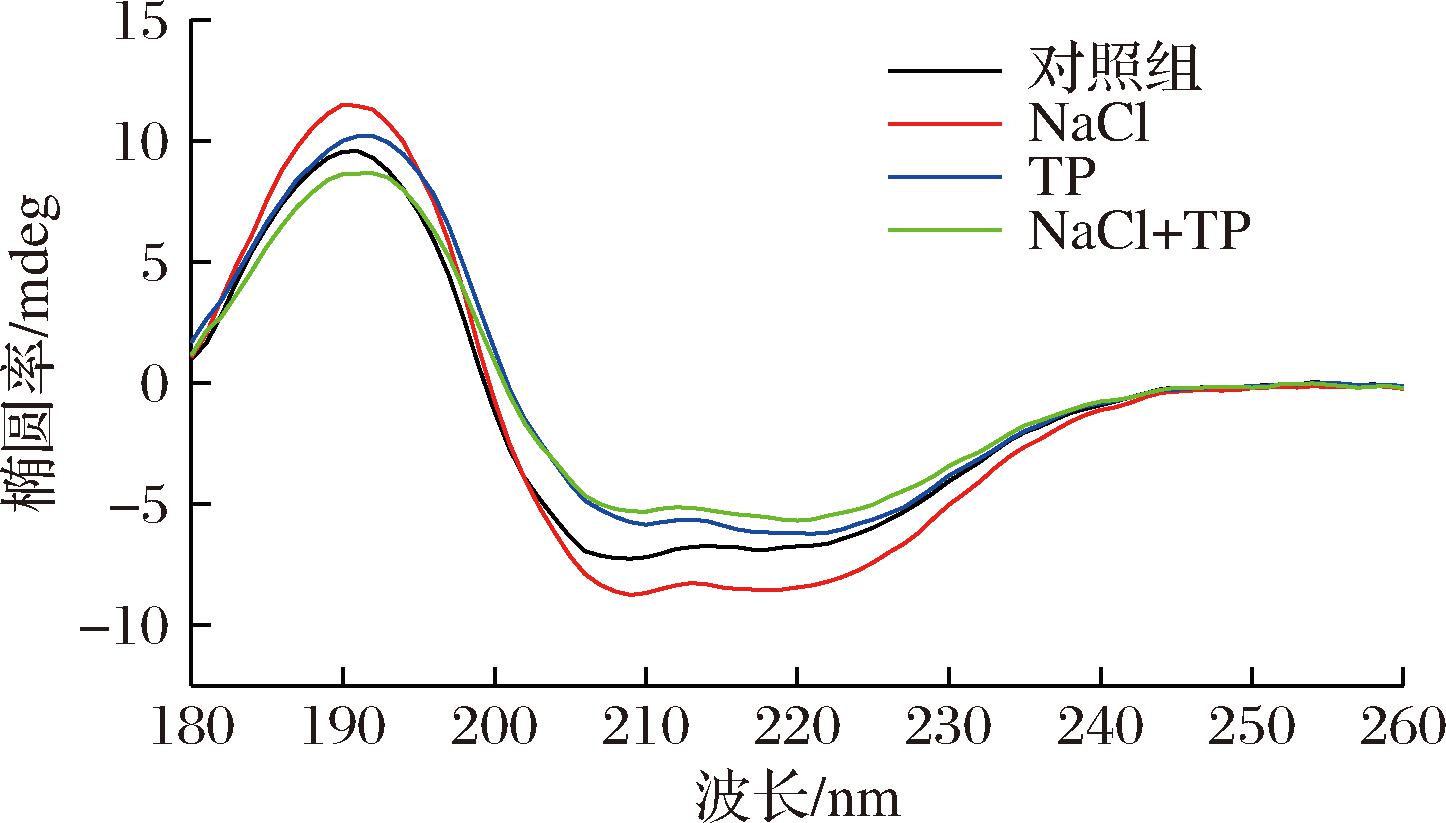
图7 NaCl和TP对碱诱导蛋清凝胶的圆二色谱图的影响
Fig.7 Effects of NaCl and TP on circular dichroism spectra of alkali-induced alkali-induced egg white gels
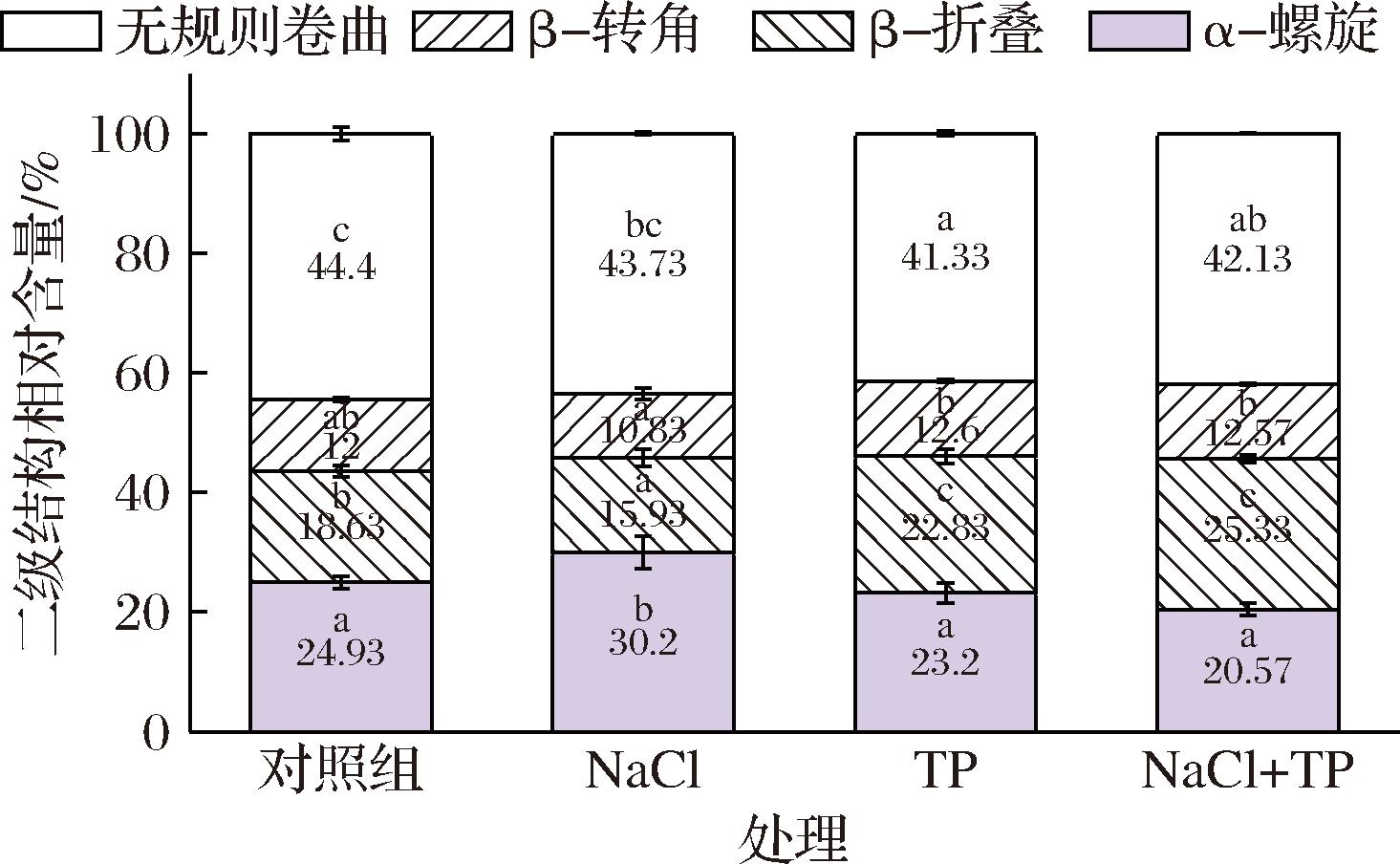
图8 NaCl和TP对碱诱导蛋清凝胶二级结构的影响
Fig.8 Effects of NaCl and TP on secondary structure of alkali-induced egg white gels
与对照组相比,NaCl组的α-螺旋含量显著上升(P<0.05),β-折叠和β-转角含量下降。可能是由于NaCl破坏了蛋白质分子之间的静电相互作用和多肽链中氢键的稳定性,导致蛋白质二级结构的改变[35]。TP组的α-螺旋含量显示出降低的趋势,β-折叠和β-转角含量上升。可能是由于TP氧化为醌后与蛋白质的赖氨酰、酪氨酰和半胱氨酸残基交联,使蛋白质的构象发生了改变[36]。其β-转角含量的增加可能由于TP促进脯氨酸和甘氨酸残基(最可能形成β-转角结构的氨基酸残基)之间形成氢键[20]。
3 结论
本研究采用鸡蛋清为主要原料,考察单独添加NaCl或TP以及两者组合对碱诱导蛋清凝胶理化特性、流变特性和结构特性的影响。结果显示,3组样品pH值均降低,浊度则增加;NaCl组的硬度和咀嚼度与TP组的弹性显著增加(P<0.05);NaCl组黏度最大,且凝胶速率最大;NaCl和TP均能改变蛋清蛋白的二级结构,NaCl组的α-螺旋含量显著上升(P<0.05),β-折叠和β-转角含量下降,TP组则相反。NaCl和TP组对碱诱导鸡蛋清凝胶特性影响显著。然而NaCl和TP组对鸡蛋清凝胶特性的影响机理不同,NaCl组通过影响蛋白质分子的静电相互作用来影响蛋白质分子的聚集、展开和交联,从而影响蛋清凝胶特性;而TP的羟基能与蛋白质结合,通过发生交联反应来改善蛋清凝胶特性。
[1] TAN J E, LIU T T, YAO Y, et al.Changes in physicochemical and antioxidant properties of egg white during the Maillard reaction induced by alkali[J].LWT, 2021, 143:111151.
[2] GUO H R, BAO Z, ZHANG S Y, et al.A novel NIR-based strategy for rapid freshness assessment of preserved eggs[J].Food Analytical Methods, 2022, 15(5):1457-1469.
[3] 畅柯飞. 热处理对蛋清蛋白聚集行为及界面性质调控作用机制研究[D].长春:吉林大学, 2021.
CHANG K F.Study on the mechanism of heat treatment on aggregation behavior and interface properties of egg white protein[D].Changchun:Jilin University, 2021.
[4] LI J H, ZHANG M Q, CHANG C H, et al.Molecular forces and gelling properties of heat-set whole chicken egg protein gel as affected by NaCl or pH[J].Food Chemistry, 2018, 261:36-41.
[5] NICOLAI T.Gelation of food protein-protein mixtures[J].Advances in Colloid and Interface Science, 2019, 270:147-164.
[6] 陈志云, 李杰, 冯雨, 等.茶多酚生物活性及作用机制研究进展[J].食品工业科技, 2024, 45(13):333-341.
CHEN Z Y, LI J, FENG Y, et al.Research progress on bioactivity and mechanism of tea polyphenols[J].Science and Technology of Food Industry, 2024, 45(13):333-341.
[7] LI J H, LI X, WANG C Y, et al.Characteristics of gelling and water holding properties of hen egg white/yolk gel with NaCl addition[J].Food Hydrocolloids, 2018, 77:887-893.
[8] WAN Z C, XIAO N, GUO S G, et al.Synergistic effects of tea polyphenols and phosphorylation on the gelation behavior of egg white proteins[J].Food Hydrocolloids, 2024, 149:109530.
[9] 周绪霞, 陈婷, 吕飞, 等.茶多酚改性对蛋清蛋白凝胶特性的影响及机理[J].食品科学, 2018, 39(16):13-18.
ZHOU X X, CHEN T, LYU F, et al.Effect and mechanism of modification with tea polyphenols on the gel properties of egg white protein[J].Food Science, 2018, 39(16):13-18.
[10] 邵瑶瑶. 金属离子对碱诱导皮蛋蛋白凝胶形成的影响[D].南昌:江西农业大学, 2018.
SHAO Y Y.Effect of metal ions on alkali-induced gel formation of preserved egg protein[D].Nanchang:Jiangxi Agricultural University, 2018.
[11] LI J H, ZHANG Y F, FAN Q, et al.Combination effects of NaOH and NaCl on the rheology and gel characteristics of hen egg white proteins[J].Food Chemistry, 2018, 250:1-6.
[12] 郑赵敏, 徐巧玲, 郑洪梨, 等.枸杞粉对白鲢鱼糜凝胶品质的影响[J].食品与发酵工业, 2024, 50(2):168-176.
ZHENG Z M, XU Q L, ZHENG H L, et al.Effects of wolfberry powder on gel quality of silver carp surimi[J].Food and Fermentation Industries, 2024, 50(2):168-176.
[13] 鲁金佩, 丁可盈, 郭雯雯, 等.不同离子多糖对鱼明胶凝胶特性和结构的影响[J].食品与发酵工业, 2021, 47(17):140-147.
LU J P, DING K Y, GUO W W, et al.Effects of different ionic polysaccharides on the gel and structural properties of fish gelatin[J].Food and Fermentation Industries, 2021, 47(17):140-147.
[14] AI M M, ZHOU Q, XIAO N, et al.Enhancement of gel characteristics of NaOH-induced duck egg white gel by adding Ca(OH)2 with/without heating[J].Food Hydrocolloids, 2020, 103:105654.
[15] 范盛玉, 严竟, 朱坤, 等.辣椒红色素对魔芋葡甘聚糖-大豆分离蛋白复合凝胶性质的影响[J].食品与发酵工业, 2023, 49(8):216-222.
FAN S Y, YAN J, ZHU K, et al.Effects of capsanthin on properties of konjac glucomannan-soybean protein isolate composite gel[J].Food and Fermentation Industries, 2023, 49(8):216-222.
[16] 张晓洁, 马良, 马明思, 等.迷迭香酸的添加对明胶凝胶体系的影响[J].食品与发酵工业, 2018, 44(12):80-85.
ZHANG X J, MA L, MA M S, et al.Effect of rosemary acid on properties of gelatin gel[J].Food and Fermentation Industries, 2018, 44(12):80-85.
[17] ZHOU H L, HU X Y, XIANG X K, et al.Modification of textural attributes of potato protein gels using salts, polysaccharides, and transglutaminase:Development of plant-based foods[J].Food Hydrocolloids, 2023, 144:108909.
[18] 金文刚, 尚美君, 刘洋, 等.单宁酸和芦丁对马哈鱼鱼皮明胶凝胶性质的影响[J].食品与发酵工业, 2022, 48(3):123-129.
JIN W G, SHANG M J, LIU Y, et al.Effects of tannin acid and rutin on gelling characteristics of chum salmon skin gelatin[J].Food and Fermentation Industries, 2022, 48(3):123-129.
[19] HAN T F, XUE H, HU X B, et al.Combined effects of NaOH, NaCl, and heat on the gel characteristics of duck egg white[J].LWT, 2022, 159:113178.
[20] XUE H, XU M, ZHANG G W, et al.Effects of stewing with tea polyphenol on the gel properties, microstructure, and secondary structure of boiled egg white[J].Journal of Food Science, 2021, 86(10):4262-4274.
[21] XU L L, ZHAO Y, XU M S, et al.Effects of salting treatment on the physicochemical properties, textural properties, and microstructures of duck eggs[J].PLoS One, 2017, 12(8):e0182912.
[22] XUE H, ZHANG G W, HAN T F, et al.Improvement of gel properties and digestibility of the water-soluble polymer of tea polyphenol-egg white under thermal treatment[J].Food Chemistry, 2022, 372:131319.
[23] 常海军, 熊杰, 周文斌, 等.植物多酚调控肉蛋白氧化及在肉制品中应用研究进展[J].食品与发酵工业, 2022, 48(20):329-337.
CHANG H J, XIONG J, ZHOU W B, et al.Research progress of plant polyphenols regulating meat protein oxidation and its application in meat products[J].Food and Fermentation Industries, 2022, 48(20):329-337.
[24] CHEN D, ZHU X, ILAVSKY J, et al.Polyphenols weaken pea protein gel by formation of large aggregates with diminished noncovalent interactions[J].Biomacromolecules, 2021, 22(2):1001-1014.
[25] 孟甘露, 楚玉南, 吴仪, 等.自由基法多酚共价结合对大豆蛋白基乳液凝胶特性的影响[J].食品科学, 2024,45(1):23-31.
MENG G L, CHU Y N, WU Y, et al.Effect of free radical method of polyphenol covalent binding on the properties of soy protein-based emulsion gel[J].Food Science, 2024,45(1):23-31.
[26] AI M M, ZHOU Q, GUO S G, et al.Effects of tea polyphenol and Ca(OH)2 on the intermolecular forces and mechanical, rheological, and microstructural characteristics of duck egg white gel[J].Food Hydrocolloids, 2019, 94:11-19.
[27] MIRARAB RAZI S, MOTAMEDZADEGAN A, SHAHIDI A, et al.The effect of basil seed gum (BSG) on the rheological and physicochemical properties of heat-induced egg albumin gels[J].Food Hydrocolloids, 2018, 82:268-277.
[28] RAZI S M, FAHIM H, AMIRABADI S, et al.An overview of the functional properties of egg white proteins and their application in the food industry[J].Food Hydrocolloids, 2023, 135:108183.
[29] LI J H, WANG C Y, ZHANG M Q, et al.Effects of selected phosphate salts on gelling properties and water state of whole egg gel[J].Food Hydrocolloids, 2018, 77:1-7.
[30] XUE H, HAN T F, ZHANG G W, et al.Combined effects of NaOH, NaCl, and heat on the characteristics of ovalbumin gel and the exploration of the mechanism of transparent gel formation[J].Food Hydrocolloids, 2023, 140:108589.
[31] 王月月, 刘莹, 姜鹏飞, 等.CaCl2替代NaCl协同海藻酸钠对虾糜凝胶特性的影响[J].食品科学, 2024,45(2):32-40.
WANG Y Y, LIU Y, JIANG P F, et al.Effects of CaCl2 substitution of NaCl and sodium alginate on the gelling properties of shrimp surimi[J].Food Science, 2024,45(2):32-40.
[32] PHAM L B, WANG B, ZISU B, et al.Covalent modification of flaxseed protein isolate by phenolic compounds and the structure and functional properties of the adducts[J].Food Chemistry, 2019, 293:463-471.
[33] ZHANG G P, ZHU C Y, WALAYAT N, et al.Effect of cryoprotectants on physicochemical and structural changes in repeated freeze-thawed egg white protein[J].Food Bioscience, 2023, 55:102913.
[34] MILLAN S, SWAIN B C, TRIPATHY U, et al.Effect of micro-environment on protein conformation studied by fluorescence-based techniques[J].Journal of Molecular Liquids, 2020, 320:114489.
[35] LI L, LAI B, YAN J N, et al.Characterization of complex coacervation between Chia seed gum and whey protein isolate:Effect of pH, protein/polysaccharide mass ratio and ionic strength[J].Food Hydrocolloids, 2024, 148:109445.
[36] ZHOU X X, CHEN T, LIN H H, et al.Physicochemical properties and microstructure of surimi treated with egg white modified by tea polyphenols[J].Food Hydrocolloids, 2019, 90:82-89.