骨关节系统由骨骼、软骨和肌肉组成,骨骼起到支撑作用,软骨负责润滑、承重和缓冲,而肌肉则发挥运动、连接和保护作用。三者相互协同,共同保障骨关节系统正常生理功能,任何一个部件出现问题,都会影响关节的正常功能,甚至导致关节炎(osteoarthritis,OA)等疾病[1]。目前已有大量研究表明,腿部肌肉无力和肌肉失衡是导致膝关节炎发生发展的重要因素[2],肌肉对于关节软骨的物理保护作用已经得到了充分的重视。关节和软骨同属于肌骨系统的一部分,它们与肌肉除了物理相互作用还存在内分泌相互串扰[3],需要从肌肉与骨关节健康相互作用深入思考。
目前硫酸软骨素(chondroitin sulfate,CS)和氨基葡萄糖(glucosamine,GlcN)常被用作预防和干预关节炎的膳食补充剂。一方面它们本身是软骨细胞合成糖胺聚糖的原料[4],另一方面能够减少促炎因子的转录,降低炎症反应[5]。市场上部分硫酸软骨素和氨基葡萄糖产品会添加Ca和维生素D,以维持骨密度、减少骨质流失,但却忽略肌肉与软骨的相互作用,尤其对于肌少症人群,这些产品无法改善他们因为肌肉无力和肌肉失衡导致的关节磨损加剧的情况[6]。
优质蛋白质和必需氨基酸作为人体重要的营养素在推动肌肉蛋白代谢正平衡,促进肌肉合成方面具有重要作用。乳清蛋白(whey protein,WP)是一种从牛奶中提取的蛋白,富含的20种必须氨基酸(23%为支链氨基酸)是肌肉蛋白合成的底物,能有效促进肌肉蛋白合成[7]。WP作为一种动物蛋白相比于植物蛋白具有必需氨基酸种类齐全和生物利用度高的优点[8],并且研究发现其相比于同样来源于牛乳的酪蛋白能更有效地促进全身蛋白合成[9]。此外WP中的免疫球蛋白、乳铁蛋白和β-乳球蛋白等具有免疫调节功效[10]。因此在种类繁多的蛋白补充剂中WP备受青睐,已被广泛应用于各类营养补充剂。亮氨酸(leucine,Leu)是一种支链氨基酸,是肌肉蛋白质合成的直接底物。而不同于其他氨基酸,Leu也能作为信号分子激活mTOR信号通路,加速肌肉蛋白合成,因此其促进肌肉生长的效果优于其他氨基酸[11]。已有研究指出在必需氨基酸中,Leu对于老年人肌肉蛋白合成的刺激作用最佳[12]。因此,本研究在普通骨关节补充剂基础上添加WP和Leu,以关节炎大鼠模型为研究对象,探究其对关节的保护作用及可能机制,以期通过肌肉对关节软骨的物理保护作用和内分泌串扰,获得更好的保护软骨的效果,并为相关产品的开发提供有价值的理论依据。
1 材料与方法
1.1 动物、材料与试剂
1.1.1 实验动物
40只SPF级6周龄SD大鼠,购自浙江维通利华实验动物技术有限公司(生产许可证号:SCXK(浙)2019-0001),饲养于江南大学实验动物中心(许可证号:SYXK(苏)2021-0056),所有操作均符合江南大学动物伦理委员会所制定的伦理学标准,伦理编号:JN.No20230330S0560605[116]。
1.1.2 实验原料
普通补充剂组成:33.35%(质量分数,下同)氨基葡萄糖、12.09%硫酸软骨素、54.45%柠檬酸钙、0.11%维生素D3;
WP+Leu补充剂组成:79.54% WP、2.01% Leu、6.15%氨基葡萄糖、2.23%硫酸软骨素、10.04%柠檬酸钙、0.02%维生素D3。
其中普通补充剂的组成参考了市售的多款氨糖硫酸软骨素钙片成分和QB/T 2895—2007《运动营养食品 运动人群营养素》;WP+Leu补充剂中额外添加WP和Leu的量和比例参考了一项刺激肌肉蛋白合成的低热量高蛋白营养组合物专利[13]。
1.1.3 主要试剂
木瓜蛋白酶,美国Sigma有限公司;L-半胱氨酸,国药集团;双醋瑞因胶囊,昆明积大制药有限公司;二甲基亚甲蓝氯化锌复盐,阿拉丁生化科技股份有限公司;羟脯氨酸测定试剂盒,南京建成生物工程研究所;大鼠MMP-3、MMP-10、IL-1b、IL-6、IL-10、TNF-α、IGF-1、FGF-2试剂盒,厦门慧嘉生物科技有限公司;骨组织 RNA 提取试剂盒,北京艾德莱生物科技有限公司;ChamQ Universal SYBR qPCR Master Mix,诺唯赞生物科技有限公司;PCR引物,苏州金唯智生物科技有限公司。
1.2 仪器与设备
M5酶标仪,美国Molecular Devices公司;台式高速离心机,美国Thermo Fisher Scientific公司;微量移液器,德国Eppendorf公司;PCR仪苏州东胜兴业科学仪器有限公司;实时荧光定量PCR仪,美国ABI公司;CX40生物显微镜,舜宇光学科技有限公司。
1.3 实验动物造模与分组
1.3.1 关节炎模型建立
采用膝关节注射木瓜蛋白酶的方法建立大鼠关节炎模型。配制4%(质量分数,下同)木瓜蛋白酶和0.03 mol/L L-半胱氨酸混合溶液,0.22 μm滤膜过滤除菌,4 ℃保存备用。分别于适应期结束后的第1、4、7天,将大鼠用异氟烷麻醉后双膝关节腔注射0.1 mL 4%木瓜蛋白酶溶液(正常组注射生理盐水)。研究表明,木瓜蛋白酶能降解软骨中的糖胺聚糖[14],使得正常范围内的应力也能造成软骨损伤,进而产生炎症,因此注射完成后大鼠在正常饲养下逐渐形成膝关节炎。
1.3.2 动物分组
40只大鼠随机分为正常组、模型组、阳性(双醋瑞因)对照组、普通补充剂组、WP+Leu补充剂组,注射后第10天开始灌胃干预。阳性对照组灌胃10.3 mg/kg·BW双醋瑞因(以60 kg成年人推荐剂量按体表面积换算),WP+Leu补充剂组灌胃剂量4.2 g/kg·BW(相当于60 kg成年人推荐剂量的10倍),普通补充剂组灌胃剂量0.86 g/kg·BW(使氨基葡萄糖、硫酸软骨素、柠檬酸钙、维生素D3水平与WP+Leu补充剂组相同),其余组灌胃等体积去离子水,具体灌胃方案如表1所示。连续干预30 d,大鼠处死前禁食12 h,腹腔注射戊巴比妥钠溶液麻醉,心脏采血致死,静置30 min后4 ℃,3 000 r/min,15 min离心取血清,-80 ℃保存;解剖大鼠取脏器、腿骨和腿肌。
表1 大鼠分组及灌胃情况
Table 1 Rat grouping and gavage
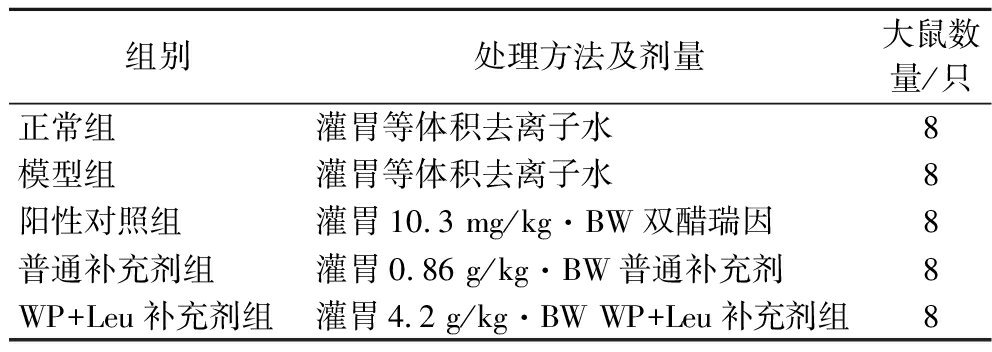
组别处理方法及剂量大鼠数量/只正常组灌胃等体积去离子水8模型组灌胃等体积去离子水8阳性对照组灌胃10.3 mg/kg·BW双醋瑞因8普通补充剂组灌胃0.86 g/kg·BW普通补充剂8WP+Leu补充剂组灌胃4.2 g/kg·BW WP+Leu补充剂组8
1.4 实验方法
1.4.1 体长、体重、脏器指数和肌肉指数的测定
用皮尺测量大鼠从颈部到尾巴根部的长度,记为体长;称量记录体重,解剖取胸腺、肝脏、肾脏、脾脏和腿部肌肉,分别称重。各脏器指数和腿肌率按照公式(1)、公式(2)计算。
脏器指数![]()
(1)
腿肌率![]()
(2)
1.4.2 大鼠前肢拉力测定
使用大鼠抓力记测定大鼠前肢拉力。抓住大鼠尾巴提起大鼠,并使其前肢靠近拉力杆,待其抓牢拉力杆后水平向后匀速拉大鼠尾巴直至其松开前肢,记录最大拉力,重复3次取平均值。
1.4.3 膝关节组织学观察及Mankin’s评分
将右侧膝关节上下1 cm处截断,将截取的膝关节放入多聚甲醛中固定24 h,之后转移到脱钙液中脱钙1个月,期间每3天换1次脱钙液;脱钙完成后经除酸、脱水、透明、石蜡包埋、番红O-固绿染色,于显微镜下观察软骨细胞和细胞外基质染色情况及结构完整性,并参照Mankin’s评分标准[15]进行关节软骨病理评分,评分表详见表2。
表2 Mankin’s 评分标准
Table 2 Mankin’s scoring criteria
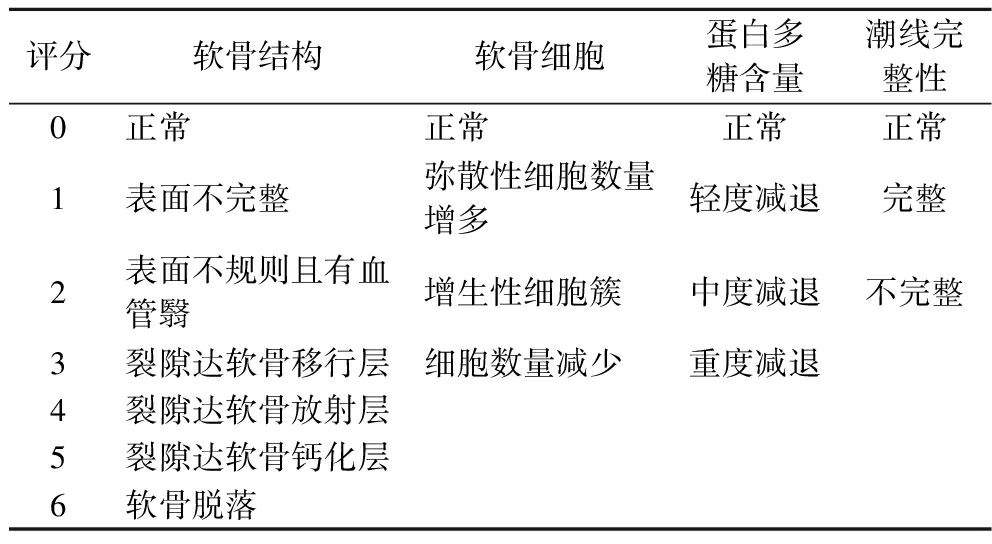
评分软骨结构软骨细胞蛋白多糖含量潮线完整性0正常正常正常正常1表面不完整弥散性细胞数量增多轻度减退完整2表面不规则且有血管翳增生性细胞簇中度减退不完整3裂隙达软骨移行层细胞数量减少重度减退4裂隙达软骨放射层5裂隙达软骨钙化层6软骨脱落
1.4.4 血清、肌肉和软骨生化指标测定
使用Elisa试剂盒测定血清中IL-1β、IL-6、IL-10、TNF-α、基质金属蛋白酶3(matrix met-alloproteinase-3, MMP-3)、基质金属蛋白酶10(matrix met-alloproteinase-10, MMP-10)、胰岛素生长因子1(insulin growth factor-1, IGF-1)、成纤维细胞生长因子2(fibroblast growth factor-2, FGF-2)水平以及软骨匀浆中整合素β1水平,操作按试剂盒说明书进行。
1.4.5 关节软骨糖胺聚糖含量测定
用1,9-二甲基亚甲蓝比色法测定软骨中糖胺聚糖含量。取关节软骨5 mg,加4%木瓜蛋白酶溶液0.075 mL,于65 ℃水浴中恒温消化20 h,将消化液按1∶50比例稀释;取20 μL稀释后的消化液于酶标板中,加入200 μL 16 mg/L的1,9-二甲基亚甲蓝溶液,用酶标仪在492 nm下测量吸光值;用同样方法测定不同浓度硫酸软骨素溶液的吸光值制作标准曲线。
1.4.6 关节软骨胶原蛋白含量测定
使用羟脯氨酸测定试剂盒(碱水解法)测定关节软骨中胶原蛋白含量。取5 mg关节软骨,用试剂盒中碱水解液水解后,按照试剂盒说明书操作,测定水解液中羟脯氨酸含量,并换算得出软骨中胶原蛋白含量。
1.4.7 实时荧光定量 PCR 测定软骨相关基因表达
使用骨组织RNA提取试剂盒(柱式提取法)提取RNA,操作按照试剂盒说明书进行。
采用SYBR Green qPCR方法,以三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GADPH)为内参,测定性别决定区域迁移组框转录因子9(sex-determining region mobility group box 9, SOX9)、磷脂酰肌醇三羟基激酶(phosphoinositide-3 kinase, PI3K)和蛋白激酶B(PKB, AKT)mRNA的表达量,引物序列如表3所示。反应体系如下:0.4 μL上游引物(10 μmol/L)、0.4 μL下游引物(10 μmol/L)、5.0 μL 2×ChamQ Universal SYBR qPCR Master Mix、3.2 μL无菌水和1 μL cDNA模板,形成10 μL体系。使用实时荧光定量PCR仪检测各模板的Ct值,通过2-△△Ct法进行相对定量。
表3 实时荧光定量PCR引物序列
Table 3 Real-time quantitative polymerase chain reaction primers
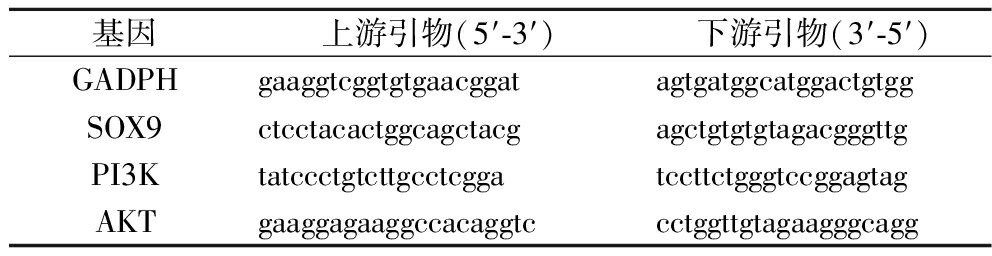
基因上游引物(5′-3′)下游引物(3′-5′)GADPHgaaggtcggtgtgaacggatagtgatggcatggactgtggSOX9ctcctacactggcagctacgagctgtgtgtagacgggttgPI3KtatccctgtcttgcctcggatccttctgggtccggagtagAKTgaaggagaaggccacaggtccctggttgtagaagggcagg
1.4.8 数据分析
采用Prism 8对实验数据进行统计分析与绘图,组间采用单因素方差分析(one-way ANOVA),以P<0.05为显著性差异,P<0.01为极显著性差异,数值以“平均值±标准差”形式表示。
2 结果与分析
2.1 生长性能及脏器指数
如表4所示,各组大鼠体重和体长无显著性差异。WP+Leu补充剂组大鼠的胸腺指数和脾脏指数较正常组显著升高,肝脏和肾脏指数则无显著性变化。胸腺和脾脏是重要的免疫器官,免疫器官指数的高低可以提示免疫能力的强弱[16],该结果暗示WP和Leu的添加可以增强大鼠的免疫能力,这可能与WP的免疫调节功效有关。
表4 大鼠生长性能和脏器指数
Table 4 Growth performance and organ index of rats
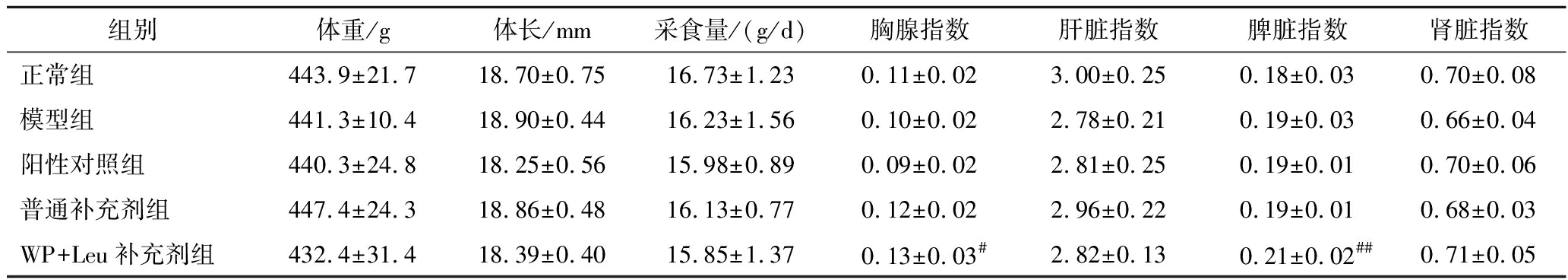
组别体重/g体长/mm采食量/(g/d)胸腺指数肝脏指数脾脏指数肾脏指数正常组443.9±21.718.70±0.7516.73±1.230.11±0.023.00±0.250.18±0.030.70±0.08模型组441.3±10.418.90±0.4416.23±1.560.10±0.022.78±0.210.19±0.030.66±0.04阳性对照组440.3±24.818.25±0.5615.98±0.890.09±0.022.81±0.250.19±0.010.70±0.06普通补充剂组447.4±24.318.86±0.4816.13±0.770.12±0.022.96±0.220.19±0.010.68±0.03WP+Leu补充剂组432.4±31.418.39±0.4015.85±1.370.13±0.03#2.82±0.130.21±0.02##0.71±0.05
注:与正常组相比,#表示差异显著(P<0.05),##表示差异极显著(P<0.01)(下同)。
2.2 膝关节组织学观察、软骨成分和基质金属蛋白酶水平测定
2.2.1 膝关节组织学观察及Mankin’s评分
番红O会和糖胺聚糖结合呈红色,而固绿会将骨骼中的钙质结合呈蓝绿色。如图1所示,正常大鼠软骨呈饱满的红色,且表面平整无破损,软骨细胞排列规整;模型组软骨染色结果红色明显衰退,可见糖胺聚糖含量明显减少,这与木瓜蛋白酶水解蛋白多糖有关[14],且软骨表面有明显损伤,软骨细胞排列紊乱,并出现簇状增生细胞团。双醋瑞因是临床常用的关节炎治疗药物,作为IL-1的有效抑制剂,能抑制炎症反应,减缓关节炎的病程发展,减轻疼痛,提高患者生活质量。图1-c显示阳性对照组较模型组软骨损伤有所改善,细胞团簇增生减少,但糖胺聚糖含量衰退情况并没有明显改善。灌胃普通补充剂后软骨糖胺聚糖含量恢复较好,但表面损伤恢复较差,细胞团簇增生减少,这与硫酸软骨素和氨基葡萄糖上调糖胺聚糖合成,促进软骨修复的作用有关;而WP+Leu补充剂干预对糖胺聚糖含量和表面损伤恢复程度最好,细胞团簇增生减少,整体效果最好,表明WP和Leu的加入可以增强普通补充剂对软骨的修复效果。

a-正常组;b-模型组;c-阳性对照组;d-普通补充剂组;e-WP+Leu 补充剂组
图1 膝关节软骨组织学观察(番红O-固绿染色,×100)
Fig.1 Histological observation of knee cartilage (safranin O-fast green staining, ×100)
Mankin’s评分是一种通过观察切片量化评价关节炎进展的指标,评分越高表明关节炎症状越严重。如表5所示,正常大鼠膝关节软骨Mankind’s评分显著低于模型组,各干预组评分均显著低于模型组,其中WP+Leu补充剂组评分显著低于普通补充剂组,提示添加WP和Leu能够帮助改善关节炎。
表5 大鼠膝关节软骨 Mankin’s 评分结果
Table 5 Mankin’s scores of knee cartilage of rats
组别正常组模型组阳性对照组普通补充剂组WP+Leu 补充剂组得分0.33±0.58∗∗8.33±2.085.67±0.58∗4.67±0.58∗∗2.33±0.58∗∗&
注:与模型组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与普通补充剂组相比,&表示差异显著(P<0.05)(下同)。
2.2.2 关节软骨糖胺聚糖、胶原蛋白含量和血清MMPs水平
如图2所示,大鼠关节注射4%木瓜蛋白酶后导致软骨糖胺聚糖含量和胶原蛋白含量显著降低;阳性对照组相比于模型组胶原蛋白含量显著恢复,但糖胺聚糖含量没有显著提升;补充剂干预后软骨糖胺聚糖和胶原蛋白含量均显著高于模型组,软骨糖胺聚糖含量测定结果与番红O-固绿染色结果相符。值得注意的是添加WP和Leu使软骨胶原蛋白和糖胺聚糖含量显著高于普通补充剂组,表明该组具有最优的软骨修复效果。
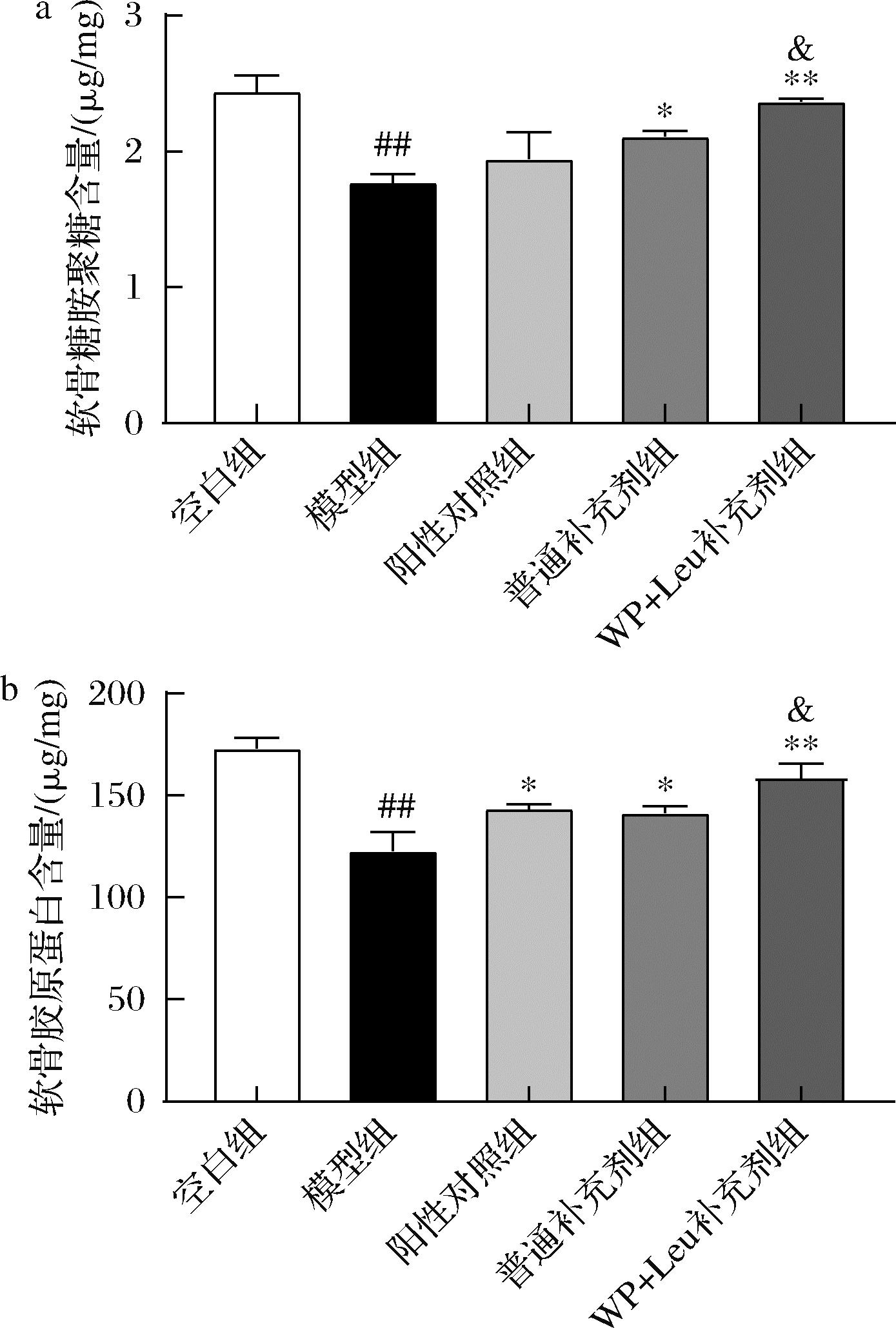
a-软骨糖胺聚糖含量差异;b-软骨胶原蛋白含量差异
图2 关节软骨糖胺聚糖含量和胶原蛋白含量差异
Fig.2 Difference of glycosaminoglycan content and collagen content of articular cartilage
注:与模型组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与正常组相比,#表示差异显著(P<0.05),##表示差异极显著(P<0.01);与普通补充剂组相比,&表示差异显著(P<0.05)(下同)。
MMPs可以分解Ⅱ型胶原的三螺旋结构,在软骨降解中起主要作用,其基因表达可以被IL-1β等炎症因子激活[17]。MMP-3是MMP的关键组成,对多糖具备充分的裂解活性,在基质降解和软骨破坏的病理发展过程中发挥关键作用[18]。MMP-10属于基质金属蛋白酶中的基质溶解酶类,可以降解包括胶原质Ⅲ、Ⅳ、Ⅴ、层黏连蛋白-1等蛋白质,破坏关节正常结构[19]。
如图3所示,模型组大鼠血清MMP-3和MMP-10含量显著高于正常组,提示模型组炎症水平上升,而阳性对照组、各补充剂组血清MMP-3和MMP-10水平均显著低于模型组,这可能与双醋瑞因、硫酸软骨素和氨基葡萄糖的抑炎效果有关。可以推测MMPs水平变化也是模型组胶原蛋白含量显著降低,而各干预组组胶原蛋白含量显著恢复的原因之一。
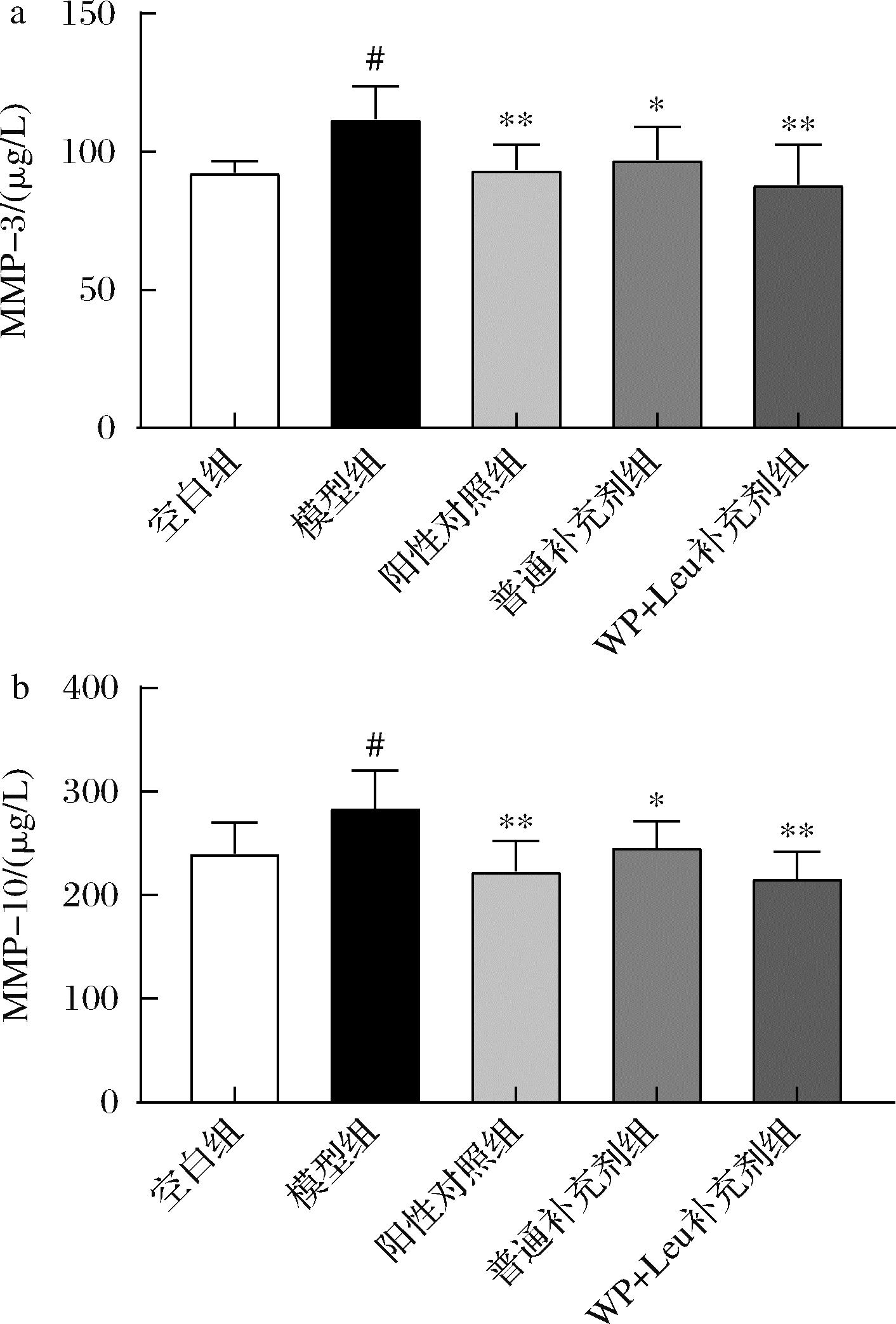
a-MMP-3;b-MMP10
图3 大鼠血清基质金属蛋白酶水平
Fig.3 Serum matrix metalloproteinase levels in rats
2.3 补充剂对大鼠血清炎性因子水平的影响
IL-1β、IL-6、TNF-α是主要由活化的巨噬细胞产生的促炎因子,细胞损伤时释放,在关节炎发生发展中起重要调节作用[20]。IL-10是一种有效的抗炎细胞因子,来源于单核细胞、巨噬细胞、CD4+T细胞、CD8+T细胞或B细胞,抑制免疫和炎症反应[21]。如表6所示,与正常组相比,模型组血清IL-1β、IL-6水平和TNF-α水平显著升高,IL-10水平显著降低,表明膝关节腔注射木瓜蛋白酶使大鼠出现炎症反应。而双醋瑞因、补充剂干预能不同程度降低上述促炎因子水平,提高抑炎因子水平,这进一步验证了双醋瑞因和补充剂成分对关节炎的干预效果,其中添加WP和Leu的补充剂效果最佳。血清促炎因子的升高也是MMPs水平升高的原因。
表6 大鼠血清炎性因子水平 单位:ng/L
Table 6 Levels of serum inflammatory factors in rats

组别IL-1βIL-6TNF-αIL-10正常组18.65±1.8676.98±5.06202.1±18.825.21±0.90模型组21.17±1.84#91.54±12.02#241.7±29.4#20.62±3.22#阳性对照组19.05±2.6675.07±7.15∗202.4±17.4∗25.74±3.27∗∗普通补充剂组18.01±0.89∗83.14±8.04190.4±31.6∗∗24.86±3.64∗WP+Leu补充剂组17.22±0.92∗∗70.84±10.15∗∗182.1±29.3∗∗29.7±3.01∗∗
2.4 大鼠肌肉相关指标
为了阐明WP和Leu帮助软骨修复的机制,本研究进一步测定了肌肉相关指标。从图4可以看出,灌胃WP和Leu补充剂能够显著提高大鼠肌肉拉力和腿肌率。肌肉收缩的力学刺激通过以整合素β1为基础的黏着斑结构传导给软骨细胞[22],当受到力学刺激时,整合素β1表达上调,促进黏着斑结构的组装,使细胞更好地感受力学刺激。如图5所示,WP+Leu补充剂组软骨整合素β1水平显著高于正常组、模型组和骨关节补充剂组,这可能与大鼠肌肉拉力的显著上升有关。
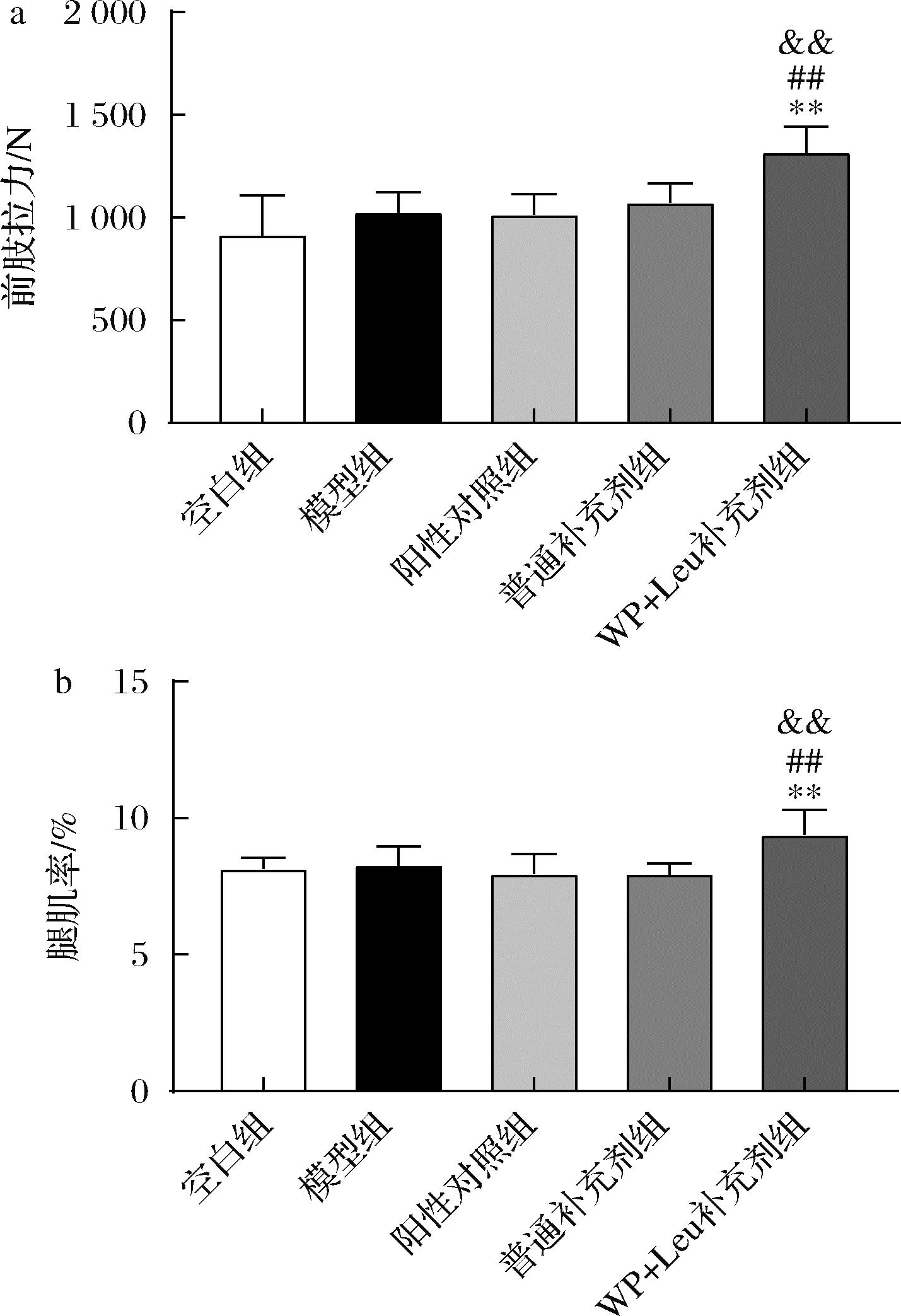
a-前肢拉力;b-腿肌率
图4 大鼠肌肉表观指标
Fig.4 Muscle apparent indexes of rats
注:与普通补充剂组相比,&&表示差异极显著(P<0.01)(下同)。
FGF-2是主要由成肌细胞、肌纤维细胞、肌卫星细胞[3]分泌的一种细胞因子,经由血液到达滑膜液,作用于关节软骨,促进软骨细胞合成代谢[23]。IGF-1主要由肝脏和肌肉分泌,通过体液循环经滑膜液到达关节软骨,以剂量依赖性方式刺激蛋白多糖的产生[24]。如图5所示,WP+Leu补充剂组血清中FGF-2及IGF-1水平均显著高于其他组,这可能与肌肉量的显著增加有关。
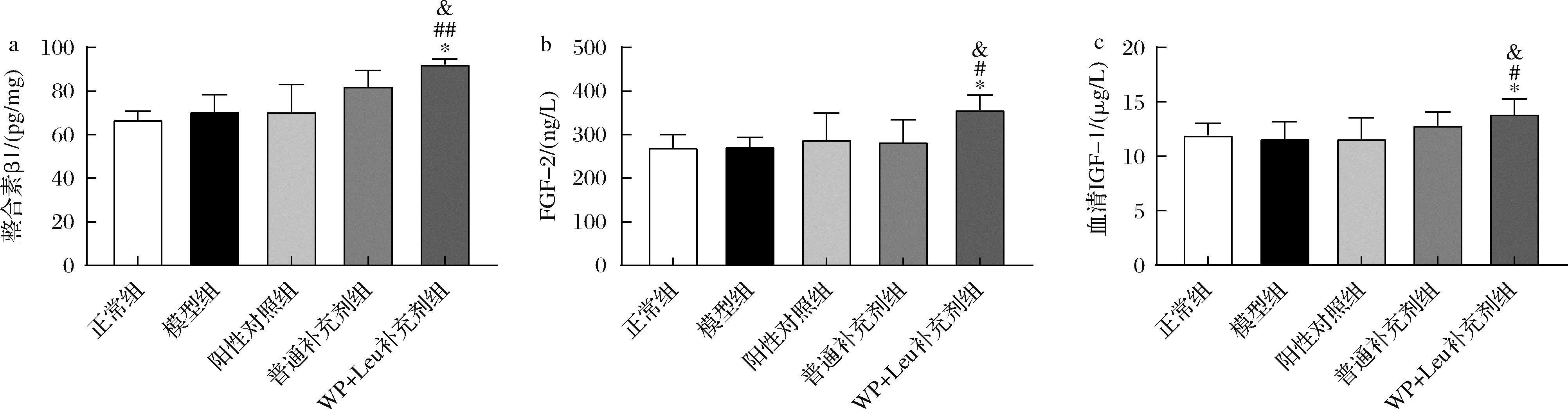
a-螯合素β1;b-FGF-2;c-血清IGF-1
图5 大鼠肌肉内分泌指标
Fig.5 Muscle-related endocrine indicators in rats
2.5 软骨充质干细胞转化和细胞外基质合成相关基因表达水平
SOX9是间充质干细胞(mesenchymal stem cell,MSC)分化过程中的一种重要的转录因子,研究表明 FGF-2可以上调SOX9基因的表达,促进MCS向软骨分化[25],增加软骨的细胞外基质的合成。同时,整合素β1可以通过黏着斑激酶(focal adhesion kinase, FAK)激活PI3K-AKT通路,促进软骨细胞合成细胞外基质[26]。如图6所示,灌胃WP+Leu补充剂后软骨PI3K mRNA、AKT mRNA和SOX9 mRNA的相对表达量均显著高于正常组、模型组和普通补充剂组。
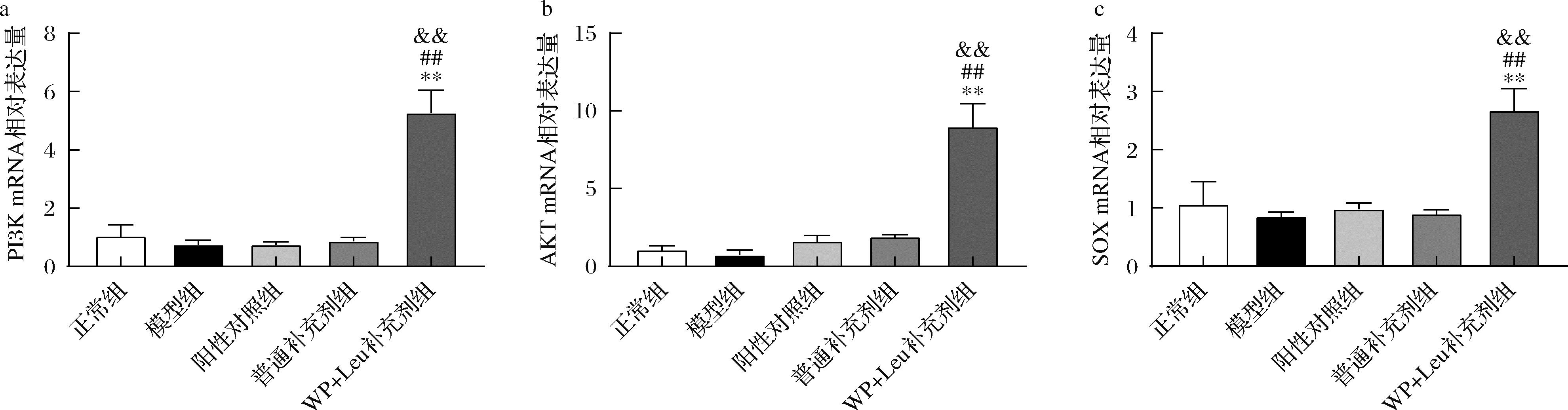
a-PI3K;b-AKT;c-SOX9
图6 软骨细胞中PI3K mRNA、AKT mRNA和SOX9 mRNA的相对表达量
Fig.6 Relative expression levels of SOX9-mRNA, PI3K-mRNA, AKT-mRNA in chondrocytes
结合肌肉指标可以得出,WP和Leu一方面可增加肌肉量和增强拉力,强化对软骨的力学刺激,引起关节软骨整合素β1水平提高,通过上调PI3K mRNA和AKT mRNA表达,促进Ⅱ型胶原和蛋白聚糖合成;另一方面提高了血清FGF-2和IGF-1水平,促进软骨细胞的合成代谢,同时上调FGF-2和SOX9 mRNA表达水平,促进间充质干细胞增值和向软骨细胞的分化,进而修复软骨损伤,因此添加WP和Leu的补充剂效果要优于普通补充剂组。
3 讨论
近年来随着人口老龄化进展,关节炎等与增龄相关疾病的患病人数正在逐年增加,对社会和经济造成巨大压力。目前对于关节炎的标准化治疗方案尚无统一定论[27],这使得以预防为主的研究极为重要,通过建立关节炎动物模型可以更好地研究预防治疗手段。本研究采用膝关节注射木瓜蛋白酶的方式建立大鼠关节炎模型,发现大鼠膝关节软骨胶原蛋白和糖胺聚糖含量显著降低,并伴随着血清促炎因子IL-1β、IL-6、TNF-α以及基质金属蛋白酶MMP-3、MMP-10的上调和抑炎因子IL-10下调。关节软骨组织学观察结果显示,关节软骨表面出现明显损伤,软骨细胞簇状增生,Mankin’s评分显著升高,整体表现出早期关节炎的症状,这与刘映岐[17]的研究相符。
氨基葡萄糖和硫酸软骨素是目前常用的预防关节炎的膳食补充剂。口服硫酸软骨素和氨基葡萄糖在经过肠胃吸收后会跟随血液到达软骨细胞,促进软骨细胞合成糖胺聚糖[4]。此外,氨基葡萄糖能够上调软骨细胞蛋白多糖、Ⅱ型胶原合成基因的表达,同时降低胶原蛋白酶和磷脂酶A2活性,减少胶原蛋白分解[28-29];硫酸软骨素则通过抑制p38丝裂原激活蛋白激酶和细胞外信号调节激酶1/2磷酸化来减少NF-κB的核异位,从而减少促炎因子的转录,降低炎症反应[5]。从血清炎性因子和MMPs水平结果来看,两种补充剂均能显著降低促炎因子和提高抑炎因子水平,下调MMP-3和MMP-9水平,其抑炎效果与双醋瑞因相近。软骨成分和组织学观察发现,两者亦能显著提高软骨糖胺聚糖和胶原蛋白含量,显著降低Mankin’s评分,改善病理学异常现象。但双醋瑞因干预不能使糖胺聚糖含量显著上升,这可能是因为其主要是抑制炎症,而不是促进糖胺聚糖合成。值得注意的是,补充剂添加WP和Leu灌胃能显著提高了模型大鼠关节软骨糖胺聚糖和胶原蛋白含量,降低Mankin’s评分,效果要优于普通补充剂组,表明WP和Leu更有利于软骨损伤修复。
WP和Leu能有效促进肌肉蛋白的合成。为了阐明WP和Leu帮助软骨修复的机制,本研究测定了肌肉相关指标。结果发现,WP+Leu补充剂组大鼠后肌肉量和肌肉拉力相比于其他组都有显著提升。ELISA实验结果显示,WP与Leu联用显著提高软骨整合素β1水平和血清FGF-2和IGF-1水平。一方面,整合素β1作为软骨感受力学变化的黏着斑结构核心,可以帮助软骨更好地感受力学刺激;另一方面,由肌肉分泌的生长因子FGF-2和IGF-1,可通过血液进入滑膜液作用于软骨,促进软骨损伤修复,其水平上调与肌肉量的增加有显著相关。进一步测定软骨中相关基因的表达发现,WP+Leu补充剂组较其他组PI3K mRNA、AKT mRNA和SOX9 mRNA的相对表达量均显著上调。一般认为,整合素β1可激活FAK上调PI3K-AKT信号通路,促进II型胶原和蛋白聚糖合成,帮助关节软骨修复[26];SOX9则是软骨分化过程中的一种重要的转录因子,可激活一些软骨组织特异性基因如COL2A1的表达,影响MSC的细胞外基质合成。FGF-2可以上调SOX9基因表达,促进MSC向软骨细胞分化[25]并合成软骨细胞外基质,帮助软骨的修复。上述结果表明,WP与Leu联用一方面可增加肌肉量和增强拉力,强化对软骨的力学刺激,引起关节软骨整合素β1水平提高,通过上调PI3K mRNA和AKT mRNA表达,促进II型胶原和蛋白聚糖合成;另一方面提高了血清FGF-2和IGF-1水平,促进软骨细胞的合成代谢,同时上调FGF-2水平和SOX9 mRNA表达水平,促进间充质干细胞增值和向软骨细胞的分化,进而修复软骨损伤,效果要优于普通补充剂组。
综上,本研究以WP和Leu为主要成分复配得到了一款骨关节补充剂,发现能够修复关节炎大鼠的关节软骨损伤,在增加肌肉量与肌肉力量的同时强化肌肉与软骨的物理相互作用和内分泌相互串扰,达到比普通补充剂更好的修复软骨损伤作用,可为针对肌肉无力和肌肉失衡导致的关节磨损的相关产品的开发提供有价值的理论依据。
[1] DE BRITO FONTANA H, HERZOG W.The role of muscles in knee joint osteoarthritis[J].Sports Orthopaedics and Traumatology, 2021, 37(2):85-100.
[2] SAWATSKY A, BOURNE D, HORISBERGER M, et al.Changes in patellofemoral joint contact pressures caused by vastus medialis muscle weakness[J].Clinical Biomechanics, 2012, 27(6):595-601.
[3] 金晶, 谢娇娇, 姜丹阳, 等.运动和细胞信号分子的交互作用及骨骼肌肥大调控机制[J].中国体育科技, 2021, 57(2):66-73.
JIN J, XIE J J, JIANG D Y, et al.Interaction between exercise and signaling molecules and regulation mechanism of skeletal muscle hypertrophy[J].China Sport Science and Technology, 2021, 57(2):66-73.
[4] BASSLEER C, ROVATI L, FRANCHIMONT P.Stimulation of proteoglycan production by glucosamine sulfate in chondrocytes isolated from human osteoarthritic articular cartilage in vitro[J].Osteoarthritis and Cartilage, 1998, 6(6):427-434.
[5] JOMPHE C, GABRIAC M, HALE T M, et al.Chondroitin sulfate inhibits the nuclear translocation of nuclear factor-kappaB in interleukin-1beta-stimulated chondrocytes[J].Basic &Clinical Pharmacology &Toxicology, 2008, 102(1):59-65.
[6] HURLEY M V.The role of muscle weakness in the pathogenesis of osteoarthritis[J].Rheumatic Disease Clinics of North America, 1999, 25(2):283-298.
[7] 张辉. 浅谈乳清蛋白与增肌运动[J].才智, 2009(33):297.
ZHANG H.Whey protein and muscle building exercise[J].Intelligence, 2009(33):297.
[8] 杨慧丽. 不同来源膳食蛋白质与慢性肾脏病发生及进展关系的研究进展[J].全科护理, 2022, 20(31):4359-4363.
YANG H L.Research progress on the relationship between different sources of dietary protein and the occurrence and progression of chronic kidney disease[J].Chinese General Practice Nursing, 2022, 20(31):4359-4363.
[9] DANGIN M, GUILLET C, GARCIA-RODENAS C, et al.The rate of protein digestion affects protein gain differently during aging in humans[J].The Journal of Physiology, 2003, 549(2):635-644.
[10] LEE J H, PAEK S H, SHIN H W, et al.Effect of fermented soybean products intake on the overall immune safety and function in mice[J].Journal of Veterinary Science, 2017, 18(1):25-32.
[11] D’ANTONA G, RAGNI M, CARDILE A, et al.Branched-chain amino acid supplementation promotes survival and supports cardiac and skeletal muscle mitochondrial biogenesis in middle-aged mice[J].Cell Metabolism, 2010, 12(4):362-372.
[12] KATSANOS C S, KOBAYASHI H, SHEFFIELD-MOORE M, et al.A high proportion of leucine is required for optimal stimulation of the rate of muscle protein synthesis by essential amino acids in the elderly[J].American Journal of Physiology.Endocrinology and Metabolism, 2006, 291(2):E381-E387.
[13] 伊薇特·查尔洛特·卢伊金, 乔治·韦尔兰, 马里昂·茹尔当.用于刺激肌肉蛋白合成的低热量高蛋白营养组合物:中国,CN102665736B[P].2014-10-29.
CHARLOT-LUYKIN Y, VERLAND G, JOURDAN M.A low-calorie, high-protein nutrient composition for stimulating muscle protein synthesis:China, CN102665736B[P].2014-10-29.
[14] MURRAY D G.Experimentally induced arthritis using intra-articular papain[J].Arthritis &Rheumatism, 1964, 7(3):211-219.
[15] MANKIN H J, LIPPIELLO L.Biochemical and metabolic abnormalities in articular cartilage from osteo-arthritic human hips[J].The Journal of Bone and Joint Surgery.American Volume, 1970, 52(3):424-434.
[16] OH M J, CHOI H D, HA S K, et al.Immunomodulatory effects of polysaccharide fraction isolated from Fagopyrum esculentum on innate immune system[J].Biochemical and Biophysical Research Communications, 2018, 496(4):1210-1216.
[17] 刘映岐. 菟丝子治疗膝骨性关节炎实验及临床验证研究[D].成都:成都中医药大学, 2017.
LIU Y Q.Experimental and clinical validation of dodder in the treatment of knee osteoarthritis[D].Chengdu:Chengdu University of TCM, 2017.
[18] HALLER J M, SWEARINGEN C A, PARTRIDGE D, et al.Intraarticular matrix metalloproteinases and aggrecan degradation are elevated after articular fracture[J].Clinical Orthopaedics and Related Research, 2015, 473(10):3280-3288.
[19] 文军, 荣晓凤.复方大黄散对类风湿关节炎大鼠MMP-10及IL-33的影响[J].免疫学杂志, 2015, 31(1):41-46.
WEN J, RONG X F.Effects of the combination of compound rhubarb powder and methotrexate on the expression of MMP-10 and IL-33 in rheumatoid arthritis rats[J].Immunological Journal, 2015, 31(1):41-46.
[20] BOKHARI R A, TANTOWI N A C A, LAU S F, et al.Java tea (Orthosiphon stamineus) protected against osteoarthritis by mitigating inflammation and cartilage degradation:A preclinical study[J].Inflammopharmacology, 2018, 26(4):939-949.
[21] 王也, 张力木, 齐帅, 等.IL-6、IL-33、IL-10在牙周炎和类风湿关节炎中的表达和相关性分析[J].上海口腔医学, 2021, 30(5):498-503.
WANG Y, ZHANG L M, QI S, et al.Preliminary study on the correlation between IL-6, IL-33, and IL-10 and periodontitis and rheumatoid arthritis[J].Shanghai Journal of Stomatology, 2021, 30(5):498-503.
[22] SCHWARZ U S, ERDMANN T, BISCHOFS I B.Focal adhesions as mechanosensors:The two-spring model[J].Biosystems, 2006, 83(2-3):225-232.
[23] CHONG K W, CHANALARIS A, BURLEIGH A, et al.Fibroblast growth factor 2 drives changes in gene expression following injury to murine cartilage in vitro and in vivo[J].Arthritis &Rheumatism, 2013, 65(9):2346-2355.
[24] COUTTS R D, SAH R L, AMIEL D.Effects of growth factors on cartilage repair[J].Instructional Course Lectures, 1997, 46:487-494.
[25] HANDORF A M, LI W J.Fibroblast growth factor-2 primes human mesenchymal stem cells for enhanced chondrogenesis[J].PLoS One, 2011, 6(7):e22887.
[26] KIM S H, TURNBULL J, GUIMOND S.Extracellular matrix and cell signalling:The dynamic cooperation of integrin, proteoglycan and growth factor receptor[J].Journal of Endocrinology, 2011, 209(2):139-151.
[27] 梁功强, 李富林, 程锦文, 等.膝关节炎患者关节腔药物注射方案标准化现状及评价[J].中国标准化, 2023(6):224-228.
LIANG G Q, LI F L, CHENG J W, et al.Current situation and evaluation of standardization of intra-articular drug injection scheme for patients with knee osteoarthritis[J].China Standardization, 2023(6):224-228.
[28] VARGHESE S, THEPRUNGSIRIKUL P, SAHANI S, et al.Glucosamine modulates chondrocyte proliferation, matrix synthesis, and gene expression[J].Osteoarthritis and Cartilage, 2007, 15(1):59-68.
[29] UITTERLINDEN E J, KOEVOET J L M, VERKOELEN C F, et al.Glucosamine increases hyaluronic acid production in human osteoarthritic synovium explants[J].BMC Musculoskeletal Disorders, 2008, 9:120.