肥胖、糖尿病、高血压、不规律的生活方式等因素会减缓血液流向心脏、大脑和周围组织的过程,导致心脏供应不足,增加罹患心力衰竭、心律失常、冠心病等心血管疾病的可能[1]。研究表明,心血管疾病的发病率和死亡率每年都在增加。据2019年《全球心血管疾病和危险因素负担》研究显示,约5.23亿人患有心血管疾病,是1990年的两倍,其中约1 860万人死于心血管疾病[2-3]。临床上治疗心血管疾病最常用的药物为化学合成类,如抗血脂类药阿托伐他汀、降血压类药硝苯地平、β受体阻断剂美托洛尔、抗血小板类药阿司匹林、抗心律失常类的胺碘酮等[4]。尽管这些药物可以控制和减缓病情,但发现这些化学药物会引起咳嗽、下肢水肿、味觉紊乱、血钾水平升高、过敏反应、低血压等不良反应[5-6]。因此,寻找安全有效且无明显毒副作用的药物已成为必然趋势。近些年,植物和动物蛋白中的抗氧化剂,越来越成为治疗心血管疾病药物替代品的研究热潮。
江珧[Pinna (Atrina) pectinate]俗称“大海红、油螺、玉珧、带子螺、牛耳螺”,隶属于软体动物门(Mollusc)、双壳纲(Lamellibranchia)、贻贝目(Mytiloida)、江珧科(Pinnidae)、江珧属(Atrina),是一种大型底栖双壳贝类,主要在热带和亚热带地区快速繁殖[7-8]。其体内富含蛋白、多元醇、牛磺酸、多糖等生物活性物质,具有去积滞、缩小便等药用功效,又因其价格低廉、肉质鲜美、经济价值高而深受消费者青睐[9]。目前,国内外对于江珧的研究主要集中在分子生物学、形态学[10]、繁殖生物学[11-12]、群体遗传学[13]和生殖调控[14],以及少量的活性研究如抗氧化活性[15-16]、抗菌活性[17]等,然而对江珧柱生物活性的直接研究较少,目前尚未见报道。因此,本文以江珧柱为研究对象,采用现代酶解技术对江珧柱蛋白进行酶解,并优化其酶解工艺,通过超滤、柱色谱等现代分离技术对酶解产物进行分离纯化,用N端测序法鉴定酶解肽的氨基酸序列,并对纯肽体外抗氧化活性进行评价,总结江珧柱酶解肽氨基酸序列和抗氧化活性之间的关系;随后研究江珧柱抗氧化肽对H2O2诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)氧化损伤的保护作用,为江珧柱抗氧化肽在血管内皮细胞保护方面的应用提供理论依据,为江珧柱高附加值产品的开发提供数据支撑,为食源性抗氧化保健品及相关医药产品的研发提供新的原材料来源。
1 材料与方法
1.1 实验材料
江珧柱,购自于海头国际水产城水产品批发市场(江苏省连云港市),由浙江海洋大学海洋生物形态与分类学专家赵盛龙教授鉴定为江珧科动物栉江珧的后闭壳肌。
1.2 实验试剂
胃蛋白酶(pH 2.0、37.5 ℃、200.0 U/mg),上海晶纯生化科技股份有限公司;碱性蛋白酶(pH 8.0、50.0 ℃、160.0 U/mg)、中性蛋白酶(pH 7.0、50.0 ℃、50.0 U/mg),上海瑞昂生物科技有限公司;胰蛋白酶(pH 7.0、37.0 ℃、300.0 U/mg)、木瓜蛋白酶(pH 7.0、50.0 ℃、500.0 U/mg),美国Gibco公司;DPPH、色谱甲醇,美国Sigma公司;三羟甲基氨基甲烷(Tris)、阴离子交换柱(Q-sepharose fast flow,QFF)填料,南京建成生物工程研究所;谷胱甘肽(glutathione,GSH),北京索莱宝科技有限公司;Gly-Gly-Tyr-Arg四肽标准品、双缩脲试剂、纤维素透析袋,上海源叶生物科技有限公司;硫酸铵,百灵威科技有限公司。
1.3 实验仪器
UV-1100紫外分光光度计,上海精科仪器有限公司;N-1100旋转蒸发仪,上海沪西分析仪器厂有限公司;MK3酶标仪,赛默飞世尔科技有限公司;WTM-1812G膜分离机,杭州沃腾膜工程有限公司;BSA224分析天平,北京奥多利斯科学仪器有限责任公司;LGJ-10D冷冻干燥机,北京四环科学仪器厂;DF-101S电热搅拌水浴锅,上海芜强仪器设备有限公司;JJ-02高速粉碎机,江苏常州华国电器有限公司;Agilent-1260高效液相色谱仪,美国安捷伦科技公司。
1.4 实验方法
1.4.1 江珧柱样品预处理
首先,用自来水清洗新鲜的江珧柱至干净,之后在25 ℃条件下低温干燥48 h。随后,使用中药粉碎机粉碎并过60目筛,按照1∶5(m∶v)的比例加入乙酸乙酯,搅拌48 h后抽滤去除乙酸乙酯(重复3次),脱脂完毕后,将滤渣放置在通风处自然晾干,备用。
1.4.2 最佳酶解条件筛选
参考文献[18]方法优化后进行实验,称取1.0 g上述备用江珧柱粉末,并将其加入到20.0 mL超纯水中进行蛋白质提取。经饱和硫酸铵溶液盐析、半透膜透析除盐后按照底物为3.0%(质量分数)分别添加不同种类蛋白酶进行酶促水解反应,待反应结束后,水浴加热至100.0 ℃灭酶10 min,灭酶后冷却至室温,然后以10 000 r/min的转速离心5.0 min,收集上清液。以蛋白质水解度和DPPH自由基清除率为筛选指标,获取最佳江瑶柱蛋白水解酶。
筛选出最佳水解蛋白酶后进行单因素试验,以DPPH自由基清除率为评价指标,分别调节不同料液比(1∶10、1∶20、1∶30、1∶40、1∶50),不同加酶量(1.0%、2.0%、3.0%、4.0%、5.0%),不同酶解时间(1.0、2.0、3.0、4.0、5.0 h),测试3个因素的变化所得的酶解产物对DPPH自由基清除活性的影响,根据最佳DPPH自由基清除率,筛选出最优酶解工艺。
1.4.3 抗氧化能力的测定
DPPH自由基清除率的测定:实验分为空白组(Ac)、样品组(As)、对照组(Ab)。取250 μL的DPPH乙醇溶液(质量分数为0.02%)、1.0 mL的无水乙醇、1.0 mL的实验样品,混匀后置于暗室中反应30.0 min,在517.0 nm处检测各组吸光度。空白组:用1.0 mL的超纯水代替1.0 mL实验样品;对照组:用1.0 mL无水乙醇代替1.0 mL实验样品。DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
超氧阴离子自由基(·O2-)清除率的测定:实验分为空白组(Ac)、样品组(As)。取1.0 mL硝基四唑氯化蓝(浓度为2.52 mmol/L)、1.0 mL NADH(浓度为624 mmol/L)、1.0 mL吩嗪硫酸甲酯混合均匀,随后置于25 ℃暗室中反应6.0 min,在560 nm处检测各组吸光度。·O2-清除率的计算如公式(2)所示:
·O2-清除率![]()
(2)
ABTS阳离子自由基清除率的测定:实验分为空白组(Ac)、样品组(As)。首先,将ABTS与2.45 mmol/L K2S2O8发生缓慢的氧化反应,生成ABTS阳离子自由基,然后,用PBS溶液将混合物调整至吸光度(734 nm)稳定在0.70±0.2备用。空白组:用1.0 mL的超纯水代替样品与1.0 mL的ABTS溶液混合,振荡10.0 min进行反应。样品组:将1.0 mL的ABTS溶液与1.0 mL样品进行混合,剧烈振荡10.0 min进行反应。ABTS阳离子自由基清除率的计算如公式(3)所示:
ABTS阳离子自由基清除率![]()
(3)
1.4.4 水解度的测定
参考文献[19]结合适当的修正,用甲醛滴定法测定水解度,计算如公式(4)所示:
水解度![]()
(4)
式中:V1,待测样品消耗的NaOH体积,mL;V0,纯水消耗的NaOH体积,mL;14,氮的摩尔质量,g/mol;C,NaOH溶液的浓度,mol/L。
1.4.5 三氯乙酸(trichloroacetic acid,TCA)法测定肽得率
用质量分数为5%的TCA依次配制0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mg/mL的Gly-Gly-Tyr-Arg四肽标准溶液,然后分别取6.0 mL标准溶液,加入4.0 mL双缩脲试剂,混合均匀后静置10 min,随后2 000 r/min离心10 min,取上清液于540 nm下测定OD值,并制作标准曲线。取2.5 mL样品溶液,加入等体积100 g/L的TCA溶液,混匀,静置10 min,在4 000 r/min下离心15 min,用5% TCA将上清液定容至50 mL,摇匀。然后取6.0 mL上述溶液,加入双缩脲试剂4.0 mL混合均匀,静置10 min,2 000 r/min离心10 min,取上清液于540 nm下测定OD值,对照标准曲线求得样品溶液中的多肽浓度C(mg/mL),并计算多肽得率。
1.5 江珧柱抗氧化肽的分离纯化
1.5.1 超滤
启动膜超滤装置,设定频率与压力,用弱碱和超纯去离子水对超滤膜进行清洗。选用不同分子质量(1.0、3.0、5.0、10.0 kDa)超滤膜对江珧柱酶解液进行超滤,得到5组分酶解物AP-Ⅰ(<1.0 kDa)、AP-Ⅱ(1.0~3.0 kDa)、AP-Ⅲ(3.0~5.0 kDa)、AP-Ⅳ(5.0~10.0 kDa)、AP-Ⅴ(>10.0 kDa)。分别收集5个组分,配成3.0 mg/mL的溶液,测定其自由基清除能力,筛选出活性最好的组分冻干,以备后续分离纯化。
1.5.2 Q强阴离子交换快速流层析柱(Q sepharose fast flow,QFF)离子交换层析
选取上述超滤后活性结果最好的组分AP-Ⅰ(Mw<1 kDa),以去离子水为溶剂将其制备成质量浓度为80.0 mg/mL,体积为5.0 mL的溶液,该溶液经0.22 μm滤膜过滤去除不溶性的杂质,于QFF阴离子柱上上样。以Tris-HCl缓冲液(0~0.5 mol/L NaCl)逐级洗脱,每管以恒定流速收集8.0 mL,在214.0 nm紫外波长下检测吸光度并收集洗脱峰,将处于同一吸收峰内的洗脱液合并,凝胶柱除盐、旋蒸浓缩、超低温冷冻干燥后,用纯水配成3.0 mg/mL的溶液,测定其自由基清除能力。
1.5.3 高效液相色谱纯化、制备
收集上步所得自由基清除活性最好的组分AP-Ⅰ-2,冻干,将其溶于超纯水配成10.0 mg/mL体积为1.0 mL的溶液,并过0.22 μmol/L微孔滤膜后,吸取10 μL溶液加载到高效液相Zorbax 300SB-C18(4.6 mm×250 mm)柱上进行分离。洗脱液A液0.05% TFA的超纯水,B液为0.05% TFA的甲醇,流速设定为0.8 mL/min,分离过程采用梯度洗脱法,依次设置时间及对应的B液百分比为:0~2 min,2% B;2~4 min,2%~30% B;4~27 min,30%~60% B;27~30 min,0%~100% B;30~35 min,100% B。最终在214 nm处测吸光强度,并分别收集各峰洗脱液,冷冻干燥处理。
采用Edman降解法检测其N端序列,使用美国Applied Biosystems 494蛋白质测序仪(Perkin Elmer/Applied biosystemsInc.)进行N端氨基酸序列的分析。为确保所制备的抗氧化肽可供使用,委托上海波泰生物科技有限公司,使用日本岛津PSSM-8型多肽自动合成仪合成纯度为95%以上的目的肽。最后,结合四极杆飞行时间质谱仪(Quadrupole-time of flight mass spectrometer,Q-TOF)与电喷雾电离(electrospray ionization,ESI)源,准确测定酶解肽的分子质量,确定其正确结构。
1.6 氧化损伤模型的建立
人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)保存于-80 ℃超低温冰箱。冷冻管从冰箱中取出后,立即置于37 ℃恒温水浴锅中解冻。等待冻存管内无冰渣后,在无菌条件下打开冻存管,并制备细胞混悬液,将混悬液置于细胞培养箱中培养。当细胞处于单层融合状态时,使用1.0 mL PBS洗去残留培养基。随后,使用胰蛋白酶对细胞进行消化,制备细胞混悬液。按照1∶2的比例将细胞混悬液置于细胞培养瓶中进行培养。选择细胞代数为3~20代且生长状态良好的HUVEC细胞,密度为0.7×104个/孔,每孔体积为180 μL。将细胞接种于96孔板上,并在37 ℃、CO2浓度为5%条件下孵育24.0 h。完成以上步骤后,细胞可做进一步实验处理。
空白组不做任何处理,在其余各组中,加入不同浓度(100~600 μmol/L)的双氧水与HUVEC细胞共同孵育4.0 h,每组设有6个平行实验。细胞与双氧水共同培养4.0 h后,将96孔板倒置放置在显微镜下观察细胞形态,并拍照。随后利用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐比色法(3-(4,5)-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide assay,MTT法)方法计算细胞存活率,以确定最终的造模浓度。
1.7 江珧柱活性肽对H2O2诱导损伤HUVEC细胞的保护作用
使用完全培养基对细胞进行培养,并在模型组中加入400.0 μmol/L H2O2处理4.0 h,模拟细胞损伤。实验组中分别加入20.0 μL样品肽JY1~JY5使其终浓度为300.0 μmol/L,以评估其对细胞保护作用的影响。阳性对照,使用终浓度为300.0 μmol/L的GSH,每组设置6个复孔。实验过程中,在培养细胞24 h后加入400 μmol/L的H2O2进行4 h的处理。使用MTT法,评估细胞存活率,以确定不同多肽对H2O2诱导损伤的保护作用。细胞存活率的计算如公式(5)所示:
细胞存活率![]()
(5)
1.8 数据处理
每组实验均采用3次平行实验(n=3),实验结果采用平均值±标准偏差的方式表示,用Origin 19进行作图,并采用SPSS 22.0软件包中one-way ANOVA单因素方差检验进行统计学分析,采用Duncan多重范围检验法进行差异分析,显著性水平设定为P<0.05表示差异性显著,P<0.01表示差异性非常显著,P<0.001表示差异性极显著。
2 结果与分析
2.1 最佳蛋白酶筛选
将酶解物配成质量浓度为1.0 mg/mL的样品液,分别用胃蛋白酶、中性蛋白酶、胰蛋白酶、碱性蛋白酶和木瓜蛋白酶进行酶解,测定并比较5种酶解物对DPPH自由基清除率影响的大小。结果如图1-a所示,当质量浓度为3.0 mg/mL时,DPPH自由基清除率强弱依次为:木瓜蛋白酶(48.90±1.09)%>胃蛋白酶(32.20±1.41)%>胰蛋白酶(30.83±1.43)%>中性蛋白酶(27.13±1.23)%>碱性蛋白酶(22.19±1.85)%。与其他酶的酶解产物相比,木瓜蛋白酶酶解产物对DPPH自由基的清除率最高(P<0.05)。从图1-b可知,与其他4种蛋白酶酶解产物相比,木瓜蛋白酶水解物表现出最高的水解度,为(21.89±0.69)%(P<0.05)。由于不同蛋白酶结构不同、活性不同、酶解位点的不同,致使其水解程度和水解产物有极大差异,进而导致多肽的种类、片段和产率有明显不同。本实验发现,当以木瓜蛋白酶酶解江珧柱蛋白时,其酶解产物对DPPH自由基清除率最高,总蛋白水解度最高,此条件下酶解产物中多肽得率为820 mg/g(表1)。综上可得,木瓜蛋白酶为江珧柱蛋白最适水解蛋白酶,选择其进行后续酶解工艺优化。
表1 不同蛋白酶水解后肽得率
Table 1 Different enzyme species on the yield of polypeptides

酶种肽得率/(mg/g)胃蛋白酶602中性蛋白酶430木瓜蛋白酶820胰蛋白酶552碱性蛋白酶514
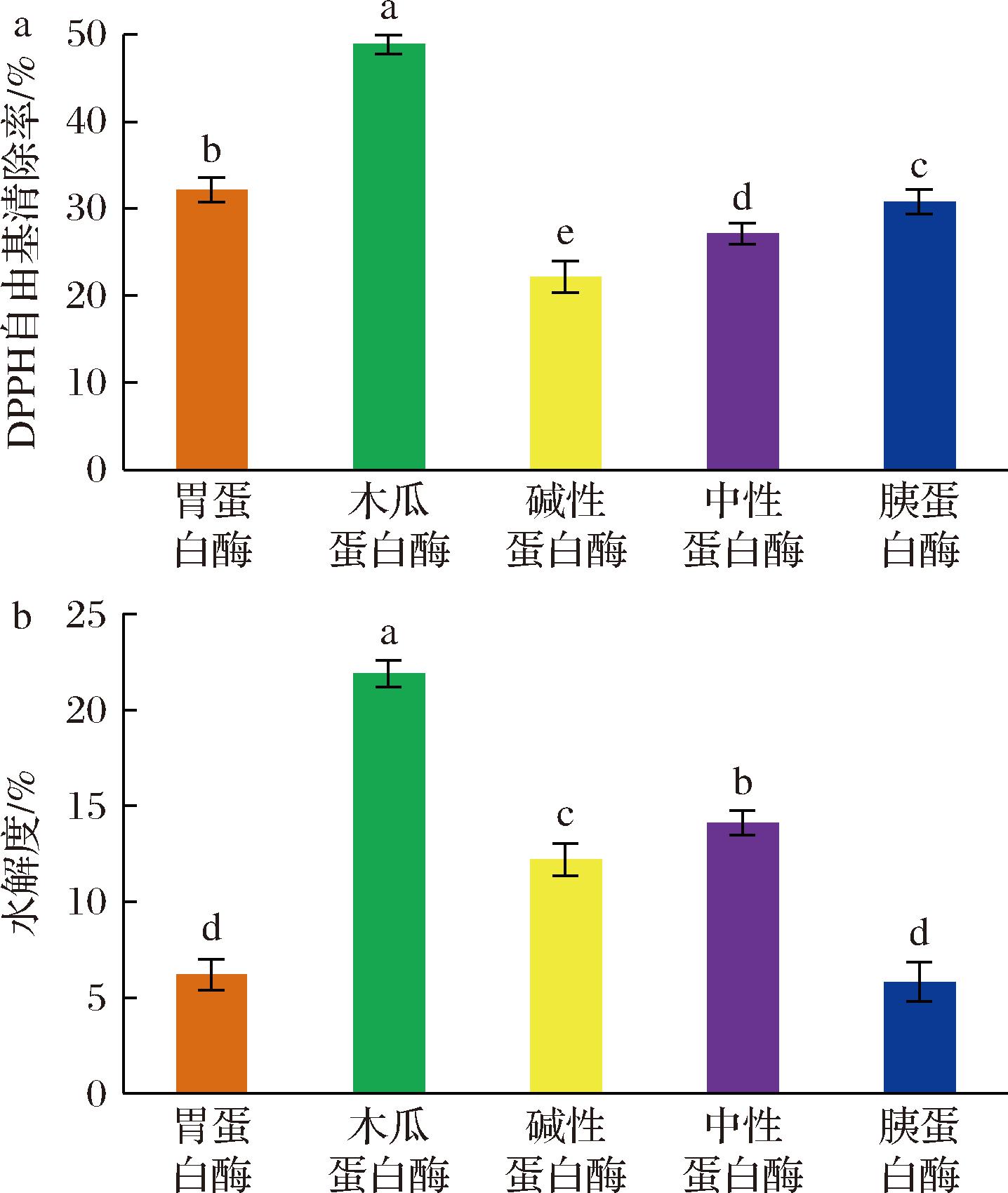
a-不同蛋白酶酶解产物对DPPH自由基清除率的影响;b-不同蛋白酶酶解产物对水解度的不同
图1 不同蛋白酶酶解产物对DPPH自由基清除率的影响和对水解度的不同
Fig.1 Effects of five kinds of protease hydrolysates on the DPPH free radical rate and the degree of hydrolysis of the protein from P.(A.) pectinate
注:不同字母表示有显著性差异(P<0.05)(下同)。
2.2 最佳酶解条件优化
采用单因素试验,检测木瓜蛋白酶的料液比、酶解时间、加酶量对酶解产物DPPH自由基清除率的影响,结果如图2所示。
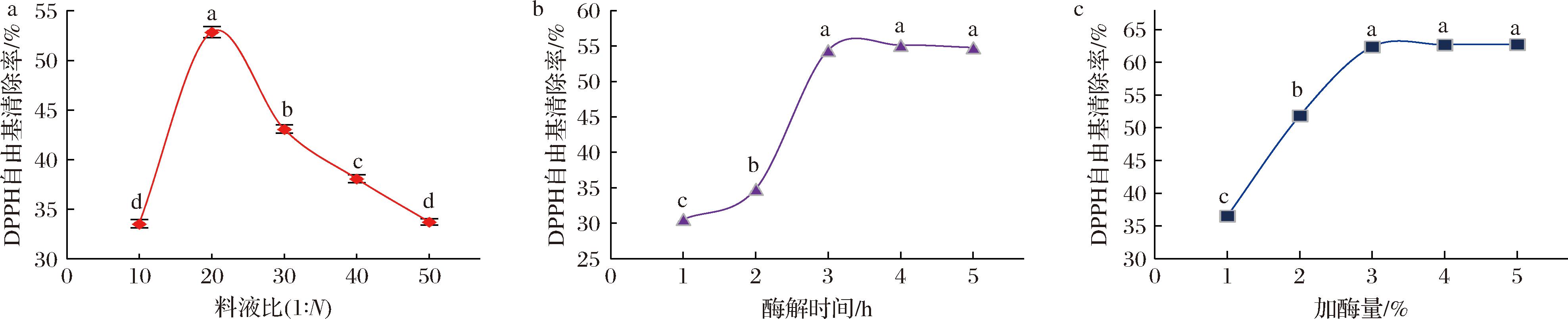
a-料液比;b-酶解时间;c-加酶量
图2 DPPH自由基清除率随料液比、酶解时间、加酶量的变化
Fig.2 The scavenging rate of DPPH radical varied with feed-liquid ratio, enzymolysis time and enzyme dosage
如图2-a所示,料液比为1∶20时,DPPH自由基清除率最高,为(52.85±0.56)% (P<0.05),在1∶10~1∶20区间,随着溶剂的增多酶解产物自由基清除率显著增大;当料液比<1∶20时,DPPH自由基清除率逐渐降低。分析其原因,不同料液比时酶解产物产生明显的活性变化,可能是由于在1∶10~1∶20区间随着溶剂量的增加,底物浓度被稀释,活动空间增大,与酶的接触表面积暴露更充分,因此酶解更彻底,从而酶解出更多活性肽,提高自由基清除率;然而,随着溶剂持续增多至过量,降低了酶浓度及酶与底物接触的概率,导致酶解不够充分,活性肽未被释放,以致自由基清除活性降低。因此,木瓜蛋白酶最适料液比为1∶20。
木瓜蛋白酶不同酶解时间所得酶解产物对DPPH自由基清除率的影响,由图2-b可知,在1.0~3.0 h时,随着酶解时间延长,酶解反应更为充分,酶解产物的DPPH自由基清除率逐渐升高,与时间呈正相关,3.0 h时DPPH自由基清除率最高,为(54.38±0.62)%,显著高于酶解时间1.0 h时的(30.55±0.62)%和2.0 h时的(34.85±0.86)%的清除率(P<0.05)。然而,3.0 h后,当酶解时间持续增加,酶解产物的DPPH自由基清除率基本没有明显变化(P>0.05),分别为4.0 h(55.09±0.90)%和5.0 h(54.75±0.71)%。原因在于酶解反应的早期阶段,由于反应时间有限,酶与底物的充分接触还未完全实现,从而导致反应的程度不够充分。随着反应时间的增加,酶和底物之间的结合更加充分,从而导致水解程度的提高,酶解更充分,提高了自由基清除活性;随着酶解时间的延长,酶促反应逐渐达到终点,水解产物的生成趋于稳定,而对DPPH自由基的清除活性基本保持不变。因此,木瓜蛋白酶酶解江珧柱蛋白的最适酶解时间为3.0 h。
由图2-c可知,在不同加酶量(1.0%、2.0%、3.0%、4.0%、5.0%)条件下进行酶解,酶解产物对DPPH自由基清除率有明显影响。当加酶量小于3.0%时,随着加酶量的增加,底物的酶解愈发完全,酶解反应更加充分,同时,酶解产物对DPPH自由基的清除率与加酶量呈现出正相关的趋势。当加酶量达到3.0%时,底物开始逐渐饱和,酶解过程也趋于彻底。因此,酶解产物的DPPH自由基清除率达到最高值,为(62.38±0.82)%。这一结果明显优于加酶量为1.0%[(36.55±1.21)%]和2.0%[(51.85±1.16)%]时的清除率(P<0.05)。随后,清除率趋于稳定,并与加酶量为4.0%[(62.69±0.70)%]和5.0%[(62.75±0.91)%]时没有显著差异(P>0.05),说明酶解过程已经彻底完成,无明显变化。因此,木瓜蛋白酶酶解江珧柱蛋白的最适加酶量为3.0%。
2.3 江珧柱活性肽的分离纯化
超滤是一种利用膜内外压差作为动力,对具有不同分子质量的多肽样品进行分离纯化的一种膜技术。使用木瓜蛋白酶最佳酶解条件对江珧柱蛋白进行酶解,得到酶解产物后进行超滤,从而得到了5个组分:AP-Ⅰ(<1 kDa)、AP-Ⅱ(1 k~3 kDa)、AP-Ⅲ(3 k~5 kDa)、AP-Ⅳ(5 k~10 kDa)、AP-Ⅴ(>10 kDa)。随后,对这些组分进行浓缩、冻干。为进一步评估其抗氧化活性,冻干后的样品与原液分别配制成3.0 mg/mL的溶液,并通过0.22 μm滤膜过滤,以DPPH自由基清除率作为指标,对超滤后的5个组分进行体外抗氧化活性评价。
如图3所示,与原液相比,江珧柱木瓜蛋白酶酶解产物中的组分AP-I表现出最佳的DPPH自由基清除活性,达到(78.15±1.26)%,显著高于AP-Ⅱ[(42.21±1.78)%]、AP-Ⅲ[(52.19±1.19)%]、AP-Ⅳ[(48.79±1.84)%]和AP-Ⅴ[(39.88±1.44)%](P<0.05)。这表明,分子质量低于1.0 kDa的组分具有最优的抗氧化活性,选择AP-Ⅰ组分作为进一步分离纯化的目标。
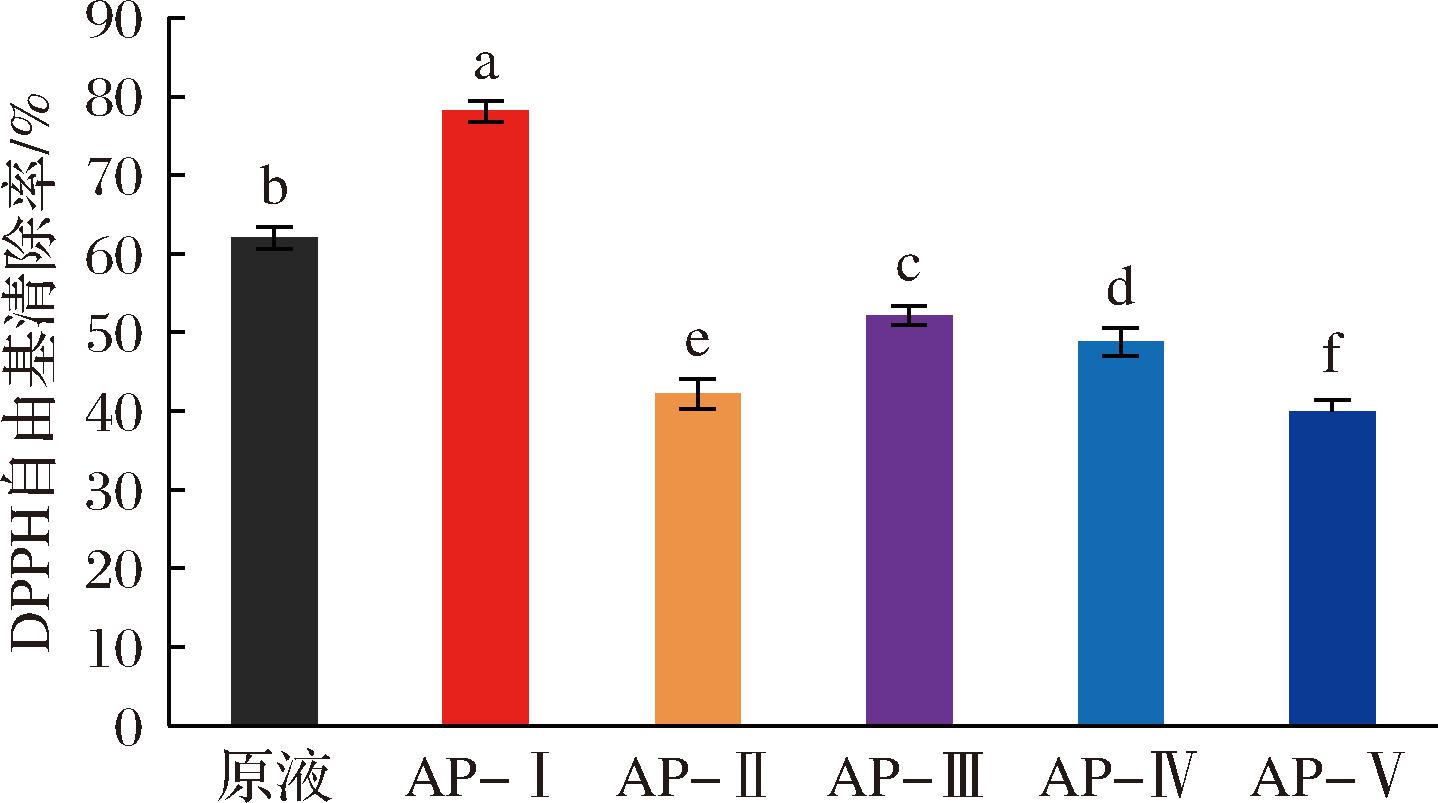
图3 超滤后各组分对DPPH自由基清除率的影响
Fig.3 Effects of ultrafiltration components on DPPH radical scavenging rate
AP-Ⅰ组分通过QFF阴离子柱进行分离,使用不同浓度(0、0.1、0.25、0.5 mol/L)的NaCl溶液进行洗脱。将试管中的溶液按吸光度合并,并进行脱盐处理后冻干,得到AP-Ⅰ-1、AP-Ⅰ-2、AP-Ⅰ-3、AP-Ⅰ-4 4个组分(图4-a)。基于3.0 mg/mL的质量浓度进行DPPH自由基清除活性,结果显示,AP-Ⅰ-2[(88.17±1.84)%]和AP-Ⅰ-3[(81.21±1.23)%]表现出了比AP-I更高的DPPH自由基清除活性(P<0.05)。AP-Ⅰ-1和AP-Ⅰ-4的DPPH自由基清除活性明显低于AP-I(P<0.05),AP-Ⅰ-3的DPPH自由基清除活性与AP-I较为接近,进一步强调了AP-Ⅰ-2在DPPH自由基清除方面的优越性。因此,在后续的纯化实验中,选择具有较高DPPH自由基清除活性的AP-Ⅰ-2进行研究。
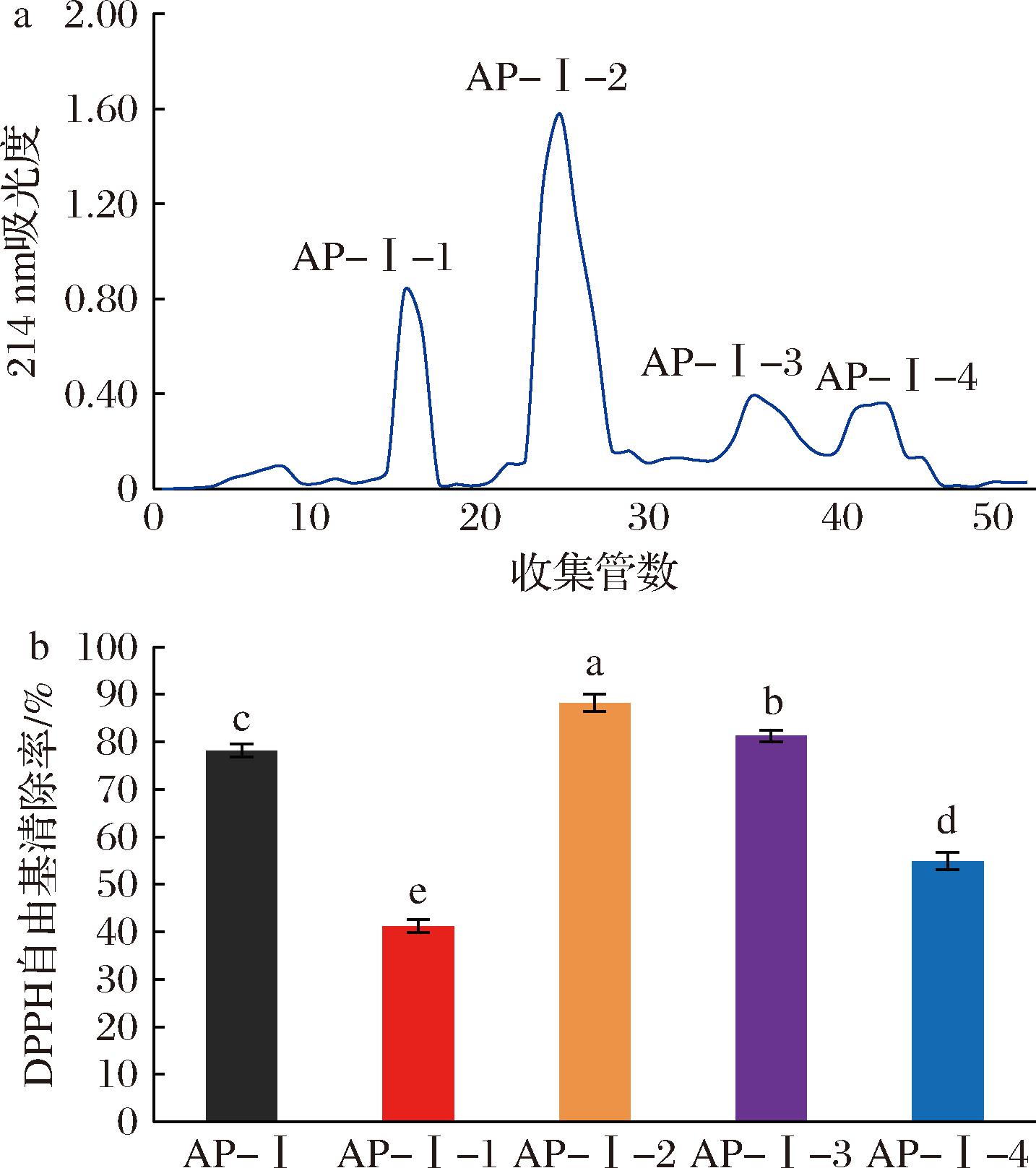
a-QFF阴离子柱层析;b-各组分对DPPH自由基清除率的影响
图4 QFF阴离子柱层析和各组分对DPPH自由基清除率的影响
Fig.4 Effects of QFF anion column chromatography and components on DPPH radical scavenging rate
经高效液相色谱分析,AP-Ⅰ-2被进一步分离,并进行测序和质谱分析,得到了5条多肽。多肽的出峰时间、氨基酸序列、分子质量及化学结构如表2和图5所示。经与NCBI数据库比对,该5条肽均为已知。根据文献调研,JY2显示出良好的抗真菌活性[20],JY3具有抑制肿瘤细胞迁移的能力,可降低Ⅱ型糖尿病的发生和发展[21],JY4则能够通过抑制单胺氧化酶的活性来改善功能认知和记忆衰退,从而减少与衰老和年龄相关疾病的发生[22]。此外,JY5具有显著的降压作用,其降压效果尤其突出[23-24]。本研究将继续对这些肽的抗氧化活性展开研究。
表2 多肽JY1-JY5的出峰时间、氨基酸序列、分子质量及体外抗氧化活性
Table 2 Peak times, sequences, molecular mass and antioxidant activities in vitro of JY1-JY5

样品编号保留时间/tR氨基酸序列分子质量/DaEC50/(mg/mL)DPPH自由基ABTS阳离子自由基·O2-JY115.27Val-Ala-His 325.182.102±0.01e4.215±0.024d3.019±0.021eJY221.32Glu-Pro 244.1112.176±0.024b11.401±0.028b18.255±0.018aJY326.29Ala-Val 188.1217.992±0.017a15.215±0.032a15.215±0.026bJY443.13Trp-Tyr 367.152.981±0.014d5.385±0.027c4.204±0.031dJY543.89Trp-Val 303.168.169±0.016c3.018±0.031e10.223±0.025c阳性对照-GSH 307.320.074±0.002f0.201±0.012f0.123±0.008f
注:不同字母表示有显著性差异(P<0.05)。
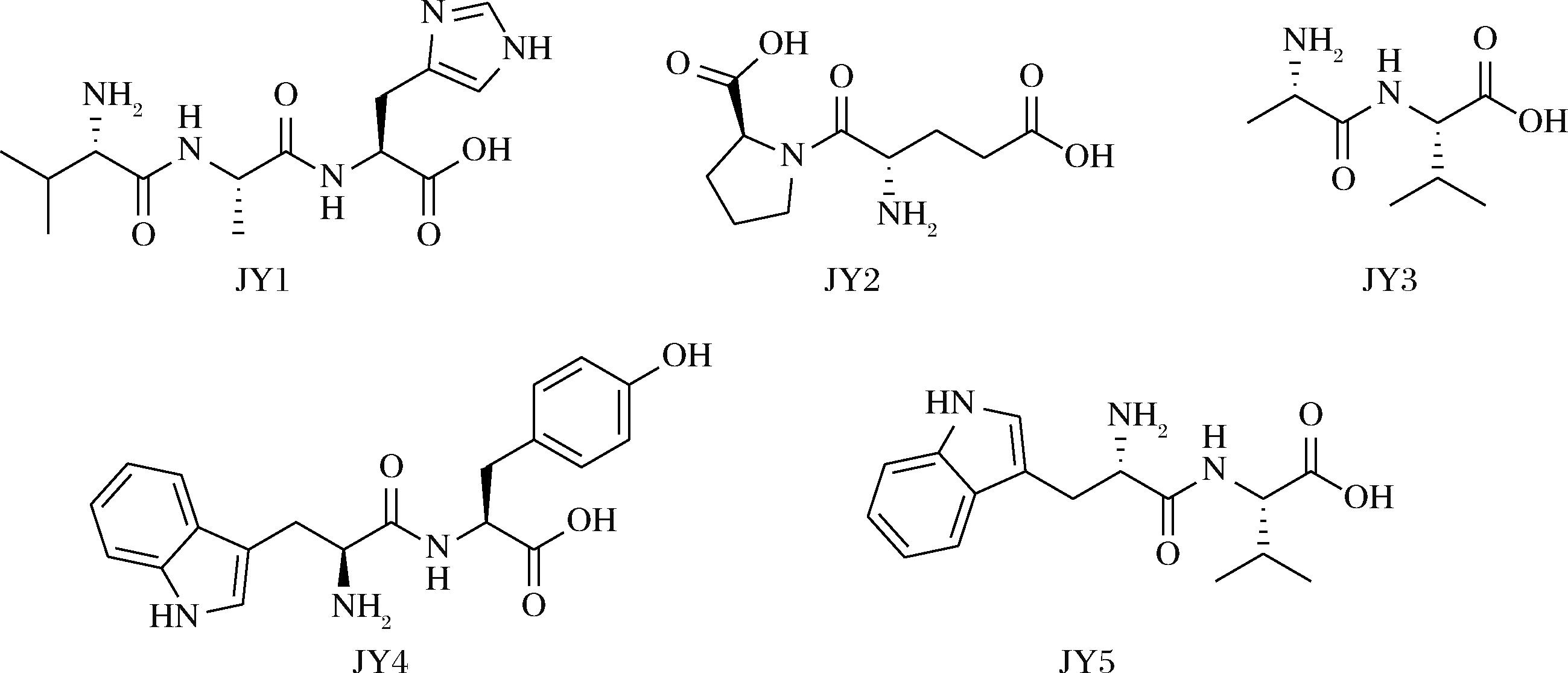
图5 肽JY1-JY5的化学结构
Fig.5 Chemical structures of peptides JY1-JY5
2.4 江珧柱纯化肽的抗氧化活性
在不同浓度下对5种纯肽进行体外抗氧化活性的测定,以评估其在清除自由基方面的能力,EC50值越小,说明其体外抗氧化活性越强。结果如表2所示,JY1、JY4对DPPH自由基、ABTS阳离子自由基、·O2- 3种自由基的清除活性最好,其EC50值分别为2.102±0.01、4.215±0.024、3.019±0.021,2.981±0.014、5.385±0.027、4.204±0.031;JY5对ABTS阳离子自由基的清除活性较好,其EC50值为3.018±0.031,对DPPH自由基、·O2-的清除活性低于JY1、JY4高于JY2、JY3,后两者的抗氧化活性最差。肽的氨基酸组成和顺序对抗氧化活性具有重要影响,例如,肽中含有芳香族氨基酸,如酪氨酸(Tyr)、色氨酸(Trp)、组氨酸(His)和苯丙氨酸(Phe),往往会表现出较强的抗氧化能力[25-27]。这与本研究结果基本一致,JY1中的His、JY4中的Trp-Tyr、JY5中的Trp均为芳香族氨基酸,因此三者的抗氧化活性较高。其中,JY4中的2个氨基酸均为芳香族氨基酸,其活性优于仅有一个芳香族氨基酸Trp的JY5。JY1的综合抗氧化活性最佳,可能与His位于C-末端有关,这与CHEN等[28]发现的去除源自大豆蛋白的抗氧化多肽C-末端的一个His则抗氧化活性消失的结论相吻合。
2.5 江珧柱抗氧化肽对H2O2诱导的HUVEC细胞氧化损伤的保护作用
当H2O2作用于HUVEC细胞时,氧化和抗氧化平衡会被破坏,导致细胞发生氧化应激,进而可能诱发心血管相关疾病的发生。通过实验观察到正常细胞在显微镜下呈长梭形,形态饱满,轮廓清晰,整体细胞大小均匀;100~200 μmol/L之间随着H2O2添加浓度的增加,细胞形态逐渐皱缩变圆、细胞间隙变大;300 μmol/L后开始出现明显的细胞聚集甚至破裂脱落,细胞数量出现减少;400~600 μmol/L随着浓度的增加,细胞形态变化明显、大量细胞破裂凋亡、间隙变大很多、细胞碎片增多(图6-a)。量化分析后,选择H2O2浓度为400 μmol/L,作用时间4 h,该条件下,HUVEC细胞的存活率为(51.04±1.54)%,符合氧化应激模型的需求(图6-b)。

a-不同浓度H2O2对HUVEC细胞形态的影响;b-不同浓度H2O2对HUVEC细胞存活率的影响;c-JY1-JY5对氧化损伤HUVEC细胞的保护作用
图6 江珧柱抗氧化肽对H2O2-HUVEC细胞氧化损伤的保护作用
Fig.6 Protective effects of antioxidant peptides from P. pectinata on oxidative damaged H2O2- HUVEC cells
注:###P<0.001,##P<0.01,#P<0.05 vs空白组;***P<0.001,**P<0.01,*P<0.05 vs模型组。
利用MTT法评估肽JY1~JY5对细胞氧化损伤的保护作用。实验结果如图6-c所示,与空白组相比,模型组细胞的存活率显著降低至(51.04±1.54)%(P<0.001),表明模型建立成功。然而,与模型组相比,添加GSH和JY1~JY5后,均能显著提高HUVEC细胞的存活率(P<0.05),说明肽JY1~JY5对H2O2诱导的氧化损伤具有明显的保护效果。其中,JY1和JY4这2种抗氧化肽对HUVEC细胞存活率的提升效果最为显著。相对于模型组的存活率为(51.04±1.54)%,它们能够将存活率提升至(78.10±1.83)%和(76.23±2.63)%(P<0.001)。JY5抗氧化肽的存活率提升能力稍弱,但仍能将存活率提升至(70.52±1.86)%(P<0.01)。然而,JY2和JY3这2种抗氧化肽对HUVEC细胞存活率的提升能力较弱,仅能将存活率分别提升至(56.04±1.54)%和(58.33±3.03)%(P<0.05)。这一结果与前文所述的体外抗氧化活性结果基本一致,说明JY1~JY5这些抗氧化肽通过抗氧化机制对氧化损伤导致的细胞凋亡起到了保护作用,从而减少细胞损伤和凋亡。这一发现对于深入了解抗氧化肽的保护作用以及其在细胞损伤治疗中的应用具有重要的学术意义。
3 结论
本文以江珧柱为原料,以DPPH自由基清除率为指标,筛选出最佳水解酶为木瓜蛋白酶;以单因素试验法,从料液比、酶解时间、加酶量3个因素着手优化酶解工艺,得出木瓜蛋白酶酶解江珧柱的最佳酶解工艺为:37 ℃、pH 8.0、料液比1∶20、酶解时间3.0 h、加酶量3.0%,此条件下所得酶解产物的DPPH自由基清除率为(62.38±0.82)%。
酶解液经过超滤、柱层析、反相高效液相色谱(reversed phase high-performance liquid chromatography, RP-HPLC)等一系列分离纯化技术制备出5条抗氧化寡肽:Val-Ala-His(JY1,325.18 Da)、Glu-Pro(JY2,244.11 Da)、Ala-Val(JY3,188.12 Da)、Trp-Tyr(JY4,367.15 Da)、Trp-Val(JY5,303.16 Da)。其中,JY1、JY4的抗氧化活性最高,进一步研究发现二者可将H2O2诱导损伤的HUVEC细胞存活率显著提升至(78.10±1.83)%、(76.23±2.63)%。说明JY1、JY4可通过抗氧化机制对氧化损伤导致的细胞凋亡起到保护作用,减少细胞损伤和凋亡,为进一步研究其机制及应用提供了有益的参考。本研究可为江珧柱蛋白酶解肽抗氧化活性及抗氧化功能产品的开发提供理论依据。
[1] COSTANTINO S, PANENI F, COSENTINO F.Ageing, metabolism and cardiovascular disease[J].The Journal of Physiology, 2016, 594(8):2061-2073.
[2] 杨飞, 肖纯.高血压肥胖者血浆促动脉硬化指数与心血管疾病风险的相关性研究[J].河北医科大学学报, 2020, 41(2):138-141.
YANG F, XIAO C.Correlation between plasma arteriosclerosis index and cardiovascular disease risk in obese patients with hypertension[J].Journal of Hebei Medical University, 2020, 41(2):138-141.
[3] SIRI-TARINO P W, KRAUSS R M.Diet, lipids, and cardiovascular disease[J].Current Opinion in Lipidology, 2016, 27(4):323-328.
[4] 徐伟豪. 他汀类药物依从性对心血管疾病患者远期预后影响的系列研究[D].北京:中国人民解放军医学院, 2016.
XU W H.The study of impact of statin adherence on long-termprognosis of patients with cardiovascular disease[D].Beijing:People’s Liberation Army School of Medicine, 2016.
[5] MEYER P W, ANDERSON R, KER J A, et al.Rheumatoid arthritis and risk of cardiovascular disease[J].Cardiovascular Journal of Africa, 2018, 29(5):317-321.
[6] WORO J, SIWEK M, GOROSTOWICZ A.Adverse effects of interactions between antidepressants and medications used in treatment of cardiovascular disorders[J].Psychiatria Polska, 2019, 53(5):977-995.
J, SIWEK M, GOROSTOWICZ A.Adverse effects of interactions between antidepressants and medications used in treatment of cardiovascular disorders[J].Psychiatria Polska, 2019, 53(5):977-995.
[7] 王晓娜. 栉江珧与旗江珧贝壳中黑色素的提取研究[D].烟台:烟台大学, 2017.
WANG X N.Study of the melanin extraction from the shells of Atrina pectinate and Atrina vexillum[D].Yantai:Yantai University, 2017.
[8] AN H S, KIM B H, LEE J W, et al.Comparison between wild and hatchery populations of Korean pen shell (Atrina pectinata) using microsatellite DNA markers[J].International Journal of Molecular Sciences, 2011, 12(9):6024-6039.
[9] 陈桢. 栉江珧(Atrina pectinata)、魁蚶(Scapharca broughtonii)不同群体的遗传多样性研究[D].青岛:中国海洋大学, 2011.
CHEN Z.Study of genetic diversity in pen shell (Atrina pectinata) and ark shell (Scapharca broughtonii)[D].Qingdao:Ocean University of China, 2011.
[10] LIU J, LI Q, KONG L F, et al.Cryptic diversity in the pen shell Atrina pectinata (Bivalvia:Pinnidae):High divergence and hybridization revealed by molecular and morphological data[J].Molecular Ecology, 2011, 20(20):4332-4345.
[11] SHIMIZU K, KINTSU H, AWAJI M, et al.Evolution of biomineralization genes in the prismatic layer of the pen shell Atrina pectinata[J].Journal of Molecular Evolution, 2020, 88(10):742-758.
[12] NING Y F, LI Z B, SHANGGUAN J B, et al.Development and characterization of microsatellite markers for molecular genetic diversity in Atrina pectinata[J].Genetics and Molecular Research, 2015, 14(3):8290-8293.
[13] XUE D X, WANG H Y, ZHANG T, et al.Population genetic structure and demographic history of Atrina pectinata based on mitochondrial DNA and microsatellite markers[J].PLoS One, 2014, 9(5):e95436.
[14] FUNAYAMA S, MATSUMOTO T, KODERA Y, et al.A novel peptide identified from visceral Ganglia induces oocyte maturation, spermatozoa active motility, and spawning in the pen shell Atrina pectinata[J].Biochemical and Biophysical Research Communications, 2022, 598:9-14.
[15] KIM Y S, KIM E K, DONG X, et al.Antioxidant and protective effects of Atrina pectinata extract[J].Advances in Experimental Medicine and Biology, 2019, 1155:627-641.
[16] LEE H J, ROY V C, HO T C, et al.Amino acid profiles and biopotentiality of hydrolysates obtained from comb penshell (Atrina pectinata) viscera using subcritical water hydrolysis[J].Marine Drugs, 2021, 19(3):137.
[17] HONG S Y, KIM D G, KIM Y O, et al.Purification and cDNA cloning of the antimicrobial peptide apMolluscidin from the pen shell, Atrina pectinata[J].Fish &Shellfish Immunology, 2018, 81:408-415.
[18] 包斐, 孙丽霞, 孙建华, 等.长蛇鲻鱼蛋白水解制备抗氧化肽工艺研究[J].食品科技, 2019, 44(8):241-247.
BAO F, SUN L X, SUN J H, et al.Optimization of technology conditions for antioxidant peptides from protein hydrolysates of lizard fish[J].Food Science and Technology, 2019, 44(8):241-247.
[19] RAO P S, BAJAJ R, MANN B.Impact of sequential enzymatic hydrolysis on antioxidant activity and peptide profile of casein hydrolysate[J].Journal of Food Science and Technology, 2020, 57(12):4562-4575.
[20] ACOSTA-SERRANO A, COLE R N, MEHLERT A, et al.The procyclin repertoire of Trypanosoma brucei.Identification and structural characterization of the Glu-Pro-rich polypeptides[J].Journal of Biological Chemistry, 1999, 274(42):29763-29771.
[21] ERDOGAN H, BABUR E, YILMAZ M, et al.Morphological versatility in the self-assembly of Val-Ala and Ala-Val dipeptides[J].Langmuir, 2015, 31(26):7337-7345.
[22] ZAVADSKIY S, SOLOGOVA S, MOLDOGAZIEVA N.Oxidative distress in aging and age-related diseases:Spatiotemporal dysregulation of protein oxidation and degradation[J].Biochimie, 2022, 195:114-134.
[23] LIN Y H, CHEN G W, YEH C H, et al.Purification and identification of angiotensin I-converting enzyme inhibitory peptides and the antihypertensive effect of Chlorella sorokiniana protein hydrolysates[J].Nutrients, 2018, 10(10):1397.
[24] NONGONIERMA A B, MOONEY C, SHIELDS D C, et al.Inhibition of dipeptidyl peptidase IV and xanthine oxidase by amino acids and dipeptides[J].Food Chemistry, 2013, 141(1):644-653.
[25] MURASE H, NAGAO A, TERAO J.Antioxidant and emulsifying activity of N-(long-chain-acyl)histidine and N-(long-chain-acyl)carnosine[J].Journal of Agricultural and Food Chemistry, 1993, 41(10):1601-1604.
[26] CHAN K M, DECKER E A.Endogenous skeletal muscle antioxidants[J].Critical Reviews in Food Science and Nutrition, 1994, 34(4):403-426.
[27] OSTDAL H, ANDERSEN H J, DAVIES M J.Formation of long-lived radicals on proteins by radical transfer from heme enzymes:A common process[J].Archives of Biochemistry and Biophysics, 1999, 362(1):105-112.
[28] CHEN H M, MURAMOTO K, YAMAUCHI F, et al.Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein[J].Journal of Agricultural and Food Chemistry, 1996, 44(9):2619-2623.