甘油磷脂是真核细胞中最常见的基于甘油骨架的脂质,其在sn-1和sn-2位置具有2个长链疏水性脂肪酸分子,在sn-3位置具有亲水性基团,使其在本质上具有两亲性。由于这种两亲性特征,甘油磷脂能够产生实现各种生物功能的脂质双分子层。脂质双分子层作为动物细胞膜的结构成分发挥着重要作用[1]。磷脂酰胆碱(phosphatidylcholine, PC)是磷脂的重要种类之一,已被证实具有丰富的生理活性,如改善大脑功能、抗肿瘤、调节糖脂代谢、抗炎等[2]。磷虾中含有2%~6%的脂质,其中磷脂、甘油三酯和游离甾醇是磷虾油中发现的主要脂质类别,分别占39%~40%、20%~31%和16%~22%[3]。与甘油三酯相比,磷脂部分含有更多的ω-3多不饱和脂肪酸(polyunsaturated fatty acid, PUFA),特别是二十碳五烯酸(eicosapentaenoic acid, EPA)和二十二碳六烯酸(docosahexaenoic acid, DHA)[4]。而磷脂形式的EPA和DHA因其广泛的功能活性和药理作用,受到了科研人员、消费者以及功能食品和药品企业越来越多的关注。
磷脂存在于由糖脂、甘油三酯、甾醇和碳水化合物等组成的复杂混合物中,为了从中性脂质中分离磷脂,必须经过脱油过程。磷脂提取方法主要分为使用有机溶液的常规提取方法和非常规的新型提取技术。由于磷脂和糖脂几乎不溶于丙酮,故通常采用丙酮、乙醇、氯仿、乙醚和己烷等有机溶剂实现脂质的提取和磷脂的脱油[5]。新型磷脂提取方法主要包括超临界流体萃取技术[6]、超声波辅助提取技术[7]、微波辅助提取技术[8]、脉冲电场提取技术[9]和酶促提取技术等[10-11]。其中研究较多的为超临界流体萃取技术,但是因成本较高并未实现大规模的应用。然而,传统溶剂法提取天然磷脂大多仅关注磷脂的提取效率,而较少关注磷脂分子种的组成和脂肪酸的组成,有关不同溶剂提取南极磷虾PC的研究报道较少。天然磷脂的提取和富集技术进展缓慢,阻碍了其功能活性的深入研究和产业化的进程。近年来,在质谱技术进步的推动下,脂质组学得到了迅速的发展,并实现了从完整的分子水平描述细胞、组织或生物体内的脂质谱[12-13]。基于MS的脂质组学谱,产生了大量全面的、可重复分析的,且没有故意偏向特定脂质类别或物种的数据。通过亲水作用色谱与质谱联用(hydrophilic interaction liquid chromatography-mass spectrometry, HILIC-MS)技术,可以准确获取生物样品的脂质组学特征,并已成功应用于物种和/或菌株等的鉴别[14-16]。鉴于此,本研究拟采用HILIC-MS/MS方法对不同溶剂提取的南极磷虾PC的分子种组成进行系统分析,以期为高效提取海洋磷脂提供数据支撑。
1 材料与方法
1.1 材料与试剂
南极磷虾粉,浙江海力生生物科技股份有限公司;PC、磷脂酰乙醇胺、磷脂酰肌醇标准品,美国Avanti公司;乙腈、甲醇、乙酸(均为色谱纯),德国Merck公司;乙醇、甲酸铵、丙酮、异丙醇、乙酸乙酯、正己烷、三氯甲烷、甲醇、石油醚、无水硫酸钠(均为分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
4000 Q-TRAP三重四级杆质谱(ESI离子源),美国Applied Biosystems公司;ACQUITY UPLC System超高效液相色谱,美国Waters公司;Fresco-21G台式离心机,美国Thermo Fisher公司;Millipore超纯水系统,美国Millipore公司;7890B气相色谱,美国Agilent公司;N-1300V-WB旋转蒸发仪,日本东京理化器械株式会社。
1.3 实验方法
1.3.1 样品制备方法
按照比例配制不同提取溶剂,包括95%体积分数乙醇、正己烷、异丙醇、乙酸乙酯、V(异丙醇)∶V(正己烷)=1∶1、V(乙酸乙酯)∶V(正己烷)=1∶1、Folch溶剂[V(三氯甲烷)∶V(甲醇)=2∶1]。采用不同溶剂提取南极磷虾油,即准确称取50 g磷虾粉置于500 mL烧杯,按照1∶20的料液比加入1 000 mL不同提取溶剂,超声波提取15 min,过滤得到滤液,旋蒸脱溶后采用FOLCH法复提油脂,收集下层有机相,旋蒸脱溶后即获得南极磷虾油,称重,记录南极磷虾油质量[17]。南极磷虾油置于-80 ℃超低温冰箱避光保存,用于后续测定磷脂含量。其计算如公式(1)所示:
(1)
式中:R1,不同溶剂提取南极磷虾油及磷脂的提取效率;m1,不同溶剂提取南极磷虾油(磷脂)质量,mg;m2,Folch法提取南极磷虾油(磷脂)质量,mg。
1.3.2 GC测定脂肪酸组成
参照薛静等[17]的方法稍作修改。准确称取南极磷虾油50 mg,加入5 mL 0.5 mol/L氢氧化钾-甲醇溶液,于65 ℃水浴30 min,冷却后加入2 mL质量分数为14%三氟化硼-甲醇溶液,于65 ℃水浴5 min,超声波提取10 min后加入2 mL正己烷,振摇后用2 mL饱和NaCl淋洗上层,取上层用无水硫酸钠脱水,过滤待测。
GC参数:HP-88毛细管色谱柱(30 m×0.25 mm,0.20 μm);升温程序:初温70 ℃保持1 min,以4 ℃/min升至180 ℃,保持5 min;再以3 ℃/min升至230 ℃,保持5 min,进样口温度250 ℃,分流比30∶1,进样量1 μL,载气N2,流速1 mL/min。
采用峰面积归一化法分析各脂肪酸组分的相对含量。每组样品重复测试3次。
1.3.3 HILIC-MS/MS测定磷脂分子种
参照薛静等[17]的方法稍作修改,采用氯仿-甲醇溶液(2∶1,体积比)对南极磷虾油进行稀释,以0.2 μm有机滤膜过滤后用于质谱分析。
液相条件:色谱柱:Cosmosil HILIC色谱柱(4.6 mm×250 mm,2.5 μm);流动相A:超纯水(20 mmol/L甲酸铵,18 mmol/L甲酸);流动相B:乙腈(18 mmol/L甲酸)。梯度洗脱程序:0 min,95% B;3 min,95% B;18 min,70% B;23 min,50% B;28 min,50% B;29 min,95% B;32 min,95% B。流量0.6 mL/min,进样量2 μL。每组样品重复测试3次。
质谱条件:电喷雾离子源ESI负离子模式;离子源电压-4 500 V;毛细管温度500 ℃;气帘气25 psi;雾化气24 psi;辅助气30 psi;扫描范围400~1 000 m/z。
1.4 数据处理
HILIC-MS/MS数据由Analyst 1.6软件处理。使用LIPIDMAPS预测工具(https://www.lipidmaps.org/resources/tools/index.php)分析磷脂结构组成,输入离子的m/z以获得总的碳原子个数/双键数(CN/DB)。采用SPSS 21.0对数据进行显著性分析,所有的实验数据均以“平均值±标准偏差”表示。
2 结果与分析
2.1 不同溶剂对南极磷虾油总脂提取率的影响
由图1可知,Folch法提取南极磷虾油的效率最高,其次为95%体积分数乙醇、异丙醇/正己烷、异丙醇和乙酸乙酯/正己烷,但差异不显著,但均显著高于乙酸乙酯和正己烷。南极磷虾含有丰富的甘油三酯和磷脂,其中甘油三酯为中性脂质,而磷脂因其不同的头部基团而具有一定的极性。因此,仍需进一步讨论不同提取体系对磷虾油中甘油三酯和磷脂组成的影响。
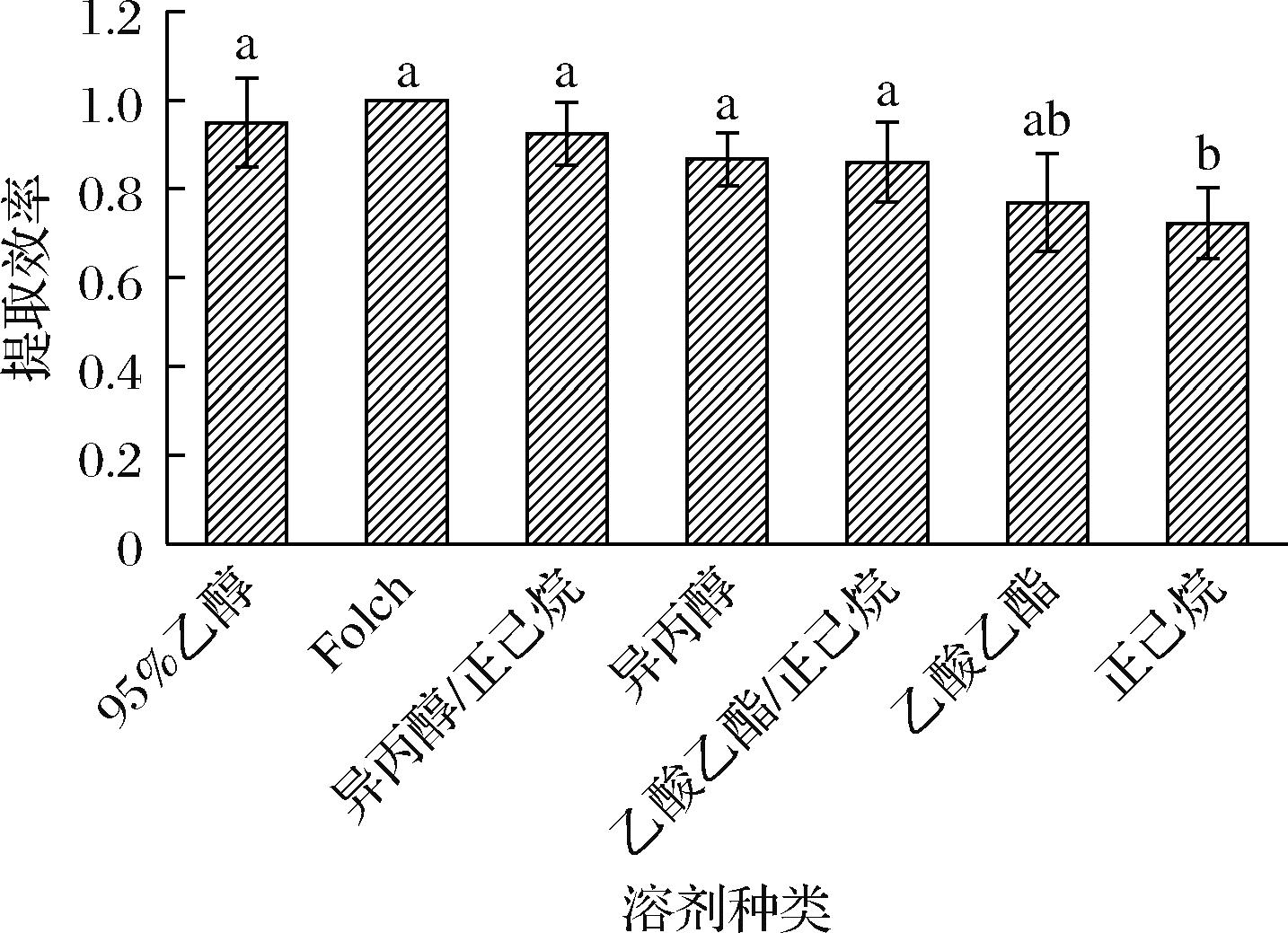
图1 不同溶剂对南极磷虾油提取效率的比较
Fig.1 Comparison of extraction efficiency of Antarctic krill oil by different solvents
注:字母不同表示差异显著(下同)。
2.2 不同溶剂对南极磷虾油中PC和溶血磷脂酰胆碱(lysophosphatidylcholine, LPC)提取率的影响
由图2可知,95%体积分数乙醇提取南极磷虾PC的效率最高,其后依次为Folch溶剂、乙酸乙酯/正己烷、正己烷、异丙醇/正己烷,而异丙醇和乙酸乙酯的提取效率最低;Folch法提取南极磷虾LPC的效率最高,其后依次为异丙醇/正己烷、95%体积分数乙醇、正己烷和乙酸乙酯,乙酸乙酯/正己烷和异丙醇的效率最低。分析其原因可能是不同溶剂对PC和LPC的溶解性存在差异,Folch试剂与乙醇可破坏脂质与蛋白的结合释放更多的结合态磷脂,因此对PC和LPC的提取效果较好。虽然正己烷可以提取相对丰富的PC和LPC,但推测异丙醇和正己烷混合后更适宜LPC的提取,而乙酸乙酯和正己烷的混合更适宜PC的提取。
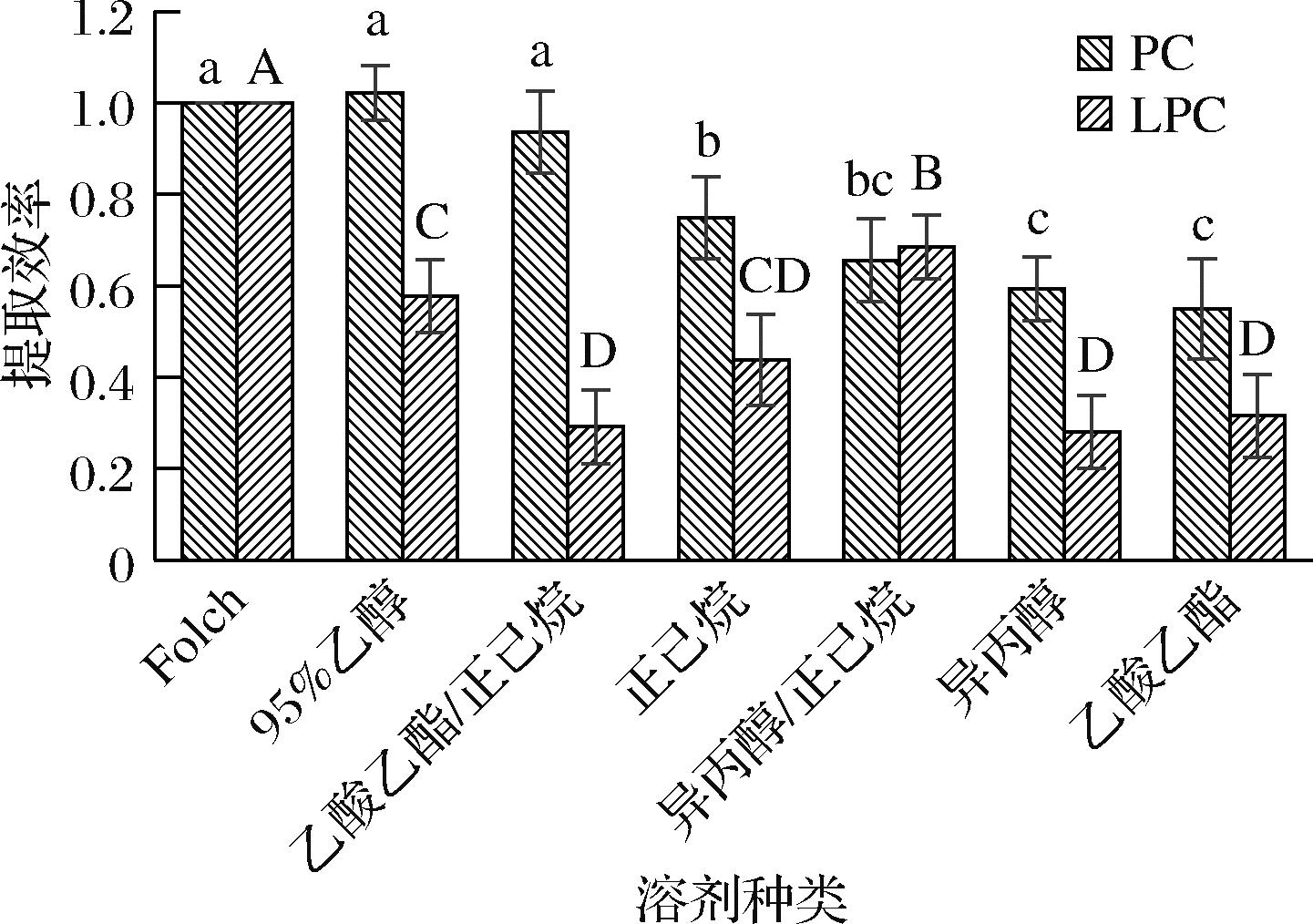
图2 不同溶剂对南极磷虾油PC和LPC提取效率的比较
Fig.2 Comparison of extraction efficiency of PC and LPC from Antarctic krill oil by different solvents
注:字母不同表示差异显著,小写字母和大写字母分别代表PC和LPC。
2.3 不同溶剂对提取的南极磷虾油中EPA和DHA含量影响
由图3可知,异丙醇/正己烷、95%体积分数乙醇、乙酸乙酯/正己烷和异丙醇提取的南极磷虾油中EPA和DHA总含量较高,分别为20.42%、20.05%、19.17%和18.89%,显著高于Folch溶液和乙酸乙酯,分别为17.19%和16.48%。分析其差异的原因可能是:南极磷虾脂质富含EPA和DHA,且较多以磷脂的形式存在[4,18]。因此,磷脂在磷虾油中的比例将会对南极磷虾油总EPA、DHA的含量产生影响。此外,甘油三酯结构中包含3条脂肪酸链,磷脂中包含2条脂肪酸链,因其脂肪酸链和极性基团的不同,其在不同的溶剂中的溶解性存在差异,因此,不同溶剂对脂质分子的富集效果也存在差异。为进一步明确不同溶剂条件下南极磷虾PC分子种的种类和含量差异,对获取的南极磷虾油进行HILIC-MS/MS分析。
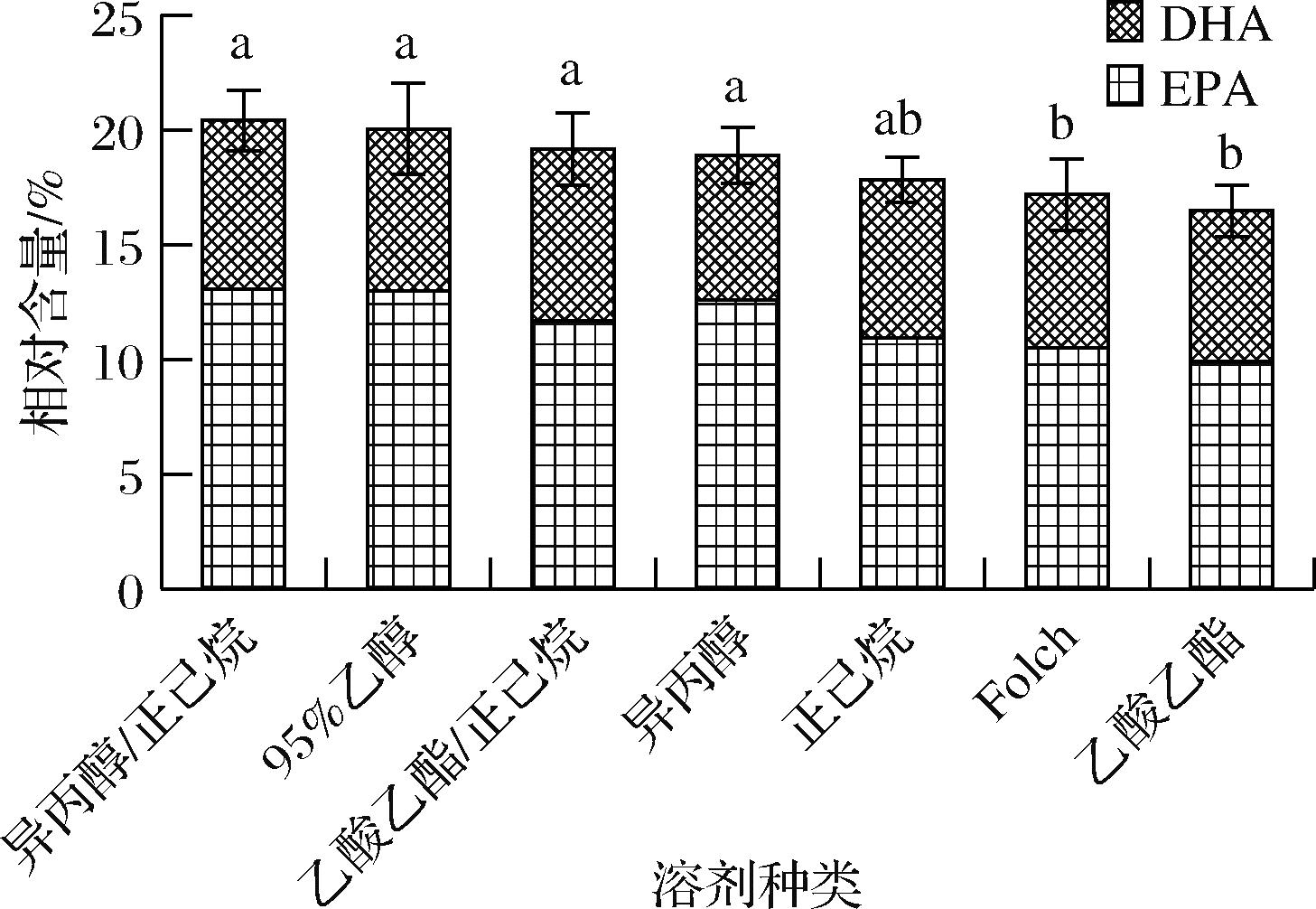
图3 不同溶剂提取的南极磷虾油中EPA和DHA相对含量比较
Fig.3 Comparison of EPA and DHA in Antarctic krill oil extracted with different solvents
2.4 不同溶剂对提取的南极磷虾油中PC和LPC分子种的影响
图4为异丙醇提取南极磷虾油的液相色谱图和PC及LPC组分的质谱图。对其中的PC和LPC分子种的含量进行分析,结果见表1和表2。
表1 不同溶剂提取的南极磷虾PC分子种的相对含量
单位:%
Table 1 Relative contents of PC molecular species of Antarctic krill extracted by different solvents

m/z分子种C∶D分子式95%乙醇Folch乙酸乙酯乙酸乙酯/正己烷异丙醇异丙醇/正己烷正己烷956.7PC(22∶5/24∶4)46∶9C54H90NO8P0.00 0.00 0.00 0.00 0.00 0.43 0.00 936.7PC(22∶0/22∶5)44∶5C52H94NO8P0.00 0.00 0.00 1.73 0.00 0.00 1.34 934.8PC(22∶0/22∶6)44∶6C52H92NO8P0.94 0.89 0.00 2.81 1.00 1.16 0.00 932.9PC(22∶1/22∶6)PC(22∶2/22∶5)44∶7C52H90NO8P0.99 0.00 0.00 1.58 0.00 0.00 0.00 924.7PC(22∶6/22∶5)44∶11C52H82NO8P0.00 0.00 0.00 0.00 1.57 0.00 1.49 922.8PC(22∶6/22∶6)44∶12C52H80NO8P0.95 1.90 2.66 0.75 1.28 1.03 1.31 908.9PC(20∶5/22∶0)PC(20∶1/22∶4)42∶5C50H90NO8P0.85 0.00 0.00 0.66 1.33 1.15 1.10 906.8PC(20∶0/22∶6)PC(20∶1/22∶5)42∶6C50H88NO8P1.92 2.85 3.71 1.65 1.72 2.92 1.64 904.6PC(20∶1/22∶6)PC(20∶5/22∶2)42∶7C50H86NO8P0.00 0.00 0.00 0.00 0.00 0.00 0.86 898.7PC(20∶4/22∶6)PC(20∶5/22∶5)42∶10C50H80NO8P1.89 0.66 0.00 2.51 0.00 0.00 2.27 896.7PC(20∶5/22∶6)42∶11C50H78NO8P3.63 3.70 2.94 3.94 3.65 5.03 5.07 894.7PC(O-18∶1/24∶4)42∶5C50H92NO7P0.00 0.00 1.02 0.00 0.00 0.24 0.00 886.9PC(20∶0/20∶2)PC(18∶1/22∶1)40∶2C48H92NO8P0.00 0.00 0.00 0.61 0.00 0.73 1.17 884.7PC(20∶1/20∶2)40∶3C48H90NO8P0.00 0.00 0.00 0.92 0.00 0.00 0.00 882.8PC(20∶0/20∶4)40∶4C48H88NO8P0.70 1.20 1.23 0.00 0.00 1.71 1.50 880.9PC(20∶0/20∶5)PC(20∶1/20∶4)40∶5C48H86NO8P0.92 0.00 0.00 1.24 1.00 0.85 0.00 878.9PC(18∶0/22∶6)PC(20∶1/20∶5)40∶6C48H84NO8P1.94 1.41 1.23 1.98 1.42 1.84 1.46 876.8PC(18∶1/22∶6)PC(20∶2/20∶5)40∶7C48H82NO8P4.50 2.52 3.35 1.74 3.17 3.50 2.43 872.9PC(18∶3/22∶6)PC(20∶4/20∶5)40∶9C48H78NO8P0.69 1.12 1.28 0.93 0.84 0.99 2.37 870.8PC(20∶5/20∶5)PC(18∶4/22∶6)40∶10C48H76NO8P1.46 1.96 0.00 2.25 2.41 2.17 2.44 868.7PC(O-18∶0/22∶4)40∶4C48H90NO7P0.00 0.00 0.00 0.79 0.00 0.00 0.00 866.8PC(O-18∶0/22∶5)PC(O-18∶1/22∶4)40∶5C48H88NO7P1.25 0.85 1.41 1.34 1.38 1.69 1.36 864.8PC(O-18∶0/22∶6)40∶6C48H86NO7P1.71 0.60 0.00 0.83 0.00 0.84 0.94 862.8PC(O-18∶1/22∶6)40∶7C48H84NO7P1.02 0.00 0.00 0.76 1.50 0.00 1.15 856.9PC(18∶1/20∶2)PC(18∶2/20∶1)38∶3C46H86NO8P0.00 0.00 1.20 0.78 0.00 0.78 0.00 854.8PC(18∶0/20∶4)38∶4C46H84NO8P0.00 0.00 0.00 0.00 1.11 1.16 0.90 852.9PC(18∶0/20∶5)PC(18∶1/20∶4)38∶5C46H82NO8P5.80 3.28 3.79 3.14 3.49 3.41 3.88 850.8PC(16∶0/22∶6)PC(18∶1/20∶5)38∶6C46H80NO8P7.45 8.11 10.18 7.83 11.66 11.49 10.66 848.7PC(16∶1/22∶6)PC(18∶2/20∶5)38∶7C46H78NO8P1.38 0.00 0.00 0.98 0.84 0.85 0.00 842.8PC(O-16∶1/22∶2)PC(O-18∶1/20∶2)38∶3C46H88NO7P0.00 0.00 0.00 0.00 0.00 0.33 0.00
续表1

m/z分子种C∶D分子式95%乙醇Folch乙酸乙酯乙酸乙酯/正己烷异丙醇异丙醇/正己烷正己烷840.8PC(O-18∶0/20∶4)PC(O-16∶0/22∶4)38∶4C46H86NO7P2.98 2.17 1.96 2.93 3.88 2.25 5.59 838.8PC(O-18∶0/20∶5)PC(O-18∶1/20∶4)38∶5C46H84NO7P1.59 1.40 2.43 2.19 3.04 0.00 2.33836.6PC(O-18∶1/20∶5)PC(O-16∶0/22∶6)38∶6C46H82NO7P2.94 3.28 2.04 1.37 2.93 2.33 2.24 834.8PC(O-16∶1/22∶6)38∶7C46H80NO7P0.83 0.00 0.00 0.00 1.60 0.86 1.22 832.6PC(18∶0/18∶1)PC(16∶0/20∶1)36∶1C44H86NO8P0.00 0.00 0.00 0.93 0.00 0.00 0.00 830.8PC(18∶0/18∶2)PC(18∶1/18∶1)36∶2C44H84NO8P1.43 0.90 0.00 0.73 0.00 1.22 0.00 828.8PC(18∶3/18∶0)PC(18∶2/18∶1)36∶3C44H82NO8P0.99 0.92 2.61 0.00 0.00 1.19 0.00 826.7PC(16∶0/20∶4)PC(18∶1/18∶3)36∶4C44H80NO8P3.17 0.00 5.45 3.49 3.76 4.42 2.88 824.8PC(16∶0/20∶5)36∶5C44H78NO8P15.60 15.07 14.34 10.75 17.89 16.31 13.71 822.8PC(14∶0/22∶6)PC(16∶1/20∶5)36∶6C44H76NO8P2.04 1.79 1.66 1.99 0.00 2.46 2.01 818.8PC(O-18∶0/18∶1)PC(O-16∶0/20∶1)36∶1C44H88NO7P1.08 0.00 0.00 0.00 0.00 0.00 0.00 816.6PC(O-18∶0/18∶2)PC(O-18∶1/18∶1)36∶2C44H86NO7P0.00 0.75 0.00 0.00 2.58 0.72 0.00 814.8PC(O-18∶0/18∶3)PC(O-18∶1/18∶2)36∶3C44H84NO7P0.00 0.00 0.00 0.79 0.00 0.25 0.00 812.8PC(O-16∶0/20∶4)PC(O-18∶1/18∶3)36∶4C44H82NO7P0.00 1.30 0.00 1.20 0.00 0.00 0.00 810.9PC(O-16∶0/20∶5)PC(O-16∶1/20∶4)36∶5C44H80NO7P1.99 2.87 2.14 2.79 1.81 2.82 1.89 808.8PC(O-16∶1/20∶5)36∶6C44H78NO7P2.20 2.99 1.03 2.22 1.41 1.10 1.60 806.8PC(14∶0/20∶0)PC(16∶0/18∶0)34∶0C42H84NO8P1.01 1.34 1.33 0.94 0.95 1.61 0.93 804.9PC(16∶0/18∶1)34∶1C42H82NO8P5.61 14.04 6.76 6.18 6.70 0.00 5.71 802.7PC(16∶0/18∶2)PC(16∶1/18∶1)34∶2C42H80NO8P0.00 3.80 5.14 3.61 3.34 3.88 2.55 800.8PC(16∶0/18∶3)PC(16∶1/18∶2)34∶3C42H78NO8P1.66 1.94 2.75 4.32 2.39 2.16 1.92 798.8PC(14∶0/20∶4)PC(16∶1/18∶3)34∶4C42H76NO8P2.13 2.12 2.16 0.00 1.14 2.55 1.79 796.9PC(14∶0/20∶5)34∶5C42H74NO8P1.79 1.89 2.55 2.05 2.22 2.56 1.94 790.9PC(O-16∶0/18∶1)PC(O-16∶1/18∶0)34∶1C42H84NO7P2.55 0.91 0.00 0.00 0.00 0.00 1.34 788.6PC(O-16∶0/18∶2)PC(O-16∶1/18∶1)34∶2C42H82NO7P0.75 0.00 0.00 0.00 0.00 0.00 0.00 784.8PC(O-16∶0/18∶4)PC(O-16∶1/18∶3)34∶4C42H78NO7P0.00 0.00 1.23 0.00 0.00 0.00 0.00 782.8PC(O-16∶1/18∶4)34∶5C42H76NO7P1.25 1.96 2.52 0.00 0.00 0.00 0.00 778.9PC(16∶0/16∶0)PC(14∶0/18∶0)32∶0C40H80NO8P0.00 0.00 0.00 1.17 0.00 0.00 0.00 776.6PC(16∶0/16∶1)PC(14∶0/18∶1)32∶1C40H78NO8P3.51 4.93 6.62 5.09 4.98 5.90 3.82 774.9PC(14∶0/18∶2)PC(16∶1/16∶1)32∶2C40H76NO8P1.87 1.20 1.27 0.00 0.00 0.00 1.20 772.8PC(14∶0/18∶3)32∶3C40H74NO8P0.00 0.00 0.00 1.33 0.00 0.66 0.00 770.8PC(14∶0/18∶4)32∶4C40H72NO8P0.00 0.00 0.00 0.00 0.00 0.47 0.00 764.7PC(O-16∶0/16∶0)PC(O-18∶0/14∶0)32∶0C40H82NO7P0.00 0.00 0.00 0.76 0.00 0.00 0.00 762.8PC(O-16∶0/16∶1)PC(O-18∶1/14∶0)32∶1C40H80NO7P0.00 0.00 0.00 0.71 0.00 0.00 0.00 748.9PC(16∶1/14∶0)30∶1C38H74NO8P1.06 1.37 0.00 0.69 0.00 0.00 0.00脂肪酸酰基碳数>3648.3237.9240.4448.2550.8249.7356.71脂肪酸酰基碳数>36且双键数>444.64 34.54 36.04 42.23 45.84 42.79 47.55 双键数>469.5161.1160.2862.0369.1668.0268.69双键数>617.3411.8610.2315.4416.8714.8620.61
注:C∶D为脂肪酰基碳数∶双键数。
表2 不同溶剂提取南极磷虾LPC分子种相对含量 单位:%
Table 2 Relative contents of LPC molecular species of Antarctic krill extracted by different solvents

m/z分子种C∶D分子式95%乙醇Folch乙酸乙酯乙酸乙酯/正己烷异丙醇异丙醇/正己烷正己烷622.7PC(0∶0/22∶1)22∶1C30H60NO7P2.76 2.51 0.00 3.89 0.00 1.97 5.56 614.6PC(0∶0/22∶5)22∶5C30H52NO7P0.00 1.92 0.00 6.70 0.00 0.00 1.45 612.5PC(0∶0/22∶6)22∶6C30H50NO7P9.54 7.09 3.30 7.50 6.46 9.41 5.66 594.4PC(0∶0/20∶1)20∶1C28H56NO7P0.00 1.18 0.00 0.00 0.00 0.00 0.66 588.4PC(0∶0/20∶4)20∶4C28H50NO7P0.00 0.00 0.00 3.51 0.00 0.00 1.95 586.5PC(0∶0/20∶5)20∶5C28H48NO7P12.36 16.60 6.83 8.87 10.50 14.30 8.17 568.7PC(0∶0/18∶0)18∶0C26H54NO7P2.70 4.55 0.00 6.92 4.15 3.19 6.05 566.7PC(0∶0/18∶1)18∶1C26H52NO7P8.54 13.30 38.14 7.69 18.11 13.87 17.09 564.6PC(0∶0/18∶2)18∶2C26H50NO7P4.01 2.08 0.00 0.00 0.00 1.86 1.27 562.2PC(0∶0/18∶3)18∶3C26H48NO7P0.00 1.31 0.00 0.00 0.00 0.00 0.00 560.6PC(0∶0/18∶4)18∶4C26H46NO7P0.00 0.00 0.00 0.00 0.00 0.00 3.14 554.5PC(O-18∶0/0∶0)18∶0C26H54NO7P0.00 2.36 0.00 5.00 0.00 2.06 0.00 552.6PC(O-18∶1/0∶0)18∶1C26H54NO6P2.31 2.43 0.00 0.00 0.00 0.00 1.70 540.5PC(0∶0/16∶0)16∶0C24H50NO7P32.75 31.84 31.78 35.56 50.33 40.81 34.38 538.7PC(0∶0/16∶1)16∶1C24H48NO7P7.19 4.34 3.64 0.00 3.85 4.35 0.00 526.5PC(O-16∶0/0∶0)16∶0C24H52NO6P4.55 3.90 4.32 6.32 6.60 2.85 6.38 524.6PC(O-16∶1/0∶0)16∶1C24H50NO6P4.03 1.37 5.01 0.00 0.00 1.64 4.06 512.7PC(0∶0/14∶0)14∶0C22H46NO7P6.59 3.22 6.97 8.04 0.00 3.68 2.49 510.5PC(0∶0/14∶1)14∶1C22H44NO7P2.66 0.00 0.00 0.00 0.00 0.00 0.00 含一条多不饱和脂肪酸的LPC的总和25.91 29.01 10.13 26.58 16.96 25.58 21.63 含一条单不饱和脂肪酸的LPC的总和27.50 25.13 46.79 11.58 21.96 21.83 29.06 含一条饱和脂肪酸的LPC的总和46.59 45.87 43.08 61.84 61.08 52.60 49.31 PC 0∶0/20∶5+ PC 0∶0/22∶621.91 23.69 10.13 16.37 16.96 23.72 13.83
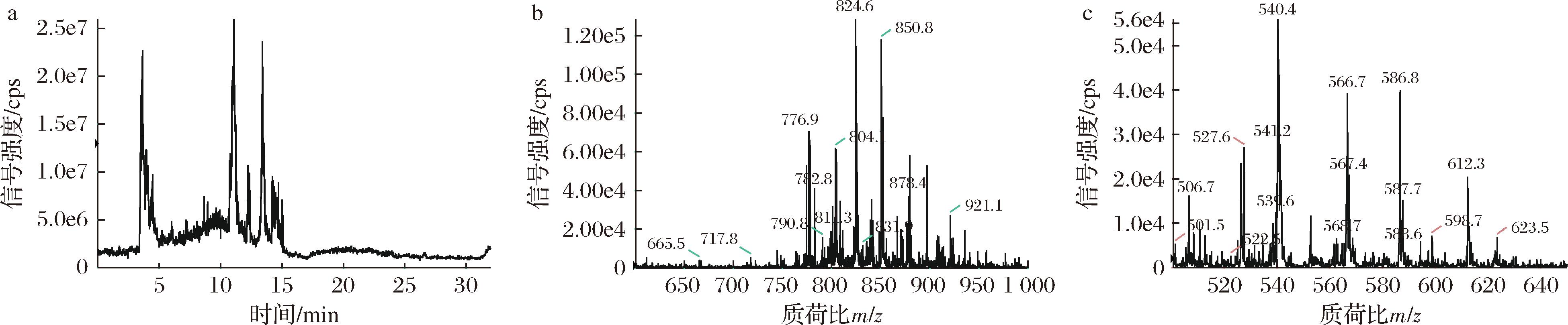
a-南极磷虾油液相色谱图;b-南极磷虾油PC质谱图;c-南极磷虾油LPC质谱图
图4 异丙醇提取南极磷虾油的液相色谱和PC及LPC的质谱图
Fig.4 The liquid chromatography, the mass spectrometry of PC and LPC of Antarctic krill oil extracted with isopropanol
2.4.1 PC分子种的差异
由表1可知,不同溶剂提取的南极磷虾PC分子种的种类和相对含量存在差异如下:
a)7种溶剂提取的南极磷虾PC中含量最高的分子种均为m/z 824.8(PC 16∶0/20∶5),其在95%乙醇、Folch溶剂、异丙醇和异丙醇/正己烷提取的PC中的含量均超过15.00%,而在乙酸乙酯、正己烷和乙酸乙酯/正己烷中的含量相对较低。
b)按照脂肪酸酰基碳数对PC分子种进行汇总统计可知,正己烷提取的PC中脂肪酸酰基碳数>36的分子种比例最高,占56.71%;其次为异丙醇和异丙醇/正己烷,分别占50.82%和49.73%;而Folch溶剂和乙酸乙酯中的比例较低,仅占37.92%和40.44%。
c)按照双键数对PC分子种进行汇总统计可知,95%乙醇、异丙醇、正己烷和异丙醇/正己烷提取的PC中双键数>4和双键数>6的分子种比例较高,而乙酸乙酯和Folch溶剂组较低。
d)正己烷、乙酸乙酯/正己烷和异丙醇中含有较高比例的m/z 922.8(PC 22∶6/22∶6)、m/z 896.7(PC 20∶5/22∶6)和m/z 870.8(PC 20∶5/20∶5),三者合计分别占8.7%、6.8%和7.2%,而乙酸乙酯组含量较低,仅占5.6%。
2.4.2 LPC分子种的差异
由表2可知,不同溶剂提取的南极磷虾LPC分子种的种类和相对含量存在一定差异。具体为:
a)南极磷虾LPC中主要的分子种为m/z 586.5(PC 0∶0/20∶5)、m/z 612.5(PC 0∶0/22∶6)、m/z 566.7(PC 0∶0/18∶1)、m/z 540.5(PC 0∶0/16∶0)、m/z 568.7(PC 0∶0/18∶0)、m/z 526.5(PC O-16∶0/0∶0)和m/z 512.7(PC0∶0/14∶0)等。
b)FOLCH法、乙酸乙酯/正己烷、95%体积分数乙醇和异丙醇/正己烷提取的LPC中含有较高的多不饱和脂肪酸,分别为29.01%、26.58%、25.91%和25.58%,而乙酸乙酯和异丙醇中的多不饱和脂肪酸比例较低,仅占10.13%和16.96%;乙酸乙酯/正己烷和异丙醇提取的LPC中含有较高的饱和脂肪酸,占61.84%和61.08%。
c)异丙醇/正己烷、Folch溶剂和95%体积分数乙醇提取的LPC中含有较高比例的m/z 586.5(PC 0∶0/20∶5)和m/z 612.5(PC 0∶0/22∶6),两者合计分别占23.72%、23.69%和21.91%,而乙酸乙酯和正己烷中仅占10.13%和13.83%。
3 结论
本研究以常用的较为安全的有机溶剂,如乙醇、正己烷、乙酸乙酯和异丙醇,以及其混合溶剂,对南极磷虾粉中的脂质进行提取,并与经典FOLCH法进行对比。结果表明:采用正己烷和乙酸乙酯等单一溶剂提取南极磷虾油的效率较低,且南极磷虾油中的EPA和DHA含量较低,而95%体积分数乙醇和异丙醇/正己烷提取南极磷虾油的效率较高,且EPA和DHA含量较高。范雁等[19]研究表明,南极磷虾油中PC型EPA相比于非PC型EPA具有更高的生物活性和生物利用度,因此推荐将PC型EPA含量占总EPA含量的比例作为评价南极磷虾油的品质的标准。本研究进一步讨论不同提取体系对PC的提取效率,95%体积分数乙醇提取效率最高,其次为Folch溶剂、乙酸乙酯/正己烷、正己烷、异丙醇/正己烷,而异丙醇和乙酸乙酯的提取效率最低。对LPC的提取效率,FOLCH法提取效率最高,其次为异丙醇/正己烷、95%体积分数乙醇、正己烷和乙酸乙酯,乙酸乙酯/正己烷和异丙醇的效率最低。乙酸乙酯单一溶剂提取长链型PC/LPC或高不饱和脂肪酸型PC/LPC的效果最差,对EPA和DHA的富集效果也最差。
分析其原因,磷虾粉所含磷脂成分占总脂肪的比例较其他水产品更高[20],其特殊的分子结构决定了其具有亲水亲脂属性,因此采用极性较高的乙醇溶剂有助于磷脂的充分渗透、提取和游离,故采用乙醇体系时总脂和磷脂的提取效率较高。而正己烷作为弱极性有机溶剂,有助于非极性脂质甘油三酯的提取,但对于磷脂的提取效率相对较弱。因此,由于受到磷脂提取效率的影响,单一使用正己烷提取总脂时提取效率较低。此外,PC作为南极磷虾磷脂中的主要组分,该组分的提取效率对于南极磷虾磷脂以及总脂的提取效率具有重要的影响。PC可溶于氯仿、正己烷等低极性溶剂及低类醇中,微溶于苯,基本不溶于乙酸乙酯、丙酮,而磷脂酰乙醇胺不易溶于乙醇。虽然单一使用乙酸乙酯进行提取时总脂提取率与正己烷接近,但该体系下PC/LPC提取效率较差。考虑到单一体系对磷脂和甘油三酯提取效率的差异,混合体系可调节总体系极性,并结合各自优势改善南极磷虾油的提取效率。曹文静等[21]研究表明,正己烷和乙醇体系提取南极磷虾油的效果差异明显,且随着混合体系中正己烷含量的增加,提取效率呈先增加后下降趋势,且提取效率与时间、温度、搅拌速度和料液比等相关,但上述研究并未就磷虾油具体成分进行深入分析。谢丹[22]报道了一种分级提取南极磷虾油的工艺,以全脂磷虾粉为原料,依次以丙酮、己烷、乙醇为提取溶剂进行三级分级提取,提取得到的虾油磷脂含量分别为2.39、35.02、62.79 g/100 g,EPA和DHA总含量分别占总脂肪酸质量的11.52%、26.17%、41.39%。虽然组合溶剂提取法一定程度上提高了提取率,增加了南极磷虾油产品的多样性,但是由于操作的复杂性,目前不适于产业化生产。
本研究中,95%体积分数乙醇和异丙醇/正己烷提取南极磷虾油的效率最高,且其所含的PC和LPC含量较高。此外,两种溶剂体系对EPA和DHA亦具有较好的富集效果。综上所述,95%体积分数乙醇和异丙醇/正己烷是提取富含EPA和DHA的南极磷虾油的良好溶剂,后续研究可进一步优化其他操作参数以提升南极磷虾油及其微量生物活性成分的提取效率。
[1] CASTRO-G MEZ P, GARCIA-SERRANO A, VISIOLI F, et al. Relevance of dietary glycerophospholipids and sphingolipids to human health[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 2015, 101:41-51.
MEZ P, GARCIA-SERRANO A, VISIOLI F, et al. Relevance of dietary glycerophospholipids and sphingolipids to human health[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 2015, 101:41-51.
[2] ZHANG T T, XU J, WANG Y M, et al. Health benefits of dietary marine DHA/EPA-enriched glycerophospholipids[J]. Progress in Lipid Research, 2019, 75:100997.
[3] BURRI L, HOEM N, BANNI S, et al. Marine omega-3 phospholipids: Metabolism and biological activities[J]. International Journal of Molecular Sciences, 2012, 13(11):15401-15419.
[4] SAETHER O, ELLINGSEN T E, MOHR V. Lipids of North Atlantic krill[J]. Journal of Lipid Research, 1987, 27(3):274-285.
[5] HAQ M, CHUN B S. Characterization of phospholipids extracted from Atlantic salmon by-product using supercritical CO2 with ethanol as co-solvent[J]. Journal of Cleaner Production, 2018, 178:186-195.
[6] ASADUZZAMAN A K M, CHUN B S. Quality characteristics of lecithin isolated from deoiled mackerel (Scomber japonicus) muscle using different methods[J]. Journal of Industrial and Engineering Chemistry, 2015, 21:620-626.
[7] AL KHAWLI F, FERRER E, BERRADA H, et al. Innovative green technologies of intensification for valorization of seafood and their by-products[J]. Marine Drugs, 2019, 17(12):689.
[8] ZGHAIBI N, OMAR R, KAMAL S M M, et al. Microwave-assisted brine extraction for enhancement of the quantity and quality of lipid production from microalgae Nannochloropsis sp[J]. Molecules, 2019, 24(19):3581.
[9] FOMO G, MADZIMBAMUTO T N, OJUMU T V. Applications of nonconventional green extraction technologies in process industries: Challenges, limitations and perspectives[J]. Sustainability, 2020, 12(13):5244.
[10] 俞喜娜, 陈康, 张燕平, 等. 酶辅助提取南极磷虾磷脂及脂质组学研究[J]. 中国食品学报, 2020, 20(11):97-106.
YU X N, CHEN K, ZHANG Y P, et al. Enzyme-assisted extraction of phospholipids from Antarctic krill and it’s lipidomics[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(11):97-106.
[11] 刘雪凌, 林贝, 周学材. 复合酶法提取革胡子鲶下脚料中的磷脂酰胆碱的工艺[J]. 食品工业, 2020, 41(8):153-156.
LIU X L, LIN B, ZHOU X C. Extraction of lecithin by using papain from the clariasleather processing scrap[J]. The Food Industry, 2020, 41(8):153-156.
[12] CUI Y W, WANG H H, ZHAO Q L, et al. Real-time detection of authenticity and adulteration of krill phospholipids with soybean phospholipids using rapid evaporative ionization mass spectrometry: Application on commercial samples[J]. Food Control, 2021, 121:107680.
[13] WANG J, LIAO J, WANG H H, et al. Quantitative and comparative study of plasmalogen molecular species in six edible shellfishes by hydrophilic interaction chromatography mass spectrometry[J]. Food Chemistry, 2021, 334:127558.
[14] SHEN Q, DAI Z Y, HUANG Y W, et al. Lipidomic profiling of dried seahorses by hydrophilic interaction chromatography coupled to mass spectrometry[J]. Food Chemistry, 2016, 205:89-96.
[15] YU X N, CHEN K, LI S Y, et al. Lipidomics differentiation of soft-shelled Turtle strains using hydrophilic interaction liquid chromatography and mass spectrometry[J]. Journal of Chromatography B, 2019, 1112:11-15.
[16] ZHENG J Y, JIN Y Y, SHI Z Q, et al. Fluorous-paired derivatization approach towards highly sensitive and accurate determination of long chain unsaturated fatty acids by liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2020, 1136:187-195.
[17] 薛静, 崔益玮, 沈清, 等. 富含EPA/DHA型结构磷脂的酶法合成条件优化及表征[J]. 核农学报, 2020, 34(12):2780-2792.
XUE J, CUI Y W, SHEN Q, et al. Enzymatic preparation of EPA/DHA-rich phospholipids and structure characterization[J]. Journal of Nuclear Agricultural Sciences, 2020, 34(12):2780-2792.
[18] FALK-PETERSEN S, HAGEN W, KATTNER G, et al. Lipids, trophic relationships, and biodiversity in Arctic and Antarctic krill[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2000, 57(S3):178-191.
[19] AL KHAWLI F, FERRER E, BERRADA H, et al. Innovative green technologies of intensification for valorization of seafood and their by-products[J]. Marine Drugs, 2019, 17(12):689.
[20] 林柳, 曹振海, 陶宁萍, 等. 南极磷虾油氧化稳定性及调控方法研究进展[J]. 食品科学, 2023, 44(15):310-320.
LIN L, CAO Z H, TAO N P, et al. Research progress in oxidation stability of Antarctic krill(Euphausia superba) oil and review of methods for its control[J]. Food Science, 2023, 44(15):310-320.
[21] 曹文静, 惠欢庆, 沈俊涛, 等. 混合溶剂提取南极磷虾油的工艺研究[J]. 中国油脂, 2013, 38(12):6-9.
CAO W J, HUI H Q, SHEN J T, et al. Mixed solvent extraction of oil from Euphausia superba[J]. China Oils and Fats, 2013, 38(12):6-9.
[22] 谢丹. 南极磷虾油的分级制备及功能评价[D]. 无锡: 江南大学, 2019.
XIE D. Graded preparation and functional evaluation of Antarctic krill oil[D]. Wuxi: Jiangnan University, 2019.