碧根果[Carya illinoinensis(Wangenh.)K.Koch]是最有价值的北美坚果品种之一[1]。碧根果除直接炒制食用外,也可用于制取碧根果油。目前碧根果油的主要生产工艺以低温压榨为主,1 kg碧根果原料压榨后可产生约0.5 kg饼粕,这些饼粕中含有约40%~45%的蛋白质[2],但目前大多作为饲料使用、或直接丢弃,造成了严重的资源浪费。
为了改善植物蛋白的溶解性、乳化性(emulsion activity index, EAI)等功能特性,酶水解法[3]、高压处理法[4]和热处理法[5]等多种技术被报道和应用。这些技术各有优势,但也存在局限性:酶水解法制备的蛋白中常含有酶解碎片,这些碎片易降低蛋白的胶凝能力和乳化稳定性(emulsification activity index, ESI);高压处理法可能引起蛋白质的变性和活性丧失,并降低其营养价值;热处理法可导致蛋白亚基解聚,而解聚亚基的重新聚合或沉淀是难以精准控制的。pH调节法是一种在20世纪末新兴的技术,该方法通过在极端pH条件下使部分蛋白质溶解,然后通过离心去除不溶性物质,最后通过调整pH至蛋白质的等电点来沉淀目标蛋白质[6];在植物蛋白[7]和动物蛋白[8]研究中,该方法提供了一种可靠的手段,可以快速而有效地提取和分析样品中的蛋白质,同时最大限度地减小蛋白质的变性风险,并受到广泛应用。
张源生[1]采用碱溶酸沉法提取碧根果蛋白,即将脱去内皮的碧根果仁脱脂粉在pH 12、40 ℃条件下提取2 h,离心取上清液,调节上清液至pH 4.8,再次离心并收集沉淀;沉淀经透析脱盐、冷冻干燥后得到碧根果蛋白。为促进碧根果粕的深加工,本研究以碧根果粕为原料,探讨广谱pH调节法制备碧根果酸溶蛋白(acid-soluble protein, AP)和碱溶蛋白(alkali-soluble protein, BP)的最佳提取条件和最佳沉淀条件,分析了AP和BP的蛋白结构等理化性质和乳化性等加工特性,并预测了它们在不同食物系统中的兼容性。
1 材料与方法
1.1 材料与设备
低温压榨碧根果油粕,自制;考马斯亮蓝R250,国药集团上海化学试剂有限公司;SDS-PAGE凝胶电泳试剂盒、Marker、Lowry法蛋白含量检测试剂盒,伯乐生命医学产品(上海)有限公司。
FD-1B-5冷冻干燥机,北京博医康实验仪器有限公司;Bio-Rad电泳仪,美国Bio-Rad公司;F2-standard pH计,梅特勒-托利多仪器有限公司;CR22 GⅡ高速冷冻离心机,日本HITACHI公司。
1.2 实验方法
1.2.1 碧根果蛋白pH调节法制备溶出pH值及沉淀pH值的确定
将碧根果低温榨油[9],取碧根果饼并脱脂得到碧根果粕脱脂粉。准确称取1 g碧根果粕脱脂粉[10],与蒸馏水以料液比1∶25(g∶mL)混合,用0.1 mol/L NaOH溶液或HCl溶液调节pH值1~13,并在室温下搅拌浸提2 h后,于20 ℃、8 000 r/min离心20 min,使用Lowry法测定离心上清液中蛋白质含量,分析pH值对碧根果蛋白溶出率的影响。其计算如公式(1)所示:
蛋白溶出率![]()
(1)
将上述得到的最佳溶出pH值的酸性上清液和碱性上清液分别调节pH值为7~13和2~7,然后离心(8 000 r/min,20 min),采用Lowry法测定上清液中蛋白的含量,计算沉淀回收率;收集沉淀,将沉淀转入透析袋,透析48 h,期间每隔6 h换一次水,再冷冻干燥24 h后得到AP和BP粉末[11]。沉淀回收率的计算如公式(2)所示:
沉淀回收率/%=
(2)
1.2.2 AP和BP的分子质量、巯基和二硫键分析
AP和BP分子质量的测定采用WU等[12]报道的SDS-PAGE法;SDS-PAGE电泳的实验条件如下:分离胶和浓缩胶的浓度分别为120 g/L和50 g/L,蛋白质标准品分子质量为14~97 kDa。将AP和BP(2 mg)分别分散在1 mL SDS样品缓冲液中,煮沸5 min后,取20 μL样品溶液加入到上样槽后开始电泳。浓缩胶的电压为80 V,样品进入分离胶后调节电压为110 V。电泳结束,剥离电泳胶,用考马斯亮蓝R-250染色30 min,再脱色48 h,期间多次更换脱色液,最后在凝胶成像系统中拍照保存,并分析碧根果粕AP和BP的分子质量大小。
将50 mg蛋白质样品溶解于15 mL Tris-Gly缓冲液(包含8 mol/L尿素和50 μL Ellman试剂)中,将混合物在黑暗中孵育1 h,然后进行离心。在412 nm处测定上清液的吸光度值,将OD值代入计算游离巯基含量。
将25 mg蛋白质样品溶解在15 mL Tris-Gly(含8 mol/L尿素和100 μL β-巯基乙醇)中,随后孵育混合物1 h,接着加入120 g/L三氯乙酸15 mL,然后离心。收集沉淀并用15 mL 120 g/L三氯乙酸洗涤沉淀物,再次离心,收集沉淀物并重新悬浮于15 mL Tris-Gly(含8 mol/L尿素)中,在412 nm处测定含有50 μL Ellman试剂的溶液的吸光度值,将OD值代入计算总巯基含量。总巯基含量和二硫键含量的计算如公式(3)和公式(4)所示:
总巯基含量![]()
(3)
二硫键含量![]()
(4)
式中:73.53,消光系数;A412,吸光值;D,稀释倍数;C,蛋白含量,mg/mL。
1.2.3 AP和BP的加工特性研究
1.2.3.1 溶解性测定
参考HU等[13]的方法并加以修改,将蛋白质样品与蒸馏水按料液比1∶20(g∶mL)混合。悬浮液用0.1 mol/L HCl溶液或NaOH溶液调节至所需的pH值(3、5、7、9、11),在室温下磁力搅拌1 h,在4 ℃条件下以8 000 r/min离心10 min,使用Lowry法测定离心上清液中蛋白质含量,溶解度的计算如公式(5)所示:
溶解度![]()
(5)
1.2.3.2 持水性和持油性测定
AP和BP的持水性(water holding capacity, WHC)和持油性(oil holding capacity, OHC)参考YU等[14]的方法并加以修改。称取0.1 g样品置于离心管中,并加入2 mL水/油进行WHC和OHC的测定。将悬浮液涡旋3 min,静置30 min,4 000 r/min离心5 min,倾析上清液后,将试管倒置在滤纸上45 min,称量所得沉淀物。WHC和OHC的计算如公式(6)所示:
(6)
式中:m0,样品的干质量,g;m1,样品的初始质量,g;m2,倾析油或水后的沉淀物质量,g。
1.2.3.3 EAI和ESI测定
EAI和ESI参考DROZ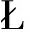 OWSKA等[15]的方法并加以修改,将蛋白质与蒸馏水按料液比1∶20(g∶mL)混合,并调至相应pH值至3、5、7、9、11,与相同体积大豆油充分混合,使用剪切机以10 000 r/min均质1 min。取100 μL底部乳液,加入5 mL 0.1% SDS溶液,并选择500 nm下测定其吸光值。随后,等待10 min后重复以上步骤,EAI和ESI的计算如公式(7)和公式(8)所示:
OWSKA等[15]的方法并加以修改,将蛋白质与蒸馏水按料液比1∶20(g∶mL)混合,并调至相应pH值至3、5、7、9、11,与相同体积大豆油充分混合,使用剪切机以10 000 r/min均质1 min。取100 μL底部乳液,加入5 mL 0.1% SDS溶液,并选择500 nm下测定其吸光值。随后,等待10 min后重复以上步骤,EAI和ESI的计算如公式(7)和公式(8)所示:
(7)
式中:A0,乳液在0 min时的吸光度;w,所用蛋白质的质量浓度,g/mL;φ,乳液的油体积比;N,稀释倍数。
(8)
式中:A0,乳液在0 min时的吸光度;A10,10 min后乳液的吸光度。
1.2.3.4 FC和泡沫稳定性测定
起泡性(foaming capcity, FC)和泡沫稳定性参考RAGAB等[16]的方法进行并加以修改。将2.5 g AP/BP蛋白样品分别溶解到50 mL蒸馏水中,将蛋白质与蒸馏水按料液比1∶20(g∶mL)混合,并调至相应pH值至3、5、7、9和11,使用剪切机以10 000 r/min均质1 min,在停止均质时迅速记录此时泡沫的体积;静置10 min后,再次记录泡沫的体积,FC和FS的计算如公式(9)和公式(10)所示:
(9)
(10)
式中:V0,样品溶液原体积,mL;V1,均质1 min后泡沫体积,mL;V2,均质静置10 min后泡沫体积,mL。
1.2.4 AP和BP微观结构观察
取适量待测样品,在氩气环境条件下,对冻干的样品进行喷金处理后,使用热场电子显微镜观察[17]。
1.3 数据处理
所有测量均重复3次,结果以“平均值±标准差![]() 表示,数据采用Excel 2010分析和Origin 2018软件进行绘图。
表示,数据采用Excel 2010分析和Origin 2018软件进行绘图。
2 结果与分析
2.1 pH调节法制备碧根果蛋白的最佳溶出pH值和沉淀pH值
pH值对碧根果蛋白溶出率的影响如图1-a所示,当pH值由1增大至7时,蛋白溶出率呈先升高后降低的趋势。pH值为3时,溶出率最低,表明碧根果蛋白的等电点接近3。当pH升高或降低时,溶出率增加,在pH值为2.0溶出率最高。这可能是pH值为2时蛋白质(氨基酸)的质子化程度较高,这使得它们之间的排斥性更大,从而有利于它们向周围溶液迁移[18]。在碱性pH下,随着提取pH的升高,蛋白质的溶出率显著提高。这表明蛋白质在更极端的碱性条件下更容易被溶出。在碱性环境中,蛋白质溶出率在pH 12时最高,为(53.01±0.02)%。然而,提取pH继续增大会导致溶出率降低,样品在pH 12~13时的溶出率明显下降。这可能是由于蛋白质在较高的碱性pH下出现变性和水解[19]。综上,酸溶蛋白和碱溶蛋白的最佳溶出pH值分别为2.0和12.0。

a-溶出率;b-回收率
图1 pH对AP和BP溶出率及沉淀回收率的影响
Fig.1 Effects of pH on dissolution rate and precipitation recovery of AP and BP
注:不同大小写字母表示差异显著(P<0.05)。
图1-b分析了在pH值为12和pH值为 2条件下溶出的碧根果蛋白的分别在pH值为 2~7和pH值为 7~13的沉淀特性。BP在pH 值为3~4时沉淀回收率最高,在pH 值为7时最低。AP在pH值为 12时沉淀回收率最高,在pH 值为7时最低,这表明中性、弱酸性和弱碱性环境均不利于蛋白的沉淀。在酸性条件下,BP的沉淀量在pH值为 3时达到最大值;在碱性条件下,AP的沉淀量在pH 值为12时达到最大值。因此选择pH值为 12、pH 值为3分别作为AP和BP的沉淀pH值,即pH调节法制备AP的条件为pH 值为2溶出、pH值为 12沉淀,BP的条件为pH 值为12溶出、pH 值为3沉淀。
2.2 AP和BP的分子质量
由图2可知,在14 k~22 kDa、31 k~43 kDa和43 k~75 kDa范围内,蛋白质AP和BP均显示有亚基的分布,这表明它们在分子质量上相对相似。具体而言,AP在15 k~75 kDa范围内的亚基条带分布显著,分别位于18、20、35、51、66 kDa,而BP则主要呈现3个条带,分子质量分别为20、35、49 kDa。这一差异的原因在于碧根果粕中存在具有不同等电点的蛋白质,另外AP大部分蛋白质亚基集中在22 kDa以下,可能是因为蛋白质更多地解离成更多的亚基[18]。可见,AP和BP的亚基组成上存在一定差异。
1-AP;2-BP
图2 AP和BP的电泳图
Fig.2 SDS-PAGE of AP and BP
2.3 AP和BP游离巯基和二硫键含量
巯基是蛋白质中的一种重要功能性基团,紧密关联着蛋白质的生物活性、氧化状态以及蛋白质的变性程度。由表1可知,AP和BP的游离巯基含量分别为16.61和14.58 μmol/g,可能是因为提取pH的不同而导致各蛋白的游离巯基含量产生差异。蛋白质的空间结构和功能性质受到二硫键含量的影响,高二硫键含量的蛋白质更有助于形成稳定的网络结构[20]。表1结果还表明,AP的二硫键含量为1.40 μmol/g,稍稍高于BP,蛋白结构也可能比BP更稳定。
表1 AP和BP的游离巯基、二硫键、持水性和持油性
Table 1 Free sulfhydryl groups, disulfide bonds, and water and oil holding capacity of AP and BP

蛋白游离巯基/(μmol/g)二硫键/(μmol/g)OHC/(g/g)WHC/(g/g)AP16.61±0.76a1.40±0.19a3.73±0.27b4.70±0.30aBP14.58±0.18b1.34±0.06b3.79±0.03a4.08±0.11b
注:不同小写字母表示差异显著(P<0.05)。
2.4 AP和BP的加工特性
2.4.1 溶解性
蛋白质的溶解性受溶液pH值的影响,这也影响着蛋白质的加工特性。由图3可知,AP在pH值为3时溶解度最高,达到76.77%;但随着pH值的增加而下降,当pH值为11时溶解度最低,仅为21.31%;而BP恰恰相反,BP在pH 值为3时溶解度最低,仅为14.20%;随pH值的增加而升高,并且在pH值为 7后溶解度显著提升,在pH值为 11时达到94.75%。这是由于,pH值为3和11更接近BP、AP的等电点,等电点处的溶解度低是由于肽的净电荷为零,疏水相互作用对蛋白质的静电排斥低,表面疏水性增加[21]。

图3 pH对AP和BP溶解度的影响
Fig.3 Effects of pH on solubilities of AP and BP
2.4.2 WHC和OHC
WHC衡量蛋白质与水结合的能力,与蛋白质分子的组成和构象有关,并影响产品的质地、口感和黏度等[22]。由表1可知,AP和BP持水性分别为4.70 g/g和4.08 g/g,2种蛋白具有不同的蛋白质结构和亲水性碳水化合物,因此AP、BP表现出不同的WHC。黏性食品的适宜WHC值为1.49~4.72 g/g[23],而AP、BP的WHC值均在此范围内,因此可将AP、BP应用于黏性食品中以补充蛋白质。
OHC与风味保持、保质期和乳化性能密切相关[24]。AP和BP的持油性分别为3.73 g/g和3.79 g/g,高于其他植物蛋白,如商业大豆分离物(3.29 g/g)、芝麻蛋白(1.5 g/g)和银杏叶籽蛋白(2.95 g/g)[16]。这些结果表明,AP和BP具有较好的持水性和持油性,可用于碎肉配方、肉类替代品和填充剂,以及香肠、烘焙产品、蛋糕面糊、蛋黄酱和沙拉酱等食品的生产加工。
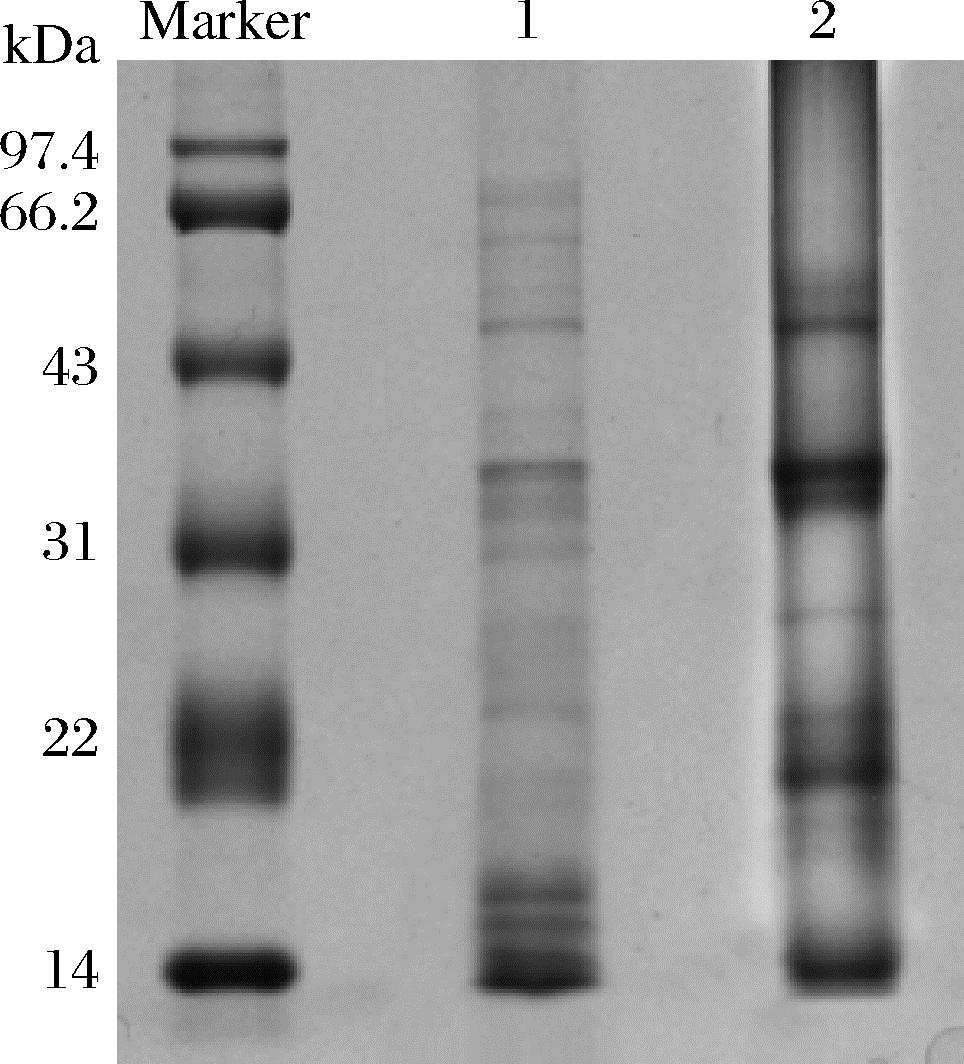
2.4.3 FC和FS
FC是指悬浮液混合后体积增加的百分比,显示液体溶液与空气之间的相互作用;而FS是指泡沫形成后保持其体积的时间变化[24]。由图4可知,AP和BP的FC和FS值在pH值为11和3处均最低。这可能是由于等电点处蛋白质在水-空气界面扩散并形成气泡的能力受到限制,蛋白质溶解度低,减少了水-蛋白质的相互作用,阻碍了蛋白质结构的去折叠,从而减少了空气包封[25];当2种蛋白远离pH值为 3或11时,FC、FS都有所提高,这可能是在酸和碱环境中,由于蛋白质的净电荷较高,蛋白质的溶解度和表面活性得到加强,从而产生更好的发泡性能[4];当pH值大于9时,BP的FS降低,这可能是由于肽受到离子排斥所导致的。pH改变了蛋白质分子的构象,从而改变了泡沫的泡沫稳定性[26]。
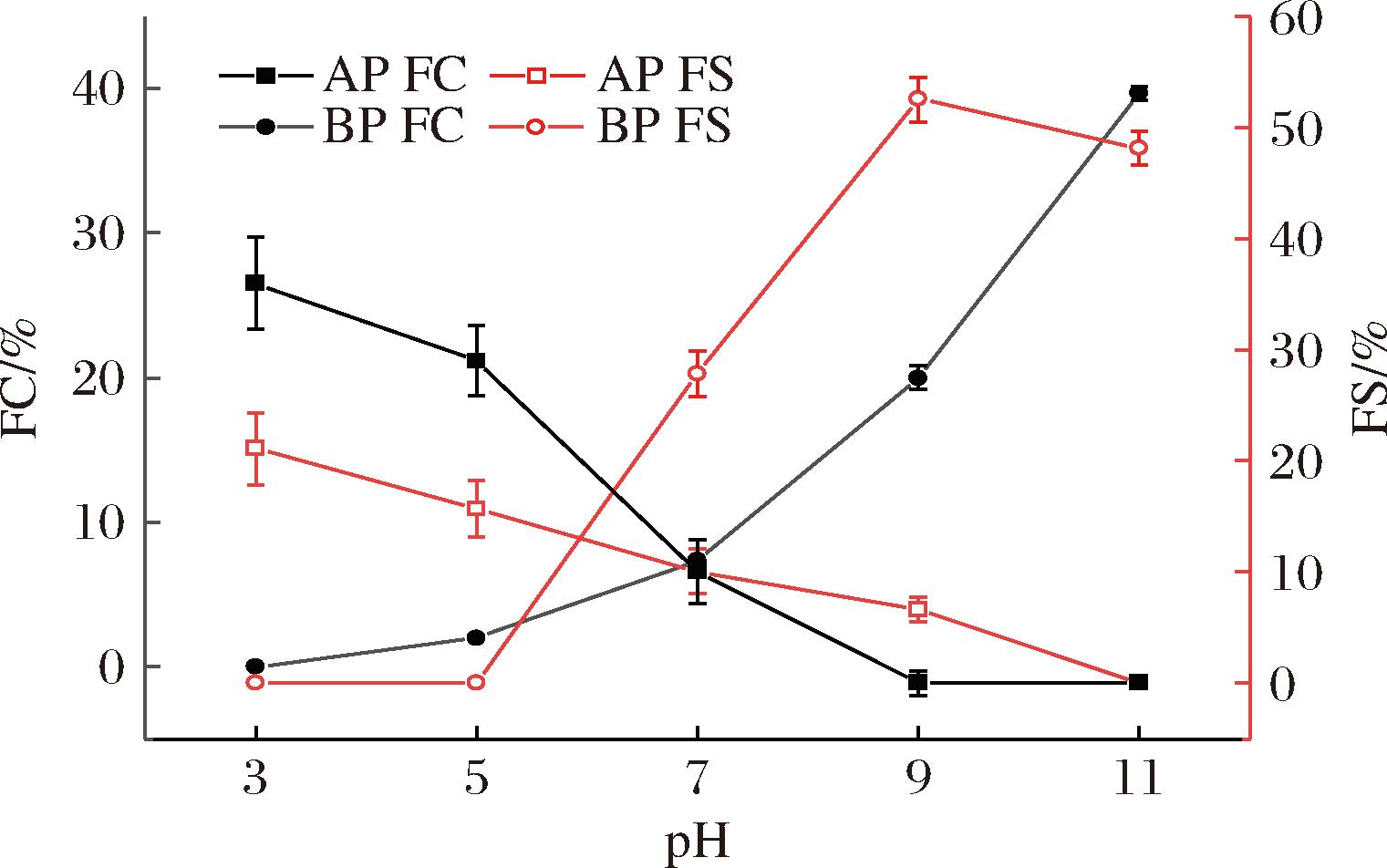
图4 pH值对AP和BP FC和FS的影响
Fig.4 Effects of pH on the foaming properties and foaming stability of AP and BP
2.4.4 EAI和ESI
EAI是蛋白质在乳液制备过程中在油/水界面吸附的能力,而ESI是蛋白质保持乳液稳定的能力[27]。如图5所示,BP比AP表现出更好的EAI,表明AP降低界面张力并在油滴周围形成保护屏障的能力受到一定限制,这很可能是因为提取过程中的酸处理导致蛋白质变性和不溶性,从而降低了其乳化能力[28]。随着AP和BP的pH值远离3和11,EAI都有所提高,可能与蛋白质的溶解性相关。
图5 pH值对AP和BP EAI和ESI的影响
Fig.5 Effects of pH on emulsification activity and emulsion stability of AP and BP
当pH值为3和11时,BP、AP的ESI达到最低。这可能是由于蛋白质的溶解度减小,导致在O/W界面吸附的蛋白质减少,进而稳定界面的薄膜受到破坏,发生絮集,从而导致ESI值的减小。当随着pH值偏离等电点,使得更多的蛋白质吸附到油水界面处,形成的界面膜之间的静电斥力变大,有助于抑制它们的合并作用,从而提高了乳化稳定性[29]。
2.5 AP和BP的微观结构
AP和BP 2种蛋白的微观结构如图6所示,它们之间存在明显的差异。AP结构呈现不规则的聚集状态,颗粒内部结合紧密,未观察到明显的孔洞。BP的微观结构疏松多孔且形成许多不同形状和大小蛋白颗粒,这可能是由于碱性条件下相互作用力的增加,形成光滑的结构特性。表明这2种蛋白质的表面结构存在显著差异。

a-AP;b-BP
图6 AP和BP的SEM图
Fig.6 SEM images of AP and BP
3 结论
本研究采用pH调节法制备了碧根果AP和BP,AP的制备条件为pH值为 2.0时溶出、pH 值为12时沉淀,BP的制备条件为pH 值为12.0时溶出、pH 值为3时沉淀。在分子结构方面,AP大部分蛋白质亚基集中在22 kDa以下;BP亚基分子质量集中为20、35、49 kDa。AP游离巯基和二硫键含量为16.61和1.40 μmol/g,BP为14.58和1.34 μmol/g。在加工特性方面,AP蛋白在pH值为3时溶解性最高,BP蛋白则在pH 值为11时溶解性最高;AP WHC高于BP,OHC与之相反;BP在pH值为3~11 FC、EAI均高于AP;AP微观形貌呈现不规则形状,BP呈现表面光滑疏松多孔的大片状结构。AP更适合应用于酸性饮料等食品中,而BP更适合应用于冰淇淋等对起泡性质要求高的食品中。
[1] 张源生. 不同脱皮方式对碧根果蛋白结构和特性的影响[J].食品科技, 2022, 47(10):120-127.
ZHANG Y S.Effects of different peeling methods on the structure and properties of pecan protein[J].Food Science and Technology, 2022, 47(10):120-127.
[2] LI X Y, GUO M L, CHI J T, et al.Bioactive peptides from walnut residue protein[J].Molecules, 2020, 25(6):1285.
[3] PANYAM D, KILARA A.Enhancing the functionality of food proteins by enzymatic modification[J].Trends in Food Science &Technology, 1996, 7(4):120-125.
[4] MAKRI E A, DOXASTAKIS G I.Emulsifying and foaming properties of Phaseolus vulgaris and coccineus proteins[J].Food Chemistry, 2006, 98(3):558-568.
[5] SORGENTINI D A, WAGNER J R, ANON M C.Effects of thermal treatment of soy protein isolate on the characteristics and structure-function relationship of soluble and insoluble fractions[J].Journal of Agricultural and Food Chemistry, 1995, 43(9):2471-2479.
[6] NOLSØE H, UNDELAND I.The acid and alkaline solubilization process for the isolation of muscle proteins:State of the art[J].Food and Bioprocess Technology, 2009, 2(1):1-27.
[7] JIANG J, XIONG Y L, CHEN J.pH shifting alters solubility characteristics and thermal stability of soy protein isolate and its globulin fractions in different pH, salt concentration, and temperature conditions[J].Journal of Agricultural and Food Chemistry, 2010, 58(13):8035-8042.
[8] KRISTINSSON H G, INGADOTTIR B.Recovery and properties of muscle proteins extracted from Tilapia (Oreochromis niloticus) light muscle by pH shift processing[J].Journal of Food Science, 2006, 71(3):132-141.
[9] 吉钦, 潘利华, 李贺兴, 等.红外预处理对低温压榨碧根果油品质及贮藏稳定性的影响[J].食品科学, 2024,45(4):257-263.
JI Q, PAN L H, LI H X, et al.Effects of infrared pretreatment on qualities and storage stabilities of low temperature pressed pecan oil[J].Food Science, 2024,45(4):257-263.
[10] SURASANI V K R, TYAGI A, KUDRE T.Recovery of proteins from rohu processing waste using pH shift method:Characterization of isolates[J].Journal of Aquatic Food Product Technology, 2017, 26(3):356-365.
[11] 赵琼, 陈越, 施亚楠, 等.盐法结合两步分级沉淀法提取辣木籽蛋白质工艺优化[J].食品工业, 2019, 40(8):19-24.
ZHAO Q, CHEN Y, SHI Y N, et al.Optimization of extraction process of moringaoleifera seed protein by salt method combined with two-step fractionation precipitation method[J].The Food Industry, 2019, 40(8):19-24.
[12] WU J J, ZHOU X, ZHOU L, et al.Physicochemical, structural, and functional properties of protein fractions and protein isolate from jackfruit seeds[J].Journal of Food Science, 2022, 87(4):1540-1551.
[13] HU H F, FAN T, ZHAO X Y, et al.Influence of pH and salt concentration on functional properties of walnut protein from different extraction methods[J].Journal of Food Science and Technology, 2017, 54(9):2833-2841.
[14] YU J M, AHMEDNA M, GOKTEPE I.Peanut protein concentrate:Production and functional properties as affected by processing[J].Food Chemistry, 2007, 103(1):121-129.
[15] DROZ OWSKA E, WERONIS M, BARTKOWIAK A.The influence of thermal hydrolysis process on emulsifying properties of potato protein isolate[J].Journal of Food Science and Technology, 2020, 57(3):1131-1137.
OWSKA E, WERONIS M, BARTKOWIAK A.The influence of thermal hydrolysis process on emulsifying properties of potato protein isolate[J].Journal of Food Science and Technology, 2020, 57(3):1131-1137.
[16] RAGAB D M, BABIKER E E, ELTINAY A H.Fractionation, solubility and functional properties of cowpea (Vigna unguiculata) proteins as affected by pH and/or salt concentration[J].Food Chemistry, 2004, 84(2):207-212.
[17] LI Y H, CHENG Y, ZHANG Z L, et al.Modification of rapeseed protein by ultrasound-assisted pH shift treatment:Ultrasonic mode and frequency screening, changes in protein solubility and structural characteristics[J].Ultrasonics Sonochemistry, 2020, 69:105240.
[18] GERLIANI N, HAMMAMI R, AÏDER M.Assessment of the extractability of protein-carbohydrate concentrate from soybean meal under acidic and alkaline conditions[J].Food Bioscience, 2019, 28:116-124.
[19] 李婷. 核桃粕蛋白提取工艺研究[D].乌鲁木齐:新疆农业大学, 2015.
LI T.Study on extraction technology of walnut meal protein[D].Urumqi:Xinjiang Agricultural University, 2015.
[20] 李涛. 青稞蛋白质的提取及其特性研究[D].郑州:河南工业大学, 2010.
LI T.Study on extraction and characteristics of protein from highland barley[D].Zhengzhou:Henan University of Technology, 2010.
[21] SORGENTINI D A, WAGNER J R.Comparative study of foaming properties of whey and isolate soybean proteins[J].Food Research International, 2002, 35(8):721-729.
[22] MOURE A, SINEIRO J, DOM NGUEZ H, et al.Functionality of oilseed protein products:A review[J].Food Research International, 2006, 39(9):945-963.
NGUEZ H, et al.Functionality of oilseed protein products:A review[J].Food Research International, 2006, 39(9):945-963.
[23] ALETOR O, OSHODI A A, IPINMOROTI K.Chemical composition of common leafy vegetables and functional properties of their leaf protein concentrates[J].Food Chemistry, 2002, 78(1):63-68.
[24] DENG Q C, WANG L, WEI F, et al.Functional properties of protein isolates, globulin and albumin extracted from Ginkgo biloba seeds[J].Food Chemistry, 2011, 124(4):1458-1465.
[25] NGO N T T, SHAHIDI F.Functional properties of protein isolates from Camelina (Camelina sativa (L.) Crantz) and flixweed (Sophia, Descurainis sophia L.) seed meals[J].Food Production, Processing and Nutrition, 2021, 3(1):31.
[26] SANDOVAL-OLIVEROS M R, PAREDES-L PEZ O.Isolation and characterization of proteins from Chia seeds (Salvia hispanica L.)[J].Journal of Agricultural and Food Chemistry, 2013, 61(1):193-201.
PEZ O.Isolation and characterization of proteins from Chia seeds (Salvia hispanica L.)[J].Journal of Agricultural and Food Chemistry, 2013, 61(1):193-201.
[27] 王海东, 张红印, 曹珺, 等.五味子四种组分蛋白结构、理化性质和功能特性比较[J].食品与发酵工业, 2024, 50(2):67-77.
WANG H D, ZHANG H Y, CAO J, et al.Comparison of protein structure, physicochemical properties, and functional properties of four components in Schisandra chinensis[J].Food and Fermentation Industries, 2024, 50(2):67-77.
[28] ALBE-SLABI S, MESIERES O, MATHÉ C, et al.Combined effect of extraction and purification conditions on yield, composition and functional and structural properties of lupin proteins[J].Foods, 2022, 11(11):1646.
[29] 张锋, 王美玉, 薛静雯, 等.不同pH及离子强度对葡萄籽分离蛋白功能特性的影响[J].食品科技, 2019, 44(9):277-282.
ZHANG F, WANG M Y, XUE J W, et al.Effects of different pH and ionic strength on functional properties of grape seed protein isolate[J].Food Science and Technology, 2019, 44(9):277-282.