魔芋,多年生宿根草本植物,天南星科魔芋属。主要集中种植于我国西南地区及非洲、印度等国家。魔芋中的主要成分为魔芋葡甘露聚糖(konjac glucomannan,KGM),其具有良好的胶凝性、成膜性、亲水性和增稠性,还是一种可溶性的膳食纤维,同时具有良好的生物活性[1-2]。目前,国内外主要集中于对KGM功能特性的研究。但在实际生产中,魔芋中其他组成成分(淀粉、蛋白质等)也有着一定的应用价值,例如将鲜魔芋磨浆加入食用碱后制作成魔芋豆腐[3],但鲜魔芋中生物碱的存在会引起人体的过敏反应,直接触碰新鲜魔芋球茎手指会有灼烧感。因此,新鲜魔芋脱除生物碱可以扩大其在食品药品等方面的应用。
生物碱是自然界中一类含氮的碱性有机化合物,张忠良等[4]研究发现魔芋皮层总生物碱含量为0.28%,球茎总生物碱含量为0.134%。目前,魔芋中生物碱脱除的方法主要是采用乙醇连续洗脱的湿法加工方式,存在着乙醇用量大和脱除时间长的问题。相较于传统的脱除方法,超声波和微波辅助脱除的效率更高,符合绿色工艺的概念,超声波的空化效应造成细胞壁的破裂,加速目标化合物进入溶剂中,增加溶质与溶剂的接触,从而提高脱除效率[5]。微波通过渗透到细胞内部产生热量,细胞在高温下破裂,目标化合物进入溶剂中[6]。虽然这两种方法都可以提高效率,但也存在超声波无法控温和微波加热不均匀的缺点。超声波-微波协同辅助可以弥补两者单独脱除时的缺点,并缩短脱除时间[6]。目前,超声波-微波协同辅助已广泛应用在樱桃花青素[6]、蓖麻子油[7]、苜蓿汁抗氧化成分[8]等天然产物的提取,但超声波-微波协同辅助对脱除魔芋生物碱的效果及对魔芋粉理化性质和微观结构的影响,尚未清楚。
因此,本研究通过单因素和正交试验探究超声波-微波协同辅助对魔芋中生物碱的脱除效果,通过色泽、傅里叶红外光谱、X射线衍射、扫描电镜、相对分子质量和流变学等实验方法比较超声波辅助、微波辅助和酸性酒精辅助处理后魔芋全粉的理化性质。为鲜魔芋生物碱的脱除和获得品质较好的魔芋全粉提供新工艺参考和理论支持。
1 材料与方法
1.1 材料与试剂
珠芽金魔芋,云南勐海;HCl、NaOH、无水乙醇、三氯甲烷、溴甲酚绿、柠檬酸、柠檬酸钠、碘化铋钾均属于分析纯,成都市科隆化学品有限公司。
1.2 仪器与设备
XH-300B微波超声波组合合成萃取仪器,北京祥鹄科技发展有限公司;Phenom Pro扫描电镜,荷兰Phenom World公司;DHR-1流变仪,美国TA公司;AXTG16G型离心机,盐城市安信实验仪器有限公司;Spectrum100红外光谱仪,美国Perking Elmer公司;TU-1950双光束紫外-可见分光光谱仪,北京普析通用仪器有限责任公司;Bruker D8Advance X 射线衍射仪,德国布鲁克分析仪器公司。
1.3 试验方法
1.3.1 样品的前处理
将新鲜的魔芋洗净,去皮,切成大小均匀的小块,便于后续称重。
1.3.2 总生物碱的脱除
取5 g新鲜的魔芋切块,按1∶20(g∶mL)加入75%(体积分数)的乙醇,乙醇预先用50%(体积分数)HCl溶液调节pH值为2。在50 ℃,超声功率600 W、微波功率500 W下脱除30 min后,离心(8 000 r/min,15 min),收集上清液,将上清液在50 ℃下旋转蒸发得到胶质,用2%(体积分数,下同)HCl溶解后再用100 g/L的NaOH溶液调节pH值为10,氯仿萃取,萃取液于4 ℃下保存备用。
1.3.2.1 生物碱检测方法
标准曲线制作方法为分别取10 mg/L盐酸小檗碱标准溶液0、0.2、0.4、0.6、0.8、1.0 mL加去离子水至1 mL,依次加入3 mL溴甲酚绿、4 mL柠檬酸-柠檬酸钠缓冲液、5 mL三氯甲烷充分振荡摇匀1 min,静置1 h后在417 nm下测定吸光度。测得的标准曲线为Y=0.025X-0.011,相关系数R2=0.992 3(n=6)。
生物碱的测定方法选用酸性染料比色法,取生物碱脱除液1 mL,分别加入溴甲酚绿3 mL、柠檬酸-柠檬酸钠缓冲液4 mL、三氯甲烷5 mL后充分振荡摇匀1 min,静置1 h后在417 nm下测定吸光度。
测定单次脱除生物碱含量时不同脱除方式的单次脱除时间为40 min,生物碱脱除效果采用碘化铋钾进行沉淀反应。
1.3.2.2 单因素试验
在超声波-微波协同辅助脱除魔芋生物碱的单因素试验中,将脱除温度固定为50 ℃,考察料液比(1∶10~1∶35, g∶mL)、超声波功率(300~900 W)、微波功率(300~700 W)、脱除时间(10~50 min)、乙醇体积分数(55%~95%)5个因素对生物碱脱除效果的影响。初始脱除条件为料液比1∶20(g∶mL)、超声波功率600 W、微波功率500 W、脱除时间30 min、乙醇体积分数75%。离心收集上清液,测定生物碱含量。生物碱含量计算如公式(1)所示:
生物碱含量![]()
(1)
式中:c,脱除液中生物碱质量浓度,mg/L;v,氯仿体积,mL;m,鲜魔芋质量,g。
1.3.2.3 正交试验
在单因素试验的基础上,选取超声波功率(A)、微波功率(B)、脱除时间(C)、乙醇体积分数(D)进行L9(34)正交试验,优化超声波-微波协同辅助脱除生物碱的工艺条件,因素水平见表1。
表1 正交试验设计
Table 1 Orthogonal array design
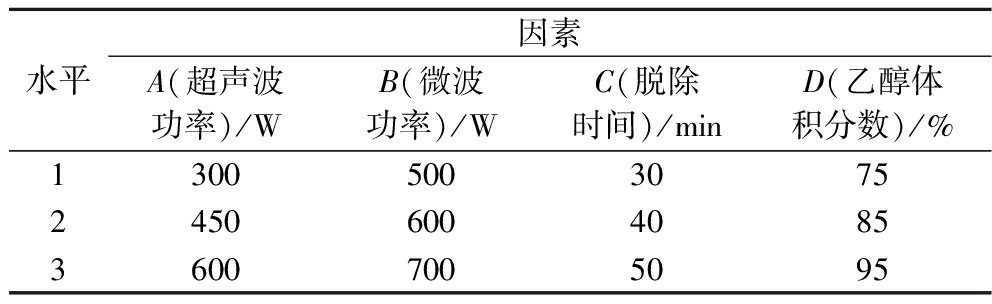
水平因素A(超声波功率)/WB(微波功率)/WC(脱除时间)/minD(乙醇体积分数)/%130050030752450600408536007005095
1.3.3 魔芋全粉的制备
分别采用酸辅助(acidity alcohol elution,AAE)、微波辅助(microwave-assisted elution,MAE)、超声波辅助(ultra-sound assisted elution,UAE)和优化的超声波-微波协同辅助(ultrasound-microwave-assisted elution,UMAE)脱除魔芋生物碱,并比较不同方法的脱除效果,其中UAE、MAE采用正交优化后的组合,AAE根据龙德清等[9]的方法稍作改变,脱除温度为50 ℃,单次脱除时间为1.5 h。将经过不同处理后的匀浆离心,弃去上清液,在60 ℃下热风干燥1.5 h,用研钵将样品磨成粉末状,过80目筛(粒度≤0.185 mm)后即得到待测的魔芋全粉。并将未经任何处理直接打浆烘干过筛后的样品命名为CK组。所有后续测定的魔芋全粉均为脱除生物碱的样品。
1.3.4 色泽分析
将样品装入透明自封袋中,利用校正好的色差仪测定样品L*、a*、b*值。白度值的计算如公式(2)所示:
(2)
1.3.5 红外光谱分析
将脱除生物碱后的魔芋全粉样品干燥研磨并过200目筛,取适量的样品进行测定,扫描背景为空气,光谱扫描范围设置为4 000~600 cm-1,分辨率为32 cm-1。
1.3.6 X射线衍射(X-ray diffraction,XRD)分析
设置X射线衍射仪的扫描速度为5 °/min,样品在5°~60°(2θ)进行扫描并记录扫描数据。
1.3.7 KGM含量及相对分子质量
KGM含量按照NY/T 494—2010进行测定。
相对分子质量测试条件:将样品溶液(2 mg/mL)经0.45 μm滤膜过滤,再将20 mL滤液装入凝胶渗透色谱仪(gel permeation chromatography,GPC)中,柱温30 ℃,流速1.00 mL/min,流动相为超纯水。
1.3.8 扫描电镜(scanning electron microscope,SEM)分析
将经过生物碱脱除过后的魔芋全粉干燥研磨后,固定于导电胶上,喷金处理,用扫描电镜在放大5 000×倍数下观察经不同处理后样品的形貌[10]。
1.3.9 流变学分析
用TA流变仪测定脱除生物碱后的魔芋全粉样品的流变曲线。准确称取1.00 g魔芋全粉于烧杯中,加入10 mL去离子水,在60 ℃下搅拌60 min至完全溶胀,自然冷却至室温后于4 ℃保存24 h,测试前样品平衡至室温。
稳态流变测试条件:pp40平板,加载间隙1 mm,测试温度25 ℃,测试前平衡120 s,剪切速率0.1~100 s-1,用纸轻轻擦拭边缘多出的样品,并沿平板边缘涂抹一层二甲基硅油以防水分的蒸发[11]。
动态流变测试条件:pp40平板,加载间隙1 mm,测试温度25 ℃,测试前平衡120 s,形变量(γ)1%,扫描范围0.1~10 Hz[10]。
1.3.10 数据分析与处理
所有试验至少进行3次平行,结果以“平均值±标准差”的形式呈现。SPSS 27.0软件进行数据分析与处理,ANOVA进行显著性分析,P<0.05表示数据之间有显著性差异,Origin 2018进行绘图。
2 结果与分析
2.1 单因素试验结果分析
由图1-a所示,液固比对生物碱脱除含量的影响相较于其他因素并不明显,这与XIONG等[12]和CHEN等[13]的研究结果相似。考虑到乙醇的用量,将生物碱脱除的液固比固定为20∶1。由图1-b和1-c所示,脱除液中生物碱含量随着超声波功率和微波功率的增大而升高,趋势相同,当超声波功率达到450 W,微波功率达到600 W时,生物碱含量达到最大(分别为9.15 μg/g和7.55 μg/g),这是因为超声波空化强度的增加,造成细胞组织的破损,从而加速生物碱的浸出[14],而微波产生的高热量,会促进细胞破裂,从而增强魔芋生物碱在乙醇中的溶解[15]。当超声波功率超过450 W、微波功率超过600 W时,超声波空化强度增大的同时所伴随产生的强烈冲击波和剪切应力及微波增大带来的高热高压可能会损伤生物碱的结构,从而导致脱除液中生物碱含量下降。从能量损耗方面,选择450 W和600 W为超声波功率和微波功率单因素最佳数值。
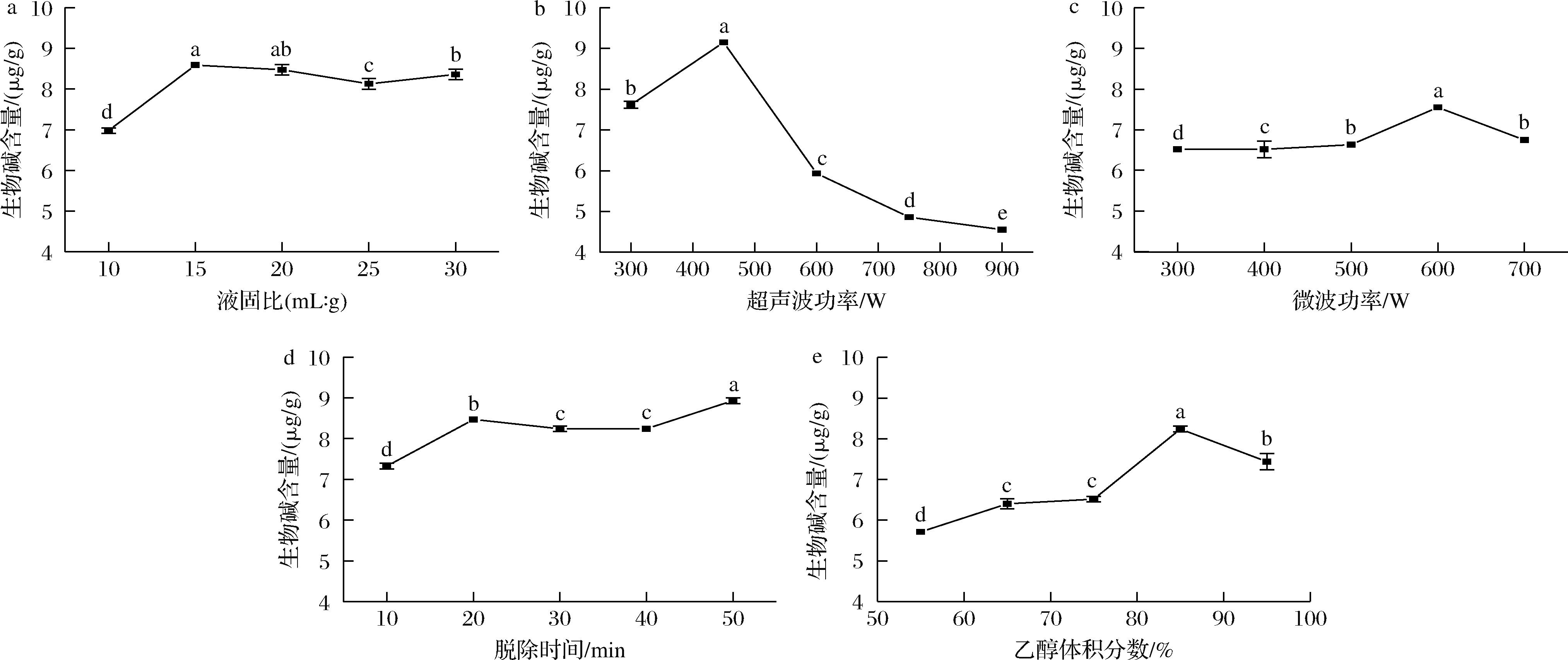
a-液固比;b-超声波功率;c-微波功率;d-脱除时间;e-乙醇体积分数
图1 液固比、超声波功率、微波功率、脱除时间、乙醇体积分数对魔芋生物碱脱除含量的影响
Fig.1 Effect of liquid-solid ratio, ultrasonic power, microwave power, removal time, and ethanol volume fraction on the removal concentration of konjac alkaloids
由图1-d所示,随着脱除时间从10 min增加到20 min,脱除液中生物碱含量快速增加,在20~50 min内生物碱含量缓慢增加,在溶液中生物碱浓度达到饱和之前,生物碱的浓度都随着脱除时间的延长而增加,脱除时间、超声波的空化作用和微波的高热量之间的协同作用能够有效促进生物碱的溶出[16]。选择50 min为脱除时间单因素最佳数值。
由图1-e所示,脱除液中生物碱含量随着乙醇体积分数的增大而升高,当乙醇体积分数达到85%时,生物碱含量达到最大,这与LEE等[17]的研究结果一致。使用乙醇-水混合物可以使细胞中的化学成分更好的进入溶剂[18]。同时水分通过促进细胞膨胀提高传质速率[19],由于乙醇体积分数达到95%时,水分含量过少导致生物碱含量的下降。考虑到原料损耗,选择85%作为乙醇体积分数单因素的最佳数值。
2.2 正交试验结果分析
正交试验结果见表2,方差分析结果见表3。4个因素对魔芋生物碱脱除含量均有显著影响(P<0.05)。4个因素对其影响程度为B(微波功率)>C(脱除时间)>D(乙醇浓度)>A(超声波功率)。最优水平分别为A3、B1、C2、D2,最优的脱除组合为A3B1C2D2。在该组合条件下魔芋生物碱的单次脱除含量为8.47 μg/g,因此魔芋生物碱的最佳脱除条件为超声波功率600 W、微波功率500 W、脱除时间40 min、乙醇体积分数85%。
表2 L9(34)正交试验设计统计分析
Table 2 L9(34) Orthogonal array design statistical analysis
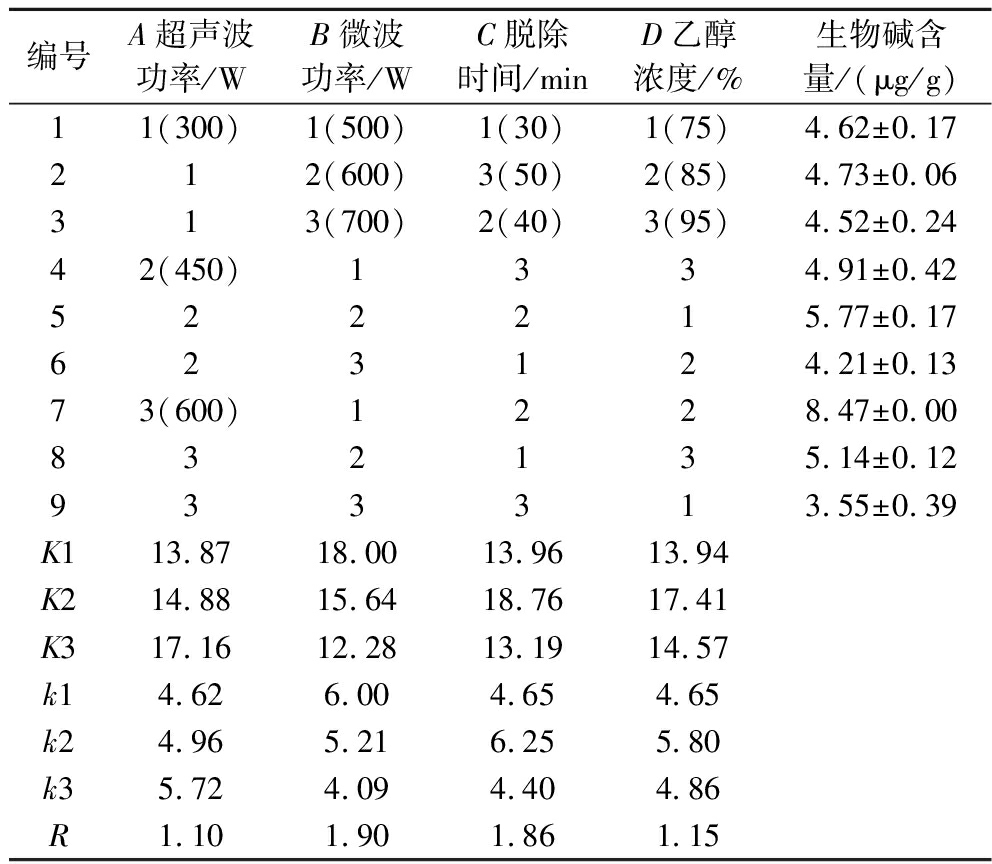
编号A超声波功率/WB微波功率/WC脱除时间/minD乙醇浓度/%生物碱含量/(μg/g)11(300)1(500)1(30)1(75)4.62±0.17212(600)3(50)2(85)4.73±0.06313(700)2(40)3(95)4.52±0.2442(450)1334.91±0.42522215.77±0.17623124.21±0.1373(600)1228.47±0.00832135.14±0.12933313.55±0.39K113.8718.0013.9613.94K214.8815.6418.7617.41K317.1612.2813.1914.57k14.626.004.654.65k24.965.216.255.80k35.724.094.404.86R1.101.901.861.15
表3 正交试验方差分析
Table 3 Orthogonal test analysis of variance
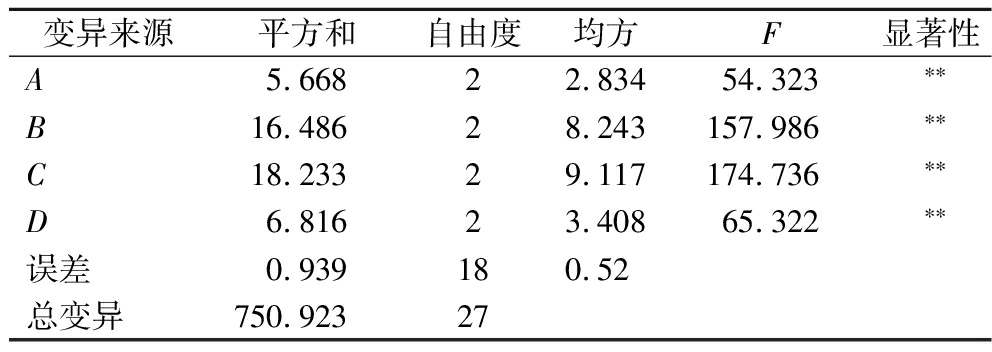
变异来源平方和自由度均方F显著性A5.66822.83454.323∗∗B16.48628.243157.986∗∗C18.23329.117174.736∗∗D6.81623.40865.322∗∗误差0.939180.52总变异750.92327
注:**表示差异极显著(P<0.01)。
2.3 不同方法脱除生物碱综合比较
图2-a为不同条件下单次脱除液中生物碱含量,其中UMAE组脱除液中生物碱含量为(8.47±0.00) μg/g,UAE组(4.33±0.03) μg/g,MAE组(4.25±0.02) μg/g,AAE组为(3.20±0.02) μg/g。UMAE组相较于UAE、MAE、AAE分别高出4.14、4.22、5.27 μg/g(P<0.05)。
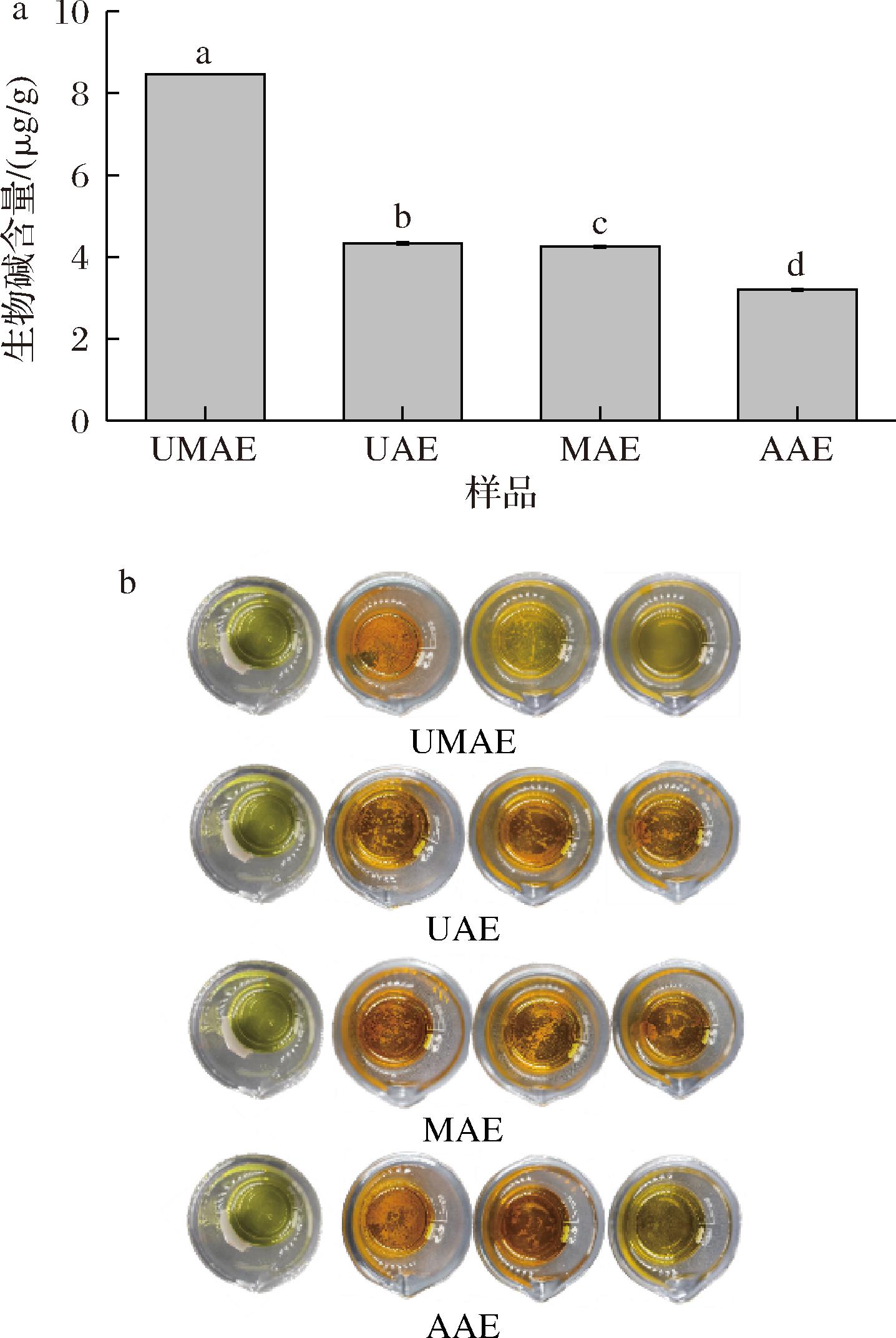
a-不同脱除方式单次脱除液生物碱含量比较;b-不同脱除方式脱除次数比较
图2 不同脱除方式脱除魔芋生物碱含量及脱除次数比较
Fig.2 Comparison of konjac alkaloid content and number of removals by different removal methods
注:图2-b最左列为HCl与碘化铋钾反应的空白对照组。
超声波-微波协同作用可以有效破坏细胞壁,加速生物碱在溶剂中的浸出,超声波-微波协同辅助可以更加高效的脱除魔芋中的生物碱。魔芋中乙醇脱除液被2% HCl溶解经活性炭脱色后,加入碘化铋钾进行沉淀反应,产生橘黄色沉淀物证明溶液中含有生物碱。图2-b为不同脱除方式脱除生物碱3次其脱除液依次的碘化铋钾沉淀反应,可以看出UMAE及AAE组经2次脱除后生物碱基本脱除完全,UAE、MAE组经3次脱除后生物碱基本脱除完全。虽然UMAE和AAE组均为脱除2次,但UMAE组单次脱除时间为40 min,而AAE组单次脱除时间为1.5 h,UMAE缩短了近乎一半的脱除时间。
2.4 色泽分析
色泽是评价魔芋粉的重要指标,在实际生产中与品质直接相关。由表4可知,经过超声波-微波协同辅助处理的魔芋全粉亮度值(L*)和白度值(W)最高,相较于对照组L*从89.77提高至94.03,W从24.72提高至73.83。产品外观偏白色也会更被消费者所接受,MAE组的L*相较于UAE组从90.83提高至93.17,这可能是因为微波可以降低酶活力,抑制褐变。UMAE、UAE、MAE、AAE组的a*和b*值都较CK组小,表明HCl与微波均可以抑制魔芋的酶促褐变,在酸性条件,多酚氧化酶的活性降低甚至不能存活,而微波可以通过快速地传热来达到灭酶效果[20]。
表4 不同脱除方式魔芋粉色泽参数
Table 4 Color parameters of konjac powder with different removal methods
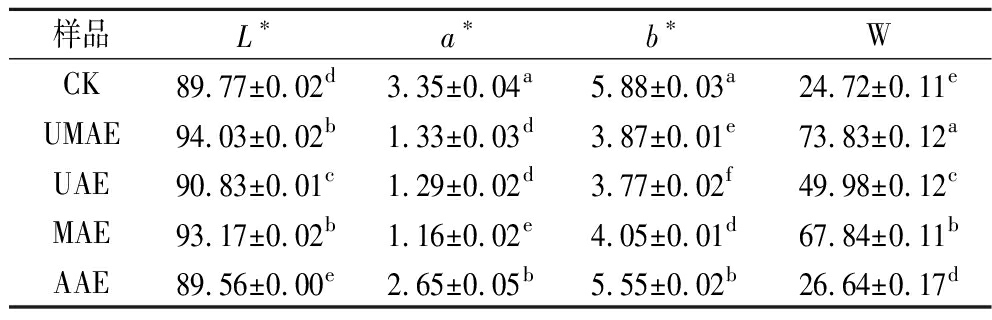
样品L∗a∗b∗WCK89.77±0.02d3.35±0.04a5.88±0.03a24.72±0.11eUMAE94.03±0.02b1.33±0.03d3.87±0.01e73.83±0.12aUAE90.83±0.01c1.29±0.02d3.77±0.02f49.98±0.12cMAE93.17±0.02b1.16±0.02e4.05±0.01d67.84±0.11bAAE89.56±0.00e2.65±0.05b5.55±0.02b26.64±0.17d
2.5 红外光谱分析
经过不同脱除方式脱除生物碱的魔芋全粉红外光谱如图3所示。魔芋全粉的红外谱图整体显示为魔芋多糖的峰值走势。3 290 cm-1附近的宽吸收峰是多糖的特征峰,来自于—OH的拉伸振动;2 920 cm-1附近的弱吸收峰归因于—CH的伸缩振动;1 620 cm-1左右的吸收峰对应于分子内氢键及—OH的弯曲振动;1 150 cm-1左右的峰对应吡喃糖环上醚基C—O—C的不对称拉伸振动;884 cm-1和822 cm-1处的特征峰分别来自β-糖苷键和甘露糖吡喃环的伸缩振动,用以表征β-甘露糖的特征吸收带[21-22]。由图3可知,经过超声波、微波处理的魔芋多糖与未经处理组的魔芋多糖的红外光谱峰型极其相似,这意味着多糖的大分子碳链骨架和一级重复单元结构不受超声波及微波的影响,其主要官能团没有发生改变[23]。
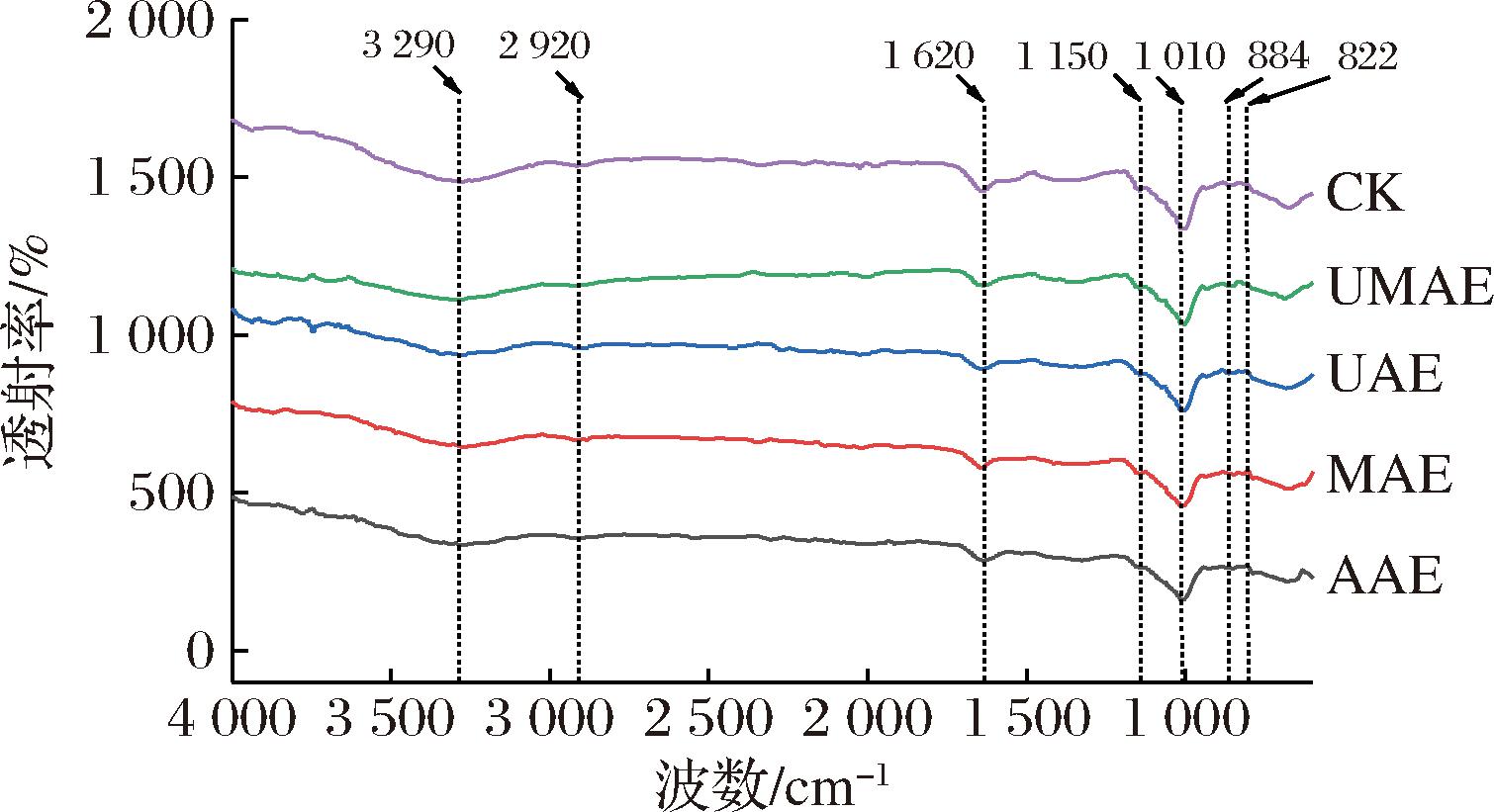
图3 不同脱除方式的魔芋全粉红外光谱图
Fig.3 FT-IR spctra of konjac powder with different removal methods
2.6 结晶结构分析
经过不同脱除方式脱除生物碱的的魔芋全粉XRD如图4所示。各样品间的衍射曲线除强度外均相同,衍射峰分别出现在14.9°、24.4°、30.1°和38.2°附近。与CK组相比,其余4组样品在乙醇体系中作用时间更长,衍射峰也更为尖锐。所有样品均是鲜魔芋与乙醇打浆后经60 ℃热风干燥得到的,乙醇的存在与全粉体系中的多糖竞争水分导致多糖被挤压,分子聚集内聚收缩,分子间氢键作用增强,形成局部短程有序的结构,表明乙醇可以促进魔芋全粉体系的结晶,从而产生尖锐的结晶峰[24]。乙醇体系中盐酸的存在导致38.2°附近的衍射峰增强,酸解会降低结晶度,破坏全粉体系的结晶面积[25]。YE等[26]研究结果表明超声波处理并不会改变魔芋多糖的结晶结构。LI等[27]在微波辅助臭氧对KGM进行氧化改性的研究中也表明微波并不会对魔芋多糖的结晶结构产生明显的改变。
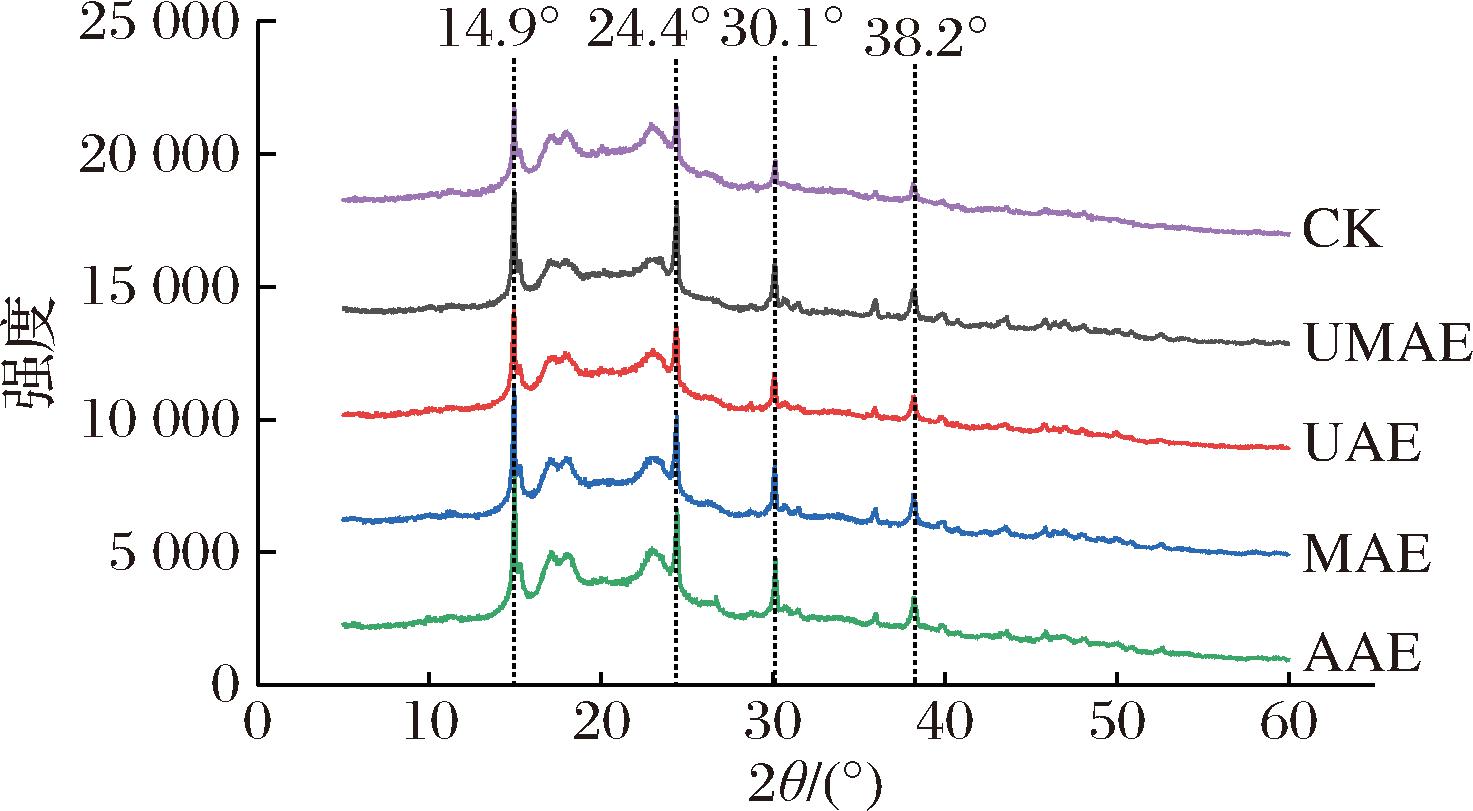
图4 不同脱除方式的魔芋全粉XRD图
Fig.4 The XRD of konjac powder with different removal methods
2.7 微观结构分析
通过SEM对魔芋全粉的微观结构进行表征,观察经过不同处理后魔芋全粉微观结构的变化。由图5可知,未经处理的魔芋全粉的颗粒表面较为完整光滑,超声波和微波造成颗粒表面的凹陷和裂缝。UMAE对全粉颗粒微观结构的影响最大,形态破坏也最为严重,这也从微观层面解释了超声波-微波协同辅助脱除生物碱效率最高的原因,超声波和微波能量侵蚀全粉颗粒在其表面产生了大量的孔洞,加速了生物碱的溶出。超声波辐射引起颗粒腔体坍塌反映在固体表面,微波处理造成多孔的原因可能是由于温度和压力的突然增加。固体表面和内部面积的增加也可以增大传质和传热速率。

图5 不同脱除方式的魔芋全粉SEM图
Fig.5 The SEM of konjac powder with different removal methods
2.8 KGM含量和魔芋全粉相对分子质量变化
5组样品中的KGM含量如图6所示,分别为51.39%、88.98%、77.21%、75.41%、64.48%,其中UMAE组的KGM含量显著高于其他4组(P<0.05)。相较于CK组,UAE、MAE组的KGM含量也显著升高,结合魔芋全粉的微观结构分析可见,经过超声波和微波的处理,全粉颗粒表面孔隙增加,促使聚集在魔芋球茎异细胞中的魔芋多糖释放[28]。
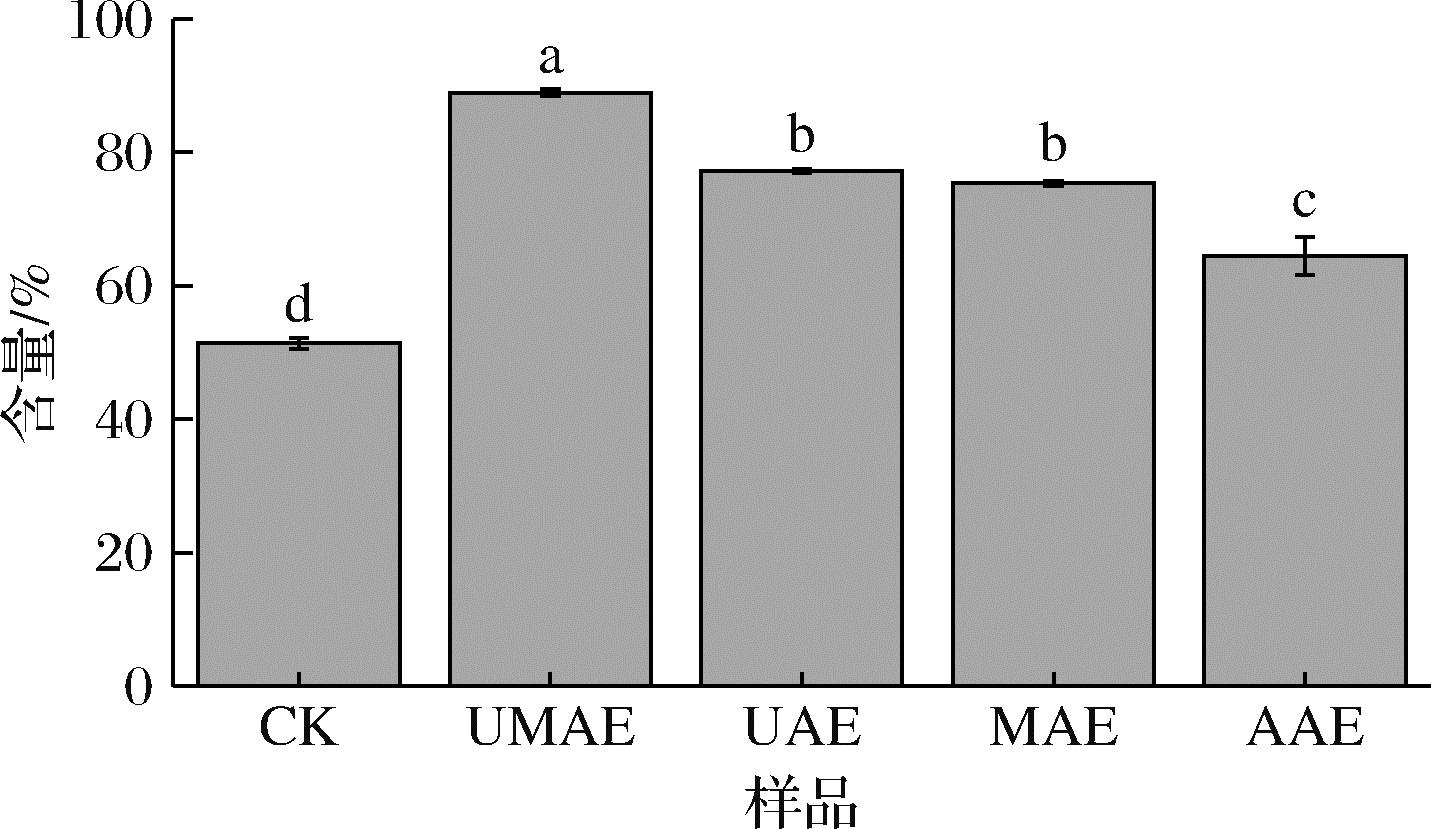
图6 不同脱除方式的魔芋全粉KGM含量
Fig.6 KGM content of konjac powder with different removal methods
在魔芋全粉中含有大分子质量的魔芋多糖,多糖作为可降解材料,其理化性质和生物活性与其相对分子质量的大小紧密相关。根据表5进行分析,UMAE组相较于UAE和MAE组分子质量降低是由于超声波作用导致液体中空化气泡快速塌陷产生的剪切力[29]和微波辐射带来的分子热效应造成糖苷键的断裂,相较于超声波和微波的单一作用,两者结合能够更加有效的降解多糖。CK组和AAE组分子质量较低是由于其魔芋多糖的含量显著降低。
表5 不同脱除方式魔芋全粉相对分子质量分布
Table 5 Relative molecular mass distribution of konjac powder with different removal methods

样品Mn/DaMw/DaMp/DaMz/DaPDI(Mw/Mn)CK1.02×1041.45×1041.86×1041.87×1041.42UMAE3.02×1043.42×1043.38×1043.80×1041.13UAE5.41×1055.47×1055.71×1055.53×1051.01MAE4.79×1055.01×1055.49×1055.18×1051.05AAE8.62×1049.19×1049.01×1049.75×1041.07
2.9 流变学分析
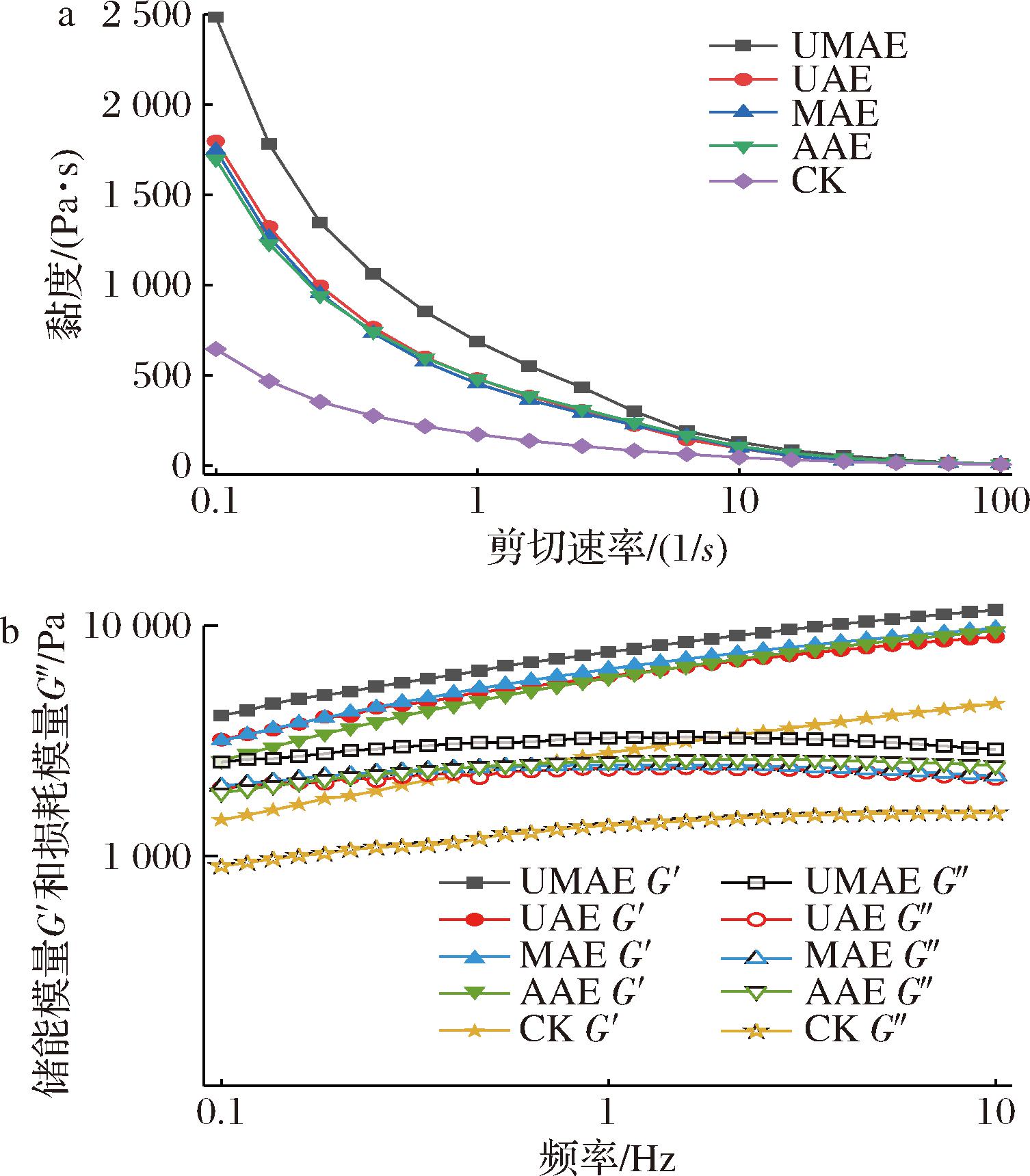
图7-a反映样品表观黏度的变化,在0.1~100 s-1的剪切速率内,样品的表观黏度均随着剪切速率的增加而减小,表现出剪切稀化的现象。属于典型的假塑性流体[10]。UMAE组的表观黏度明显高于其他几组样品,结合对魔芋全粉微观结构和相对分子量的分析,经过超声波-微波协同辅助处理后,一方面是由于UMAE组的KGM含量显著高于其他4组,另一方面颗粒表面和内部的孔洞可以促进多糖与水分子的结合。其余4组的表观黏度变化规律与不同处理方式对魔芋全粉相对分子质量影响相同。
a-表观黏度的变化;b-动态黏弹特性
图7 不同脱除方式对魔芋全粉流变学性能的影响
Fig.7 The rheological properties of konjac powder with different removal methods
图7-b反映样品的动态黏弹特性,在0.1~10 Hz的频率范围内,各组样品的储能模量G′均高于损耗模量G″,说明在整个剪切过程中魔芋全粉的水凝胶体系中弹性占主导,且魔芋水凝胶表现出类固体性质,这可能是由于流变测定时样品的浓度较高。随着频率的增加,G′和G″都迅速增大,相同频率下,UMAE组的G′和G″均高于其他组别,与表观黏度的趋势相同,说明经过超声波-微波协同辅助处理后,魔芋全粉形成的水凝胶网络结构更稳定,抗击形变的能力更强。
3 结论
本试验采用超声波-微波协同辅助探讨了不同脱除方式对魔芋生物碱的脱除效果,以及对魔芋全粉色泽、流变学特性和微观结构的影响,得到如下结论:
1)超声波功率、微波功率、脱除时间和乙醇体积分数对魔芋生物碱的脱除含量具有极显著性(P<0.01)的影响,最优组(超声波功率600 W、微波功率500 W、脱除时间40 min、乙醇体积分数85%)脱除2次后生物碱基本被脱除干净,与UAE、MAE、AAE组相比,缩短了脱除时间并减少了乙醇用量。
2)超声波-微波协同脱除生物碱后的魔芋全粉亮度和白度达到94.03和73.83,色泽更好;红外光谱分析可知多糖的基本结构单元未被破坏;XRD分析可知,全粉体系的短程结构更有序;微观结构显示其具有更细密的孔隙,加速生物碱和魔芋多糖的溶出,增加与溶剂接触面积;魔芋全粉中KGM显著增加,全粉的相对分子质量降低;流变分析表明魔芋全粉体系表观黏度更高,且具有更稳定的凝胶网络结构,水凝胶抗形变能力更强。
因此,经过超声波-微波协同辅助处理可以更高效绿色地脱除魔芋中的生物碱,获得更高品质的魔芋全粉,有助于扩大魔芋的应用范围。
[1] 谢建华, 庞杰, 朱国辉, 等.魔芋葡甘聚糖功能研究进展[J].食品工业科技, 2005, 26(12):180-183.
XIE J H, PANG J, ZHU G H, et al.Research advances of konjac glucomannan functions[J].Science and Technology of Food Industry, 2005, 26(12):180-183.
[2] 钟刚琼, 盛德贤, 滕建勋, 等.魔芋食品的开发利用与研究进展[J].食品研究与开发, 2005, 26(1):106-108.
ZHONG G Q, SHENG D X, TENG J X, et al.The newest research development and the development of konjac food[J].Food Research and Development, 2005, 26(1):106-108.
[3] 张忠良. 用鲜魔芋制作魔芋豆腐技术[J].农村百事通, 2013(16):32.
ZHANG Z L.Technology of making konjac tofu with fresh konjac[J].Nongcun Baishitong, 2013(16):32.
[4] 张忠良, 王照利, 吴万兴.魔芋中总生物碱提取试验[J].食品工业科技, 2004, 25(9):101-103.
ZHANG Z L, WANG Z L, WU W X.Extraction of konjak whole alkaloid[J].Science and Technology of Food Industry, 2004, 25(9):101-103.
[5] DIAS A L B, DE AGUIAR A C, ROSTAGNO M A.Extraction of natural products using supercritical fluids and pressurized liquids assisted by ultrasound:Current status and trends[J].Ultrasonics Sonochemistry, 2021, 74:105584.
[6] XIE D T, WANG Y Q, KANG Y, et al.Microwave-assisted extraction of bioactive alkaloids from Stephania sinica[J].Separation and Purification Technology, 2014, 130:173-181.
[7] THAKKAR K, KACHHWAHA S S, KODGIRE P.Enhanced Castor seed oil extraction assisted by the synergistic effect of ultrasound and microwave:Impact on extraction effectiveness and oil quality[J].Chemical Engineering and Processing-Process Intensification, 2023, 185:109307.
[8] WU D M, GAO T T, YANG H X, et al.Simultaneous microwave/ultrasonic-assisted enzymatic extraction of antioxidant ingredients from Nitraria tangutorun Bobr.juice by-products[J].Industrial Crops and Products, 2015, 66:229-238.
[9] 龙德清, 饶贞学, 丁宗庆.酸性醇浸渍法提取魔芋中的总生物碱[J].食品科学, 2003, 24(10):126-127.
LONG D Q, RAO Z X, DING Z Q.Extraction of whole alkaloid from amorphaphallus konjak by dipping method in acidity alcohol[J].Food Science, 2003, 24(10):126-127
[10] 刘海利, 范盛玉, 张盛林, 等.不同干燥条件对白魔芋精粉性质的影响及其结构表征[J].食品与发酵工业, 2024, 50(7):212-219.
LIU H L, FAN S Y, ZHANG S L, et al.Effect of different drying conditions on the properties of white konjac flour and its structural characterization[J].Food and Fermentation Industries, 2024, 50(7):212-219.
[11] 彭曼曼, 吴思凝, 迪珂君, 等.超声处理对魔芋葡甘聚糖流变与结构的影响[J].食品与发酵工业, 2020, 46(3):152-159.
PENG M M, WU S N, DI K J, et al.Effect of ultrasonic treatment on the rheology and structure of konjac glucomannan[J].Food and Fermentation Industries, 2020, 46(3):152-159.
[12] XIONG W, CHEN X Q, LYU G P, et al.Optimization of microwave-assisted extraction of bioactive alkaloids from Lotus plumule using response surface methodology[J].Journal of Pharmaceutical Analysis, 2016, 6(6):382-388.
[13] CHEN Q Y, DONG W J, WEI C Q, et al.Combining integrated ultrasonic-microwave technique with ethanol to maximise extraction of green coffee oil from Arabica coffee beans[J].Industrial Crops and Products, 2020, 151:112405.
[14] WANG F, ZHANG Y Z, XU L, et al.An efficient ultrasound-assisted extraction method of pea protein and its effect on protein functional properties and biological activities[J].LWT, 2020, 127:109348.
[15] LIEW S Q, NGOH G C, YUSOFF R, et al.Sequential ultrasound-microwave assisted acid extraction (UMAE) of pectin from pomelo peels[J].International Journal of Biological Macromolecules, 2016, 93:426-435.
[16] GUO Z B, ZHAO B B, LI H, et al.Optimization of ultrasound-microwave synergistic extraction of prebiotic oligosaccharides from sweet potatoes (Ipomoea batatas L.)[J].Innovative Food Science &Emerging Technologies, 2019, 54:51-63.
[17] LEE C H, LEE T H, ONG P Y, et al.Integrated ultrasound-mechanical stirrer technique for extraction of total alkaloid content from Annona muricata[J].Process Biochemistry, 2021, 109:104-116.
[18] MART NEZ-RAMOS T, BENEDITO-FORT J, WATSON N J, et al.Effect of solvent composition and its interaction with ultrasonic energy on the ultrasound-assisted extraction of phenolic compounds from Mango peels (Mangifera indica L.)[J].Food and Bioproducts Processing, 2020, 122:41-54.
NEZ-RAMOS T, BENEDITO-FORT J, WATSON N J, et al.Effect of solvent composition and its interaction with ultrasonic energy on the ultrasound-assisted extraction of phenolic compounds from Mango peels (Mangifera indica L.)[J].Food and Bioproducts Processing, 2020, 122:41-54.
[19] CASTA EDA-VALBUENA D, AYORA-TALAVERA T, LUJ
EDA-VALBUENA D, AYORA-TALAVERA T, LUJ N-HIDALGO C, et al.Ultrasound extraction conditions effect on antioxidant capacity of mango by-product extracts[J].Food and Bioproducts Processing, 2021, 127:212-224.
N-HIDALGO C, et al.Ultrasound extraction conditions effect on antioxidant capacity of mango by-product extracts[J].Food and Bioproducts Processing, 2021, 127:212-224.
[20] 申丹, 钟果林, 杨大伟.魔芋片微波灭酶的最佳工艺参数研究[J].农产品加工, 2020(11):45-47;51.
SHEN D, ZHONG G L, YANG D W.Study on the optimal processing parameters of inhibiting enzyme of konjac films by microwave treatment[J].Farm Products Processing, 2020(11):45-47;51.
[21] LI J, LI B, GENG P, et al.Ultrasonic degradation kinetics and rheological profiles of a food polysaccharide (konjac glucomannan) in water[J].Food Hydrocolloids, 2017, 70:14-19.
[22] ZHU B, XIN C, LI J, et al.Ultrasonic degradation of konjac glucomannan and the effect of freezing combined with alkali treatment on their rheological profiles[J].Molecules, 2019, 24(10):1860.
[23] XU Y, ZHANG X, YAN X H, et al.Characterization, hypolipidemic and antioxidant activities of degraded polysaccharides from Ganoderma lucidum[J].International Journal of Biological Macromolecules, 2019, 135:706-716.
[24] TONG C L, LIU L, LIN Q W, et al.Insights into the formation of konjac glucomannan gel induced by ethanol equilibration[J].Food Hydrocolloids, 2022, 126:107469.
[25] TANG H B, WANG L, LI Y P, et al.Effect of acidolysis and oxidation on structure and properties of konjac glucomannan[J].International Journal of Biological Macromolecules, 2019, 130:378-387.
[26] YE S X, ZHU J S, SHAH B R, et al.Preparation and characterization of konjac glucomannan (KGM) and deacetylated KGM (Da-KGM) obtained by sonication[J].Journal of the Science of Food and Agriculture, 2022, 102(10):4333-4344.
[27] LI Y, LIU H B, XIE Y, et al.Preparation, characterization and physicochemical properties of Konjac glucomannan depolymerized by ozone assisted with microwave treatment[J].Food Hydrocolloids, 2021, 119:106878.
[28] 孟凡冰, 王小燕, 范定涛, 等.脱敏魔芋粉制备集成技术初探及其对魔芋粉理化性质的影响[J].食品科学, 2015, 36(2):63-68.
MENG F B, WANG X Y, FAN D T, et al.Preparation of konjac flour by combined use of different techniques and its physicochemical properties[J].Food Science, 2015, 36(2):63-68.
[29] RONG H C, JAAN R C, JU S S.Effects of ultrasonic conditions and storage in acidic solutions on changes in molecular weight and polydispersity of treated chitosan[J].Carbohydrate Research, 1997, 299(4):287-294.