鲜切哈密瓜美味、营养且便利,深受消费者喜爱,是维生素C、维生素A等营养物质的极佳来源。鲜切水果的制备过程会促进乙烯生产、加剧呼吸作用、加速颜色变化和产生微生物污染等问题[1],易腐烂变质。果蔬的代谢过程依赖于温度变化,低温储存是保持水果和蔬菜品质的有效方法之一[2]。并且,鲜切水果的内部果肉暴露在环境中,其腐烂变质速度会明显快于未分切水果。在相同冷藏情况下,鲜切水果保质期也短于未分切水果。
温度是影响水果长期贮藏的重要因素之一。在食品冰点以下1~2 ℃时,大多数细菌无法生长,微生物活性下降[3]。过冷贮存被提出作为延长水果和蔬菜保质期的创新方法之一[4]。过冷是指食物被冷却到冰点以下的温度而不结冰的现象。过冷状态下的食品状态是不稳定的,相变随时可能发生[5]。
为克服不稳定的过冷状态,研究人员高压、电场和磁场以及超声波振动等先进技术在食品过冷保鲜中的应用进行研究[6-8]。维持过冷状态稳定的技术有限,其中一些技术在食品工业中的应用成本很高[9]。LIU等[4]研究表明,对恒温恒湿箱设定合适的逐步冷却法可使各种鱼类在贮存过程中有效地保持过冷状态,其设置程序为每24 h降低0.5 ℃,直至达到-5 ℃。STONEHOUSE等[10]在猪肉和鸡胸肉过冷贮藏过程中应用逐步冷却法成功保持过冷状态,其设定为每18 h降低0.5 ℃并进行3次降低,每72 h重复1次。由于每种食品的最佳保存条件不同,因此有必要确定和设置准确的食品逐步冷却控制程序。目前,关于鲜切水果使用逐步冷却法进行过冷贮藏的研究较少,本文根据预实验确定鲜切哈密瓜的过冷点和逐步冷却法,对恒温恒湿室温度进行程序设定,并评价其在过冷贮藏12 d期间理化品质和菌落总数的变化。在过冷贮藏期间,冷冻发生的风险随着贮藏温度和冰点之间的差异增加而增加,选择-3~-4 ℃作为过冷贮藏环境温度。研究人员贮藏在5 ℃的鲜切哈密瓜的生理品质进行研究[11-13],遂选择贮存在5 ℃的鲜切哈密瓜作为对照组。研究结果将为鲜切水果的品质保鲜和微生物控制提供基础数据,为促进过冷贮藏技术在实际中的应用提供依据。
1 材料与方法
1.1 材料与试剂
供试材料为“鲜丰”哈密瓜,购买于鲜丰水果优选连锁店,挑选外观一致、大小均一、表面无机械损伤的同一批次新鲜哈密瓜,可溶性固形物(total soluble solids content,TSS)含量为9%~9.5%,平均单瓜重4~5 kg,随后立即运回实验室,进行试验。
浓盐酸、甲醇、硫代巴比妥酸、三氯乙酸、磷酸、红菲咯啉、FeCl3、平板计数琼脂,国药集团化学试剂有限公司;无水乙醇、L-抗坏血酸,上海泰坦科技股份有限公司;MARS培养基,杭州百思生物技术有限公司。
1.2 仪器与设备
JK808手持多路温度测试仪,金爱联电子科技有限公司;UV-1800紫外分光光度计,日本岛津国际贸易公司;TMS-Pro食品物性分析仪,北京盈盛恒泰科技责任有限公司;恒温恒湿室,昆山庆声电子科技有限公司;PAL-BX/ACIDF5糖酸度一体机,日本ATAGO公司;DDS-11A 电导率仪,天津市塞得利斯实验分析仪器制造厂;AP-08研磨仪,上海芸进仪器设备有限公司;LC-LX-HR165A高速冷冻离心机,上海一恒科学仪器有限公司;C650B顶空气体分析仪,济南兰光机电技术有限公司。
1.3 试验材料处理方法
取新鲜哈密瓜洗净晾干,首尾两端切去3 cm并去除瓜瓤与果皮,将剩余瓜体按照2 cm厚度先切分成圆柱圈,再切分成梯形(上底3 cm、下底5 cm、厚度2 cm),装入透明聚乙烯自封袋(64 mm×76 mm,单面厚度0.1 m)中,避免贮存过程中的重量损失和微生物污染。利用顶空气体分析仪初步测定过冷贮藏12 d后样品包装中O2和CO2浓度分别>21%和<0.9%,对照样品中O2和CO2浓度分别>18.3%和<1.4%。这表明包装好的鲜切哈密瓜在有氧条件下贮存是安全的,而不是在厌氧条件下。
包装后的样品(40块)分为2组,分别放置在2个聚丙烯保鲜盒(39 cm×27 cm×13.5 cm)中,每个保鲜盒中大约480 g,底部有缓冲,以减少物理振动和冲击,并带有盒盖,以防止在贮存过程中包装上的任何空气运动,并将2个保鲜盒分别放置于2个恒温恒湿室中。
样品随机挑选分为2组:一组在逐步冷却后过冷贮藏,逐步冷却法程序设定:初始温度0 ℃,每隔5 h降低1 ℃,达到-5 ℃保持5 h后再次升高至0 ℃,再次进行1次降温循环后降温至-4 ℃,整个周期为12 d,并且此前预实验表明,此程序设定可使哈密瓜进行过冷保存;另一组直接冷藏于5 ℃恒温恒湿箱中。并于0、3、6、9、12 d后进行物理化学分析和微生物评价。
1.4 指标测定
1.4.1 鲜切哈密瓜冰点与过冷点测定
鲜切哈密瓜的冰点和过冷点的测定参考KOIDE等[14]的方法:将t型热电偶放置在鲜切哈密瓜样品的几何中心并装入自封袋,缓慢降低恒温恒湿箱中的环境温度,进一步冷却至-20 ℃。使用温度记录仪记录样品内部温度,并确定文钰等[15]描述的冰点和过冷点。
1.4.2 硬度、颜色、TSS含量测定
硬度使用食品物性分析仪测量;TSS含量采用糖酸度一体机测定;颜色测定采用精密色差仪对表面颜色(L*、a*、b*)测定。于0、3、6、9、12 d时从每组样品中随机抽取3个独立样品,分别在其表面取2个点进行硬度测量并取2个点进行颜色测量。
1.4.3 相对电导率和丙二醛(malondialdehyde,MDA)含量的测定
均参照曹建康等[16]的方法测定。
1.4.4 菌落总数测定
参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》进行测定。
1.4.5 抗坏血酸含量和总酚含量测定
均参照曹建康等[16]的方法。以抗坏血酸为标准品构建标准曲线,得到回归方程:y=0.006 07+0.043 7x,R2=0.995。
1.5 数据处理
采用Excel 2010进行原始数据的基础处理,采用SPSS 19.0软件对数据进行统计分析,P<0.05表示差异显著,作图采用Origin 2018绘图软件。
2 结果与分析
2.1 鲜切哈密瓜冰点和过冷点分析
表1所示为鲜切哈密瓜(n=15)的冰点和过冷点。鲜切哈密瓜冰点为(-1.83±0.57) ℃,其过冷点在-8.2~-4.3 ℃之间。为保证样品过冷状态稳定性,选择过冷贮藏温度为-4~-3 ℃。
表1 鲜切哈密瓜的冰点和过冷点 单位:℃
Table 1 Freezing point and supercooling point of fresh-cut Hami melon samples
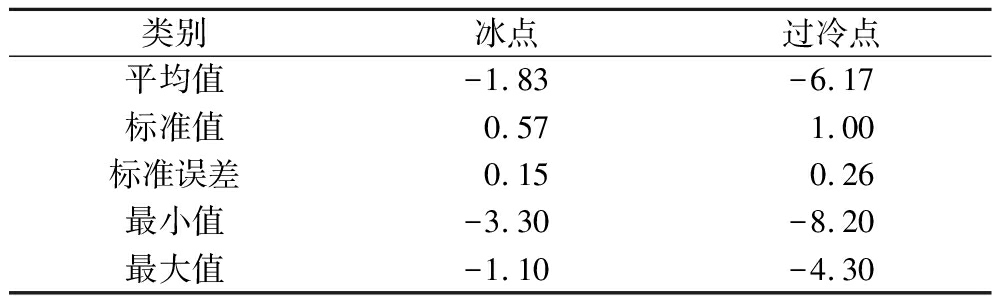
类别冰点过冷点平均值-1.83-6.17标准值0.571.00标准误差0.150.26最小值-3.30-8.20最大值-1.10-4.30
图1所示为鲜切哈密瓜样品逐步冷却后过冷贮藏的代表性时间-温度曲线。在贮藏期间,鲜切哈密瓜样品经2次逐步冷却后其内部温度保持在-3~-4 ℃。鲜切哈密瓜样品在过冷贮藏期间没有放热现象,表明其已保持过冷状态12 d。该现象说明,对样品进行薄膜包装并在保鲜盒底部放置缓冲泡沫进行缓冲,可以有效建立保持样品过冷状态的贮藏条件。
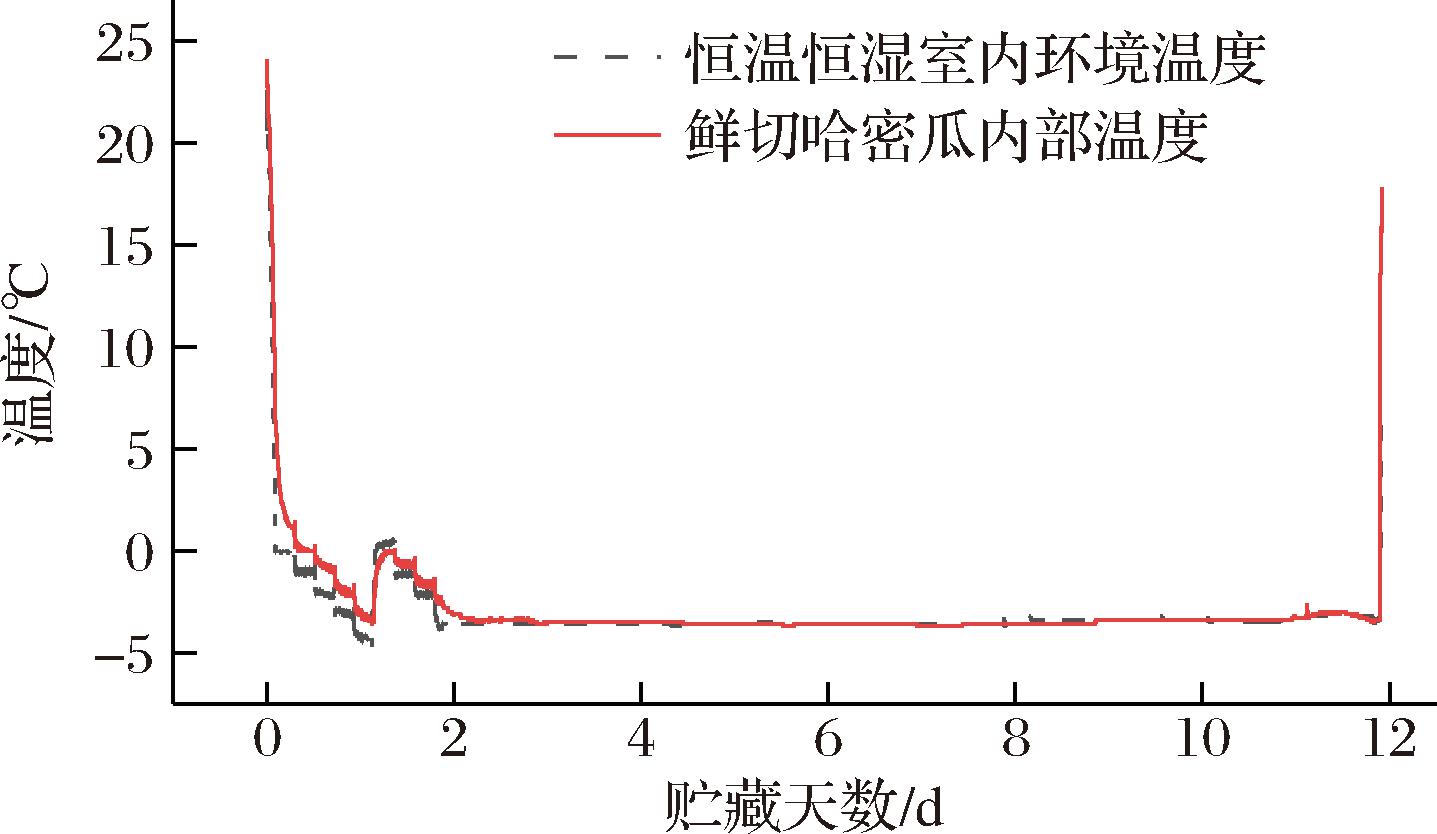
图1 鲜切哈密瓜样品逐步冷却后过冷贮存12 d的时间-温度曲线
Fig.1 Time-temperature curve of fresh-cut Hami melon samples after stepwise cooling algorithm and storage for 12 days
2.2 鲜切哈密瓜生理生化指标分析
2.2.1 逐步冷却法结合过冷贮藏对鲜切哈密瓜样品MDA含量和相对电导率的影响
为防止鲜切哈密瓜在低温贮藏期间产生冷害,对其进行独立包装,并放置在装有缓冲泡沫的保鲜盒中。MDA含量上升被当作是植物细胞膜脂过氧化的标志,而相对电导率的上升则被认为是植物细胞膜破坏的表现。如图2所示,过冷组和对照组样品在贮藏期间,MDA含量整体呈现下降趋势,相对电导率呈现先上升后下降再上升状态。图2-a所示,MDA含量在第6天呈现显著差异(P<0.001),过冷组样品MDA含量始终低于对照组样品。FENG等[17]研究包装对叶生菜过冷状态的影响,发现双层包装叶生菜与未包装和单层包装叶生菜相比,双层包装叶生菜在没有相变的情况下可保持更长的过冷状态。结果表明,所测鲜切哈密瓜样本没有被冻结的迹象,因此可被用于过冷组和对照组样品的物理化学和微生物分析。
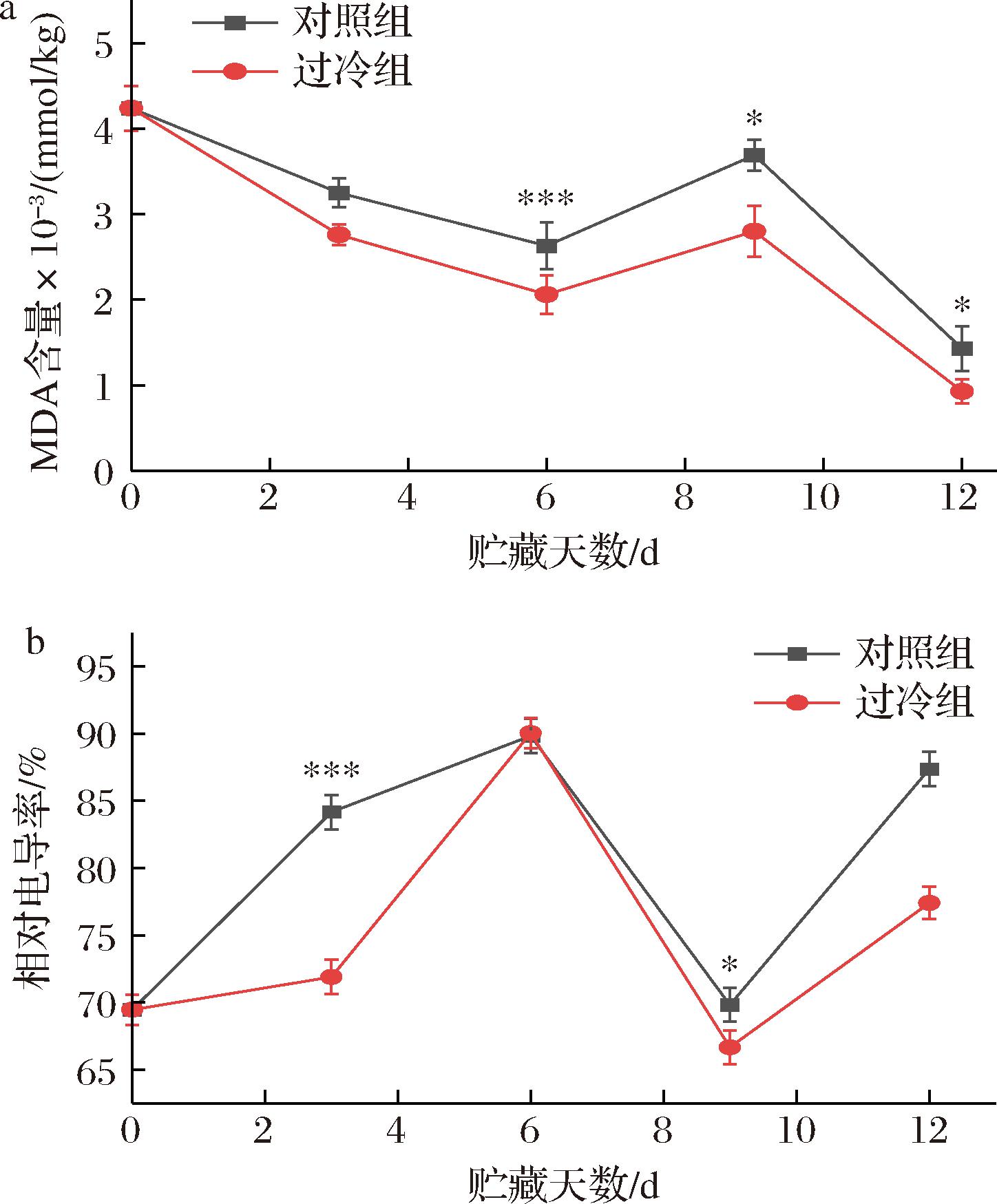
a-MDA含量;b-相对电导率
图2 逐步冷却法结合过冷贮藏对鲜切哈密瓜样品贮藏期间MDA含量、相对电导率的影响
Fig.2 Effect of the stepwise cooling algorithm combined with supercooling storage on MDA content and relative conductivity of fresh-cut Hami melon samples
注:*P<0.05,**P<0.01,***P<0.001(下同)。
2.2.2 逐步冷却法结合过冷贮藏对鲜切哈密瓜样品硬度、TSS含量、颜色、抗坏血酸含量及总酚含量的影响
图3-a所示,过冷组与对照组样品呈现同样趋势,前期缓慢下降后期急速上升,并且第12天出现显著差异(P<0.001)。过冷贮藏期间,如果样品产生冰结晶,破坏细胞结构,会导致其硬度急速下降[18],第12天硬度上升的原因可能为鲜切哈密瓜表面失水皱缩,导致了硬度急速上升。
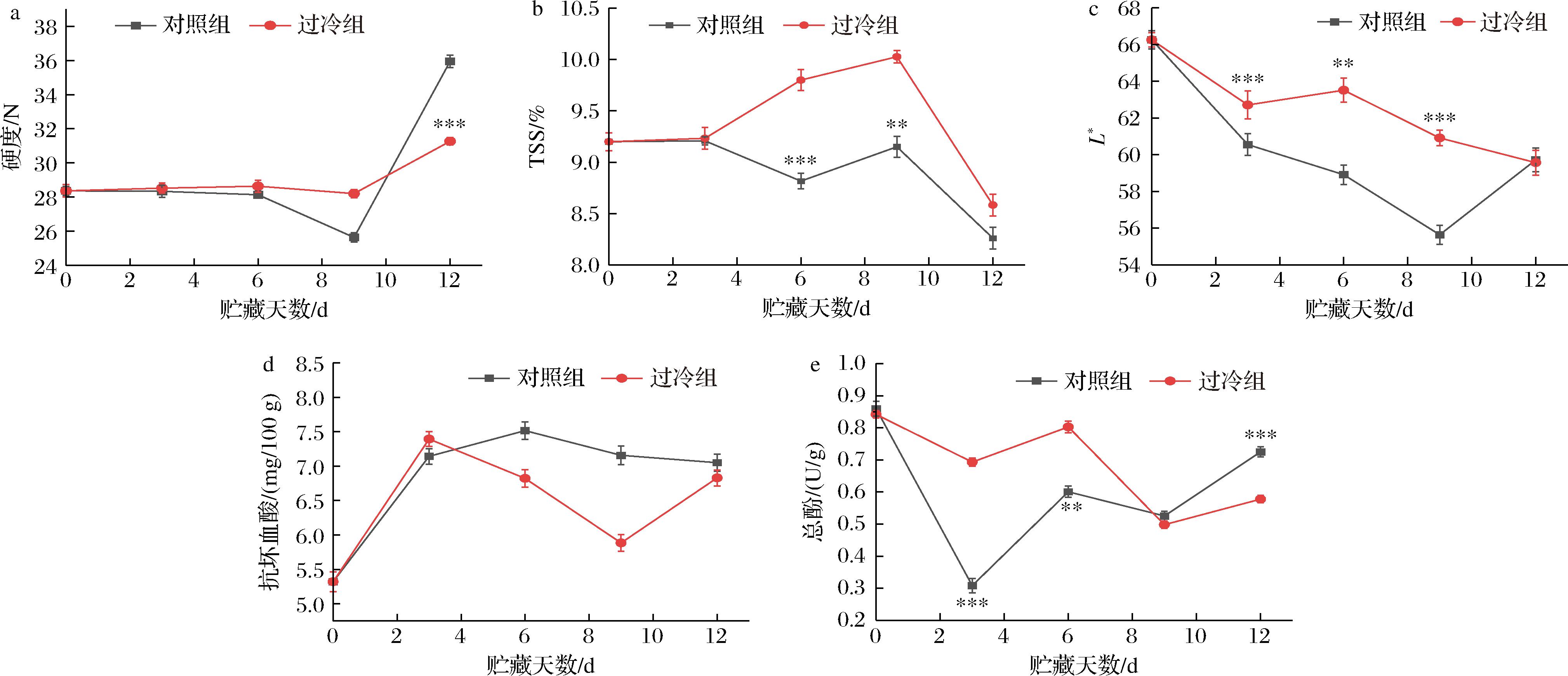
a-硬度;b-TSS;c-L*值;d-抗坏血酸含量;e-总酚
图3 逐步冷却法结合过冷贮藏对鲜切哈密瓜样品贮藏期间硬度、TSS含量、L*值、抗坏血酸含量和总酚含量的影响
Fig.3 Effect of the stepwise cooling algorithm combined with supercooling storage on firmness, TSS content, L* value, ascorbic acid content, and total phenol content of fresh-cut Hami melon samples
根据双因素方差分析表明,贮藏温度与贮藏天数对TSS含量具有显著影响(P<0.05)。如图3-b所示,在过冷条件下,TSS含量在前期呈现持续上升状态。其原因为,在低温贮藏过程中,生物组织通过自身的生理代谢产生可溶性糖和蛋白质维持组织细胞的生命状态,抵御外部低温胁迫[4]。
颜色是鲜切水果最重要的物理化学参数,因为酶促褐变会损害其感官特性,削强消费者购买欲。如图3-c所示,过冷贮藏的色度L*值在第3天开始与对照组有显著差异(P<0.05)。鲜切哈密瓜果肉色度L*值在过冷贮藏期间持续下降,其初始值为66.26±1.4,在第12天其L*值降至59.57±0.88,但其整体平均值高于对照组。
有研究表明抗坏血酸含量在收获后的贮藏过程中会迅速降低,加工后甚至会更快[19]。如图3-d所示,过冷组与对照组样品抗坏血酸含量一直高于最初始状态,没有显著降低,原因为抗坏血酸具有抗氧化能力。
如图3-e所示,鲜切哈密瓜在过冷贮藏环境中总酚含量在第3天降低19%,其在对照组贮藏中降低64%。其原因可能是鲜切哈密瓜在过冷贮藏时采取了逐步冷却法,能更好的建立其耐冷性。综上,逐步冷却法结合过冷贮藏对保持鲜切哈密瓜的贮藏品质具有潜在的价值。
2.2.3 菌落总数测定
微生物生长是限制鲜果产品保质期和质量的最重要因素之一。与其他水果相比,哈密瓜果肉的高pH值会加剧微生物污染[20]。如图4所示,过冷组与对照组样品菌落总数都呈现持续上升状态,具有明显的温度依赖性变化。在贮藏第3天,过冷组与对照组样品菌落总数存在显著差异(P<0.01)。对照组样品中菌落总数的增长速度为过冷组样品的2倍,恒温恒湿条件下贮藏的样品菌落总数在第6天达到(6.15±0.12) lg (CFU/g),而在过冷条件下贮藏的样品在第12天才达到(5.49±0.16) lg (CFU/g)。MOUSSA等[21]研究了大肠杆菌和酿酒酵母在体外长期过冷条件下的生存能力。发现暴露在0 ℃以下,它们生存能力会丧失而导致冷休克,从而导致细菌膜的损伤。表明逐步冷却法结合过冷贮藏技术可显著抑制微生物生长。
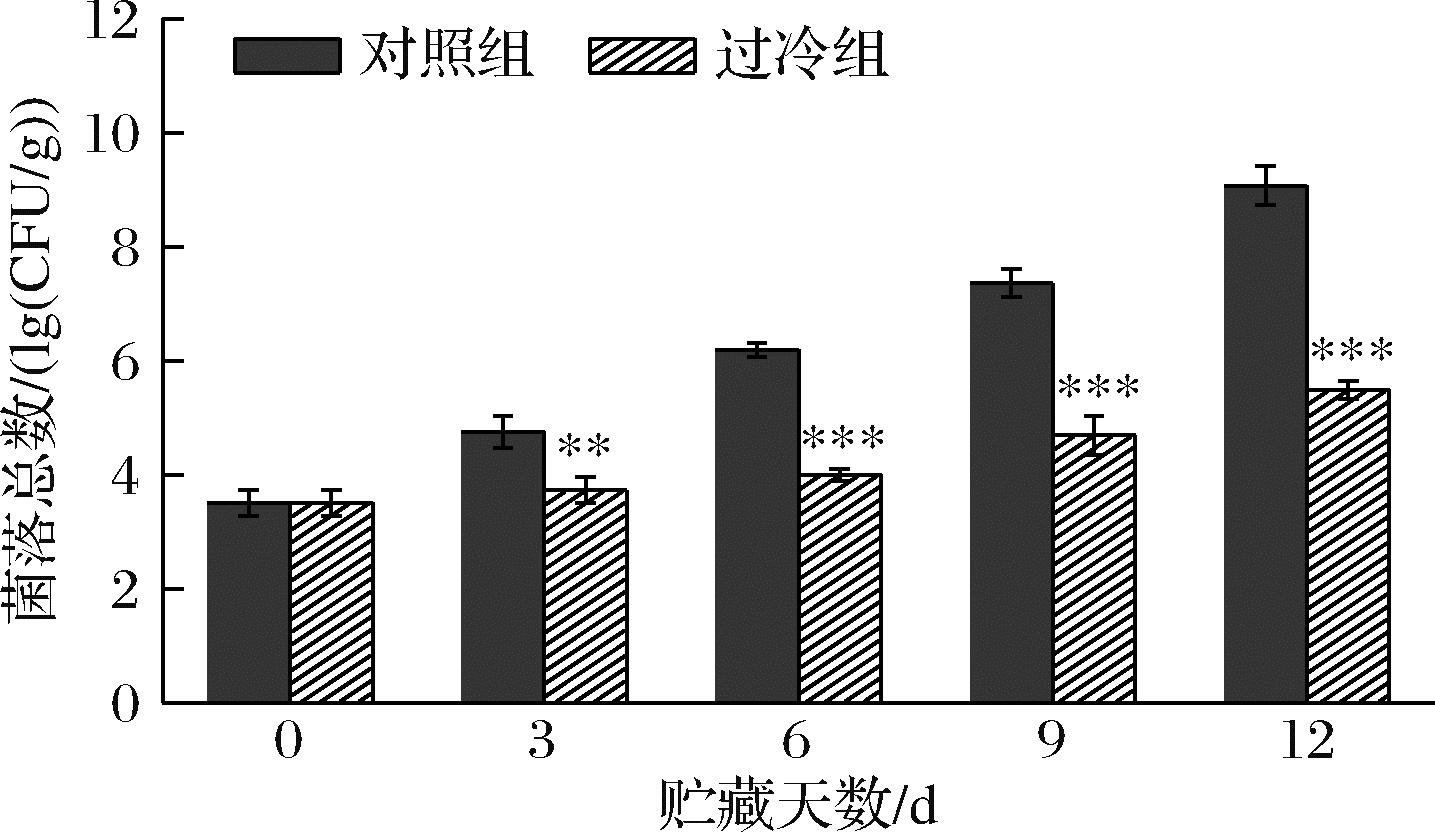
图4 逐步冷却法结合过冷贮藏对鲜切哈密瓜样品贮藏期间菌落总数的影响
Fig.4 Effect of the stepwise cooling algorithm combined with supercooling storage on total bacterial count of fresh-cut Hami melon samples
3 讨论与总结
使用过冷贮藏技术的关键因素是通过降低食品受外界影响的程度来保持食品的过冷状态。这些影响包括温度波动、物理振动和冲击[10]。如果产品内部发生冰结晶,则产生的冻害会降低产品的整体质量,包括滴水损失、细胞损伤、颜色变化和解冻后硬度损失[22-23]。研究者最关注的是过冷贮存后发生冻伤的可能性。在产品可能经历不可预知的振动或冲击的情况下,例如在零售店,建议产品的温度应保持在其冰点以上,而不是处于过冷状态。
对鲜切哈密瓜进行单独包装和减震缓冲处理可能会减轻其冷害和显著抑制菌落生长(P<0.05),从而延长食品在冷链中的保质期。但逐步冷却法维持鲜切哈密瓜过冷状态和抑制冷害的机理还需深入研究。
本研究评估了鲜切哈密瓜在-3~-4 ℃过冷贮藏12 d期间的生理品质和菌落总数的变化,并将其与5 ℃恒温恒湿贮藏样品进行比较。鲜切哈密瓜的冰点为(-1.83±0.57) ℃,过冷点为-8.2~-4.3 ℃,时间-温度曲线表明样品可以在-4~-3 ℃过冷状态下贮藏。结果表明,鲜切哈密瓜经逐步冷却后过冷贮藏,可显著维持其生理品质和显著抑制菌落总数增长,有助于延长鲜切“鲜丰”哈密瓜的保鲜期。
[1] VELDERRAIN-RODR GUEZ G R, QUIR
GUEZ G R, QUIR S-SAUCEDA A E, GONZ
S-SAUCEDA A E, GONZ LEZ AGUILAR G A, et al.Technologies in Fresh-cut Fruit and Vegetables[M]. Food Engineering Series.Cham:Springer International Publishing, 2014:79-103.
LEZ AGUILAR G A, et al.Technologies in Fresh-cut Fruit and Vegetables[M]. Food Engineering Series.Cham:Springer International Publishing, 2014:79-103.
[2] AHVENAINEN R.New approaches in improving the shelf life of minimally processed fruit and vegetables[J].Trends in Food Science &Technology, 1996, 7(6):179-187.
[3] KAALE L D, EIKEVIK T M, RUSTAD T, et al.Superchilling of food:A review[J].Journal of Food Engineering, 2011, 107(2):141-146.
[4] LIU D K, XU C C, GUO C X, et al.Sub-zero temperature preservation of fruits and vegetables:A review[J].Journal of Food Engineering, 2020, 275:109881.
[5] YUN Y C, RAMACHANDRAIAH K, HONG G P.Effect of precooling conditions on the ice nucleation temperature and freezing characteristics of semisolid matrices[J].Journal of Food Engineering, 2021, 291:110232.
[6] HONG G P, CHOI M J.Comparison of the quality characteristics of abalone processed by high-pressure sub-zero temperature and pressure-shift freezing[J].Innovative Food Science &Emerging Technologies, 2016, 33:19-25.
[7] MOK J H, HER J Y, KANG T, et al.Effects of pulsed electric field (PEF) and oscillating magnetic field (OMF) combination technology on the extension of supercooling for chicken breasts[J].Journal of Food Engineering, 2017, 196:27-35.
[8] ZHENG L Y, SUN D W.Innovative applications of power ultrasound during food freezing processes—a review[J].Trends in Food Science &Technology, 2006, 17(1):16-23.
[9] DALVI-ISFAHAN M, HAMDAMI N, XANTHAKIS E, et al.Review on the control of ice nucleation by ultrasound waves, electric and magnetic fields[J].Journal of Food Engineering, 2017, 195:222-234.
[10] STONEHOUSE G G, EVANS J A.The use of supercooling for fresh foods:A review[J].Journal of Food Engineering, 2015, 148:74-79.
[11] RAYBAUDI-MASSILIA R M, MOSQUEDA-MELGAR J, MART N-BELLOSO O.Edible alginate-based coating as carrier of antimicrobials to improve shelf-life and safety of fresh-cut melon[J].International Journal of Food Microbiology, 2008, 121(3):313-327.
N-BELLOSO O.Edible alginate-based coating as carrier of antimicrobials to improve shelf-life and safety of fresh-cut melon[J].International Journal of Food Microbiology, 2008, 121(3):313-327.
[12] BAI J H, SAFTNER R A, WATADA A E, et al.Modified atmosphere maintains quality of fresh-cut cantaloupe (Cucumis melo L.)[J].Journal of Food Science, 2001, 66(8):1207-1211.
[13] MORGADO C M A, SALLANON H, MATTIUZ B H, et al.Heat treatment and active packaging to improve the storage of fresh-cut melons (Cucumis meloL.)[J].Fruits, 2016, 71(1):9-15.
[14] KOIDE S, OHSUGA R, ORIKASA T, et al.Evaluation of electrical and physiological properties of supercooled fresh cut spinach[J].Nippon Shokuhin Kagaku Kogaku Kaishi, 2019, 66(9):335-340.
[15] 文钰, 杨莉玲, 刘岚, 等.近冰温贮藏对西梅的采后品质及活性氧代谢的影响[J].食品与发酵工业, 2024, 50(11):270-276.
WEN Y, YANG L L, LIU L, et al.Effects of near-freezing temperature storage on postharvest quality and reactive oxygen species metabolism of prunes[J].Food and Fermentation Industries, 2024, 50(11):270-276.
[16] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Post-harvest Physiological and Biochemical Laboratory Guidance for Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007.
[17] FENG G P, YANG H S, LI Y F.Kinetics of relative electrical conductivity and correlation with gas composition in modified atmosphere packaged bayberries (Myrica rubra Siebold and Zuccarini)[J].LWT, 2005, 38(3):249-254.
[18] LU S M, LUO Y G, TURNER E, et al.Efficacy of sodium chlorite as an inhibitor of enzymatic browning in apple slices[J].Food Chemistry, 2007, 104(2):824-829.
[19] KALT W.Effects of production and processing factors on major fruit and vegetable antioxidants[J].Journal of Food Science, 2005, 70(1):R11-R19.
[20] SOLIVA-FORTUNY R C, MART N-BELLOSO O.New advances in extending the shelf-life of fresh-cut fruits:A review[J].Trends in Food Science &Technology, 2003, 14(9):341-353.
N-BELLOSO O.New advances in extending the shelf-life of fresh-cut fruits:A review[J].Trends in Food Science &Technology, 2003, 14(9):341-353.
[21] MOUSSA M, DUMONT F, PERRIER-CORNET J M, et al.Cell inactivation and membrane damage after long-term treatments at sub-zero temperature in the supercooled and frozen states[J].Biotechnology and Bioengineering, 2008, 101(6):1245-1255.
[22] HOLZWARTH M, KORHUMMEL S, CARLE R, et al.Evaluation of the effects of different freezing and thawing methods on color, polyphenol and ascorbic acid retention in strawberries (Fragaria × Ananassa Duch.)[J].Food Research International, 2012, 48(1):241-248.
[23] KOIDE S, YONEYAMA A, ORIKASA T, et al.Assessing the supercooling of fresh-cut Onions at -5 ℃ using electrical impedance analysis[J].Food Quality and Safety, 2020, 4(2):55-58.