香蕉(Musa acuminata L.)为芭蕉科(Musaceae)芭蕉属(Musa)植物,是东南亚国家水果出口收入的最高来源之一,也是我国重要的经济作物,香蕉产业已成为支撑广西、海南和云南等地区脱贫攻坚和乡村振兴的重要产业[1]。机械损伤是指水果在采摘、包装和运输等过程中,因碰撞和挤压等外在伤害导致局部细胞受损乃至破裂,进而破坏细胞膜系统和结构,干扰果实免疫系统,降低免疫应答能力,从而诱发果实褐变和病害的现象[2]。香蕉是典型的呼吸跃变型水果,由于果皮组织存在细胞结构紧密、弹性有限以及含水量高等因素,导致其在受到外力作用时容易发生变形和破裂,在田间采摘、运输、装卸、包装、贮藏等过程中极易受到机械损伤。此外,当果皮受到机械损伤后,其天然的屏障功能受到影响,果皮处的细胞间隙增大,抵抗能力降低,使得外界病原菌更容易侵入,影响果实的品质,严重时甚至会导致果实失去食用价值。因此,降低机械损伤对香蕉造成的伤害,对降低香蕉采后贮运中的损失率具有重要意义。
研究发现,脂类在机械伤害诱导的信号转导过程和防御机制中起重要作用,植物的膜脂代谢广泛参与机械伤害反应过程[3]。膜脂代谢异常会破坏细胞膜的完整性和稳定性,导致细胞功能受损,果实质量下降,口感变差,进而影响果实的储存和运输[4]。膜脂代谢系统涉及许多酶类,其中包括磷脂酶(phospholipase,PL)、脂氧合酶(lipoxygenase,LOX)、甘油二酯激酶(diacylglycerol kinase,DGK)和脂磷酸磷酸酶(lipid phosphate phosphatase,LPP)等,它们在调控膜脂的合成、分解和转运过程中起着重要作用[5]。PL是一类催化细胞膜磷脂类物质的水解或转移反应的酶,植物中主要包括磷脂酶A(phospholipase A,PLA)、磷脂酶C(phospholipase C,PLC)、磷脂酶D(phospholipase D,PLD)3类,PL能够催化细胞膜上的磷脂酸(phosphatidic acid,PA)、磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)以及甘油二酯(diacylglycerol,DAG)等物质的反应,调节细胞内的磷脂水平,在一定程度上维持细胞膜的稳定性[6]。细胞膜磷脂酶系统对细胞的正常功能和稳态至关重要,它能够调节细胞的生理活动并响应外界环境,保持细胞的健康状态[4]。分析拟南芥[7]和水稻[8]的PLC基因发现,它们的启动子上均具有响应外界胁迫的顺式调控元件,参与生物和非生物胁迫的应答,在受到胁迫时,PLC的相对表达量会增加;同时,许佳妮等[9]研究也证明PLD活性上升会使细胞膜的完整性受到破坏,不利于采后果蔬的贮藏。
本研究以“桂蕉6号”为试验材料,探讨采后香蕉果实在机械损伤胁迫下的果皮细胞膜渗透率、细胞膜脂代谢相关酶活以及细胞膜磷脂组分含量。此外,前期研究发现,香蕉果实中的4个PLD基因(MaPLD1~MaPLD4)在炭疽病胁迫中有一定的调控作用[10]。然而,关于机械损伤对上述基因的影响尚不明确。因此,为深入了解香蕉果实中PLD基因在机械损伤条件下的表达情况,本研究同时对其进行了荧光定量分析。通过以上研究,旨在揭示机械损伤对香蕉果实细胞膜的影响,并为改善香蕉的保鲜技术提供理论依据。
1 材料与方法
1.1 实验材料
香蕉品种选取广西主栽的“桂蕉6号”,于2021年10月摘自广西南宁市坛洛镇果园。选取大小相近、成熟度7~8成、无病虫害和物理损伤的香蕉果实进行试验。
BioTek Epoch型全波长酶标仪,美国BioTek公司;DDS-IIA型电导率仪,上海盛磁仪器有限公司;UV-3200 PCS型紫外可见分光光度计,上海美普达仪器有限公司。
1.2 实验方法
1.2.1 机械伤处理
参考黄敏等[11]方法将试验香蕉随机分为2组,每组60个香蕉果实。用直径为2 mm的不锈钢打孔器在香蕉中轴部位内外侧戳伤,模拟机械损伤情况作为机械伤处理组,无机械伤的香蕉果实作为对照组。将2组香蕉果实分别放入厚度为0.03 mm的聚乙烯保鲜袋中扎口保藏,在25 ℃、相对湿度90%~95%条件下贮藏15 d。每隔3 d取样1次,样品经液氮打磨成粉,存于-80 ℃低温冰箱,试验重复3次。
1.2.2 果皮细胞膜渗透率测定
参照吴小建等[12]方法并加以改进。用打孔器(直径5 mm)随机取香蕉果皮圆片10片,用蒸馏水冲洗3遍,滤纸吸干水分后放入50 mL离心管中,加入20 mL蒸馏水,振荡1 h,测定浸提液的电导率L1;煮沸20 min后冷却至室温,测定浸提液的电导率L2。细胞膜渗透率为前后2次电导率之比所得到的相对电导率,试验重复3次,细胞膜渗透率单位为%。
1.2.3 果皮细胞膜脂代谢相关酶活性测定
参照YI等[10]的方法,并稍作修改。称取0.5 g香蕉果皮粉,加入4.5 mL预冷的HEPES缓冲液(pH 7.0,含0.32 mol/L蔗糖、1 mmol/L二硫代苏糖醇、1 mmol/L苯甲基磺酰氟和1 mmol/L EGTA),振荡混匀,在4 ℃下3 000×g离心15 min,收集上清液待测。PLC、PLD、LOX、DGK以及LPP等膜脂代谢相关酶活性参照相应的酶联免疫分析试剂盒说明进行操作,单位表示为U/g。
1.2.4 果皮细胞膜磷脂组分含量测定
参照LI等[13]的方法,并稍作修改。称取0.1 g香蕉果皮粉,加入1.0 mL氯仿/甲醇溶液(2∶1,体积比)超声波提取30 min后,室温下静置30 min,在4 ℃下 3 000×g离心20 min,收集上清液待测。PA、PC、PE以及DAG等膜磷脂组分含量测定参照相应的酶联免疫分析试剂盒说明进行操作,PA、PC以及PE的单位表示为μmol/g。DAG的单位表示为ng/g。
1.2.5 果皮PLD基因表达分析
香蕉果皮组织总RNA选用RNAprep Pure Plant Kit RNAprep Pure提取试剂盒提取备用。取1 μg香蕉果皮组织总RNA参照Hiscript®Ⅱ RT SuperMix for qPCR试剂盒说明书反转录合成cDNA用于后续试验分析。基因特异性引物(表1)由Primer Premier 5.0软件设计,由北京擎科生物科技股份有限公司南宁分公司合成。参照ChamQ TMSYBR® Color qPCR Master Mix(诺唯赞,南京,中国)说明书进行实时荧光定量PCR(qRT-PCR)实验,选择香蕉CAC基因为内参基因[10],使用2-ΔΔCt法来计算MaPLD1、MaPLD3以及MaPLD4基因相对表达量。
表1 实时荧光定量分析所用引物
Table 1 Primers for quantitative real-time PCR analysis
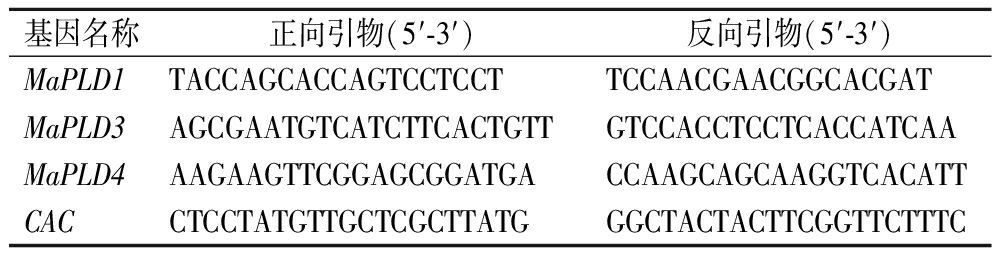
基因名称正向引物(5′-3′)反向引物(5′-3′)MaPLD1TACCAGCACCAGTCCTCCTTCCAACGAACGGCACGATMaPLD3AGCGAATGTCATCTTCACTGTTGTCCACCTCCTCACCATCAAMaPLD4AAGAAGTTCGGAGCGGATGACCAAGCAGCAAGGTCACATTCACCTCCTATGTTGCTCGCTTATGGGCTACTACTTCGGTTCTTTC
1.3 统计分析
选用SPSS 19.0对试验数据进行统计分析,采用独立样本T检验进行因素水平间的显著性方差分析(P<0.05),用Origin 8.1制图。试验重复3次,试验结果以“平均值±标准差”表示。
2 结果与分析
2.1 机械损伤对香蕉果皮细胞膜渗透率的影响
机械损伤会使果皮细胞膜的完整性遭到破坏,通过测定果皮细胞膜渗透率可以了解在外界刺激下果皮细胞膜对离子通透性的变化情况,进而判断果皮细胞膜损伤程度[14]。如图1所示,随着贮藏时间延长,香蕉果实的细胞膜渗透率呈上升趋势,在前6天机械伤处理组和对照组无显著差异,9~15 d时机械伤处理组的细胞膜渗透率显著高于对照组(P<0.05)。贮藏第15天时,机械伤处理组的细胞膜渗透率为83.51%,较对照组高出23%。由此推测,当香蕉果皮受到机械伤害时,果皮细胞膜发生破损,果皮组织结构发生破坏,离子流动性增强、组织液渗漏,进而导致香蕉果皮细胞膜渗透率上升,加快果实的衰老。
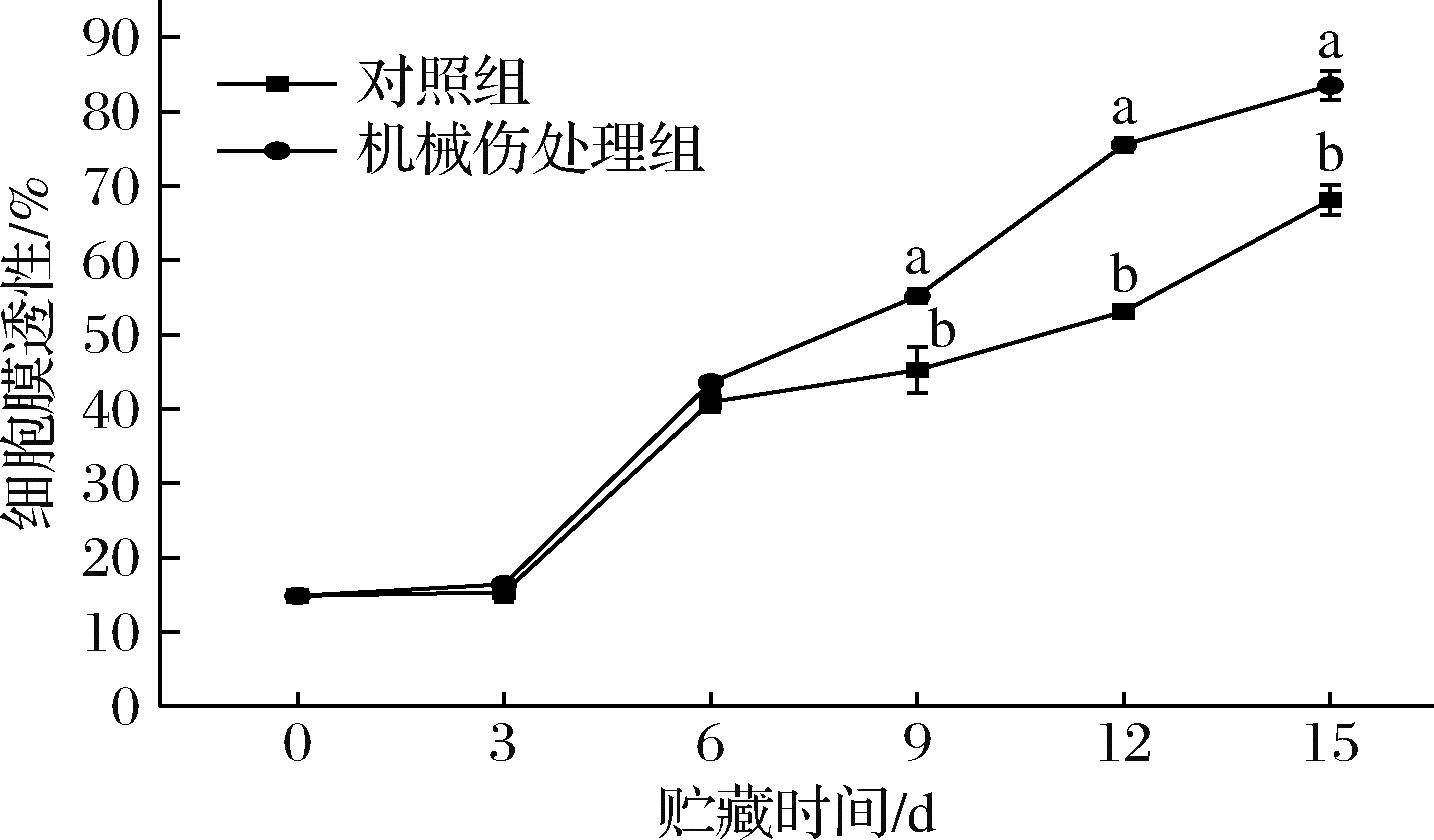
图1 机械损伤对香蕉果皮细胞渗透率的影响
Fig.1 Effect of mechanical damage on the cell permeability of banana peels
注:图中数值为3次重复试验的平均值;误差区间表示为平均值的标准误差;不同字母表示同一时间存在显著差异(P<0.05)(下同)。
2.2 机械损伤对香蕉果皮细胞膜脂代谢相关酶活性的影响
2.2.1 PLC活性的变化
PLC在细胞信号传导中发挥着关键作用,它能够作用于细胞膜上的磷脂,将其水解成DAG和肌醇三磷酸(inositol trisphosphate,IP3)[14]。由图2可知,在整个贮藏期间内,机械伤处理组的PLC活性显著高于对照组(P<0.05)。机械伤处理组PLC活性总体呈现上升趋势,在第3天时达到最高值,活性达到438.02 U/g,较对照组高出72%。贮藏第15天时,机械伤处理组活性降至375.13 U/g,仍较对照组高出58%。这表明,机械损伤能够影响细胞内信号传导的通路,PLC作为细胞内重要的信号分子,在机械伤胁迫下被激活,加快细胞膜磷脂的降解,从而加速果实衰老。
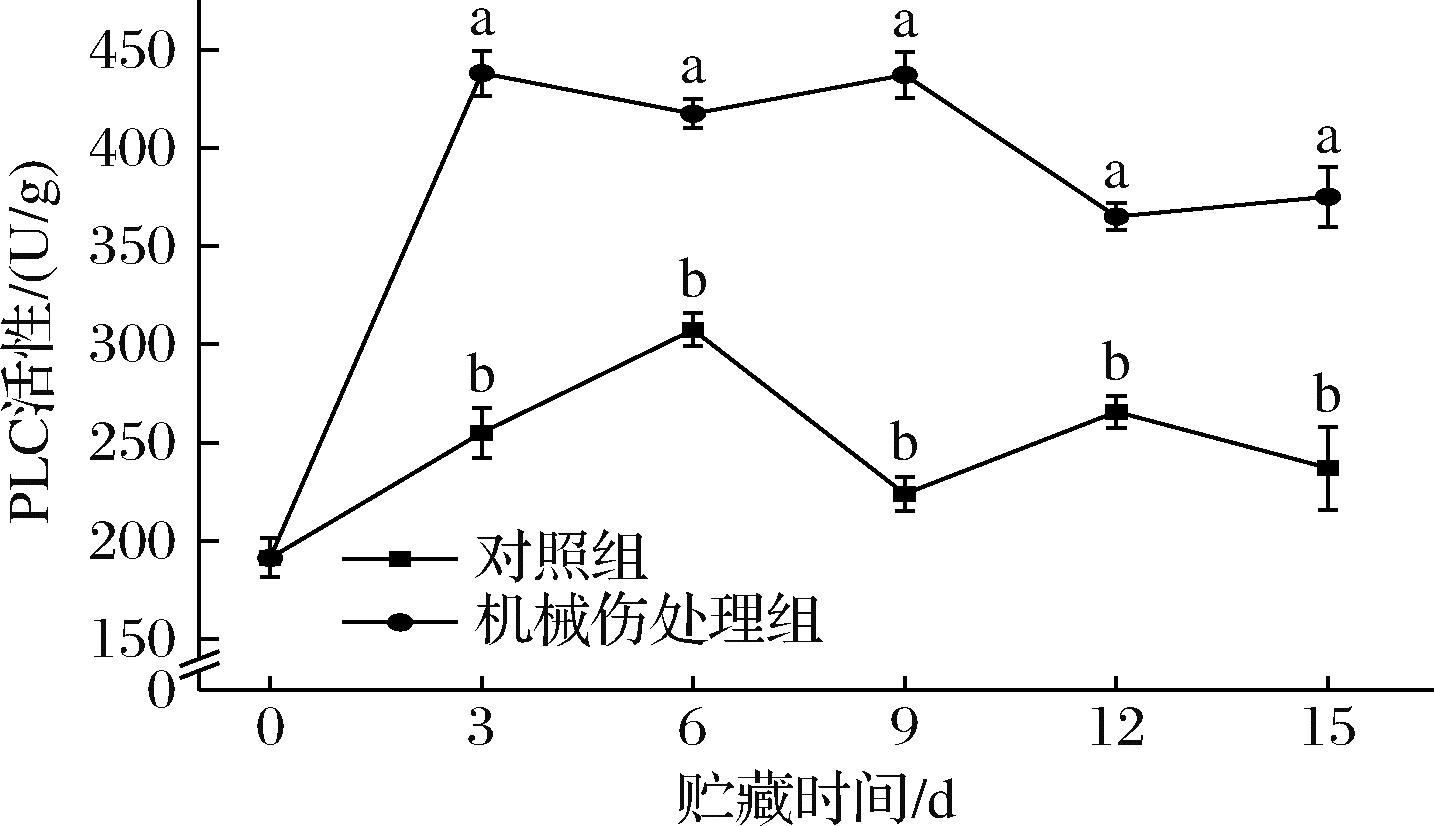
图2 机械损伤对香蕉果皮PLC活性影响
Fig.2 Effect of mechanical damage on PLC activity of banana peel
2.2.2 PLD活性的变化
PLD在细胞信号传导和代谢调节中起着重要的作用。由图3可知,在整个贮藏期间内,机械伤处理组的PLD活性均显著高于对照组(P<0.05)。机械伤处理组的PLD活性总体呈现上升趋势,并在第12天达到峰值441.51 U/g,比活性较对照组高出66%。贮藏第15 d时,香蕉果实腐败严重,PLD活性降至392.44 U/g,仅高出对照组52%。由此可知,在机械伤的胁迫下,细胞中的PLD被激活并开始催化底物的水解反应,导致PLD活性显著提升。
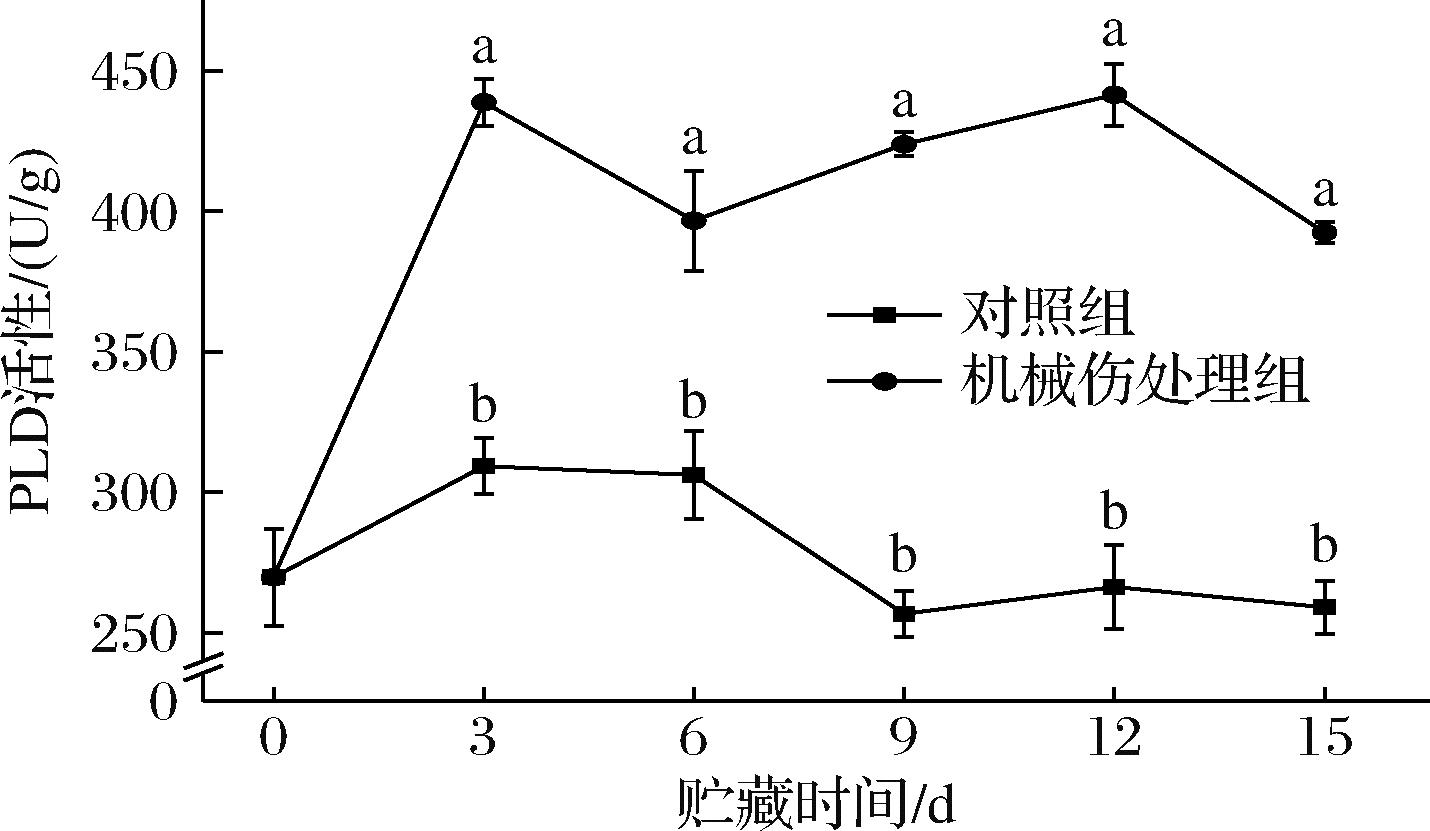
图3 机械损伤对香蕉果皮PLD活性影响
Fig.3 Effect of mechanical damage on PLD activity of banana peel
2.2.3 LOX活性的变化
LOX能够将植物细胞中的多种不饱和脂肪酸转化为相应的过氧化产物,进而参与调节植物生长发育、逆境响应以及次生代谢产物的合成等过程[15]。如图4所示,机械伤处理组的LOX活性总体呈现上升趋势,而对照组的LOX活性总体呈现下降趋势。在整个贮藏期间,机械伤处理组的LOX活性显著高于对照组(P<0.05),两者均在第6天达到最大值,分别为11 218 U/g和8 739.6 U/g,其中机械伤处理组较对照组高出28%。贮藏第15天时,机械伤处理组的LOX比活性较对照组高出41%。由此可知,在机械伤胁迫下,细胞内的LOX被激活,引发一系列生物学过程,有助于植物适应环境压力。
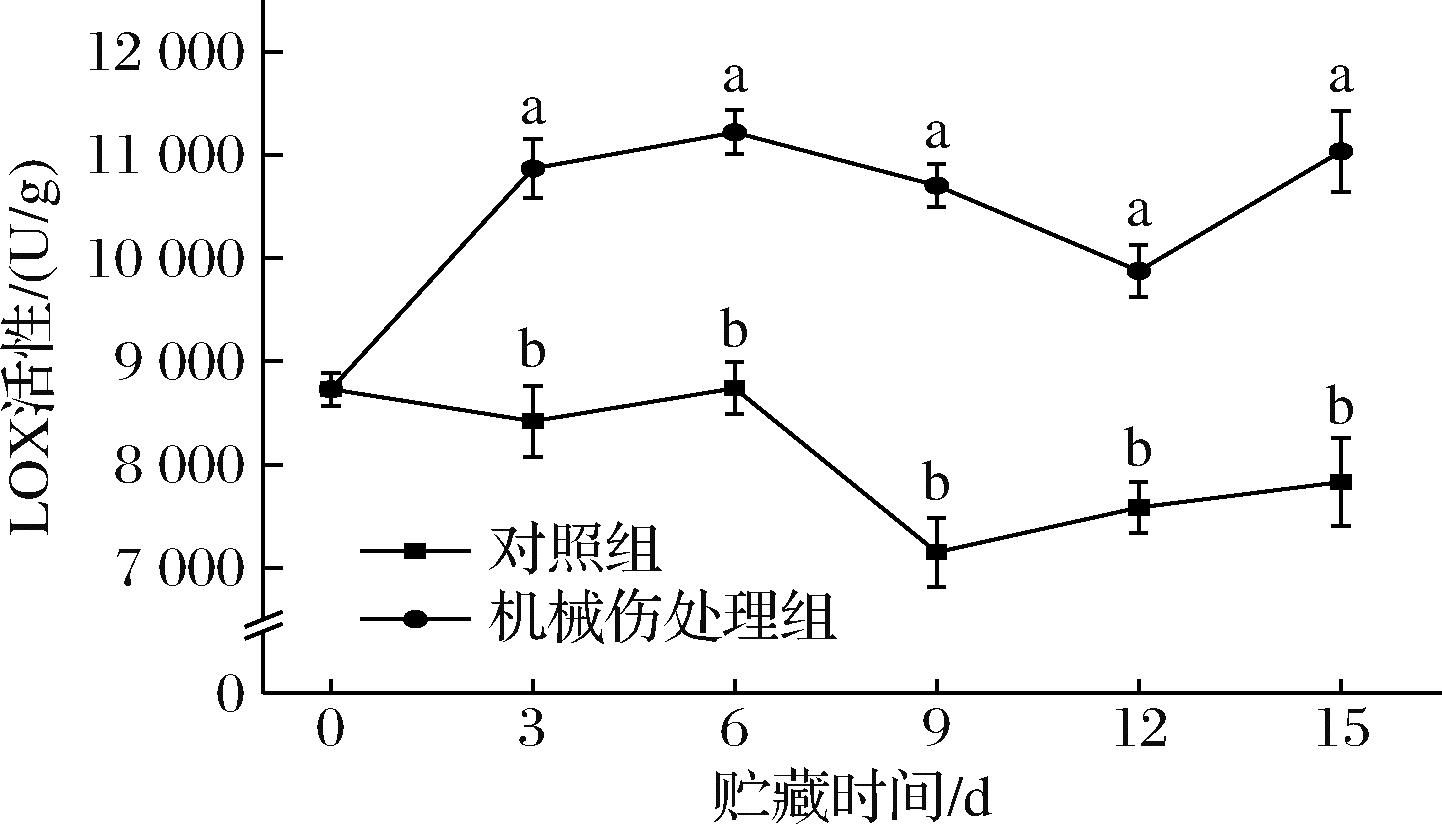
图4 机械损伤对香蕉果皮LOX活性影响
Fig.4 Effect of mechanical damage on LOX activity of banana peel
2.2.4 DGK活性的变化
DGK是磷脂代谢中至关重要的酶,它能够催化磷酸化反应,影响DAG和PA水平,进而调控磷脂代谢通路中相关的生理过程[16]。如图5所示,在整个贮藏期间,机械伤处理组的DGK活性显著高于对照组(P<0.05)。其中,对照组的DGK活性总体呈现下降趋势,在贮藏第15天时,活性降至94.05 U/g。而机械伤处理组的DGK活性总体呈现上升的趋势,在贮藏第15天达到了181.79 U/g,较对照组高出93%。结果表明,在贮藏过程中,机械伤处理可能刺激了细胞内的信号传导途径,DGK对机械伤胁迫产生应答,促使DGK的表达和功能得到增强。
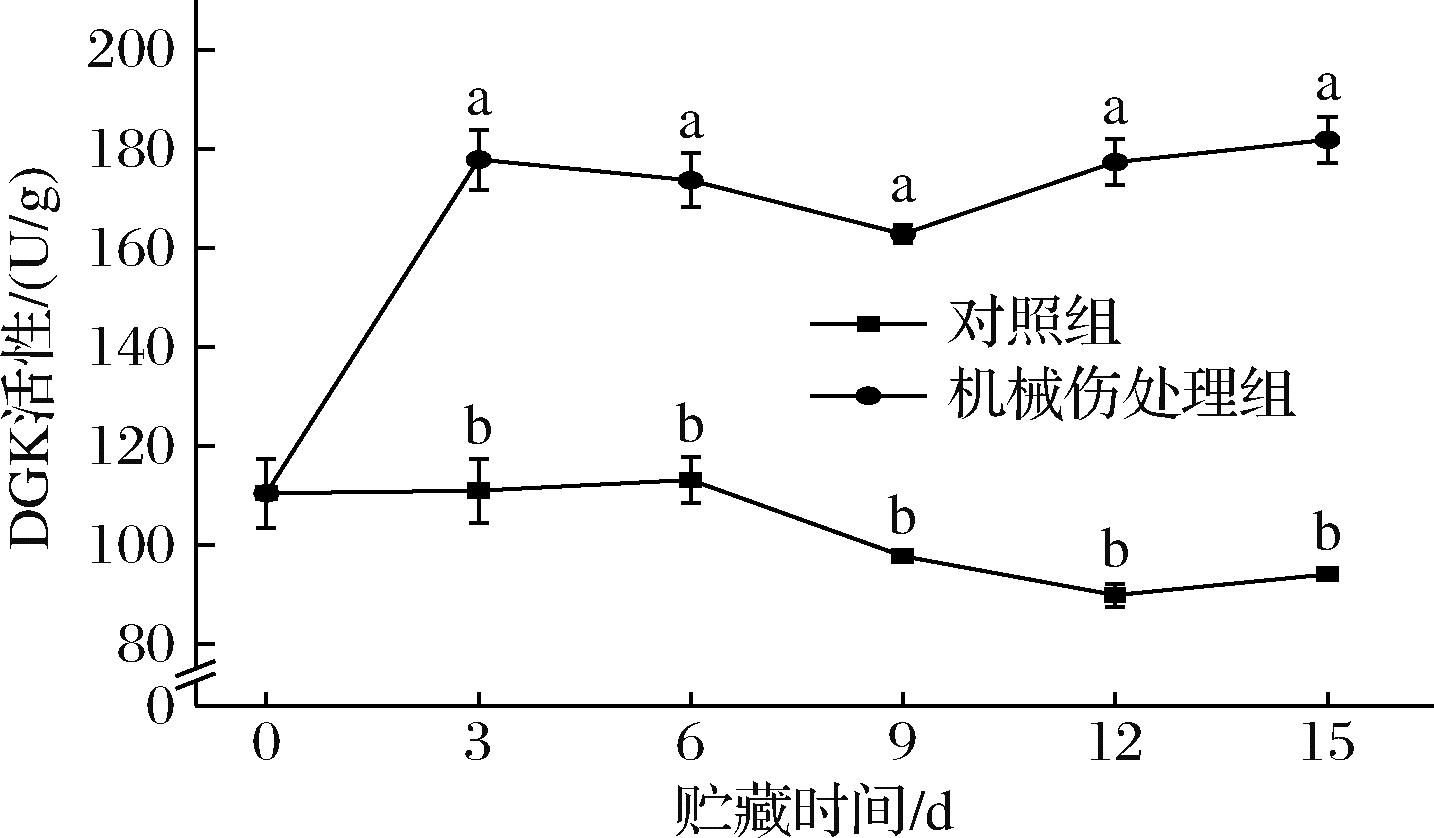
图5 机械损伤对香蕉果皮DGK活性影响
Fig.5 Effect of mechanical damage on DGK activity of banana peel
2.2.5 LPP活性的变化
LPP是一种存在于细胞膜上的磷酸水解酶,能够通过其去磷酸化产物调节细胞外脂类信号分子水平,对细胞的生理和病理过程产生影响[17]。如图6所示,贮藏3~12 d,机械伤处理组的LPP活性均显著高于对照组(P<0.05),其中第12天时机械伤处理组的LPP活性达到峰值,为105.52 U/g,较对照组高出55%。随着贮藏时间增加,香蕉果实腐烂加剧,在第15天时,机械伤处理组的LPP活性降至79.22 U/g,与对照组相比无显著差异(P>0.05)。由此推测,在贮藏前期,机械伤害导致细胞膜破裂,细胞内脂质过氧化反应加剧,LPP活性上升;随着贮藏时间延长,机械伤引起的细胞膜破裂和脂质过氧化会导致细胞内部的自我修复机制启动,细胞内部产生抗氧化物质对抗脂质过氧化反应,使LPP活性下降至正常水平。
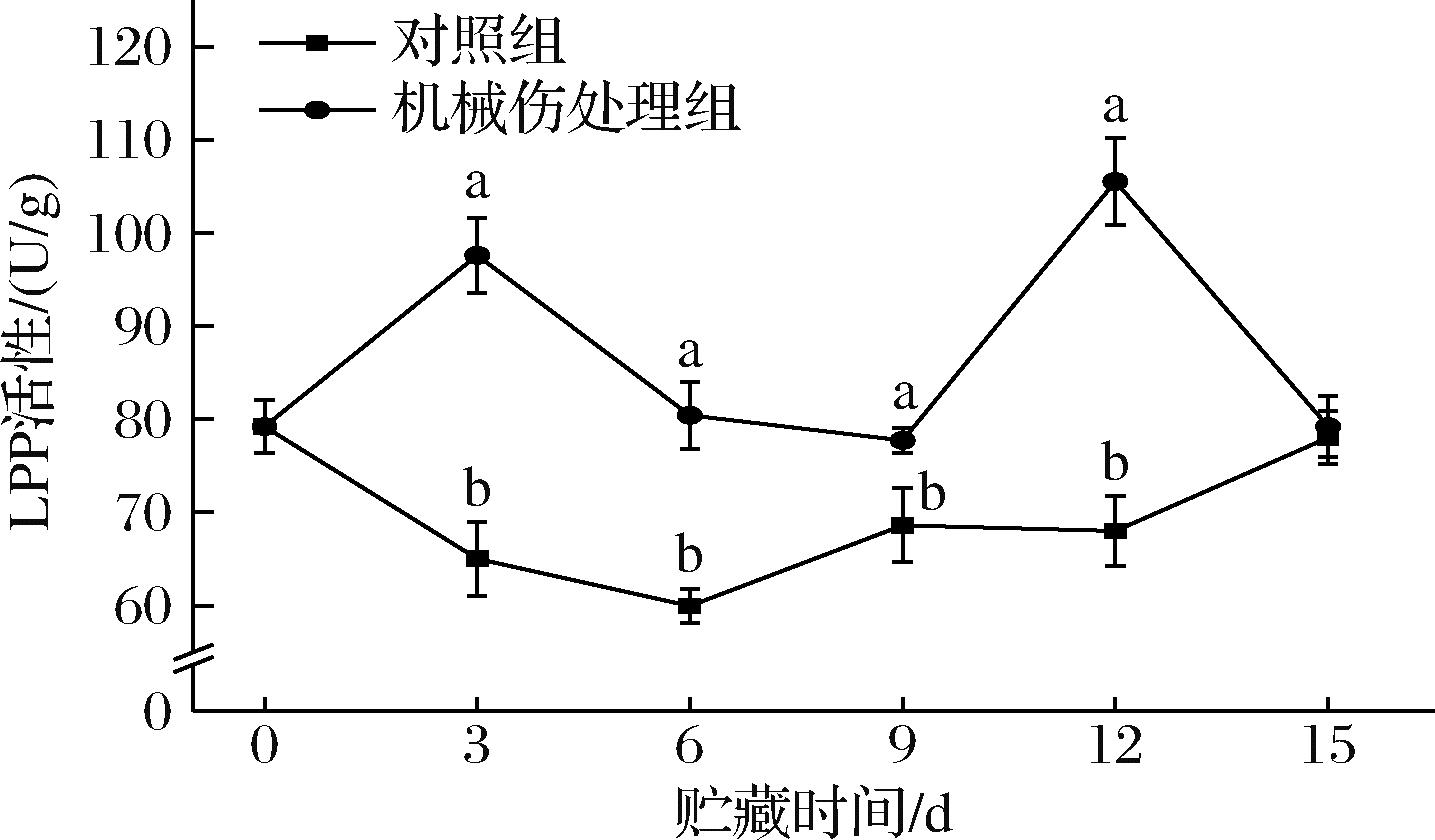
图6 机械损伤对香蕉果皮LPP活性影响
Fig.6 Effect of mechanical damage on LPP activity of banana peel
2.3 机械损伤对香蕉果皮细胞膜磷脂组分含量的影响
2.3.1 PA含量的变化
PA是细胞膜中最丰富的磷脂之一,不仅在脂质合成、细胞膜生物合成以及细胞内Ca2+调节等生理过程中发挥重要作用,同时还作为转运载体参与细胞内脂质代谢,在细胞内发挥着重要的生理功能[16]。如图7所示,机械伤处理组的PA含量总体呈现上升趋势。从贮藏第3天起,机械伤处理组的PA含量均显著高于对照组(P<0.05)。贮藏第6天时,2组PA含量均达到最大值,其中机械伤处理组的PA含量为79.65 μmol/g,对照组为57.09 μmol/g。贮藏15 d时,机械伤处理组的PA含量较对照组高出46%。由此推测,机械伤处理会导致香蕉果皮细胞膜发生破裂和损伤,使得细胞内的PA被释放。同时,这一过程激活了细胞内的信号通路,进而促使PA的合成和积累,使得PA总含量上升。
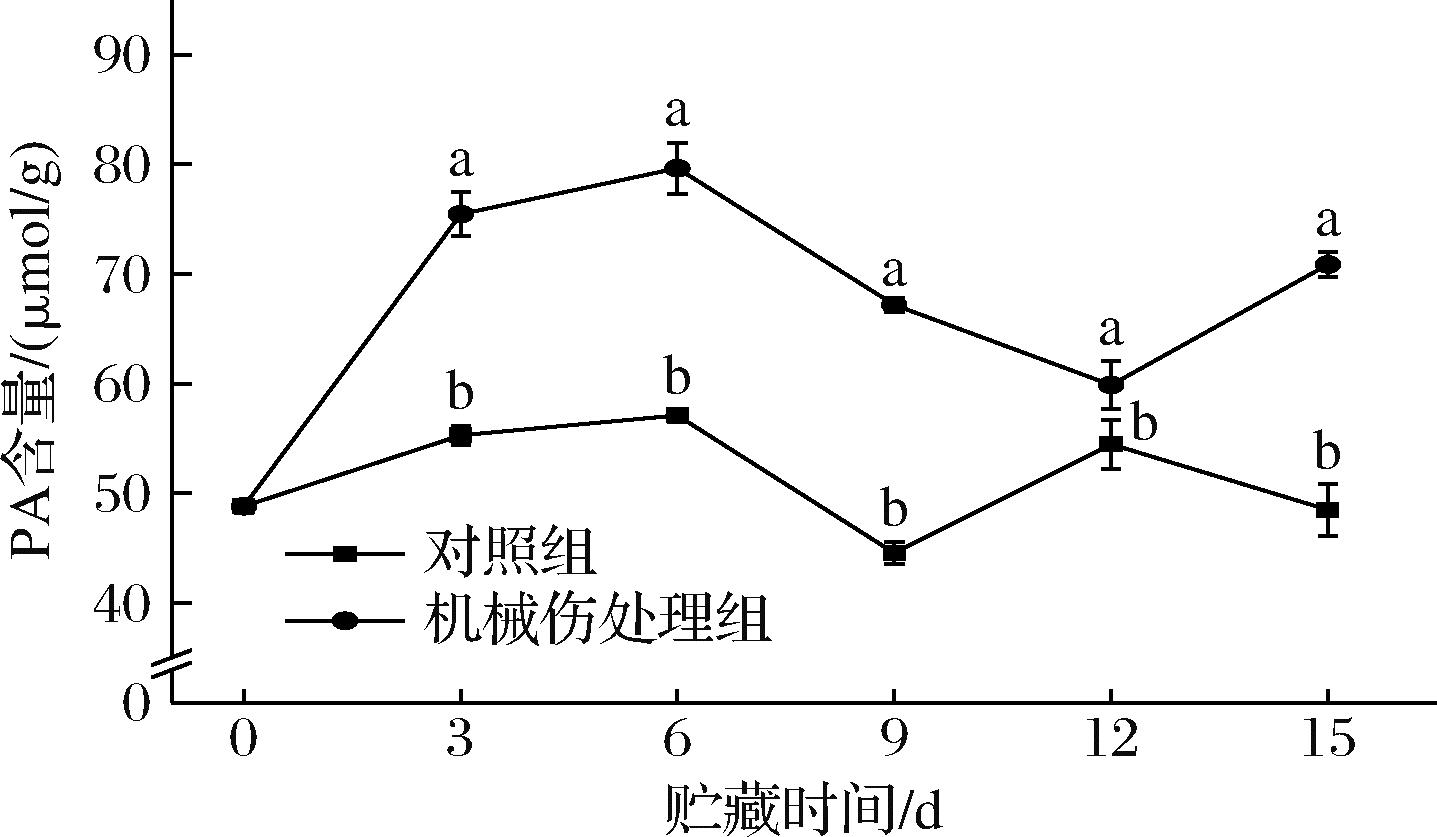
图7 机械损伤对香蕉果皮PA含量的影响
Fig.7 Effect of mechanical damage on PA content of banana peel
2.3.2 PC含量的变化
PC能够维持细胞膜基本结构的稳定,并参与细胞内的信号传导和离子通道调节等生理过程[18]。如图8所示,随着贮藏时间的增加,机械伤处理组和对照组的PC含量均呈现上升趋势。从贮藏第3天起,机械伤处理组的PC含量均显著高于对照组(P<0.05)。贮藏第15天时。机械伤处理组的PC含量达到最大值3 765.69 μmol/g,较对照组高出81%。由此推测,经过机械伤处理,香蕉果皮细胞膜破损,使得细胞内的PC被释放,PC含量增多。同时为修复受损的细胞膜,细胞内关键酶类被激活,促使PC合成,从而导致PC在细胞内积累。
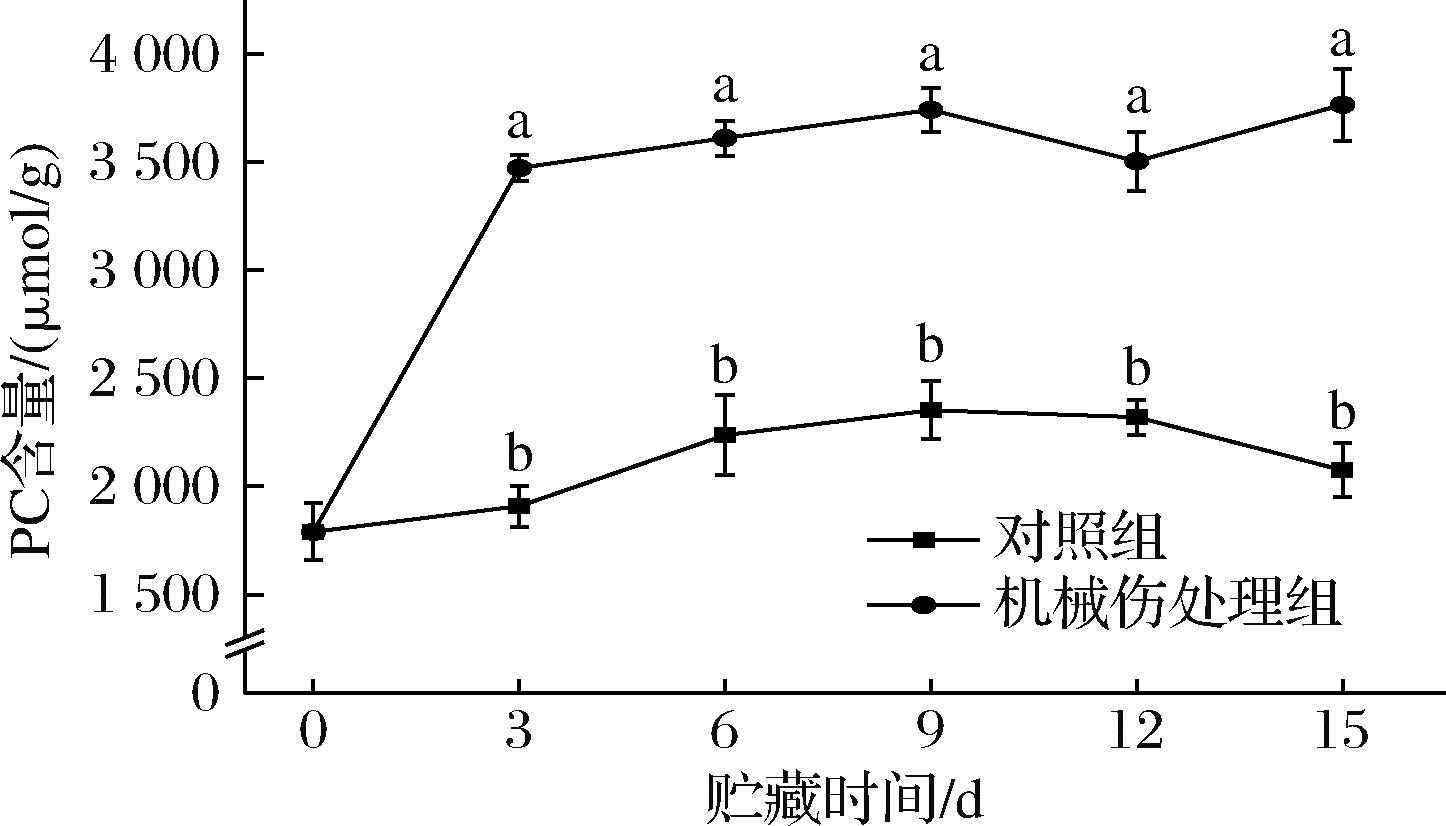
图8 机械损伤对香蕉果皮PC含量的影响
Fig.8 Effect of mechanical damage on the PC content of banana peel
2.3.3 PE含量的变化
PE是一种磷脂类化合物,能够维持细胞的基本形态和功能,并参与细胞内多种生理过程,如细胞信号传导、细胞膜的修复和脂质代谢等[19]。如图9所示,机械伤处理组PE含量总体呈现下降趋势,而对照组的PE含量总体变化较小。从贮藏第3天起,机械伤处理组的PE含量均显著低于对照组(P<0.05)。贮藏第6天时,机械伤处理组PE大量转化为PA,使得PA达到最大值,而PE含量达到最低值885.45 μmol/g,仅为对照组的70.67%。由此可知,当细胞膜因受到机械伤而发生破损时,细胞为重新构建新的细胞膜结构,促进细胞膜的修复和再生,会消耗细胞内PE含量,激活信号通路,从而导致细胞内PE含量下降。
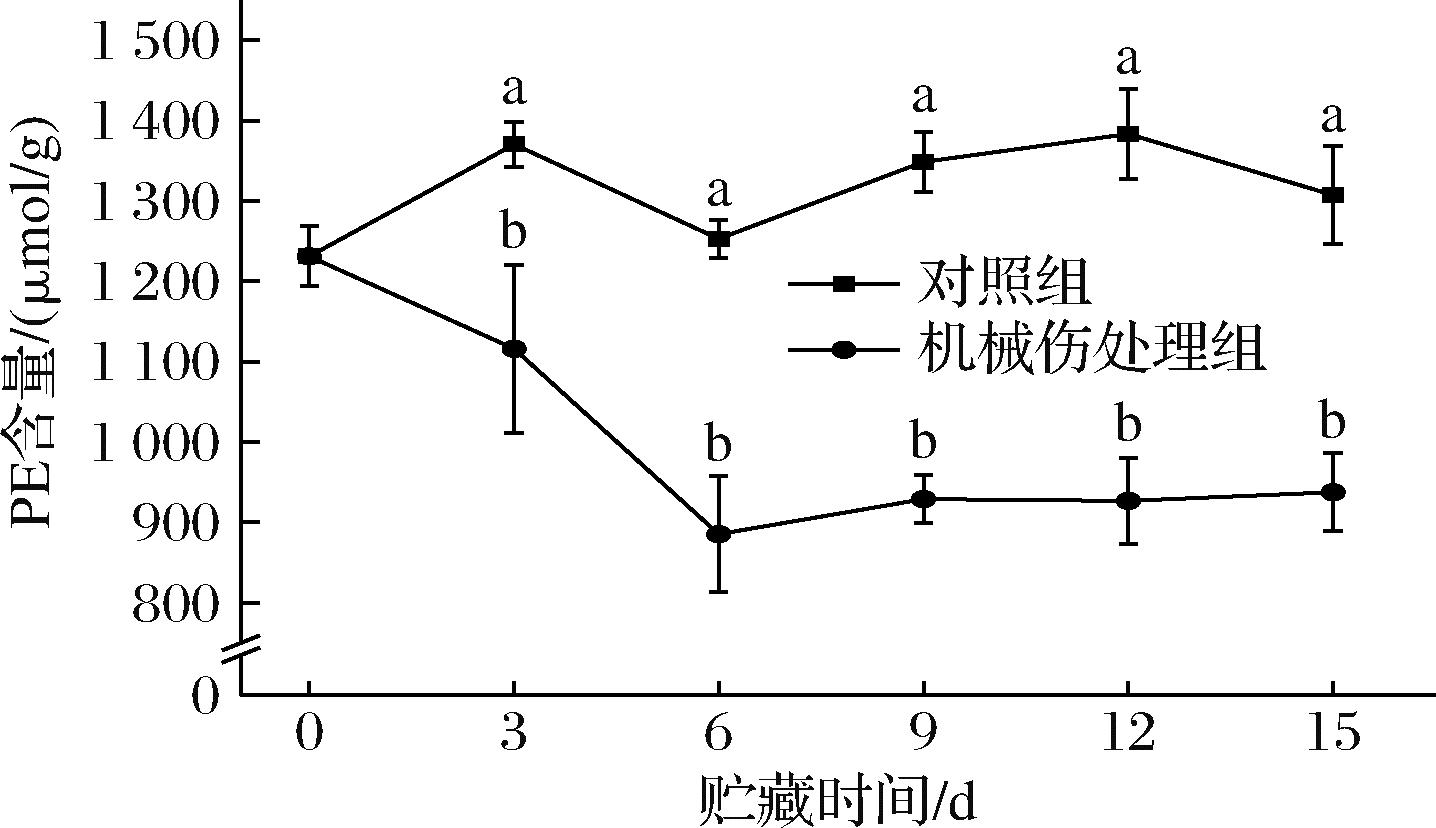
图9 机械损伤对香蕉果皮PE含量的影响
Fig.9 Effect of mechanical damage on the PE content of banana peel
2.3.4 DAG含量测定
DAG作为主要的非极性脂质之一,与其他磷脂分子共同构建了细胞膜的结构基础。如图10所示,机械伤处理组的DAG含量总体呈现上升趋势,而对照组的DAG含量在贮藏期间变化较小。从贮藏第3天起,机械伤处理组的DAG含量均显著高于对照组(P<0.05)。在贮藏第12天时,机械伤处理组的DAG含量达到最大值,为187.43 ng/g,较对照组高140%。由此推测,在机械伤作用下,细胞为修复细胞膜的破损,上调PLD活性,促使大量磷脂被水解并生成DAG,从而导致DAG含量增加,并为后续信号传导提供必要的营养支持,促进受损组织的修复和再生。
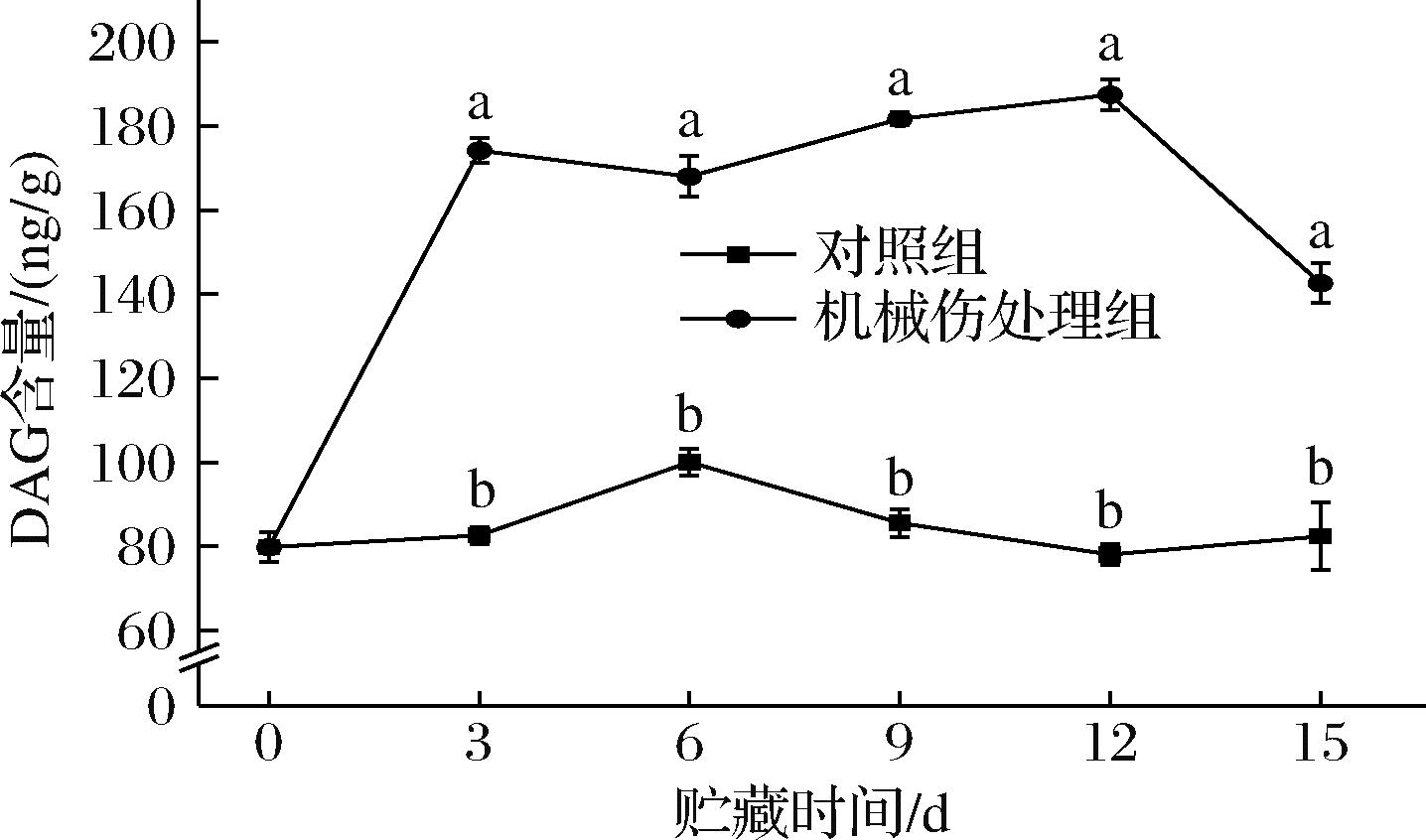
图10 机械损伤对香蕉果皮DAG含量的影响
Fig.10 Effect of mechanical damage on DAG content of banana peel
2.4 机械损伤对香蕉果皮PLD基因表达水平的影响
2.4.1 MaPLD1基因相对表达量
为研究机械损伤对香蕉果皮PLD基因的影响,本次试验对MaPLD1、MaPLD3及MaPLD4的相对表达量进行分析。如图11所示,香蕉果皮中的MaPLD1相对表达量整体呈现上升趋势。贮藏0~6 d时,机械伤处理组的MaPLD1基因相对表达量与对照组无显著性差异。然而,在贮藏9 d后,机械伤处理组的MaPLD1基因相对表达量显著高于对照组(P<0.05)。贮藏第15天时,机械伤处理组的MaPLD1基因相对表达量达到最大值,为11.53,较对照组高出88%。由此可知,机械伤处理会增强香蕉果皮中MaPLD1基因相对表达量,进而影响果皮细胞内的酶活反应,缩短香蕉果实的贮藏期限。
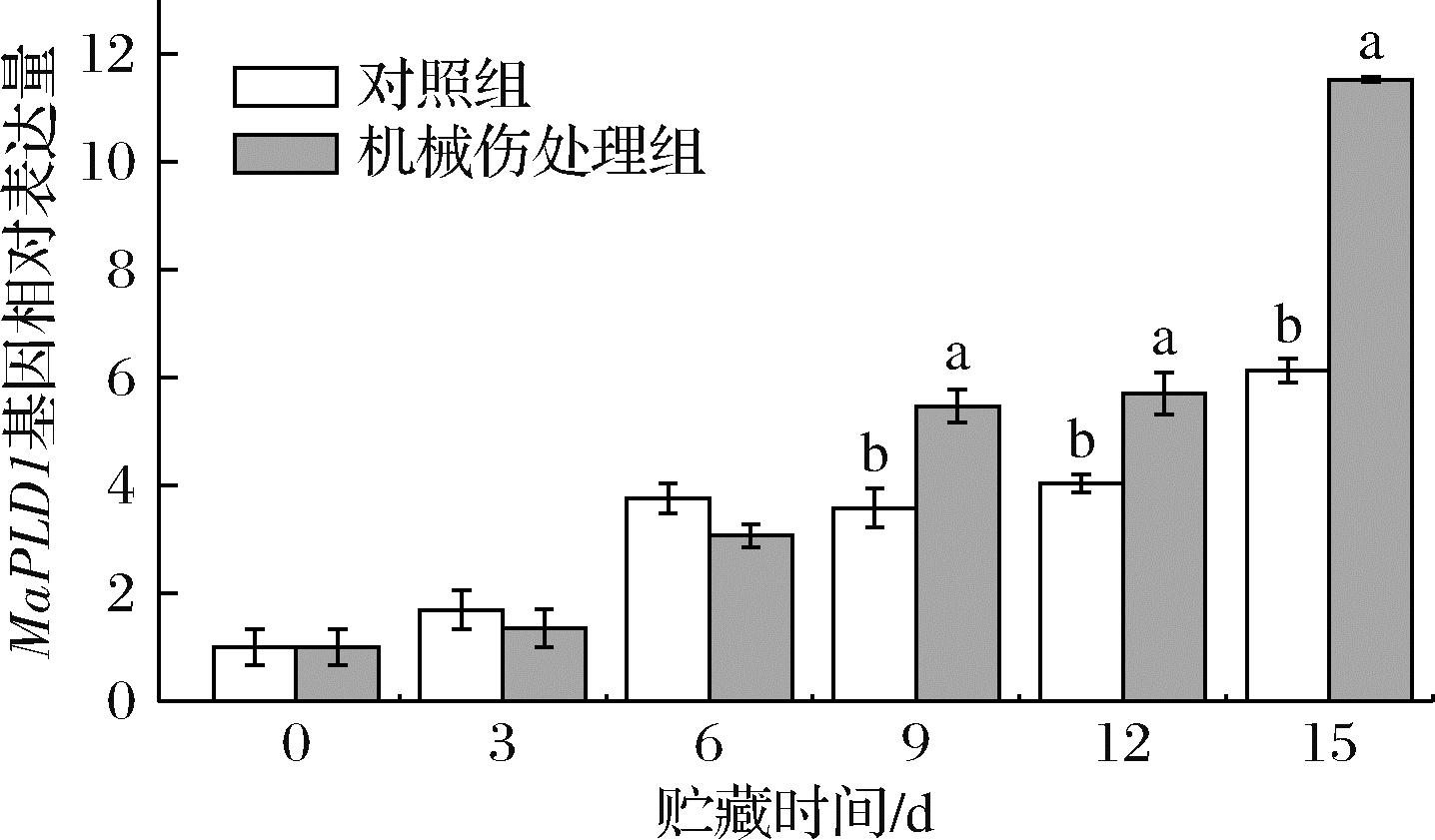
图11 机械损伤对香蕉果皮MaPLD1基因相对表达量的影响
Fig.11 Effect of mechanical damage on the relative expression of the MaPLD1 gene in banana peel
2.4.2 MaPLD3基因相对表达量
如图12所示,香蕉果皮MaPLD3基因相对表达量整体呈现先上升后下降的趋势。从贮藏第3天起,机械伤处理组的MaPLD3基因相对表达量显著低于对照组(P<0.05)。在贮藏第3天时,两者MaPLD3基因相对表达量达到峰值,此时机械伤处理组的MaPLD3基因相对表达量仅为对照组的68%。随着贮藏时间增加,两者MaPLD3基因相对表达量呈下降趋势。在贮藏第15天时,机械伤处理组的MaPLD3基因相对表达量降至0.095,仅为对照组的30%。由此推测,MaPLD3基因相对表达量与果实成熟度密切相关,随着果实成熟,MaPLD3基因相对表达量上升。然而,当果实开始腐烂时,MaPLD3表达被抑制。此外,与对照组相比,机械损伤处理可能会引发细胞内外的应激反应,进而抑制MaPLD3的进一步表达,导致其相对表达量降低。
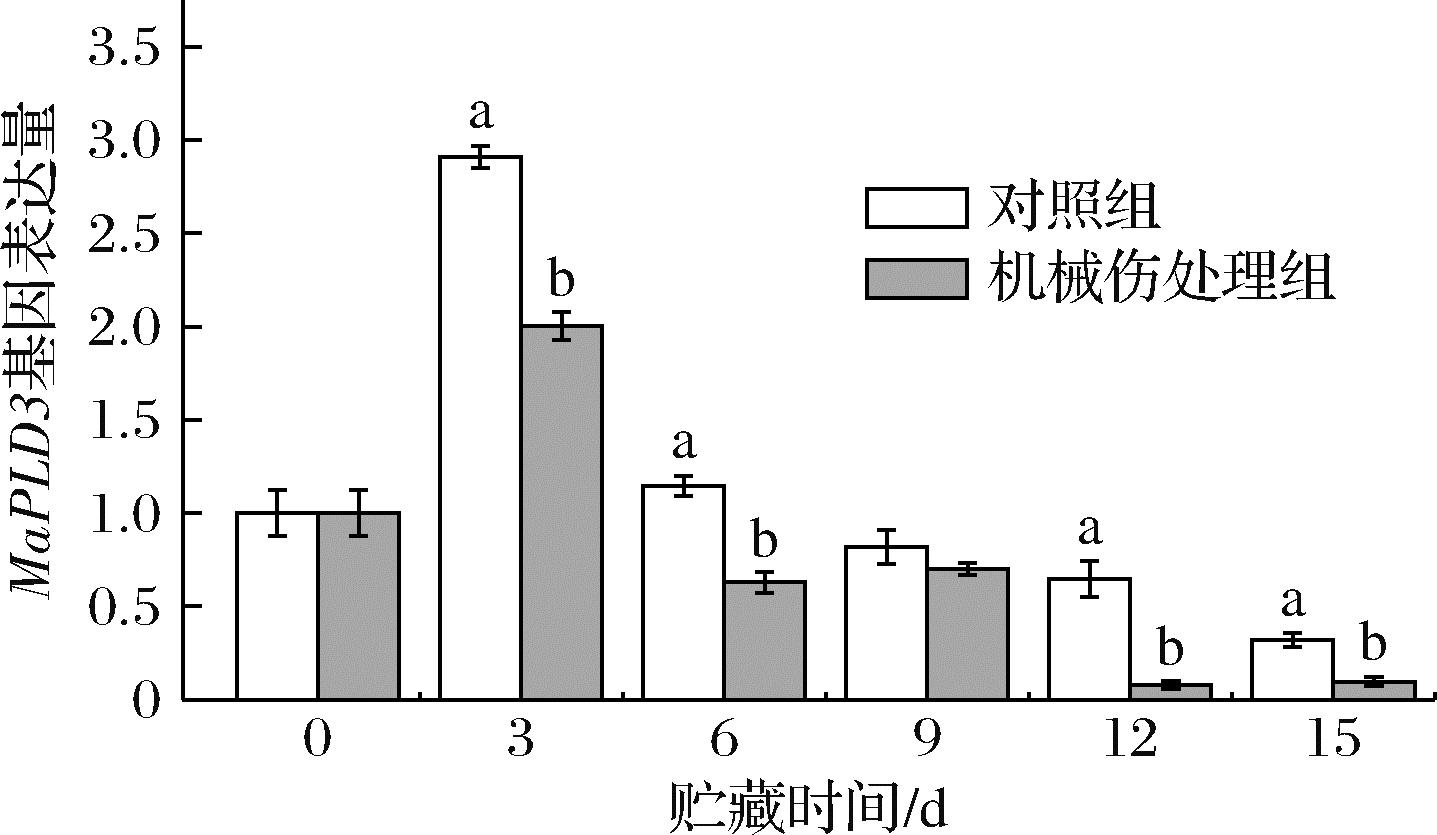
图12 机械损伤对香蕉果皮MaPLD3基因相对表达量的影响
Fig.12 Effect of mechanical damage on the relative expression of the MaPLD3 gene in banana peel
2.4.3 MaPLD4基因相对表达量
如图13所示,机械伤处理组的MaPLD4基因相对表达量总体呈现上升趋势。从贮藏第9天起,机械伤处理组的MaPLD4基因相对表达量均高于对照组,且两者具有显著性差异(P<0.05)。在贮藏第15天时,机械伤处理组的MaPLD4基因相对表达量达到峰值5.17,是对照组的3.27倍。由此推测,在机械伤胁迫下,细胞膜可能激活特定的信号通路,如磷酸肌酸途径和Ca2+信号通路等。这些信号通路的激活可能直接或间接地调节MaPLD4表达,导致其相对表达量上升。
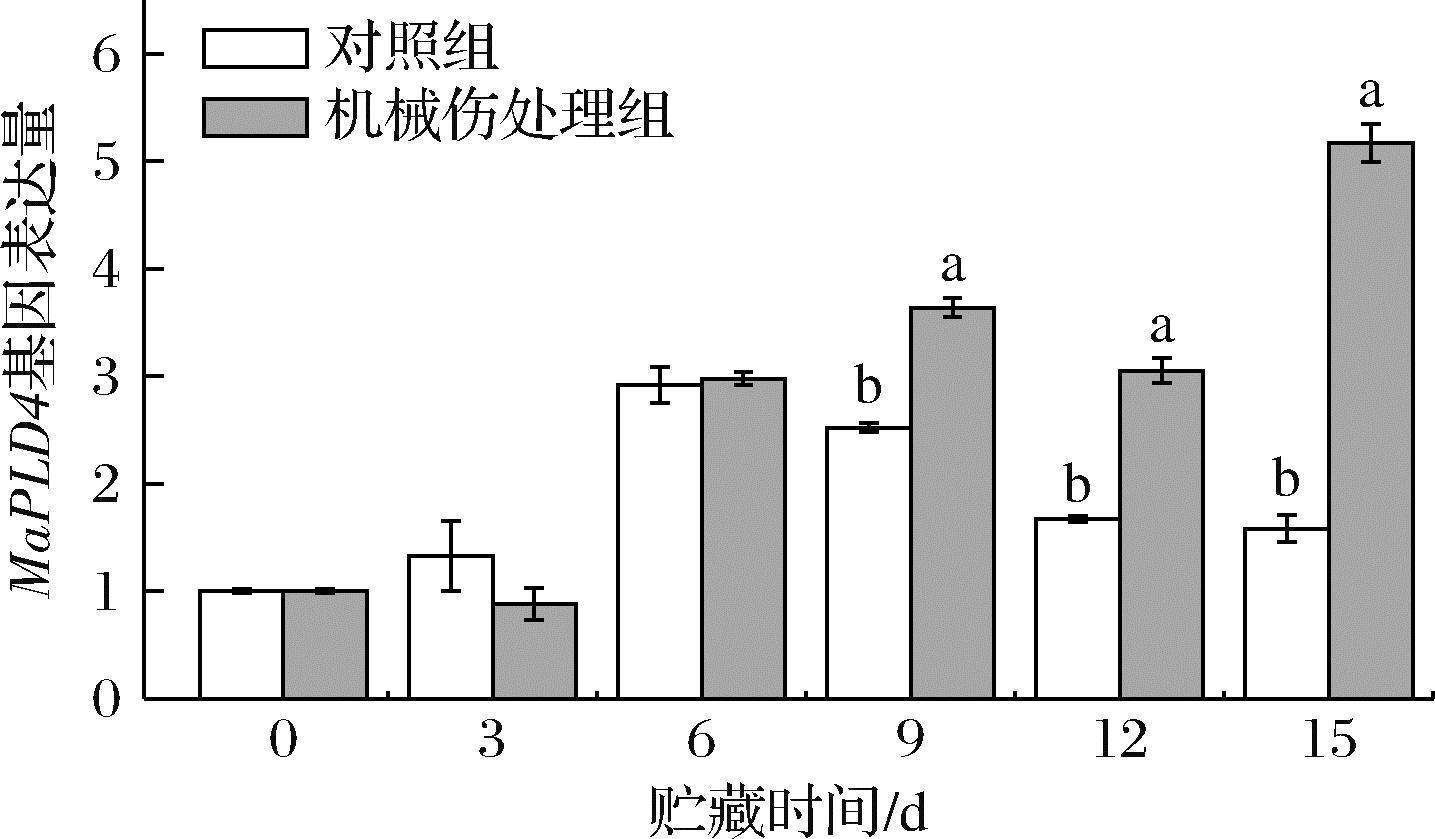
图13 机械损伤对香蕉果皮MaPLD4基因相对表达量的影响
Fig.13 Effect of mechanical damage on the relative expression of the MaPLD4 gene in banana peel
3 结论与讨论
细胞膜退化是植物细胞衰败和损伤的早期特征之一。当细胞膜受损时,细胞内容物流出,细胞内外环境失衡,细胞内部脂质代谢过程紊乱,从而直接影响果实的品质。因此,维护细胞膜的完整性,保持细胞内外环境的稳定,对香蕉果实生产和品质保持具有重要的意义。细胞膜渗透率是评价细胞膜完整性的关键指标,能有效地反映细胞膜的结构和功能状态的变化。本研究结果显示,随着贮藏时间推移,机械伤处理组的渗透率上升,较对照组高23%。任紫烟等[20]研究发现,随着贮藏时间延长,果实在遭受机械损伤后,果皮细胞膜的渗透率逐渐增加,与本研究结果一致。此外,LOX是维持细胞膜完整性的关键酶之一,当细胞受到损伤时,LOX被激活,能够促进细胞修复和再生过程。本研究结果表明,在贮藏15 d时,机械伤处理组的LOX活性增大,较对照组高41%。唐燕等[21]以损伤猕猴桃为研究对象,发现LOX活性在贮藏期间整体呈现上升趋势,与本研究的结果相符,证实机械伤胁迫能够刺激LOX活性增强。
研究发现,细胞膜完整性的丧失还与细胞内磷脂的降解有关[22]。磷脂作为细胞膜的主要成分之一,在维护细胞结构和功能的方面有着重要作用。在机械损伤胁迫下,细胞内的PLC、PLD、LPP以及DGK等膜脂代谢关键酶被激活,催化细胞膜上的PC和PE等磷脂物质发生水解反应,从而导致细胞膜降解。同时,磷脂水解生成的PA和DAG等物质将进一步参与到细胞内的各种代谢途径,在一定程度上调节细胞的生长和修复。因此,通过调节不同的磷脂代谢酶活性,植物细胞能够有效应对外部环境的变化,实现损伤修复[23]。本研究结果显示,在贮藏期间,机械伤处理组的PLC、PLD、LPP以及DGK等酶活性显著高于对照组(P<0.05),PA、PC以及其代谢产物DAG含量显著上升(P<0.05),而PE含量下降。WANG等[24]指出PLD和PA参与植物对环境逆境的应答,在机械损伤、干旱以及盐碱等逆境条件下,PLD被激活并产生更多的PA。KUE FOKA等[16]指出PA是植物脂质信号传导的关键分子,植物能够通过调节PA水平感知外界环境压力并启动相应的防御机制。因此,PA的积累能够直接影响植物对环境变化做出的适应性反应。
PLD作为磷脂代谢的关键酶之一,在逆境胁迫下会被激活并参与多个信号传导通路,以调节植物对逆境的应答。PLD在逆境胁迫中能够产生游离脂肪酸以及DAG等来影响细胞膜的结构和功能,同时能够激活并催化PC转化为PA来调节逆境相关基因的表达[25]。当细胞受到外部损伤时,PLD活性会出现过高或异常激活现象,细胞内外环境的平衡和稳定被打破,导致细胞膜功能紊乱,脂质屏障功能受损,进而引发严重的膜伤害[26]。在本研究中,机械伤胁迫下MaPLD3基因的表达被抑制,而MaPLD1和MaPLD4的相对表达量增加,PLD活性增强。ZIEN等[27]和WANG等[28]指出拟南芥叶片中的PLDα,PLDβ,PLDγ等基因相对表达量可被外界创伤诱导激活,PLD活性增大。ZHANG等[29]研究表明PLDζ和PA通过调节与氧化应激反应和细胞死亡调控相关的基因表达来发挥作用,PLDζ的表达可能有助于削弱植物的胁迫反应。LI等[30]通过研究发现损伤香蕉的PLD基因表达在贮藏第4天时达到峰值,并且在整个贮藏期间PLD活性都显著高于对照组。
本研究表明,从贮藏第3天起,机械伤处理组的细胞膜渗透率、PLC、PLD、LOX、DGK、LPP、PA、PC和DAG均大于对照组,且贮藏期间差异显著(P<0.05);PE含量以及MaPLD3基因相对表达量均显著小于对照组(P<0.05)。从贮藏第9天起,机械伤处理组的MaPLD1和MaPLD4基因相对表达量均显著大于对照组(P<0.05),且在第15天时,机械伤处理组MaPLD1和MaPLD4基因相对表达量分别为对照组的1.88倍和3.27倍;机械伤处理组的细胞膜渗透率较对照组高23%;膜脂代谢相关酶PLC、PLD、LOX以及DGK活性分别较对照组高58%、52%、41%和93%;细胞膜磷脂组分PA、PC以及DAG含量分别较对照组高46%、81%和73%;PE含量以及MaPLD3基因相对表达量下降至对照组的70.67%和30%。本文通过研究机械伤胁迫对香蕉细胞膜透性、膜脂代谢相关酶活以及PLD基因表达量的影响,为以后从膜脂代谢角度分析香蕉对机械伤的应答机制提供参考依据。
[1] DWIVANY F M, APRILYANDI A N, SUENDO V, et al.Carrageenan edible coating application prolongs Cavendish banana shelf life[J].International Journal of Food Science, 2020, 2020:8861610.
[2] FERNANDO I, FEI J G, STANLEY R.Measurement and analysis of vibration and mechanical damage to bananas during long-distance interstate transport by multi-trailer road trains[J].Postharvest Biology and Technology, 2019, 158:110977.
[3] LIN Y X, LIN H T, CHEN Y H, et al.Hydrogen peroxide-induced changes in activities of membrane lipids-degrading enzymes and contents of membrane lipids composition in relation to pulp breakdown of Longan fruit during storage[J].Food Chemistry, 2019, 297:124955.
[4] 林毅雄, 林河通, 陈艺晖, 等.采前喷施胺鲜酯对采后龙眼果实贮藏期间果皮膜脂代谢的影响[J].食品科学, 2019, 40(21):203-210.
LIN Y X, LIN H T, CHEN Y H, et al.Effect of pre-harvest spraying of diethyl aminoethyl hexanoate on membrane lipid metabolism in pericarp of Longan fruits during postharvest storage[J].Food Science, 2019, 40(21):203-210.
[5] HOU Q C, UFER G, BARTELS D.Lipid signalling in plant responses to abiotic stress[J].Plant, Cell &Environment, 2016, 39(5):1029-1048.
[6] ALI U, LU S P, FADLALLA T, et al.The functions of phospholipases and their hydrolysis products in plant growth, development and stress responses[J].Progress in Lipid Research, 2022, 86:101158.
[7] TASMA I M, BRENDEL V, WHITHAM S A, et al.Expression and evolution of the phosphoinositide-specific phospholipase C gene family in Arabidopsis thaliana[J].Plant Physiology and Biochemistry, 2008, 46(7):627-637.
[8] SINGH A, KANWAR P, PANDEY A, et al.Comprehensive genomic analysis and expression profiling of phospholipase C gene family during abiotic stresses and development in rice[J].PLoS One, 2013, 8(4):e62494.
[9] 许佳妮, 邓丽莉, 曾凯芳.磷脂酶D在果蔬采后逆境胁迫及衰老过程中的作用[J].食品工业科技, 2015, 36(5):392-395;399.
XU J N, DENG L L, ZENG K F.Role of phospholipase D in postharvest fruits and vegetables under stress and during senescence[J].Science and Technology of Food Industry, 2015, 36(5):392-395;399.
[10] YI P, LI L, SUN J, et al.Characterization and expression of phospholipase D putatively involved in Colletotrichum musae disease development of postharvest banana fruit[J].Horticulturae, 2022, 8(4):312.
[11] 黄敏, 唐杰, 黄方, 等.机械损伤对香蕉采后品质及抗氧化酶活性的影响[J].食品工业, 2022, 43(10):151-155.
HUANG M, TANG J, HUANG F, et al.Effect of mechanical injury on quality and antioxidant enzyme activity of postharvest banana[J].The Food Industry, 2022, 43(10):151-155.
[12] 吴小建, 陈茜, 梁朋光, 等.炭疽病胁迫下采后香蕉的膜脂代谢[J].南方农业学报, 2021, 52(5):1325-1333.
WU X J, CHEN X, LIANG P G, et al.Membrane lipid metabolism of postharvest banana under anthracnose stress[J].Journal of Southern Agriculture, 2021, 52(5):1325-1333.
[13] LI L, YI P, HUANG F, et al.Effects of phospholipase D inhibitors treatment on membrane lipid metabolism of postharvest banana fruit in response to mechanical wounding stress[J].Horticulturae, 2022, 8(10):901.
[14] SHUAI L, LI L, SUN J, et al.Role of phospholipase C in banana in response to anthracnose infection[J].Food Science &Nutrition, 2020, 8(2):1038-1045.
[15] 李会容, 赵昶灵, 杨焕文, 等.高等植物脂氧合酶活性测定方法的研究进展[J].中国农学通报, 2011, 27(15):217-223.
LI H R, ZHAO C L, YANG H W, et al.Research advances in the assay methods of the lipoxygenase activity in higher plants[J].Chinese Agricultural Science Bulletin, 2011, 27(15):217-223.
[16] KUE FOKA I C, KETEHOULI T, ZHOU Y G, et al.The emerging roles of diacylglycerol kinase (DGK) in plant stress tolerance, growth, and development[J].Agronomy, 2020, 10(9):1375.
[17] BRINDLEY D N, PILQUIL C, SARIAHMETOGLU M, et al.Phosphatidate degradation:Phosphatidate phosphatases (lipins) and lipid phosphate phosphatases[J].Biochimica et Biophysica Acta, 2009, 1791(9):956-961.
[18] SUN M X, LIU X L, GAO H F, et al.Phosphatidylcholine enhances homeostasis in peach seedling cell membrane and increases its salt stress tolerance by phosphatidic acid[J].International Journal of Molecular Sciences, 2022, 23(5):2585.
[19] 沈晓华. 高含量磷脂酰乙醇胺的制备[D].无锡:江南大学, 2022.
SHEN X H.Preparation of high content phosphatidylethanolamine[D].Wuxi:Jiangnan University, 2022.
[20] 任紫烟, 程玉豆, 关晔晴, 等.机械损伤对‘鸭梨’褐变的影响[J].食品科技, 2021, 46(6):35-41.
REN Z Y, CHENG Y D, GUAN Y Q, et al.Effects of mechanical damage on browning in ‘yali’ pear[J].Food Science and Technology, 2021, 46(6):35-41.
[21] 唐燕, 张继澍.机械损伤对猕猴桃果实生理与膜脂过氧化的影响[J].中国食品学报, 2012, 12(4):140-145.
TANG Y, ZHANG J S.Influence of damages on kiwifruits of physiological index and membrane lipid peroxidation[J].Journal of Chinese Institute of Food Science and Technology, 2012, 12(4):140-145.
[22] FOBEL M, LYNCH D V, THOMPSON J E.Membrane deterioration in senescing carnation flowers:Coordinated effects of phospholipid degradation and the action of membranous lipoxygenase[J].Plant Physiology, 1987, 85(1):204-211.
[23] NAKAMURA Y.Plant phospholipid diversity:Emerging functions in metabolism and protein-lipid interactions[J].Trends in Plant Science, 2017, 22(12):1027-1040.
[24] WANG X M.Regulatory functions of phospholipase D and phosphatidic acid in plant growth, development, and stress responses[J].Plant Physiology, 2005, 139(2):566-573.
[25] BARGMANN B O R, MUNNIK T.The role of phospholipase D in plant stress responses[J].Current Opinion in Plant Biology, 2006, 9(5):515-522.
[26] PINHERO R G, PALIYATH G, YADA R Y, et al.Modulation of phospholipase D and lipoxygenase activities during chilling.Relation to chilling tolerance of maize seedlings[J].Plant Physiology and Biochemistry, 1998, 36(3):213-224.
[27] ZIEN C A, WANG C X, WANG X M, et al.In vivo substrates and the contribution of the common phospholipase D, PLDα, to wound-induced metabolism of lipids in Arabidopsis[J].Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids, 2001, 1530(2-3):236-248.
[28] WANG C, ZIEN C A, AFITLHILE M, et al.Involvement of phospholipase D in wound-induced accumulation of jasmonic acid in Arabidopsis[J].The Plant Cell, 2000, 12(11):2237-2246.
[29] ZHANG W H, WANG C X, QIN C B, et al.The oleate-stimulated phospholipase D, PLDdelta, and phosphatidic acid decrease H2O2-induced cell death in Arabidopsis[J].The Plant Cell, 2003, 15(10):2285-2295.
[30] LI L, HE X M, SUN J, et al.Responses of phospholipase D and antioxidant system to mechanical wounding in postharvest banana fruits[J].Journal of Food Quality, 2017, 2017(1):8347306.