番茄(Solanum lycopersicum L.)又被称为“菜中之果”,是一种具有较高营养价值的蔬菜作物[1]。番茄是一种呼吸跃变型的果实,在采摘后发生后熟。如果收获后的贮藏条件和方法不理想,番茄的软化、腐烂和变质就会加剧,导致各种病原菌的侵袭,番茄的贮藏品质下降,最终逐渐失去商业价值,造成巨大的经济损失[2]。近年来由于消费市场的全球化,对更为优质的果蔬需求不断加大,因此延长果蔬的贮藏期变得尤为重要[3]。
ε-聚赖氨酸(ε-polylysine, ε-PL)是一种天然的多肽抗菌药品,它能够有效地抵御革兰氏阳性菌、革兰氏阴性菌、酵母菌以及霉菌等各类微生物,并具备优秀的热稳定性,水溶性好,对人体无毒,2003年,ε-PL在美国被列为FDA许可的添加剂,并被广泛应用于食品中[4]。SUN等[5]对ε-PL和壳寡糖联合生物杀菌剂在控制西红柿灰霉病方面的协同效应进行了研究,实验结果表明经过这种组合的抗菌剂处理,番茄中的水杨酸和茉莉酸的浓度有所提升,而苯丙氨酸氨裂解酶、过氧化物酶以及超氧化物歧化酶的活性也有所提高。刘欣洁[6]进行了ε-PL复配对番茄灰霉病防治的增效作用研究,实验结果表明ε-PL与壳寡糖的复配对灰霉病菌菌丝生长的抑制作用更明显,并且其抑制率与壳寡糖浓度呈正比,对灰霉菌菌丝生长的抑制作用可达90%以上,且效果稳定。曹森等[7]将猕猴桃浸泡在1 g/L ε-PL、0.8 g/L纳他霉素和 0.8 g/L壳聚糖的水溶液中作为试验材料,结果发现所有这些物质都能延缓果实老化,保持果实品质。
纳他霉素(natamycin, NT)因其在控制真菌生长方面的功效而闻名,在食品工业中用作防腐剂已有30多年的历史。纳他霉素是一种天然防腐剂,提取自一种名为“纳他链霉菌”的微生物,与其他防腐剂相比,这种防腐剂最受欢迎的原因是它没有气味和颜色,世界卫生组织(World Health Organization,WHO)、欧洲食品安全局(European Food Safety Authority,EFSA)和美国食品和药物管理局(Food and Drug Administration,FDA)在对其进行全面评估后,将其列为公认安全(Generally Recognized as Safe,GRAS)物质,欧盟将其视为天然防腐剂,并标有E编号[8]。YANG等[9]研究了一种掺入纳他霉素/甲基-β-环糊精包合物开发淀粉基抗真菌涂膜,用于抗樱桃番茄采后贮藏期间灰霉菌病害的发生,其实验结果证明,添加纳他霉素的涂膜材料可减少番茄贮藏过程中的失重,延缓果实成熟,抑制灰霉菌引起的果实腐烂。巴良杰等[10]探讨了纳他霉素在火龙果采后贮藏保鲜上的作用,结果发现,纳他霉素的应用能够大幅度减缓火龙果的生长过程,并且能够确保果实的贮藏质量,特别是在0.8 g/L的纳他霉素处理下,表现出的效果尤为突出。
基于以上研究,为了探究ε-PL和NT两种不同生物保鲜剂处理对番茄采后贮藏效果的影响,本研究以番茄为实验材料,通过对对照(control,CK)、ε-PL、NT三组处理进行营养、生理、衰老3种指标和生理变化相关酶的测定,通过实验数据分析得出最适合番茄的采后贮藏方式。通过本实验结果,以期找寻一种安全且经济的采后贮藏保鲜方式,为有效延缓番茄品质劣变、延长贮藏时间提供一定的理论依据及数据支撑。
1 材料与方法
1.1 材料与试剂
番茄,品种为美琪,2023年4月19日于北京平谷采收。采收完毕后立即运往国家农产品保鲜工程技术研究中心(天津)进行挑选和处理,挑选果实大小均匀、无明显病虫害现象、无明显机械损伤现象的果实作为试验试材。
冰醋酸、醋酸钠、硫酸、聚乙二醇、聚乙烯吡咯烷酮、体积分数为95%的乙醇、无水乙醇、苯酚、考马斯亮蓝G-250、NaOH、H2O2、偏磷酸、草酸、EDTA、钼酸铵、磷酸钠、正己烷、丙酮、三氯乙酸、硫代巴比妥酸、甲醇、碳酸钠、亚硝酸钠、硝酸铝、磷酸氢二钾、磷酸二氢钾、抗坏血酸、硼酸、硼砂,天津市大茂化学试剂厂;Trion X-100、β-巯基乙醇、l-苯丙氨酸、愈创木酚,上海麦克林生化科技股份有限公司;体积分数为85%的磷酸、酒石酸钾钠,天津市科密欧化学试剂有限公司;几丁质酶试剂盒,南京建成生物工程研究所有限公司;福林酚、β-1,3-葡聚糖酶试剂盒,北京索莱宝科技有限公司;纳他霉素、ε-PL,浙江新银象生物工程有限公司;PE纳米膜(规格:400 mm×550 mm×0.03 mm),上海复命新材料科技有限公司;1-MCP,国家农产品保鲜工程技术研究中心(天津)提供。
1.2 仪器与设备
岛津2010气相色谱仪,日本岛津公司;722-100可见分光光度计,上海佑科仪器仪表有限公司;Synergy H1全功能微孔板检测仪酶标仪,美国伯腾仪器有限公司;恒温水浴锅,金坛市金南仪器制造有限公司;Sigma 3-30k高速冷冻离心机,德国SIGMA离心机有限公司;916 Ti-Touch自动电位滴定仪,瑞士万通公司;A11 basic研磨机,德国IKA公司;ML503/02分析天平,梅特勒-托利多仪器(上海)有限公司;MDF-U32V(N)超低温冰箱,日本三洋电机株式会社;PAL-1便携式手持折光仪,日本爱宕公司;Check PiontⅡ便携式残氧仪,丹麦Dansensor公司。
1.3 实验处理
(1)挑选果实大小均匀、无明显病虫害现象、无明显机械损伤现象的番茄果实。
(2)将挑选后的番茄每13个放入1个PE袋中进行包装,放入泡沫箱中进行贮藏,记为CK组。
(3)将番茄整齐摆放至托盘中,将配好的质量浓度为1.0 g/L的ε-PL溶液均匀喷涂在整个番茄表面,自然风干后将每13个番茄放入1个PE袋中进行包装,放入泡沫箱中进行贮藏,记为ε-PL处理组。
(4)将番茄整齐摆放至托盘中,将配好的质量浓度为0.8 g/L的纳他霉素溶液均匀喷涂在整个番茄表面,自然风干后将每13个番茄放入1个PE袋中进行包装,放入泡沫箱中进行贮藏,记为NT处理组。
(5)将3组处理统一放入0 ℃冷库预冷24 h,然后进入贮藏期,每次实验结束后每组处理取番茄果肉部分用液氮进行冻样处理,然后将其转移至-80 ℃超低温冰箱中保藏,用于后续生理变化相关酶活性的测定。
1.4 实验方法
1.4.1 感官调查
参考韦强等[11]的方法,感官评分标准见表1。
表1 番茄总体感官质量评分标准
Table 1 Standard scoring criteria for overall sensory quality of tomatoes

评分(分)色泽气味外观腐烂程度质地7.5~10果实呈红色或橙红色,色泽均匀番茄特有清香番茄表面很滑,有光泽,无任何水渍、斑和黏性新鲜,无腐败软硬度适中5~7.4果实颜色变深,视觉效果下降无清香但也无异味番茄表面略滑,无水渍黏性,轻微失水,外形较规整不新鲜,<5%出现腐烂斑点果实开始软化,部分位置开始变软2.5~4.9果实逐渐由橙红色变为深红色轻微异味番茄表面有萎疲软态,果实部分软化5%~30%腐败变质果实软化较为严重,明显变软0~2.4果实完全变为暗红色异味严重其萎蔫明显,外表皱缩软烂,失水严重30%以上腐败变质果实整体软化,出现软烂现象
1.4.2 可溶性固形物
参考韦强等[11]的方法进行测定,实验重复6次。
1.4.3 可滴定酸
采用李文生等[12]的方法进行测定。
1.4.4 可溶性蛋白
采用考马斯亮蓝染色法[13]进行测定。
1.4.5 维生素C
采用钼蓝比色法[14]进行测定。
1.4.6 番茄红素
参考赵焕兰等[15]的方法进行测定。
1.4.7 呼吸速率
参考张鹏等[16]的方法,并略作修改,随机选取3颗质量接近的番茄装入750 mL的圆柱形密闭保鲜盒。在20 ℃下静置2 h后,测定盒内CO2浓度,然后计算番茄的呼吸速率,各处理重复3次,取平均值。
1.4.8 乙烯生成速率
参考张鹏等[17]的方法,并略作修改,随机选取3颗质量接近的番茄装入750 mL的圆柱形密闭保鲜盒。在20 ℃下静置2 h后使用1.0 mL玻璃进样针进样,在气相色谱进样口温度160 ℃、色谱柱温度60 ℃、检测器温度210 ℃下进行测定。之后根据浓度-峰面积标准曲线进行结果计算,每个处理重复3次,取平均值。
1.4.9 总酚
参考徐辉艳等[18]的方法进行测定。
1.4.10 黄酮
参考赵佳等[19]的方法进行测定。
1.4.11 丙二醛(malondialdehyde,MDA)
参考曹建康等[13]的方法进行测定。
1.4.12 抗坏血酸过氧化物酶(ascorbate peroxidase, APX)
采用比色法[13]测定。
1.4.13 过氧化物酶(peroxidase,POD)
采用愈创木酚法[13]测定。
1.4.14 过氧化氢酶(catalase,CAT)
采用比色法[13]测定。
1.4.15 苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)
采用比色法[13]测定。
1.4.16 几丁质酶
采用几丁质酶试剂盒进行测定,方法为比色法。
1.4.17 β-1,3-葡聚糖酶
采用β-1,3-葡聚糖酶试剂盒进行测定,方法为比色法。
1.4.18 数据处理
实验结果每组重复3次平行,实验结果取其平均值。数据采用Excel 2021进行数据处理,采用OriginPro 2021进行图像绘制,采用SPSS 26进行单因素ANOVA检验分析样品数据之间的差异(P<0.05代表差异显著)。
2 结果与分析
2.1 不同生物保鲜剂处理对番茄感官品质的影响
由图1可知,贮藏35 d时,CK组已经发生了严重的霉变腐烂现象,ε-PL处理组果实顶端出现了霉变现象,果实出现轻微的软化现象,NT处理组果实顶端出现相对轻微的霉变现象,但整体感官品质良好,仍具有一定的商品性。由表2可知,在0~21 d贮藏期间,3组处理的感官评分并无显著差异(P>0.05),然而,在贮藏28 d时,ε-PL和NT处理组的感官评分显著高于CK组(P<0.05)。当贮藏35 d时,NT处理组感官评分最高,显著高于ε-PL处理组和CK组(P<0.05),同时,ε-PL处理组感官评分显著高于CK组(P<0.05)。

图1 贮藏35 d时不同处理对番茄贮藏期感官品质的影响
Fig.1 Effects different treatments on the sensory quality of tomatoes during 35 days of storage
表2 番茄感官评分结果
Table 2 Tomato sensory score results

处理时间/d0714212835CK50.00±0.00a49.75±0.25a49.08±0.29a38.83±0.14a36.83±0.29a18.42±0.29aㄠ-PL50.00±0.00a49.83±0.29a48.75±0.75a38.33±0.14a38.25±0.25b24.91±0.57bNT50.00±0.00a49.75±0.43a49.42±0.52a38.92±0.14a38.67±0.88b33.75±1.15c
注:不同小写字母表示差异显著,P<0.05。
2.2 不同生物保鲜剂处理对番茄营养品质的影响
如图2-a所示,随着贮藏时间的不断延长,3个处理组的可溶性固形物含量呈下降趋势。在贮藏0~14 d期间,ε-PL处理组的可溶性固形物含量明显高于CK组(P<0.05)。在贮藏21~28 d期间,NT处理组的可溶性固形物含量相对较高,明显高于ε-PL处理组和CK组(P<0.05)。贮藏35 d后,NT处理组的可溶性固形物含量最高,明显高于CK组,但与ε-PL处理组相比差异不显著(P>0.05)。
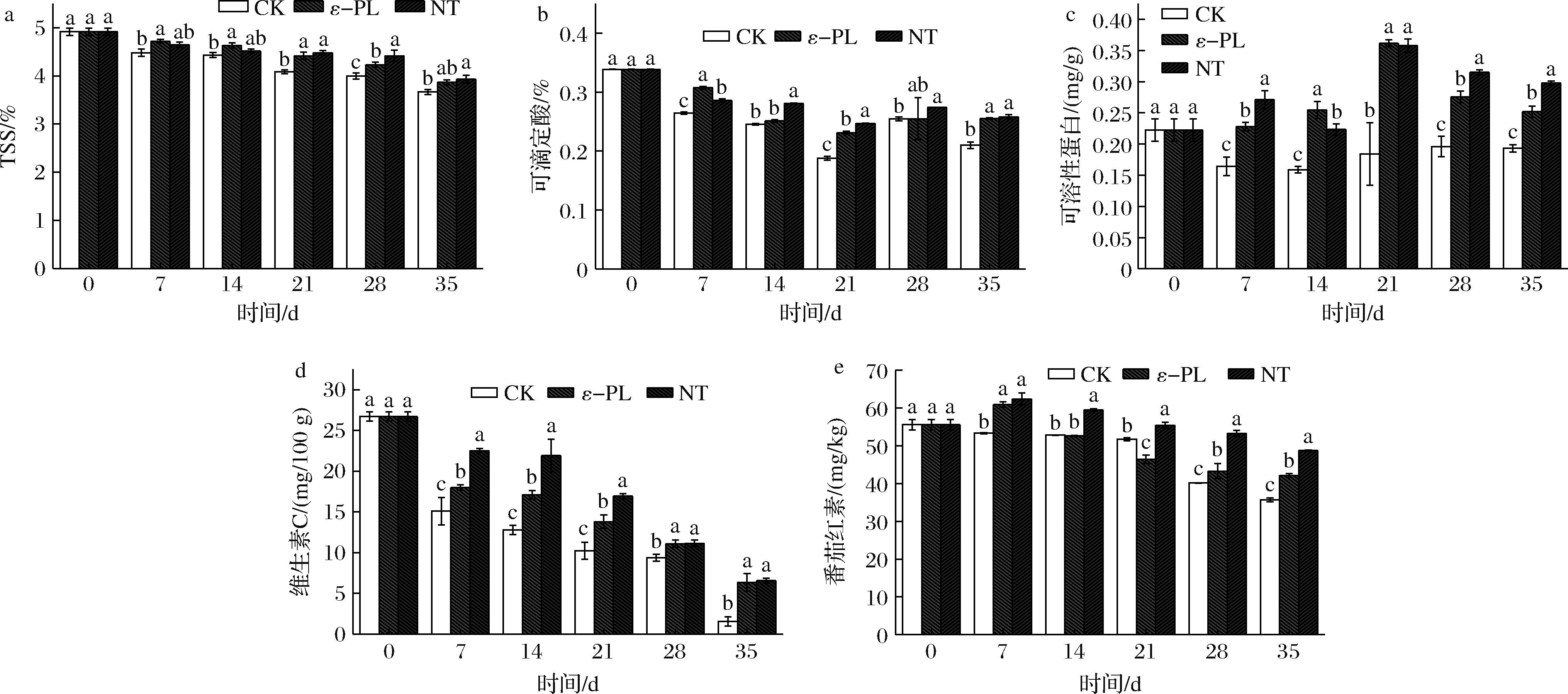
a-可溶性固形物;b-可滴定酸;c-可溶性蛋白;d-维生素C;e-番茄红素
图2 不同生物保鲜剂处理对番茄营养品质的影响
Fig.2 Effects of different biopreservative treatments on the nutritional quality of tomatoes
注:不同小写字母表示差异显著,P<0.05(下同)。
从图2-b可以看出,随着贮藏时间的延长,3个处理组的可滴定酸度先下降后上升。在贮藏14、21、35 d时,NT处理组的可滴定酸度最高,明显高于CK组(P<0.05)。贮藏28 d时,3个处理组的可滴定酸度差异不大(P>0.05)。贮藏35 d时,NT处理组的可滴定酸度最高,与ε-PL处理组无明显差异(P>0.05),但两种处理的可滴定酸度都明显高于CK组(P<0.05)。
如图2-c所示,随着贮藏时间的不断延长,3个处理组的可溶性蛋白含量呈先增加后减少的趋势,在整个贮藏期内,NT和ε-PL处理组的可溶性蛋白含量显著高于CK组(P<0.05)。在35 d的贮藏期间,NT处理组的可溶性蛋白质含量最高,明显高于其他两个处理组(P<0.05),其次是ε-PL处理组,其可溶性蛋白质含量明显高于CK组(P<0.05)。
如图2-d所示,随着贮藏时间的延长,3个处理组的维生素C含量呈下降趋势。在贮藏7~21 d期间,NT组的维生素C含量最高,明显高于其他两个处理组(P<0.05)。在贮藏28~35 d期间,NT组和ε-PL组的维生素C含量没有显著差异(P>0.05),但两组的维生素C含量都明显高于CK组(P<0.05)。
如图2-e所示,3个处理组的番茄红素含量随着贮藏时间的延长而增加,然后减少。在整个贮藏期间,NT处理组的番茄红素含量明显高于CK组(P<0.05)。在28~35 d的贮藏期间,NT处理组的番茄红素含量最高,明显高于其他两个处理组(P<0.05),其次是ε-PL处理组,其番茄红素含量明显高于CK组(P<0.05)。
2.3 不同生物保鲜剂处理对番茄生理指标的影响
如图3-a所示,随着贮藏时间的不断延长,3组处理的呼吸速率先降低后升高再降低。在整个贮藏期间,NT处理组的呼吸速率均维持在一个较低的水平,显著低于其他两组处理(P<0.05)。贮藏35 d时,NT处理组的呼吸速率最低,显著低于其他两组处理(P<0.05),其次是ε-PL处理组,呼吸速率显著低于CK组(P<0.05)。
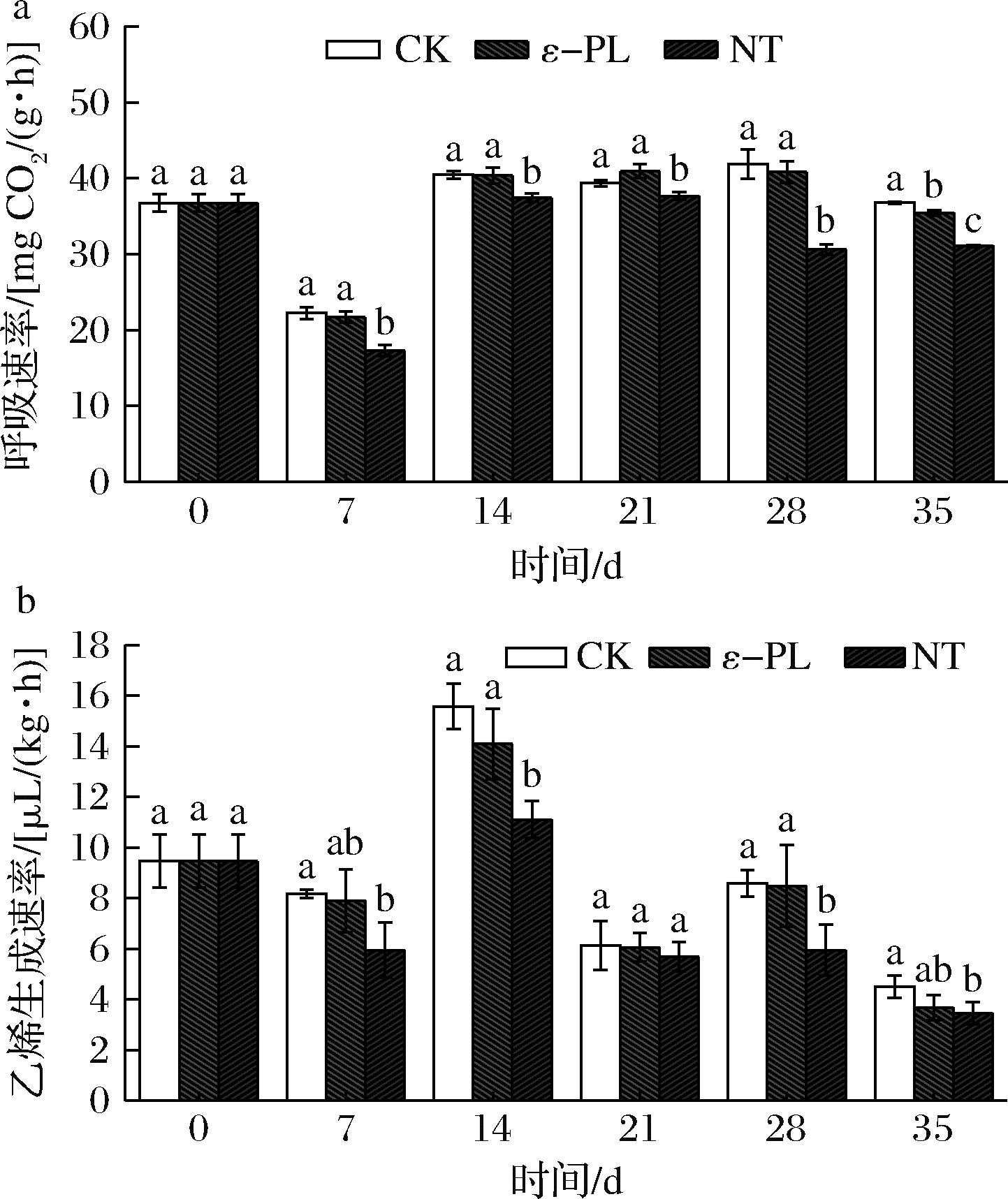
a-呼吸速率;b-乙烯生成速率
图3 不同生物保鲜剂处理对番茄生理指标的影响
Fig.3 Effects of different biopreservative treatments on the physiological parameters of tomatoes
如图3-b所示,随着贮藏时间的不断延长,3组处理的乙烯生成速率先升高后降低。在整个贮藏期间,NT处理组的乙烯生成速率整体维持在一个较低水平,除贮藏21 d外,其他贮藏期NT处理组的乙烯生成速率均显著低于其他两组处理(P<0.05)。贮藏35 d时,NT处理组的乙烯生成速率最低,显著低于CK组(P<0.05),但与ε-PL处理组的乙烯生成速率无显著差异(P>0.05)。
2.4 不同生物保鲜剂处理对番茄MDA、APX、POD及CAT活性变化的影响
如图4-a所示,随着贮藏时间的不断延长,3组处理的MDA含量整体呈现上升的趋势。贮藏7~14 d期间,ε-PL处理组的MDA含量显著低于CK组和NT处理组(P<0.05)。贮藏21~35 d期间,NT处理组的MDA含量最低,显著低于其他两组处理(P<0.05),其次是ε-PL处理组,MDA含量显著低于CK组(P<0.05)。

a-MDA;b-APX;c-POD;d-CAT
图4 不同生物保鲜剂处理对番茄MDA、APX、POD及CAT活性变化的影响
Fig.4 Effects of different biopreservative treatments on the changes in MDA, APX, POD, and CAT activities in tomatoes
如图4-b所示,随着贮藏时间的不断延长,3组处理的APX活性先上升后下降。贮藏14 d时,CK组达到APX活性的峰值,贮藏21 d时,ε-PL处理组和NT处理组达到APX活性峰值,此时,NT处理组的APX活性最高,显著高于ε-PL处理组和CK组(P<0.05),ε-PL处理组的APX活性显著高于CK组(P<0.05)。贮藏35 d时,NT处理组的APX活性最高,其次是ε-PL处理组,两组处理之间无显著性差异(P>0.05),但两组处理的APX活性均显著高于CK组(P<0.05)。
如图4-c所示,随着贮藏时间的不断延长,3组处理的POD活性先上升后下降再上升。除贮藏14 d外,在整个贮藏期间,NT处理组的POD含量均显著高于CK组(P<0.05)。贮藏28~35 d期间,NT处理组的POD活性最高,显著高于其他两组处理(P<0.05),ε-PL处理组的POD活性显著高于CK组(P<0.05)。
如图4-d所示,随着贮藏时间的不断延长,3组处理的CAT活性整体呈现上升的趋势。在整个贮藏期间,NT处理组的CAT活性均维持在一个较高的水平,显著高于CK组(P<0.05)。ε-PL处理组在贮藏14 d时有波动,显著低于CK组和NT处理组(P<0.05),但随后CAT活性上升,显著高于CK组(P<0.05)。贮藏35 d时,NT处理组的CAT活性最高,其次是ε-PL处理组,显著高于CK组(P<0.05)。
2.5 不同生物保鲜剂处理对番茄总酚、黄酮、PAL、几丁质酶及β-1,3-葡聚糖酶活性变化的影响
如图5-a所示,随着贮藏时间的不断延长,3组处理的总酚含量先上升后下降。贮藏7~21 d期间,ε-PL处理组的总酚含量显著高于其他两组处理(P<0.05)。贮藏35 d时,NT处理组的总酚含量显著高于其他两组处理(P<0.05),ε-PL处理组的总酚含量与CK组无显著差异(P>0.05)。

a-总酚;b-黄酮;c-PAL活性;d-几丁质酶;e-β-1,3-葡聚糖酶活性
图5 不同生物保鲜剂处理对番茄总酚、黄酮、PAL、几丁质酶及β-1,3-葡聚糖酶活性变化的影响
Fig.5 Effects of different biopreservative treatments on the variations in total phenols, flavonoids, pal, chitinase, and β-1,3-glucanase activities in tomatoes
如图5-b所示,随着贮藏时间的不断延长,3组处理的黄酮含量先上升后下降。贮藏14 d时,3组处理的黄酮含量均达到峰值,此时NT处理组的黄酮含量显著高于CK组(P<0.05)。贮藏35 d时,NT处理组的黄酮含量最高,其次是ε-PL处理组,两组处理之间无显著性差异(P>0.05),但两组处理的黄酮含量均显著高于CK组(P<0.05)。
如图5-c所示,随着贮藏时间的不断延长,3组处理的PAL活性呈现上升的趋势。在整个贮藏期间,CK组的PAL活性波动较小,ε-PL和NT两组处理在贮藏28~35 d期间,PAL活性急剧上升。贮藏35 d时,ε-PL和NT组PAL活性较为接近,无显著性差异(P>0.05),两组处理的PAL活性均显著高于CK组(P<0.05)。
如图5-d所示,随着贮藏时间的不断延长,3组处理的几丁质酶活性先上升后下降。3组处理的几丁质酶变化较为平稳,贮藏21 d时达到几丁质酶活性的峰值,其中ε-PL处理组的几丁质酶活性最高,显著高于NT处理组和CK组,贮藏28~35 d期间,ε-PL和NT两组处理的几丁质酶差异不显著,但两组处理的几丁质酶活性显著高于CK组。
如图5-e所示,随着贮藏时间的不断延长,3组处理的β-1,3-葡聚糖酶活性先上升后下降。在整个贮藏期间,NT处理组的β-1,3-葡聚糖酶活性明显超过CK组(P<0.05)。然而,在贮存28 d后,ε-PL处理组的β-1,3-葡聚糖酶活性与NT处理组相似,并无显著差异(P>0.05)。贮藏35 d时,NT处理组的β-1,3-葡聚糖酶活性最高,显著高于ε-PL处理组和CK组(P<0.05),ε-PL处理组的β-1,3-葡聚糖酶活性显著高于CK组(P<0.05)。
3 结论与讨论
相关研究表明,ε-PL利用静电吸附的方式黏附于细胞膜,二价阳离子取代了磷脂头,导致细胞膜产生负曲率折叠,细胞膜的完整性和结构被破坏,进而引起细胞死亡;其还能抑制细菌的糖酵解和三羧酸循环途径,从而对细菌代谢产生一定的影响,并导致细菌的死亡;其通过对基因微粒或基因材料的结构产生影响,使微生物产生氧化应激反应,使DNA等重要的大分子受到氧化损害,进而诱导细胞凋亡。纳他霉素依靠其内酯环结构与真菌细胞膜上的甾醇化合物作用,形成抗生素-甾醇化合物,从而破坏真菌的细胞质膜结构。大环内脂的亲水部分(多醇部分)在膜上形成水孔,损伤细胞膜通透性,进而引起菌内氨基酸、电解质等物质渗出,菌体死亡。当某些微生物细胞膜上不存在甾醇化合物时,纳他霉素就对其无作用,因此纳他霉素一般只对真菌产生抑制,对细菌和病毒不产生抗菌活性。本研究以番茄为实验材料,通过分析ε-PL与NT两种不同的生物保鲜剂处理对番茄采后贮藏的影响,通过实验数据分析可知,采后进行ε-PL与NT两种处理方式均可以有效的维持番茄采后贮藏期间的营养品质,其中NT处理效果最好,相关研究也表明,ε-PL与NT两种不同的生物保鲜剂均可有效地抑制番茄采后灰霉病的发生。SUN等[5]研究了生物保鲜剂ε-PL与壳聚糖在防治番茄灰霉病的协同作用,实验结果表明壳聚糖与ε-PL复合保鲜剂可以使番茄贮藏期间苯丙氨酸解氨酶和过氧化物酶活性增加,具有良好的抑菌效果。王馨渝等[20]研究了真空预冷与雾化ε-PL共处理对采后上海青品质的影响,实验结果表明真空预冷过程中联合雾化ε-PL处理可以更显著地减缓上海青中抗氧化物质和营养成分的损失。张鹏等[21]开展了关于纳他霉素在樱桃番茄的气调保鲜过程的探讨。他们的试验发现,无论纳他霉素的浓度如何,都能够推迟樱桃番茄的衰退过程,减轻其水分流失,并且能够显著降低其呼吸强度。此外,纳他霉素还能够有效地阻止樱桃番茄的酸性物质以及可溶性固形物的分解,并使其维生素C含量得到提升,并且能够良好地保留其营养成分,因此具有良好的贮藏保鲜效果。在本实验中,NT处理组可以较好地维持TSS、可溶性蛋白和番茄红素的含量,可以较好地抑制番茄采后贮藏期间呼吸速率和乙烯生成速率的提高。
黄酮、总酚和番茄红素是番茄中较为重要的抗氧化物质,根据本实验结果可知,ε-PL与NT处理均可有效维持番茄贮藏期间黄酮、总酚及番茄红素的含量,进而有效地维持番茄贮藏期间的品质。宋晓雪等[22]探讨了纳他霉素如何影响新鲜莴苣的表皮微生物繁衍及其生理生化过程,研究发现,纳他霉素的应用能够显著地阻止莴苣表皮霉菌的扩散和繁衍,同时维持新鲜莴苣中的高浓度花青素,并且能够防止总酚和类黄酮的减少。通过对比分析番茄采后贮藏期间MDA积累量、APX、POD和CAT活性,可以分析番茄在受到胁迫后抗氧化酶系统对逆境胁迫的响应程度。结合实验数据分析可知,ε-PL与NT处理均可有效地抑制番茄采后贮藏期间MDA含量的积累,有效地增加APX、POD和CAT活性,其中NT处理效果好于ε-PL。徐冬颖等[23]的研究揭示了纳他霉素在鲜切双孢菇褐变抑制方面的作用原理,发现纳他霉素可以在鲜切双孢菇贮存期间减少其硬度以及质量流失率、增加其呼吸强度以及提高其相对电导率,同时也可以减少霉菌和酵母的总数。此外,纳他霉素还可以维持双孢菇子实体维生素C、还原性谷胱甘肽、总酚以及羟脯氨酸的含量,以及谷胱甘肽还原酶和苯丙氨酸解氨酶的活性,这有助于双孢菇维持较高的抗氧化酶活性、自由基清除率以及整体的抗氧化性。因此,双孢菇的褐化现象得到了缓解,并且它的贮藏时间也得到了增加。黎晓媚等[24]对纳他霉素结合ε-聚赖氨酸对火龙果贮藏品质的影响进行了研究,实验结果表明纳他霉素和ε-PL复配可以延缓火龙果质量损失率和腐烂率的上升,减缓果皮L*和硬度的下降速度,降低呼吸强度和MDA含量,提高SOD、CAT、POD、APX活性。PAL是植物抗逆抗病能力的关键指标之一,几丁质酶与β-1,3-葡聚糖酶是防御病原菌入侵果实的关键酶。在本实验中,ε-PL与NT处理均可有效地维持番茄贮藏期间PAL、几丁质酶和β-1,3-葡聚糖酶的活性,其中NT处理效果好于ε-PL。林育钊等[25]探讨了ε-PL在西番莲果实收获后的病害和抗病相关物质的代谢过程。他们的试验发现,ε-PL能够增强西番莲果实内的肉桂酸-4-羟化酶、多酚氧化酶、苯丙氨酸解氨酶、过氧化物酶、β-1,3-葡聚糖酶、4-香豆酰辅酶A连接酶、几丁质酶、肉桂醇脱氢酶等与抗病相关酶的活性。周福慧等[26]研究了纳他霉素对采后蓝莓果实灰霉病防治,实验结果表明,纳他霉素处理可以有效地提高POD、PAL等抗病相关酶的活性。
综上所述,NT处理可以显著地维持番茄采后贮藏期间的感官品质、可溶性蛋白含量和番茄红素含量;显著抑制番茄采后贮藏期间呼吸速率和乙烯生成速率的提高,抑制MDA的积累,维持总酚含量,提高了POD、CAT和β-1,3-葡聚糖酶活性。对于NT处理番茄营养指标中TSS、维生素C、可滴定酸含量和抗病相关的黄酮、APX、PAL和几丁质酶活性与ε-PL处理差异不显著。
[1] 马丽丽, 白春美, 周新原, 等.低温贮藏对高品质番茄果实采后生理的影响[J].北方园艺, 2023(14):97-104.
MA L L, BAI C M, ZHOU X Y, et al.Effects of low temperature storage on postharvest physiological of high-quality tomato fruit[J].Northern Horticulture, 2023(14):97-104.
[2] 钟心怡, 张文霞, 邓嘉欣, 等.GSH与NO协同处理对番茄贮藏品质及抗氧化性的影响[J].南方农业学报, 2022, 53(1):157-165.
ZHONG X Y, ZHANG W X, DENG J X, et al.Synergistic effect of glutathione and nitric oxide treatment on storage quality and antioxidant activity in tomato[J].Journal of Southern Agriculture, 2022, 53(1):157-165.
[3] AL-DAIRI M, PATHARE P B, AL-YAHYAI R.Chemical and nutritional quality changes of tomato during postharvest transportation and storage[J].Journal of the Saudi Society of Agricultural Sciences, 2021, 20(6):401-408.
[4] FAN K, ZHANG M, BHANDARI B, et al.A combination treatment of ultrasound and ε-polylysine to improve microorganisms and storage quality of fresh-cut lettuce[J].LWT, 2019, 113:108315.
[5] SUN G Z, YANG Q C, ZHANG A C, et al.Synergistic effect of the combined bio-fungicides ε-poly-l-lysine and chitooligosaccharide in controlling grey mould (Botrytis cinerea) in tomatoes[J].International Journal of Food Microbiology, 2018, 276:46-53.
[6] 刘欣洁. ε-聚赖氨酸复配对番茄灰霉病防治的增效作用研究 [D].杨凌:西北农林科技大学, 2021.
LIU X J.Synergistic effect of ε-poly-L-lysine compound to control tomato gray mold[D].Yangling:Northwest A &F University, 2017.
[7] 曹森, 雷霁卿, 马超, 等.3种生物保鲜剂对贵长猕猴桃货架期品质变化的影响[J].中国南方果树, 2020, 49(6):136-140.
CAO S, LEI J Q, MA C, et al.Effect of 3 bio-preservatives on quality changes during shelf-life of ‘Gui Chang’ kiwifruit[J].South China Fruits, 2020, 49(6):136-140.
[8] MEENA M, PRAJAPATI P, RAVICHANDRAN C, et al.Natamycin:A natural preservative for food applications-a review[J].Food Science and Biotechnology, 2021, 30(12):1481-1496.
[9] YANG Y X, HUAN C, LIANG X R, et al.Development of starch-based antifungal coatings by incorporation of natamycin/methyl- β-cyclodextrin inclusion complex for postharvest treatments on cherry tomato against Botrytis cinerea[J].Molecules, 2019, 24(21):3962.
[10] 巴良杰, 曹森, 吉宁, 等.纳他霉素处理对火龙果贮藏品质的影响[J].中国果树, 2021(2):26-30;39.
BA L J, CAO S, JI N, et al.Effect of natamycin on the storage quality of pitaya fruit[J].China Fruits, 2021(2):26-30;39.
[11] 韦强, 钱井, 赵立群, 等.不同品种及采收时期番茄果实的品质分析[J].保鲜与加工, 2023, 23(1):32-37.
WEI Q, QIAN J, ZHAO L Q, et al.Quality analysis of tomato fruits in different varieties and harvest periods[J].Storage and Process, 2023, 23(1):32-37.
[12] 李文生, 冯晓元, 王宝刚, 等.应用自动电位滴定仪测定水果中的可滴定酸[J].食品科学, 2009, 30(4):247-249.
LI W S, FENG X Y, WANG B G, et al.Study on determination of titratable acidity in fruits using automatic potentiometric titrator[J].Food Science, 2009, 30(4):247-249.
[13] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导 [M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Guidelines for Postharvest Physiological and Biochemical Experiments on Fruits and Vegetables [M].Beijing:China Light Industry Press, 2007.
[14] 李军. 钼蓝比色法测定还原型维生素C[J].食品科学, 2000, 21(8):42-45.
LI J.Study on molybdenum blue method of L-VC test by spectrometry[J].Food Science, 2000, 21(8):42-45.
[15] 赵焕兰, 曹嘉灿, 刘奎, 等.贝莱斯芽孢杆菌发酵液对樱桃番茄贮藏品质的影响[J].食品研究与开发, 2022, 43(20):12-18.
ZHAO H L, CAO J C, LIU K, et al.Effect of Bacillus velezensis fermentation supernatant on storage quality of cherry tomatoes[J].Food Research and Development, 2022, 43(20):12-18.
[16] 张鹏, 袁兴铃, 王利强, 等.1-MCP处理对“阳光玫瑰” 葡萄货架品质的影响[J].包装工程, 2021, 42(7):19-27.
ZHANG P, YUAN X L, WANG L Q, et al.Effect of 1-MCP treatment on shelf quality of “sunshine Muscat” grapes[J].Packaging Engineering, 2021, 42(7):19-27.
[17] 张鹏, 陈曦冉, 贾晓昱, 等.1-MCP结合乙烯吸收剂对软枣猕猴桃贮藏品质的影响[J].包装工程, 2022, 43(21):17-24.
ZHANG P, CHEN X R, JIA X Y, et al.Effects of 1-MCP combined with ethylene absorbent on storage quality of Actinidia arguta[J].Packaging Engineering, 2022, 43(21):17-24.
[18] 徐辉艳, 孙晓东, 张佩君, 等.红枣汁中总酚含量的福林法测定[J].食品研究与开发, 2009, 30(3):126-128.
XU H Y, SUN X D, ZHANG P J, et al.Determination of total polyphenols of Chinese jujube juice by folin-ciocaileu method[J].Food Research and Development, 2009, 30(3):126-128.
[19] 赵佳, 霍俊伟.蓝果忍冬总黄酮提取工艺研究[J].食品工业科技, 2010, 31(11):242-244.
ZHAO J, HUO J W.Study on extraction technology of total flavonoids from berry of blue honeysuckle(Lonicera caerulea L.)[J].Science and Technology of Food Industry, 2010, 31(11):242-244.
[20] 王馨渝, 安容慧, 赵安琪, 等.真空预冷与雾化ε-聚赖氨酸共处理对采后上海青品质的影响[J].食品科学技术学报, 2022, 40(6):103-115.
WANG X Y, AN R H, ZHAO A Q, et al.Effect of vacuum pre-cooling co-treated with atomized ε-polylysine on postharvest quality of pakchoi[J].Journal of Food Science and Technology, 2022, 40(6):103-115.
[21] 张鹏, 王剑功, 李江阔, 等.纳他霉素在气调保鲜樱桃番茄中的应用[J].食品工业, 2017, 38(4):216-221.
ZHANG P, WANG J G, LI J K, et al.Application natamycin in MAP preservation of cherry tomatoes[J].The Food Industry, 2017, 38(4):216-221.
[22] 宋晓雪, 胡文忠, 毕阳, 等.纳他霉素对鲜切莴苣表面微生物增殖与生理生化变化的影响[J].食品工业科技, 2014, 35(8):336-339;348.
SONG X X, HU W Z, BI Y, et al.Effect of natamycin on surface microorganism’s growth and physiological properties of fresh-cut lettuces[J].Science and Technology of Food Industry, 2014, 35(8):336-339;348.
[23] 徐冬颖, 顾思彤, 周福慧, 等.纳他霉素处理对鲜切双孢菇褐变的抑制机理[J].食品科学, 2019, 40(17):255-262.
XU D Y, GU S T, ZHOU F H, et al.Inhibitory mechanism of natamycin on browning of fresh-cut Agaricus bisporus[J].Food Science, 2019, 40(17):255-262.
[24] 黎晓媚, 何雪梅, 李静, 等.纳他霉素结合ε-聚赖氨酸对火龙果贮藏品质的影响[J].包装工程, 2023, 44(17):33-40.
LI X M, HE X M, LI J, et al.Effects of natamycin combined with ε-polylysine on storage quality of pitaya[J].Packaging Engineering, 2023, 44(17):33-40.
[25] 林育钊, 陈蕾伊, 陈佳怡, 等.ε-聚赖氨酸对西番莲果实采后病害与抗病物质代谢的影响[J].食品科学, 2024, 45(3):142-149.
LIN Y Z, CHEN L Y, CHEN J Y, et al.Effect of ε-poly-L-lysine on postharvest diseases and disease-resistant substance metabolism in passion fruits[J].Food Science, 2024, 45(3):142-149.
[26] 周福慧, 姜爱丽, 姬亚茹, 等.纳他霉素对采后蓝莓果实灰霉病(Botrytis cinerea)防治[J].食品工业科技, 2018, 39(8):257-260;317.
ZHOU F H, JIANG A L, JI Y R, et al.Natamycin on Botrytis cinerea of postharvest blueberry fruits prevention and treatment of natamycin on of postharvest blueberry fruit[J].Science and Technology of Food Industry, 2018, 39(8):257-260;317.