大量证据表明,适当运动有利于保持身体健康并降低潜在疾病风险,在剧烈和长时间的运动后导致的机体运动疲劳状态可能会损害身体健康,如导致肌肉损伤、身体炎症和氧化应激增加[1]。ENOKA等[2]更是将疲劳定义为一种疾病症状。运动疲劳是中枢和外周因素相互作用的结果,外周因素主要包括能量消耗、代谢物积累、氧化应激等,中枢因素则为交感神经肾上腺髓质和下丘脑-垂体-肾上腺轴活动的改变[3-4]。运动引起的疲劳通常与工作效率和运动表现的降低有关,致使生活质量下降,尤其是对于运动员、飞行员、士兵、消防员和体力劳动者[4]。因此,预防和缓解运动引起的疲劳成为近年来的研究热点。
肠道菌群在人类健康和疾病中发挥重要作用,已知肠道菌群状态不仅与饮食习惯和活动水平有关,还是运动训练对代谢健康益处的重要介质和调节因子[5]。SCHEIMAN等[6]研究表明,马拉松前后,运动员的肠道菌群有很大变化,运动后肠道菌群中韦荣球菌属丰度上升[6],且韦荣球菌属提高了将乳酸代谢为丙酸的甲基丙二酰辅酶A通路的基因丰度;相较于正常小鼠,无菌小鼠的运动能力下降,更加直接地说明肠道菌群能够影响运动相关代谢[5]。肠道菌群可产生乙酸盐、丙酸盐以及丁酸盐等代谢物,这些代谢产物可以通过结肠进入骨骼肌中,在骨骼肌中可以被氧化,并增加运动过程中葡萄糖、糖原和脂肪酸的生物利用度,从而提高运动表现[5];肠道菌群还通过“脑-肠轴”影响运动表现,其产生的小分子代谢物脂肪酸酰胺(fatty acid amide,FAA)能够通过激活肠道神经增加大脑腹侧纹状体的多巴胺水平从而促进运动欲望,并通过“色氨酸-犬尿氨酸”代谢通路影响肌肉性能[7];除此之外,肠道菌群对于性激素缺乏引起的骨质流失中起着至关重要的作用,其可以通过影响宿主体内睾酮的水平,从而调节骨骼稳态,进而影响运动表现[8]。
近年来研究发现,益生菌具有调节人体能量代谢和肌肉损伤,并能通过调节神经系统增加运动欲望等作用,具有改善运动耐力的潜力。例如补充植物乳杆菌(Lactobacillus plantarum)Tana 4周可降低运动后血乳酸和血氨水平以及肌酸激酶活性,显著改善运动表现[9];唾液乳杆菌SA-03可改善肌肉力量并增加肝脏和肌肉糖原含量进而增加小鼠负重游泳时间[10];补充副干酪乳杆菌PS23可以保护肌肉损伤,减少氧化应激和血液中的睾酮损失[11],植物乳杆菌PS128的干预影响了肠道菌群的α和β多样性,显著降低了厌氧菌等的相对丰度,增加了阿克曼氏菌和双歧杆菌等有益菌的相对丰度,从而整体增加了肠道菌群对于短链脂肪酸的产生[12],最后改善了铁人三项运动员的生理适应和表现。
本研究着重探讨了植物乳杆菌CCFM1280在缓解运动疲劳方面的的功能和功效。
1 材料与方法
1.1 实验试剂
乳酸(lactic acid,LD)试剂盒(比色法)、尿素氮(blood urea nitrogen,BUN)试剂盒(二乙酰肟比色法)、肌酸激酶(creatine kinase,CK)试剂盒(比色法)、血红蛋白测试液、葡萄糖(glucose)测试盒、肝/肌糖原测定试剂盒(比色法)、乳酸脱氢酶(lactic dehydrogenase,LDH)试剂盒(微板法)、苏木紫-伊红(hematoxylin and eosin,HE)染色试剂盒,南京建成生物工程研究所;SYBR Green Supermix,美国Bio-Rad公司;粪便基因组提取试剂盒,美国MP Biomedicals公司;细胞/组织总RNA分离试剂盒、反转录试剂盒,南京诺唯赞生物科技有限公司;qRT-PCR引物,上海生工生物工程有限公司。
1.2 实验设备
CFX384 Touch实时定量基因扩增仪,美国Bio-Rad公司;LYNX 4000落地式离心机,美国Thermo Fisher Scientific公司;GRP-9080恒温恒湿培养箱,上海森信实验仪器有限公司;C-MAG HS7 digital加热磁力搅拌器,德国IKA公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司;1510多功能酶标仪,美国赛默飞世尔科技公司。
1.3 实验菌株
本实验使用的2株植物乳杆菌CCFM1280、71L1分离自健康成人的粪便样品,江南大学食品学院生物技术中心菌种保藏库。在MRS固体培养基上划线活化2次后(37 ℃,培养36~48 h),挑取单菌落接种至MRS液体培养基中,37 ℃培养18 h后,在同样的条件下以1%的接种量进行扩培以增大菌量,将所得的扩培液在4 ℃,8 500 r/min离心15 min弃去上清液并收集菌体,用无菌的生理盐水重复以上操作洗涤2次后,加入10%(体积分数)脱脂乳充分混匀,置于-80 ℃下保存备用。
1.4 动物实验方案
实验动物为购自浙江维通利华公司的32只ICR小鼠,6周龄,体重为18~22 g。所有动物实验均经江南大学动物实验中心伦理委员会批准,伦理编号为JN.No20201230i0960420[398]。将小鼠在室温(22±1) ℃和(55±10)%的湿度下保持12 h的光照/黑暗循环中,并提供普通维持饲料和水供其随意摄取。所有动物适应一周后,将动物随机分为空白组、模型组、植物乳杆菌CCFM1280干预组和植物乳杆菌71L1干预组,每组8只,空白组和疲劳组小鼠每日灌胃200 μL超纯水复溶的100 g/L脱脂乳,CCFM1280干预组和71L1干预组每日灌胃200 μL浓度为1×109 CFU/mL的植物乳杆菌CCFM1280和71L1。设计方案如图1所示。

图1 动物实验设计方案
Fig.1 Design for animal experiments
从动物入驻开始记录小鼠每周的体重变化。模型组和植物乳杆菌干预组小鼠进行为期6周的负重游泳实验[13]。具体方案如下:实验时间共6周;第一周无负重适应游泳,周一游泳30 min,周二游泳45 min,周三~周五游泳60 min,周末休息;第二周负重1%(重物/体重),周一~周五游泳60 min,周末休息;第三周~第四周负重2%(重物/体重),周一~周五游泳60 min,周末休息;第五周~第六周负重3%(重物/体重),周一~周五游泳60 min,周末休息。造模期间小鼠均在水深30 cm,水温(25±1) ℃的塑料水箱中进行。
1.5 行为学实验
1.5.1 力竭游泳实验
对小鼠采取尾部负重的方式进行游泳,缠绕松紧适宜,负重质量为体重的5%,单独处于水深50 cm,水温(25±1) ℃的游泳箱中。从小鼠进入水箱开始计时,当小鼠游至连续3次没入水面下,每次超过7 s,视为力竭,记录力竭游泳时间。
1.5.2 前肢握力测试实验
使用握力仪评估前肢握力,轻轻地握住老鼠的尾巴,让它自然摆动,同时小鼠的两个前肢握住一根拉杆,然后向相反的方向轻轻拉动。使其前爪可以抓住力量计的电线,然后轻轻地向后拉,使其尾巴平行于桌子的表面,直到他们失去对电线的抓握。记录每次抓取的最大力度。每只小鼠进行3次测试,取平均力度进行统计分析。
1.6 实时荧光定量PCR
通过实时定量PCR检测肌肉单羧酸转运蛋白1(monocarboxylate transporter 1,MCT1)、单羧酸转运蛋白4(monocarboxylate transporter 4,MCT4)基因的表达情况。由生工生物工程(上海)股份有限公司进行引物合成,引物信息如表1所示。
表1 引物序列
Table 1 Primer sequence

基因引物5′-3′MCT1F-5′- TGACCATTGTGGAATGCTGT-3′R-5′- GAGCCGACCTAAAAGTGGTG-3′MCT4F-5′- GCATCTCCTACGGCATGGTG-3′R-5′- CAGGAGTTTGCCTCCCGAA-3′
1.7 血清中疲劳相关代谢物及肝脏中能源物质测定
按照试剂盒的说明书进行小鼠血清样本中葡萄糖、血红蛋白、LDH、CK、BUN及肝脏样本中肝糖原含量的检测。
1.8 肌肉中疲劳相关代谢物及能源物质测定
按照试剂盒的说明书进行小鼠肌肉样本中乳酸、肌糖原、MCT1及MCT4含量的检测。
1.9 肠道菌群16S rRNA测序分析
使用粪便基因组提取试剂盒提取小鼠粪便总基因组,利用引物(341F:5′-CCTAYGGGRBGCASCAG-3′;806R:5′-GGACTACNNGGGTATCTAAT-3′)对细菌模板DNA进行16S rDNA的V3-V4区扩增。使用琼脂糖凝胶电泳对PCR产物进行纯化,并使用Qubit dsDNA BR胶回收试剂盒进行回收。样本测序在Illumina Miseq PE300平台进行,获得文库初始数据后,采用QIIME软件对下级数据进行质控、拼接、注释等分析[12]。
1.10 数据分析
数值表示为“平均值±标准差”(mean±SD),采用Prism 9.0进行统计分析和图形绘制。模型组与空白组、干预组采用单因素方差分析(One-way ANOVA)。*代表空白组、干预组与模型组之间有显著差异。显著性标准设为P<0.05;其中*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
2 结果与分析
2.1 植物乳杆菌CCFM1280增加小鼠力竭游泳时间
在植物乳杆菌CCFM1280干预的6周内,力竭游泳模型使得小鼠体重有轻微降低,植物乳杆菌CCFM1280和71L1干预后体重有轻微恢复,但不同时间点的小鼠平均体重差异无统计学意义(图2-a)。相对于模型组,植物乳杆菌CCFM1280干预后显著增加了小鼠力竭游泳时间(P<0.01),而在植物乳杆菌71L1干预后并未观察到此现象(P>0.01),说明CCFM1280有较好的缓解运动疲劳的效果(图2-b)。前肢握力是小鼠力量的表征,本研究中,力竭游泳模型及益生菌干预均并没有对小鼠的力量造成影响(P<0.05)。
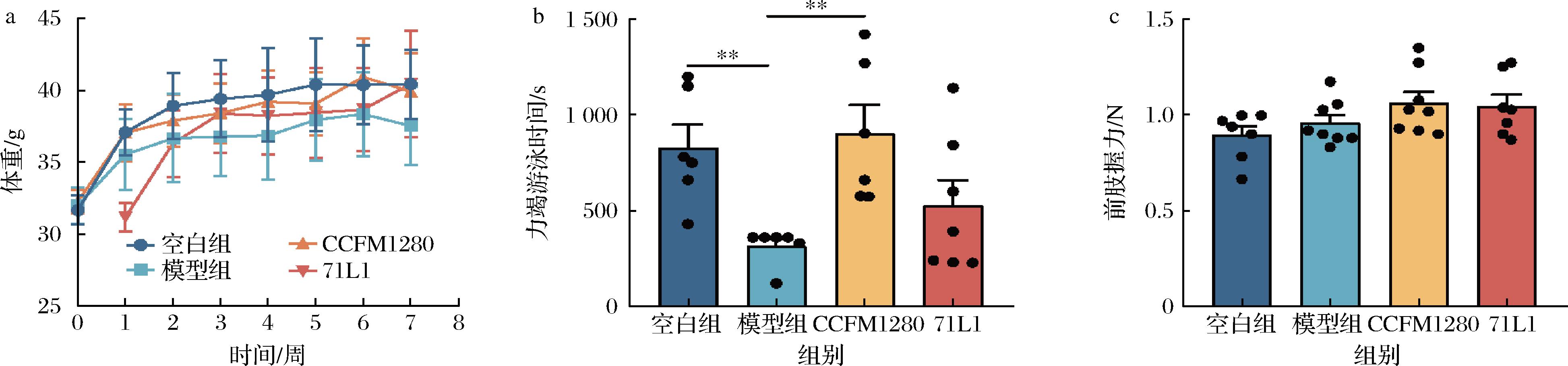
a-小鼠体重变化;b-力竭游泳测试实验;c-前肢握力测试实验
图2 行为学实验结果
Fig.2 Results of behavioral tests
注:**P<0.01,下同。
2.2 植物乳杆菌CCFM1280减少血清中能量代谢产物的积累
在运动过程中,来自肝脏和肌肉的糖原被磷酸肌酸系统代谢成葡萄糖,葡萄糖进一步代谢以满足更高的能量需求[14]。当能源消耗超过供需时,引起疲劳的副产物就会增加,短时间内难以消除,就会导致体内代谢物(包括乳酸、无机磷和氨)积累进而引起肌肉疲劳[15-16]。因此,要从运动引起的疲劳中恢复过来,就必须消除运动中积累的代谢物。
为了深入解析植物乳杆菌CCFM1280缓解运动疲劳的机制,本研究对小鼠血清中疲劳相关代谢物进行检测分析。结果表明,为期6周的力竭游泳造模引起了相关代谢物的积累(图3-c~图3-e),具体包括LDH和BUN,而CCFM1280干预后能够显著降低两者在小鼠血清中的含量(P<0.05),除此之外,本研究还检测了小鼠血清中CK的含量(图3-d),结果表明,力竭游泳模型并未对其含量造成显著影响(P>0.05),但具有恢复趋势。

a-血清葡萄糖含量变化;b-血清血红蛋白含量变化;c-血清BUN含量变化;d-血清CK含量变化;e-血清LDH含量变化;f-肝脏中肝糖原含量变化
图3 血清中疲劳相关代谢物变化
Fig.3 Fatigue-related metabolite changes in serum
注:*P<0.05,**P<0.01,下同。
在长时间的运动中,能量物质得不到及时补充,身体的生理状况减弱,就会导致肌肉的疼痛延长,从而影响运动表现[2]。本研究中评估了CCFM1280调节能量代谢的能力,与空白组相比,力竭游泳造模降低了血清葡萄糖、血红蛋白及肝脏中肝糖原含量(图3-a、图3-b、图3-f),而CCFM1280能够显著恢复肝脏糖原储存(P<0.05),同时显著恢复血清中血红蛋白浓度(P<0.05),其对O2运输至关重要,因为严重缺氧条件下会导致肌肉代谢变化的加剧,从而造成乳酸堆积现象,导致外周疲劳的产生[17]。最后,CCFM1280干预对血清中葡萄糖含量并无显著影响(P<0.05)。说明植物乳杆菌CCFM1280可能通过减少血清中LDH和BUN含量并增加肝糖原储存来缓解运动疲劳。
2.3 植物乳杆菌CCFM1280缓解肌肉疲劳
乳酸堆积是导致肌肉疲劳的原因之一[18],且乳酸也一直被视作诱导骨骼肌发生疲劳的关键因素。首先,乳酸堆积会降低糖酵解的关键酶磷酸果糖激酶的活性,进而通过降低糖酵解的速度来影响ATP的再合成速度;其次,对于肌细胞来说,乳酸的堆积会形成酸性的内环境,降低肌肉做功的效率,影响骨骼肌收缩与放松的生理过程[19];最后,过度的乳酸堆积会触发肌肉的一系列病理性反应,可能会造成延迟性肌肉酸痛或者非感染性炎症的产生。而乳酸在肌肉中的转运也会影响血乳酸的含量,MCT4和MCT1是两种单羧酸转运蛋白,其对于乳酸在肌肉组织中的转运至关重要,MCT4主要负责快肌纤维中乳酸的释放过程,MCT1主要负责慢肌纤维中乳酸的吸收过程,两者共同控制乳酸在肌肉中的积累[20]。
在本研究中,力竭游泳造模导致小鼠肌肉中的乳酸堆积及肌糖原含量减少(图4-a、图4-b),CCFM1280干预能够显著降低肌肉中的乳酸含量并增加肌糖原含量(P<0.05)。但是,在肌肉组织中并未检测到MCT4基因(图4-c),而相对于空白组,力竭游泳导致模型组MCT1基因的上调表达,但差异不具有显著性(P>0.05),证明了在运动性疲劳造模过程中,可能对快慢肌纤维之间的乳酸转移影响不大。这些结果表明,CCFM1280可能影响肌肉中乳酸和糖原的含量来缓解肌肉疲劳。
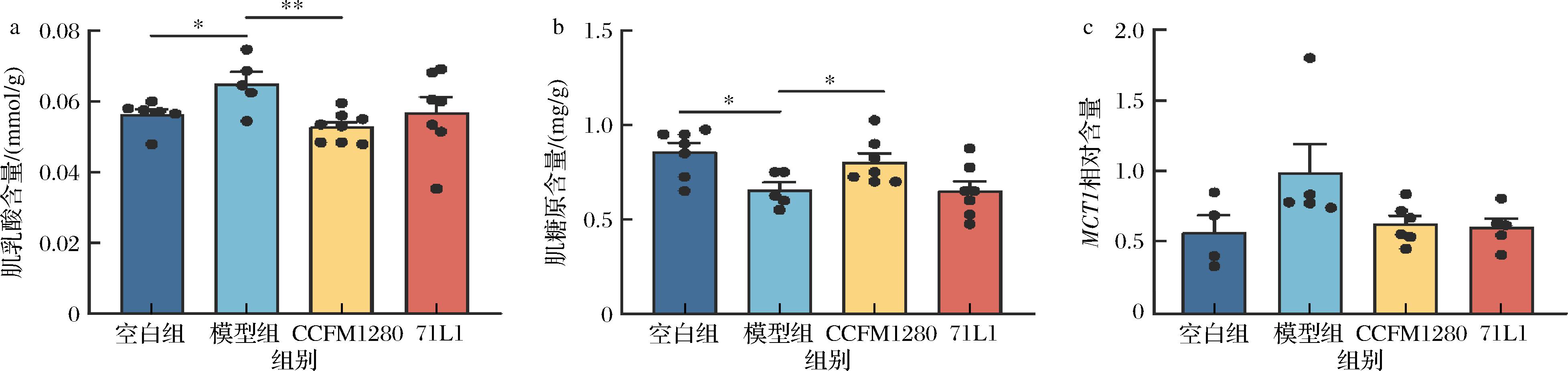
a-肌肉中乳酸含量变化;b-肌肉中肌糖原含量变化;c-肌肉中MCT1基因表达
图4 肌肉中疲劳相关代谢物变化
Fig.4 Fatigue-related metabolite changes in muscle
2.4 植物乳杆菌CCFM1280改善肠道菌群失调
近年来,肠道菌群在运动性疲劳的发生和发展中的作用受到越来越多的重视,肠道菌群及其代谢产物已被证实能够参与调控骨骼肌的结构和功能,故衍生出了“肠-肌肉轴(gut-muscle axis)”这一理论。本研究显示,力竭游泳造模会显著升高肠道菌群的Shannon指数(P<0.05),对于Chao1指数没有显著影响,表明了力竭游泳造模会增强小鼠菌群的多样性和均匀度(图5-a、图5-b)。相比于模型组,CCFM1280干预对Chao1和Shannon指数均无显著影响(P>0.05)。同时,采用了基于Weighted Unifrac距离的主坐标分析(principal coordinate analysis,PCoA)来评估肠道菌群的β多样性,PCoA得分图(图5-c)显示,力竭游泳至疲劳状态后并未对肠道菌群的β多样性产生影响(P=0.646),而CCFM1280干预后也未出现显著差异。

a-Chao1;b-Shannon;c-β多样性
图5 小鼠粪便菌群多样性分析
Fig.5 Diversity analysis of mouse fecal microbiota
根据多样性分析结果,对肠道菌群进行进一步注释,图6显示了4个组在门和属水平上的微生物群的总体组成和平均相对丰度。模型组小鼠肠道中拟杆菌门(Deferribacteres)的相对丰度降低导致肠道菌群在门水平上失衡,CCFM1280干预可以恢复力竭游泳导致的Deferribacteres的比例失衡。研究表明,Deferribacteres是一类通过专性或兼性厌氧代谢获得能量的细菌,Deferribacteres的相对丰度变化与炎症水平息息相关[21]。表明在运动性疲劳过程中,植物乳杆菌CCFM1280可能通过调节菌群来调节炎症反应进而改善运动表现。
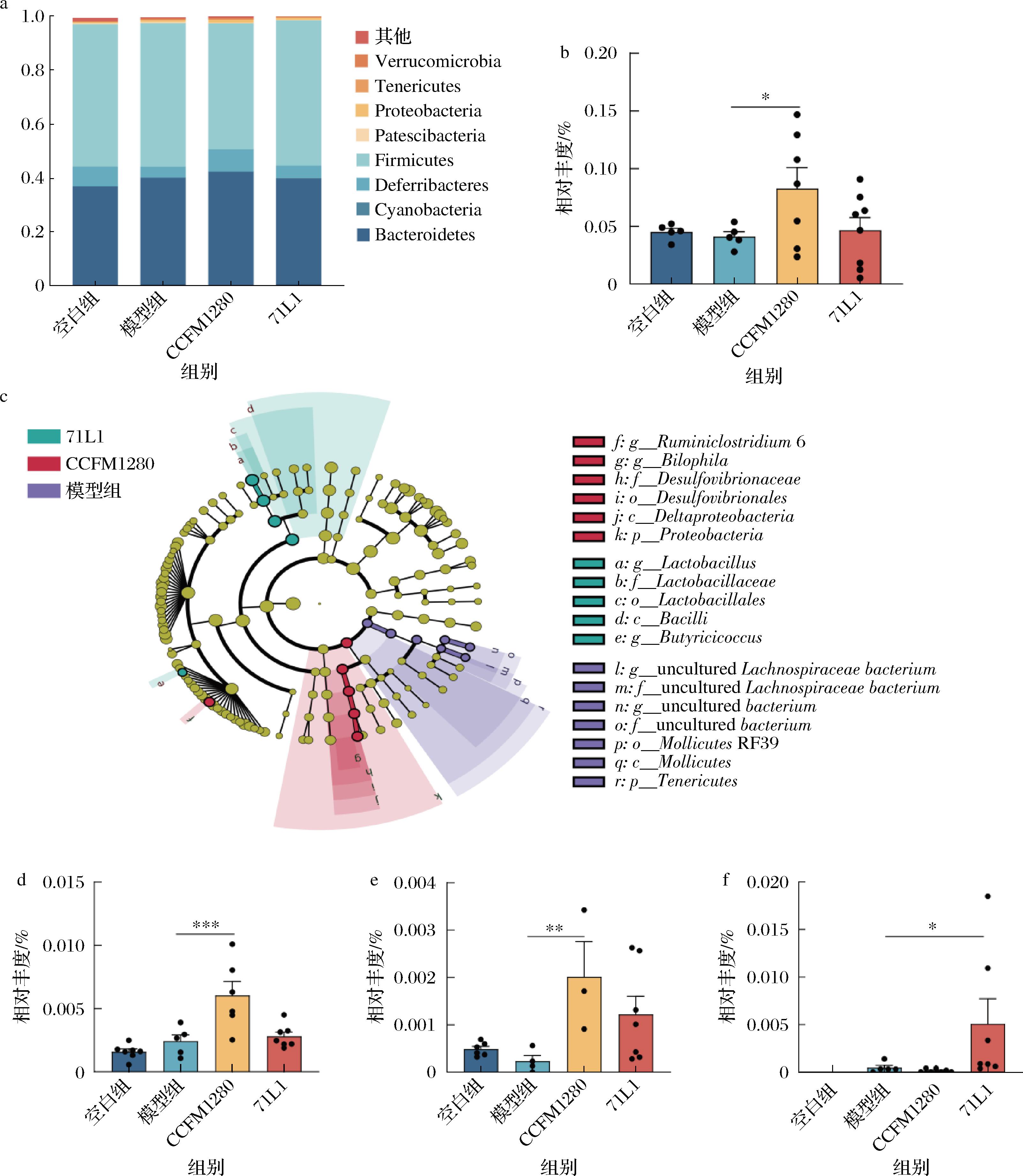
a-门水平相对丰度;b-Deferribacteres;c-属水平LEfSe分析;d-Bilophila相对丰度;e-Ruminiclostridium 6相对丰度;f-Lachnospiraceae bacterium相对丰度
图6 小鼠粪便菌群门属水平分析
Fig.6 Analysis of the phylum and genus level of mouse fecal microbiota
注:*P<0.05,**P<0.01,***P<0.001。
基于LEfSe分析(LDA>2,P<0.05),进一步探究4组间属水平的分布差异,与植物乳杆菌71L1相比,CCFM1280可以提高反刍克罗斯特里迪菌6(Ruminiclostridium 6)和双硫细菌(Bilophila)的相对丰度(图6-d、图6-e),但对于拉克诺斯皮拉细菌(Lachnospiraceae bacterium),CCFM1280的效果不如71L1明显(图6-f)。研究表明,温暖暴露过程会增加小鼠Ruminiclostridium 6等菌属相对丰度,从而减少小鼠骨质流失,改善骨骼肌代谢[22],而Bilophila是一种机会致病菌,代谢牛磺酸产生乙酸盐以及硫化物,嗜好胆汁[23],表明CCFM1280缓解运动性疲劳的机制可能与胆汁酸代谢有关。
3 结论与讨论
本研究使用力竭游泳运动疲劳模型,对植物乳杆菌CCFM1280缓解运动性疲劳的功效及作用机制进行探究。结果表明,CCFM1280是潜在的“运动益生菌”,可提高运动表现、减少疲劳相关代谢物积累并提高能源物质储存,同时调节肠道菌群,缓解运动疲劳导致的菌群失调。本研究为缓解运动疲劳的益生菌疗法提供了新的见解。
[1] PATIKAS D A, WILLIAMS C A, RATEL S.Exercise-induced fatigue in young people:Advances and future perspectives[J].European Journal of Applied Physiology, 2018, 118(5):899-910.
[2] ENOKA R M, DUCHATEAU J.Translating fatigue to human performance[J].Medicine and Science in Sports and Exercise, 2016, 48(11):2228-2238.
[3] CHEN H, MA X, CAO L X, et al.A multi-ingredient formula ameliorates exercise-induced fatigue by changing metabolic pathways and increasing antioxidant capacity in mice[J].Foods, 2021, 10(12):3120.
[4] LIU Y Z, LI C Y, SHEN X F, et al.The use of traditional Chinese medicines in relieving exercise-induced fatigue[J].Frontiers in Pharmacology, 2022, 13:969827.
[5] KIM H J, KIM Y J, KIM Y J, et al.Microbiota influences host exercise capacity via modulation of skeletal muscle glucose metabolism in mice[J].Experimental &Molecular Medicine, 2023, 55(8):1820-1830.
[6] SCHEIMAN J, LUBER J M, CHAVKIN T A, et al.Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism[J].Nature Medicine, 2019, 25(7):1104-1109.
[7] DOHNALOV L, LUNDGREN P, CARTY J R E, et al.A microbiome-dependent gut-brain pathway regulates motivation for exercise[J].Nature, 2022, 612(7941):739-747.
L, LUNDGREN P, CARTY J R E, et al.A microbiome-dependent gut-brain pathway regulates motivation for exercise[J].Nature, 2022, 612(7941):739-747.
[8] LI C X, PI G F, LI F.The role of intestinal flora in the regulation of bone homeostasis[J].Frontiers in Cellular and Infection Microbiology, 2021, 11:579323.
[9] LEE M C, HO C S, HSU Y J, et al.Live and heat-killed probiotic Lactobacillus paracasei PS23 accelerated the improvement and recovery of strength and damage biomarkers after exercise-induced muscle damage[J].Nutrients, 2022, 14(21):4563.
[10] LEE M C, HSU Y J, HO H H, et al.Lactobacillus salivarius subspecies salicinius SA-03 is a new probiotic capable of enhancing exercise performance and decreasing fatigue[J].Microorganisms, 2020, 8(4):545.
[11] LEE M C, CHEN M J, HUANG H W, et al.Probiotic Lactiplantibacillus plantarum Tana isolated from an international weightlifter enhances exercise performance and promotes antifatigue effects in mice[J].Nutrients, 2022, 14(16):3308.
[12] HUANG W C, PAN C H, WEI C C, et al.Lactobacillus plantarum PS128 improves physiological adaptation and performance in triathletes through gut microbiota modulation[J].Nutrients, 2020, 12(8):2315.
[13] ZHANG X Y, JING S, LIN H J, et al.Anti-fatigue effect of anwulignan via the NRF2 and PGC-1α signaling pathway in mice[J].Food &Function, 2019, 10(12):7755-7766.
[14] GONZALEZ J T, FUCHS C J, BETTS J A, et al.Liver glycogen metabolism during and after prolonged endurance-type exercise[J].American Journal of Physiology.Endocrinology and Metabolism, 2016, 311(3):E543-E553.
[15] BURNLEY M, JONES A M.Power-duration relationship:Physiology, fatigue, and the limits of human performance[J].European Journal of Sport Science, 2018, 18(1):1-12.
[16] FINSTERER J.Biomarkers of peripheral muscle fatigue during exercise[J].BMC Musculoskeletal Disorders, 2012, 13:218.
[17] MILLET G Y, MUTHALIB M, JUBEAU M, et al.Severe hypoxia affects exercise performance independently of afferent feedback and peripheral fatigue[J].Journal of Applied Physiology (Bethesda, Md., 2012, 112(8):1335-1344.
[18] PUTNAM R W.The role of lactic acid accumulation in muscle fatigue of two species of anurans, Xenopus laevis and Rana pipiens[J].Journal of Experimental Biology, 1979, 82:35-51.
[19] CHEUNG K, HUME P A, MAXWELL L.Delayed onset muscle soreness[J].Sports Medicine, 2003, 33(2):145-164.
[20] HALESTRAP A P.The SLC16 gene family-Structure, role and regulation in health and disease[J].Molecular Aspects of Medicine, 2013, 34(2-3):337-349.
[21] GOBERT A P, LATOUR Y L, ASIM M, et al.Protective role of spermidine in colitis and colon carcinogenesis[J].Gastroenterology, 2022, 162(3):813-827.
[22] CHEVALIER C, KIESER S, ÇOLAKO LU M, et al.Warmth prevents bone loss through the gut microbiota[J].Cell Metabolism, 2020, 32(4):575-590.
LU M, et al.Warmth prevents bone loss through the gut microbiota[J].Cell Metabolism, 2020, 32(4):575-590.
[23] BURRICHTER A G, DÖRR S, BERGMANN P, et al.Bacterial microcompartments for isethionate desulfonation in the taurine-degrading human-gut bacterium Bilophila wadsworthia[J].BMC Microbiology, 2021, 21(1):340.