米酒是我国特有的饮料酒之一,其酒精含量较低,口感香甜纯美[1]。米酒以糯米为主要原料,经甜酒曲直接发酵而成,其酿造原料专用化程度高,酿造方式单一,产品感官品质同质化问题突出,严重制约了我国米酒产业的发展。研究表明,添加果蔬、中草药等辅料,可以改善米酒的感官品质,对丰富米酒香气成分以及产品的类型具有非常积极的作用[2-4],因此,添加果蔬、中草药等辅料逐渐应用于米酒提质增香。
山楂(Crataegus pinnatifida Bunge)是蔷薇科山楂属落叶乔木植物,其果实含有丰富的黄酮、有机酸、维生素等营养物质,具有降血脂、降血压、健脾开胃、消食化滞以及抗癌的作用[5-9]。近年来,以山楂为原料酿造山楂黄酒的研究主要集中在山楂处理、发酵剂选择、发酵条件优化等方面[10-13],而关于山楂添加量和发酵菌种对山楂糯米酒香气成分影响的研究尚未有报道。
目前饮料酒挥发性风味物质的检测主要采用气相色谱、气相色谱串联质谱、二维气相色谱串联质谱、多维气相色谱串联质谱、气相色谱串联离子迁移谱、电子鼻等[14-18]方法。饮料酒中挥发性风味物质相互作用具有成分复杂、含量低等特点,应采用多种检测方法组合分析。电子鼻是一种智能嗅觉识别系统,能够将样品中被分析物质的相应信号以雷达图的形式呈现,通过雷达图可以对样品的香气物质种类进行区分和对比[19]。电子鼻具有较好的稳定性和重复性,目前已在饮料酒风味分析、品种辨别、真伪鉴别等方面得到广泛应用[20]。
气相色谱-离子迁移谱(gas chromatography-ion mobility spectroscopy, GC-IMS)具有灵敏度高、响应速度快、分离能力强、分析样品无需预处理等特点。电子鼻结合GC-IMS技术,被广泛地应用于样品间挥发性物质的差异分析[19-20],但是鲜有针对山楂糯米酒挥发性物质差异研究的报道。本研究利用电子鼻结合GC-IMS技术,分析不同发酵条件下山楂糯米酒挥发性物质组成差异,依据相对气味活性值(relative odor activity value,ROAV)法并结合正交偏最小二乘判别分析(orthogonal partial least-squares discriminant analysis, OPLS-DA)探索山楂糯米酒的关键性风味化合物,同时结合感官评价探明适合山楂糯米酒的最适发酵条件,以期丰富山楂的加工方式和糯米酒的种类,为山楂糯米酒的生产提供参考。
1 材料与方法
1.1 材料与试剂
山楂品种为大五棱,购自山东省枣庄市;圆糯米,购自黑龙江省五常市;甜味型甜酒曲、黄酒高活性干酵母、果酒专用酵母SY,安琪酵母股份有限公司。
1.2 仪器与设备
WK2102电磁炉,广东美的生活电器制造有限公司;LH-B55糖度计,浙江陆恒环境科技有限公司;BSC-150恒温培养箱,上海博迅医疗生物仪器股份有限公司;PEN3挥发性有机物质分析仪、FlavourSpec®气相离子迁移谱联用仪,德国G.A.S.公司。
1.3 实验方法
1.3.1 山楂糯米酒的制备
选用无霉变、无虫蚀、有光泽、颗粒均匀饱满的乳白色优质圆糯米,洗净放入清水中浸泡10 h,排出浸米水并用清水漂洗干净。将处理过的糯米进行蒸制,晾凉后与甜酒曲混合均匀。落缸搭窝后在密闭容器中30 ℃发酵,待可溶性固形物含量达到30°Brix时结束发酵。过滤得到甜酒液用于下一步实验。
取新鲜、无腐烂、无虫蚀、无机械损伤的优质山楂去核、切碎,加入山楂碎质量1.5倍的水,加热煮制至碎片浆化。
将山楂浆与甜酒液混合,加入活化后的酿酒酵母在26 ℃下发酵。待主发酵结束后,通过4层无菌纱布过滤将醪渣分离,获得的酒液在15 ℃条件下静置72 h,经冷热处理澄清、无菌过滤、装瓶巴氏杀菌后得到山楂糯米酒。
1.3.2 酵母种类对山楂糯米酒风味的影响
在二次发酵过程中,使用果酒酵母和黄酒酵母进行对比发酵,选择更适宜山楂糯米酒酿造的酿酒酵母。
首先将山楂浆和甜酒液按1∶1的体积比例混合,糖度为20°Birx,pH值为5.0,活性干酵母接种量为0.05%,接种前酵母需经适量甜酒液活化,发酵温度为26 ℃。发酵结束后,使用电子鼻对样品挥发性成分进行测定,探究不同酵母对山楂糯米酒风味物质的影响。
1.3.3 原料比例对山楂糯米酒风味的影响
使用1.3.2节中确定的酿酒酵母进行发酵,以山楂浆与甜酒液的比例为变量,设计不同的原料比例进行发酵实验,如表1所示。采用电子鼻、GC-IMS及感官分析对发酵样品进行综合评价,判断不同原料比例对山楂糯米酒香气成分的影响,并确定最佳发酵比例。
表1 山楂浆与甜酒液比例设计表
Table 1 Proportions of hawthorn pulp and sweet wine in different fermentation batches

原料组别12345山楂浆/%3040506070甜酒液/%7060504030
1.4 CO2散失量的测定
在山楂糯米酒发酵过程中,酵母菌会分解糖类产生乙醇和CO2,气体挥发导致发酵液质量减少。通过称量减少的CO2质量来判断发酵程度。发酵期间每12 h称重1次,并记录相关数据。
1.5 酒精度的测定
按GB 5009.225—2023《食品安全国家标准 酒和食用酒精中乙醇浓度的测定》中的酒精计法执行。
1.6 残糖测定
按照GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》中的直接滴定法执行。
1.7 电子鼻分析条件
参照已有研究,在室温下使用电子鼻对发酵样品的风味物质进行分析。电子鼻各传感器对应敏感物质如表2所示。
表2 电子鼻传感器阵列表
Table 2 Electronic nose sensor array
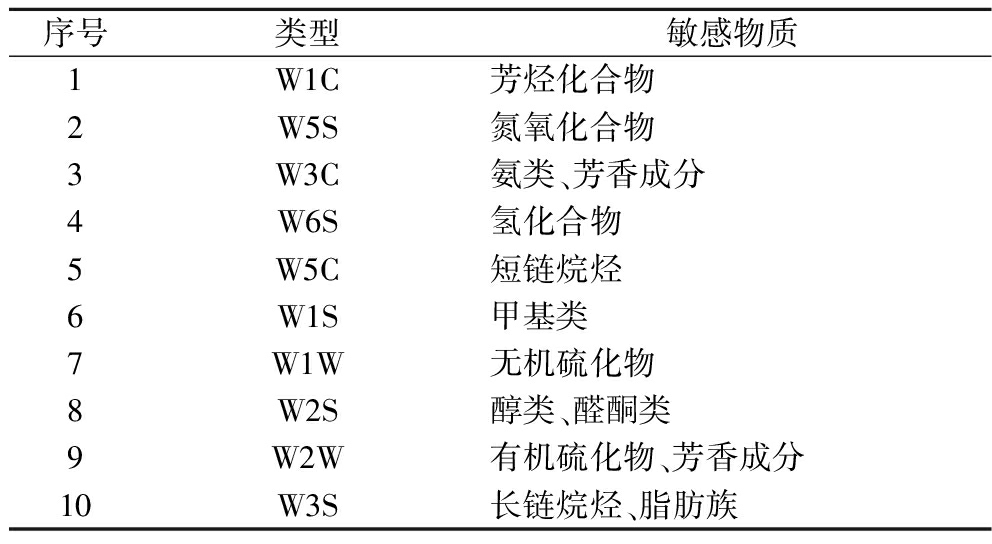
序号类型敏感物质1W1C芳烃化合物2W5S氮氧化合物3W3C氨类、芳香成分4W6S氢化合物5W5C短链烷烃6W1S甲基类7W1W无机硫化物8W2S醇类、醛酮类9W2W有机硫化物、芳香成分10W3S长链烷烃、脂肪族
1.8 色谱条件
GC-IMS检测样品信息如表3所示,分析时孵化转速为500 r/min,60 ℃条件孵育20 min后进样,进样温度85 ℃,每种样品平行测定3次。
表3 样品信息表
Table 3 Sample information table

序号样品编号说明1H30山楂浆30%,黄酒酵母发酵2H50山楂浆50%,黄酒酵母发酵3H70山楂浆70%,黄酒酵母发酵
实验采用WAX色谱柱,以高纯氮气(纯度≥99.99%)作为载气和漂移气,色谱条件见表4,柱温设定为60 ℃,IMS温度为45 ℃。
表4 气相色谱条件
Table 4 Gas chromatography conditions

时间/minE1漂移气/(mL/min)E2载气/(mL/min)015022150210150102015010040150100
1.9 风味物质评价
参考刘登勇等[21]的方法,样品总体风味贡献最大化合物的ROAVstan为100,其余组分的ROAV按公式(1)计算:
(1)
式中:Ci,某种挥发性化合物的相对含量,%;Ti,某种挥发性化合物的感觉阈值,μg/kg;Cstan,风味贡献最大挥发性化合物的相对含量,%;Tstan,风味贡献最大挥发性化合物的感觉阈值,μg/kg。
1.10 感官评定
感官评定小组由食品专业的10名本科生组成,在正式品评前进行培训,确保他们可以较准确的描述产品的基本香气。评价的香气主要包括甜香、醇香、果香3种,以及香气丰富度和香气平衡度。要求品评成员按照从低强度到高强度得分1~9的顺序进行量化描述。
2 结果与分析
2.1 基础数据分析
发酵过程中每隔12 h进行1次发酵液质量测定,发酵液质量不再变化时,即发酵结束。对所得数据进行汇总,并使用Origin 2021绘制如下所示统计图。由图1可知,虽然发酵结束后,样品间的总CO2散失量存在差别,但所有样品发酵趋势基本一致。
图1 CO2散失量
Fig.1 Cumulative CO2 production
发酵结束后,依据前述的方法对各组样品的酒精度和残还原糖进行测定,并汇总如表5所示,结果表明各组样品均完成发酵,且发酵程度较高,符合预期的发酵效果。
表5 发酵基础数据统计
Table 5 Basic fermentation data

组别酒精度/%残糖/(g/L)H3011±0.12.13±0.02H4010±0.52.02±0.01H5010±0.12.06±0.03H6010±0.22.05±0.02H709.5±0.51.97±0.03
2.2 酵母种类对山楂糯米酒风味的影响
在酵母种类选择过程中,对发酵所得样品使用电子鼻进行挥发性物质测定,并使用WinMuster和Origin 2021软件进行绘图分析。电子鼻传感器的响应值如图2所示,其中2、6、7、8号传感器的响应值高,说明酒中主要的风味来源于氮氧化合物、甲基类物质、无机硫化物以及醇醛酮类,这与现有资料中关于酒的风味物质的检测结果基本一致。由电子鼻结果分析,黄酒酵母发酵产品的2号和6号传感器所测物质响应值明显升高,而7号传感器响应值降低,其他物质的响应值相对接近,说明黄酒酵母发酵产品的氮氧化合物和甲基类物质含量更丰富,无机硫化物含量更低。由此可以确定酵母种类的不同对发酵样品的风味有显著影响。另外经过PCA(图3),黄酒酵母发酵的平行样品风味特点更为集中,发酵过程中受环境影响小,更有利于工业化生产。
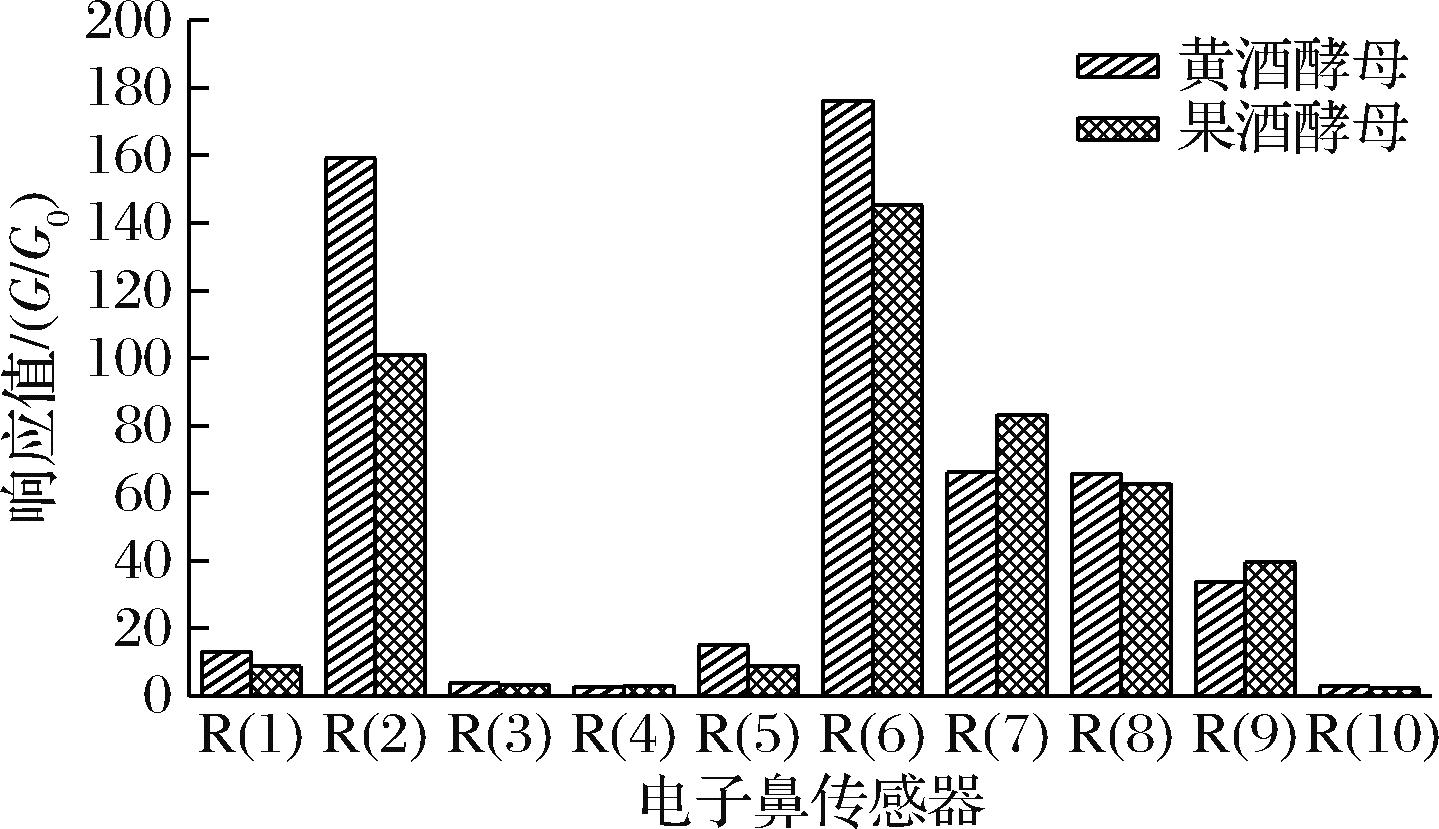
图2 两组样品挥发性成分的传感器响应值
Fig.2 Sensor response values of volatile components in two samples
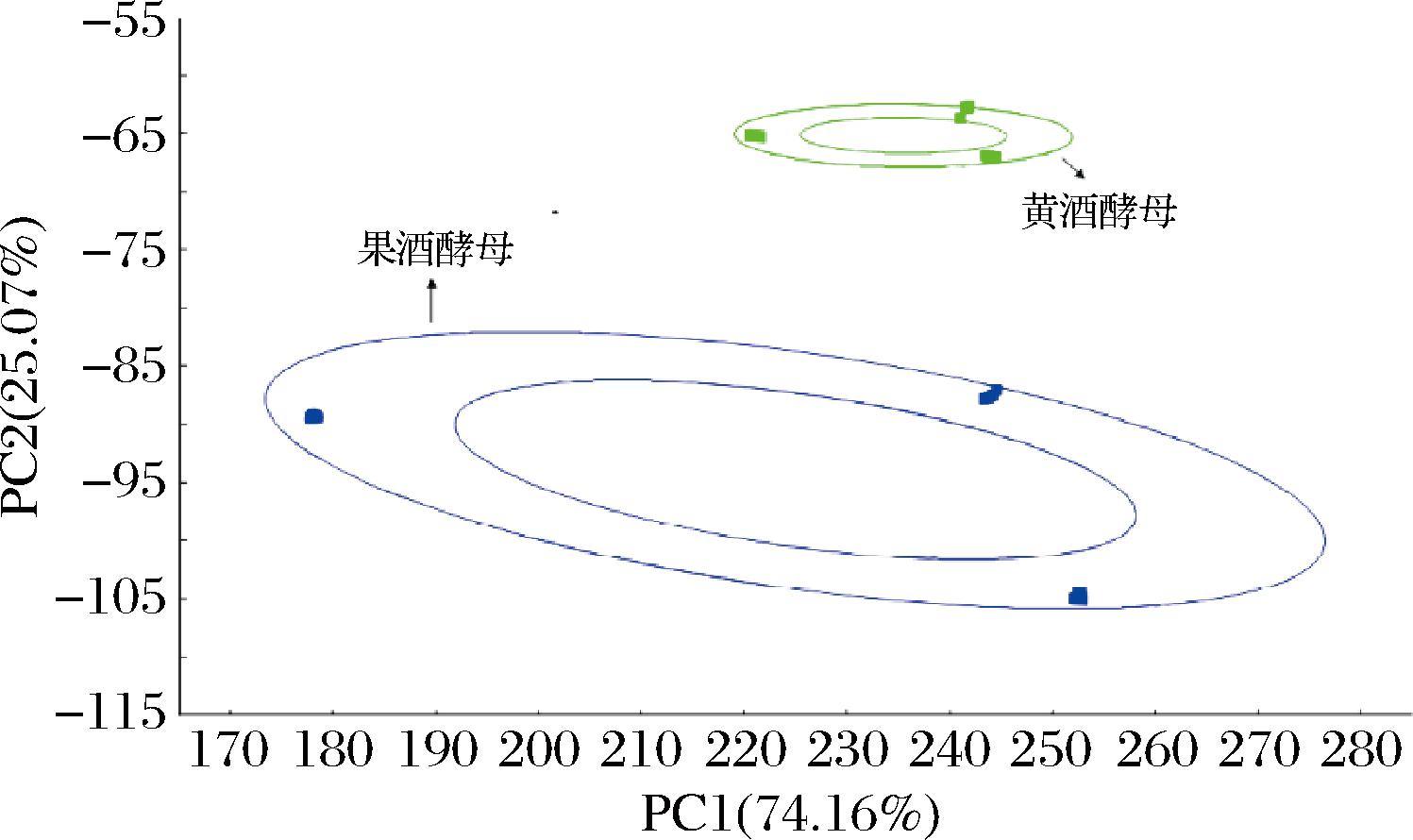
图3 黄酒酵母与果酒酵母样品PCA
Fig.3 PCA of samples fermented with rice wine yeast and fruit wine yeast
2.3 原料比例对山楂糯米酒风味的影响
样品使用黄酒酵母进行发酵,对不同原料比例发酵的样品进行电子鼻检验,将所得结果进行响应值柱状图的绘制和PCA。
由5种不同原料比例发酵样品的电子鼻分析结果(图4)对比可知,随着山楂占比的变化,电子鼻各传感器的响应值出现了差异,差异主要集中在2号,6号和8号传感器,即表明山楂占比会显著影响到氮氧化合物、甲基类物质以及醇醛酮等物质的含量。第2、3、4组样品的结果表明,随着山楂占比的增加,这3类物质的响应值逐渐增高且变化较均匀,经过PCA(图5)后3组样品的差异较小。而在第1组和第5组的结果中,表现出不同的趋势,但通过电子鼻的定性分析无法准确判断差异所在,为进一步探究其具体的物质变化,选择其中的第1、3、5组样品并分别命名为H30、H50、H70进行后续实验分析。

图4 不同原料比例样品挥发性成分的传感器响应值
Fig.4 Sensor response values of volatile components in samples with different raw material ratios
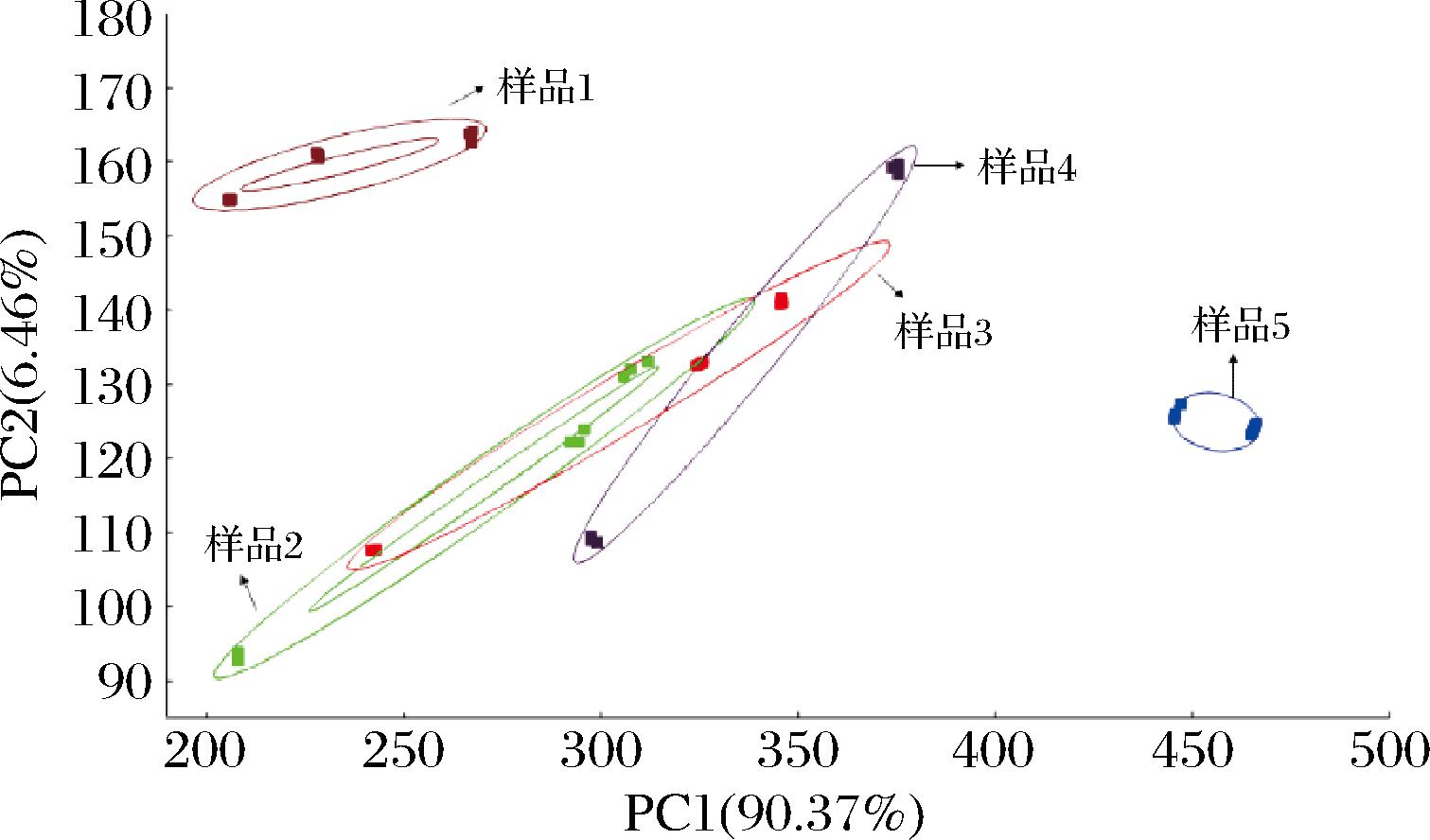
图5 不同原料比例样品的PCA图
Fig.5 PCA diagram of samples with different raw material ratios
2.4 不同原料比例条件下山楂糯米酒的挥发性成分的差异分析
2.4.1 山楂糯米酒挥发性成分GC-IMS谱图分析
利用Reporter插件绘制发酵样品H30、H50、H70挥发性有机物差异的三维谱图,如图6所示;为了方便观察选取二维谱图进行对比,如图7所示;为了进一步比较样品风味的差异所在,绘制了三者的差异谱图,即以H30为参比,扣除其信号峰,得到如图8所示谱图。蓝色区域说明该物质在此处中较H30低,反之红色表示较H30高,颜色越深差异越大。由图可以判断,随着发酵原料中山楂占比的提高,红色斑点和蓝色斑点的颜色均有加深,表明三者的风味在所示位置有较大差异,山楂浆所占的比例会对产品风味产生显著影响。
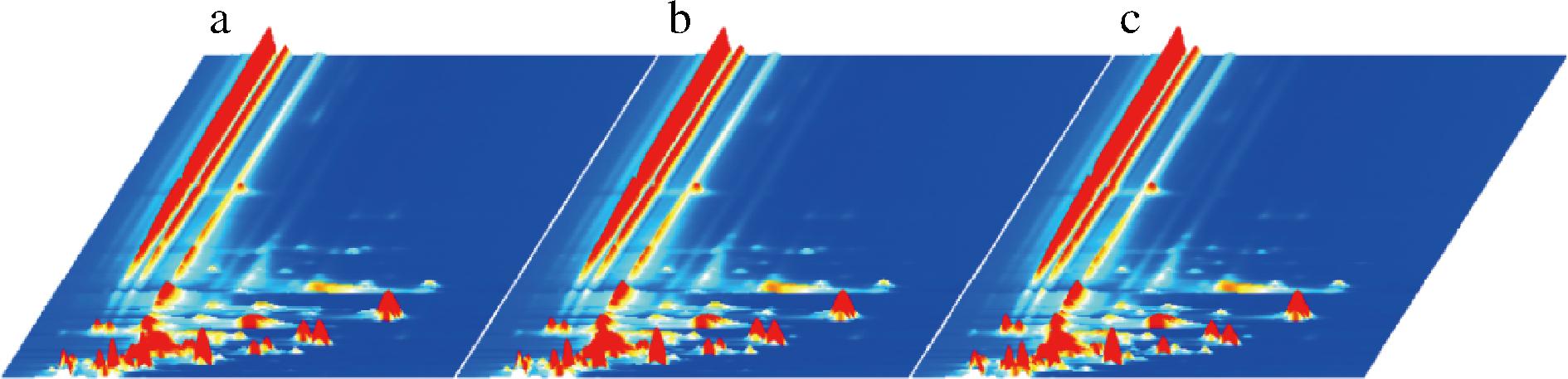
a-H30谱图;b-H50谱图;c-H70谱图
图6 三组样品的GC-IMS三维谱图
Fig.6 Three-dimensional GC-IMS spectra of three groups of samples
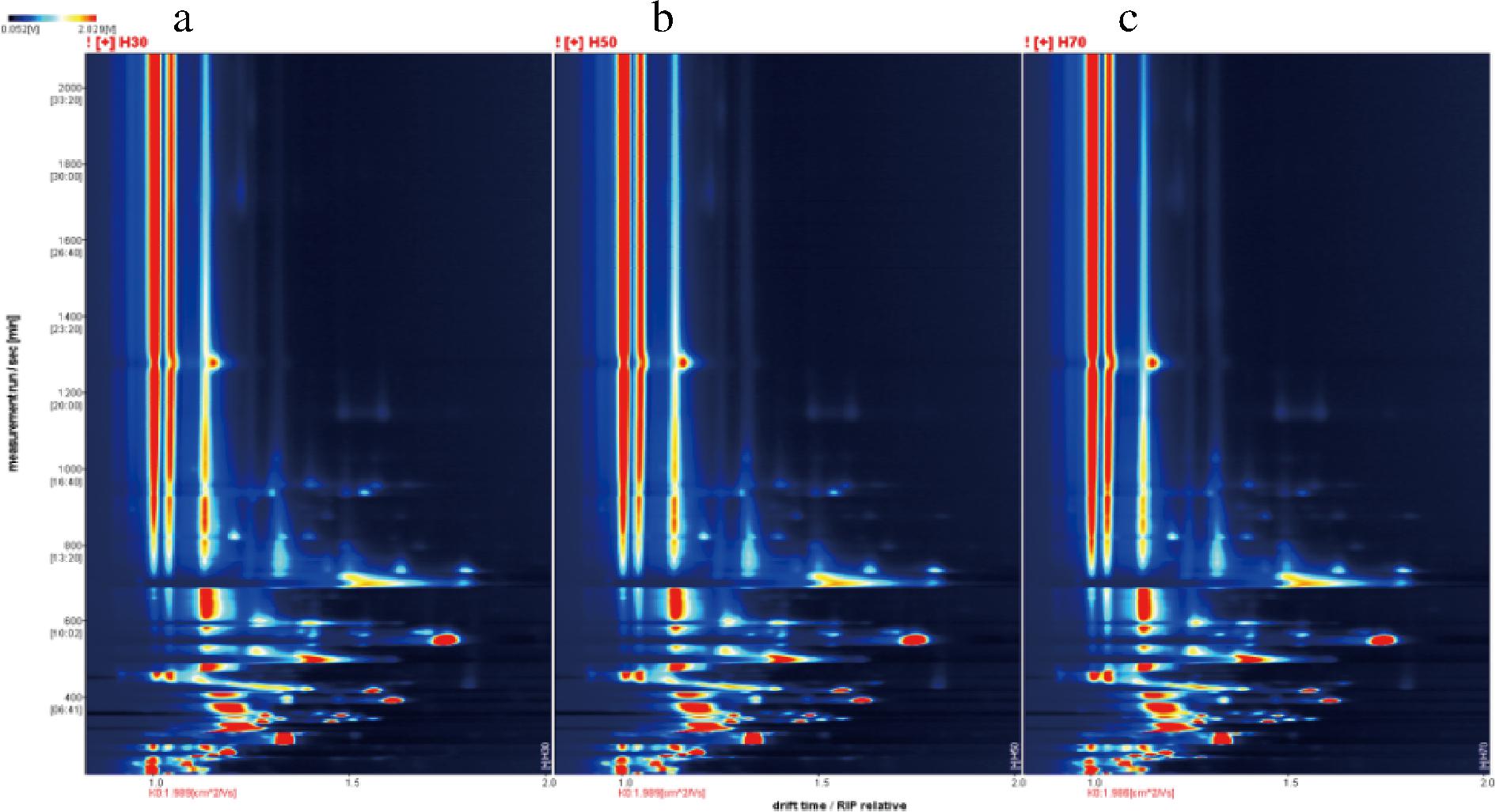
a-H30谱图;b-H50谱图;c-H70谱图
图7 三组样品的GC-IMS二维谱图
Fig.7 Two-dimensional GC-IMS spectra of three groups of samples
注:谱图背景为蓝色,横坐标1.0处红色竖线为RIP峰,纵坐标代表气相色谱保留时间(s),横坐标代表离子相对迁移时间;颜色代表物质浓度,白色表示浓度较低,红色表示浓度较高,颜色越深浓度越大。

a-H30谱图;b-H50谱图;c-H70谱图
图8 三组样品的GC-IMS差异谱图
Fig.8 Differential GC-IMS spectra of three groups of samples
2.4.2 山楂糯米酒挥发性成分 GC-IMS 指纹图谱分析
由前述分析结果可以发现,3个样品的风味物质存在差异,为了更直观准确地比较样品风味的差异,更加全面地分析风味成分分布情况,实验选取了所有的风味物质信号峰,使用Gallery Plot插件构建如图9所示的指纹图谱。样品H30中2,4,6-三甲基吡啶、异松油烯、3-蒈烯、庚酸乙酯、乳酸乙酯、乙酸异丁酯、乙酸丙酯、乙酸甲酯、芳樟醇、1-己醇、1-丁醇、1-戊烯-3-醇、3-甲基-3-丁烯-1-醇、2,4-己二烯醛、庚醛、乙醛等物质的含量较高;样品H50中苯乙醛、丁酸乙酯、己酸乙酯、异丁酸乙酯、乙酸乙酯、丙酮、1-辛烯-3-酮等物质的含量较高;样品H70中乙酸、二甲基三硫醚、辛酸乙酯、2-甲基丁酸乙酯、丙酸乙酯、3-甲基丁酸乙酯、乙酸叶醇酯、3-壬酮、3-羟基-2-丁酮、环戊酮、Z-2-戊烯-1-醇、1-戊醇、辛醛、戊醛、3-甲基丁醛、2-甲基丙醛、丙醛、二甲基硫醚等物质的含量较高;3个样品的挥发性风味物质浓度存在明显的差异。

图9 三组样品的有机挥发性物质指纹谱图
Fig.9 Fingerprints of organic volatile substances in three groups of samples
注:每一行代表一个样品中选取的全部信号峰;每一列代表同一物质在不同样品中的信号峰差异,颜色越深表示物质浓度越高,信号峰越强。
2.4.3 山楂糯米酒挥发性有机物定性分析及关键物质的确定
通过GC-IMS对3个样品进行测定,使用NIST数据库和IMS数据库对物质进行定性分析,结果如表6所示,共检测并定性了52种挥发性物质,共7大类物质,依次为酯类物质20种、醇类物质11种、醛类物质10种、酮类物质5种、醚类物质2种、萜烯类物质2种、吡啶类物质1种。其中,醇类物质相对含量最高,其次为酯类物质,醇类和酯类的相对含量约占90%;其余5大类物质的相对含量相差较小。由表6可知,7大类物质在3个样品中的相对含量差异显著(P<0.05)。庚酸乙酯、乳酸乙酯、乙酸异戊酯、2-甲基丁酸乙酯、丁酸乙酯、乙酸异丁酯、乙酸异丁酯(二聚体)、乙酸丙酯、乙酸丙酯(二聚体)、异丁酸乙酯(二聚体)、乙酸甲酯、异戊酸乙酯、乙酸叶醇酯等13种酯类,乙醇、正丁醇、正戊醇、正己醇、异戊醇、1-戊烯-3-醇、芳樟醇、顺-2-戊烯-1-醇等8种醇类,戊醛、异丁醛、2,4-己二烯醛等3种醛类,3-壬酮、环戊酮等2种酮类,3-蒈烯、异松油烯等2种萜烯类,2,4,6-三甲基吡啶,甲基三硫醚等物质在3个样品中的相对含量差异显著(P<0.05)。
表6 挥发性有机物定性分析结果
Table 6 Results of qualitative analysis of volatile organic compounds

类别化合物CAS号分子式保留指数保留时间/s相对迁移时间/s相对含量/%H30H50H70酯类辛酸乙酯(单体)C106321C10H20O21 454.01 148.1621.490 530.21±0.02b0.20±0.01b0.28±0.01a辛酸乙酯(二聚体)C106321C10H20O21 453.61 147.2442.026 420.07±0.010.07±0.000.08±0.01庚酸乙酯C106309C9H18O21 370.0958.8971.402 680.36±0.01a0.32±0.01b0.29±0.01c乳酸乙酯C97643C5H10O31 360.6939.8611.539 590.43±0.00a0.38±0.00b0.21±0.01c已酸乙酯C123660C8H16O21 240.2738.0741.800 290.99±0.00a0.99±0.01a0.91±0.02b乙酸异戊酯C123922C7H14O21 126.2550.3211.748 288.02±0.04a7.79±0.06b7.37±0.08c2-甲基丁酸乙酯C7452791C7H14O21 051.7436.6781.650 80.08±0.00c0.12±0.00b0.15±0.00a丁酸乙酯C105544C6H12O21 038.4420.5271.563 491.94±0.01b2.10±0.03a1.80±0.02c乙酸异丁酯(单体)C110190C6H12O21 014.3392.9091.346 071.42±0.02a1.29±0.01b1.17±0.02c乙酸异丁酯(二聚体)C110190C6H12O21 014.3392.9091.615 063.39±0.02a3.09±0.02b2.30±0.01c乙酸丙酯(单体)C109604C5H10O2977.6354.5991.288 921.01±0.00a0.93±0.00b0.74±0.02c乙酸丙酯(二聚体)C109604C5H10O2977.6354.5991.486 830.85±0.00a0.71±0.01b0.47±0.02c异丁酸乙酯(单体)C97621C6H12O2967.4344.7991.327 950.63±0.00a0.57±0.00b0.50±0.03b异丁酸乙酯-二聚体C97621C6H12O2968.3345.691.563 490.28±0.00c0.32±0.01a0.30±0.01b丙酸乙酯(单体)C105373C5H10O2959.8337.6711.283 351.14±0.00a1.07±0.01ab1.01±0.03a丙酸乙酯(二聚体)C105373C5H10O2961.7339.4531.453 380.75±0.01b0.82±0.02b0.99±0.02a乙酸乙酯C141786C4H8O2887.7284.2161.337 79.15±0.069.13±0.028.91±0.10乙酸甲酯C79209C3H6O2831.6255.7061.194 153.64±0.01a3.33±0.01b2.19±0.01c3-甲基丁酸乙酯C108645C7H14O21 067.2456.1641.270 80.03±0.00c0.05±0.00b0.06±0.00a乙酸叶醇酯C3681718C8H14O21 328.6877.5731.817 150.02±0.01c0.04±0.00b0.06±0.00a小计34.42±0.10a33.32±0.16b29.80±0.20c醇类乙醇C64175C2H6O 936.9317.181.135 6126.82±0.10c 27.97±0.10b 30.27±0.42a 正丙醇C71238C3H8O1 040.9423.531.245 665.54±0.05b5.55±0.05b5.80±0.07a正丁醇C71363C4H10O1 149.6595.4031.387 312.61±0.03a2.24±0.01b1.59±0.02c正戊醇C71410C5H12O1 261.3767.2641.502 080.25±0.00c0.28±0.01b0.32±0.00a正己醇C111273C6H14O1 358.7936.0541.305 150.56±0.00a0.53±0.01b0.46±0.02c异戊醇C123513C5H12O1 209.3697.4631.502 089.61±0.02c9.95±0.06b10.28±0.07a1-戊烯-3-醇C616251C5H10O1 139.1574.741.376 650.21±0.01a0.19±0.00b0.17±0.00c芳樟醇C78706C10H18O1 641.51 716.351.227 080.47±0.02a0.37±0.02b0.33±0.02c顺-2-戊烯-1-醇C1576950C5H10O1 327.3875.1371.447 690.12±0.00c0.16±0.00b0.19±0.00a2-甲基-1-丙醇C78831C4H10O1 096.9498.6651.370 558.90±0.06b8.97±0.03b9.17±0.14a3-甲基-3-丁烯-1-醇C763326C5H10O1 173.4645.0411.415 750.06±0.00a0.06±0.00a0.05±0.00b小计55.15±0.08c56.28±0.14b58.72±0.11a醛类戊醛C110623C5H10O 982.2 359.0541.425 510.18±0.00c0.19±0.24b0.24±0.01a庚醛C111717C7H14O1 180.5660.6591.363 290.03±0.000.03±0.000.03±0.00辛醛C124130C8H16O1 298.0821.8351.400 80.41±0.00ab0.39±0.01b0.44±0.00a异丁醛C78842C4H8O810.9245.9061.279 170.06±0.00c0.08±0.00b0.34±0.01a乙醛C75070C2H4O725.6209.3780.985 090.28±0.02a0.22±0.00b0.20±0.03b丙醛(单体)C123386C3H6O797.3239.6691.067 320.31±0.03b0.23±0.00b0.58±0.01a丙醛(二聚体)C123386C3H6O797.3239.6691.146 760.35±0.01b0.33±0.00b0.40±0.02a3-甲基丁醛C590863C5H10O927.5309.1621.411 570.06±0.00b0.06±0.00b0.12±0.00a苯乙醛C122781C8H8O1 696.71 932.011.251 570.14±0.010.14±0.010.14±0.022,4-己二烯醛C142836C6H8O1 388.7998.241.100 720.08±0.01a0.06±0.00b0.05±0.01c小计1.90±0.04b1.73±0.02c2.53±0.08a酮类丙酮C67641C3H6O 816.6 248.5791.111 921.12±0.02b1.19±0.00a1.17±0.01a3-羟基-2-丁酮C513860C4H8O21 299.4824.3731.335 160.30±0.00a0.29±0.01a0.36±0.01b3-壬酮C925780C9H18O1 340.7900.5191.385 80.07±0.00c0.10±0.00b0.12±0.00a环戊酮C120923C5H8O1 134.2565.3481.326 380.11±0.00c0.19±0.00b0.28±0.00a1-辛烯-3-酮C4312996C8H14O1 279.8793.8261.683 350.06±0.00b0.08±0.00a0.07±0.01a小计1.66±0.01c1.84±0.01b2.00±0.00a
续表6

类别化合物CAS号分子式保留指数保留时间/s相对迁移时间/s相对含量/%H30H50H70萜烯类3-蒈烯C13466789C10H161 138.1572.8621.698 020.87±0.02a0.59±0.01b0.29±0.01c异松油烯C586629C10H161 297.3820.5661.211 380.84±0.02a0.71±0.01c0.76±0.03b小计1.71±0.03a1.30±0.02b1.05±0.02c醚类甲基三硫醚C3658808C2H6S31 402.71 028.562 1.319 1 0.24±0.01c0.30±0.00b0.34±0.01a二甲基硫醚C75183C2H6S762.6224.5241.088 231.57±0.05b1.72±0.00ab1.91±0.08a小计1.82±0.06c2.02±0.01b2.25±0.07a吡啶类2,4,6-三甲基吡啶C108758C8H11N1 370.0958.8971.573 350.23±0.01a0.17±0.00b0.11±0.01c酸类乙酸C64197C2H4O21 504.01 278.2811.149 73.11±0.11b3.34±0.13a3.54±0.05a
注:同行不同字母表示差异显著(P<0.05)。
饮料酒中相对含量差异显著的化合物不一定表明该物质对饮料酒的整体风味起关键作用,需要结合化合物的风味阈值进行分析。ROAV法可用于确定食品的关键风味化合物。选择风味阈值较低、相对含量较高的化合物或相对含量变化较大的化合物,作为关键性风味物质,即ROAVstan为100,依此计算各类化合物的ROAV。如表7所示,甲基三硫醚的风味阈值较低(0.8 μg/kg)且在3种样品中的相对含量均较高,故选择甲基三硫醚作为山楂糯米酒关键性风味物质。3种样品中ROAV>1的关键风味化合物为甲基三硫醚、丁酸乙酯、庚酸乙酯、乙酸异戊酯、异丁酸乙酯(二聚体)、芳樟醇、异丁醛,此外在样品H30中异松油烯的ROAV>1,样品H70中乙酸叶醇酯的ROAV>1。甲基三硫醚是在二价铜离子存在时,硫化氢与甲硫醇反应生成;常用于调味、汤类等食品香精中,已在葡萄酒、白酒、啤酒等饮料酒中检测到;丁酸乙酯、庚酸乙酯、异丁酸乙酯等乙酯类化合物和乙酸异戊酯、乙酸叶醇酯等乙酸酯类化合物呈现水果香、花香,是饮料酒中最重要的化合物,可以赋予饮料酒悦人的香气;芳樟醇是天然存在的一种萜烯醇,具有令人愉悦的花香,在啤酒中最为常见;饱和脂肪醛类物质是由氨基酸以Strecker降解方式形成,是饮料酒中重要的嗅觉和味觉化合物;异松油烯具有松香,带有柑橘香韵,对饮料酒的香气具有重要贡献[22]。
表7 关键化合物阈值及相对气味活度值
Table 7 Thresholds and relative odor activity values of key compounds
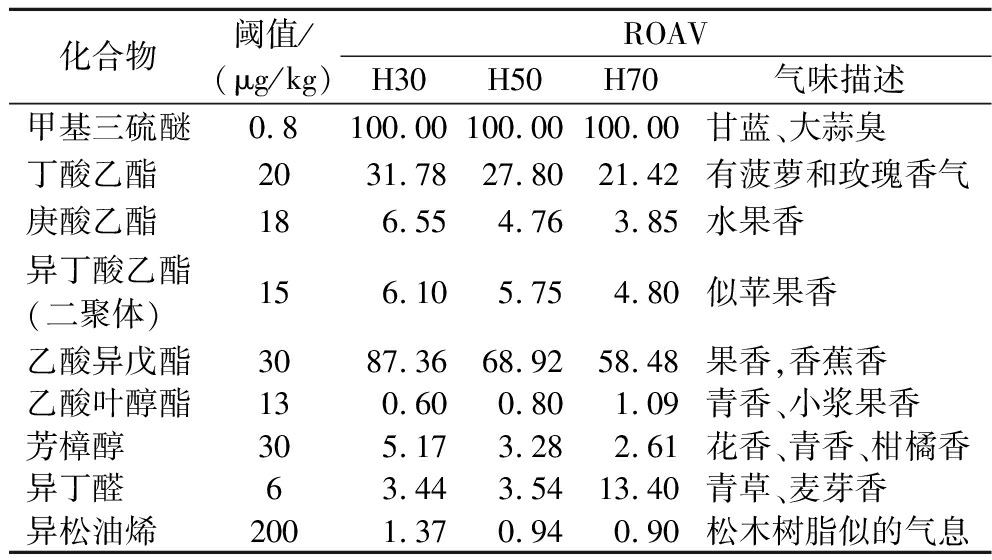
化合物阈值/(μg/kg)ROAVH30H50H70气味描述甲基三硫醚0.8100.00100.00100.00甘蓝、大蒜臭丁酸乙酯2031.7827.8021.42有菠萝和玫瑰香气庚酸乙酯186.554.763.85水果香异丁酸乙酯(二聚体)156.105.754.80似苹果香乙酸异戊酯3087.3668.9258.48果香,香蕉香乙酸叶醇酯130.600.801.09青香、小浆果香芳樟醇305.173.282.61花香、青香、柑橘香异丁醛63.443.5413.40青草、麦芽香异松油烯2001.370.940.90松木树脂似的气息
注:相对气味活度阈值数据主要来源于《化合物嗅觉阈值汇编》,气味描述来源于《酒类风味化学》;仅列出ROAV>1的化合物。
2.4.4 山楂糯米酒关键风味成分正交偏最小二乘法判别分析
利用SIMCA14.1对山楂糯米酒ROAV>1的化合物进行 OPLS-DA,计算预测变量重要性投影(variable importance in projection, VIP)。以9个香气化合物的相对含量作为因变量,不同样品作为自变量,进行OPLS-DA建模设计,结果如图10-a所示。自变量拟合指数R2X=0.981,表示该模型可以反映98.1%的数据;因变量拟合指数R2Y=0.983,模型的预测指数Q2=0.967,R2和Q2均接近于1.0,表明模型的拟合性好,拟合结果接受度高。由图10-a可知,山楂糯米酒3个样品位于OPLS-DA得分散点图上不同的区域,且组内聚集度高,表明3个样品区分度好。OPLS-DA模型的可靠性经过200次交叉置换检验,结果如图10-b所示,R2和Q2保留度均小于1.0,Q2回归线与纵坐标的相交点在0点以下,模型验证有效,说明模型稳定可靠,不存在过拟合。
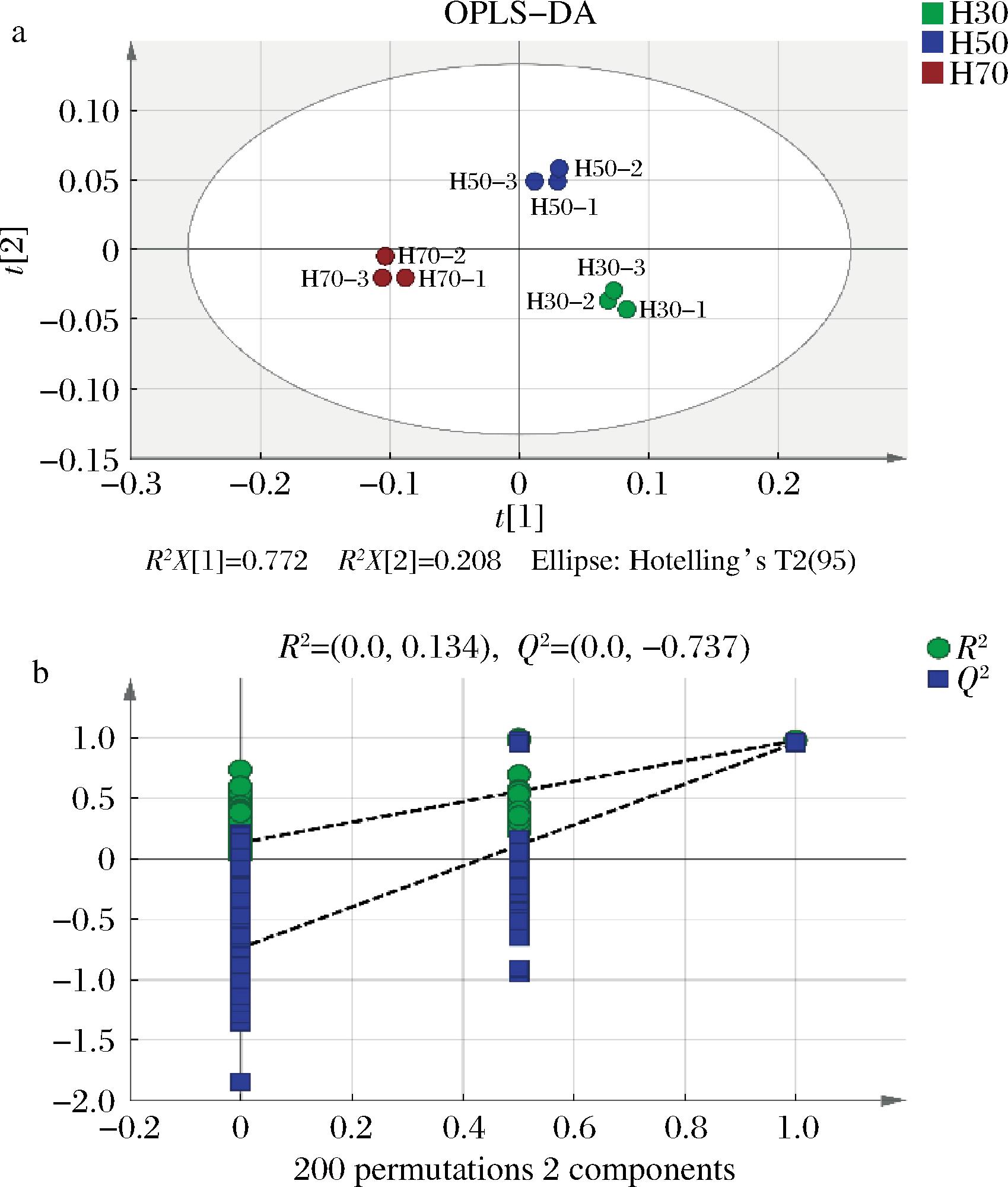
a-OPLS-DA得分图;b-置换检验图
图10 三种不同原料比例山楂糯米酒香气化合物OPLS-DA得分图和置换检验图
Fig.10 OPLS-DA score plot and permutation test of aroma compounds in hawthorn glutinous rice wine with three different raw material ratios
利用VIP值量化OPLS-DA的每个因变量对样品区分度的贡献,VIP值越大,因变量对样品区分度的贡献值就越大,若VIP值大于1表明为关键因变量。由图11可知,乙酸异戊酯、丁酸乙酯、异丁醛、异松油烯的VIP>1,结合化合物的ROAV及气味描述将上述4种物质确定为山楂糯米酒的关键风味物质,甲基三硫醚、庚酸乙酯、异丁酸乙酯(二聚体)、芳樟醇、乙酸叶醇酯是对山楂糯米酒风味具有重要修饰作用的化合物。
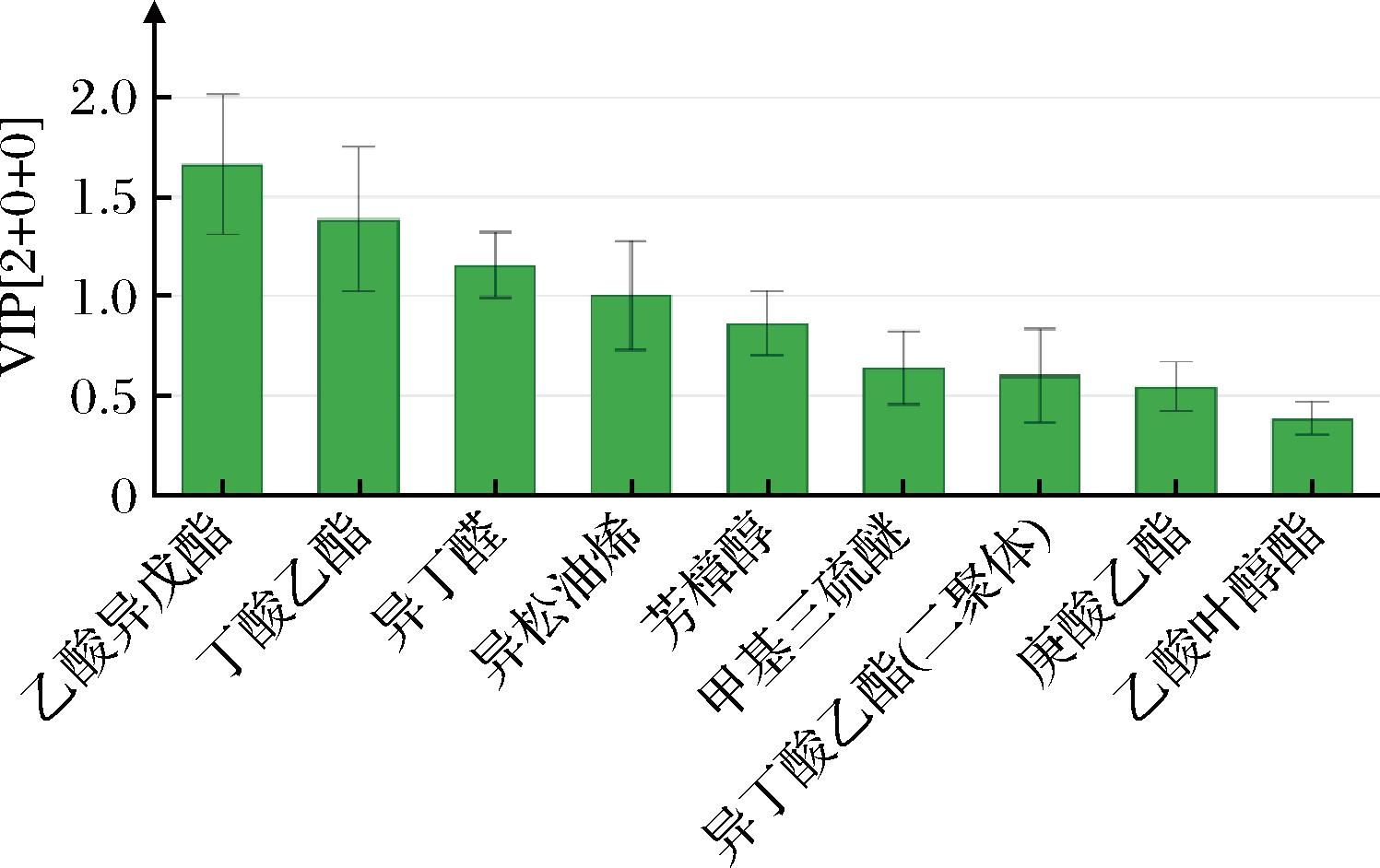
图11 基于OPLS-DA模型分析的变量投影重要性值
Fig.11 VIP values of hawthorn glutinous rice wine based on OPLS-DA model analysis
2.5 感官评定
通过感官分析,对比了不同条件下发酵山楂糯米酒香气成分的差异,汇总品评员的评分并利用Origin 2021绘制雷达图,如图12所示。雷达图展示了所有比较项目的平均得分,可以直观判断山楂糯米酒的香气分布。综合分析可知,H40、H50、H60的得分较为接近,香气分布明显优于另外两组样品;进一步对比,样品H50除香气成分得分较高以外,在香气丰富度和平衡度上也有较大优势,相比于其他样品,香气更加和谐平衡,人群可接受性更好。这一结果也与前述仪器检测的结果基本一致,进一步证实了不同的发酵条件会对山楂糯米酒的香气产生影响。

图12 感官评定得分雷达图
Fig.12 Radar map of sensory assessment scores
3 结论
本研究使用电子鼻和GC-IMS技术对酵母种类和发酵原料比例对山楂糯米酒的风味差异进行分析,电子鼻传感器对黄酒酵母发酵样品中氮氧化合物、甲基类、醛酮醇类等物质的响应值更高,可以判断黄酒酵母发酵样品的风味物质丰富度优于果酒酵母;同时随着原料比例的改变,产品的风味也发生显著变化。GC-IMS分析定性了52种物质,主要为酯类、醇类物质。其中,甲基三硫醚、丁酸乙酯、庚酸乙酯、乙酸异戊酯、异丁酸乙酯(二聚体)、芳樟醇、异丁醛、异松油烯、乙酸叶醇酯等9种化合物的ROAV>1。OPLS-DA结合VIP值筛选出4种关键风味化合物(VIP>1),分别是乙酸异戊酯、丁酸乙酯、异丁醛、异松油烯。
在不同原料占比的发酵样品中,随着山楂浆占比的增加,挥发性成分的含量明显增加,风味特征更加明显。通过对比可知,山楂浆占比40%、50%、60%的样品,组间差异较小,但与其他组别的风味差异明显。甜酒液的含量高,发酵液糖度高,更加有利于酵母发酵,使得乳酸乙酯、乙酸异丁酯等以及醇类物质含量增加;反之山楂浆占比增加,发酵液的糖度降低,酸度升高,不利于发酵的进行,导致乙酸等物质的含量增加,产品口感变酸;同时山楂含有果胶类物质较多,果胶发酵产生甲醇,对风味和安全性产生不良影响。结合感官评定结果,山楂浆占比50%的样品风味更佳,香气更加和谐平衡,人群可接受性更好。
实验结果表明,电子鼻可以将山楂糯米酒中的挥发性成分区分开,检测出氮氧化合物、甲基类等的挥发性成分,但不能定量比较挥发性物质的具体差异。GC-IMS技术生成的样品特征谱图,能够直观辨别不同山楂糯米酒样品之间挥发性成分的差异,采用ROAV结合OPLS-DA明确了山楂糯米酒关键风味化合物。电子鼻与GC-IMS技术联用可以对不同发酵条件下山楂糯米酒的香气成分差异进行分析,为水果糯米酒的开发提供理论依据,为我国饮料酒产业发展奠定技术基础。
[1] 袁国亿, 何宇淋, 王春晓, 等.米酒风味品质形成相关因素的研究进展[J].食品与发酵工业, 2022, 48(9):286-294.
YUAN G Y, HE Y L, WANG C X, et al.Research progress on the factors correlated with flavor quality in rice wine[J].Food and Fermentation Industries, 2022, 48(9):286-294.
[2] 尤洁, 宋飞飞, 吴伟斌.响应面法优化松针板栗黑米酒的发酵工艺[J].食品与发酵工业, 2024, 50(9):64-70.
YOU J, SONG F F, WU W B.Optimization of fermentation technology of pine needle chestnut black rice wine by response surface method[J].Food and Fermentation Industries, 2024, 50(9):64-70.
[3] 王春芳, 陈冰洁, 刘晨霞, 等.原料及酒曲对米酒品质影响的研究进展[J].粮食与油脂, 2023, 36(1):22-24.
WANG C F, CHEN B J, LIU C X, et al.Research progress on the effects of raw materials and koji on the quality of rice wine[J].Cereals &Oils, 2023, 36(1):22-24.
[4] LOU H, HAN X Y, FAN B Z, et al.The effect of incorporating lingonberry (Vaccinium vitis-Idaea L.) on the physicochemical, nutrient, and sensorial properties of Chinese sweet rice wine[J].Journal of Food Measurement and Characterization, 2023, 17(3):2932-2943.
[5] GU W J, WANG R Q, CAI Z W, et al.Hawthorn total flavonoids ameliorate ambient fine particulate matter-induced insulin resistance and metabolic abnormalities of lipids in mice[J].Ecotoxicology and Environmental Safety, 2023, 249:114456.
[6] LU M K, ZHANG L, PAN J Y, et al.Advances in the study of the vascular protective effects and molecular mechanisms of hawthorn (Crataegus anamesa Sarg.) extracts in cardiovascular diseases[J].Food &Function, 2023, 14(13):5870-5890.
[7] HUANG X, BIAN Y Y, LIU T Z, et al.Antioxidant potential and in vitro inhibition of starch digestion of flavonoids from Crataegus pinnatifida[J].Heliyon, 2022, 8(10):e11058.
[8] CLOUD A, VILCINS D, MCEWEN B.The effect of hawthorn (Crataegus spp.) on blood pressure:A systematic review[J].Advances in Integrative Medicine, 2020, 7(3):167-175.
[9] LI T P, FU S Y, HUANG X, et al.Biological properties and potential application of hawthorn and its major functional components:A review[J].Journal of Functional Foods, 2022, 90:104988.
[10] 崔晓. 山楂黍米黄酒酿造工艺及抗氧化活性研究[D].太谷:山西农业大学, 2018.
CUI X.Study on brewing process and antioxidant activity of hawthorn yellow rice wine[D].Taigu:Shanxi Agricultural University, 2018.
[11] 李博艺. 山楂黄酒生产工艺的研究[D].天津:天津科技大学, 2018.
LI B Y.Study on the Production technology of hawthorn rice wine[D].Tianjin:Tianjin University of Science &Technology, 2018.
[12] 王俊敏. 黑藜麦山楂酒的研制及抗氧化分析[D].太原:山西大学, 2021.
WANG J M.Development and antioxidant analysis of black quinoa and hawthorn wine[D].Taiyuan:Shanxi University, 2021.
[13] 潘志明, 陈志杰, 罗立川.起泡山楂黄酒酿造工艺优化及品质评价[J].中国酿造, 2022, 41(9):188-193.
PAN Z M, CHEN Z J, LUO L C.Optimization of brewing technology and quality evaluation of sparkling hawthorn Huangjiu[J].China Brewing, 2022, 41(9):188-193.
[14] 牛云蔚, 李雯慧, 肖作兵.白酒风味物质分析研究进展[J].食品科学技术学报, 2021, 39(2):23-31;90.
NIU Y W, LI W H, XIAO Z B.Research progress on analysis of flavor compounds in Baijiu[J].Journal of Food Science and Technology, 2021, 39(2):23-31;90.
[15] 田露琴, 戴怡凤, 徐浩, 等.饮料酒中手性风味物质分析方法研究进展[J].食品与发酵工业, 2023, 49(5):291-298.
TIAN L Q, DAI Y F, XU H, et al.Research progress on analytical methods of chiral flavor compounds in alcoholic beverages[J].Food and Fermentation Industries, 2023, 49(5):291-298.
[16] 孙细珍, 熊亚青, 唐娟, 等.液液微萃取结合气相色谱-串联质谱测定饮料酒中挥发性酚类化合物[J].食品与发酵工业, 2022, 48(3):257-265.
SUN X Z, XIONG Y Q, TANG J, et al.Analysis of phenols in alcoholic beverages by liquid-liquid microextraction coupled with gas chromatography-tandem mass spectrometry[J].Food and Fermentation Industries, 2022, 48(3):257-265.
[17] 周晨曦, 郑福平, 孙宝国.离子迁移谱技术在食品风味分析中的应用研究进展[J].食品工业科技, 2019, 40(18):309-318.
ZHOU C X, ZHENG F P, SUN B G.Research progress on the application of ion mobility spectrometry(IMS) in food flavor analysis[J].Science and Technology of Food Industry, 2019, 40(18):309-318.
[18] LIU M, HAN X M, TU K, et al.Application of electronic nose in Chinese spirits quality control and flavour assessment[J].Food Control, 2012, 26(2):564-570.
[19] 张佳丽, 李朋亮, 赵巍, 等.基于电子鼻和GC-IMS联用技术分析不同豆类馒头挥发成分的差异[J].中国粮油学报, 2023, 38(6):156-163.
ZHANG J L, LI P L, ZHAO W, et al.Analysis of volatile components in different bean steamed bread based on electronic nose and GC-IMS[J].Journal of the Chinese Cereals and Oils Association, 2023, 38(6):156-163.
[20] 刘丽丽, 杨辉, 荆雄, 等.基于GC-IMS和电子鼻技术分析贮酒容器对凤香型白酒香气成分的影响[J].食品科学, 2022, 43(4):257-263.
LIU L L, YANG H, JING X, et al.Influence of different storage containers on the aroma composition of Fengxiang-type Baijiu analyzed by gas chromatography-ion mobility spectroscopy and electronic nose[J].Food Science, 2022, 43(4):257-263.
[21] 刘登勇, 周光宏, 徐幸莲.确定食品关键风味化合物的一种新方法:“ROAV” 法[J].食品科学, 2008, 29(7):370-374.
LIU D Y, ZHOU G H, XU X L.“ROAV” method:A new method for determining key odor compounds of Rugao ham[J].Food Science, 2008, 29(7):370-374.
[22] 范文来, 徐岩.酒类风味化学[M].北京:中国轻工业出版社, 2014.
FAN W L, XU Y.Flavor Chemistry of Alcoholic Beverage [M], Beijing:China Light Industry Press, 2014.