现代酿酒学技术的最新研究表明,非酿酒酵母在改善葡萄酒品质方面发挥了重要作用。这些酵母与传统酿酒酵母不同,能够促进葡萄酒质量参数和风味特征差异化。目前,研究人员已经将非酿酒酵母应用于葡萄酒行业的不同生物技术目标,包括较强β-葡萄糖苷酶和酯酶活性来提升香气复杂性,改变乙醇、甘油、有机酸的化学组成,释放胞外活性因子,改善微生物稳定性等[1-3]。市面上已经开发了多种具有有趣特性的非酿酒酵母商业产品,涉及戴尔有孢圆酵母(Torulaspora delbrueckii)、耐热克鲁维酵母(Lachancea thermotolerans)和美极梅奇酵母(Metschnikowia pulcherrima)[4]。值得注意的是,大多数非酿酒酵母发酵能力弱,无法独立完成发酵。
裂殖酵母表现出较强的发酵活性,其独特的苹果酸乙醇代谢途径还可以降解酒中的绝大部分苹果酸,这一酿酒特性尤其受到酿酒师的关注。然而,该属的许多菌株倾向于产生高浓度的乙酸,强调了对分离菌株进行有效筛选的重要性[5]。此外,近年来的研究集中在粟酒裂殖酵母(Schizosaccharomyces pombe,以下简称SP)与酿酒酵母以及与其他非酿酒酵母如耐热克鲁维酵母及戴尔有孢圆酵母混合发酵方面,不仅关注苹果酸的降解,而且还深入探索了降低酒中有害化合物、提升特定品种香气感知、改善酒中多糖水平以及防止苹果酸乳酸发酵引起的颜色损失等酿酒学应用[6-9]。
当前,SP在苹果酒、啤酒、芒果酒等行业的应用日益广泛,用于解决与冷凉产区相似的苹果酸过高的特定问题[10]。SP对葡萄酒最终功能特性的改善相关研究也显著增加,利用SP发酵进行葡萄酒生物脱酸及避免苹乳发酵已成为新酿造技术应用的热点。为此,本文在介绍SP基本性质的基础上,重点分析了其对葡萄酒品质的影响以及混合接种发酵的研究和应用情况,以期为在未来的酿酒工业中更好地使用SP酵母提供有益的参考和借鉴。
1 粟酒裂殖酵母的基本性质
粟酒裂殖酵母,与日本裂殖酵母(Schizosaccharomyces japonicus),八孢裂殖酵母(Schizosaccharomyces octosporus)构成了裂殖酵母属,其中SP是发酵工业中最常见的菌种。SP在酵母中具有独特的形态,细胞呈杆状或偏矩形,尺寸为(3~5)×(5~24) μm,多以单细胞或成对的形式存在(图1)。与普通酵母出芽行为不同,SP主要以二分裂方式进行营养繁殖,细胞通过中部的壁或隔膜的形成而分离。在胁迫条件下(如营养缺乏),SP通过形成2~4个单倍体子囊孢子进行有性生殖[11]。
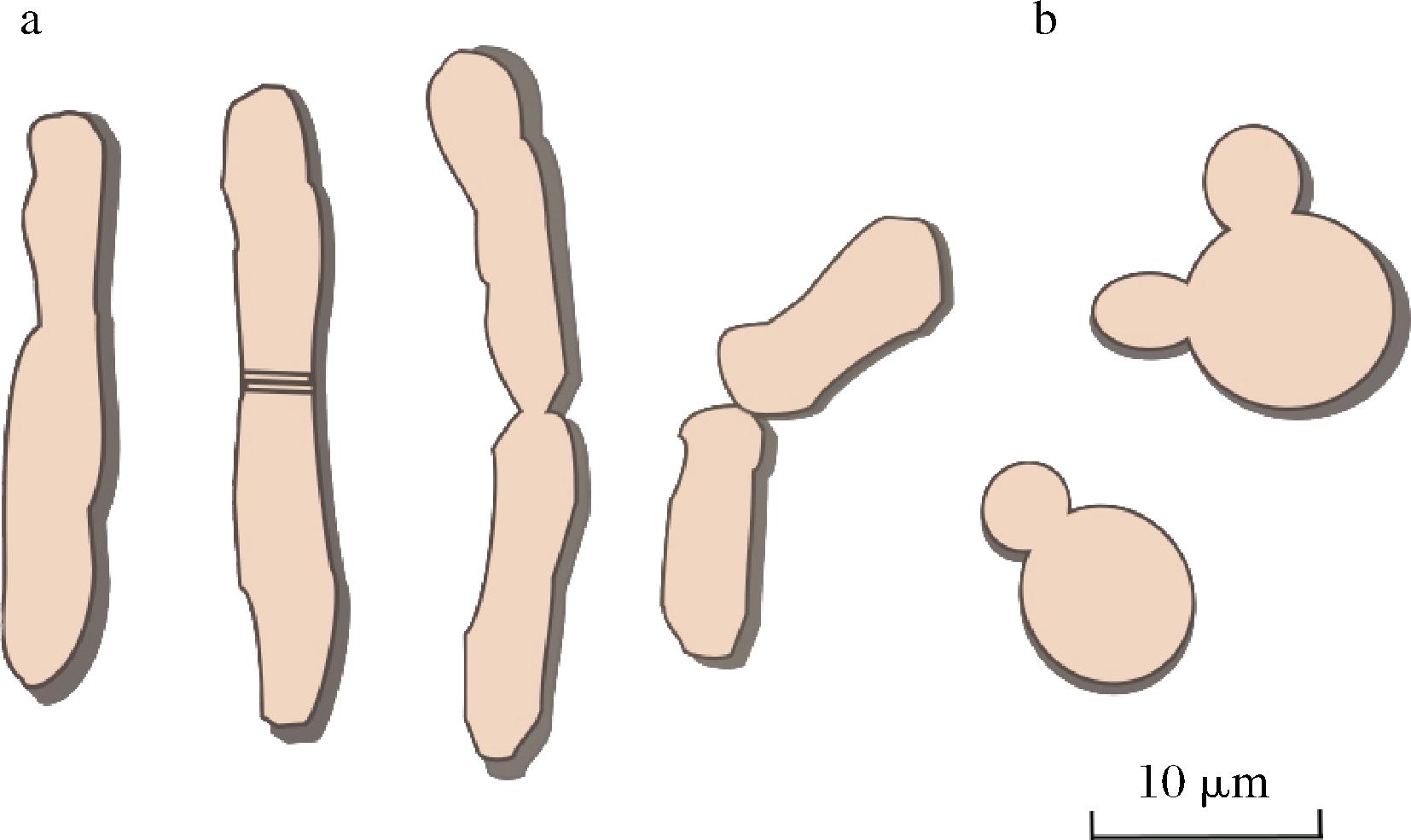
a-粟酒裂殖酵母;b-酿酒酵母
图1 粟酒裂殖酵母与酿酒酵母常见形态比较
Fig.1 Comparison of the common morphology between S. pombe and Saccharomyces cerevisiae
SP对维生素需求高,但对氮源不敏感。该菌种是一种嗜高渗酵母,可在高糖的培养基中筛选,还表现出对低水分活度,低pH,较高的温度及SO2耐受性。SP生长速率较慢,延滞期长,但却是高发酵活力酵母,可以将葡萄糖发酵至10%~15%的酒精度,取决于不同菌株和曝气条件[11]。这些发酵特性体现了SP在葡萄酒工业中作为单一或辅助发酵剂的显著优势。
然而,SP菌株很少从水果、葡萄汁、葡萄酒或其他发酵饮料中分离出来,因为酿酒酵母、其他非酿酒酵母、细菌等竞争性微生物可以快速的在培养基上定植使其自然界中存在较弱,因而无法使用常规微生物学筛选程序分离,这也部分解释了其在发酵剂市场上商业菌株缺乏的原因[10]。而在高渗基质中如干果、浓缩葡萄汁、蜂蜜等,SP由于对渗透压的高耐受能力表现出明显的竞争优势。此外,使用特定的优化选择性培养基可使该种的菌株分离机率增加60%,选择因子主要包括放线菌酮(>100 mg/L)、苯甲酸(>200 mg/L)及糖(>400 g/L),外加一些差异参数,溴甲酚蓝染色、苹果酸降解带来的pH变化以及添加氯霉素等,以便区分出选择性培养基中的假阳性菌株同时避免细菌干扰[12]。这些方法显著提高了自然SP菌株的分离效率,对未来SP商业菌株的开发具有重要的现实意义。
2 粟酒裂殖酵母对葡萄酒品质的影响
2.1 对主要酿酒学参数的影响
乙醇是葡萄酒发酵过程中的主要代谢产物,在初始含糖量为22%~24%的情况下,约95%的糖转化为乙醇和CO2,1%用于产生细胞生物质,其余负责合成甘油和酸、酯等挥发性组分[13]。BENITO等[14]分别使用SP与酿酒酵母单独发酵及混合发酵,最终葡萄酒中的残糖均低于1.5 g/L,酒精度为12.53%~13.18%,诸多研究也显示SP的发酵能力与酿酒酵母相当,属于高发酵活力酵母[7,15-16]。尽管SP单独发酵表现出比酿酒酵母更慢的发酵动力学,但由于其具有苹果酸酒精发酵的潜力,避免了二次苹乳发酵,使其工业化应用的进程加快。此外,营养物质的补充也与SP的乙醇耐受能力密切相关。Mg2+(>3.5 mmol/L)的存在促进了乙醇胁迫下SP细胞质膜通透性的降低,使其在30 ℃下能够耐受20%的乙醇[17]。因此,优化适当的营养条件可使SP更容易在温暖栽培地区初始糖度高的葡萄醪中发酵。
甘油是第二大酵母代谢产物,高水平的甘油产量通常与更好的感官品质相关,例如结构、酒体及甜度[13]。DOMIZIO等[18]报道了SP单一发酵的甘油产量为9~11.4 g/L,这可能与裂殖酵母属筛选过程中约20%的菌株变异性有关。一些研究发现SP可以产生比酿酒酵母高1.51~2.93 g/L的甘油水平,虽然星形假丝酵母(Starmerella bacillaris)仍是甘油的最高生产者(达14 g/L),但SP带来的甘油增加对口感的积极影响仍优于酿酒酵母[19]。这些试验结果在一定程度上表明,SP相比酿酒酵母可能具有更活跃的甘油-丙酮酸代谢途径。
葡萄酒的酸度是影响其新鲜度的主要原因。苹果酸与酒石酸占葡萄总酸度的70%~90%,影响着最终葡萄酒的感官特性,葡萄酒中的糖酸平衡是确保其最佳品质的基础。但过量苹果酸会影响葡萄酒的微生物学稳定性,因此苹果酸的去除可以避免装瓶后可能出现的再发酵和浑浊的风险。在所有酵母中,裂殖酵母属被描述为苹果酸消耗量最高的菌属,能够消耗高达100%的苹果酸。这种能力与其独特的苹果酸-乙醇代谢能力密不可分,即1分子苹果酸转化为1分子乙醇和2分子CO2(图2)。
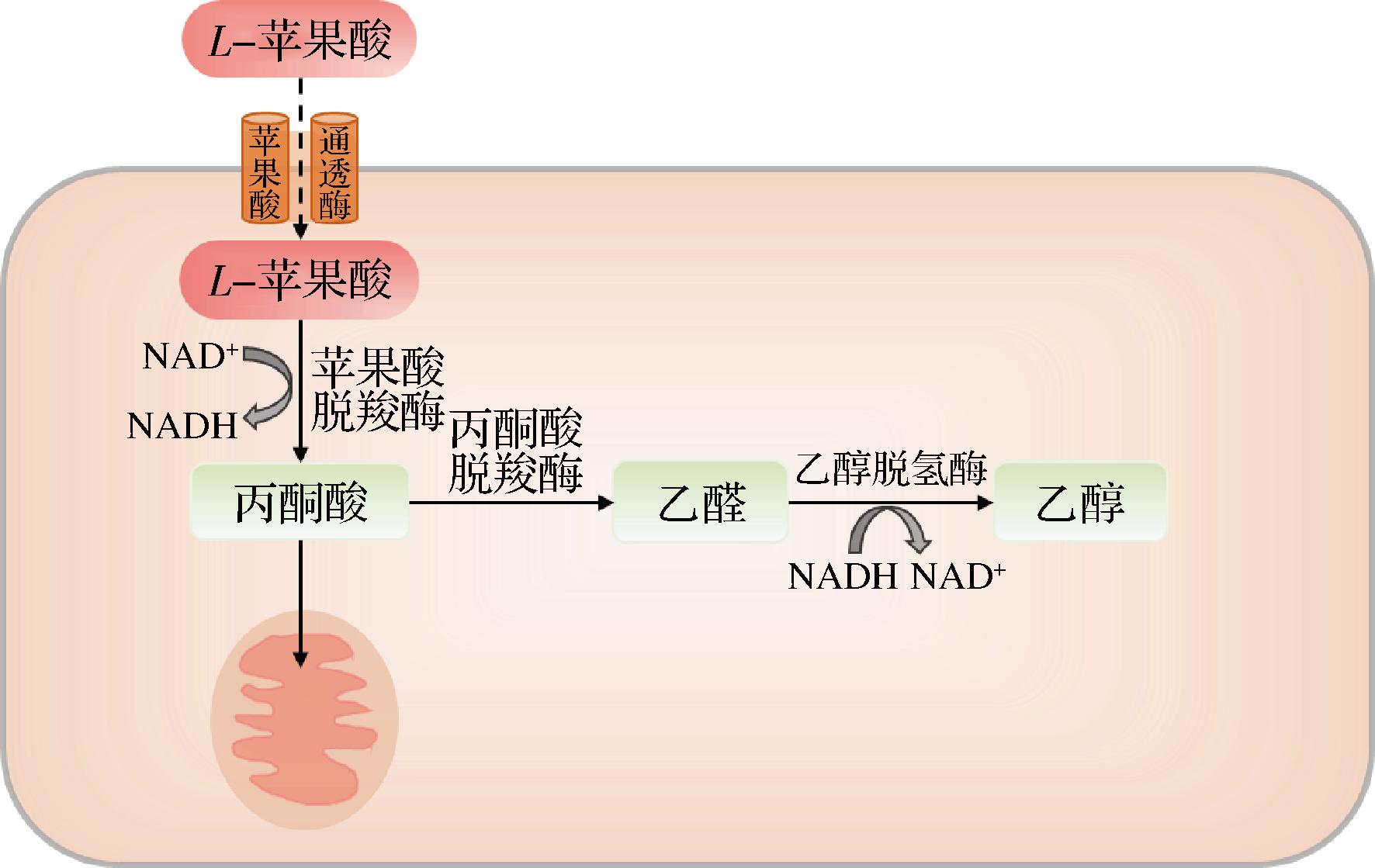
图2 裂殖酵母属的苹果酸乙醇代谢途径示意图
Fig.2 The malo-alcoholic metabolism pathway in the Schizosaccharomyces spp.yeasts
其中,苹果酸脱羧酶在Mn2+/Mn3+存在下诱导苹果酸转化为丙酮酸是限速步骤,之后进入酒精发酵途径。酿酒酵母苹果酸脱羧酶位于线粒体,而在葡萄酒发酵条件下,其细胞器数量低并且功能失调,阻碍其活性;反之,SP则具有活跃的胞外苹果酸吸收转运系统及细胞膜上苹果酸脱羧酶的强亲和力。此外,虽然其他非酿酒酵母,如东方伊萨酵母(Issatchenkia orientalis)也具有苹果酸代谢潜力,但大多仅存在于发酵早期或代谢能力弱(<25%)。
研究发现,SP在酒精发酵接种后不久,就会消耗苹果酸,其降解能力存在菌株差异性,可以观察到75%~100%的苹果酸降低[20]。这种脱酸作用对于降低冷凉栽培区葡萄汁的酸度十分重要,因为高苹果酸浓度(超过5 g/L)是这些产区生产不平衡葡萄酒的主要原因。研究人员也证实SP单独发酵或者与耐热克鲁维酵母混合发酵都可以完全消耗初始浓度近5 g/L的苹果酸,与酿酒酵母和酒酒球菌结合的经典发酵工艺取得了相似的结果,强调了SP作为传统工艺替代品的潜力[21]。在温暖的葡萄栽培区,高乙醇含量增加了乳酸菌启动的困难,高pH(接近4)也会导致苹乳发酵的偏差,包括较高水平挥发酸,生物胺及氨基甲酸乙酯[10]。因此,单独使用SP或与小比例的酿酒酵母混合接种有助于实现微生物稳定性,使葡萄酒避免瓶内再发酵的风险。
挥发酸是微生物代谢的腐败副产物之一,其中乙酸是主要成分,约占总含量的90%[22]。当其分子质量浓度大于0.8 g/L时,醋味主导葡萄酒的风味,是消费者感知最明显的葡萄酒缺陷之一。SP在酿酒工业中使用受限的主要原因正是产生较高水平的乙酸[8,23]。目前已开发不同策略旨在解决这一限制,首先是与选定的商业酿酒酵母混菌发酵,使用固定化的海藻酸盐SP细胞可以在乙酸达高浓度前立即去除他们,以实现苹果酸降解及防止乙酸含量超过故障阈值的双重作用[10];或者是与其他低产乙酸的非酿酒酵母混合发酵,特别是与耐热克鲁维酵母的结合使用已经在许多试验中报道了乙酸水平的显著降低[6],但采用合适的接种策略对理想的结果至关重要。此外,研究人员也致力于筛选中低水平乙酸产量的SP菌株,尽管研究者们发现大约仅5%的SP分离株可以生产出最终挥发酸浓度低于 0.3 g/L 的葡萄酒,但这种筛选对于未来SP酵母在葡萄酒行业的商业化应用具有重要意义[24-25]。
2.2 对葡萄酒风味化合物的影响
葡萄酒的香气特征是决定其品质和价值的关键因素之一,包括高级醇、酯、萜烯等物质。酵母在葡萄酒香气发展中的作用是至关重要的(图3)。大多数SP发酵的葡萄酒芳香特征都与它们较低的高级醇含量相吻合,尽管不同菌株间存在差异[26]。这种效应对于具有较强品种特性的葡萄酒风味特征有积极影响,因为较低高级醇不会掩盖单萜醇、降异戊二烯、果香硫醇等品种香气。在单独接种SP发酵时,6株SP产生的不同高级醇含量均低于酿酒酵母,其中1-丙醇降低30%~60%、2-甲基丁醇降低25%~50%、3-甲基丁醇下降35%~60%、正己醇下降50%,而酿酒酵母产生了更高水平的2-苯乙醇[24],在其他研究中也注意到高级醇产量的显著减少[8,19]。
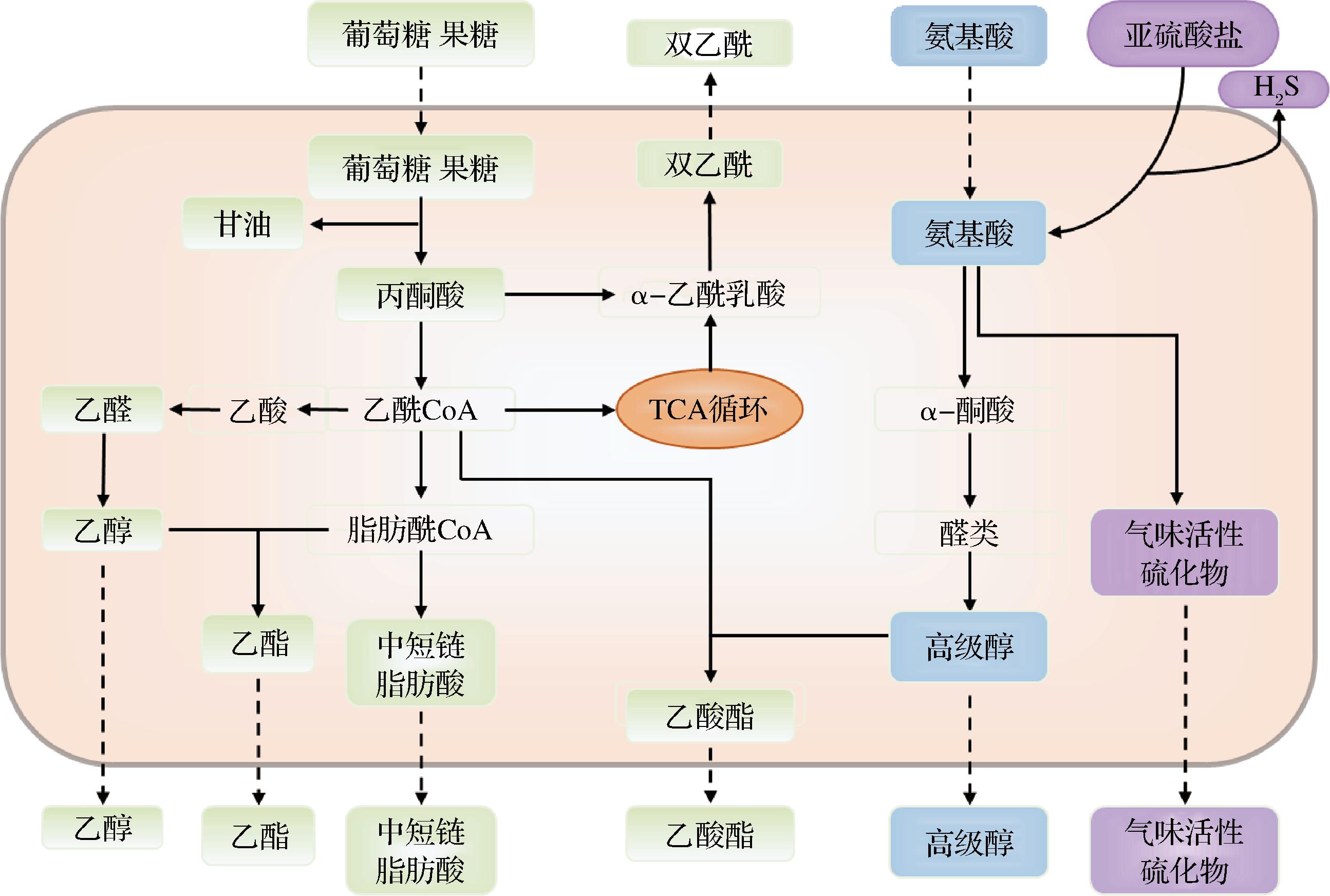
图3 粟酒裂殖酵母中潜在的香气化合物代谢机制
Fig.3 Mechanisms of potential aroma compounds metabolism in S. pombe
酯类主要有酰基辅酶A与高级醇或乙醇在相关酶催化作用下形成,能够赋予葡萄酒花香和果香[22]。与高级醇类似,SP产生酯类物质浓度往往低于酿酒酵母对照。然而,乙酸乙酯水平有所差异,取决于不同SP菌株产乙酸能力,一些SP菌株与酿酒酵母无明显差异,但更多情况下SP产量高于酿酒酵母[23]。考虑到过量的乙酸乙酯可能带来不愉悦的指甲油味道,乙酸乙酯水平的控制也是酿酒师们在应用SP时必须考虑的问题。此外,与酿酒酵母相比,SP单独发酵的苯乙酸乙酯、乙酸苯乙酯和乙酸异戊酯产量均较低[14,24]。这种趋势也体现在DEL FRESNO等[19]的研究中,SP发酵的挥发性化合物的总量比酿酒酵母低30%。
中短链脂肪酸是合成乙酯类的重要前体,通常被描述为脂肪、奶酪和腐臭味,但有研究表明在总浓度低于20 mg/L时会对葡萄酒的香气产生积极贡献[27]。与酿酒酵母相比,SP单一发酵产生的异戊酸、癸酸、壬酸含量显著降低,通常表现出较低的脂肪酸产量[21,26]。然而,在发酵早期阶段,SP被发现能够产生最高的己酸和己酸乙酯,以及较高的辛酸乙酯,赋予葡萄酒令人愉悦的果香[28]。然而,有必要进一步验证这种高产量能否持续到发酵结束,同时还应考虑不同菌株之间的差异。
萜烯类化合物具有极低的感官阈值,是麝香型葡萄及葡萄酒的典型香气组分[22]。研究发现,接种SP的伊斯特拉玛尔维萨葡萄酒具有最高的莰烯、β-蒎烯、薄荷醇、6,10-二氢月桂烯醇和乙酸香叶酯浓度,对于该品种的典型香气成分——芳樟醇产量也显著高于酿酒酵母。此外,在SP发酵早期,β-大马士酮与β-紫罗兰酮含量也显著增加,带来理想的苹果和紫罗兰花香[28]。这可能与酵母的β-葡萄糖苷酶活性有关,该酶能够水解相应的糖苷以释放游离态萜烯。尽管DU PLESSIS 等[29]报道的SP与酿酒酵母的β-葡萄糖苷酶活性均呈阴性,但该研究仅针对一株SP菌株,这并不具有代表性。因为酶的产生不是特定属或种的特征,而是取决于所分析的酵母菌株。此外,萜烯在发酵过程中会经历相互转化,这也可能受到不同酵母菌的影响。未来,针对不同SP菌株的糖苷酶活性和萜烯类物质释放能力值得进一步研究。
香气活性化合物的降低对酿造独特品种特征的葡萄酒具有积极影响,保护品种香不受掩盖。因此,在SP酿酒应用中,若主要目的在于确保或维持最终葡萄酒的香气复杂性,可以考虑与具有更高胞外酶活性以及更高乙酸酯和乙酯产量的酿酒酵母或毕赤克鲁维酵母(Pichia kluyveri)、美极梅奇酵母、东方伊萨酵母等非酿酒酵母结合使用。
2.3 对葡萄酒颜色的影响
颜色强度和稳定性是影响葡萄酒感官品质的关键因素,年轻红葡萄酒的主要呈色物质为花色苷单体及相关衍生物。酵母及细菌等微生物可通过pH改变,生成辅色素或细胞吸附效应对葡萄酒的颜色发挥重要作用。在典型酿酒条件下,pH值通常在3.2~3.8,pH升高,会导致颜色从深红色向蓝色转变[11]。由于SP对苹果酸的大量消耗会在一定程度上造成pH增加。
其次,相对酿酒酵母,SP酵母发酵过程中的甘油-丙酮酸通路更为活跃,直接结果是形成了更多的次级代谢产物,包括乙醛及丙酮酸,这些物质与酒中的花色苷结合形成更稳定的颜色形式——吡喃花青素,对于pH及SO2变化具有较强稳定性和持久性。研究表明,4株SP菌株的丙酮酸产量是酿酒酵母的3~7倍,酒精发酵后颜色强度增加了12.5%~18%[30]。同年其他作者也报道了SP单独发酵的丙酮酸产量为150~350 mg/L,而酿酒酵母少于100 mg/L,这可能是因为丙酮酸作为其特殊的苹果酸乙醇发酵途径的代谢中间体[31]。丙酮酸可以与花青素反应形成高度稳定的Vitisin A色素。SP发酵产生的Vitisin A约为酿酒酵母的2~4倍,取决于SP菌株差异及其丙酮酸代谢。
酵母菌分泌的胞外酶活性也发挥重要作用,特别是β-葡萄糖苷酶和羟基肉桂酸脱羧酶。前者促进花色苷的潜在水解,不利于其颜色稳定性,在许多SP菌株中未检测到或有较弱的活性[11]。后者可以将葡萄汁中的羟基肉桂酸转化为乙烯基酚类物质,进而与单体花青素缩合形成乙烯基酚类吡喃花青素。尽管许多酵母中发现这种活性,但SP被报道为强羟基肉桂酸脱羧酶生产者[31]。此外,SP产生的低于香气阈值的高乙醛水平有助于增加稳定花色素的产量,如Vitisin B及聚合色素[10]。
最后,SP对于红葡萄酒颜色最大的影响在于避免苹乳发酵,因为乳酸菌具有较强的降解和吸附葡萄酒中花青素的活性。BENITO等[32]报道了酒精发酵后颜色更强烈的SP发酵与酿酒酵母之间的颜色强度差异约为10%,当酿酒酵母组进行苹乳发酵后,差异增加到23%。此外,苹乳发酵后飞燕草素-3-O-葡萄糖苷降低约60%,矢车菊素-3-O-葡萄糖苷降低约100%,矮牵牛素-3-O-葡萄糖苷降低约66%,芍药素-3-O-葡萄糖苷降低约75%,锦葵素-3-O-葡萄糖苷降低约66%,再加上苹乳发酵期间乙醛的降解,减少了稳定的复合色素[23]。这种颜色损失效应可能归因于乳酸菌糖苷酶的作用。
2.4 对产多糖的影响
多糖和甘露聚糖蛋白通过增加与葡萄酒结构相关的品质特性来影响葡萄酒的感官感知,改善葡萄酒的酒体和口感,增强蛋白质和酒石酸的稳定性,同时还能够保护葡萄酒中的酚类物质,使其免受氧化。多糖或甘露糖蛋白主要在酒精发酵或酒糟陈酿过程中从酵母释放到培养基中。SP在β-葡聚糖酶和甘露糖苷酶的作用下从细胞壁释放α-半乳糖甘露聚糖和β-葡聚糖,最近,诸多研究证实SP发酵期间释放的多糖含量显著高于酿酒酵母。例如,研究发现所有裂殖酵母菌株释放的多糖含量大约是商业酿酒酵母菌株在相同合成培养基条件下的3~7倍,特别是大量甘露糖蛋白的释放,使得这些酵母在外源多糖制剂的工业生产上展示巨大潜力[18]。此外,BENITO等[15]进一步报道了SP发酵的葡萄酒中水解甘露糖含量比酿酒酵母高2.5倍。这种优势可能与其较厚的细胞壁有关,平均厚度为10~200 nm,其生物聚合体的特殊分子组织可能赋予其足够的结构强度以抵抗高渗透压。值得注意的是,葡萄酒的带酒泥陈酿过程也有助于调节涩味,改善适口性和稳定颜色。因为在细胞自溶期间,酵母菌复杂的细胞壁多糖轮廓,可以快速从细胞壁上释放出来,以及吸附于壁上的花色苷组分[11]。SP酵母自溶物陈酿2个月释放的多糖浓度是酿酒酵母在6~7个月时达到的浓度,这种快速释放可能会为酒庄带来竞争优势[33]。选择适宜的SP菌株可以缩短红酒陈酿的时间,并减少与该技术相关的微生物风险。
2.5 对葡萄酒安全性的影响
SP的代谢特性可以使其成为降低葡萄汁和葡萄酒中某些有害化合物含量的理想生物工具,因为生物胺、氨基甲酸乙酯、葡萄糖酸等物质会破坏葡萄酒感官质量或对人体有害。
过量摄入生物胺会引入诸多健康问题,以组胺和酪胺毒性最强。与传统苹乳发酵相比,SP在酒精发酵期间去除培养基全部的糖及苹果酸,使其不再含有任何可以供乳酸菌定殖或产生物胺的营养基质,从而显著降低生物胺的形成[32]。未来在温暖栽培区被认为是生产不含组胺的葡萄酒的一种有潜力的替代方法,氨基甲酸乙酯是由酵母菌合成尿素或乳酸菌合成瓜氨酸与乙醇化学反应形成,已被列为2A类致癌物。目前的控制策略主要包括:避免苹乳发酵及使用商业脲酶去除尿素前体。3种天然裂殖酵母属菌株被发现具有脲酶活性,催化尿素进一步水解成氨和CO2[10,34]。这也解释了为什么SP发酵酒样的尿素产量仅为0.1 mg/L,而酿酒酵母为3 mg/L,对氨基甲酸乙酯前体降解率最高可达30倍[32]。
葡萄糖酸可能会对葡萄酒的稳定性产生负面影响,乳酸菌等微生物可以将葡萄糖酸代谢为乳酸和挥发酸;葡萄糖酸易结合SO2,并降低其对抑制氧化和不良微生物生长的积极作用。而裂殖酵母属的特定菌株被发现可能具有代谢葡萄汁中大部分葡萄糖酸的能力。
3 外界因素对粟酒裂殖酵母影响葡萄酒品质的调节作用
在葡萄酒发酵过程中,SP通过产生初级和次级代谢产物及酶活性来改善葡萄酒颜色、香气、口感和安全性,值得注意的是,这种调节作用也会受到来自葡萄汁组成、环境压力、发酵条件及其他酿酒措施的强烈影响,进而影响最终的葡萄酒感官品质。
葡萄汁中的氮含量及组成在调控酵母细胞的生长、增殖和产生具有高芳香性的次级代谢物中至关重要。酵母能够以氨基酸和铵的形式吸收并同化氮源[35]。之前的研究发现,SP对氮素的需求较低,因为发酵结束后SP处理组的初级氨基氮含量为20 mg/L,远远高于酿酒酵母对照[30]。之后,作者通过对比6株SP与2株酿酒酵母在发酵结束时的氨基酸谱,进一步证实SP在发酵过程中能释放出更多的氨基酸,这可能在很大程度上与前人报道的SP阳性蛋白酶活性有关[24,29]。然而,发酵结束后苏氨酸、缬氨酸、异亮氨酸和亮氨酸的较高浓度也解释了SP处理的高级醇水平较低,例如,丙醇、异丁醇、2-甲基丁醇和异戊醇,因为它们是通过酵母菌代谢相应的氨基酸前体产生的[24]。未来,SP酵母的氨基酸同化能力及改变不同氮组成对高级醇及乙酸酯形成的影响需要进一步研究。
在发酵期间,酵母同时暴露于多种胁迫条件下(氧化、渗透和乙醇应激等),酵母通常会调节自身的生长和代谢对应激环境做出反应。最近的研究发现,SP在有氧与无氧条件下表现出平行生长趋势,属于兼性厌氧微生物。此外,SP CLI 1085菌株被发现在30%山梨糖醇、8%乙醇及pH=3的应激条件下具有良好的耐受性和生长趋势[36]。然而,与酿酒酵母相比,SP的发酵动力学较慢,需17~20 d完成发酵,在低温下甚至更慢,而在25~30 ℃的较高温度下会缩短发酵时间,在发酵前选择合适的发酵温度至关重要[29]。此外, SP对SO2具有较强耐受性,不仅由于乙醛产量的增加,因为乙醛与SO2结合可以灭活其游离形式的作用,SP发酵带来的pH值上升,也会降低其有效浓度[10]。因此,使用SO2之外的抗氧化剂及抗菌剂十分重要,以避免异味产生和工业规模的污染风险。在这种情况下,在葡萄酒行业开始使用壳聚糖作为SO2的替代品和补充剂来抑制腐败酵母和细菌[37]。虽然有研究表明0.5 g/L壳聚糖不会显著改变SP的活力与发酵性能,但对酒精发酵会有延缓作用,对最终的甘油、乙醛、丙酮酸、高级醇、乙酸酯、脂肪酸及乙酯仍有显著影响[26]。关于壳聚糖的抗菌活性及壳聚糖与葡萄酒成分之间复杂的相互作用还需要进一步了解。
许多研究在优化SP发酵的酿酒技术上取得一定成果,旨在更大程度发挥其应用优势同时避免其不良影响。早在20世纪90年代,研究人员开始使用固定化酵母技术对高酸葡萄汁进行可控的脱酸和酒精发酵,这种技术可以加速发酵进程,适应连续的酿酒过程,有利于解决SP缓慢发酵的问题[38]。目前常见的固定化类型是通过海藻酸钙凝珠捕获酵母细胞,对于这种新工艺的可行性和对葡萄酒品质的改善也在酿酒酵母发酵时得到了验证[39-40],但是在SP中的应用仍然较少,海藻酸钙制作的成本及耗时也是制约其工业化应用的重要因素。最近,一项有前景的新工艺被提出——补料分批发酵技术[41],在发酵过程中将糖浓度保持在较低水平,减少糖诱导的酵母菌的渗透应激,引起酵母菌生理的根本变化,主要表现在乙酸的形成显著减少。该方法能够在糖和苹果酸完全消耗的同时,获得不含醋酸的葡萄酒,并保持较高的甘油水平。当应用于白葡萄酒生产时,可使SP的乙醛产量减少50 %左右,避免了青苹果、青草等不良香气的产生[41]。此外,Mg2+补充剂在促进酵母新陈代谢、细胞分裂和减少乙醇毒性相关的压力方面发挥了重要作用。这对于许多非选择性SP菌株,甚至产生大量乙酸的菌株的进一步应用是有益的,可以大大降低挥发酸浓度,表达积极的感官特征。
4 粟酒裂殖酵母与其他酵母菌混合发酵
SP菌株在冷凉产区用于生物降酸,在温暖产区应用可避免苹乳发酵带来的附加效应,如高pH值的葡萄酒中潜在的高水平的醋酸、生物胺或氨基甲酸乙酯。但是,酸度的大幅下降会使成品酒过于肥腻,糖酸不平衡。耐热克鲁维酵母在酒精发酵期间高产乳酸、低产乙酸的特性,与SP混合接种可弥补其酸度的降低,在一定程度上解决该问题[13]。如表1所示,SP与耐热克鲁维酵母的顺序接种可以完全消耗尖锐的不稳定的苹果酸,降低尿素水平,增加乳酸、丙酮酸、甘油、花色苷、多糖等积极感官贡献的组分。与酿酒酵母单独发酵相比,虽然高级醇、酸、酯类物质有所减少,但某些香气物质,如苯乙醇、萜烯类、大马士酮等明显增加,提高了香气的多样性。因此,将这种技术应用于萜烯品种可能会非常有趣,因为可以显著提高其萜烯类香气。耐热克鲁维酵母的参与也可能促进许多果香酯的合成,如苯甲酸乙酯、乙酸苯乙酯、甲酸庚酯、水杨酸甲酯、月桂酸乙酯等,这些酯类在酿酒酵母发酵时并不常见[42]。此外,二者混合发酵也被报道具有更高的颜色强度,除SP的特定贡献外,乳酸形成引起的pH下降也有助于稳定颜色,花青素含量的增加主要与避免了苹乳发酵有关[43]。因此,SP与耐热克鲁维酵母的联合使用是一种非常有潜力的新型生物技术,有利于应对消费者的多样化需求并降低生产成本。
表1 不同粟酒裂殖酵母菌株与其他酵母菌在酿酒中混合发酵的应用现状
Table 1 Current progress of the application of mixed fermentation of different S. pombe strains with other yeasts in winemaking

酵母菌株接种方案品种对化学和感官特征影响参考文献粟酒裂殖酵母V2,耐热克鲁维酵母顺序接种(4 d)丹魄增加了丙酮酸、甘油、花色苷及Vitisin A;降低了乙醇、尿素,最高的整体印象评分。[43]粟酒裂殖酵母V2,耐热克鲁维酵母顺序接种(3 d)丹魄增加了葡萄酒中含有甘露糖的多糖;有助于实现葡萄酒结构和酸度之间的理想平衡。[15]粟酒裂殖酵母Atecrem 12H,耐热克鲁维酵母顺序接种(5 d)丹魄降低了乙醇、苹果酸和琥珀酸的最终浓度;增加了乳酸和酯类的浓度。[5]粟酒裂殖酵母SP-70,耐热克鲁维酵母顺序接种(4 d)美乐降低挥发酸、酯类、高级醇的浓度;增加总酸、苯乙醇、萜烯类、大马士酮,改善了葡萄酒的色泽和酸度,明显的花果香气。[42]
续表1

酵母菌株接种方案品种对化学和感官特征影响参考文献粟酒裂殖酵母SP1260/酿酒酵母同时接种(10∶1、100∶1、1 000∶1、10 000∶1)黑比诺增加了色度值、总花色苷含量;降低了高级醇、脂肪酸含量;提高了乙酸异戊酯、辛酸甲酯、癸酸乙酯和丁香酚浓度。[44]粟酒裂殖酵母,酿酒酵母顺序接种(6、8、10、12 d)黑比诺己酸乙酯、辛酸乙酯、癸酸乙酯、苯乙醇和香茅醇等香气物质的含量明显增加。[45]粟酒裂殖酵母S17,戴尔有孢圆酵母同时接种(1∶1);顺序接种(4 d)赤霞珠桃红增加了花色苷和丙酮酸含量;降低了挥发酸、苹果酸含量;增加了酯类、柠檬烯、金合欢醇和苯乙醛等;改善了色泽和香气。[46]
注:粟酒裂殖酵母,菌株V2:预商业化,保存于西班牙马德里理工大学化学和食品技术系;菌株Atecrem 12H:来自意大利奥德尔佐Bioenologia 2.0公司;菌株SP-70:保藏在北京北欧博伟生物技术有限公司;菌株SP1260:甘肃省葡萄与葡萄酒工程学重点实验室鉴定并保藏;菌株S17:保藏在西北农林科技大学葡萄酒学院。
除耐热克鲁维酵母外,赵美等[44]对SP与酿酒酵母混合发酵提高黑比诺干红葡萄酒品质进行了研究,发现二者在1 000∶1的接种比例同时接种时,可以显著改善葡萄酒颜色,增加更为丰富浓郁的花果香气。而在顺序接种时,间隔8 d接种酿酒酵母能够形成更为复杂的香气,与酿酒酵母对照相比,乙酯类和萜烯类物质显著增加,极大地弥补了SP酵母在发酵香气上的不足[45]。戴尔有孢圆酵母,具有增强葡萄酒的果香和玫瑰香,减少挥发酸含量的理想酿酒学特征,具有对SP不良特征发酵工艺优化的潜力。董超等[46]利用本土SP和戴尔有孢圆酵母混合酿造赤霞珠桃红葡萄酒,结果表明,不同混酿方式均可以增加颜色的稳定性,甘油和酒体的柔顺度,以及酯类、高级醇类物质的含量,特别是共同接种发酵,表现为最低的挥发酸(0.29 g/L)和苹果酸(0.62 g/L)含量,以及最高的酯类物质水平(21 525.6 μg/L)。因此,混合接种可以用于弥补单一SP菌株发酵的某些缺陷,实现增香、增酸、降低挥发酸和降醇的目标,是提升葡萄酒品质和风味多样性的理想工艺。
值得注意的是,混合发酵中的各种酵母菌并不是被动共存的, 而是会不断发生正、负或中性相互作用,并产生特殊的目标代谢产物, 从而影响葡萄酒的化学组成及感官特征。在混合发酵过程中,酵母菌株的优势会受到营养竞争,细胞直接接触及乙醇等抗菌化合物的综合影响,改变其代谢活性和存活时间,以及对发酵结果的贡献[47]。例如,在SP与耐热克鲁维酵母顺序发酵过程中,当接种SP之后,主导的耐热克鲁维酵母就开始迅速下降并逐渐消失。乳酸通常是在发酵的第一阶段产生的,此时耐热克鲁维酵母具有较高活性,因此可以延长SP的接种时间来调节乳酸的产生[48-49]。这两种酵母之间还可能存在良性协同效应,增强葡萄酒的分析成分和香气特征。这不仅体现在乙酸、高级醇含量的下降,还体现在乳酸及乳酸乙酯、苯乙醇、萜烯类物质的显著增加,提升了香气复杂性。耐热克鲁维酵母对花青素的低吸附能力还可以辅助增加颜色强度[6]。尽管这些研究所使用的耐热克鲁维酵母不同,但大多数菌株在增酸、增甘油、降乙酸的能力是一致的,在增香、增色方面也具有较大潜力。
与酿酒酵母相比,SP展现出独特的氮代谢特性,主要表现在其氮源需求较低,却能释放较多的氮。二者在葡萄酒中共存时,这些氮源可以作为营养,刺激酿酒酵母菌株的生长。酿酒酵母的参与可以缩短发酵时间,避免不必要的污染。因此,SP与酿酒酵母的混菌发酵应用愈加广泛,其中不同接种方式的选择是研究人员较为关注的问题。同时接种时,SP在整个发酵阶段定殖,随着SP1260接种比例的增加,发酵时间延长,对苹果酸的降解幅度,对酒样颜色强度、酯类和萜烯类提升性能越强。当接种比例为1 000∶1时,葡萄酒的感官评价最高[44]。然而,当接种比例相差过大,菌株间可能会发生拮抗作用,抑制酿酒酵母生长及对葡萄酒香气的贡献。在延迟接种方面,由于发挥作用时间较长,SP对酒样的影响更为显著。但是过长的时间间隔,在苹果酸去除的同时也会引入SP发酵的缺陷,包括挥发酸增加,酯类减少[45]。合适的接种时间有利于促进酵母间发生积极的代谢相互作用,调节酿酒学上感兴趣的代谢物。戴尔有孢圆酵母在降低挥发酸含量、提升最终芳香特性的显著优势使其成为SP的另一个潜在伴侣,二者不同特性的融合有望对葡萄酒品质产生积极影响,但混菌发酵的可行性还应在不同品种和发酵条件下进一步的研究与验证。因此,在葡萄酒发酵生态系统中,代谢物的适当表达及理想的感官效果,离不开每种菌种或菌株的特定贡献,了解SP与不同酵母菌株之间复杂的相互作用对选择具有良好相容性的菌株组合和适当的接种策略也至关重要。
5 结论和展望
裂殖酵母属为现代酿酒挑战提供了解决方案,不仅可解决冷凉产区酸度过高的问题,还可以避免温暖葡萄产区高糖水平和高pH值的葡萄汁中进行苹果酸乳酸发酵的相关的品质与健康风险。SP代谢苹果酸,避免苹乳发酵,提升了成品酒的微生物稳定性及降低生物胺、氨基甲酸乙酯前体,稳定色素及多糖的形成,对葡萄酒颜色及口感具有积极影响,减少与苹乳发酵相关的食品安全问题。混菌发酵工艺也为改善SP的高挥发酸和不良风味的问题提供了较好的应用前景。未来,在SP工业应用时应注意以下几点:(a)菌株特异性。不同SP菌株降解苹果酸能力相当,但产酸和产香特性存在差异,特别是乙酸的高产,因此在较大规模酿酒前应进行预实验评估其发酵和酿造性能。(b)与其他菌种(酿酒酵母与非酿酒酵母)相容性。控制合适接种方式使SP菌株最大程度消耗苹果酸,降低有害前体,结合增酸或者低产乙酸的酵母可以实现酸度的良好平衡。了解SP与其他酵母菌株之间复杂的相互作用,实施有利于发酵剂存在和优势的酿酒条件对塑造最终葡萄酒特征品质,促进工业化应用十分重要。(c)需进一步增强SP的产香性能。SP属于缓慢发酵酵母,发酵时可能会造成非典型的香气和果香的损失。优化多菌发酵工艺是有效改进方式,特别是三菌发酵工艺:引入酿酒酵母与一株产香特性突出非酿酒酵母。此外,新型工艺,固定化技术、补料分批发酵技术及补充Mg2+作为可能的降低乙酸和其他异味方法需要在中试或工业规模验证。未来,还需要进一步阐明SP在单菌及多菌发酵时的分子基础和代谢特征,从而更好地控制和发挥其酿造优势,以适应不同区域、不同品种、不同风格和不同消费需求的葡萄酒生产。
[1] BENITO  , CALDER
, CALDER N F, BENITO S.The influence of non-Saccharomyces species on wine fermentation quality parameters[J].Fermentation, 2019, 5(3):54.
N F, BENITO S.The influence of non-Saccharomyces species on wine fermentation quality parameters[J].Fermentation, 2019, 5(3):54.
[2] 战吉宬, 曹梦竹, 游义琳, 等.非酿酒酵母在葡萄酒酿造中的应用[J].中国农业科学, 2020, 53(19):4057-4069.
ZHAN J C, CAO M Z, YOU Y L, et al.Research advance on the application of non-Saccharomyces in winemaking[J].Scientia Agricultura Sinica, 2020, 53(19):4057-4069.
[3] MORATA A, ESCOTT C, BA UELOS M, et al.Contribution of non-Saccharomyces yeasts to wine freshness.A review[J].Biomolecules, 2019, 10(1):34.
UELOS M, et al.Contribution of non-Saccharomyces yeasts to wine freshness.A review[J].Biomolecules, 2019, 10(1):34.
[4] VEJARANO R, GIL-CALDER N A.Commercially available non-Saccharomyces yeasts for winemaking:Current market, advantages over Saccharomyces, biocompatibility, and safety[J].Fermentation, 2021, 7(3):171.
N A.Commercially available non-Saccharomyces yeasts for winemaking:Current market, advantages over Saccharomyces, biocompatibility, and safety[J].Fermentation, 2021, 7(3):171.
[5] VICENTE J, KELANNE N, NAVASCUÉS E, et al.Combined use of Schizosaccharomyces pombe and a Lachancea thermotolerans strain with a high malic acid consumption ability for wine production[J].Fermentation, 2023, 9(2):165.
[6] ESCOTT C, MORATA A, RICARDO-DA-SILVA J M, et al.Effect of Lachancea thermotolerans on the formation of polymeric pigments during sequential fermentation with Schizosaccharosmyces pombe and Saccharomyces cerevisiae[J].Molecules, 2018, 23(9):2353.
[7] LIU S X, LAAKSONEN O, KORTESNIEMI M, et al.Chemical composition of bilberry wine fermented with non-Saccharomyces yeasts (Torulaspora delbrueckii and Schizosaccharomyces pombe) and Saccharomyces cerevisiae in pure, sequential and mixed fermentations[J].Food Chemistry, 2018, 266:262-274.
[8] CHEN K, ESCOTT C, LOIRA I, et al.Use of non-Saccharomyces yeasts and oenological tannin in red winemaking:Influence on colour, aroma and sensorial properties of young wines[J].Food Microbiology, 2018, 69:51-63.
[9] 李福荣, 吕晓彤, 闫昕, 等.优选适于发酵玫瑰香葡萄酒的粟酒裂殖酵母[J].食品研究与开发, 2022, 43(15):201-208.
LI F R, LÜ X T, YAN X, et al.Selection of a Schizosaccharomyces pombe strain suitable for Muscat wine fermentation[J].Food Research and Development, 2022, 43(15):201-208.
[10] BENITO S.The impacts of Schizosaccharomyces on winemaking[J].Applied Microbiology and Biotechnology, 2019, 103(11):4291-4312.
[11] LOIRA I, MORATA A, PALOMERO F, et al.Schizosaccharomyces pombe:A promising biotechnology for modulating wine composition[J].Fermentation, 2018, 4(3):70.
[12] BENITO  , CALDER
, CALDER N F, BENITO S.Schizosaccharomyces pombe isolation protocol[M].Methods in Molecular Biology.New York, NY:Springer New York, 2018:227-234.
N F, BENITO S.Schizosaccharomyces pombe isolation protocol[M].Methods in Molecular Biology.New York, NY:Springer New York, 2018:227-234.
[13] 唐冲, 成池芳, 许引虎, 等.耐热克鲁维酵母在葡萄酒发酵中的研究和应用进展[J].食品科学, 2023, 44(3):323-331.
TANG C, CHENG C F, XU Y H, et al.Progress in research and application of Lachancea thermotolerans in wine fermentation[J].Food Science, 2023, 44(3):323-331.
[14] BENITO S, PALOMERO F, MORATA A, et al.Physiological features of Schizosaccharomyces pombe of interest in making of white wines[J].European Food Research and Technology, 2013, 236(1):29-36.
[15] BENITO  , CALDER
, CALDER N F, BENITO S.Mixed alcoholic fermentation of Schizosaccharomyces pombe and Lachancea thermotolerans and its influence on mannose-containing polysaccharides wine composition[J].AMB Express, 2019, 9(1):17.
N F, BENITO S.Mixed alcoholic fermentation of Schizosaccharomyces pombe and Lachancea thermotolerans and its influence on mannose-containing polysaccharides wine composition[J].AMB Express, 2019, 9(1):17.
[16] 高娉娉, 温华婷, 赵美, 等.粟酒裂殖酵母接种方式对黑比诺干红葡萄酒品质的影响[J].浙江农业学报, 2021, 33(12):2397-2405.
GAO P P, WEN H T, ZHAO M, et al.Effect of inoculation of Schizosaccharomyces pombe on quality of Pinot Noir dry red wine[J].Acta Agriculturae Zhejiangensis, 2021, 33(12):2397-2405.
[17] HU C K, BAI F W, AN L J.Enhancing ethanol tolerance of a self-flocculating fusant of Schizosaccharomyces pombe and Saccharomyces cerevisiae by Mg2+ via reduction in plasma membrane permeability[J].Biotechnology Letters, 2003, 25(14):1191-1194.
[18] DOMIZIO P, LIU Y, BISSON L F, et al.Cell wall polysaccharides released during the alcoholic fermentation by Schizosaccharomyces pombe and S.japonicus:Quantification and characterization[J].Food Microbiology, 2017, 61:136-149.
[19] DEL FRESNO J M, MORATA A, LOIRA I, et al.Use of non-Saccharomyces in single-culture, mixed and sequential fermentation to improve red wine quality[J].European Food Research and Technology, 2017, 243(12):2175-2185.
[20] SU REZ-LEPE J A, PALOMERO F, BENITO S, et al.Oenological versatility of Schizosaccharomyces spp[J].European Food Research and Technology, 2012, 235(3):375-383.
REZ-LEPE J A, PALOMERO F, BENITO S, et al.Oenological versatility of Schizosaccharomyces spp[J].European Food Research and Technology, 2012, 235(3):375-383.
[21] GARDONI E, BENITO S, SCANSANI S, et al.Biological deacidification strategies for white wines[J].South African Journal of Enology and Viticulture, 2021, 42(2):114-122.
[22] 董琦楠, 李莹, 叶冬青, 等.耐热克鲁维酵母在葡萄酒酿造中的研究进展[J].微生物学通报, 2022, 49(5):1941-1954.
DONG Q N, LI Y, YE D Q, et al.Research progress of Lachancea thermotolerans in winemaking[J].Microbiology China, 2022, 49(5):1941-1954.
[23] MYLONA A E, DEL FRESNO J M, PALOMERO F, et al.Use of Schizosaccharomyces strains for wine fermentation—Effect on the wine composition and food safety[J].International Journal of Food Microbiology, 2016, 232:63-72.
[24] BENITO  , JEFFARES D, PALOMERO F, et al.Selected Schizosaccharomyces pombe strains have characteristics that are beneficial for winemaking[J].PLoS One, 2016, 11(3):e0151102.
, JEFFARES D, PALOMERO F, et al.Selected Schizosaccharomyces pombe strains have characteristics that are beneficial for winemaking[J].PLoS One, 2016, 11(3):e0151102.
[25] BENITO S, PALOMERO F, CALDER N F, et al.Selection of appropriate Schizosaccharomyces strains for winemaking[J].Food Microbiology, 2014, 42:218-224.
N F, et al.Selection of appropriate Schizosaccharomyces strains for winemaking[J].Food Microbiology, 2014, 42:218-224.
[26] SCANSANI S, RAUHUT D, BREZINA S, et al.The impact of chitosan on the chemical composition of wines fermented with Schizosaccharomyces pombe and Saccharomyces cerevisiae[J].Foods, 2020, 9(10):1423.
[27] SAN-JUAN F, FERREIRA V, CACHO J, et al.Quality and aromatic sensory descriptors (mainly fresh and dry fruit character) of Spanish red wines can be predicted from their aroma-active chemical composition[J].Journal of Agricultural and Food Chemistry, 2011, 59(14):7916-7924.
[28] DELA SALOPEK D, HORVAT I, HRANILOVI
SALOPEK D, HORVAT I, HRANILOVI A, et al.Diversity of volatile aroma compound composition produced by non- Saccharomyces yeasts in the early phase of grape must fermentation[J].Foods, 2022, 11(19):3088.
A, et al.Diversity of volatile aroma compound composition produced by non- Saccharomyces yeasts in the early phase of grape must fermentation[J].Foods, 2022, 11(19):3088.
[29] DU PLESSIS H W, DU TOIT M, HOFF J W, et al.Characterization of non-Saccharomyces yeasts using different methodologies and evaluation of their compatibility with malolactic fermentation[J].South African Journal of Enology &Viticulture, 2017, 38(2):46-63.
[30] BENITO S, PALOMERO F, MORATA A, et al.New applications for Schizosaccharomyces pombe in the alcoholic fermentation of red wines[J].International Journal of Food Science &Technology, 2012, 47(10):2101-2108.
[31] MORATA A, BENITO S, LOIRA I, et al.Formation of pyranoanthocyanins by Schizosaccharomyces pombe during the fermentation of red must[J].International Journal of Food Microbiology, 2012, 159(1):47-53.
[32] BENITO  , CALDER
, CALDER N F, PALOMERO F, et al.Combine use of selected Schizosaccharomyces pombe and Lachancea thermotolerans yeast strains as an alternative to the traditional malolactic fermentation in red wine production[J].Molecules, 2015, 20(6):9510-9523.
N F, PALOMERO F, et al.Combine use of selected Schizosaccharomyces pombe and Lachancea thermotolerans yeast strains as an alternative to the traditional malolactic fermentation in red wine production[J].Molecules, 2015, 20(6):9510-9523.
[33] PALOMERO F, MORATA A, BENITO S, et al.New Genera of yeasts for over-lees aging of red wine[J].Food Chemistry, 2009, 112(2):432-441.
[34] LUBBERS M W, RODRIGUEZ S B, HONEY N K, et al.Purification and characterization of urease from Schizosaccharomyces pombe[J].Canadian Journal of Microbiology, 1996, 42(2):132-140.
[35] ROMANO P, BRASCHI G, SIESTO G, et al.Role of yeasts on the sensory component of wines[J].Foods, 2022, 11(13):1921.
[36] GARC A M, CRESPO J, CABELLOS J M, et al.Growth of non-Saccharomyces native strains under different fermentative stress conditions[J].Fermentation, 2021, 7(3):124.
A M, CRESPO J, CABELLOS J M, et al.Growth of non-Saccharomyces native strains under different fermentative stress conditions[J].Fermentation, 2021, 7(3):124.
[37] BA DER ELMACI S, GÜLGÖR G, TOKATLI M, et al.Effectiveness of chitosan against wine-related microorganisms[J].Antonie Van Leeuwenhoek, 2015, 107(3):675-686.
DER ELMACI S, GÜLGÖR G, TOKATLI M, et al.Effectiveness of chitosan against wine-related microorganisms[J].Antonie Van Leeuwenhoek, 2015, 107(3):675-686.
[38] YOKOTSUKA K, OTAKI A, NAITOH A, et al.Controlled simultaneous deacidification and alcohol fermentation of a high-acid grape must using two immobilized yeasts, Schizosaccharomyces pombe and Saccharomyces cerevisiae[J].American Journal of Enology and Viticulture, 1993, 44(4):371-377.
[39] GENISHEVA Z, TEIXEIRA J A, OLIVEIRA J M.Immobilized cell systems for batch and continuous winemaking[J].Trends in Food Science &Technology, 2014, 40(1):33-47.
[40] COSTA G, NICOLLI K, WELKE J, et al.Volatile profile of sparkling wines produced with the addition of mannoproteins or lees before second fermentation performed with free and immobilized yeasts[J].Journal of the Brazilian Chemical Society, 2018, 29:1866-1875.
[41] ROCA-DOM NECH G, CORDERO-OTERO R, ROZ
NECH G, CORDERO-OTERO R, ROZ S N, et al.Metabolism of Schizosaccharomyces pombe under reduced osmotic stress conditions afforded by fed-batch alcoholic fermentation of white grape must[J].Food Research International, 2018, 113:401-406.
S N, et al.Metabolism of Schizosaccharomyces pombe under reduced osmotic stress conditions afforded by fed-batch alcoholic fermentation of white grape must[J].Food Research International, 2018, 113:401-406.
[42] 王玉华, 盛文军, 李敏, 等.耐热克鲁维酵母和粟酒裂殖酵母顺序接种发酵对美乐干红葡萄酒品质的影响[J].食品科学, 2019, 40(8):102-111.
WANG Y H, SHENG W J, LI M, et al.Effect of sequential fermentation with Lachancea thermotolerans and Schizosaccharomyces pombe on the quality of merlot dry red wine[J].Food Science, 2019, 40(8):102-111.
[43] BENITO  , CALDER
, CALDER N F, BENITO S.The combined use of Schizosaccharomyces pombe and Lachancea thermotolerans-Effect on the anthocyanin wine composition[J].Molecules, 2017, 22(5):739.
N F, BENITO S.The combined use of Schizosaccharomyces pombe and Lachancea thermotolerans-Effect on the anthocyanin wine composition[J].Molecules, 2017, 22(5):739.
[44] 赵美, 田秀, 李敏, 等.粟酒裂殖酵母与酿酒酵母共同接种发酵对‘黑比诺’干红葡萄酒品质的影响[J].食品科学, 2021, 42(24):108-116.
ZHAO M, TIAN X, LI M, et al.Effect of mixed culture fermentation with Schizosaccharomyces pombe and Saccharomyces cerevisiae on the quality of ‘pinot noir’ dry red wine[J].Food Science, 2021, 42(24):108-116.
[45] 王婧, 高娉娉, 田秀, 等.粟酒裂殖酵母与酿酒酵母顺序接种发酵对干红葡萄酒品质的影响[J].食品与发酵工业, 2021, 47(9):84-90.
WANG J, GAO P P, TIAN X, et al.The effects of sequential inoculation fermentation of Schizosaccharomyces pombe and Saccharomyces cerevisiae on the quality of dry red wine[J].Food and Fermentation Industries, 2021, 47(9):84-90.
[46] 董超, 黄蓉, 姜娇, 等.粟酒裂殖酵母和戴尔有孢圆酵母混合发酵对赤霞珠桃红葡萄酒品质的影响[J].中国食品学报, 2023, 23(3):206-216.
DONG C, HUANG R, JIANG J, et al.Influence of mixed fermentation with schizosaccharomce spombe and Torulaspora delbrueckii on the quality of cabernet sauvignon rosé wine[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(3):206-216.
[47] ENGLEZOS V, JOLLY N P, DI GIANVITO P, et al.Microbial interactions in winemaking:Ecological aspects and effect on wine quality[J].Trends in Food Science &Technology, 2022, 127:99-113.
[48] 梁丽红, 高娉娉, 张馨文, 等.优选本土非酿酒酵母混合发酵在干红葡萄酒中的应用潜力分析[J].食品与发酵工业, 2022, 48(14):118-124;130.
LIANG L H, GAO P P, ZHANG X W, et al.Potential application of mixed fermentation of superior indigenous non-Saccharomyces cerevisiae on dry red wine[J].Food and Fermentation Industries, 2022, 48(14):118-124;130.
[49] BENITO S.Combined use of Lachancea thermotolerans and Schizosaccharomyces pombe in winemaking:A review[J].Microorganisms, 2020, 8(5):655.