水产品即渔业和水产养殖产品,指用于消费或国内外贸易的渔业和水产养殖生产的产品,常包括水生动物(鱼、甲壳动物、软体动物和其他水生动物)、藻类(大型藻类、微藻和蓝绿藻)以及其他水产品(如:珊瑚和海绵)。水产品种类丰富,味道鲜美,并具有低脂肪、高蛋白、营养平衡性好的特点,常按照不同物种、保存方法和产品形式加工成具有各种各样特性和风味的水产食品以供人食用[1]。在产品的自身代谢以及加工过程中,会产生一系列称为代谢物的中间产物或最终产物,包括分子质量<1 000 Da的内源性小分子代谢物,如糖、脂肪酸、氨基酸、核苷酸以及相关衍生物等[2]。这些小分子代谢物在食品品质方面起着核心作用,它们通过对食品的感官属性以及营养价值产生影响,从而直接或间接地决定了消费者对食品的接受程度。经过几十年的发展,食品分析的原理和技术日趋完善,小分子化合物的分析检测方法日益成熟,现有常见的食品分析检测方法如光谱法、色谱法、质谱法、色质联用技术以及核磁共振波谱技术,可以对某类特定代谢物进行定性定量检测。通过选取合适的分析手段获得水产品整体的代谢图谱可以方便对食品特性进行研究。现已运用到食品的掺假分析、品种鉴定、药残检测、营养改善、风味把控和品质变化规律等方向的探究。在现有的水产小分子代谢物分析中,基于不同的研究方向和目的,研究者们所使用的分析方法也不尽相同。本文基于水产品分析方法的种类,技术特点以及优缺点,尝试对水产品中小分子代谢物的分析进行总结汇总,以期为研究者们根据分析物特点以及分析目的,选择适用的分析方法起到一定的参考作用。
1 分析方法研究进展
1.1 光谱法
光谱技术无需复杂的样品制备过程,具有便携性和环境友好性,但是小分子化合物的种类众多,光谱技术的原始数据处理较为困难,无法对一系列代谢物进行灵敏的鉴别。所以光谱技术常常应用在非靶向代谢物的分析。光谱法可根据物质与光谱的相互作用类型主要分为两大类:吸收光谱和发射光谱。
吸收光谱法可分为紫外吸收-可见光谱和红外吸收光谱。紫外-可见吸收光谱比较简单,特征性不强,并且大多数简单官能团在近紫外光区只有微弱吸收或者无吸收,因此该方法的应用有一定的局限性,目前在小分子代谢物分析中多作为检测器结合液相色谱实现分离鉴定。
红外光谱可以针对特定化合物的基团进行检测如蛋白质成分与—NH基团有关、水分含量与—OH相对应、脂肪结构可能与亚甲基、—CH、—CH2和—CH3基团有关[3],对应波长见表1。BROWN等[4]应用可见光近红外光谱揭示了养殖大西洋鲑鱼(Salmo salar)的虾青素和脂肪含量。傅里叶变化红外技术(Fourier transform infrared spectroscopy, FTIR)可以在短时间内以低成本检测少量样品的光谱特征。VOLPE等[5]利用FTIR的优势,成功验证了喂养添加多酚的饲料所引起的小龙虾肝胰腺中代谢物的变化。拉曼光谱(Raman spectroscopy, RS)作为红外光谱技术的补充,降低了水的存在造成的图像干扰,适用于分析水分含量高的食品,此外RS产生的蛋白质和脂肪之间重叠光谱带程度较低,在脂肪酸和脂溶性维生素分析例如在二十碳五烯酸(eicosapentaenoic acid, EPA)和二十二碳六烯酸(docosahexaenoic acid, DHA)以及类胡萝卜素方面具有比较大的优势。振动光谱技术还非常适合用于研发便携式或手持仪器。KILLEEN等[6]首次使用便携式拉曼光谱仪在避免鱼油胶囊氧化的同时定量了其中的ω-3脂肪酸。由于拉曼散射约占总散射的0.001%,信号强度非常微弱,研究者们开发使用某些贵金属纳米材料来增强信号强度,这项技术改进被称为表面增强拉曼光谱(surface-enhanced RS, SERS),该技术在抑制荧光产生的同时提供增强的拉曼信号,从而降低了检测限。该方法现多用于检测水产品中残留的毒害性有机化合物如孔雀石绿、亚甲基蓝、结晶紫等[7]。
表1 水产品成分及对应基团的近红外吸收波长
Table 1 Near-infrared absorption wavelengths of aquatic product components and corresponding groups
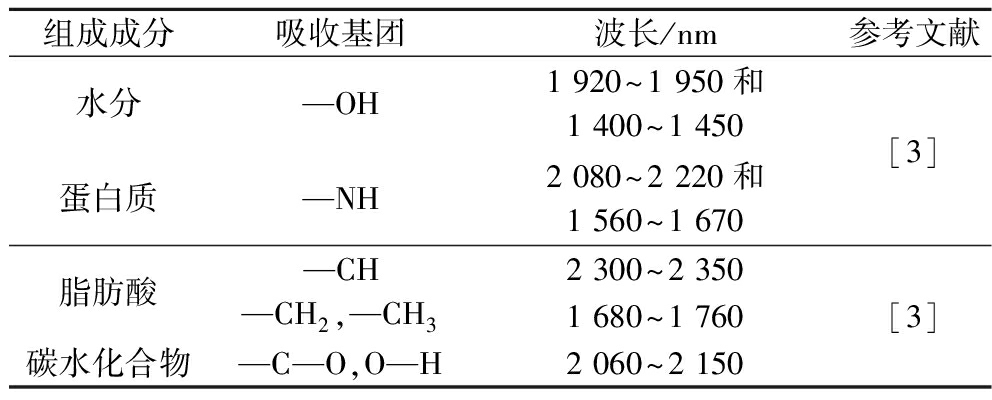
组成成分吸收基团波长/nm参考文献水分—OH1 920~1 950和1 400~1 450蛋白质—NH2 080~2 220和1 560~1 670[3]脂肪酸碳水化合物—CH2 300~2 350—CH2,—CH31 680~1 760—C—O,O—H2 060~2 150[3]
发射光谱可以进一步分为荧光光谱、磷光光谱和原子发射光谱。其中荧光光谱在小分子代谢物检测中最为常见。水产品可视做复杂的多荧光系统,包含几类具有共轭双键的分子,例如芳香族氨基酸、核酸、NADH、泛酸、核黄素和其氧化产物等[8]。LIN等[9]将三聚氰胺、氯化钾和氯化钠混合煅烧后,得到了在420 nm具有具有强荧光和良好分散性的g-C3N4,利用组织胺能够选择性地猝灭荧光的特性,实现了鱼肉中组胺的快速检测。LIU等[10]设计了一种高选择性和灵敏度的荧光探针,用简洁的荧光信号检测鉴别H2S、Cys、Hcy和GSH,实现了它们在细胞和斑马鱼中的可视化区分。
1.2 色谱法
水产品内源性小分子代谢物通常处于一个复杂的混合体系中,一些化合物之间的性质相近,因此需要一种有效的分离手段来鉴定某种(类)化合物。色谱是一种最重要的物理化学分离方法,它能够分离性质相近的复杂化合物,尤其适合小分子代谢物。色谱法按照其流动相的状态可以分为气相色谱、液相色谱和超临界二氧化碳色谱(supercritical fluid chromatography, SFC)。
气相色谱多基于化合物自身的沸点、分子大小和极性等性质分离混合物中的热稳定挥发性组分。气相色谱的检测器大致可以分为热传导检测器(thermal conductivity detector, TCD)、氢火焰离子化检测器(flame ionization detector, FID)、火焰光度检测器(flame photometric detector, FPD)和氮磷检测器(nitrogen phosphorus detector, NPD)。FID对含碳的有机物具有很高的灵敏度,一般来说要比TCD高几个数量级,GC-FID是鉴定和定量食品中脂肪酸的最常用的技术。MAHMOUD等[11]使用GC-FID进行对于养殖和野生的鳟鱼(Oncorhynchus mykiss)进行脂肪酸分析,结合嗅辨仪(gas chromatography olfactometry,GC-O)、碳浓度和同位素分析将结果与鱼类来源的原核和真核微生物特征相关联,结果表明养殖鳟鱼具有更高的营养价值,而野生鳟鱼具有更加丰富的香味。KUMAR等[12]使用GC-FID对黑边魟(Himantura marginata)的肝脏提取物进行脂肪酸分析,鉴定出了了22种不同类型的脂肪酸。FPD和NPD擅长特异性检验如硫、磷等官能团的检测器,相关文献多集中检测有机污染元素(如磷,硫等)在水产品体内的残留[13]。
液相色谱的检测器大致可以分为紫外检测器(ultraviolet detector, UV)、二极管阵列检测器(diode array ultraviolet-visible detector, DAD)和荧光检测器(fluorescence detector, FD)以及蒸发光散射检测器(evaporative light scattering detector, ELSD)等。UV是目前使用最普遍的检测器,韩迎雪等[14]采用高效液相色谱-紫外检测器(HPLC-UV)检测了虾肉糜中的核苷酸及其关联产物含量,分析了鲜味氨基酸和呈味核苷酸之间的协同作用。此外一些检测器的应用也被用于与其他方法相比较。YU等[15]开发并验证了一种将HPLC与蒸发光散射检测器(HPLC-ELSD)相结合的方法,与核磁共振磷谱(31P NMR)相比较,用于鲸油中的磷脂分析。该方法中磷脂的检测结果31P NMR光谱学的结果相一致。
超临界流体色谱使用超临界流体(常为CO2)作为流动相,超临界流体的高扩散性和低黏度可以减少分析时间和提高分辨率[16]。相对于其他技术如HPLC、毛细管电泳、离子色谱等,使用非传统的超临界流体色谱方法分离这些化合物还是未被广泛应用。目前常见的SFC在水产品小分子中的应用集中在脂肪酸和脂溶性维生素[17-18]。SFC也正在用于多维小分子代谢物分离方法研究,FRANÇOIS等[18]使用银离子SFC和反相液相色谱(reverse phase-liquid chromatography, RP-LC)进行二维综合分析来分离鱼油提取物中脂肪酸的苯乙酰酯。
1.3 质谱法
质谱通过分析目标化合物的质荷比以及特定离子裂解信息来定性和定量化合物,是一种强有力的分析手段。SHEN等[19]通过将鲈鱼、草鱼和鲫鱼中总脂质提取物不经过色谱分离直接注入到串联质谱中进行了分析,鉴定出至少81种磷脂分子。质谱还常与实时直接分析(direct analysis in real time, DART),基质辅助激光解吸电离(matrix-assisted laser desorption/ionization, MALDI),电烙铁电离(electric soldering iron ionization, ESII)法等快速电离技术串联以达到来实现分离鉴定的目的。NEI等[20]使用DART-MS作为一种快速筛选方法,测定了鱼片中的组胺浓度。CAJKA等[21]使用水和环己烷混合物作为提取溶剂,分离出了鲤鱼肌肉中的代谢物,并通过DART-TOF-MS进行了快速检测。BI等[22]通过基质辅助激光解吸电离质谱(MALDI-MS)建立了3种鲀鱼汤的代谢物图谱,找出了其中的独特化合物。需要注意的是MALDI-MS通常需要引入有机基质来辅助目标分析物的电离,这在低分子质量区域(<800 Da)产生了严重的信号干扰。因此,其适合在DNA、蛋白质和多肽等大分子的检测[23]。对小分子化合物的衍生化可以有效地避免这种情况的出现。QIN等[23]合成了一种N-羟基琥珀酰亚胺功能化的C60,并用作衍生化试剂来标记氨基硫醇。这种策略将一个880 Da的标签添加到氨基酸上,将氨基酸信号移动到高质量区域,并有效地避免了传统MALDI基质在800 Da以下产生的信号干扰。
1.4 色质联用法
由于小分子化合物种类多、难以分离的特点,使用单一技术手段难以直接定性和定量,色谱-质谱联用技术结合色谱和质谱的优点可以聚焦于非靶向分析,同时检测许多未知物,还可以指定某些靶向化合物,研究这些化合物的代谢谱[24]。色质联用总体可以分为气质联用、液质联用以及毛细管电泳串联质谱法(capillary electrophoresis-mass spectrometry, CE-MS)。
1.4.1 气质联用
由于风味小分子化合物多为烃、醛、酮、酸、呋喃、酚以及一些芳香类挥发性化合物。不同的化合物的感受阈值不同,许多需要痕量分析。气质联用分析常常作为获得食品风味化合物指纹图的工具。LIANG等[25]使用固态微萃取结合气质联用技术(SPME-GC-MS)测定了鱼糜凝胶和鱼糜/蟹肉混合凝胶的风味特征,共检测到挥发性化合物50种,其中烃类16种、醇类10种、酮类2种、醛类11种、酯类2种、酸类5种、杂环类4种。离子迁移谱(ion mobility spectrometry, IMS)检出限低,不要求样品的预处理、能够进行二次分离,直观地显示结果的特点,适合作为风味变化的可视化检测工具,提供大量样本的分析信息[26-27]。QIU等[28]使用GC-IMS调查了传统发酵过程中金鲳鱼的微生物群落和挥发性风味化合物,检测到35种挥发性化合物,结果表明随着发酵的进行,醇和酯含量逐渐增加,醛和酮在整个发酵过程中占据了主导地位。
以GC-MS为分析手段结合衍生方法还可以研究食品不挥发化合物如单糖和双糖、糖醇、有机酸、脂肪酸、氨基酸等。研究者们使用N-甲基-N-(三甲基硅基)三氟乙酰胺和N,O-双(三甲基硅基)三氟乙酰胺进行硅烷化反应,增加了它们的挥发性[29]。NAGAPPAN等[30]使用甲醇钠通过转甲基化将脂质转化为甲酯,结合GC-MS在海藻中鉴定出34种脂肪酸。需要指出的是,由于小分子代谢物性质的差异,较难找到通用的衍生化方式,而且衍生化步骤在数据收集过程中容易产生伪峰,可能会被鉴定为目标分析物,模糊了重要的分析物的检测[29]。
1.4.2 液质联用
不同于气质联用相对限制性的衍生化方法以及挥发性代谢物分析,基于液质联用的技术已广泛应用于小分子代谢产物的靶向分析和非靶向代谢组学。UPLC具有2 μm以下颗粒的色谱柱允许流动相在高达100 000 kPa的高压下操作,小粒径的填充材料加上高的操作压力,降低了样品分子在色谱柱上的分散而不会降低分离度,促进了水产品中的更多小分子代谢物的检测。UPLC的高分离能力非常适合与飞行时间质谱(time of flight mass spectrometer, TOF MS)或轨道离子陷(Orbitraps)联用分析应用。WANG等[31]采用UHPLC-Q Exactive-MS/MS的非靶向代谢组学方法,对鳜鱼发酵过程中与味觉相关的代谢产物进行了表征,在发酵鳜鱼样品中鉴定出62种代谢产物,包括氨基酸、小肽、脂肪酸、生物碱和有机酸。ROCCHETTI等[32]使用UHPLC结合电喷雾电离四极杆飞行时间质谱(ESI-Q-TOF MS)实现了对350多种酚类物质的分析。
在液质串联中,经色谱柱洗脱的代谢物必须被电离为气态后才能进入质谱。可以根据不同化合物的化学特征选择不同的电离方式。大气压化学电离(atmospheric pressure chemical ionization, APCI)和电喷雾电离(electrospray ionization, ESI)是主要的电离方式。SHAO等[33]集成了反相色谱柱和亲水相互作用色谱柱(hydrophilic interaction chromatography, HILIC),同时使用ESI-和ESI+进行LC-MS/MS数据采集。在4种分析模式下,分别鉴定了363、136、342和133种代谢物。APCI为测定低极性和中极性的挥发性和半挥发性化合物提供了较大的适用范围。大气压光电离(atmospheric pressure photoionization ionization, APPI)能够电离那些离子化程度低或不能被APCI和ESI电离的化合物。CAI等[34]比较了使用APPI、APCI和ESI分析天然鱼油游离脂肪酸和脂肪酸酯的定量准确度和灵敏度。结果发现,APPI灵敏度在很大程度上取决于流动相组成。对于非极性脂质,正相溶剂比反相溶剂具有更高的灵敏度和更好的峰形。结果表明,APPI提供了4~5个数量级的线性动态范围。当移动相不含修饰剂时,APPI的灵敏度为APCI的2~4倍,比ESI更为灵敏。
近年来提出的超高效超临界流体色谱(ultra-high performance supercritical fluid chromatography, UHPSFC)集成了SFC和UPLC技术的优点以及GC和LC的特性,具有较大的应用潜力[35]。DU等[36]验证并优化了一种准确可靠的超临界流体色谱与质谱联用的方法,用于检测水产品中的生物胺(bioamines, BAs),10种BAs均在5 min内通过UHPSFC-MS同时分离和测定。亲水相互作用色谱(hydrophilic interaction chromatography, HILIC)作为正相色谱结合了氢键、偶极-偶极和离子交换相互作用等保留机制,可以在保留极性代谢物的同时保持高速有机移动相,是保留游离氨基酸,核苷酸衍生物和磷脂的理想方法。例如在传统的反相色谱中,磷脂酰胆碱有较高的疏水性,比溶血磷脂酰胆碱保留得更强,可能需要用100%的有机溶剂进行广泛的柱冲洗,才能将其从标准C18柱中洗脱。利用HILIC可以从有限的样品分离得到溶血磷脂酰胆碱[37]。
1.4.3 毛细管电泳串联质谱
类似GC-MS和LC-MS这样的串联技术,在代谢组学中,CE-MS也是一种强有力的分析分离技术,可以有效地分析极性和带电的代谢产物,如氨基酸、核苷酸、有机酸和糖磷酸盐等[38]。为了探索鲫鱼缺氧耐受能力以及强恢复能力的特点,DAHL等[39]通过CE-MS对缺氧-复氧条件下鲫鱼(Carassius carassius)脑、心脏、肝脏和血浆中的核苷酸类、磷酸盐类、糖类、氨基酸类等116种代谢物进行分析,结果发现血浆中高水平的琥珀酸,尿酸和尿素,组织中高水平的蛋白水解和氨基酸代谢,肝脏中琥珀酸和尿酸以及大脑中尿素的高积累,可能是鲫鱼缺氧时的一些保护策略。高分辨率质谱的发展也促进了CE-MS在一些水产次级代谢物的检测应用。TASCON等[40]用毛细管电泳离子阱质谱在不到8 min内成功分离鉴定了海藻中6种生物碱的混合物。需要指出的是,CE-MS由于电路以及喷嘴电压的变化,代谢物的保留时间容易发生偏移,导致对相同样品的重复分析产生显著偏差,引发如峰识别和峰对齐等与数据处理相关的问题。在小分子化合物检测中CE应用受到其低灵敏度、选择性和重复性的限制,缺乏数据库支持,其稳定性和可靠性不如GC-MS或LC-MS[41]。只有在灵敏度、动态范围和整体定量特性得到改善,并且仪器成本降低的情况下,CE-MS在食品样品小分子代谢物分析才可能成为常规[42]。
1.5 核磁共振波谱法
核磁共振波谱可以用来区分一系列的代谢物,代谢物在NMR波谱中显示为不同的峰,每个峰对应一个特定的化学位点或功能基团。核磁共振波谱的高灵敏度技术促进了次级代谢物的表征,例如海洋多环醚是由海洋微型藻类主要为甲藻作为次级代谢物产生的,因其庞大的分子结构和多样的生物功能而引起化学领域的广泛关注,核磁共振波谱可以预测其复杂的大分子结构构成[43]。NMR波谱在小分子代谢物研究中至少有两个优势。首先,NMR波谱是一种非破坏性的技术,同一样品可以根据需要被多次扫描。降低了检出限[44]。此外,同一样本可以在不同的脉冲序列中进行分析,方便检测特定的代谢物。可用于核磁共振谱分析的原子核有1H、19F、14N、15N、13C、31P等[45]。
1H核具有较高的陀螺比,天然存在丰度较高,1H NMR已成为最常用的核磁共振技术之一。由于水分子中氢的存在,实际样品中水产生的质子信号比大多数代谢物信号高几个数量级,因此1H NMR常常被用于研究水产品加工过程中水分的迁移情况,并借此反映一些成分如脂质含量的变化。VIDAL等[46]通过1H NMR技术鉴定了养殖和野生的鲈鱼(Dicentrarchus labrax)的脂肪酸基团、磷脂和胆固醇。这是首次通过1H NMR在鱼类脂质中定性和定量ω-1脂肪酸基团。PINTO等[47]以梭鱼(Piaractus brachypomus)为研究对象,采用定量核磁共振(qNMR)技术对冻融循环后鱼类的代谢谱进行了分析,结果表明,肌苷、次黄嘌呤和三甲胺的生成是鱼肉品质和营养风味损失的主要原因。HAJIREZAEE等[48]从代谢角度研究鲤鱼(Cyprinus carpio)卵细胞过度成熟的分子基础,通过1H NMR对卵细胞中的32种代谢物进行了鉴定,主要包括能量相关代谢物、氨基酸、甲基化代谢物和三羧酸循环中间体。此外还有研究者基于1H NMR的代谢组学研究毒素对鱼代谢物的影响以及抑菌保鲜膜对金鲳鱼代谢物的影响[49-50]
13C NMR技术可以检测到多种代谢物。但13C NMR的灵敏度较低,适合于定量相对丰富的代谢产物,例如肝醣和脂类,或者用于追踪13C标记的代谢产物。随着NMR灵敏度的提高,对由13C底物合成的代谢产物的鉴定将更加全面,有助于发现水生生物中新的代谢途径,如使用同位素标记技术去示踪如脂肪酸,核苷酸和氨基酸等代谢物[51]。13C NMR技术的应用还可以获得额外的结构信息,如确定不同类脂肪酸在甘油骨架上的位置分布,以及观察羰基信号,识别n-3多不饱和脂肪酸在三酰甘油中与α和β链相连时的区域特异性特征[52]。AHMMED等[53]使用GC-FID结合13C NMR波谱法测定了中本研究调查了红鲷、红鲂和鲷鱼的头部和皮肤的脂肪酸组成和n-3脂肪酸位置分布,结果表明,红鲷头部和鲷鱼头部中,DHA主要存在于sn-2位置。
31P NMR能够直接定量磷酸肌酸、ATP、无机磷酸盐等化合物,为含磷化合物的研究提供了直接高效的信息。研究者们利用31P NMR研究了牡蛎组织和鲤鱼肌肉中高能磷酸化合物、无机磷酸盐[54]。此外,磷酸肌酸和无机磷酸盐的化学位移之间的差异还可以帮助研究者们监视细胞内的pH值变化[55]。
2 结论与展望
水产品小分子代谢物种类丰富,官能团以及性质存在差异,因此分析方法的选择非常依赖于仪器的性质以及分析目的。光谱依托于其便携性和NMR类似的快速分析能力,能够对小分子代谢物鉴定进而实现食品的分类,掺假检测以及品质快速分析。色质联用技术利用色谱的高分离能力与质谱的强鉴定能力,它在代谢标志物发现、品质把控和线性校准定量工作中具有巨大的潜力,NMR具有出色的代谢物结构鉴定能力,尤其是在分辨异构体以及同位素示踪方面对小分子代谢物的研究起到了极大地推动作用。
近年来,光谱仪,质谱仪和核磁波谱等分析仪器在分辨率、扫描速度、动态范围等方面的进步,以及相关的串联方法的优化,显著提高了代谢物的覆盖率,被鉴定的代谢物数量激增。然而由于光谱的弱定量效果,质谱信号的波动和同位素内标的缺乏,以及波谱的高检出限,大量代谢物的检测仍然具有挑战性,使用高分辨率质谱结合LC、NMR、二维色谱,二维核磁波谱等技术可以鉴定识别低浓度的代谢物,并且多维NMR和LC以及HRMS技术可以进一步提高代谢物的分辨率和鉴定能力并进一步确认它们的结构[56]。未来,随着技术的不断进步和分析方法的日益成熟,基于不同靶向和非靶向代谢物的分析将在生物医学、环境科学、农业等多个领域发挥更大的作用。研究者们需要基于不同的分析目的,根据不同方法的特点,探索新的分析策略,以应对日益复杂的科学问题,为水产品高质量加工和利用等领域提供有力的技术支持。此外,研究者们也应致力于建立和更新更加全面的小分子代谢物数据库,对更多碎片化的数据集进行更准确的注释和解析,以便于未知代谢物的发现。
[1] FAO. The State of World Fisheries and Aquaculture 2022[M].Italy: Towards Blue Transformation, 2022.
[2] TAN A L, MA X X.Exploring the functional roles of small-molecule metabolites in disease research:Recent advancements in metabolomics[J].Chinese Chemical Letters, 2024, 35(8):109276.
[3] LIU D, ZENG X A, SUN D W.NIR spectroscopy and imaging techniques for evaluation of fish quality:A review[J].Applied Spectroscopy Reviews, 2013, 48(8):609-628.
[4] BROWN M R, KUBE P D, TAYLOR R S, et al.Rapid compositional analysis of Atlantic salmon (Salmo salar) using visible-near infrared reflectance spectroscopy[J].Aquaculture Research, 2014, 45(5):798-811.
[5] VOLPE M G, COSTANTINI S, COCCIA E, et al.Evaluation of metabolic changes induced by polyphenols in the crayfish Astacus leptodactylus by metabolomics using Fourier transformed infrared spectroscopy[J].Journal of Biosciences, 2018, 43(4):585-596.
[6] KILLEEN D P, CARD A, GORDON K C, et al.First use of handheld Raman spectroscopy to analyze omega-3 fatty acids in intact fish oil capsules[J].Applied Spectroscopy, 2020, 74(3):365-371.
[7] CHEN X W, NGUYEN T H D, GU L Q, et al.Use of standing gold nanorods for detection of malachite green and crystal violet in fish by SERS[J].Journal of Food Science, 2017, 82(7):1640-1646.
[8] HASSOUN A, SAHAR A, LAKHAL L, et al.Fluorescence spectroscopy as a rapid and non-destructive method for monitoring quality and authenticity of fish and meat products:Impact of different preservation conditions[J].LWT, 2019, 103:279-292.
[9] LIN X B, HONG C Y, LIN Z Z, et al.Rapid detection of histamine in fish based on the fluorescence characteristics of carbon nitride[J].Journal of Food Composition and Analysis, 2022, 112:104659.
[10] LIU H B, XING H Z, GAO Z G, et al.A single-wavelength excited NIR fluorescence probe for distinguishing GSH/H2S and Cys/Hcy in living cells and zebrafish through separated dual-channels[J].Talanta, 2023, 254:124153.
[11] MAHMOUD M A A, MAGDY M, TYBUSSEK T, et al.Comparative evaluation of wild and farmed rainbow trout fish based on representative chemosensory and microbial indicators of their habitats[J].Journal of Agricultural and Food Chemistry, 2023, 71(4):2094-2104.
[12] KUMAR C, INBAKANDAN D, SRIDHAR J, et al.Proximate composition and fatty acid profile of Himantura marginata (Blackedge whipray) liver oil[J].Biomass Conversion and Biorefinery, 2023, 13(12):11167-11173.
[13] MACHADO C S, ALVES R I S, FREGONESI B M, et al.Chemical contamination of water and sediments in the pardo river, São Paulo, Brazil[J].Procedia Engineering, 2016, 162:230-237.
[14] 韩迎雪, 林婉玲, 杨少玲, 等.5种鲈形目淡水鱼肌肉脂肪酸及磷脂组成的研究[J].南方水产科学, 2019, 15(1):85-92.
HAN Y X, LIN W L, YANG S L, et al.Composition of fatty acids and phospholipids in five Perciformes freshwater fish muscle[J].South China Fisheries Science, 2019, 15(1):85-92.
[15] YU H Y, PARK S E, CHUN H S, et al.Phospholipid composition analysis of krill oil through HPLC with ELSD:Development, validation, and comparison with 31P NMR spectroscopy[J].Journal of Food Composition and Analysis, 2022, 107:104408.
[16] CHEN L X, DEAN B, LIANG X R.A technical overview of supercritical fluid chromatography-mass spectrometry (SFC-MS) and its recent applications in pharmaceutical research and development[J].Drug Discovery Today:Technologies, 2021, 40:69-75.
[17] STABY A, BORCH-JENSEN C, BALCHEN S, et al.Supercritical fluid chromatographic analysis of fish oils[J].Journal of the American Oil Chemists’ Society, 1994, 71(4):355-359.
[18] FRANÇOIS I, SANDRA P.Comprehensive supercritical fluid chromatography × reversed phase liquid chromatography for the analysis of the fatty acids in fish oil[J].Journal of Chromatography A, 2009, 1216(18):4005-4012.
[19] SHEN Q, WANG Y Y, GONG L K, et al.Shotgun lipidomics strategy for fast analysis of phospholipids in fisheries waste and its potential in species differentiation[J].Journal of Agricultural and Food Chemistry, 2012, 60(37):9384-9393.
[20] NEI D, NAKAMURA N, ISHIHARA K, et al.A rapid screening of histamine concentration in fish fillet by direct analysis in real time mass spectrometry (DART-MS)[J].Food Control, 2017, 75:181-186.
[21] CAJKA T, DANHELOVA H, VAVRECKA A, et al.Evaluation of direct analysis in real time ionization-mass spectrometry (DART-MS) in fish metabolomics aimed to assess the response to dietary supplementation[J].Talanta, 2013, 115:263-270.
[22] BI H Y, CAI D D, ZHANG R T, et al.Mass spectrometry-based metabolomics approach to reveal differential compounds in pufferfish soups:Flavor, nutrition, and safety[J].Food Chemistry, 2019, 301:125261.
[23] QIN Z N, DING J, YU Q W, et al.Development of C60-based labeling reagents for the determination of low-molecular-weight compounds by matrix assisted laser desorption ionization mass spectrometry (II):Determination of thiols in human serum[J].Analytica Chimica Acta, 2020, 1105:112-119.
[24] JANDRI Z, ROBERTS D, RATHOR M N, et al.Assessment of fruit juice authenticity using UPLC-QTOF MS:A metabolomics approach[J].Food Chemistry, 2014, 148:7-17.
Z, ROBERTS D, RATHOR M N, et al.Assessment of fruit juice authenticity using UPLC-QTOF MS:A metabolomics approach[J].Food Chemistry, 2014, 148:7-17.
[25] LIANG F, LIN L, ZHU Y J, et al.Comparative study between surimi gel and surimi/crabmeat mixed gel on nutritional properties, flavor characteristics, color, and texture[J].Journal of Aquatic Food Product Technology, 2020, 29(7):681-692.
[26] MART N-G
N-G MEZ A, ARROYO-MANZANARES N, RODR
MEZ A, ARROYO-MANZANARES N, RODR GUEZ-ESTÉVEZ V, et al.Use of a non-destructive sampling method for characterization of Iberian cured ham breed and feeding regime using GC-IMS[J].Meat Science, 2019, 152:146-154.
GUEZ-ESTÉVEZ V, et al.Use of a non-destructive sampling method for characterization of Iberian cured ham breed and feeding regime using GC-IMS[J].Meat Science, 2019, 152:146-154.
[27] LIU A, ZHANG H W, LIU T J, et al.Aroma classification and flavor characterization of Streptococcus thermophilus fermented milk by HS-GC-IMS and HS-SPME-GC-TOF/MS[J].Food Bioscience, 2022, 49:101832.
[28] QIU Y J, WU Y Y, LI L H, et al.Elucidating the mechanism underlying volatile and non-volatile compound development related to microbial amino acid metabolism during golden pomfret (Trachinotus ovatus) fermentation[J].Food Research International, 2022, 162:112095.
[29] SCHÖNEICH S, OCHOA G S, MONZ N C M, et al.Minimum variance optimized Fisher ratio analysis of comprehensive two-dimensional gas chromatography/mass spectrometry data:Study of the pacu fish metabolome[J].Journal of Chromatography A, 2022, 1667:462868.
N C M, et al.Minimum variance optimized Fisher ratio analysis of comprehensive two-dimensional gas chromatography/mass spectrometry data:Study of the pacu fish metabolome[J].Journal of Chromatography A, 2022, 1667:462868.
[30] NAGAPPAN T, VAIRAPPAN C S.Nutritional and bioactive properties of three edible species of green algae, genus Caulerpa (Caulerpaceae)[J].Journal of Applied Phycology, 2014, 26(2):1019-1027.
[31] WANG Y Q, NIE S, LI C S, et al.Application of untargeted metabolomics to reveal the taste-related metabolite profiles during mandarin fish (Siniperca chuatsi) fermentation[J].Foods, 2022, 11(7):944.
[32] ROCCHETTI G, GIUBERTI G, BUSCONI M, et al.Pigmented Sorghum polyphenols as potential inhibitors of starch digestibility:An in vitro study combining starch digestion and untargeted metabolomics[J].Food Chemistry, 2020, 312:126077.
[33] SHAO C, SU Y, MENG D Y, et al.Comprehensive metabolomic profiling of nutrients in fish and shrimp[J].Food Chemistry, 2023, 407:135037.
[34] CAI S S, SYAGE J A.Atmospheric pressure photoionization mass spectrometry for analysis of fatty acid and acylglycerol lipids[J].Journal of Chromatography A, 2006, 1110(1-2):15-26.
[35] SUN X C, ZHENG X, TANG Y, et al.Supercritical fluid extraction combined with ultrahigh performance liquid chromatography quadrupole time-of-flight mass spectrometry for determination of extractables to evaluate compatibility of drugs with rubber closures[J].AAPS PharmSciTech, 2021, 22(1):50.
[36] DU Y Q, TANG H Q, OU C R, et al.Rapid simultaneous analysis of ten biogenic amines in aquatic products by ultra-high-performance supercritical fluid chromatography combined with mass spectrometry[J].Food Analytical Methods, 2023, 16(1):206-214.
[37] MESS J N, C TÉ C, BERGERON A, et al.Selection of HILIC columns to handle matrix effect due to phospholipids[J].Bioanalysis, 2009, 1(1):57-62.
TÉ C, BERGERON A, et al.Selection of HILIC columns to handle matrix effect due to phospholipids[J].Bioanalysis, 2009, 1(1):57-62.
[38] VAN MEVER M, HANKEMEIER T, RAMAUTAR R.CE-MS for anionic metabolic profiling:An overview of methodological developments[J].Electrophoresis, 2019, 40(18-19):2349-2359.
[39] DAHL H A, JOHANSEN A, NILSSON G E, et al.The metabolomic response of crucian carp (Carassius Carassius) to Anoxia and reoxygenation differs between tissues and hints at uncharacterized survival strategies[J].Metabolites, 2021, 11(7):435.
[40] TASCON M, BENAVENTE F, SANZ-NEBOT V M, et al.Fast determination of harmala alkaloids in edible algae by capillary electrophoresis mass spectrometry[J].Analytical and Bioanalytical Chemistry, 2015, 407(13):3637-3645.
[41] PARK E, YU H, LIM J H, et al.Seaweed metabolomics:A review on its nutrients, bioactive compounds and changes in climate change[J].Food Research International, 2023, 163:112221.
[42] SHAMSI S A, SUTHERLAND K.Capillary electromigration techniques coupled to mass spectrometry:Applications to food analysis[J].TrAC Trends in Analytical Chemistry, 2021, 139:116240.
[43] FUWA H.Synthesis-driven stereochemical assignment of marine polycyclic ether natural products[J].Marine Drugs, 2021, 19(5):257.
[44] SPYROS A, DAIS P.NMR Spectroscopy in Food Analysis[M].Cambridge:Royal Society of Chemistry, 2012.
[45] SOLOVYEV P A, FAUHL-HASSEK C, RIEDL J, et al.NMR spectroscopy in wine authentication:An official control perspective[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(2):2040-2062.
[46] VIDAL N P, MANZANOS M J, GOICOECHEA E, et al.Quality of farmed and wild sea bass lipids studied by 1H NMR:Usefulness of this technique for differentiation on a qualitative and a quantitative basis[J].Food Chemistry, 2012, 135(3):1583-1591.
[47] PINTO V S, FLORES I S, FERRI P H, et al.NMR approach for monitoring caranha fish meat alterations due to the freezing-thawing cycles[J].Food Analytical Methods, 2020, 13(12):2330-2340.
[48] HAJIREZAEE S, ABED-ELMDOUST A, ALEKHINA N, et al.Metabolite profiling of the post-ovulatory oocytes of the common carp, Cyprinus carpio:A 1H NMR-based metabolomics approach[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics, 2021, 40:100917.
[49] LIU Y, KAI Y, YANG H S.Biodegradable fish gelatin/chitosan-based active films alter chill-stored golden pomfret (Trachinotus blochii) metabolites mainly through modulating four metabolic pathways[J].Food Packaging and Shelf Life, 2023, 36:101046.
[50] DE MARCO G, BILL B, BRAND
B, BRAND O F, et al.Differential cell metabolic pathways in gills and liver of fish (White Seabream Diplodus sargus) coping with dietary methylmercury exposure[J].Toxics, 2023, 11(2):181.
O F, et al.Differential cell metabolic pathways in gills and liver of fish (White Seabream Diplodus sargus) coping with dietary methylmercury exposure[J].Toxics, 2023, 11(2):181.
[51] SCHNIEDERS R, KEYHANI S, SCHWALBE H, et al.More than proton detection-new avenues for NMR spectroscopy of RNA[J].Chemistry, 2020, 26(1):102-113.
[52] BUNGA S, AHMMED M K, CARNE A, et al.Positional distribution of fatty acids in processed Chinook salmon roe lipids determined by 13C magnetic resonance spectroscopy (NMR)[J].Molecules, 2023, 28(1):454.
[53] AHMMED M K, CARNE A, BUNGA S, et al.Lipidomic signature of Pacific lean fish species head and skin using gas chromatography and nuclear magnetic resonance spectroscopy[J].Food Chemistry, 2021, 365:130637.
[54] SPYROS A, DAIS P.31P NMR spectroscopy in food analysis[J].Progress in Nuclear Magnetic Resonance Spectroscopy, 2009, 54(3-4):195-207.
[55] KANEKO G, USHIO H, JI H.Application of magnetic resonance technologies in aquatic biology and seafood science[J].Fisheries Science, 2019, 85(1):1-17.
[56] GOUILLEUX B, ROUGER L, GIRAUDEAU P.Ultrafast 2D NMR:Methods and applications[J].Annual Reports on NMR Spectroscopy, 2018(93):75-144.