海藻糖是一种天然的非还原性二糖,广泛存在于细菌、酵母、真菌、植物和无脊椎动物中[1]。这种糖包含两个葡萄糖分子,彼此之间经α-1,1糖苷键相连[2],稳定性极高,可用于食品甜味剂、化妆品保湿剂以及药物稳定剂等的生产[3]。海藻糖的生产方法主要有物理提取法[4]、化学合成法[5]及生物酶法[6-8],其中利用麦芽寡糖基海藻酶合成酶(maltooligosyl trehalose synthase, MTSase)及麦芽寡糖基海藻糖水解酶(maltooligosyl trehalose hydrolase, MTHase)双酶[8]的生物酶法因其收率高、产物分离提取工艺简单、成本低、环境友好等优势成为目前工业生产制备海藻糖的主要方法。双酶体系中由于MTSase及MTHase的反应特性,使得作用底物限制在聚合度≥3的麦芽聚糖及麦芽糖基海藻糖[9],因此反应结束后体系中除海藻糖外,还有葡萄糖及麦芽糖等低聚麦芽寡糖剩余[10]。
有文献报道[11]在双酶法制备海藻糖过程中加入糖基转移酶,能够有效减少副产物葡萄糖、麦芽糖和麦芽三糖等含量,从而提高海藻糖转化率。其中,4-α-糖基转移酶(4-α-glucanotransferase, 4αGT, EC 2.4.1.25),是一种能够水解和连接α-1,4糖苷键的糖基转移酶[12],属于淀粉酶GH13家族[13]。该酶具备4种活性[12,14-15],分别是水解、歧化、环化、耦合,反应过程如图1所示。在海藻糖生产过程中,利用4αGT催化歧化反应发生的特性,能够将反应体系中的低分子质量麦芽寡糖经糖基转移反应合成更容易被MTHase和MTSase高效利用的大分子麦芽寡糖,进而提升底物利用率,提高海藻糖产率。
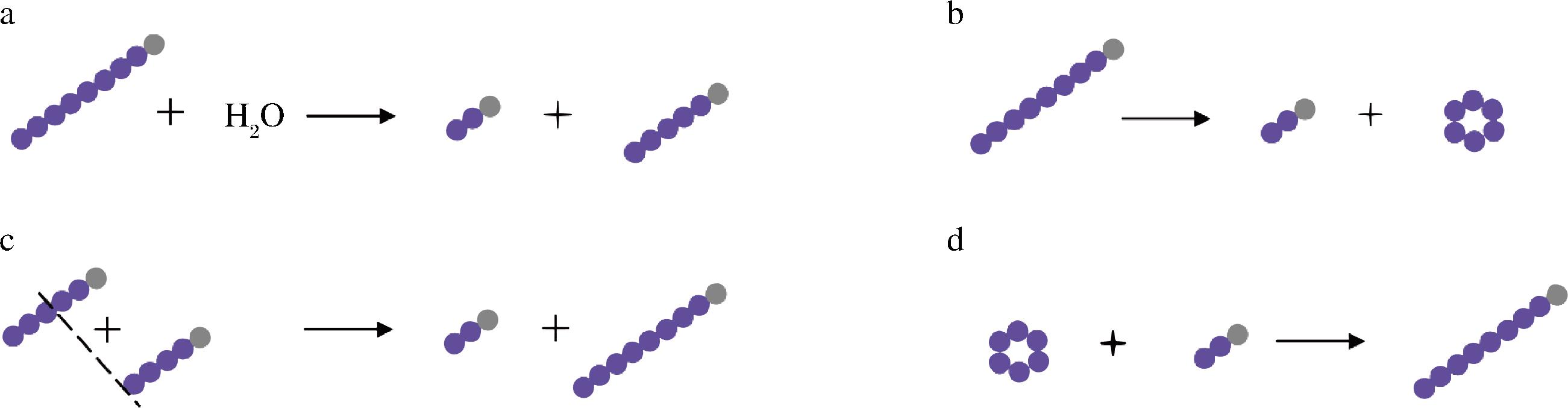
a-水解反应;b-环化反应;c-歧化反应;d-耦合反应
图1 4αGT反应过程
Fig.1 Reaction process of 4αGT
来源于集胞藻(Synechocystis sp.)PCC 6803的4αGT[16]已被证实对多种麦芽低聚糖具有歧化活性,其中最小供体分子为麦芽糖,最小受体分子为葡萄糖。本实验室在MTHase和MTSase催化麦芽糊精生产海藻糖的反应体系中加入该4αGT,海藻糖的转化率对比空白对照有大幅提升,但经液相检测发现,反应结束后体系中仍有较多麦芽低聚糖残留。为进一步提高底物利用率,试验拟对4αGT的歧化活性进行改造。本文通过对4αGT的关键氨基酸进行定点突变,获得了歧化活性提升的突变体酶将其应用于海藻糖生产中,并从水分子通道及分子机制解释歧化活性提升的原因。
1 材料与方法
1.1 菌株与主要试剂
编码4αGT蛋白的malQ基因(GenBank登录号:BA000022.2)合成、引物合成及DNA测序由苏州金唯智生物科技有限公司(上海)完成。异源表达宿主大肠杆菌Escherichia coli TR07(E.coli TR07)以及表达载体pRB1K均购自陶勇实验室。
麦芽糊精,东晓生物科技股份有限公司;普鲁兰酶及糖化酶,山东隆科特酶制剂有限公司;MTHase和MTSase粗酶液为本实验室制备并储存;葡萄糖、麦芽糖、麦芽三糖~麦芽七糖等低聚麦芽糖,上海阿拉丁生化科技股份有限公司;DNA聚合酶Phanta Max Super-Fidelity,南京诺唯赞生物科技股份有限公司;Super Fusion Cloning Kit,莫纳生物科技有限公司;甲基化模板消化酶DMT Enzyme、质粒提取试剂盒、DNA纯化回收试剂盒、Bradford蛋白浓度测定试剂盒,天根生化科技(北京)有限公司。
2×酵母提取物胰蛋白胨(2×yeast extract tryptone medium, 2YT)培养基(g/L):称取蛋白胨16,酵母粉10,NaCl 5,溶解于去离子水中,并定容至1 L。分装后向每份配培养基中添加10~20 g/L的琼脂粉即为固体培养基,121 ℃灭菌20 min。
1.2 主要仪器与设备
LDZH-100L型高压蒸汽灭菌锅,申安医疗器械有限公司;JY92-IIN型超声细胞破碎仪,宁波新芝生物科技股份有限公司;5425R型冷冻离心机,Eppendorf公司;T100 PCR仪及电泳仪,Bio-Rad公司;Ni NTA Beads重力柱镍柱,常州天地人和生物科技有限公司;2695型液相色谱仪,沃特世科技(上海)有限公司。
1.3 实验方法
1.3.1 4αGT基因的构建与异源表达
以pUC19-malQ为模板PCR扩增malQ基因,以pRB1K模板扩增载体片段,运用无缝克隆的方式构建重组质粒pRB1K-malQ。所用引物如表1所示。
表1 用于载体构建的引物
Table 1 Primers used for construction
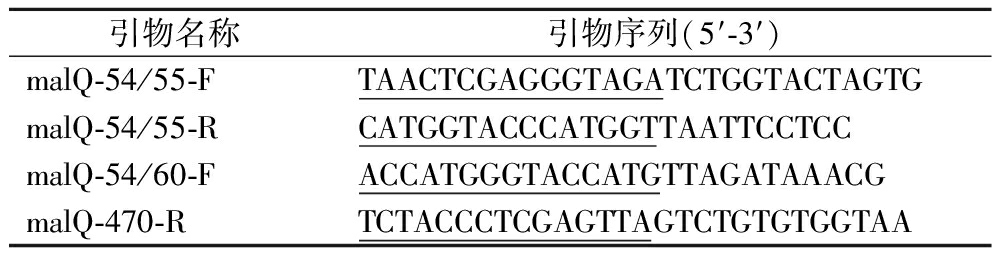
引物名称引物序列(5′-3′)malQ-54/55-FTAACTCGAGGGTAGATCTGGTACTAGTGmalQ-54/55-RCATGGTACCCATGGTTAATTCCTCCmalQ-54/60-FACCATGGGTACCATGTTAGATAAACGmalQ-470-RTCTACCCTCGAGTTAGTCTGTGTGGTAA
注:下划线部分的核苷酸序列为同源臂区域。
PCR结束后加入DMT消化甲基化模板后,利用同源重组酶将载体片段与目的基因连接,随后与大肠杆菌TR07感受态细胞混合,42 ℃水浴锅中精准热激90 s导入细胞中。将带有重组质粒pRB1K-malQ的大肠杆菌E.coli TR07接种至含50 μg/ml卡那霉素抗性的2YT液体培养基中,37 ℃,220 r/min摇床中过夜培养,隔天以1%的接种量转接到卡那霉素抗性的2YT液体培养基中继续培养2.5 h左右至OD600值达到0.6~0.8,加入阿拉伯糖溶液(终浓度为0.2%)置于28 ℃,220 r/min摇床中诱导表达16 h以上。
诱导结束后经冷冻离心机离心弃去全部培养基,收集菌体。菌体经冷冻干燥即得冻干菌粉,菌体加入缓冲液重悬后超声波破碎即得粗酶液,粗酶液经重力柱纯化后超滤即得纯酶液。粗酶液及纯酶液的蛋白纯度采用SDS-PAGE蛋白电泳进行验证分析。
1.3.2 4αGT在不同底物浓度下的应用
分别称取100、150、200、300 g麦芽糊精,加入900 mL超纯水置于60 ℃、转速220 r/min摇床中,待充分溶解后加水定容至1 L,即为100、150、200、300 g/L麦芽糊精水溶液。量取25 mL底物溶液。加入100 μL普鲁兰酶、960 μL MTSase粗酶液、960 μL MTHase粗酶液、1.92 mL 4αGT粗酶液/水、500 μL Na2HPO4/NaH2PO4缓冲液(1 mol/L,pH 7.0),反应体系置于40 ℃、转速220 r/min条件下过夜反应。反应结束后调节pH值至4.3左右加入500 μL糖化酶60 ℃水解1 h,将反应体系中麦芽寡糖彻底水解成葡萄糖以便后续产物检测,反应结束煮沸灭活10 min,离心取上清液后进行稀释后,使用糖分离柱(10 μm, 6.5 mm×300 mm)进行HPLC分析。
1.3.3 定点突变
以pRB1K-malQ为模板,利用引物引入错配碱基的PCR法替换malQ的氨基酸残基对选择位点进行定点突变,引物在表2中给出。PCR扩增产物中加入1 μL DMT,37 ℃水浴锅中消化消化甲基化模板DNA 2 h,重组质粒构建成功后转化至E.coli TR07感受态细胞中进行克隆表达。
表2 用于突变的引物
Table 2 Primers used for mutagenesis

引物名称引物序列(5′-3′)malQ-54/55-FAAAGGTAAGGGGAATTMNNMNNTCCGGTGGGGCCCAACmalQ-54/55-RGTTGGGCCCCACCGGANNKNNKAATTCCCCTTACCTTmalQ-54/60-FCTAGGGCAGAATAGCAMNNGTAAGGGGAATTGCCMNNTCCGGTGGGGCCCAACmalQ-54/60-RGTTGGGCCCCACCGGANNKGGCAATTCCCCTTACNNKTGCTATTCTGCCCTAGmalQ-55/60-FCTAGGGCAGAATAGCAMNNGTAAGGGGAATTMNNGAATCCGGTGGGGCCCmalQ-55/60-RGGGCCCCACCGGATTCNNKAATTCCCCTTACNNKTGCTATTCTGCCCTAGmalQ-465/469-FCCAACCCCAGTTGCCCGCMNNAGTGCCCGGMNNGTTCATGCGACAGTCACTAmalQ-465/469-RTAGTGACTGTCGCATGAACNNKCCGGGCACTNNKGCGGGCAACTGGGGTTGGmalQ-465/470-FTGACTGTCGCATGAACMNNCCGGGCACTGCGMNNGGCAACTGGGGTTGGCmalQ-465/470-RGCCAACCCCAGTTGCCNNKCGCAGTGCCCGGNNKGTTCATGCGACAGTCAmalQ-469/470-FGCCAACCCCAGTTGCCMNNMNNAGTGCCCGGTAAGTTCmalQ-469/470-RGAACTTACCGGGCACTNNKNNKGGCAACTGGGGTTGGCmalQ-470-FGCCAACCCCAGTTGCCMNNCGCAGTGCCCGGTAAGmalQ-470-RCTTACCGGGCACTGCGNNKGGCAACTGGGGTTGGC
注:下划线部分的核苷酸序列为突变位点。
1.3.4 突变体的筛选与4αGT活性的测定
以淀粉为底物,利用4αGT水解淀粉产生透明圈的能力对突变体进行筛选。将构建好的重组菌株转化子和4αGT野生型点在含3 g/L可溶性淀粉的2YT平板(含阿拉伯糖诱导剂,终浓度为2 g/L)上,各3组平行,37 ℃恒温培养箱中培养8 h后转入28 ℃恒温培养箱内诱导表达,过夜培养后,加入1 mL卢戈氏碘液,使用ImageJ软件计算菌落产生淀粉透明圈直径与该菌落直径之比。
以麦芽七糖和葡萄糖作为底物,采用葡萄糖检测试剂盒测定葡萄糖浓度后进一步测定酶活力。反应底物为5 g/L麦芽七糖和0.25 g/L葡萄糖,溶剂为50 mmol/L、pH值为7.0的磷酸盐缓冲液。在2 mL离心管中加入0.01 g待测菌粉(粗酶或纯酶)、反应底物溶液,反应体系为1 mL。置于45 ℃,220 r/min摇床中反应2 h。反应结束加热煮沸10 min,12 000 r/min离心10 min,取10 μL上清液与190 μL工作液混合后于505 nm处检测吸光度值计算葡萄糖浓度。以未加菌粉(粗酶或纯酶)组为反应空白对照。
1.3.5 4αGT最适温度、最适pH测定
最适温度检测:在2 mL离心管中加入5 g/L麦芽七糖、0.25 g/L葡萄糖及磷酸盐缓冲液(50 mmol/L,pH值为7.0)及酶液,于20、30、40、45、50、60 ℃,220 r/min摇床中反应2 h,反应结束煮沸10 min,离心后取上清液使用葡萄糖检测试剂盒进行活性测定,将活性最高的温度下的活性设置成100%,计算其他温度下活性。
最适pH检测:在2 mL离心管中加入酶液、5 g/L麦芽七糖、0.25 g/L葡萄糖,分别与柠檬酸盐缓冲液(50 mmol/L,pH值为4.0~6.0)、磷酸盐缓冲液(50 mmol/L,pH值为6.0~8.0)、Tris盐酸盐缓冲液(50 mmol/L,pH值为8.0~9.0)、甘氨酸-氢氧化钠缓冲液(50 mmol/L,pH值为9.0~10.0)混合后,于45 ℃,220 r/min摇床中反应2 h,反应结束煮沸10 min,离心后取上清液使用葡萄糖检测试剂盒进行活性测定,将活性最高的pH下的活性设置成100%,计算其他pH下活性。
1.3.6 4αGT歧化反应
使用葡萄糖作为受体,检测不同麦芽寡糖作为供体分子时4αGT转糖基活性。检测体系:在2 mL离心管中加入葡萄糖(0.25 g/L)、不同供体分子(5 g/L)、纯酶(3 μL)、磷酸盐缓冲液(50 mmol/L,pH值为7.0),于45 ℃下反应2 h,反应结束煮沸10 min,离心后取上清液使用葡萄糖检测试剂盒进行活性测定,歧化活性定义为2 h内1 mg/mL纯酶催化反应中葡萄糖的变化量。
1.3.7 4αGT参与转化海藻糖反应
在20 g的反应体系中加入100 μL普鲁兰酶、960 μL MTSase粗酶液、960 μL MTHase粗酶液、1.92 mL 4αGT粗酶液、6 g麦芽糊精以及Na2HPO4/NaH2PO4缓冲液(20~30 mmol/L,pH值为7.0),反应体系置于40 ℃、转速220 r/min条件下过夜反应。后续产物处理及分析条件同1.3.2节。
1.4 数据处理
HPLC的检测结果通过面积归一化法对产物进行定量处理。每次实验设置三个平行,实验数据使用Origin 2022进行数据处理和绘图分析。
2 结果与分析
2.1 重组4αGT的制备与纯化
为探究Synechocystis sp.PCC 6803来源的4αGT malQ基因能否在原核系统中实现可溶性表达,可将其构建到大肠杆菌TR07细胞中进行表达验证。将4αGT重组细胞在含有0.1 mmol/L卡那霉素的2YT培养基中培养,当培养基的OD600值达到0.6~0.8时,在培养基中加入阿拉伯糖诱导剂(终浓度为2 g/L),在28 ℃下诱导16 h产生4αGT。收集细胞,超声波破碎,获得的上清液为4αGT粗酶液(图2-a)。粗酶液经镍柱亲和层析,得到高纯度的4αGT纯酶。从镍柱纯化的酶在10% SDS-PAGE上仅显示1条条带(图2-b),分子质量为57 kDa,与粗酶液中的蛋白条带相对应,因此构建到pRB1K载体上的4αGT基因在E.coli TR07中可以实现可溶性表达。
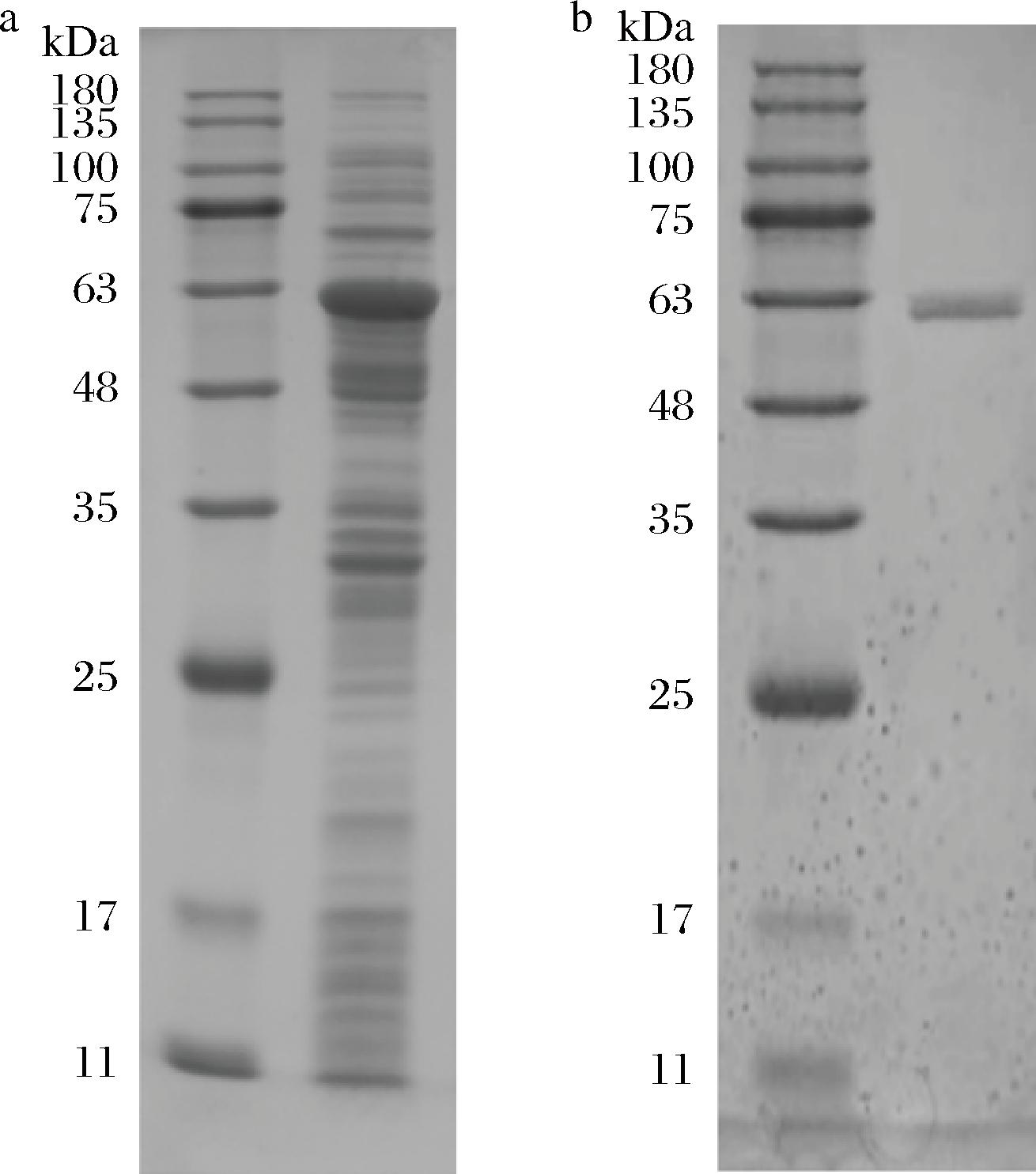
a-粗酶液;b-纯酶
图2 4αGT的SDS-PAGE分析
Fig.2 SDS-PAGE analysis of 4αGT
2.2 4αGT在不同底物浓度下的应用
为探究该4αGT在海藻糖制备过程中的应用能力,将其与普鲁兰酶、MTSase及MTHase进行复配测定不同浓度麦芽糊精下海藻糖转化率,并与未添加4αGT的对照组进行比较分析,结果如图3所示。
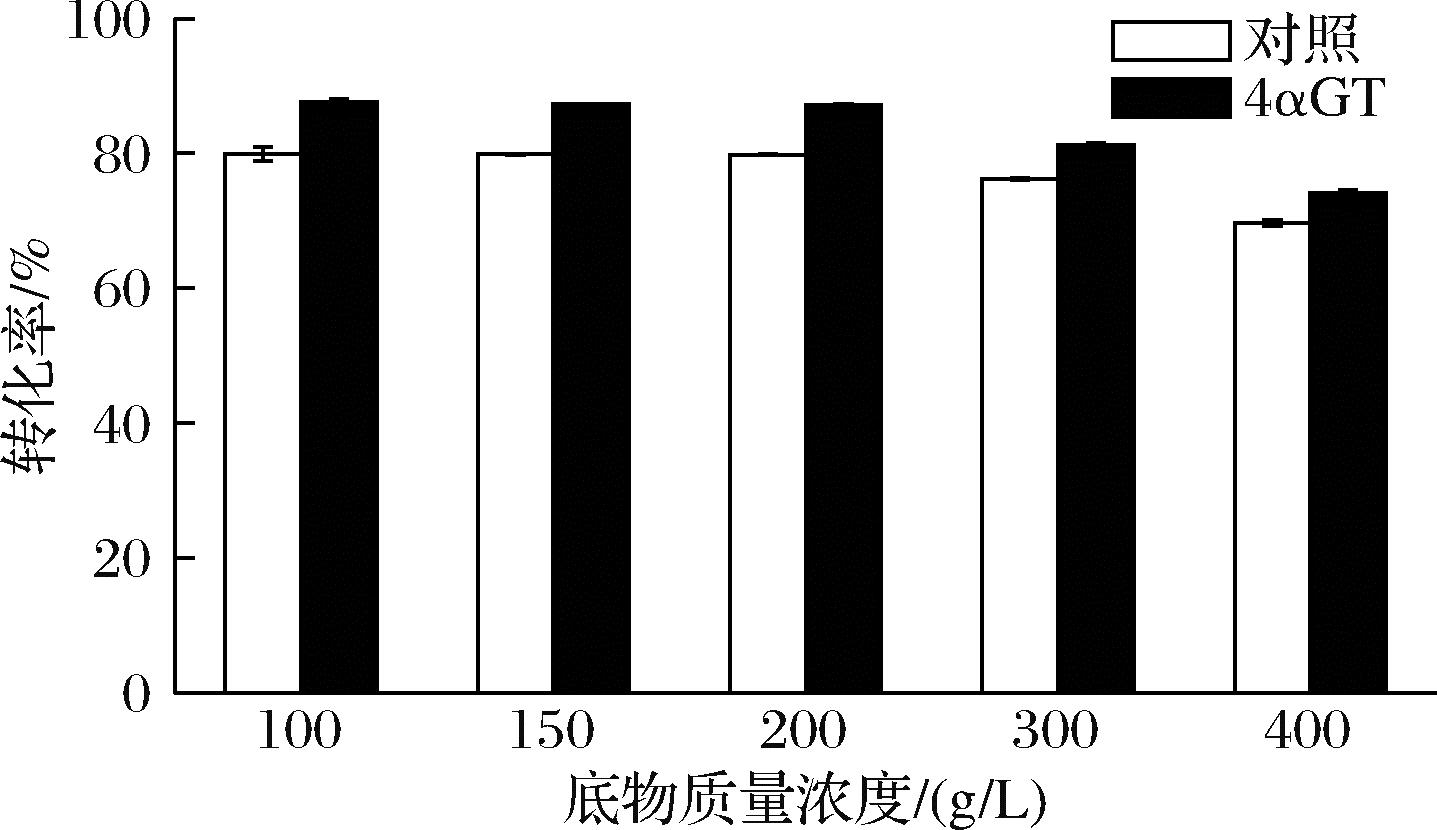
图3 不同底物质量浓度下海藻糖转化率
Fig.3 Trehalose conversion at different substrate concentrations
底物质量浓度100 g/L时加入4αGT海藻糖转化率最大(87.66%),随着底物质量浓度增加,对照组及4αGT组海藻糖转化率下降,原因可能有以下几个方面:a)随着底物质量浓度增加反应体系黏度增大,从而导致底物扩散受到抑制,与酶接触能力下降;b)出现底物抑制或产物抑制;c)酶的底物耐受性较低;d)酶活性不够。
此外,随着底物质量浓度的增加,4αGT在反应体系中的添加效果逐步降低,具体表现为随着质量浓度的增加,4αGT与对照组的差距逐步缩小,分别为7.71%、7.46%、7.33%、5.09%、4.43%。尽管100 g/L质量浓度下4αGT参与的反应体系海藻糖转化率接近理论转化率(90%),然而300 g/L高质量浓度底物下海藻糖转化率降低为81.33%,底物质量浓度为400 g/L时海藻糖转化率进一步降低为74.10%,而这些高底物质量浓度往往是高强度工业化生产的必需条件。
随着底物质量浓度的增加,酶反应效率下降,这是底物和酶分子之间的相互作用的结果,也是酶自身性质所决定,其中提升酶分子酶活力是相对简单且有效的方式。因此本文试图采用半理性设计策略从提升4αGT酶活角度出发,提高其在高底物质量浓度下的酶活力,从而提高工业化条件下海藻糖转化率。
2.3 4αGT突变位点的选择
Synechocystis sp.4αGT由1 515 bp碱基编码而成,全长共505个氨基酸。本实验室利用该酶与普鲁兰酶、MTSase及MTHase进行复配催化麦芽糊精生产海藻糖,发现该酶在高底物质量浓度下存在歧化活性低的缺陷。为了提升海藻糖转化率,采用半理性设计策略增强该酶的歧化活性。
为了获得该酶三维结构模型,使用Alpha Fold2对该酶进行建模,选择预测结果中置信度最高的结构作为其模型。为了确认获得模型的可靠性,运用ERRAT、VERIFY-3D及拉式图对该预测模型构象合理性进行评估。结果显示,该模型整体质量因子为91.15(91以上较为合理),酶分子中95.45%(80%以上较为合理)的氨基酸残基的3D原子模型/自身1D氨基酸序列评分≥0.1。此外,拉式图结果(图4)显示,氨基酸残基落在最佳区域比例为91.9%(90%以上较为合理),由此可判定4αGT的结构预测模型较为合理,可用于后续研究分析。

图4 4αGT同源模型的Ramachandran plot评估
Fig.4 Ramachandran plot evaluation of 4αGT models
为了精确选取突变位点,利用HotSpot Wizard[17]在线工具对该酶的突变“热点氨基酸”进行分析。HotSpot Wizard能通过与近200条同源序列进行比对,并基于三维结构及同源性分析识别酶的“热点氨基酸”残基。分析结果显示,该酶包含43个可能的“热点氨基酸”(E224、S388、A469、E356、E410、L465、H224、K314、V350、K368、S376、P381、S109、L192、D102、Y188、G53、F54、N56、Y62、W70、I105、M149、E153、N156、G157、G159、H161、Q162、H189、D377、T52、G55、L60、C61、K152、P51、N68、P69、Y101、Y145),如图5-a所示。然而,绝大多数预测的位点都离催化中心(包括底物通道及活性口袋)较远,考虑到处于催化中心区域的氨基酸对酶的催化性能起着更关键性作用,因此仅对该区域内的残基进行后续研究。如图5-b所示,在43个热点中处于活性中心的残基共6个,分别是F54、G55、L60、L465、A469、A470。因此,将其作为后续突变位点。
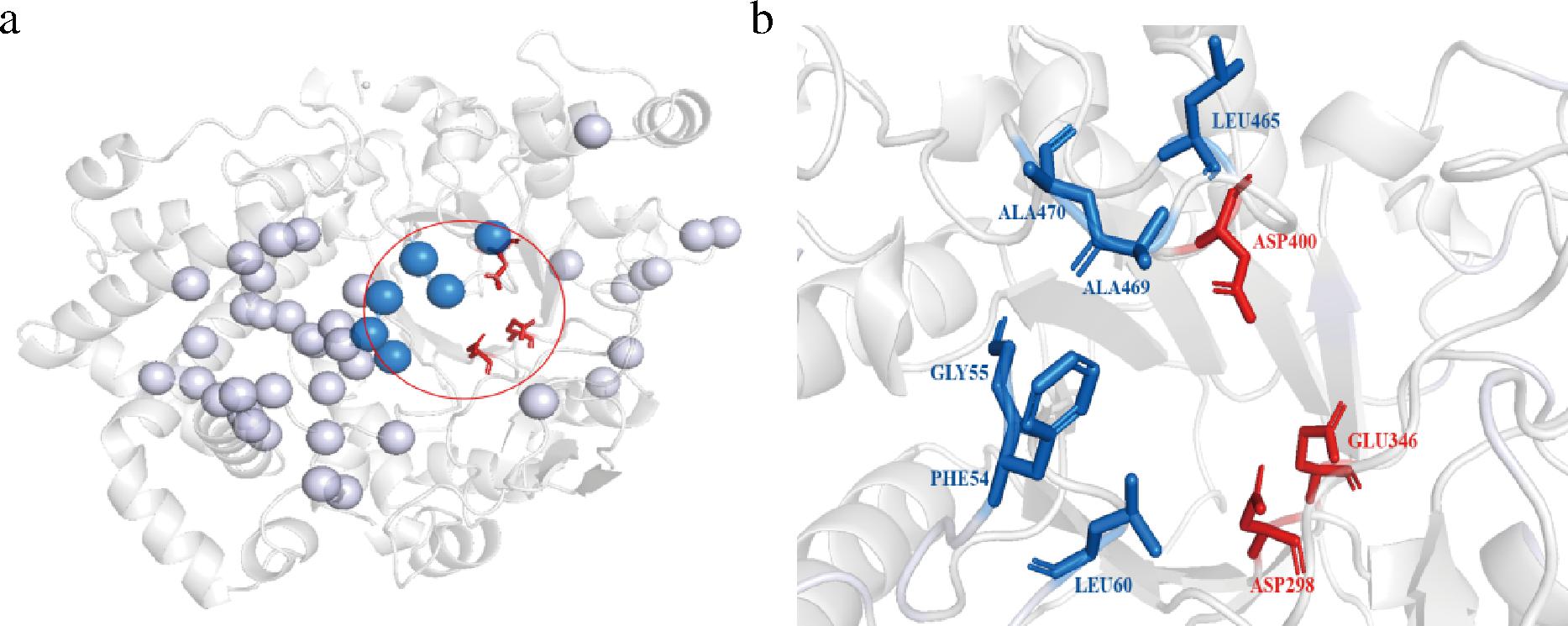
a-在线工具分析“热点氨基酸”;b-处于催化中心内“热点氨基酸”
图5 “HotSpot”所处空间位置
Fig.5 Location of “HotSpot” in space
注:小球表示“热点氨基酸”,红圈表示催化中心,红色残基为保守催化三联体,蓝色表示处于催化中心内“热点氨基酸”。
2.4 4αGT突变体的筛选
将选定的6个突变位点按照空间位置远近分为2组,分别是L465、A469、A470与F54、G55、L60。为了尽可能激发组内位点的协同效应及丰富突变体的多样性,将组内位点两两组合。每个组对应产生3个突变文库,理论上这6个突变文库包含2 394个单/双点突变体。随后研究使用NNK简并密码子对上述突变文库进行构建,并利用4αGT产生透明圈的能力对平板上的转化子进行筛选。结果显示,从大约18 000个(每个文库大约3 000个)转化子中筛选得到2个透明圈有明显变化的转化子,转化子的透明圈直径与菌落直径比值分别为3.08和2.71,较4αGT野生型(1.84)增加1.67倍和1.47倍,经测序,这2个转化子分别为A470T单点突变体和A470I单点突变体。
考虑到2个突变体均为470位点的突变体,表明该位点可能是1个对于4αGT活性调节起着关键性作用的位点,因此对该位点进行饱和突变后进一步研究。在获得该位点的全部19种突变体后,使用葡萄糖氧化试剂盒对突变体歧化活性进行检测。结果显示,470位点的突变体中活性变化最明显的突变体为单点突变体A470F。
2.5 4αGT及其突变体酶学性质的测定
对野生型及A470F突变体菌株进行诱导表达后,收集细胞,将菌体浓缩至同一浓度后超声波破碎,粗酶液经SDS-PAGE蛋白凝胶电泳后,使用ImageJ软件分析目标蛋白条带灰度值对蛋白进行定量分析,结果显示,蛋白表达量没有差异。利用镍柱对4αGT及突变体A470F的粗酶液进行纯化后,对最适温度及最适pH进行测定。
结果显示,4αGT及突变体A470F的最适温度和最适pH均没有太大变化,分别为50 ℃(如图6-a和图6-c)和pH 6.0(如图6-b和图6-d),但在pH 7.0的磷酸盐缓冲液中突变体A470F的活性远高于野生型。

a-野生型最适温度;b-野生型最适pH;c-突变体最适温度;d-突变体最适pH
图6 4αGT野生型及突变体酶学性质
Fig.6 Enzymatic properties of the wide-type and mutant 4αGT
2.6 4αGT及突变体对不同供体的转糖基反应
在实际生产过程中,该酶作用的底物为不同链长的麦芽寡糖,因此以不同链长的麦芽寡糖(二糖~七糖)作为供体分子,检测4αGT及突变体对不同供体的歧化活性。结果显示,相比于野生型酶,突变体酶在催化麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖及麦芽六糖时的活性略低于野生型,然而在以麦芽七糖作为转糖基供体时突变体的酶活性要高于野生型,为野生型的1.17倍(表3)。
表3 不同供体分子歧化活性分析
Table 3 Analysis of disproportionation activity of different donor molecules
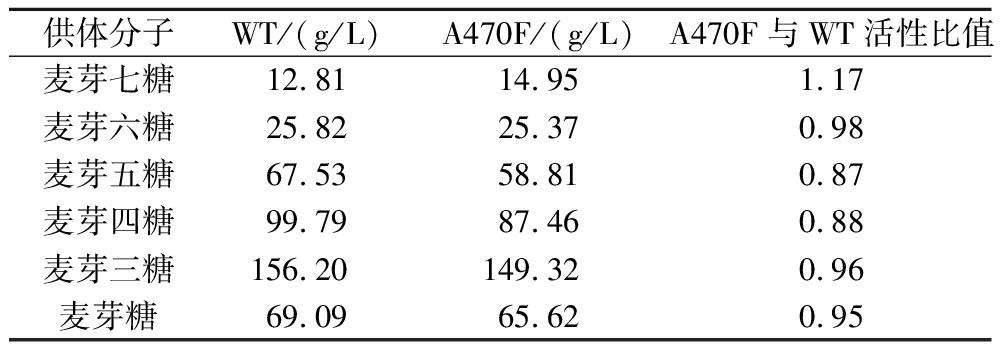
供体分子WT/(g/L)A470F/(g/L)A470F与WT活性比值麦芽七糖12.8114.951.17 麦芽六糖25.8225.370.98 麦芽五糖67.5358.810.87 麦芽四糖99.7987.460.88 麦芽三糖156.20149.320.96 麦芽糖69.0965.620.95
2.7 4αGT突变体的应用
为了验证单点突变体A470F酶活力,将其与普鲁兰酶、MTSase、MTHase复配催化麦芽糊精。野生型4αGT在催化300 g/L麦芽糊精时,海藻糖转化率可达81.33%,提高底物质量浓度至350 g/L时,转化率仅下降1.42%,此时海藻糖转化率为79.91%。而当继续提高麦芽糊精质量浓度至400 g/L时,海藻糖转化率较350 g/L底物质量浓度下降5.81%,此时转化率仅为74.10%。因此考虑到工业化规模生产中水、电、蒸汽、底物消耗及产物收率等工业经济效应,将反应体系中麦芽糊精终质量浓度设为350 g/L。反应结束调节pH加入糖化酶将副产物麦芽寡糖彻底水解成葡萄糖后使用高效液相色谱进行产物分析。结果如表4所示,突变体A470F参与的反应,最终转化率为81.06%,相较于对照组的4αGT野生型(79.91%)提升了1.15%,该反应体系无论是底物浓度、反应时间还是海藻糖转化率均处于较高水平。在本公司海藻糖年产5万t级的规模下,成本节省非常可观。
表4 4αGT及突变体参与的多酶催化体系催化的海藻糖反应
Table 4 Trehalose reaction catalyzed by multi-enzyme system involving 4αGT and mutants
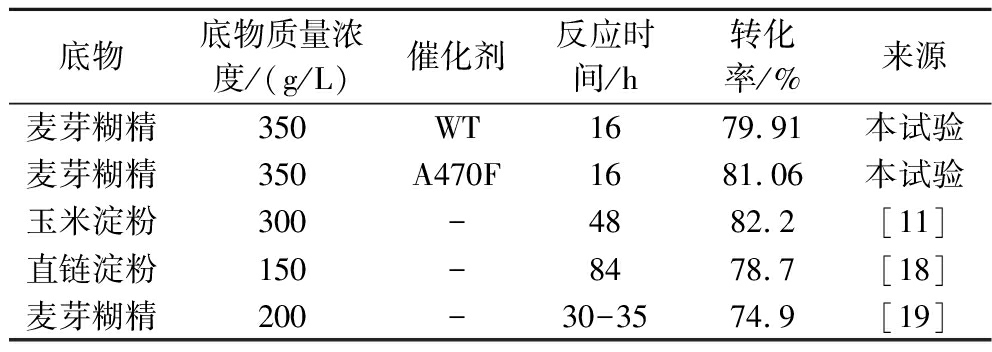
底物底物质量浓度/(g/L)催化剂反应时间/h转化率/%来源麦芽糊精350WT1679.91本试验麦芽糊精350A470F1681.06本试验玉米淀粉300-4882.2[11]直链淀粉150-8478.7[18]麦芽糊精200-30-3574.9[19]
为进一步排除蛋白表达量导致转化率提升的可能性,本实验室尝试过量添加野生型4αGT,但海藻糖转化率没有进一步提升,印证了突变体海藻糖转化率的提升是酶活力提高的结果。
2.8 4αGT及突变体的通道及催化距离分析
为了揭示470位点的残基变化对4αGT歧化活性的影响机制,对4αGT野生型和突变体A470F的底物通道进行了比较分析。4αGT涉及3个底物通道,底物通道入口分别处于250 s环(残基249~262)Y255残基、460 s环(残基464~472)T468残基、460 s环A470残基附近,其中A470残基的突变对另外2处的底物通道影响不明显,不会对底物进入和产物释放产生明显影响,所以本研究仅针对470残基附近的底物通道进行了分析。
结果如图7显示,当470残基由丙氨酸突变为苯丙氨酸后,该位置受到苯丙氨酸侧链芳香环的影响,空间位阻增强,水分子通道变窄,导致水分子进入活性口袋的概率变低,水分子竞争受体糖分子的能力下降,这是本研究认为歧化活性提升的一个重要原因。
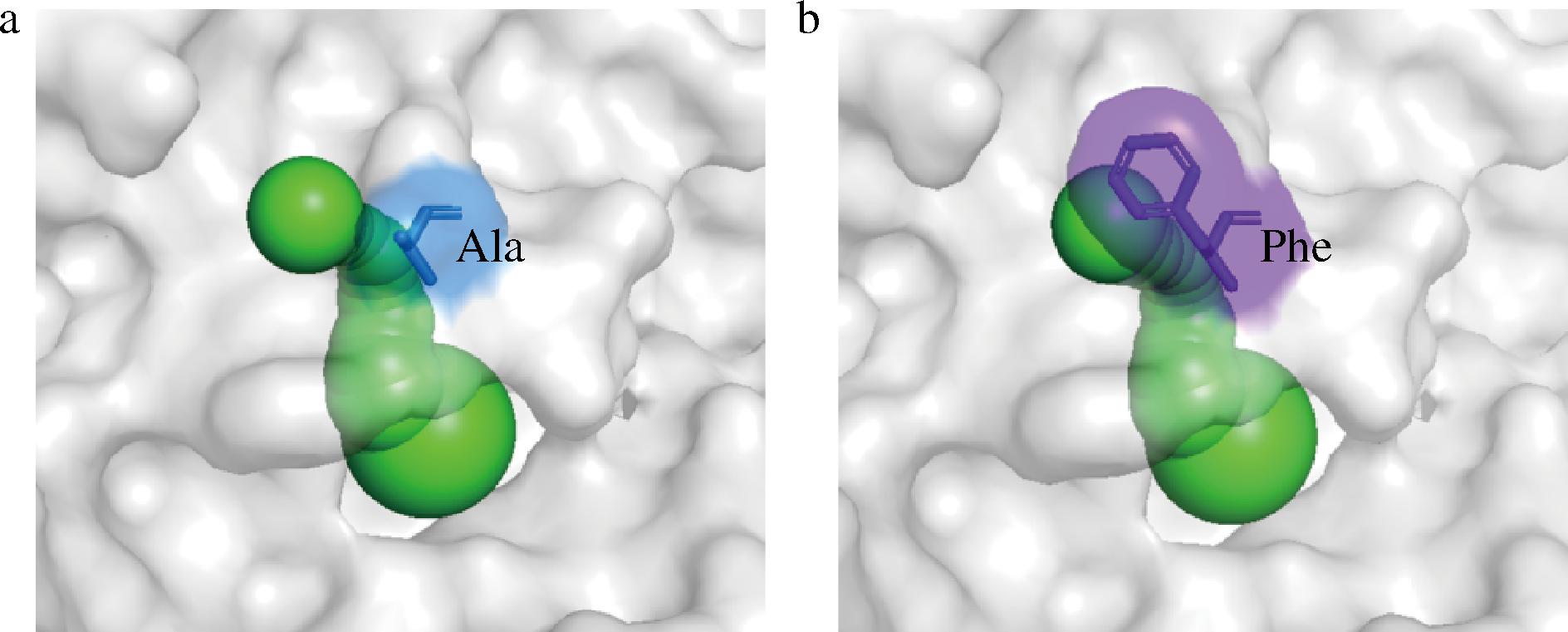
a-野生型;b-突变体A470F
图7 4αGT470残基位置的水分子通道
Fig.7 Water channel of 4αGT at the 470th residue
在4αGT中存在保守的催化三联体D298-E346-D400,在催化过程中Asp298作为亲核试剂攻击底物碳原子形成酶-底物中间体,E346作为酸碱催化剂为糖苷氧提供质子,而D400作为过渡态稳定剂可稳定酶-底物中间体。因此Asp298与底物碳原子、E346与糖苷氧的距离十分重要,因此为了进一步探究4αGT突变体歧化活性提升的原因,将4αGT野生型及突变体的蛋白模型分别与麦芽七糖进行了对接分析。
结果如图8显示,野生型中亲核残基D298与端粒碳原子的距离为3.8 Å,酸碱残基E346与糖苷氧的距离为3.4 Å,而在突变体A470F中这2个关键催化距离分别缩短为3.5 Å和3.3 Å,与先前实验中突变体活性更高的结果一致,因此推测470位点的突变使得底物构象发生轻微调整,由此导致的关键催化距离缩短可能是催化活性提升的原因。
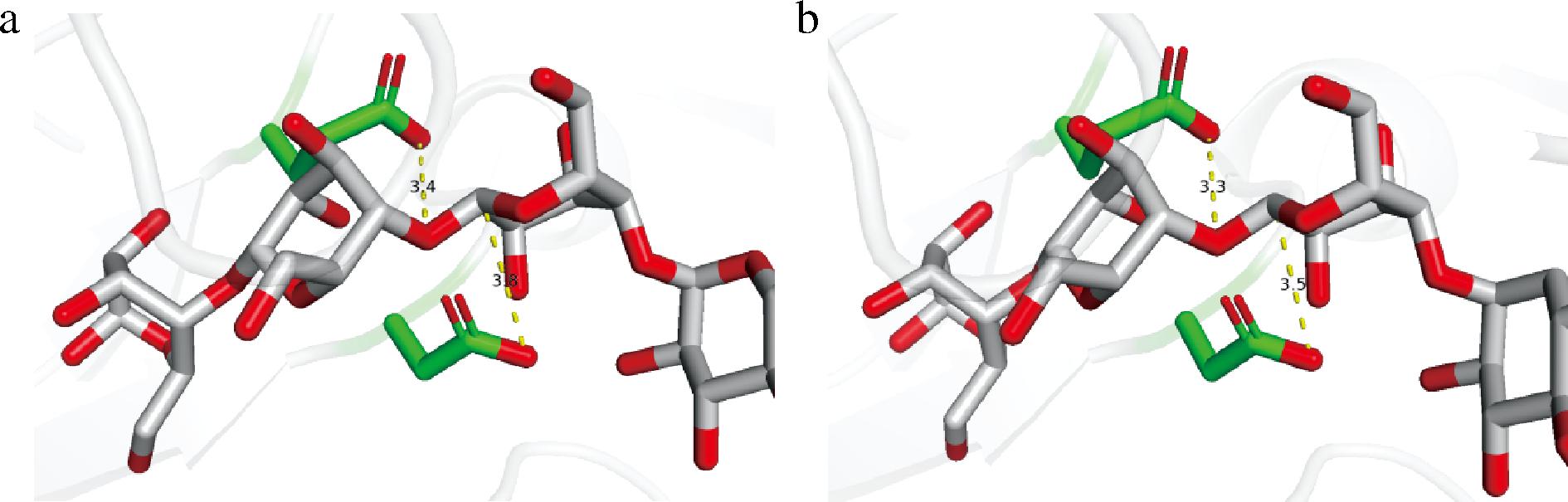
a-野生型;b-突变体A470F
图8 4αGT的2个关键距离
Fig.8 Two critical distances for 4αGT
3 结论与讨论
4αGT具有复杂的多功能催化活性(水解、环化、歧化、耦合),并且底物谱范围较为广泛。目前对4αGT的研究大都集中于4αGT基因的异源表达以及探究该酶在淀粉改性、环糊精生产中的应用,通过蛋白质工程对4αGT歧化活性进行改造的相关研究较少。
本研究利用半理性设计策略对4αGT进行分子改造,获得了歧化活性较野生型提升17%的突变体A470F,该突变体在催化350 g/L的麦芽糊精时,海藻糖转化率较野生型提升1.15%。经专业生产部门核算,该转化率的提升使得海藻糖成本降低80~90元/t,在全球年产20万t的基础上,该突变体在高底物质量浓度下转化率的提升带来的成本节省十分可观。然而反应液中仍有约19%的副产物,未来可以在突变体的基础上进一步提升其活性以提高海藻糖转化率。此外,本研究证实了4αGT水分子通道与歧化活性存在一定影响,为进一步探究4αGT的催化机制奠定了基础,同时对其他来源的糖基转移酶的分子改造具有一定的参考意义。
值得注意的是,本实验室在构建470位点的饱和突变体文库时获得了该位点的截断突变体,该突变体在淀粉平板上没有透明圈生成,水解活性完全丧失,但仍具有歧化活性(数据未显示),其在催化麦芽糊精生成海藻糖反应中转化率低于野生型。未来可以对该突变体的酶学特性进行进一步测定,探究其活性变化的分子机制。
[1] ARGÜELLES J C.Physiological roles of trehalose in bacteria and yeasts:A comparative analysis[J].Archives of Microbiology, 2000, 174(4):217-224.
[2] RICHARDS A B, KRAKOWKA S, DEXTER L B, et al.Trehalose:A review of properties, history of use and human tolerance, and results of multiple safety studies[J].Food and Chemical Toxicology, 2002, 40(7):871-898.
[3] 张玉华, 凌沛学, 籍保平.海藻糖的研究现状及其应用前景[J].食品与药品, 2005, 7(3):8-13.
ZHANG Y H, LING P X, JI B P.Current status of research for trehalose and its prospective applications[J].Food and Drug, 2005, 7(3):8-13.
[4] ELBEIN A D.The metabolism of α, α-trehalose[M]. Advances in Carbohydrate Chemistry and Biochemistry.Amsterdam:Elsevier, 1974:227-256.
[5] LEMIEUX R U, BAUER H F.A chemical synthesis of D-trehalose[J].Canadian Journal of Chemistry, 1954, 32(4):340-344.
[6] NUCCIO M L, WU J, MOWERS R, et al.Expression of trehalose-6-phosphate phosphatase in maize ears improves yield in well-watered and drought conditions[J].Nature Biotechnology, 2015, 33(8):862-869.
[7] NISHIMOTO T, NAKANO M, NAKADA T, et al.Purification and properties of a novel enzyme, trehalose synthase, from Pimelobacter sp.R48[J].Bioscience, Biotechnology, and Biochemistry, 1996, 60(4):640-644.
[8] SEO J S, AN J H, BAIK M Y, et al.Molecular cloning and characterization of trehalose biosynthesis genes from hyperthermophilic archaebacterium Metallosphaera hakonesis[J].Journal of Microbiology and Biotechnology, 2007, 17(1):123-129.
[9] NAKADA T, MARUTA K, TSUSAKI K, et al.Purification and properties of a novel enzyme, maltooligosyl trehalose synthase, from Arthrobacter sp.Q36[J].Bioscience, Biotechnology, and Biochemistry, 1995, 59(12):2210-2214.
[10] 宋龙祥, 张欣宜, 王冲, 等.多酶催化制备海藻糖及分离提取工艺优化[J].齐鲁工业大学学报, 2021, 35(3):7-12.
SONG L X, ZHANG X Y, WANG C, et al.Preparation of trehalose by multienzyme catalysis and optimization of separation and extraction process[J].Journal of Qilu University of Technology, 2021, 35(3):7-12.
[11] MUKAI K, TABUCHI A, NAKADA T, et al.Production of trehalose from starch by thermostable enzymes from Sulfolobus acidocaldarius[J].Starch - Stärke, 1997, 49(1):26-30.
[12] TAKAHA T, SMITH S M.The functions of 4-alpha-glucanotransferases and their use for the production of cyclic glucans[J].Biotechnology &Genetic Engineering Reviews, 1999, 16:257-280.
[13] KURIKI T, IMANAKA T.The concept of the α-amylase family:Structural similarity and common catalytic mechanism[J].Journal of Bioscience and Bioengineering, 1999, 87(5):557-565.
[14] IMAMURA H, FUSHINOBU S, JEON B S, et al.Identification of the catalytic residue of Thermococcus litoralis 4-alpha-glucanotransferase through mechanism-based labeling[J].Biochemistry, 2001, 40(41):12400-12406.
[15] VAN DER MAAREL M J E C, LEEMHUIS H.Starch modification with microbial alpha-glucanotransferase enzymes[J].Carbohydrate Polymers, 2013, 93(1):116-121.
[16] LEE B H, OH D K, YOO S H.Characterization of 4-α-glucanotransferase from Synechocystis sp.PCC 6803 and its application to various corn starches[J].New Biotechnology, 2009, 26(1-2):29-36.
[17] SUMBALOVA L, STOURAC J, MARTINEK T, et al.HotSpot Wizard 3.0:Web server for automated design of mutations and smart libraries based on sequence input information[J].Nucleic Acids Research, 2018, 46(W1):W356-W362.
[18] 陈晓斌. 重组MTSase和MTHase双酶法转化淀粉生产海藻糖[D].杭州:浙江大学, 2006.
CHEN X B.Production of trehalose from starch by recombinant MTSase and MTHase[D].Hangzhou:Zhejiang University, 2006.
[19] 杜立, 宿玲恰, 吴敬.提高源自Bacillus circulans 251的β-CGTase对麦芽糖亲和性及其在生产海藻糖中的应用[J].中国生物工程杂志, 2019, 39(5):96-104.
DU L, SU L Q, WU J.Enhancing maltose affinity of Bacillus circulans 251 β-CGTase and its application in trehalose preparation[J].China Biotechnology, 2019, 39(5):96-104.