辣蓼草(Polygonum hydropiper L.)是蓼科蓼属一年生草本植物。我国有13个蓼属约238种[1],属种超过了世界属种的1/4。早在公元1100年,宋代《本草衍义》记载:“水蓼大概与水荭相似,今造酒取叶,以水浸汁,和面作曲,亦取其辛耳。”说明了“蓼”在酒曲中的应用[2]。辣蓼草是制作酒药(又称小曲、白药等)的重要原材料之一,酒药是米酒、黄酒酿造过程重要的糖化剂兼发酵剂[3]。
辣蓼草具有高生物活性和营养价值[4],因为其含有芦丁(rutin)、金丝桃苷(hyperoside)、槲皮素(quercetin)等黄酮类物质[5],以及水蓼二醛(polygodial)、异水蓼二醛(isotadeonal)、密叶辛木素(confertifolin)等倍半萜物质[6],可以起到抗氧化[7]、抑菌[8]、防腐防虫[9]的重要作用。目前在辣蓼草酒药的研究中,赵申升等[10]研究了辣蓼草提取液对米曲霉和酵母的生长均有促进作用,可以缩短酿酒酵母生长对数期,延长稳定期。吴琼燕[11]探究了0.3%~0.7%的辣蓼草对根霉生长和糖化能力、酵母生长和发酵能力具有促进作用。陈辉等[12]在新化水酒酒药的制作工艺中,加入6%的辣蓼草,使得新化酒药的糖化力和发酵力大大提升。酒药富含多种微生物,CHEN等[13]采用宏基因组测序揭示酒药主要由片球菌属(Pediococcus)、魏斯氏菌属(Weissella)、复膜孢酵母属(Saccharomycopsis)和根霉属(Rhizopus)组成。杨晨[14]基于扩增子测序解析了酒药中的核心微生物为扣囊复膜酵母(Saccharomycopsis fibuligera)、小孢根霉(Rhizopus microsporus)、酿酒酵母(Saccharomyces cerevisiae)和戊糖片球菌(Pediococcus pentosaceus)等,并选育出了以上微生物,为酒药关键微生物的解析奠定基础。片球菌属、魏斯氏菌属等乳酸菌在酒药发酵阶段主要作用为产酸,为发酵提供酸性的环境,以及产生蛋白酶、脂肪酶和纤维素酶等酶类[15]。根霉属、毛霉属以及复膜孢酵母属等可以分泌糖化酶和蛋白酶等有利于淀粉糖化、蛋白质分解,为酿酒酵母等微生物提供碳源[16]。这些关键微生物的培养繁殖将显著提高酒药的理化品质。
在辣蓼草对微生物的早期研究中,主要集中在根霉和酿酒酵母,而对于其他关键微生物(如片球菌、魏斯氏菌、扣囊复膜酵母、非酿酒酒母等)的研究还相对不足。此外,现有研究中辣蓼草使用部位不明晰,植物的叶、茎和根在有效成分和含量上存在差异,不同的使用部位和添加量可能对微生物的生长产生不同程度的影响。
本研究首先采用基础培养基体系,探究辣蓼草不同部位和添加量对8株不同单一微生物生长的影响,并在真实酒药发酵体系中验证结果的一致性,旨在全面分析辣蓼草对酒药关键微生物的调控作用和稳定作用,以及酒药品质的提升作用。
1 材料与方法
1.1 材料
1.1.1 原料
辣蓼草,采于浙江省宁波市奉化区。植物全株约80~100 cm,每株平均分成4段,每段约20~30 cm(见图1右),上层的叶(AY)和茎(AJ),中层的叶(BY)和茎(BJ),下层叶(CY)和茎(CJ),以及底部(D)。籼米粉和麦麸,无锡新米市。母曲酒药粉(JY),古越龙山绍兴酒股份有限公司。

图1 辣蓼草(左)和全株4段示意图(右)
Fig.1 Polygonum hydropiper L.(left) and whole plant 4 segments (right)
1.1.2 供试菌株
本实验室前期从酒药中选育出的重要微生物:戊糖片球菌(Pediococcus pentosaceus CCTCC NO:M20232209)、食窦魏斯氏菌(Weissella cibaria)、酿酒酵母(Saccharomyces cerevisiae CCTCC NO:M2021525)、扣囊复膜酵母(Saccharomycopsis fibuligera CCTCC NO:M20221276)、小孢根霉(Rhizopus microsporus CCTCC NO:M20232210)、印度毛霉(Mucor indicus CCTCC NO:M20231800)和卷枝毛霉(Mucor circinelloides)。以上微生物皆由江南大学传统酿造食品研究中心提供。
1.1.3 培养基
肉汤液体和固体培养基(de Man, Rogosa an Medium,MRS):本品52.24 g/L(固体加入琼脂15 g/L)。
PDA培养基:本品26.0 g/L(固体加入琼脂15 g/L)。以上培养基均121 ℃灭菌20 min,青岛海博生物技术有限公司。
分别将辣蓼草叶和茎的4个部分磨碎后过50目筛,160 ℃干热灭菌数份备用。在超净台中准确称取各部分0、75、150、225、300、900 mg倒入每个平板。将已灭菌的MRS和PDA固体培养基冷却至45 ℃左右加15 mL于各平板充分混匀,配制成终质量分数为0%、0.5%、1%、1.5%、2%、6%辣蓼草含量固体培养基,以不添加为空白对照。
马铃薯-淀粉培养基:马铃薯浸粉5 g/L,可溶性淀粉20 g/L,加热溶化,每个锥形瓶分装100 mL,121 ℃灭菌20 min之后,添加干热灭菌的辣蓼草叶配制成0%、0.5%、1%、1.5%、2%、6%(质量分数)培养基,以不添加为空白对照。
大米糖化液发酵培养基:米∶水=1∶4,加入1%(体积分数)糖化酶,1%(体积分数)液化酶,60 ℃下糖化4 h以上,直到12 Brix。每个锥形瓶分装100 mL,121 ℃灭菌20 min。添加干热灭菌的辣蓼草叶配制成0%、0.5%、1%、1.5%、2%、6%(质量分数)浓度培养基,以不添加为空白对照。α-淀粉酶液≥3 500 U/mL,上海源叶生物科技有限公司;淀粉葡糖苷酶液≥10万 U/mL,北京伊诺凯科技有限公司。
1.1.4 仪器与设备
CT115A全自动高压蒸汽灭菌器,上海伯能仪器有限公司;ZXGP-B2080隔水恒温培养箱,上海智城分析仪器制造有限公司;VS-840K-U超净工作台,苏州安泰空气技术有限公司;Universal Hood II凝胶成像系统,美国伯乐公司;DYY-6C电泳仪,北京六一仪器厂;Q5000超微量核酸蛋白测定仪,美国Quawell公司;JC-FW-400A粉碎机,青岛聚创环保集团有限公司;GZX-9146MBE电热鼓风箱,上海博讯医疗设备厂;酒曲固态发酵箱,江南大学传统酿造食品研究中心;游标卡尺、糖度计等。
1.2 实验方法
1.2.1 辣蓼草对单一菌株的生长影响
无菌条件下,从甘油管中分离纯化戊糖片球菌和食窦魏斯氏菌,涂布至MRS固体培养基中,进行分离纯化。挑取单菌落接入25 mL MRS液体培养基中,在37 ℃下,180 r/min振荡培养24 h。使用无菌水稀释10-7倍的稀释液,吸取100 μL稀释液分别均匀涂布于不同辣蓼草部位添加量的固体培养基上。在37 ℃下培养24 h,同一时刻进行菌落计数。
从甘油管中分离纯化霉菌和酵母菌株,至PDA固体培养基中,进行分离纯化。将酵母菌挑取单菌落,接种到25 mL PDA液体培养基中,在28 ℃下,180 r/min振荡培养约24 h。使用无菌水稀释10-7倍的稀释液,将100 μL稀释液分别均匀涂布于不同辣蓼草部位添加量的固体培养基上。在培养箱28 ℃下培养48 h,同一时刻对菌落进行计数。霉菌接种至PDA斜面保藏管培养完成后,在超净台中加入无菌水洗涤孢子,吸取5 μL孢子悬浮液,滴于上述平板中央。在培养箱28 ℃下培养48 h,同一时刻对平板上菌落的直径(mm)进行测量。以上实验均设3次重复。
1.2.2 辣蓼草对单一菌株糖化力、发酵力的影响
选取酒药中选育的具有糖化能力的小孢根霉、印度毛霉、卷枝毛霉、扣囊复膜酵母。参考吴琼燕[11]的方法并略做修改,按1%(体积分数)接种量接种1×107 CFU/mL同浓度霉菌孢子悬液和扣囊复膜酵母种子液于100 mL不同辣蓼草叶添加量的马铃薯-淀粉液体培养基中,在30 ℃,300 r/min,每隔12 h分别吸取不同浓度发酵液2 mL,经10 000 r/min,5 min离心后,取上清液测定淀粉残留量。
酿酒酵母以1%(体积分数),1×107 CFU/mL接种于100 mL不同辣蓼草(AY)添加量的12 Brix大米糖化液培养基中,塞紧发酵栓,设置空白对照,记录初始重量W0,然后于30 ℃恒温培养72 h,每12 h晃动放气,结束时振荡充分,称重W1,计算得出CO2失重累计量[17]。以上实验均设3次重复。
1.2.3 新型酒药小曲扩培工艺
采用ZHU等[18]发酵酒药小曲的工艺,制作不同辣蓼草添加量酒药。1)按照表1原料配比,将籼米粉、麦麸及4/5总量的母曲酒药粉混合均匀;2)再将现配制好的辣蓼草浸汁缓慢地加入培养料中,边搅拌边加入,并将成团的培养料过筛(10目);3)在带有小孔(直径20 mm)的曲框(30 cm×10 cm)中垫4层纱布后,进行落料,并表面均匀地撒上余下1/5的母曲酒药粉,之后放入酒曲固态发酵箱中,温度设为(30±2) ℃,湿度设置为90%~95% RH;4)进行48 h发酵完成后,放置于烘箱38 ℃,15 h烘干至水分在8%~10%,即为成品酒药。
表1 不同辣蓼草添加量扩培酒药原料配比
Table 1 The raw material ratio of Jiuyao with different amount of Polygonum hydropiper L.
名称添加量/kg比例/%(质量分数)清水1100辣蓼草粉(AY)0~0.060,0.5,1,1.5,2,6籼米粉2200麦麸0.660母曲酒药粉(JY)0.066
酒药使用四分法取样后检测理化指标。糖化力、液化力、发酵力指标采用国标QB/T 4257—2011《酿酒大曲通用分析方法》检测;酸性蛋白酶活采用GB/T 23527.1—2023《酶制剂质量要求 第1部分:蛋白酶制剂》方法检测。
1.2.4 三代扩增子测序及分析
酒药样品邮寄至百迈客生物科技进行DNA提取与建库测序。通过DADA2进行质量过滤、去噪、合并和去除嵌合体[19]。使用特征分类器插件中的classify-sklearn朴素贝叶斯分类器对Silva(版本138)和UNITE(版本8.0)数据库将分类分配给ASV[20]。按照99%相似度对ASV进行聚类划分,得到的代表性序列被注释为不同分类水平下的分类组成,对超过1%的未分类结果进行代表性序列提取并进行BLAST检验,采用NT数据库比对,选择得分最高的比对结果,并对应重制ASV表,QIIME2可视化处理后进行微生物群落分析。使用SPSS和Canoco5软件进行理化指标与微生物群落相关性分析及冗余分析(redundancy analysis,RDA)。
1.2.5 实时荧光定量PCR分析生物量
采用改良的CTAB法提取酒药总DNA。利用琼脂糖凝胶电泳和核酸蛋白测定仪对提取的DNA进行质量检测。采用陶京兰等[21]的方法进行RT-qPCR扩增体系和程序,总细菌上下游引物(CCTACGGGAGGCAGCAG;ATTACCGCGGCTGCTGG)、总真菌上下游引物(GCGGTAATTCCAGCTCCAATA;GCCACAAGGACTCAAGGTTAG)。样品分析3次,取平均Ct值计算总生物量。根据RT-qPCR的总细菌和总真菌的生物量,以及酒药的微生物群落结构分析,得出酒药中主要菌种的生物量,计算如公式(1)所示:
生物量/(CFU/g)=细菌/真菌总数×微生物平均丰度
(1)
2 结果与分析
2.1 辣蓼草对酒药关键微生物生长和功能的影响
2.1.1 辣蓼草不同部位及添加量对单一菌株生长的影响
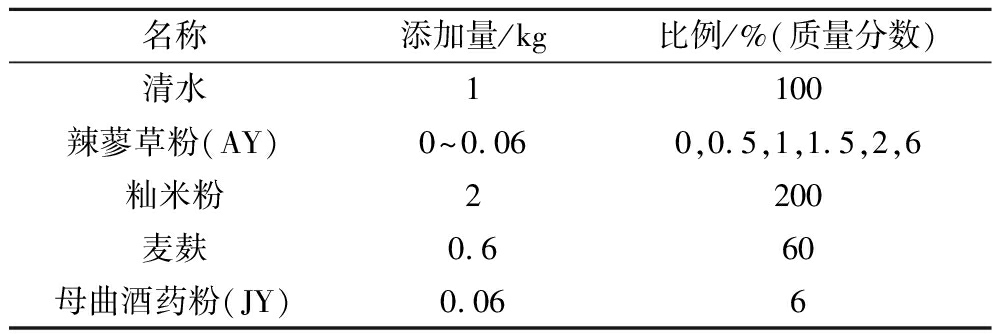
辣蓼草叶(AY)和茎(AJ)对酒药中关键细菌、酵母和霉菌的生长大致呈现低浓度促进、高浓度抑制的效果,程度大小有所不一,除了扣囊复膜酵母特殊,菌落数随着辣蓼草添加量的增加而增加。
图2所示,对于细菌,无论AY还是AJ的最佳添加量均为1.5%,此浓度下食窦魏斯氏菌菌落分别增长50.0%和30.0%左右;戊糖片球菌则没有显著增长(P<0.05)。对于酵母,扣囊复膜酵母菌在AY和AJ的添加量为6%时,分别增长38.7%和21.0%左右。酿酒酵母在AY和AJ的添加量为1.5%时,菌落分别增长55.7%和40%左右。与江威等[22]的研究结果中辣蓼草对酵母菌落增加幅度为47.7%较为一致。AY和AJ的添加量为1%时,异常威克汉姆酵母分别增长16.8%和11%左右。
a-辣蓼叶AY;b-辣蓼茎AJ
图2 辣蓼叶和茎添加量对细菌和酵母生长的影响;
Fig.2 Effects of Polygonum hydropiper L.leaf and stem contents on the growth of bacteria and yeast
注:与空白组的显著性差异*P<0.05,**P<0.01(下同)。
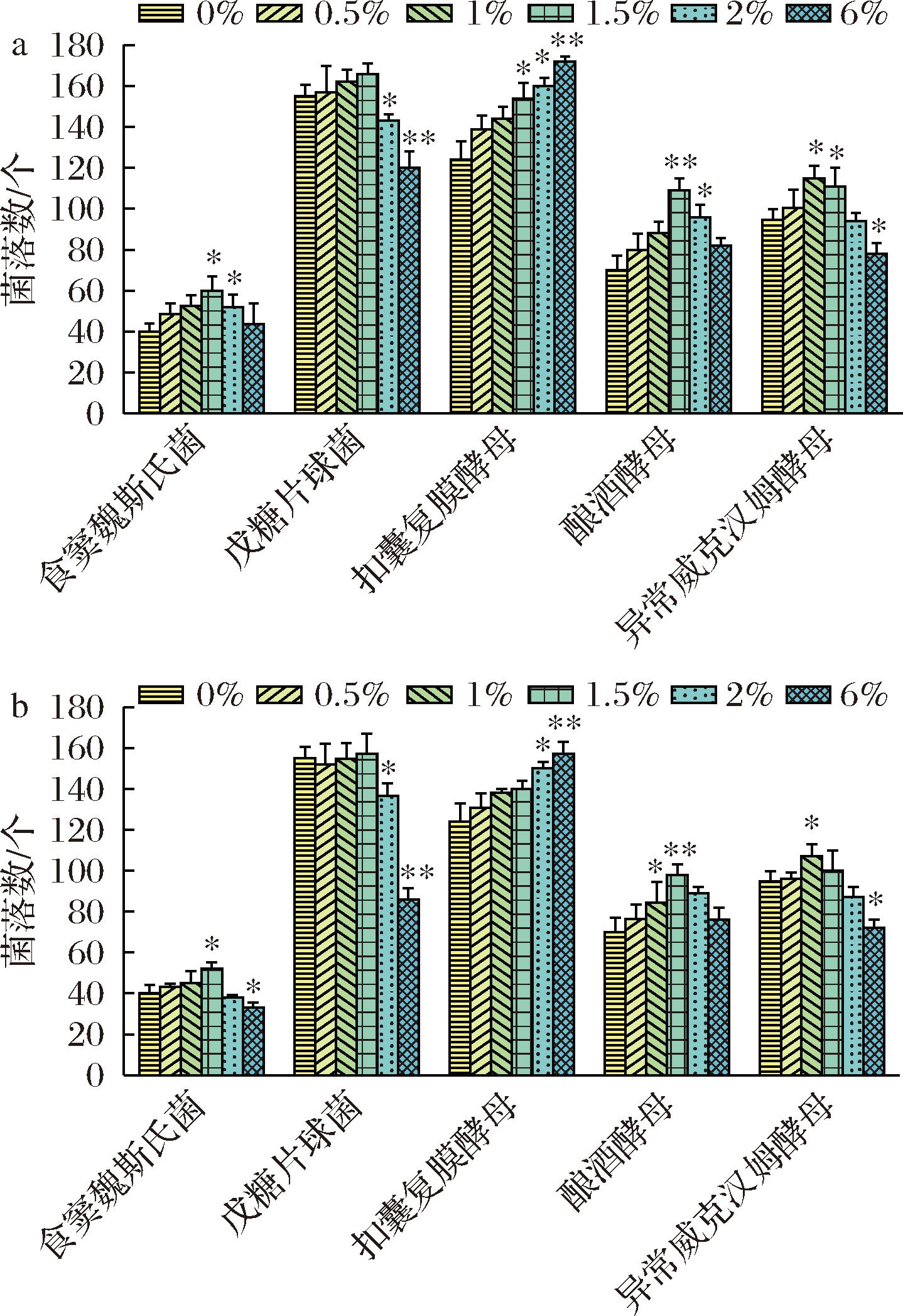
如图3所示,对于霉菌,小孢根霉受辣蓼草的促进作用显著。在1.5%的AY和AJ添加量时,小孢根霉直径分别增长14.0%和12.7%左右,印度毛霉直径分别增长3.4%和1.9%左右;对于卷枝毛霉的影响较小。微生物代谢产生的蛋白酶、纤维素酶和果胶酶等酶类能够破坏植物的细胞结构,将其降解为微生物可利用的糖和氨基酸等小分子物质[23],从而促进微生物生长。
a-辣蓼叶AY;b-辣蓼茎AJ
图3 辣蓼叶和茎添加量对霉菌生长的影响
Fig.3 Effects of Polygonum hydropiper L.leaf and stem contents on the growth of mold
根据以上结果,1.5%辣蓼草添加量对菌株生长促进显著,作为对比,以此浓度进一步探究辣蓼草其他部位对酒药中关键微生物的生长能否有相同的促进作用。表2结果表明,BY部分对食窦魏斯氏菌、扣囊复膜酵母、酿酒酵母、小孢根霉、印度毛霉这5株菌具有显著促进作用;BJ部分只对酿酒酵母具有显著促进生长作用;辣蓼草C、D部分对酒药关键微生物则没有显著促进作用。可能因为B、C、D部分的茎木质化较严重,微生物难以分解利用。而且茎不易粉碎,故舍弃不用。综上所述,在基础培养基体系同等1.5%辣蓼草添加量的条件下,AY作用最强,其次为AJ和BY,它们对酒药关键微生物生长具有显著促进作用,其中对酿酒酵母和食窦魏斯氏菌的作用较大,其次是扣囊复膜酵母和小孢根霉。
表2 辣蓼草其余部位对各菌株的生长影响
Table 2 Effects of the rest parts of Polygonum hydropiper L.on the growth of strains
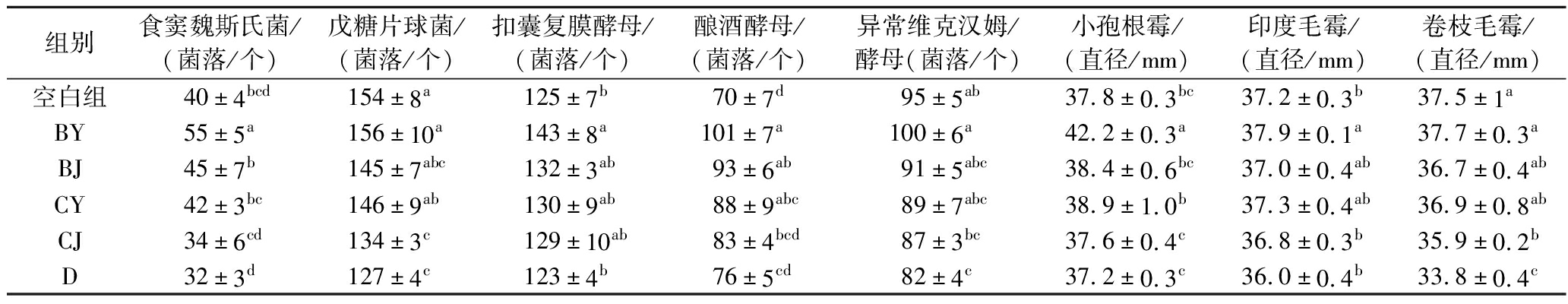
组别食窦魏斯氏菌/(菌落/个)戊糖片球菌/(菌落/个)扣囊复膜酵母/(菌落/个)酿酒酵母/(菌落/个)异常维克汉姆/酵母(菌落/个)小孢根霉/(直径/mm)印度毛霉/(直径/mm)卷枝毛霉/(直径/mm)空白组40±4bcd154±8a125±7b70±7d95±5ab37.8±0.3bc37.2±0.3b37.5±1aBY55±5a156±10a143±8a101±7a100±6a42.2±0.3a37.9±0.1a37.7±0.3aBJ45±7b145±7abc132±3ab93±6ab91±5abc38.4±0.6bc37.0±0.4ab36.7±0.4abCY42±3bc146±9ab130±9ab88±9abc89±7abc38.9±1.0b37.3±0.4ab36.9±0.8abCJ34±6cd134±3c129±10ab83±4bcd87±3bc37.6±0.4c36.8±0.3b35.9±0.2bD32±3d127±4c123±4b76±5cd82±4c37.2±0.3c36.0±0.4b33.8±0.4c
注:小写字母不同表示差异显著(P<0.05),下同。大写字母表示:辣蓼草中层的叶(BY)和茎(BJ),下层叶(CY)和茎(CJ),以及底部(D)。
2.1.2 辣蓼草对菌株糖化力和发酵力的影响
中浓度(1~2%)辣蓼草(AY)对小孢根霉(图4-a)和印度毛霉(图4-b)分解淀粉的能力有明显促进作用,以1.5%辣蓼草添加量效果最好,72 h后培养基中淀粉残留量分别比空白组低了47.6%和48.8%。辣蓼草对卷枝毛霉(图4-c)有较大的抑制作用,72 h后含6%辣蓼草培养基中淀粉残留量比空白组多了约2.83 g/L;而辣蓼草对扣囊复膜酵母的糖化能力几乎无影响,最终培养基中淀粉几乎被消耗殆尽(图4-d)。

a-小孢根霉;b-印度毛霉;c-卷枝毛霉;d-扣囊复膜酵母;e-酿酒酵母
图4 辣蓼草添加量对小孢根霉、印度毛霉、卷枝毛霉、扣囊复膜酵母糖化力及酿酒酵母发酵力的影响
Fig.4 The effect of the amount of Polygonum hydropiper L.on the saccharification ability of Rhizopus microsporus, Mucor Indicus, Mucor circinelloides, Saccharomycopsis fibuligera and the fermentation ability of Saccharomyces cerevisiae
酿酒酵母(图4-e)在不同辣蓼草含量的大米糖化液中,发酵力随着发酵时间的变化趋势是一致的。12~24 h期间酵母发酵最强,尤其在1.5%辣蓼草添加量的培养基中发酵最为旺盛,72 h时CO2累计质量为(4.54±0.096) g/100 mL,比空白组增加5.3%。
2.2 不同辣蓼草添加量酒药的微生物群落结构分析
对母曲酒药的测序结果中,除了卷枝毛霉的丰度较低没有列出,其他7株关键微生物在酒药中均有较高的丰度。选取丰度靠前的10种主要细菌和真菌的种水平进行结构分析。图5显示,母曲酒药的细菌群落中片球菌属是主要优势微生物,占群落总体的90%左右,同时包括7%左右的食窦魏斯氏菌,说明它们是酒药中的关键细菌。在0%和0.5%辣蓼草添加量的扩培酒药中,细菌种类较多,芽孢杆菌和泛菌的丰度较高,且出现了假单胞菌等杂菌,而在其他更高添加量辣蓼草酒药中丰度很低,说明辣蓼草起到了抑制其他杂菌生长的作用。在1.5%和2%辣蓼草添加量的扩培酒药中食窦魏斯氏菌丰度较高(4%~7%)。戊糖片球菌的丰度几乎不受辣蓼草添加量的变化影响。
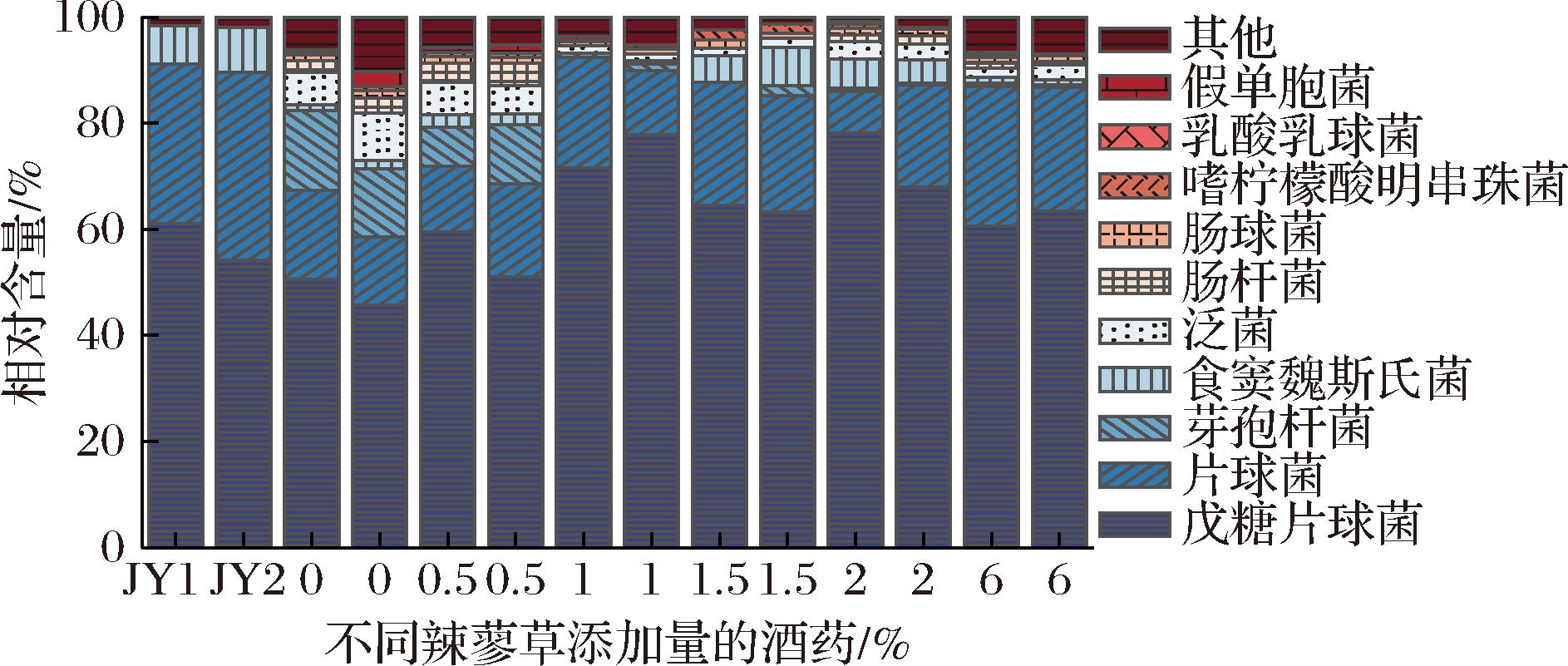
图5 细菌群落种水平结构
Fig.5 The community species-level structure of bacteria
图6显示,母曲酒药中扣囊复膜酵母丰度约为70%,其余主要由根霉属和酿酒酵母属。扩培酒药中,真菌种水平的丰度差异较大。添加0%和添加0.5%辣蓼草的酒药中真菌群落组成较为单一。在1%和1.5%辣蓼草添加量的扩培酒药中,少根根霉(Rhizopus arrhizus)丰度变化较大(30%~60%),可能是因为此添加量大大促进了其生长繁殖,而更高辣蓼草添加量下,其丰度则减小。此外,中等辣蓼草添加量(1%~2%)的酒药中,出现了曲霉属和其他非酿酒酵母属微生物,使得真菌微生物多样性更为丰富。
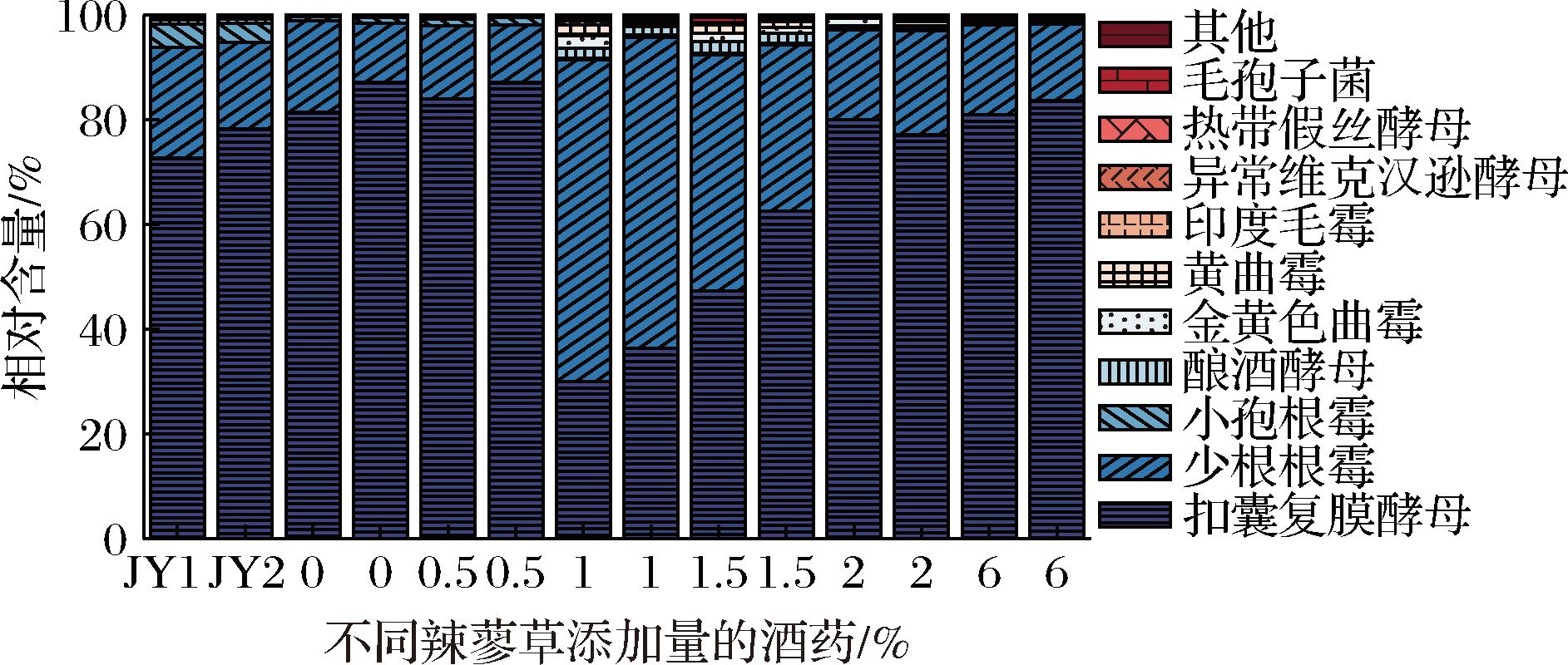
图6 真菌群落种水平结构
Fig.6 The community species-level structure of fungi
2.3 不同辣蓼草添加量对酒药中微生物生物量的影响
2.3.1 荧光定量PCR分析结果
如图7所示,熔解曲线呈现单一熔解峰,说明无引物二聚体及非特异性产物;曲线平稳,说明各浓度质粒的熔解温度均一,扩增产物特异性好。标准曲线线性较好,斜率均在标准范围内。

a-细菌;b-真菌
图7 细菌、真菌标准曲线及熔解曲线
Fig.7 Standard curves and melting curves of bacteria and fungi
由表3可知,母曲酒药中细菌的生物量约为8.08 lg copies/g;真菌生物量约为7.34×107 lg copies/g。扩培酒药中,6%辣蓼草添加量的酒药中细菌生物量最低。研究发现适量的辣蓼草可以促进酒药中真菌的生长,辣蓼草添加量为0%时,酒药中真菌生物量最低约为6.71 lg copies/g。辣蓼草添加量为1.5%时,真菌生物量最多为7.38 lg copies/g。说明添加辣蓼草能够显著改变酒药中细菌和真菌的生物量。
表3 酒药中总细菌和总真菌的生物量
Table 3 Biomass of total bacteria and fungi in Jiuyao
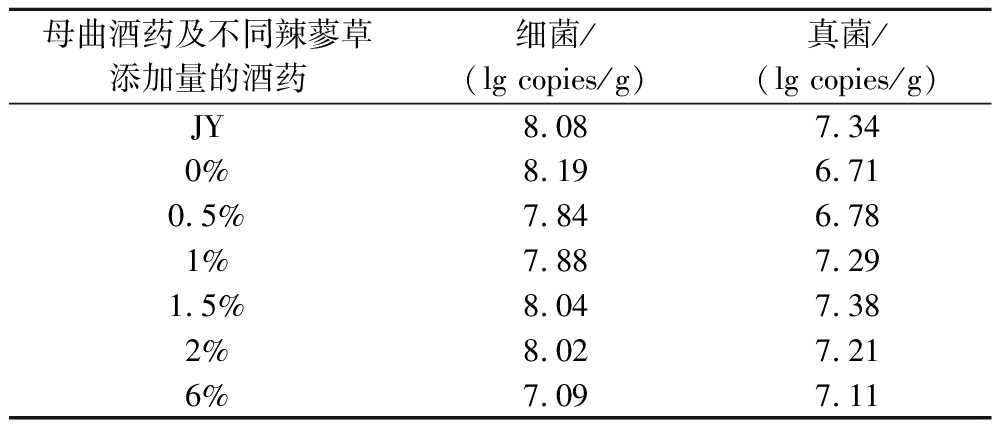
母曲酒药及不同辣蓼草添加量的酒药细菌/(lg copies/g)真菌/(lg copies/g)JY8.087.340%8.196.710.5%7.846.781%7.887.291.5%8.047.382%8.027.216%7.097.11
2.3.2 酒药中主要细菌和真菌的生物量分析
由表4可知,酒药细菌中,戊糖片球菌的生物量随着辣蓼草添加量增多而增多,添加2%辣蓼草的酒药中戊糖片球菌生物量最多是7.66×107 CFU/g,而基础培养基中(图2-a)辣蓼草对戊糖片球菌则没有显著的促进生长效果。芽孢杆菌在低辣蓼草添加量下(0~0.5%)生物量较高。食窦魏斯氏菌的数量变化与基础培养基中的研究结果具有一致性,在辣蓼草的添加量为1.5%时促进其生长,生物量为6.67×106 CFU/g。
表4 酒药中的主要细菌生物量 单位:CFU/g
Table 4 Biomass of main bacteria in Jiuyao
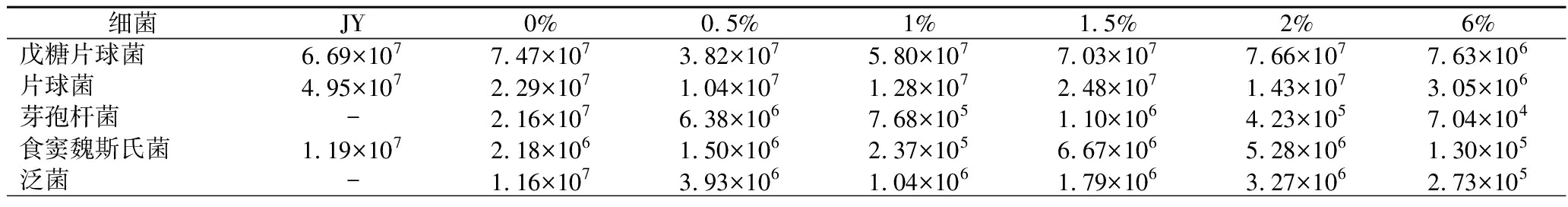
细菌JY0%0.5%1%1.5%2%6%戊糖片球菌6.69×1077.47×1073.82×1075.80×1077.03×1077.66×1077.63×106片球菌4.95×1072.29×1071.04×1071.28×1072.48×1071.43×1073.05×106芽孢杆菌-2.16×1076.38×1067.68×1051.10×1064.23×1057.04×104食窦魏斯氏菌1.19×1072.18×1061.50×1062.37×1056.67×1065.28×1061.30×105泛菌-1.16×1073.93×1061.04×1061.79×1063.27×1062.73×105
续表4

细菌JY0%0.5%1%1.5%2%6%肠杆菌-3.88×1062.74×106--1.55×1061.07×105肠球菌-1.99×1068.20×1056.57×1051.36×1061.28×1061.22×105嗜柠檬酸明串珠菌-9.39×105--1.98×1063.93×1055.50×104乳酸乳球菌--5.25×1059.22×104-3.82×1052.94×104假单胞菌-2.60×1068.83×1055.83×105---
由表5可知,酒药真菌中,扣囊复膜酵母的生物量随着辣蓼草添加量增多而增多,图6显示在1%和1.5%辣蓼草添加量的扩培酒药中扣囊复膜酵母丰度略有减少,但其生物量并没有显著降低。1.5%辣蓼草添加量对酿酒酵母和异常维克汉逊酵母促进生长效果最佳,生物量分别为4.79×105、5.57×104 CFU/g,与基础培养基的研究结果较为一致。辣蓼草添加量的增多对小孢根霉丰度和生物量影响不大;对印度毛霉表现出低浓度促进高浓度抑制生长的效果,1%辣蓼草添加量时生物量最多是1.02×105 CFU/g。关键功能菌株生物量的变化将会引起酒药理化性质的变化。
表5 酒药中主要真菌生物量 单位:CFU/g
Table 5 Biomass of main fungi in Jiuyao

真菌JY0%0.5%1%1.5%2%6%扣囊复膜酵母1.69×1074.32×1065.28×1066.48×1061.32×1071.30×1071.09×107少根根霉4.22×1067.44×1057.72×1051.18×1079.22×1063.07×1062.10×106小孢根霉9.14×1054.59×1047.89×1047.29×1047.45×1047.18×1043.30×104酿酒酵母1.76×1056.33×1031.07×1043.39×1054.79×1057.90×1044.52×104金黄色曲霉3.08×1044.16×1037.45×1032.88×1053.33×1051.83×1052.77×104黄曲霉2.12×1045.64×1021.98×1032.66×1053.29×1053.22×1042.43×104印度毛霉1.56×1045.15×1031.75×1031.02×1051.67×1048.24×1031.07×104异常维克汉逊酵母2.35×1043.96×1026.61×1023.21×1045.57×1049.96×1031.06×104热带假丝酵母1.71×1047.92×1028.76×1023.21×1049.45×1031.99×1031.45×103毛孢子菌1.82×1042.21×1035.05×1035.37×1041.97×1054.33×1042.52×104
2.4 不同辣蓼草添加量对扩培酒药理化指标的影响
由表6可知,1.5%辣蓼草添加量的酒药糖化力和液化力指标比空白组(0%)提高了214.6%和57.1%。1%和1.5%辣蓼草添加量的酒药液化力无显著差异,分别为(0.866 1±0.018 6) U/g,(0.837 1±0.026 6) U/g。在酸性的蛋白酶活和发酵力两个指标上相比母曲酒药(JY)整体偏低,但能够正常起酵(在1%~2%辣蓼草添加量下)。
表6 酒药的理化指标
Table 6 The physicochemical indicators of Jiuyao
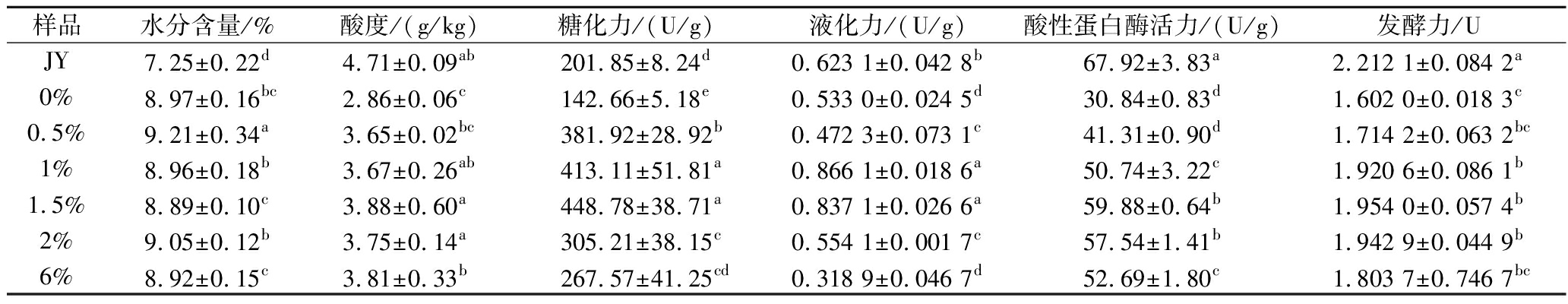
样品水分含量/%酸度/(g/kg)糖化力/(U/g)液化力/(U/g)酸性蛋白酶活力/(U/g)发酵力/UJY7.25±0.22d4.71±0.09ab201.85±8.24d0.623 1±0.042 8b67.92±3.83a2.212 1±0.084 2a0%8.97±0.16bc2.86±0.06c142.66±5.18e0.533 0±0.024 5d30.84±0.83d1.602 0±0.018 3c0.5%9.21±0.34a3.65±0.02bc381.92±28.92b0.472 3±0.073 1c41.31±0.90d1.714 2±0.063 2bc1%8.96±0.18b3.67±0.26ab413.11±51.81a0.866 1±0.018 6a50.74±3.22c1.920 6±0.086 1b1.5%8.89±0.10c3.88±0.60a448.78±38.71a0.837 1±0.026 6a59.88±0.64b1.954 0±0.057 4b2%9.05±0.12b3.75±0.14a305.21±38.15c0.554 1±0.001 7c57.54±1.41b1.942 9±0.044 9b6%8.92±0.15c3.81±0.33b267.57±41.25cd0.318 9±0.046 7d52.69±1.80c1.803 7±0.746 7bc
2.5 群落结构与酒药理化指标相关性分析
由表7可知,细菌群落多样性与酸度呈极显著正相关性(P<0.01),真菌群落多样性与糖化力、液化力、酸性蛋白酶活力呈显著正相关。
表7 酒药微生物多样性与理化指标相关性
Table 7 Correlation between microbial diversity and physicochemical indicators in Jiuyao
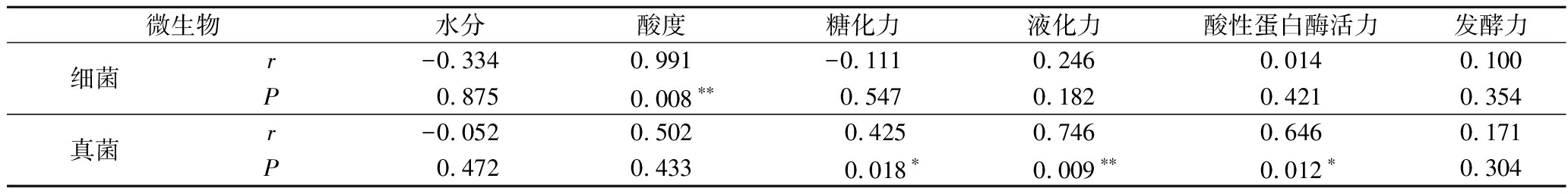
微生物水分酸度糖化力液化力酸性蛋白酶活力发酵力细菌r-0.3340.991-0.1110.2460.0140.100P0.8750.008∗∗0.5470.1820.4210.354真菌r-0.0520.502 0.4250.7460.6460.171P0.4720.4330.018∗0.009∗∗0.012∗0.304
酒药中主要的细菌种水平与其理化指标冗余分析如图8-a所示,大部分细菌与酸度显著相关,片球菌和肠杆菌与酸性蛋白酶活具有正相关性,芽孢杆菌与糖化力具有正相关性。

a-细菌;b-真菌
图8 细菌、真菌与酒药理化指标的冗余分析
Fig.8 The redundancy analysis of bacteria and fungi in relation to physicochemical indicators of Jiuyao
酒药中主要的真菌种水平与其理化指标冗余分析如图8-b所示,其中小孢根霉、少根根霉和扣囊复膜酵母与糖化力相关性最强,曲霉和毛霉与液化力相关性最强。酿酒酵母与发酵力相关性最强。群落结构丰度的变化明显地反映在酒药理化指标的波动上。
3 结论与讨论
辣蓼草拥有天然的辣味和丰富的活性物质,不同部位成分含量和组成复杂,除了黄酮、生物碱、挥发油和多糖等成分,还包含蛋白质、脂肪、微量元素、有机酸等。辣蓼草的添加部位和添加量显著影响到了酒药微生物的群落结构和生物量。
在基础培养基中,对8株不同菌株的生长研究发现,采用辣蓼草叶的效果比茎更为显著,全株最上端叶子AY部分(20~30 cm)效果最佳,工业上可使用辣蓼草的AY、AJ、BY三个部分作为生产原料。以水为基准,辣蓼草的添加量宜为1.5%(质量分数),即15 g/L辣蓼浸汁。此浓度使得酒药中总真菌生物量最大化,特别促进了关键功能微生物:酿酒酵母、扣囊复膜酵母、小孢根霉和印度毛霉等的生长代谢。扣囊复膜酵母对辣蓼草具有很强耐受性,也是在酒药中丰度占比很高的原因之一。
在真实的酒药发酵体系中,一些微生物与基础培养基中的表现存在差异。例如,在含有2%辣蓼草的基础培养基中,对于戊糖片球菌的作用显示为抑制,然而在酒药体系中,其生物量并未减少,反而有所增加。辣蓼草在基础培养基中对小孢根霉的生长影响显著,但在酒药体系中影响较小。相反,它对少根根霉的丰度影响更为显著。因此,后续计划从酒药中筛选少根根霉,并进行验证研究。酒药真实的发酵体系中微生物种类繁多,彼此之间存在复杂的相互作用,这导致与基础培养基中的研究结果有所差异。酒药中关键微生物与酒药的理化指标之间存在显著相关性,很大程度上影响了酒药的糖化力、液化力和发酵力等指标。
综上所述,辣蓼草在酒药小曲发酵过程中,能起到调控微生物群落结构及生物量的作用。然而,辣蓼草的添加量需要谨慎控制。添加过少可能无法有效抑制杂菌和促进关键微生物的生长,导致酒药容易发生变质和腐败。相反,添加过多则不利于大多数微生物的繁育,同时会增加酒的辛辣感。因此,适量的辣蓼草有助于维持关键微生物的生长和稳定传代,从而保持酒药品质的稳定性,并进一步确保酿酒过程中正常的糖化和发酵。
[1] 王永超, 韦琨, 林军.蓼属植物化学成分及药用活性研究新进展[J].广东化工, 2012, 39(9):16-17;19.
WANG Y C, WEI K, LIN J.Recent advances of chemical constituents and pharmacological activities of genus Polygonum[J].Guangdong Chemical Industry, 2012, 39(9):16-17;19.
[2] 何冰, 何以琳, 李品枬.“蓼” 为万曲之肇始考证[J].酿酒, 2022, 49(1):139-140.
HE B, HE Y L, LI P Z.Textual research on “Polygonum” as the origin of Qu[J].Liquor Making, 2022, 49(1):139-140.
[3] 赵国良. 绍兴黄酒酒药品质评价体系构建及其保藏条件的研究[D].大庆:黑龙江八一农垦大学, 2023.
ZHAO G L.Study on the quality evaluation system and storage conditions of Shaoxing Huangjiu JIUYAO[D].Daqing:Heilongjiang Bayi Agricultural University, 2023.
[4] TIN T M.Morphological, phytochemical investigation and nutritional values on leaves of polygonum hydropiper L[J].3rd Myanmar Korea Conference Research Journal, 2020, 3(3):1-8.
[5] 朱瑜, 吴建华, 杨剑, 等.辣蓼黄酮分离提取及3种黄酮类组分定量分析[J].辽宁中医药大学学报, 2019, 21(4):50-53.
ZHU Y, WU J H, YANG J, et al.Separation and extraction of flavonoids from PoLygonum hydropiper L.and quantitative analysis of three flavonoids[J].Journal of Liaoning University of Traditional Chinese Medicine, 2019, 21(4):50-53.
[6] 李挡挡. 天然倍半萜Drimenal的合成、结构优化及生物活性研究[D].南京:南京农业大学, 2017.
LI D D.Synthesis, structural optimization and biological activity of natural sesquiterpene Drimenal[D].Nanjing:Nanjing Agricultural University, 2017.
[7] 王开金, 张颖君, 杨崇仁.蓼属植物的化学成分与生物活性研究进展[J].天然产物研究与开发, 2006, 18(1):151-164.
WANG K J, ZHANG Y J, YANG C R.Recent advance on the chemistry and bioactivity of genus Polygonum[J].Natural Product Research and Development, 2006, 18(1):151-164.
[8] NASIR A, KHAN M, REHMAN Z, et al.Evaluation of alpha-amylase inhibitory, antioxidant, and antimicrobial potential and phytochemical contents of Polygonum hydropiper L[J].Plants, 2020, 9(7):852.
[9] 许龙, 邹玉, 王长平.辣蓼草提取物对玉米蚜的拒食活性[J].安徽农业科学, 2018, 46(15):126-127;142.
XU L, ZOU Y, WANG C P.Antifeedant activity of Polygonum hydropiper extract on corn leaf aphid[J].Journal of Anhui Agricultural Sciences, 2018, 46(15):126-127;142.
[10] 赵申升, 相飞, 汪立平, 等.辣蓼对酵母的影响及其在甜酒曲制作中的应用[J].食品研究与开发, 2017, 38(2):117-120.
ZHAO S S, XIANG F, WANG L P, et al.Effect of Polygonum hydropiper on yeast and its application in the production of rice wine starter[J].Food Research and Development, 2017, 38(2):117-120.
[11] 吴琼燕. 中草药对甜酒曲微生物发酵性能及酒酿香气成分研究[D].广州:华南农业大学, 2016.
WU Q Y.Study on microbial fermentation performance of Chinese herbal medicines on sweet koji and aroma components of fermented wine[D].Guangzhou:South China Agricultural University, 2016.
[12] 陈辉, 谢晶, 肖荣, 等.新化水酒辣蓼草酒药工艺技术研究[J].保鲜与加工, 2019, 19(4):136-140.
CHEN H, XIE J, XIAO R, et al.Processing technology of Polygonum lapathifolium L.var.salicifolium sihbth yeast for producing Xinhua watery wine[J].Storage and Process, 2019, 19(4):136-140.
[13] CHEN C, LIU Y, TIAN H X, et al.Metagenomic analysis reveals the impact of JIUYAO microbial diversity on fermentation and the volatile profile of Shaoxing-Jiu[J].Food Microbiology, 2020, 86:103326.
[14] 杨晨. 酒药品质的稳定性及制作过程中微生物和代谢物变化规律解析[D].无锡:江南大学, 2022.
YANG C.Analysis of the stability of Jiuyao quality and the change pattern of microorganisms andmetabolites in the production process[D].Wuxi:Jiangnan University, 2022.
[15] 肖蓓. 酱香大曲中细菌类群关系研究与功能细菌筛选[D].贵阳:贵州大学, 2015.
XIAO B.Research on the bacterial community relationship and functional bacterial screening in sauce-flavor Daqu[D].Guiyang:Guizhou University, 2015.
[16] ZHANG W D, REN Q, WANG Z C, et al.Analysis of the microbial community structure and volatile metabolites of JIUYAO in Fangxian, China[J].Fermentation, 2022, 8(12):754.
[17] 高永强, 徐大新.辣蓼草对机械化黄酒酵母菌的影响研究[J].酿酒, 2009, 36(6):67-68.
GAO Y Q, XU D X.Study on the effects of Polygonum hydropiper on the mechanization of yellow rice wine yeast[J].Liquor Making, 2009, 36(6):67-68.
[18] ZHU Y, LIU S P, MA D L, et al.Stabilization of Jiuyao quality for Huangjiu brewing by fortifying functional strains based on core microbial community analysis[J].Food Bioscience, 2023, 52:102370.
[19] CALLAHAN B J, MCMURDIE P J, ROSEN M J, et al.DADA2:High-resolution sample inference from Illumina amplicon data[J].Nature Methods, 2016, 13(7):581-583.
[20] BLASCHE S, KIM Y, MARS R A T, et al.Metabolic cooperation and spatiotemporal niche partitioning in a kefir microbial community[J].Nature Microbiology, 2021, 6(2):196-208.
[21] 陶京兰, 陆震鸣, 王宗敏, 等.实时荧光定量PCR监测镇江香醋醋酸发酵过程中微生物变化[J].食品与发酵工业, 2013, 39(2):156-160.
TAO J L, LU Z M, WANG Z M, et al.Detection of the variation of microorganisms in acetic acid fermentation of Zhenjiang aromatic vinegar through real-time quantitative PCR[J].Food and Fermentation Industries, 2013, 39(2):156-160.
[22] 江威, 李强, 唐洁, 等.中药材对清香型白酒主要酿造微生物及风味物质的影响[J].中国酿造, 2023, 42(2):89-94.
JIANG W, LI Q, TANG J, et al.Effects of Chinese medicinal materials on main brewing microorganisms and flavor components of light-flavor Baijiu[J].China Brewing, 2023, 42(2):89-94.
[23] 王春晓, 唐佳代, 吴鑫颖, 等.酿酒小曲中功能微生物的研究进展[J].食品科学, 2019, 40(17):309-316.
WANG C X, TANG J D, WU X Y, et al.Progress in research of functional microbes in xiaoqu, a Chinese traditional fermentation starter for liquor and rice wine[J].Food Science, 2019, 40(17):309-316.