高温堆积指的是在酿造酱香型及芝麻香型白酒过程中,原料在蒸煮糊化摊晾并添加高温大曲后,不立即入窖池发酵,而是在窖池旁边的场地上自然堆积一段时间,然后再将堆积的醅料入窖池发酵的过程[1-2]。芝麻香型沿用酱香型白酒堆积中“四高一长”的工艺,进一步丰富了芝麻香型白酒的典型风格[3-4]。堆积过程中不断富集空气中的酵母菌与细菌并不断增殖,霉菌逐渐死亡[5]。
目前国内对于白酒堆积过程的研究,主要集中于酱香型白酒堆积过程中的菌落演替规律、微生物群落多样性分析以及酒醅的理化指标变化等方面,有少量关于堆积高度、堆积时间对酒醅主要理化性质影响的研究。CHEN等[6]发现翻混酒醅导致酒醅不同层酸度和水分含量重新分布,微生物群落演替产生的生物热导致堆体温度快速持续升高。万清徽等[7]研究两种堆积醅对芝麻香型白酒发酵特性和香气品质的影响,解析了芝麻香堆积结束时表层及中层醅中微生物数量和糖化酶活力的规律。XU等[8]发现细菌属乳杆菌属和许多低丰度的真菌属促进了酯的合成,这些低丰度的真菌属对川芎嗪的产生也有重要贡献。刘宏基等[9]发现随着堆积高度的增加,酱香型酒醅的水分、酸度、还原糖和淀粉含量整体都呈现上升的趋势。李小东等[10]研究了芝麻香型白酒堆积发酵对入窖发酵过程及原酒品质的影响,发现堆积发酵结束时,表层酒醅微生物菌群数量巨大,单独取表层酒醅入窖后,酒醅升酸快,酵母菌下降迅速。
综合国内的相关研究可以发现,研究成果主要集中于堆积过程的菌体以及理化性质的变化,对于堆积过程的优化以及堆积结束时优劣的判断标准并没有深入的探究。本文旨在通过实验室模拟改变堆积过程中的条件,主要包括添加酒糟的比例、堆积过程中的温度、初始堆积酒醅的水分等,探究酒醅的菌落以及理化性质的变化,分析原酒的品质,得出最优的堆积条件以及影响较大的操作因素。
1 材料与方法
1.1 材料
1.1.1 原料
粉碎高粱、整粒高粱、稻壳、酒糟、酒曲,无锡市玉祁酒业有限公司。
1.1.2 试剂
乙酸、乙酸钠、酒石酸钾钠、五水硫酸铜、NaCl、NaOH、HCl、乳酸、酚酞、乙醇、次甲基蓝、亚铁氰化钾等试剂(分析纯),国药集团化学试剂有限公司;2.0%(质量分数,下同)乙酸正丁酯溶液(内标)、白酒36组分混标,兰州东立龙信息技术有限公司;YPD、营养琼脂培养基(NA)、MRS琼脂培养基,海博生物技术有限公司。
1.1.3 仪器与设备
SW-CJ2FD超净工作台,苏州净化气团安泰公司;SORVALL-ST-16R超高速冷冻离心机,赛默飞世尔科技有限公司;KQ5200E型超声波清洗器,昆山市超声仪器有限公司;CT90A型高压灭菌锅,上海伯能仪器有限公司;GC-2010 Plus气相色谱仪,日本 SHIMADZU公司;-70 ℃超低温冰箱,日本Sanyo公司;SPX-250B-Z型生化培养箱,上海博迅实业有限公司医疗设备厂;不锈钢蒸馏桶、堆积罐,酿酒蒸馏坊。
1.2 实验方法
1.2.1 堆积酒醅的实验室模拟制备[11-12]
1.2.1.1 润粮及蒸粮
先取粉碎的高粱1 800.0 g,加入1 260.0 mL(原料质量的70%)的70 ℃的蒸馏水,混匀,保鲜膜密封后润粮1 h 40 min,然后加360.0 g稻壳,混匀,继续润粮20 min,然后蒸粮40 min。
1.2.1.2 堆积发酵
将高粱摊晾,添加一定比例的酒糟以及酒曲,混匀,装入堆积罐,高30 cm,放入恒温培养箱48 h。堆积结束之后,将酒醅混匀,装入发酵罐中,保持无氧条件,放入30 ℃培养箱发酵30 d,期间测量发酵罐减重变化。
1.2.1.3 甑桶蒸馏
将发酵结束之后的酒醅混匀,取650.0 g的酒醅,加入65.0 g清蒸稻壳,混匀之后,放入蒸馏甑桶中,取头酒5 mL,中部酒25 mL,尾酒20 mL,其中头酒酒精度60°以上,中部酒度数为60°左右,尾酒酒精度为30°~40°。
1.2.2 酒醅理化指标的测定[13-14]
根据实验需求堆积48或72 h,定时取样测定,取样分上中下层,分别以堆积罐的10 cm为分界线,每层取10 g酒醅涂平板,计数微生物的数量,再留取50 g测量酒醅理化性质,包括酸度、还原糖、初始堆积、堆积结束时的淀粉含量。
1.2.3 乙醇含量测定
使用精确度为0.2的酒精计进行测定,取40.0 g发酵30 d酒醅,加120 mL 的蒸馏水,混匀,蒸馏冷凝,定容到75.0 mL,测定乙醇含量,测定乙醇溶液的温度,换算为20 ℃的乙醇体积分数。
1.2.4 有机代谢物质的测定[15]。
1.2.4.1 标准品测定
从兰州东立龙信息技术有限公司购入白酒36组分混标,测定物质包含庚酸乙酯、3-甲硫基丙醇、己酸、庚酸、异丁醛、正丙醇、乙酸乙酯、双乙酰、仲丁醇、异丁醇、丁酸乙酯、乙酸正丁酯(内标)、异戊酸乙酯、丙酸、乳酸乙酯、戊酸乙酯、乙醛、甲醇、异丙醇、1,2-丙二醇、异丁酸、正己醇、糠醛、乙缩醛、正丁醇、异丁酸乙酯、乙酸、异戊醇、丁酸、异戊酸、己酸乙酯、戊酸、丁酸异戊酯、2-乙基丁酸、β-苯乙醇、己酸异戊酯。
1.2.4.2 酒样预处理
取5 mL原酒,加70 μL内标乙酸正丁酯溶液,混匀后,超声30 min,4 ℃冰箱保存备用。
1.2.4.3 气相色谱分析条件
LZP-930色谱柱(长度30 m×内径0.32 mm;液膜厚度:1 μm);进样口温度220 ℃,FID检测器温度230 ℃;升温程序为:50 ℃保持6 min,再以5 ℃/min的速度升温至200 ℃,保持10 min;进样量为0.3 μL,分流比为10,载气为高纯氮气,尾吹流量30 mL/min,氢气流量40 mL/min,空气流量400 mL/min。
1.2.4.4 物质的相对定量
本次定量采用内标定量法。计算公式如公式(1)、公式(2)所示:
(1)
(2)
式中:Ai,混标中测定物质的峰面积;Cn,混标中内标的峰面积;An,混标中内标的峰面积;Ci,混标中测定物质的已知浓度;Ki,测定物质的相关常数系数;A′i,样品中待测样品的峰面积;C′i,待测物质相对含量,μg/g酒醅;C′n,内标的质量浓度,mg/L;A′n,样品中内标的峰面积;3.507,每g酒醅中萃取的样品mL数,mL/g酒醅。
1.2.5 原酒感官品评
最终酒样采用暗杯盲评的方法进行[16]。
1.2.6 不同原酒发酵的堆积条件
对不同堆积条件下酒醅进行发酵蒸馏,测定酒精产量和原酒风味成分,不同样品对应的堆积条件如表1所示。
表1 样品原酒的堆积条件
Table 1 The stacking conditions of sample base liquor
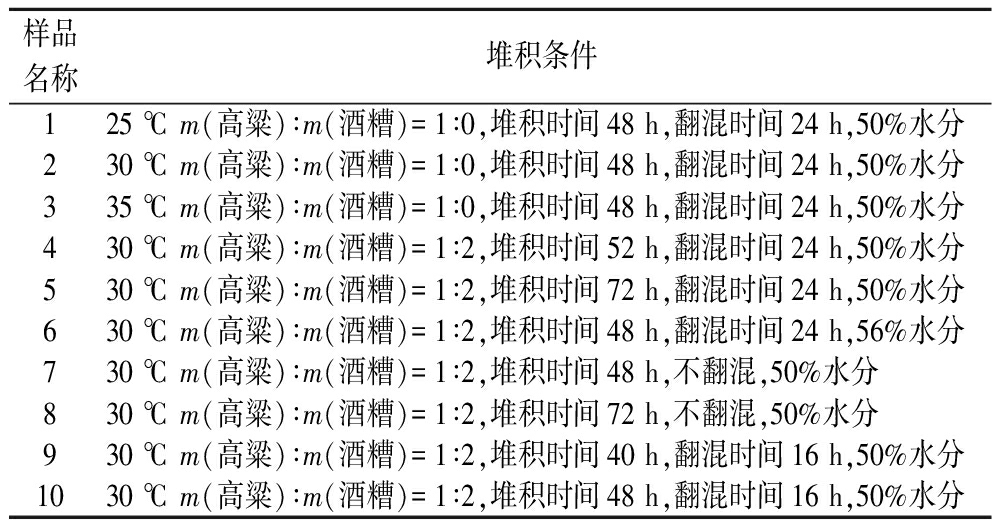
样品名称堆积条件125 ℃ m(高粱)∶m(酒糟)=1∶0,堆积时间48 h,翻混时间24 h,50%水分230 ℃ m(高粱)∶m(酒糟)=1∶0,堆积时间48 h,翻混时间24 h,50%水分335 ℃ m(高粱)∶m(酒糟)=1∶0,堆积时间48 h,翻混时间24 h,50%水分430 ℃ m(高粱)∶m(酒糟)=1∶2,堆积时间52 h,翻混时间24 h,50%水分530 ℃ m(高粱)∶m(酒糟)=1∶2,堆积时间72 h,翻混时间24 h,50%水分630 ℃ m(高粱)∶m(酒糟)=1∶2,堆积时间48 h,翻混时间24 h,56%水分730 ℃ m(高粱)∶m(酒糟)=1∶2,堆积时间48 h,不翻混,50%水分830 ℃ m(高粱)∶m(酒糟)=1∶2,堆积时间72 h,不翻混,50%水分930 ℃ m(高粱)∶m(酒糟)=1∶2,堆积时间40 h,翻混时间16 h,50%水分1030 ℃ m(高粱)∶m(酒糟)=1∶2,堆积时间48 h,翻混时间16 h,50%水分
2 结果与分析
2.1 不同添加酒糟比例对芝麻香型白酒堆积过程的影响研究
2.1.1 堆积过程中菌体数量变化以及理化指标变化分析
在添加酒糟以及仅用纯高粱堆积过程中,通过定时取样,对酒醅中菌体数量、酸度、还原糖以及初始堆积、堆积结束淀粉进行测定,各项指标变化如图1、表2所示。

a-酒醅细菌数量变化;b-酒醅酵母数量变化;c-酒醅酸度含量变化;d-酒醅还原糖含量变化
图1 不同添加酒糟比例下酒醅菌体数以及理化指标变化
Fig.1 Changes in the number of bacteria and physicochemical indexes of fermented grains under different proportions of added distiller’s grains
表2 不同添加酒糟比例下堆积前后酒醅淀粉含量变化
Table 2 Changes of starch content in fermented grains before and after stacking under different proportions of distiller’s grains
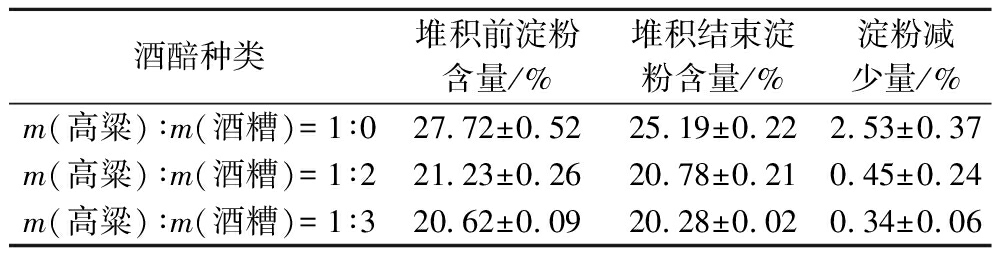
酒醅种类堆积前淀粉含量/%堆积结束淀粉含量/%淀粉减少量/%m(高粱)∶m(酒糟)=1∶027.72±0.5225.19±0.222.53±0.37m(高粱)∶m(酒糟)=1∶221.23±0.2620.78±0.210.45±0.24m(高粱)∶m(酒糟)=1∶320.62±0.0920.28±0.020.34±0.06
由图1-a和图1-b可以看出,当不添加酒糟进行堆积时,细菌数量远高于添加酒糟时的堆积过程,达到了9.10 lg CFU/g酒醅以上,这可能是由于添加酒糟之后,导致酒醅酸度提高,使一些不耐酸的菌体生长受到抑制。下层酒醅中酵母数量最少,仅用高粱堆积的酵母数量高于添加酒糟之后的混合酒醅,上层数量达到了9.05 lg CFU/g酒醅。图1-c和图1-d反应了酸度和还原糖不同变化趋势,仅用高粱堆积的过程中,酸度一直处于较低的含量,48 h之内处于缓慢上升过程,添加了酒糟之后,由于酒糟的酸度较高,导致混合酒醅的酸度同样升高。在30 h之后,酸度出现下降状态,上层酒醅下降幅度最大,最终酸度为0.50 mmol/10 g酒醅。通过ITS测序结果可知,酵母以伊萨酵母和异常威克汉姆酵母为主,其中伊萨酵母具有降低酒醅酸度的作用,这与WU等[17]研究结果一致;前期还原糖含量处于上升状态,在30 h之后,还原糖含量开始下降,最终还原糖含量为1.20%,这可能是由于前期菌体数量较少,酒醅中的糖化速率大于微生物利用还原糖的速率,所以还原糖含量上升;堆积后期菌体数量急速上升,微生物代谢活动增强,还原糖消耗速率大大提升,导致还原糖含量下降。表2反映了从初始堆积至结束时,淀粉一直处于下降状态,堆积过程中淀粉减少量较少,这与王庆宇等[18]研究结论相似。
2.1.2 堆积前后阶段混合酒醅的菌体测序结果
由图2-a可以看出两种不同酒醅堆积前都以芽孢杆菌为主要细菌,而堆积结束时仅用高粱堆积的酒醅中以魏斯氏菌属Weissella为优势菌种,而添加酒糟的混合酒醅中仍然以芽孢杆菌属Bacillus为优势菌种,芽孢杆菌具有高产淀粉酶以及糖化酶等作用,也是美拉德反应中不可或缺的一类菌种[19]。另外由图2-b可以反映出初始堆积时两种酒醅都以威克汉姆酵母属Wickerhamomyces以及曲霉属Aspergillus为主要真菌,堆积结束时仅用纯高粱堆积的主要真菌威克汉姆酵母属Wickerhamomyces和Cyberlindnera,其中Wickerhamomyces为产酯酵母,是目前已发现乙酸乙酯产量最高的菌株之一[20];而添加酒糟之后,堆积结束时优势菌种为伊萨酵母属Issatchenkia,为一种产酯生香酵母,并且有不错的产乙醇能力,具有较高的醇和酸抗性[21];结合图1-c,可以看出产酯酵母具有降酸转化为酯和醇的能力,推测添加酒糟之后酸度下降的原因可能是由于伊萨酵母分解酸的作用。
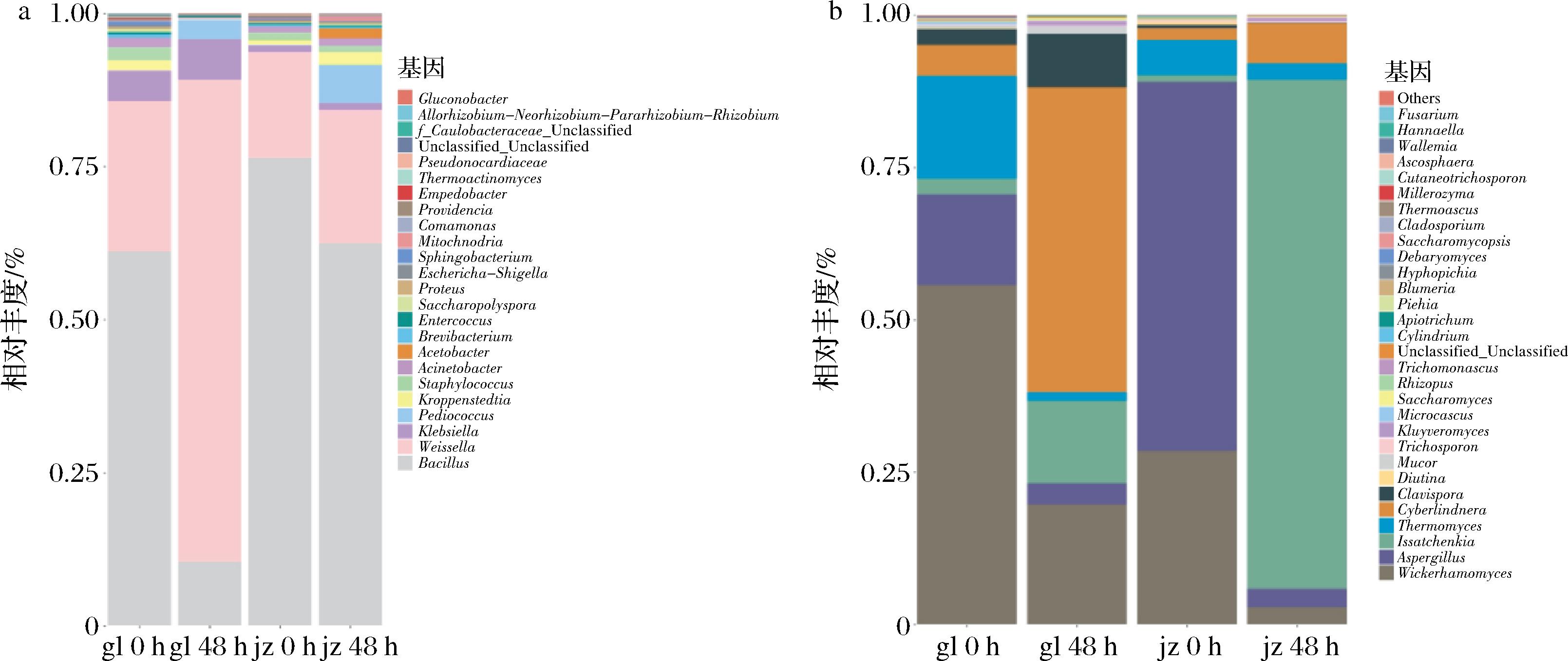
a-堆积前后阶段细菌属水平对比;b-堆积前后阶段真菌属水平对比
图2 不同添加酒糟比例下细菌和真菌测序结果
Fig.2 Sequencing results of bacteria and fungi under different proportions of distiller’s grains
注:gl 0 h与48 h分别代表纯高粱初始堆积以及堆积48 h;jz 0 h与48 h分别代表m(酒糟)∶m(高粱)=2∶1初始堆积以及堆积48 h。
2.2 不同温度对芝麻香白酒堆积过程的影响研究
将原料比为m(酒糟)∶m(高粱)=2∶1进行30、35、38 ℃恒温堆积,通过定时取样,对酒醅中菌体数量、酸度、还原糖以及堆积前后淀粉的含量进行测定,各指标变化如图3、表3所示。

a-酒醅细菌数量变化;b-酒醅酵母数量变化;c-酒醅酸度含量变化;d-酒醅还原糖含量变化
图3 不同温度堆积醅菌体数以及理化指标变化
Fig.3 Changes in the number of bacteria and physicochemical indexes of fermented grains at different temperatures
由图3-a可以看出,在8 h后细菌数量趋于平稳,数量在7.60 lg CFU/g酒醅,上中下层细菌数量相差较小。由图3-b和图3-c可以看出,三者温度对酵母影响较大,堆积结束时38 ℃酒醅中酵母数量最多,上层酵母接近8.00 lg CFU/g酒醅,其酒醅酸度也最低为1.02 mmol NaOH/10 g酒醅;30 ℃堆积条件下,酵母菌数量也较多。根据图3-d可知,30 ℃条件下还原糖一直处于上升阶段,而对比35 ℃以及38 ℃,可能是由于在44~48 h酵母菌生长速度较快,导致还原糖含量迅速减少,较少的还原糖含量不利于后续发酵过程。由表3可知,38 ℃条件下堆积过程中淀粉消耗量最少,这可能是由于高温条件下其淀粉酶活力较低。
表3 不同温度堆积前后酒醅淀粉含量变化
Table 3 Changes of starch content in fermented grains before and after stacking at different temperatures
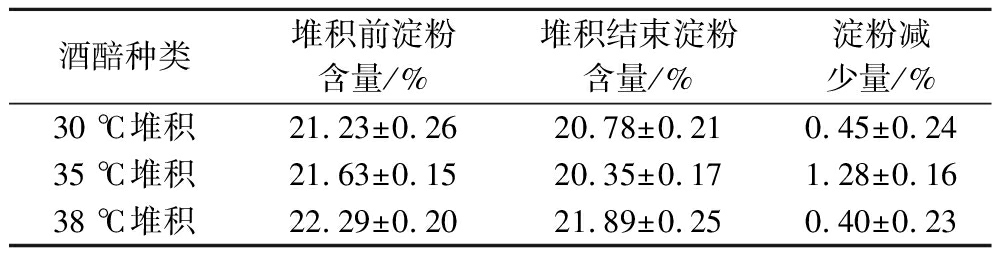
酒醅种类堆积前淀粉含量/%堆积结束淀粉含量/%淀粉减少量/%30 ℃堆积21.23±0.2620.78±0.210.45±0.2435 ℃堆积21.63±0.1520.35±0.171.28±0.1638 ℃堆积22.29±0.2021.89±0.250.40±0.23
2.3 不同水分对芝麻香型白酒堆积过程的影响研究
对50%、56%以及59%酒醅水分进行堆积过程中,通过定时取样,对酒醅中菌体数量、酸度、还原糖以及堆积前后淀粉的含量进行测定,各指标变化如图4、表4所示。

a-酒醅细菌数量变化;b-酒醅酵母数量变化;c-酒醅酸度含量变化;d-酒醅还原糖含量变化
图4 不同水分堆积醅菌体数以及理化指标变化
Fig.4 Changes of cell number and physicochemical indexes of fermented grains with different water stacking
表4 不同水分堆积前后酒醅淀粉含量变化
Table 4 Changes of starch content in fermented grains before and after different water stacking

酒醅种类堆积前淀粉含量/%堆积结束淀粉含量/%淀粉减少量/%50%初始水分23.08±0.1020.74±0.102.34±0.1056%初始水分21.71±0.4718.54±0.103.17±0.2959%初始水分21.05±0.0318.78±0.092.27±0.06
由图4-a可以看出,细菌数量差别较小,8 h之后细菌数量处于动态平衡当中,数量变化较小。从图4-b和图4-c可以看出,56%水分较高的酒醅酵母增长速度最快,迅速增长期在20~24 h,最后混合酒醅中酵母数量最多,上层酒醅中酵母数量接近9.00 lg CFU/g酒醅,堆积结束时中上层酒醅有白斑并且有较淡的酯香,白斑如图5所示;当酸度下降时,酵母都处于增长较快时期,酸度下降幅度约为0.80 mmol NaOH/10 g酒醅。这可能是由于产酯酵母可以降酸分解为酯和醇导致酒醅中酸度下降。根据图3-d可以得出,50%水分堆积过程中还原糖含量一直处于上升阶段,而56%和59%水分堆积过程中在20 h之前一直上升,20~24 h有一段迅速下降阶段,24 h至堆积结束时还原糖含量都处于缓慢下降状态。由表4可以看出,堆积过程中,50%水分酒醅消耗淀粉含量最高,可能是因为其酒醅中淀粉酶活性较高。

a-上层酒醅;b-中层酒醅;c-下层酒醅
图5 堆积结束时上中下层部分酒醅状态
Fig.5 State of the upper, middle and lower grains at the end of stacking
2.4 不同翻混时间对芝麻香型白酒堆积过程的影响研究
对不同翻堆时间以及堆积时间的酒醅,通过定时取样,对酒醅中菌体数量、酸度、还原糖以及堆积前后淀粉进行测定,各指标变化如图6和表5所示。

a-酒醅细菌数量变化;b-酒醅酵母数量变化;c-酒醅酸度含量变化;d-酒醅还原糖含量变化
图6 不同翻混时间下酒醅菌体数以及理化指标变化
Fig.6 Changes in the number of bacteria and physicochemical indexes of fermented grains under different mixing time
表5 不同翻混时间以及堆积时间下酒醅淀粉含量
Table 5 Starch contents in fermented grains under different mixing time and stacking time
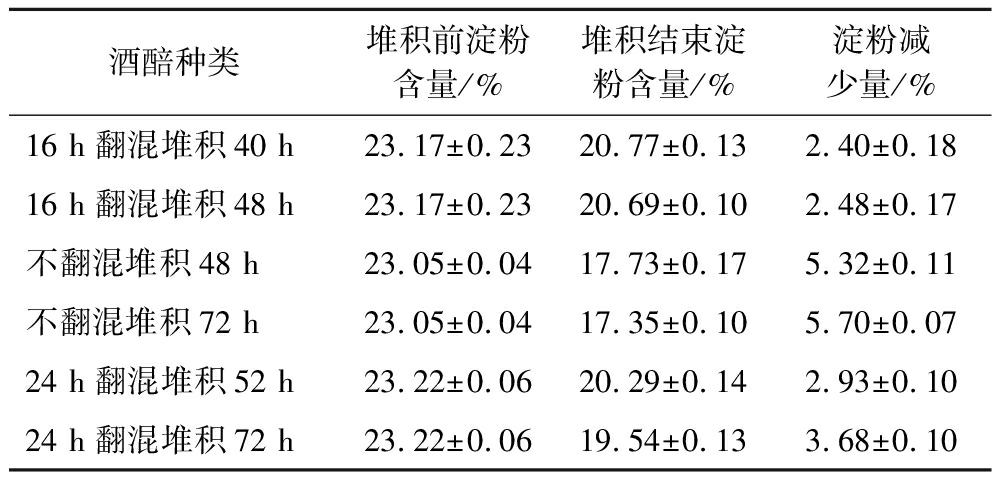
酒醅种类堆积前淀粉含量/%堆积结束淀粉含量/%淀粉减少量/%16 h翻混堆积40 h23.17±0.2320.77±0.132.40±0.1816 h翻混堆积48 h23.17±0.2320.69±0.102.48±0.17不翻混堆积48 h23.05±0.0417.73±0.175.32±0.11不翻混堆积72 h23.05±0.0417.35±0.105.70±0.0724 h翻混堆积52 h23.22±0.0620.29±0.142.93±0.1024 h翻混堆积72 h23.22±0.0619.54±0.133.68±0.10
由图6-a可以看出,两种不同翻混时间对于细菌生长曲线影响较小,细菌变化基本在8 h达到动态平衡。由图6-b和图6-c得出,在16 h翻混条件下,酵母菌的生长曲线会略微提前4 h左右;不进行翻混的堆积方式酵母数量较低,可能是由于酒醅中氧气含量不足,导致酵母生长代谢速度较慢。从酸度变化可以看出,不进行翻混酒醅的酸度减少较少,酸度减少量为0.40 mmol NaOH/10 g酒醅,三者酸度都在30 h左右开始迅速下降。从图6-d可以看出,还原糖含量在30 h之前一致处于上升状态,而且还原糖含量大致相同,30 h之后都出现下降趋势,最终还原糖含量为1.50%~3.00%。从表5得出,淀粉消耗量最高的为24 h翻混堆积72 h。综上可以推断,适当延长堆积时间可以起到提高酵母菌数量的作用。
2.5 不同堆积方式对发酵酒醅原酒酒样的影响分析
2.5.1 不同堆积方式原酒挥发性成分差异分析以及酒精产量对比
对发酵30 d结束后的酒醅进行蒸馏得到原酒,将不同堆积方式的原酒进行风味测定。由图7-a可知,原酒中最多检测出30种成分,其中酸类以乙酸为主、酯类以乙酸乙酯为主、醇类以异戊醇为主、醛类以乙醛和乙缩醛为主、还有苯乙醇等少量芳香类物质。酯类物质中,占主要成分的是乙酸乙酯,其中6号和7号最高,达到了10.00 g/L。总酯含量对比,6号酯类物质含量最高达到了约11.00 g/L,7号总酯含量次之约为6.50 g/L,其他的酒样总酯含量差别较小,基本都为3.50 g/L;6号中醇类含量最高约为1.40 g/L,其中异戊醇是主要成分。从酒精产率来看,1、2号酒精产量最高达到了6.00%vol,结合图2可知,其酒醅的优势酵母菌应该是一种高产乙醇酵母,但是产酯类物质较少。
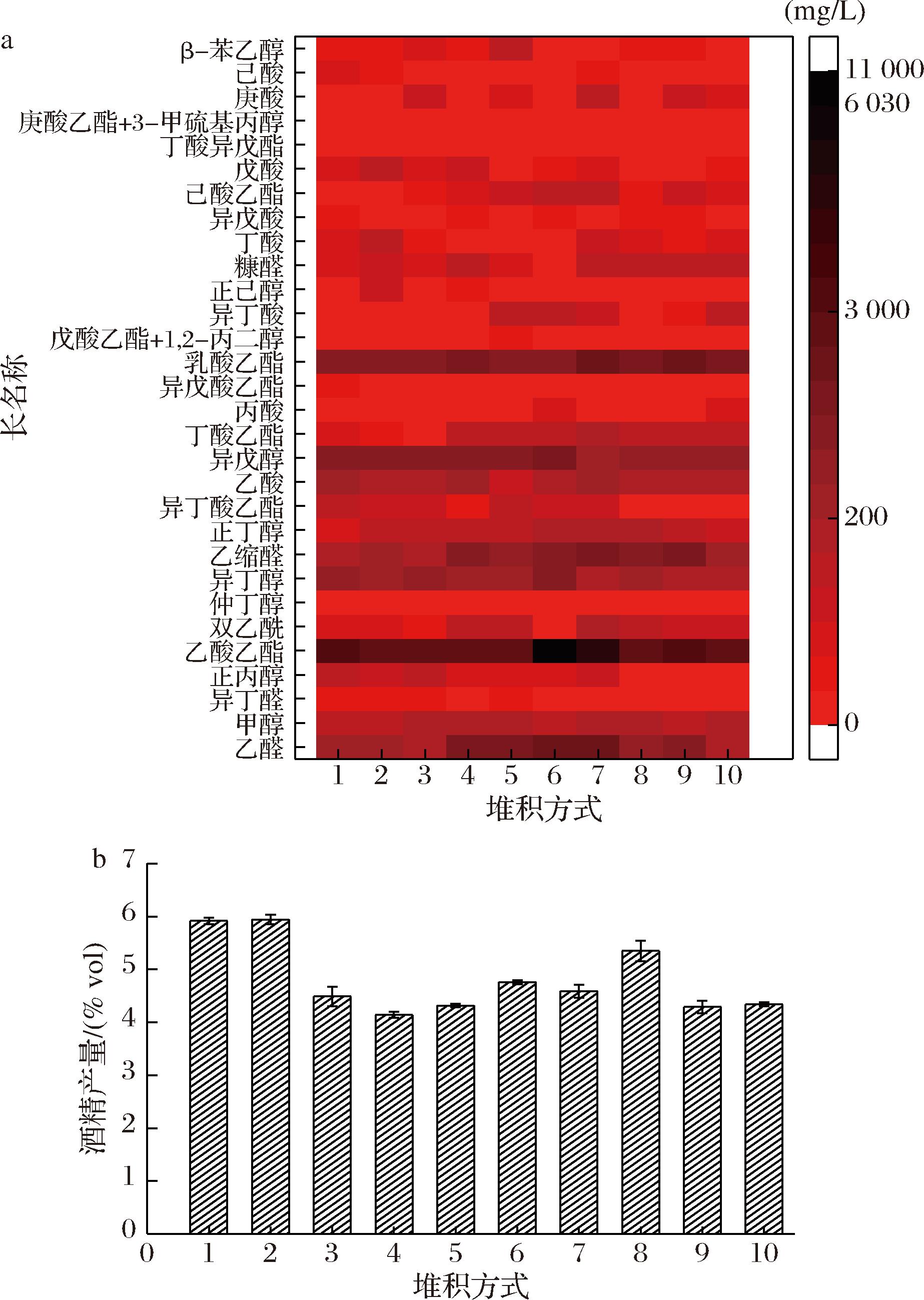
a-不同样品原酒风味成分热图;b-不同样品原酒酒精产量
图7 不同堆积方式发酵酒醅原酒酒精产量以及风味成分
Fig.7 Alcohol yield and flavor components of fermented grains under different stacking methods
2.5.2 不同堆积方式的原酒感官品评差异分析
如表6所示,虽然样品之间酒精度较接近,但是酒体风格存在差异。由于1~3号为纯高粱堆积,发酵之前酒醅中微生物以酿酒酵母为主,产酯酵母数量较少,导致其原酒成分中醇类物质较多,酯类物质较少,使得酒体的酯香味较少。4~10号样品都加入了酒糟进行堆积发酵,使得酒醅的酸度提高,产酯酵母为优势菌种,同时伊萨酵母也具有一定的产乙醇能力,配合芽孢杆菌在堆积过程中的美拉德反应,为后续发酵提供前体物质,所以其酯香较为浓郁。根据品酒师的品鉴,酒厂会偏向于参照6号原酒的工艺进行生产,6号原酒的品质为优,6号酒的堆积条件为m(酒糟)∶m(高粱)=2∶1,堆积温度为30 ℃,水分为56%,堆积时间为48 h,翻混时间为24 h。
表6 不同样品原酒感官品评
Table 6 Sensory evaluation of different samples of base liquor
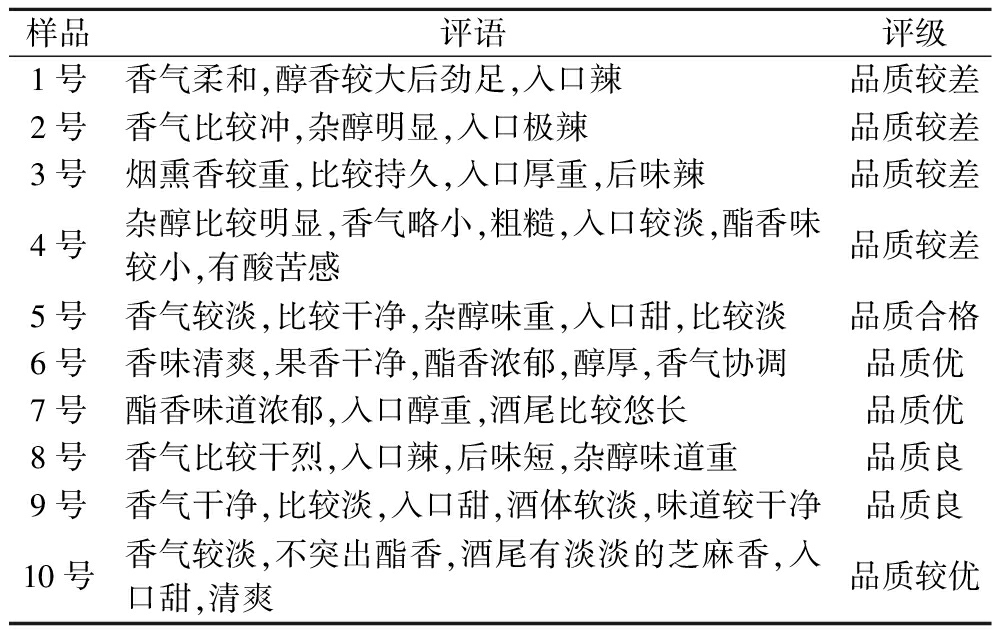
样品评语评级1号香气柔和,醇香较大后劲足,入口辣品质较差2号香气比较冲,杂醇明显,入口极辣品质较差3号烟熏香较重,比较持久,入口厚重,后味辣品质较差4号杂醇比较明显,香气略小,粗糙,入口较淡,酯香味较小,有酸苦感品质较差5号香气较淡,比较干净,杂醇味重,入口甜,比较淡品质合格6号香味清爽,果香干净,酯香浓郁,醇厚,香气协调品质优7号酯香味道浓郁,入口醇重,酒尾比较悠长品质优8号香气比较干烈,入口辣,后味短,杂醇味道重品质良9号香气干净,比较淡,入口甜,酒体软淡,味道较干净品质良10号香气较淡,不突出酯香,酒尾有淡淡的芝麻香,入口甜,清爽品质较优
3 结论
在实验室模拟芝麻香型白酒堆积工艺过程中细菌以芽孢杆菌和威斯氏菌为主,酵母以伊萨酵母为主,其中细菌在堆积过程中数量变化较少,8 h后处于动态平衡中,酵母随着堆积时间增长数量一直升高,中上层酵母数量高于下层酒醅。淀粉含量一直下降,酸度随着伊萨酵母数量增多而降低,还原糖含量与菌体数量和淀粉酶活力有关。最关键的操作因素为控制堆积酒醅的水分以及添加酒糟的比例,翻混时间和堆积时间对堆积发酵结果影响较小。其中最优的堆积条件为m(酒糟)∶m(高粱)=2∶1,堆积温度为30 ℃,水分为56%,堆积时间为48 h,翻混时间为24 h,此条件下酒精产量、风味物质含量以及品评结果较好,其最终酒精产量的体积分数为5.33%,总酯含量最高,以乙酸乙酯为主要酯类,在其酒样中达到了10.00 g/L,酒体协调。较合格的堆积条件为m(酒糟)∶m(高粱)=2∶1,水分50%,堆积温度30 ℃,此条件下酒精产量和前者相差较少,但是原酒中风味物质较少,酯类含量较低。不合格的堆积条件为m(酒糟)∶m(高粱)=0∶1,此条件堆积过程中以酿酒酵母为主,产酯酵母极少,最终原酒中醇类物质较高,杂醇味道较重,酯类物质最少,酒品质最差。
根据堆积过程酒醅的理化性质以及菌落构成结合其原酒品质可以得出入池发酵前酒醅好坏的判断依据,堆积结束时酵母数量应高于细菌数量,产酯酵母和芽孢杆菌为优势菌种,入池前酒醅有一股淡淡的酯香,并且中上层酒醅出现白斑即可入池发酵。
[1] 张福艳, 胡铁功, 苏亚娜, 等.高温堆积在白酒酿造中的研究与应用现状及发展[J].酿酒, 2023, 50(4):5-8.
ZHANG F Y, HU T G, SU Y N, et al.Research and application status and development of high-temperature stacking in Baijiu brewing[J].Liquor Making, 2023, 50(4):5-8.
[2] ZHU Q, CHEN L Q, PU X X, et al.The differences in the composition of Maillard components between three kinds of sauce-flavor daqu[J].Fermentation, 2023, 9(9):860.
[3] REN T T, SU W, MU Y C, et al.Study on the correlation between microbial communities with physicochemical properties and flavor substances in the Xiasha round of cave-brewed sauce-flavor Baijiu[J].Frontiers in Microbiology, 2023, 14:1124817.
[4] 曹润洁, 何宏魁, 葛向阳, 等.芝麻香型酒醅堆积过程中微生物结构变化分析[J].微生物学通报, 2019, 46(6):1371-1380.
CAO R J, HE H K, GE X Y, et al.Change of microbial community during stacking fermentation of sesame-flavor Jiupei[J].Microbiology China, 2019, 46(6):1371-1380.
[5] 陈向田. 芝麻香型白酒堆积过程中关键功能微生物变化的研究[J].酿酒, 2018, 45(6):39-41.
CHEN X T.Study on the change of key functional microorganisms in the accumulation process of sesame flavor liquor production[J].Liquor Making, 2018, 45(6):39-41.
[6] CHEN X, WU Y X, ZHU H, et al.Turning over fermented grains elevating heap temperature and driving microbial community succession during the heap fermentation of sauce-flavor Baijiu[J].LWT, 2022, 172:114173.
[7] 万清徽, 谢圣凯, 高大禹, 等.两种堆积醅对芝麻香型白酒发酵特性和香气品质的影响[J].食品与发酵工业, 2017, 43(11):9-15.
WAN Q H, XIE S K, GAO D Y, et al.Effects of two kinds of accumulated grains on fermentation characteristics and aroma quality of sesame-flavor liquor[J].Food and Fermentation Industries, 2017, 43(11):9-15.
[8] XU Y Q, WU M Q, NIU J L, et al.Characteristics and correlation of the microbial communities and flavor compounds during the first three rounds of fermentation in Chinese sauce-flavor Baijiu[J].Foods, 2023, 12(1):207.
[9] 刘宏基, 黄晓芬, 余有贵, 等.不同高度堆积发酵酱酒醅主要理化指标的比较研究[J].中国食品工业, 2023(8):111-113;124.
LIU H J, HUANG X F, YU Y G, et al.The main physicochemistry is to accumulate fermented sauce and fermented grains at different heights comparative study of indicators [J].China Food Industry, 2023(8):111-113;124.
[10] 李小东, 高大禹, 田庆贞, 等.芝麻香型白酒堆积发酵对入窖发酵过程及原酒品质的影响[J].食品与发酵工业, 2018, 44(5):63-69.
LI X D, GAO D Y, TIAN Q Z, et al.Effects of sesame-flavor liquor accumulation on cellar fermentation process and liquor quality[J].Food and Fermentation Industries, 2018, 44(5):63-69.
[11] 高银涛, 何璇, 余博文, 等.白酒固态双边发酵糖化机理及其对发酵过程的影响[J].食品与发酵工业, 2021, 47(13):92-97.
GAO Y T, HE X, YU B W, et al.Saccharification mechanism of solid-state fermentation of Chinese Baijiu and its influence on fermentation process[J].Food and Fermentation Industries, 2021, 47(13):92-97.
[12] 白钰琨, 廖博曦, 孙昭, 等.酿酒酵母固态发酵的精准调控技术研究[J].食品与发酵工业, 2023, 49(15):54-62.
BAI Y K, LIAO B X, SUN Z, et al.Precise regulation technology for Saccharomyces cerevisiae solid-state fermentation[J].Food and Fermentation Industries, 2023, 49(15):54-62.
[13] YAN S B, WANG S C, WEI G G, et al.Investigation of the main parameters during the fermentation of Chinese Luzhou-f lavour liquor[J].Journal of the Institute of Brewing, 2015, 121(1):145-154.
[14] 沈怡方. 白酒生产技术全书[M].北京:中国轻工业出版社, 2015.
SHEN Y F.Complete Book of Liquor Production Technology[M].Beijing:China Light Industry Press, 2007.
[15] 曹云刚, 马丽, 杜小威, 等.汾酒酒醅发酵过程中有机酸的变化规律[J].食品科学, 2011, 32(7):229-232.
CAO Y G, MA L, DU X W, et al.Variation of organic acids in fermented grains during fermentation of Fen liquor[J].Food Science, 2011, 32(7):229-232.
[16] 刘英, 余东, 岳沛, 等.白酒风味轮及其评价方法在白酒感官评价中的应用研究[J].酿酒科技, 2022(3):58-64.
LIU Y, YU D, YUE P, et al.Application of flavor wheel and its evaluation method in the sensory evaluation of Baijiu[J].Liquor-Making Science &Technology, 2022(3):58-64.
[17] WU Z Y, SUN W, SHEN Y H, et al.Metabolic engineering of low-pH-tolerant non-model yeast, Issatchenkia orientalis, for production of citramalate[J].Metabolic Engineering Communications, 2023, 16:e00220.
[18] 王庆宇, 周平, 王贵军, 等.不同品种糯高粱酿造酱香型白酒对比研究[J].中国酿造, 2023, 42(8):65-70.
WANG Q Y, ZHOU P, WANG G J, et al.Comparative study on different varieties of glutinous Sorghum for brewing sauce-flavor Baijiu[J].China Brewing, 2023, 42(8):65-70.
[19] WANG S Q, TIAN X Q, TIAN L, et al.Degradation of ethyl carbamate in strong-flavor Baijiu by the microbial combination culture[J].Food Control, 2023, 145:109447.
[20] ZHA M S, SUN B G, WU Y P, et al.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Wickerhamomyces anomalus for Chinese Baijiu making[J].Journal of Bioscience and Bioengineering, 2018, 126(2):189-195.
[21] GUAN T W, WU X T, HOU R, et al.Application of Clostridium butyricum, Rummeliibacillus suwonensis, and Issatchenkia orientalis for nongxiangxing Baijiu fermentation:Improves the microbial communities and flavor of upper fermented grain[J].Food Research International, 2023, 169:112885.