脂肪酶(EC3.1.1.3)即三酰基甘油水解酶,可在水相中将三酰甘油酯水解成甘油和游离脂肪酸,也可在微水环境下催化酯化、酯交换、酸解和氨解等反应[1-3]。运用上述生物催化活性,脂肪酶已在洗涤剂、油脂加工改性、食品工业、个人护理用品等领域得到广泛关注与应用[4]。
食品低温加工可最大限度改善高温加工对食品营养的破坏或改变,也为绿色低能耗生产所期待。低温脂肪酶在低温近中性pH条件下表现高活性,促进工业技术进步。现有研究表明,低温脂肪酶多从耐冷微生物中筛选获得,且多为细菌来源,其最适作用温度为0~40 ℃。张冰玉[5]筛选到一种低温碱性脂肪酶BcLip,其在10 ℃、pH值为8.0下活性最优,但在酸性或中性条件下活性较差。GANASEN等[6]从假单胞菌(Pseudomonas sp.)中克隆得到脂肪酶AMS8,其最适作用温度为30 ℃,最适作用pH值为10.0,在较宽泛pH范围内仍能保持稳定,30 ℃和40 ℃条件下半衰期分别为4和2 h。可见,低温脂肪酶研究,不仅增加基础研究,也为后续工业应用奠定基础。
本研究在前期试验基础上,发现丝状真菌黑曲霉中可能存在一类低温中性脂肪酶。为此,本文就其中一种可能具有特殊生化特征和应用价值的低温脂肪酶进行克隆、表达及酶学特征分析,为丰富真菌中性低温脂肪酶资源和实现其工业应用奠定理论基础。
1 材料与方法
1.1 菌株与质粒
黑曲霉(Aspergillus niger)CICIM F0215为本实验室前期分离与鉴定,保存于中国高校工业微生物资源与信息中心,用于本研究AtglF脂肪酶的编码基因atglF的供体。大肠杆菌(Escherichia coli)JM109、毕赤酵母(Pichia pastoris)GS115和质粒pPIC9k为本实验室前期收集与保藏。
1.2 酶与试剂
限制性内切酶、LA Taq DNA聚合酶,宝生物工程(大连)有限公司产品;T4 DNA连接酶、质粒小量提取试剂盒、小量DNA产物纯化回收试剂盒,Invitrogen公司;对硝基苯酚酯(C2~C16),上海生工生物科技有限公司;其他生化试剂为分析纯,国药集团化学试剂有限公司。
1.3 培养基
酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD):1%(质量分数,下同)酵母粉、2%蛋白胨、2%葡萄糖,115 ℃高压蒸汽灭菌20 min。
甘油缓冲复合培养基(buffered glycerol-complex medium, BMGY) 、诱导表达培养基(buffered methanol-complex medium, BMMY) :1%酵母粉、2%蛋白胨、1.34%酵母氮源基础培养基(yeast nitrogen base,YNB)、4×10-5%生物素、1%甘油、78%K3PO4缓冲液,121 ℃高压蒸汽灭菌20 min。
1.4 生物信息分析方法
脂肪酶氨基酸序列比对分析采用Blast在线软件进行(https://blast.ncbi.nlm.nih.gov/Blast.cgi),信号肽分析采用SignalP-5.0进行(https://services.healthtech.dtu.dk/services/SignalP-5.0/),脂肪酶的亲水性和跨膜结构域分析采用Expasy-ProtScale(https://web.expasy.org/protscale/)和TMHMM 2.0-DTU Health Tec-Bioinformatic Services(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)进行,脂肪酶三维结构采用SWISS-MODEL进行建模分析(https://swissmodel.expasy.org/)。
1.5 基因克隆与重组菌构建
质粒DNA的提取、酶切、转化及转化子的筛选等均采用实验室常规方法[7]。鉴于所研究的目标脂肪酶编码基因不含内含子,故直接以黑曲霉F0215基因组DNA为模板扩增脂肪酶编码基因,所采用的引物序列为:上游引物:5′-GTAACTCCAGTTCAACGGGATGCAGC-3′,下游引物:5′-TGCTCTAGATCAGATGTGGAACGCCGCG-3′(下划线部分:XbaⅠ位点),由生工生物工程(上海)股份有限公司合成。上述PCR产物经XbaⅠ酶切后克隆入载体pPIC9k的AvrⅡ和SnaBⅠ位点,转化至大肠杆菌JM109中,获得正确重组质粒;提取其中的重组质粒DNA,经酶切确认并进一步通过Sanger法进行核苷酸序列测定,并通过MEGA11进行序列比对分析。重组质粒线性化后电转化入GS115感受态细胞中,利用2.0 mg/mL G418抗性筛选正确构建的重组酵母转化子作为脂肪酶生产菌株。
1.6 酶液制备与纯化
重组菌发酵产酶方法参考毕赤酵母表达手册(Invitrogen EasyselectTM Pichia Expression Kit),将表达脂肪酶AtglF的毕赤酵母菌种接种到含有质量浓度为2.0 mg/mL遗传霉素(GS115)的YPD固体培养基上,30 ℃恒温培养3 d;挑取单菌落接种于25 mL的YPD液体培养基中,在30 ℃、转速200 r/min的摇床中振荡培养18 h;以10%接种量转接至BMGY液体培养基中,30 ℃、200 r/min培养18 h;收集上述培养菌体,转接入50 mL BMMY液体培养(初始生物量:1.0)中,于30 ℃、200 r/min培养5 d,每24 h补加0.25 mL甲醇进行诱导。发酵结束后于4 ℃、8 000 r/min离心15 min收集上清液,即为粗酶液。
进一步将粗酶液用10%~80%的饱和(NH4)2SO4溶液进行分级沉淀,离心收集酶蛋白沉淀并用无菌水溶解,酶液经PD-10脱盐柱(GE公司产品)脱盐后再经凝胶柱(SuperdexTM 75 10/300GL)分离纯化。纯化产物利用SDS-PAGE分析蛋白纯化情况,其中SDS-PAGE使用50 g/L浓缩胶和120 g/L分离胶[8]。
1.7 酶活力测定
参考YAO等[9]介绍的对硝基苯酚法(p-NP法)进行的脂肪酶酶活测定,基本步骤为:将对硝基苯酚母液按比例与缓冲液混合成一系列不同浓度,并用分光光度计在410 nm下测定吸光值,绘制标准曲线;将磷酸盐缓冲液(450 μL)和底物(50 μL)混合,预热5 min后添加底物50 μL,保温反应15 min,加入450 μL体积分数为95%乙醇以终止反应,在410 nm下测其吸光度。对照组添加50 μL缓冲液。酶活力定义为:在一定温度和pH下,1 min生成1 μmol对硝基苯酚为1个酶活力单位。酶活力的计算如公式(1)所示:
(1)
式中:X,试样酶活力,U;x,测得的吸光值;n,稀释倍数。
1.8 酶学性质分析
1.8.1 最适作用温度及热稳定性
在20~70 ℃下测定AtglF的酶活力,以最高酶活力值为100%,计算相对酶活力,进而确定其最适作用温度;将酶液在30~60 ℃下保温,分别在不同时间取样,测定残余酶活力,以未经热处理的酶活力值为100%,计算相对酶活力。
1.8.2 最适作用pH及pH稳定性
在酶的最适作用温度下,将酶样用pH 4.0~11.0的缓冲液进行稀释,测定对应pH条件下的酶活力,以最高酶活力值为100%,计算其他pH下的相对酶活力,从而确定酶的最适作用pH;将酶液于不同pH(pH 3.0~8.0)和4 ℃下放置1 h,测定残余酶活,以未经处理的酶活力值为100%,确定其pH稳定性。
1.8.3 金属离子对酶活力的影响
将酶液分别与不同的金属离子混合,使离子在体系中终浓度分别为1和5 mmol/L。以对硝基苯酚辛酸酯(C8)为底物,在最适作用温度及pH下测定样本酶活力;以缓冲液代替金属离子作为对照,确定不同金属离子对酶活力的影响。
1.8.4 有机溶剂对酶活力的影响
参照文献[10]进行。基本步骤为:将酶液与有机溶剂按照4∶1(体积比)在150 r/min、30 ℃下放置2 h,以对硝基苯酚辛酸酯(C8)为底物,在酶的最适作用条件下测定残余酶活力;以未加有机溶剂反应体系为100%,计算相对酶活。
1.9 底物特异性
以5种不同碳链长度的对硝基苯酚羧酸酯(C2、C4、C8、C12、C16)为底物,测定酶针对合成底物的酶活力;以日常生活中常见的18种天然油脂为底物,按国标碱滴定法测定酶针对天然底物的酶活力,以测得的最高酶活力为100%,计算相对酶活力[8]。
2 结果与分析
2.1 AtglF生物信息特征
黑曲霉AtglF由atglF基因编码,大小1 686 bp,是不含内含子的连续序列。AtglF完整读框含562个氨基酸残基,理论分子质量为61.16 kDa,pI为4.19。经信号肽分析可知,该酶分子N端1~18氨基酸残基具有疏水性,为信号肽区域,可见,该酶蛋白在黑曲霉中为分泌表达。与其他微生物来源的脂肪酶序列比对结果显示,AtglF与Aspergillus sclerotioniger脂肪酶、Aspergillus heteromorphus胞外脂肪酶以及Aspergillus egyptiacus α/β-脂类水解蛋白等,具有很高相似性,序列相似性分别为92.27%、82.65%和70.49%。比对结果同时揭示,AtglF含有脂肪酶家族活性位点(Ser233、Glu366和His478)和保守五肽序列GESAG(229~233 AA)的保守区(图1)。

1-AtglF;2-A.sclerotioniger CBS 115 572;3-A.heteromorphus CBS 117.55;4-A.egyptiacus
图1 AtglF的多序列比对
Fig.1 Multiple sequence alignments of AtglF
注:蓝色星标为催化三联体;红框标注为保守五肽序列。
进一步对该酶的三级结构进行了分析,结果如图2所示。结果显示,AtglF由8个平行的β折叠片组成,其中第2个β折叠片为反平行排列,这些平行片层组成了一个8股平行β桶,该片层中间由α螺旋相连接,此α/β折叠结构为活性位点提供了一个稳定的支架。其中,α-螺旋和β-折叠分别占比29.23%和6.8%。GESAG(229~233 aa)为脂肪酶保守五肽序列GXSXG;Ser233、Glu366和His478残基位于保守区域内,在三级结构上相邻,形成该酶的催化三联体。该酶蛋白含有高比例的“小”氨基酸,如Gly(8.09%)和Ala(9.38%);含有低比例的脯氨酸和精氨酸,并且其中酸性氨基酸(Asp和Glu,11.58%)比碱性氨基酸(Lys和Arg,6.07%)的比例更高。此特征与低温酶共有特征一致[11]。该酶底物结合位点由一个疏水“口袋”组成,在常规状态下“口袋”上方的“盖子”(361~434 AA)处于闭合状态,保护氧阴离子孔(oxyanion hole)[12],阻止溶剂进入活性部位;当酶处于激活状态时,“盖子”结构被打开,疏水端暴露出来,隐藏亲水基团,在丝氨酸残基周围形成亲电子域,引起脂肪酶构象改变,增加酶与脂类底物的亲和性。
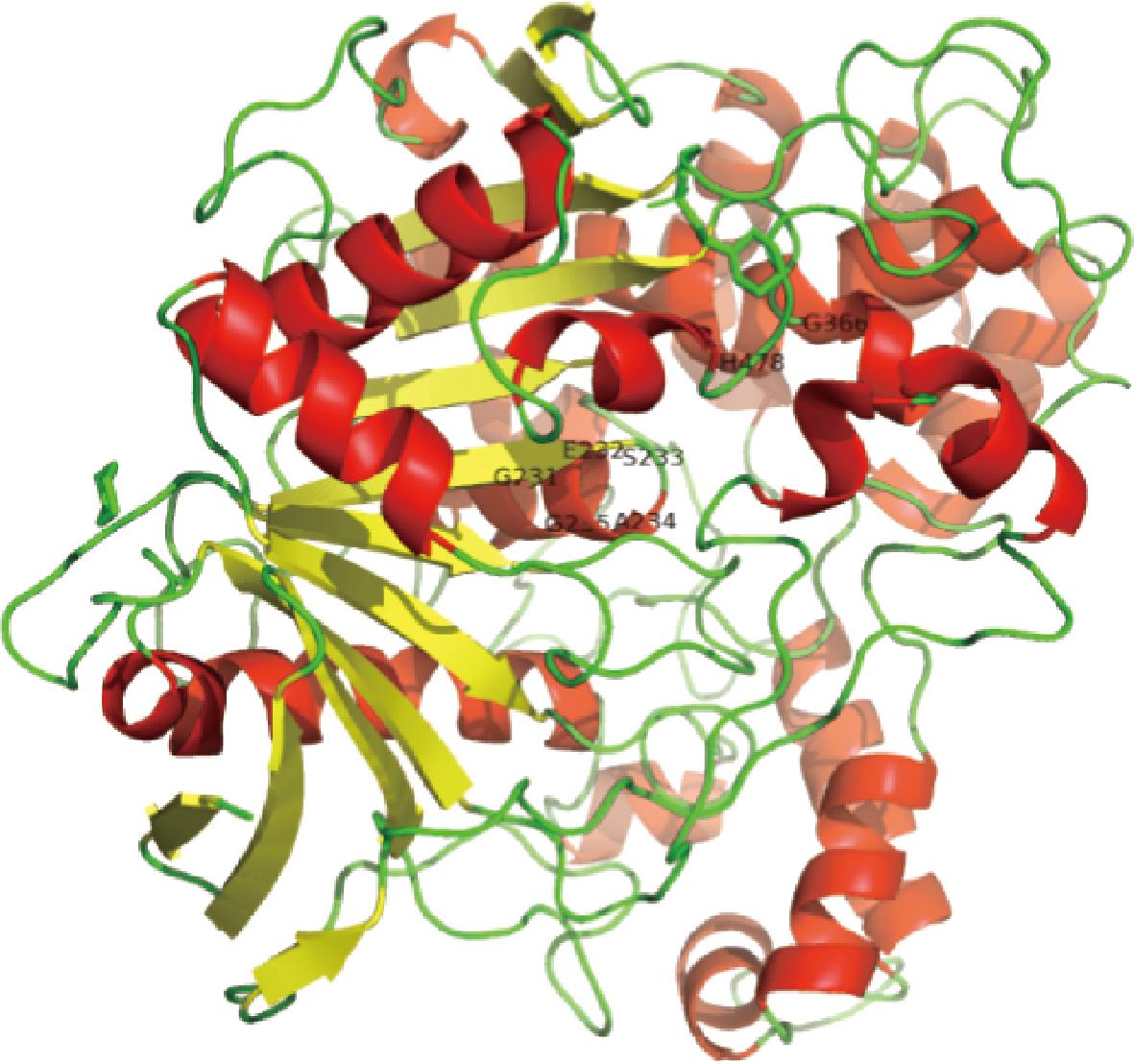
图2 AtglF的3D模拟结构
Fig.2 The mimic 3D structure of AtglF
2.2 AtglF异源表达及纯化
以黑曲霉F0215基因组DNA为模板,PCR扩增获得1 632 bp的脂肪酶成熟肽编码读框,PCR产物经酶切与毕赤酵母表达质粒pPIC9K连接,获得重组质粒pPIC-atglF并转化入毕赤酵母GS115中,获得重组毕赤酵母ANL-AtglF。重组菌ANL-AtglF经甲醇诱导5 d后,发酵液酶活达到最大25.36 U/mL。上清经(NH4)2SO4沉淀、凝胶层析进行纯化后的回收率为4.2%,纯化倍数为11.78倍(表1),SDS-PAGE显示约59 kDa的单一蛋白条带,与预期脂肪酶AtglF的成熟肽大小一致(图3)。
表1 脂肪酶AtglF纯化结果
Table 1 Purification results of AtglF
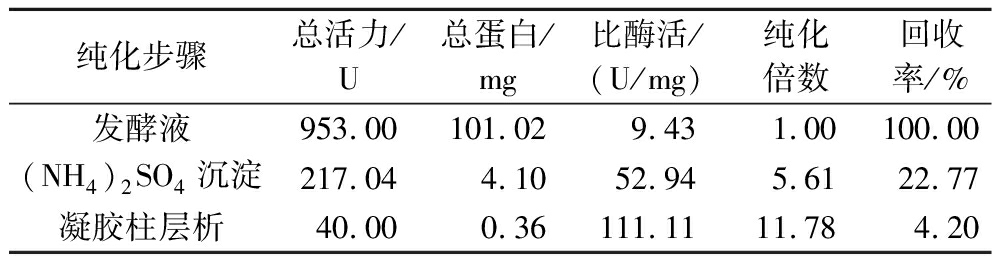
纯化步骤总活力/U总蛋白/mg比酶活/(U/mg)纯化倍数回收率/%发酵液953.00101.02 9.431.00100.00(NH4)2SO4沉淀217.044.1052.945.6122.77凝胶柱层析40.000.36111.1111.784.20
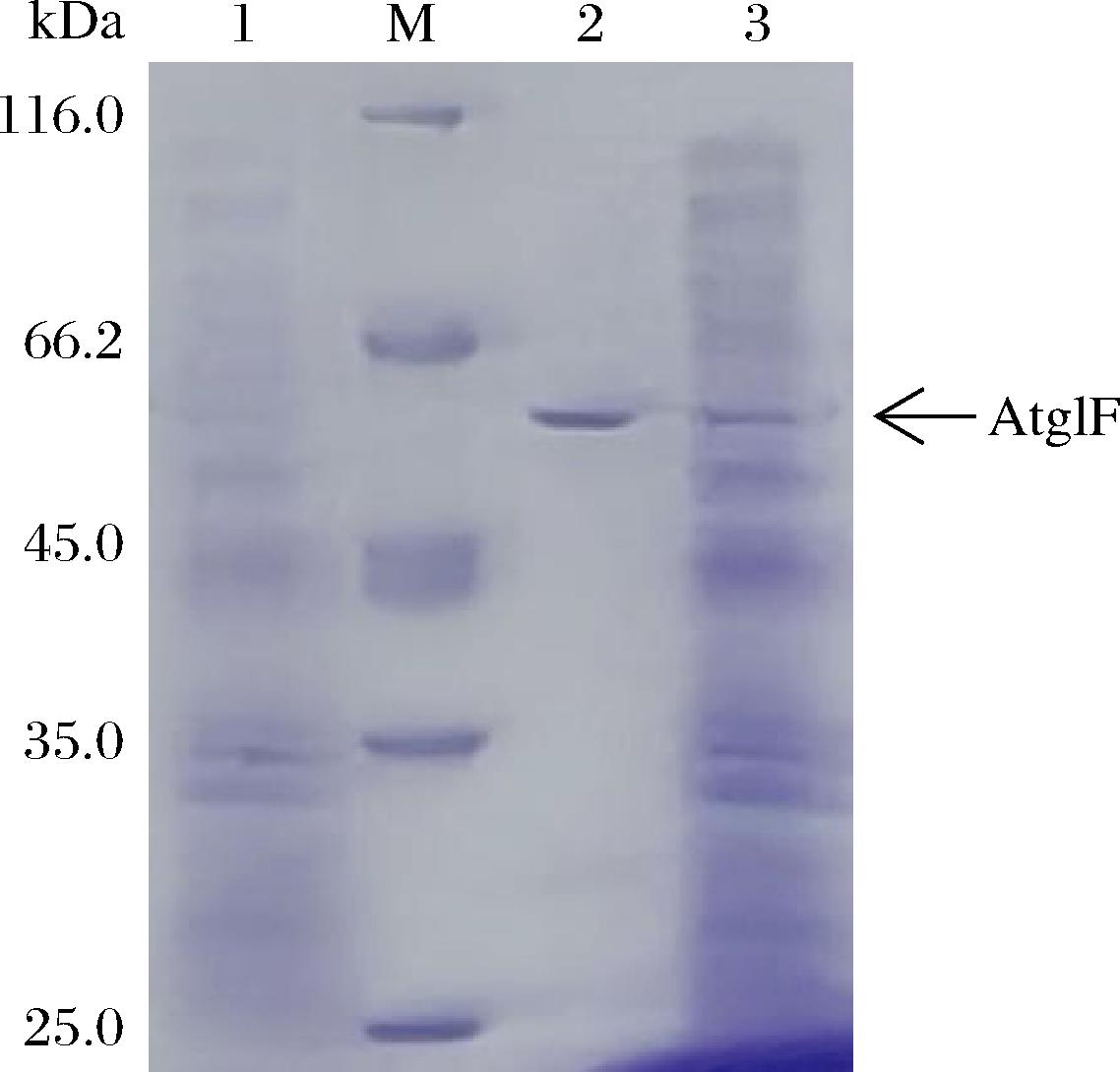
M-蛋白分子量标准;1-毕赤酵母发酵上清液空白对照;2-纯化后的脂肪酶AtglF;3-脂肪酶AtglF发酵上清液
图3 纯化后AtglF的SDS-PAGE图谱
Fig.3 SDS-PAGE profile of purified AtglF
2.3 AtglF的酶学性质与生化特征
2.3.1 最适作用温度及热稳定性
在pH 7.0,20~70 ℃条件下测定AtglF的酶活力,结果如图4-a所示。
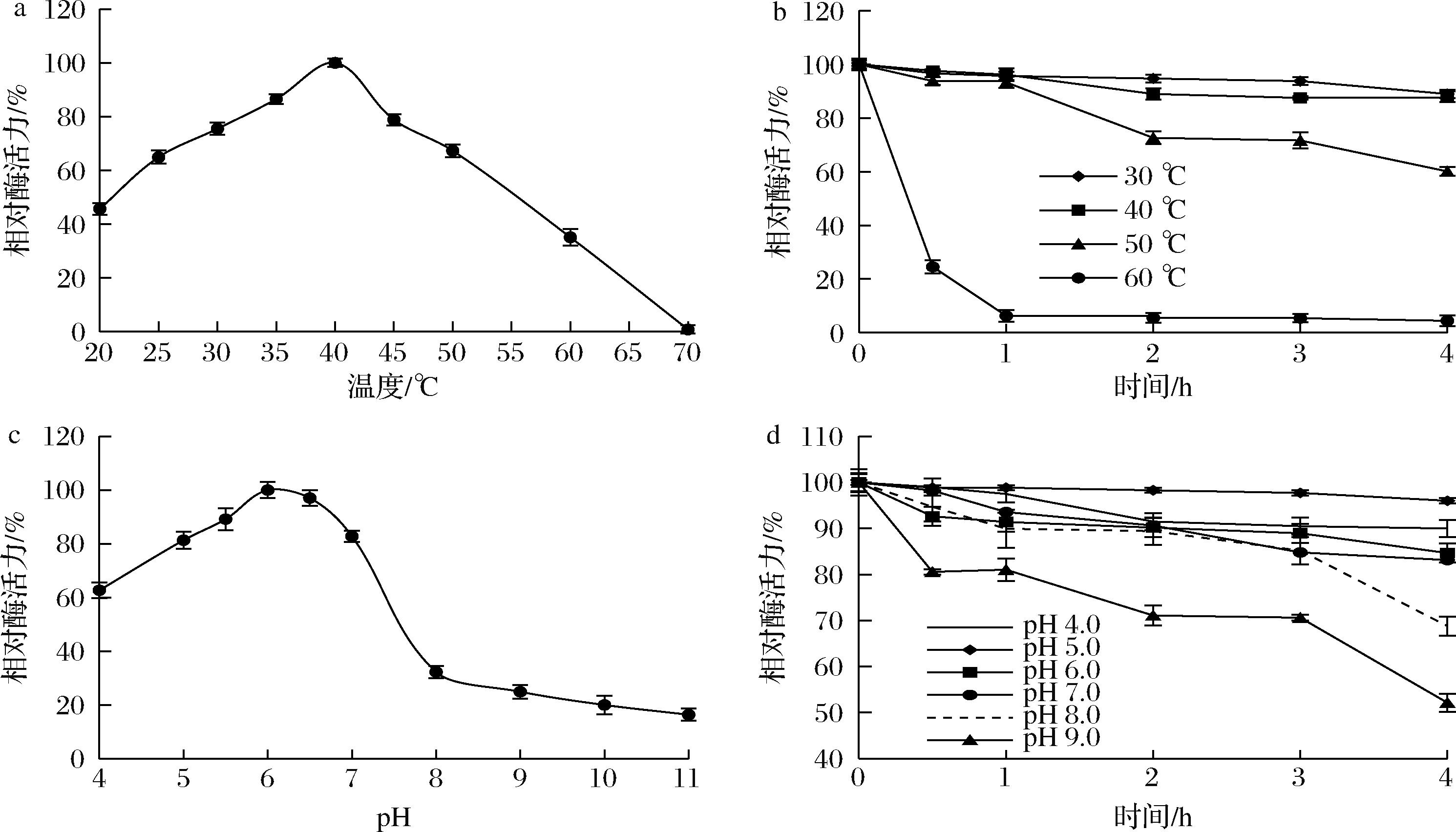
a-最适作用温度;b-热稳定性;c-最适作用pH;d-pH稳定性
图4 温度和pH对酶活力的影响
Fig.4 Effect of temperature and pH on enzyme activity
当温度为40 ℃时,AtglF表现出最高酶活力;在25~40 ℃范围内AtglF具有相对较高的催化活性,其相对酶活力均大于67%;在温度超过60 ℃时,酶活力下降明显,仅为最高酶活力的35%。将酶液在不同温度下孵育,定时取样测定残余酶活力,结果见图4-b。AtglF在30 ℃下孵育4 h后仍保持90%以上的酶活力,在50 ℃下孵育4 h可保持约60%的酶活力;而温度上升至60 ℃时酶稳定性显著下降,孵育0.5 h后仅保留24.5%酶活力。AtglF所呈现的最适作用温度与来源于嗜冷菌(Psychrobacter sp.)的低温脂肪酶ZY12相似[13],其在40 ℃、pH 8.0时活性最高,在40 ℃下保持稳定,酶活力保持在70%以上,在50 ℃下其剩余酶活性低于最大酶活性的65%。
2.3.2 最适作用pH及pH稳定性
如图4-c所示,AtglF在近中性(pH值为5.0~7.0)范围内都具有较好的酶活力,均可达到80%以上,而最佳pH值约为6.0;当pH值>7.0时,酶活力显著下降。这可能是由于碱性环境中AtglF整体带负电荷,不利于该酶暴露催化中心从而发挥作用。由图4-d可知,AtglF在pH值为4.0~7.0,室温环境中放置4 h后,酶活力仍保持85%以上,而在pH值>7.0的环境中,酶失活相对比较明显。由此可见,该酶在近中性pH范围内是稳定的。AtglF与嗜冷菌来源的脂肪酶ZC12在pH方面差异较大,当pH值升高到10.0时,ZC12活性仍保持在最大酶活力的60%左右,在碱性缓冲液中相对稳定[13]。
2.3.3 金属离子对酶活力的影响
不同的金属离子对不同的真菌脂肪酶表现出不同程度的影响[14]。如图5所示,14种常见金属离子在不同浓度下对该酶均无显著激活作用;当离子浓度在1 mmol/L时,14种金属离子对AtglF活性均无明显抑制作用;当浓度为5 mmol/L时,对重组酶酶活有部分抑制作用,其中Fe3+和Al3+对AtglF的抑制作用极为显著,残余酶活力分别为3.7%和3.4%。Fe3+作为亲电试剂可能与脂肪酶活性中心的Ser残基发生电荷相互作用,改变其构象,从而使脂肪酶变性[15]。BALASUBRAMANIAM等[16]通过研究1 mmol/L浓度下不同金属离子对来源于Rhizopus oryzae的脂肪酶影响发现,相比于Mn2+,Ca2+可促进脂肪酶酶活力及其稳定性;KATIYAR等[17]研究表明,来源于Candida rugosa的脂肪酶的催化活性在Ca2+存在的情况下得到了提高。而在本研究中,Ca2+的存在对AtglF活力有抑制作用,当Ca2+浓度为5 mmol/L时抑制作用更为显著;此与XING等[18]研究结果相似,来自黑曲霉GZUF36的脂肪酶活性被5 mmol/L的Ca2+抑制高达75%。

图5 金属离子对酶活力的影响
Fig.5 Effect of metal ions on enzyme activity
2.3.4 有机溶剂对AtglF酶活力的影响
由图6可见,N,N-二甲基甲酰胺和甲苯显著提高了脂肪酶AtglF约10%左右的酶活力,其余试剂抑制4%~30%的酶活力。脂肪酶通常由疏水的催化核心和亲水的表面构成,其催化活性需要一定极性的溶剂来维持,当极性溶剂与蛋白接触时削弱了疏水键,使得分子内部斥力增加[13],由于AtglF螺旋和转角结构附近脯氨酸数量少,整体柔性良好,此时空间结构发生延展,“盖子”打开,底物更容易进入催化“口袋”从而进行催化反应,表现为具有较高的酶活力。所测试有机溶剂基本满足极性越大所对应的相对酶活力越大。这与刘光[19]的报道一致,其指出大多数极性较大的有机溶剂对脂肪酶活力有促进作用。该酶具有一定的有机溶剂耐受性且反应温度偏低,可以用于生物柴油生产等领域。
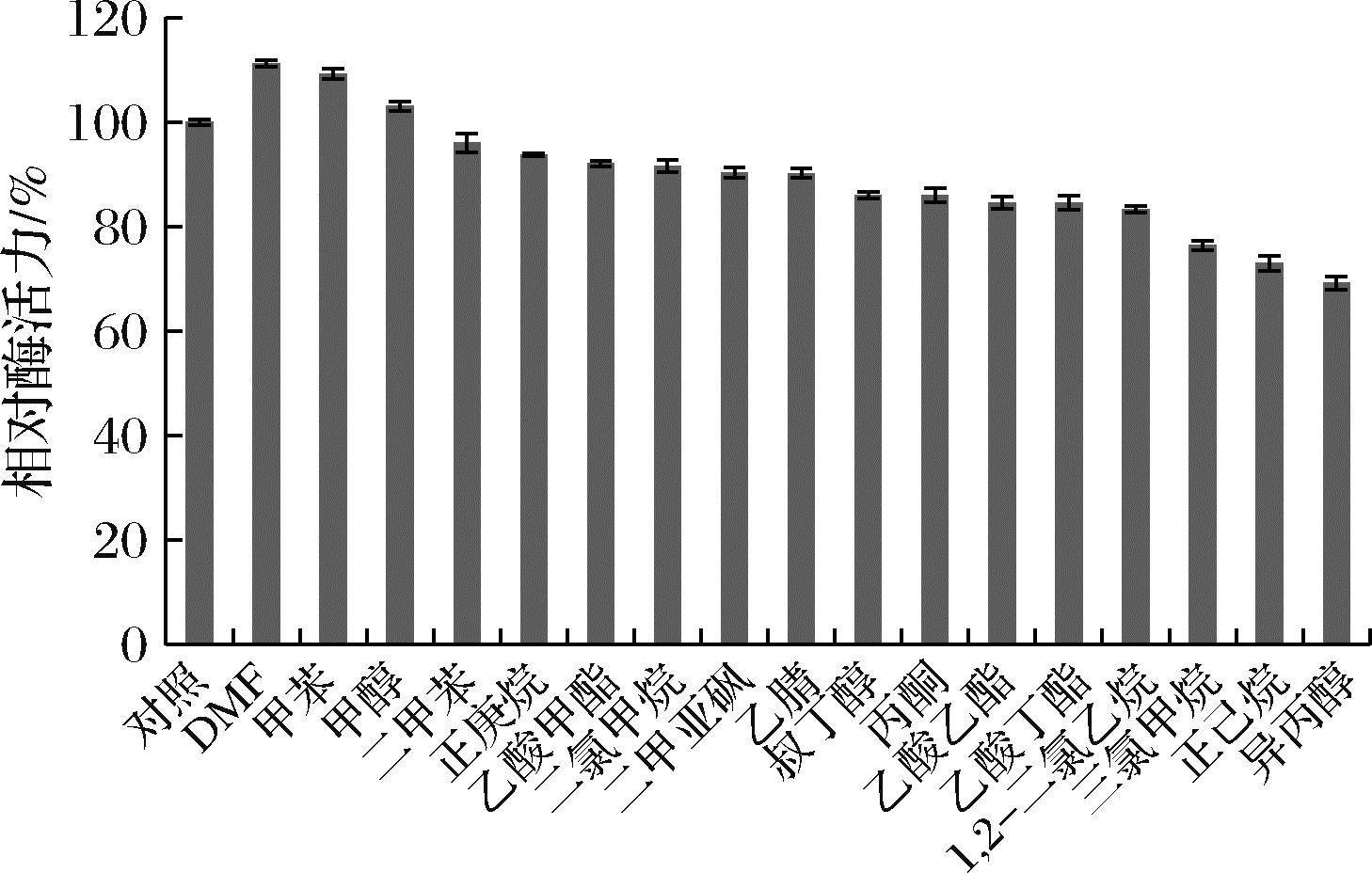
图6 有机溶剂对酶活力的影响
Fig.6 Effect of organic reagents on enzyme activity
2.4 底物特异性分析
2.4.1 合成底物特异性
AtglF水解不同碳链长度合成底物时,表现出对C8底物的水解作用最强,其次依次为C4、C12、C16、C2,水解活性分别是C8为底物时酶活力的13.33%、9.79%、3.07%和1.48%(表2)。可见,脂肪酶AtglF除对C8合成底物具有较高活性外,其他皆弱,提示主要针对中度链长脂肪酸的油脂具有更高活性。
表2 AtglF脂肪酸链长偏好性分析
Table 2 Organic acid chain-length bias of AtglF

缩写名称相对酶活力/%pNPA(C2)对硝基苯酚乙酸酯1.48pNPB(C4)对硝基苯酚丁酸酯13.33pNPC(C8)对硝基苯酚辛酸酯100.00pNPL(C12)对硝基苯酚月桂酸酯9.79pNPP(C16)对硝基苯酚棕榈酸酯3.07
2.4.2 天然底物反应谱
鉴于合成底物与天然底物在结构上的差异,本文进一步分析了脂肪酶AtglF对常见18种天然植物油的水解特征(图7)。以棕榈油为底物时,其相对酶活力最高;对花生油、芥花籽油和大豆油的水解活性偏低,相对酶活力低于50%;对其他植物油的水解程度略有不同,相对于以棕榈油为底物,其水解活性在52%~85%。所测试的18种食用油中,棕榈油饱和脂肪酸含量最高(51%),而其他植物油中饱和脂肪酸含量在5%~20%[20]。由此可见,AtglF偏向于水解饱和脂肪酸含量高的植物油脂,故有可应用于以高饱和脂肪酸植物油脂为原料的挥发性或热敏性化合物的制备。

图7 AtglF对天然底物的特异性
Fig.7 Specificity of AtglF on natural substrates
3 结论
本文首次功能鉴定了来源于丝状真菌黑曲霉的近中性低温脂肪酶,其在25~50 ℃和pH值为5.0~7.0之间能够表现出60%以上酶活力,对中链(C8)合成底物表现出底物偏好性,对所测试的绝大多数天然油脂皆有水解活性,其中对棕榈油的水解活性最高。经过进一步研究,该酶预期会在个人护理、热不稳定产品的酶法合成、食品加工等方面具有潜在应用价值。
[1] RABBANI G, AHMAD E, ZAIDI N D, et al.pH-Induced molten globule state of Rhizopus niveus lipase is more resistant against thermal and chemical denaturation than its native state[J].Cell Biochemistry and Biophysics, 2012, 62(3):487-499.
[2] QUILLES J C J, BRITO R R, BORGES J P, et al.Modulation of the activity and selectivity of the immobilized lipases by surfactants and solvents[J].Biochemical Engineering Journal, 2015, 93:274-280.
[3] STERGIOU P Y, FOUKIS A, FILIPPOU M, et al.Advances in lipase-catalyzed esterification reactions[J].Biotechnology Advances, 2013, 31(8):1846-1859.
[4] CHANDRA P, ENESPA, SINGH R, et al.Microbial lipases and their industrial applications:A comprehensive review[J].Microbial Cell Factories, 2020, 19(1):169.
[5] 张冰玉. 低温脂肪酶基因的克隆、表达及脂肪酶基因高通量筛选方法的初步建立[D].北京:中国农业科学院, 2020.
ZHANG B Y.Cloning and expression of low-temperature lipase gene and preliminary establishment of Qualcomm screening method for lipase gene[D].Beijing:Chinese Academy of Agricultural Sciences, 2020.
[6] GANASEN M, YAACOB N, Raja Noor Zaliha Raja Abd Rahman, et al.Cold-adapted organic solvent tolerant alkalophilic family I.3 lipase from an Antarctic Pseudomonas[J].International Journal of Biological Macromolecules, 2016, 92:1266-1276.
[7] 诸葛健, 王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社, 1994:94-302.
ZHU G J, WANG Z X.Procedure Manual of Industrial Microbial Experimental[M].Beijing:China Light Industry Press, 1994:94-302.
[8] 丛珊滋. 黑曲霉脂类水解酶系的表征与功能解析[D].天津:天津科技大学, 2019.
CONG S Z.Characterization and functional assignment of Aspergillus niger lipolytic enzymes[D].Tianjin:Tianjin University of Science &Technology, 2019.
[9] YAO J, GUI L, YIN S C.A novel esterase from a soil metagenomic library displaying a broad substrate range[J].AMB Express, 2021, 11(1):38.
[10] SHARMA P, SHARMA N, PATHANIA S, et al.Purification and characterization of lipase by Bacillus methylotrophicus PS3 under submerged fermentation and its application in detergent industry[J].Journal of Genetic Engineering and Biotechnology, 2017, 15(2):369-377.
[11] 张悦. 低温脂肪酶Lip ZC12理性改造及纳米花固定化研究[D].大连:大连理工大学, 2019.
ZHANG Y.Study on rational transformation of lip ZC12 and immobilization of nanoflowers[D].Dalian:Dalian University of Technology, 2019.
[12] INFANZ N B, SOTELO P H, MART
N B, SOTELO P H, MART NEZ J, et al.Rational evolution of the unusual Y-type oxyanion hole of Rhodococcus sp.CR53 lipase LipR[J].Enzyme and Microbial Technology, 2018, 108:26-33.
NEZ J, et al.Rational evolution of the unusual Y-type oxyanion hole of Rhodococcus sp.CR53 lipase LipR[J].Enzyme and Microbial Technology, 2018, 108:26-33.
[13] ZHANG Y, JI F L, WANG J Y, et al.Purification and characterization of a novel organic solvent-tolerant and cold-adapted lipase from Psychrobacter sp.ZY124[J].Extremophiles, 2018, 22(2):287-300.
[14] MAHFOUDHI A, BENMABROUK S, FENDRI A, et al.Fungal lipases as biocatalysts:A promising platform in several industrial biotechnology applications[J].Biotechnology and Bioengineering, 2022, 119(12):3370-3392.
[15] SINCHAIKUL S, SOOKKHEO B, PHUTRAKUL S, et al.Optimization of a thermostable lipase from Bacillus stearothermophilus P1:Overexpression, purification, and characterization[J].Protein Expression and Purification, 2001, 22(3):388-398.
[16] BALASUBRAMANIAM B, SUDALAIYADUM PERUMAL A, JAYARAMAN J, et al.Comparative analysis for the production of fatty acid alkyl esterase using whole cell biocatalyst and purified enzyme from Rhizopus oryzae on waste cooking oil (sunflower oil)[J].Waste Management, 2012, 32(8):1539-1547.
[17] KATIYAR M, ALI A.Effect of metal ions on the hydrolytic and transesterification activities of Candida rugosa lipase[J].Journal of Oleo Science, 2013, 62(11):919-924.
[18] XING S Q, ZHU R N, CHENG K, et al.Gene expression, biochemical characterization of a Sn-1, 3 extracellular lipase from Aspergillus niger GZUF36 and its model-structure analysis[J].Frontiers in Microbiology, 2021, 12:633489.
[19] 刘光. 黑曲霉脂肪酶的分离纯化及其性质研究[D].广州:华南理工大学, 2013.
LIU G.Purification and characterization of lipase from Aspergillus niger[D]. Guangzhou:South China University of Technology, 2013.
[20] 陈月晓, 马玉霞, 陆颖, 等.常见食用植物油中特征性脂肪酸的检测及鉴别[J].中国食品卫生杂志, 2012, 24(4):301-305.
CHEN Y X, MA Y X, LU Y, et al.Detection and identification of characteristic fatty acids in common edible vegetable oil[J].Chinese Journal of Food Hygiene, 2012, 24(4):301-305.