浓香型白酒概念的划分、总结和命名始于1979年全国第三届评酒大会,截至2020年,浓香型白酒的产量占全国白酒总产量的60%,销售收入占行业总收入的51%,是我国产销量最大的白酒香型[1]。浓香型白酒的香气以酯香为主,但不同地区白酒的风格存在差异,原因是各地自然气候、原辅材料和生产工艺不同。浓香型白酒酿造工艺的特点之一是采用泥窖固态发酵,窖泥为酿酒功能微生物的生长定殖提供良好的环境,窖泥微生物在长期酿酒过程中不断驯化、富集和固定,参与生香发酵并产生风味物质[2]。
窖泥微生物是酿造微生物的主要来源之一,对浓香型白酒风味特征有较大的影响[3]。不同窖龄中窖泥微生物的群落结构存在明显差异,窖泥微生物多样性随窖龄增加而递增[4],乳酸杆菌属的丰度随窖龄的增加而下降[5]。比较浓香型白酒主要产区:四川、湖北、安徽和江苏的窖泥微生物,发现其优势微生物种类具有明显的差异[6]。而在同一产区的不同酒厂,窖泥微生物同样具有相似性和独特性,例如浓香型白酒的主要产地四川,泸州产区[7]和宜宾产区[6]的优势微生物群落结构和丰富度在保持相似性的同时仍存在差异。窖泥的微生物差异可能会导致酒醅微生物群落结构出现不同。山东是我国浓香型白酒“淡雅”黄淮流派的重要产区,并有学者提出流派差异可能受到微生物多样性的影响[8]。目前研究多集中于“浓郁”川派白酒和安徽产区白酒,针对山东产区浓香型白酒窖池的微生物研究较少。
水分、酸度、酒度、淀粉、还原糖含量是酒醅发酵的主要理化参数,对白酒微生物群落的丰度变化有重要影响[9]。目前已有研究证明,总酸和pH值能够显著影响浓香型白酒不同窖龄、不同位置窖泥的优势菌群含量[10]。水分、温度、pH是导致浓香型白酒发酵过程中酒醅细菌群落结构发生变化的主要因素[11]。温度与浓香型白酒酒醅中梭菌的群落结构呈显著相关性[12]。酒醅作为浓香型白酒发酵的主体,其所含的微生物在发酵过程中不断进行的固液气三相间的物质和能量转化,是浓香型白酒发酵产香和独特风格形成的主要驱动力[13],解析酒醅微生物群落及其与理化指标之间的相关性,对提高浓香型白酒产量及品质起着重要作用。
本研究以山东产区浓香型白酒窖泥和酒醅为研究对象,使用第二代高通量测序技术解析窖泥和酒醅发酵过程中的细菌群落结构,在分子生物学水平上探究山东产区的独有微生物资源,并结合相关性分析揭示酒醅理化指标与细菌群落之间的相关性,为定向筛选山东产区浓香型白酒特征性细菌资源奠定基础,为白酒发酵过程的调控提供理论依据。
1 材料与方法
1.1 材料和试剂
酒醅样品,采集于山东济南趵突泉企业2个不同厂区的浓香型窖池;窖泥样品,采集于酒醅跟踪窖池发酵之后。试剂:重铬酸钾、酒石酸锑钾、亚硝基铁氰化钾、邻苯二甲酸氢钾、NaOH、高氯酸钠、酒石酸钾钠、浓硫酸、盐酸、硼酸、氯化铵、钼酸铵、氟化铵(均为分析纯),国药集团化学试剂有限公司;脱氧核糖核酸(deoxyribonucleic acid, DNA)提取试剂盒,美国Omega BioTek公司。
1.2 仪器和设备
Illumina MiSeq测序平台,上海美吉生物医药科技有限公司;DH-20008高速台式冷冻离心机,上海德洋意邦仪器有限公司;BSA822-CW感量天平,赛多利斯科学仪器(北京)有限公司;DF-1集热式恒温磁力搅拌锅,金坛市中大仪器厂。
1.3 实验方法
1.3.1 窖泥取样方法
根据山东济南某白酒企业实际生产情况,分别在2个厂区(厂一、厂二)各选择2个待跟踪的窖池。在发酵结束后,分别对不同厂区窖泥进行取样(图1)。每个点取样量约为10 g,然后将5个点所取样品混匀后置于无菌袋中,记录样品信息及相关理化指标,于-20 ℃保存备用。
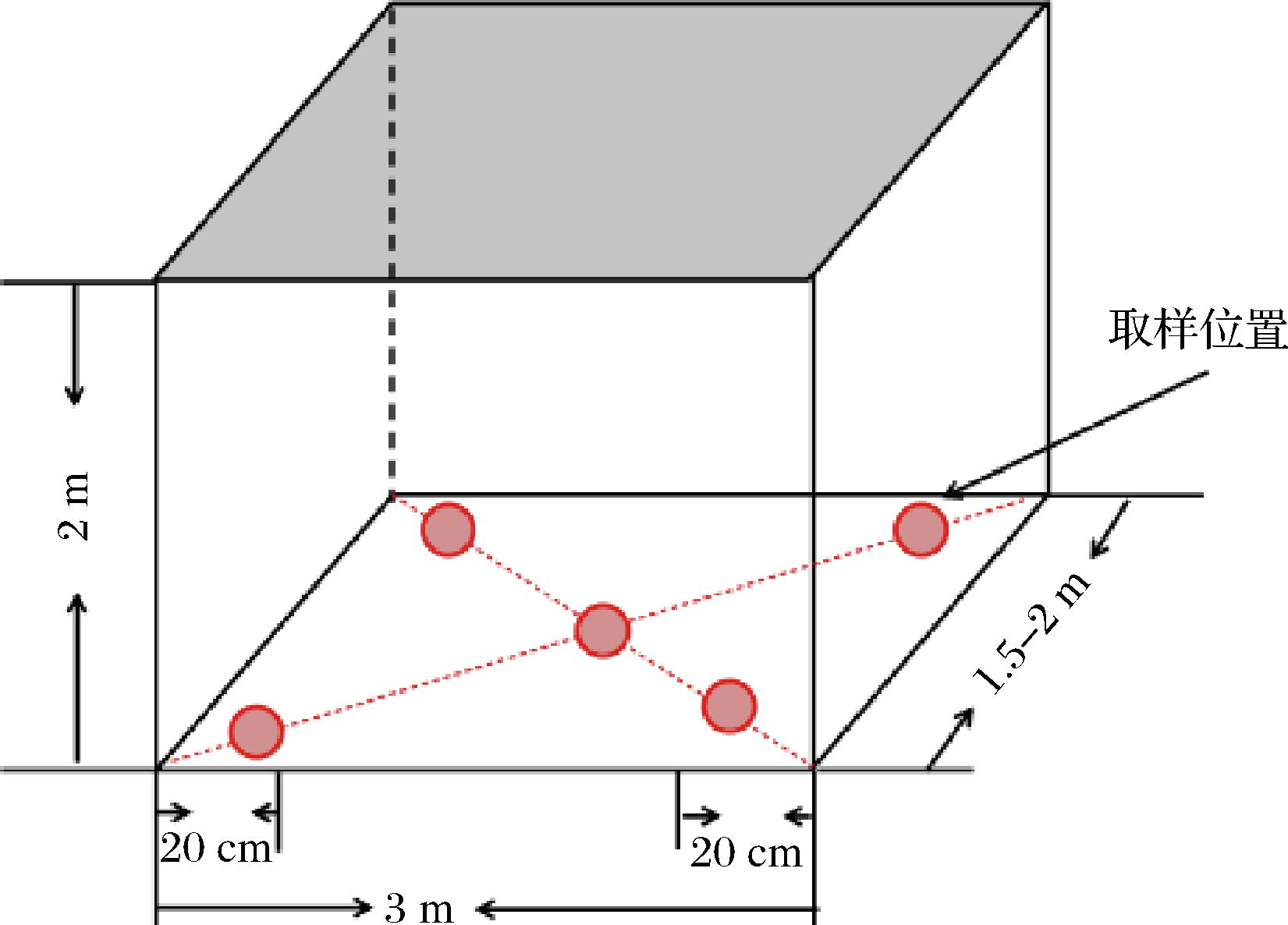
图1 窖泥取样位置
Fig.1 Collection sample location of pit mud
1.3.2 酒醅取样方法
选择窖泥取样所跟踪的窖池,分别选取入窖开始第0、5、10、15、20、30、50、70天为采样时间点。从窖池窖面与夹泥层对角线做两条连线,分别在连线的中点及距夹泥层和窖池表面20 cm处,及两点与中点的中心位置(如图2所示)使用酒醅取样器进行取样。取样时每个点取相同质量的样品后将样品混匀后取300 g样品置于无菌袋中,记录样品信息及相关理化指标,于-20 ℃保存备用。
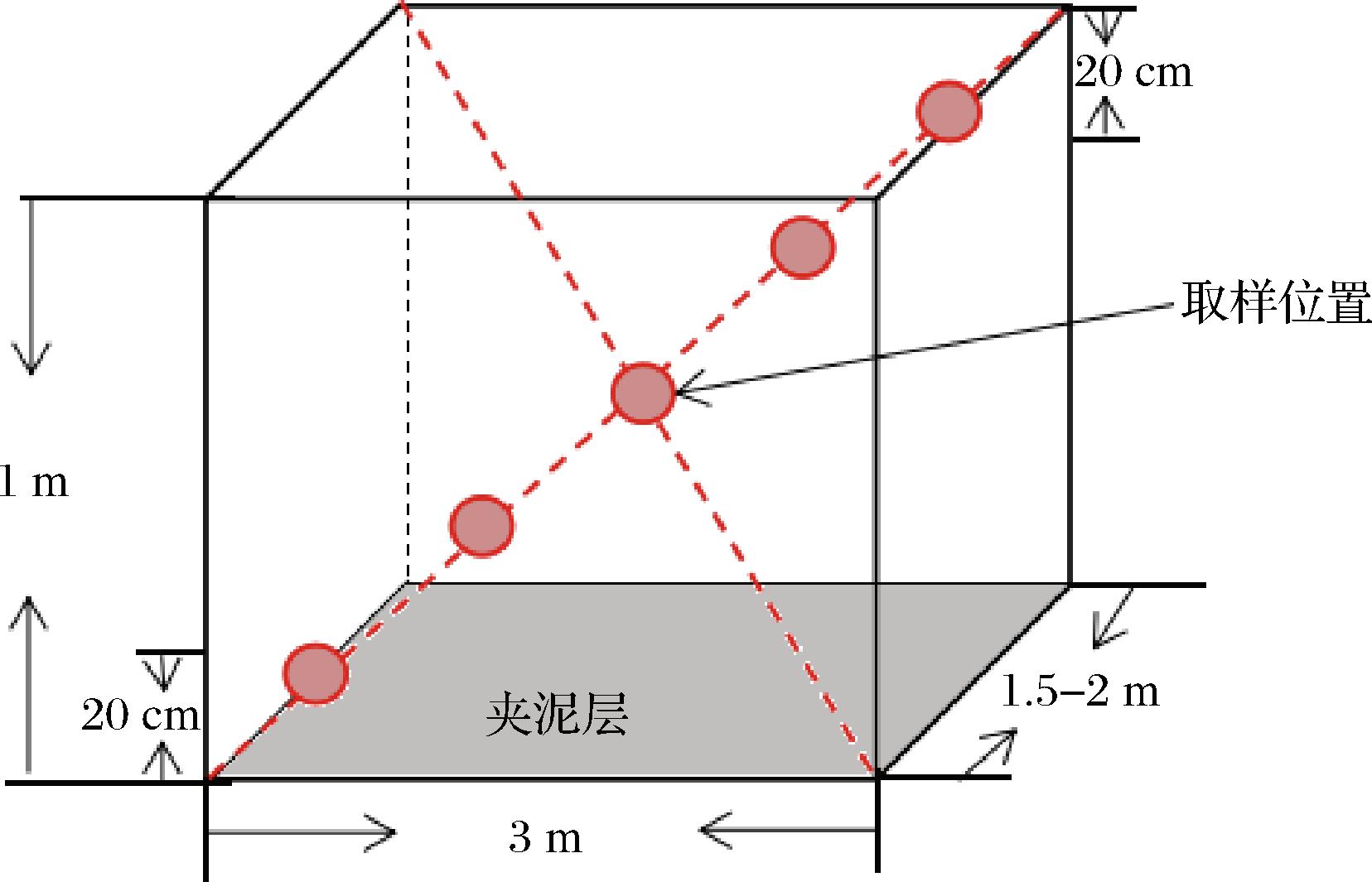
图2 酒醅取样位置
Fig.2 Collection sample location of fermented grains
1.3.3 理化指标检测方法
酒醅水分、酸度、酒份、淀粉、还原糖参考胡晓龙等[12]的方法进行测定。
1.3.4 高通量测序及数据处理
样品到达实验室后立即进行低温保存,采用环境样本DNA提取试剂盒进行基因组DNA提取。使用细菌16S rDNA通用引物对样品所提取的DNA进行扩增。
16S rDNA V3V4可变区引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。
PCR反应体系:DNA样品30 ng,338F和806R引物(5 μmol/L)各1 μL,BSA(2 ng/μL) 3 μL,2×Taq PCR MasterMix 12.5 μL,ddH2O补足至25 μL。
PCR反应条件:95 ℃ 5 min;95 ℃ 45 s,50 ℃ 50 s,72 ℃ 45 s,共25个循环;72° C 10 min[14]。
PCR结束后将产物混合后用20 g/L琼脂糖凝胶电泳检测,检测条件5 V/cm、20 min,使用OMEGA胶回收试剂盒切胶回收PCR产物,Tris-EDTA缓冲液洗脱回收目标DNA片段。将PCR回收产物用Qubit 2.0或NanoVue系统进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。委托上海美吉生物医药科技有限公司进行高通量测序文库构建及Illumina MiSeq双端测序。
按照97%相似性对非重复序列进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列并选出与OTU代表序列相似性在97%以上的序列,生成OTU表格。采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析。使用Qiime平台(http://qiime.org/scripts/assign_taxonomy.html),RDP Classifier(version 2.11 http://sourceforge.net/projects/rdp-classifier/)对OTU进行注释与评估。基于OTU表进行物种组成分析、物种差异分析和环境因子关联分析。
2 结果与分析
2.1 窖泥细菌群落结构多样性分析
2.1.1 窖泥细菌群落测序数据统计
浓香型白酒窖泥微生物高通量测序数据统计如表1所示。测序所得到厂二窖泥有效细菌OTU数目较多;chao 1指数表明厂二窖泥细菌的群落丰富度(community richness)高于厂一;shannon、simpson指数表明两厂区窖泥细菌的群落多样性(community diversity)差异较小;细菌样本的覆盖率(coverage)均在0.99左右,证明测序结果能完整反映浓香型白酒窖泥微生物物种组成信息。
表1 两厂区窖泥微生物群落测序统计
Table 1 Sequencing statistics of microbial communities in pit mud from two factories

样品类型OTU数ShannonSimpsonChao 1覆盖率 厂一窖泥细菌393±15.62.99±0.160.09±0.03185.64±19.070.99±0.01厂二窖泥细菌940±3623.2±0.960.13±0.1469.28±145.210.99±0.01
2.2.2 窖泥细菌群落分析
厂一窖泥和厂二窖泥细菌在门水平上相对丰度最高的优势菌门均为厚壁菌门(Firmicutes)(图3-a)。厂一的优势菌门还包括:互养菌门(Synergistota,7.4%)。厂二的优势菌门还包括:放线菌门(Actinobacteriota,33.6%)、变形菌门(Proteobacteria,7.42%)。LIANG等[15]研究泸州老窖浓香型白酒不同厂区的窖泥微生物多样性,发现厚壁菌门为主要的优势菌门,与本研究结果一致。

a-窖泥细菌门水平相对丰度;b-窖泥细菌属水平相对丰度
图3 两厂区窖泥细菌相对丰度
Fig.3 Relative abundance of bacteria in pit mud in the two factories
厂一窖泥中一共检测到19个优势菌属(相对丰度>1%),厂二窖泥中一共检测到16个优势菌属(图3-b)。产己酸菌属(Caproiciproducens)为厂一窖泥中丰度最高(15.14%)的优势细菌属,其次为乙酸互营菌属(Syntrophaceticus,12.73%)、Fastidiosipila(7.9%)、氨基酸杆菌属(Aminobacterium,7.64%)、互营单胞菌属(Syntrophomonas,7.06%)等;厂二窖泥相对丰度最高的优势菌属为棒状杆菌(22.3%),其次为乳酸菌属(11.83%)、芽孢杆菌属(11.52%)等。张会敏等[16]分析安徽省某浓香型白酒企业的新老窖池窖泥的细菌组成,发现新窖池主要细菌为乳酸杆菌属和产己酸菌属,老窖池主要细菌为产己酸菌属,乳酸杆菌属含量下降。辜杨[17]研究发现产己酸菌属为安徽、甘肃、江苏、四川和山东浓香型白酒窖泥核心微生物中平均丰度最高的菌属,新窖泥中以乳酸菌属为主导,老熟窖泥则以产己酸菌属和乳酸菌属作为主要优势菌属。本研究发现厂一窖泥的优势细菌属主要为产己酸菌属和乙酸互营菌属,厂二的主要优势菌属为棒状杆菌属、乳酸菌属、魏斯氏菌属,研究结果与我国其他浓香型白酒产区窖泥的研究结果相似。厂二投产相对较晚,因此乳酸杆菌属仍占有一定的相对丰度,与浓香型白酒新窖泥中乳酸杆菌属含量相对更高的研究结论保持一致性[18]。
如图4所示,2个厂区窖泥共有细菌属主要有17个,比例最高为棒状杆菌属(Corynebacterium,12.45%),其余主要菌属为产己酸菌属(Caproiciproducens,9.94%)、己酸互营菌属(Syntrophaceticus,7.97%)、乳酸菌属(Lactobacillus,7.25%)、芽孢杆菌属(Bacillus,6.43%)等。四川泸州产区窖泥微生物以乳杆菌属(Lactobacillus)、互营单胞菌属(Syntrophomonas)、甲烷杆菌属(Methanobrevibacter)、己酸菌属(Caproiciproducens)等微生物为主[19]。本研究中窖泥相对含量最高的优势菌属为棒状杆菌属,与其他产地的浓香型白酒优势菌属存在一定差异。有研究证明棒状杆菌属、芽孢杆菌属细菌可以产生乳酸等白酒风味物质[20],因此推测本实验中独有的部分优势菌属可能有助于形成山东产地浓香型白酒的独特风味。
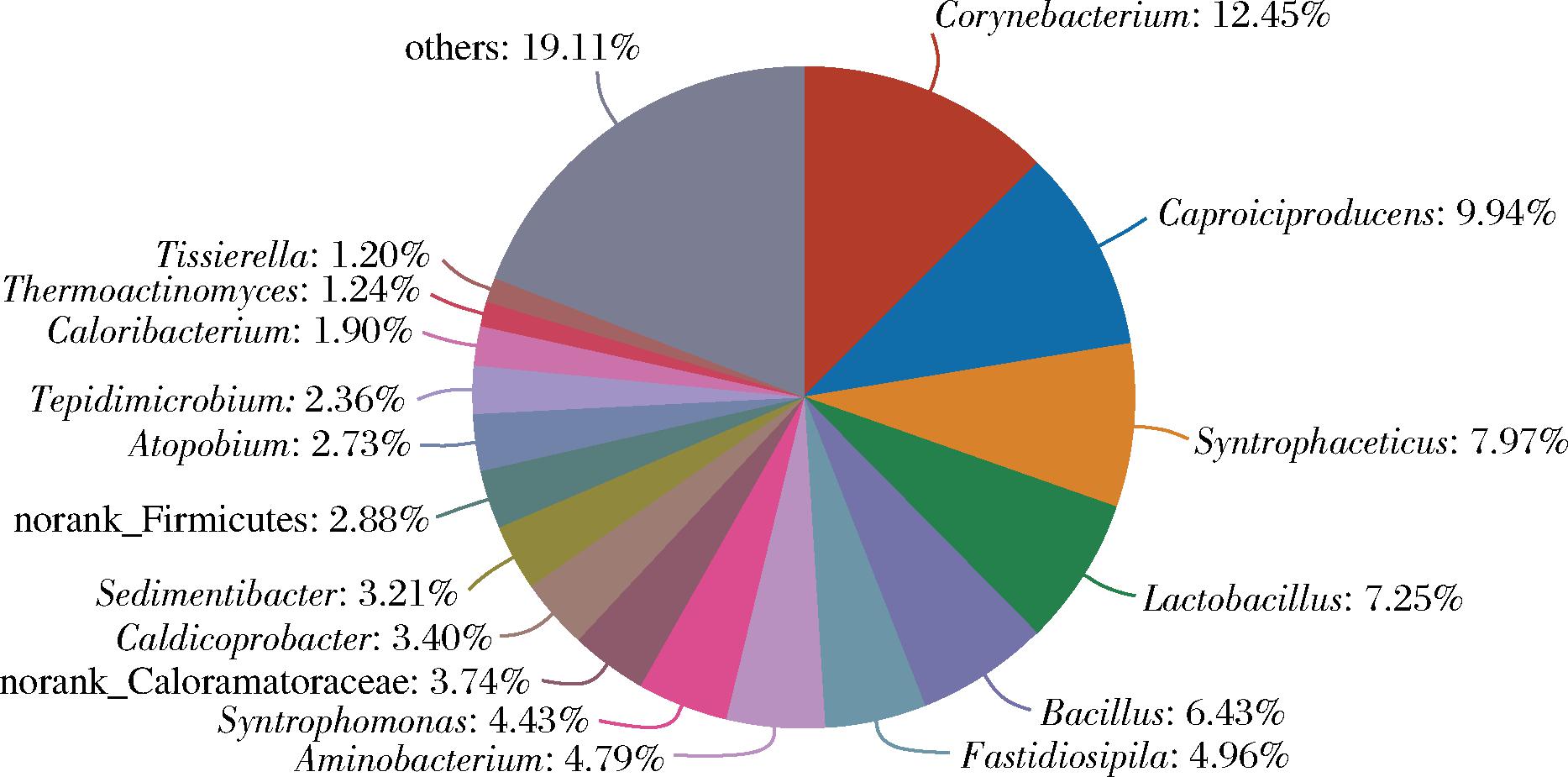
图4 两厂区窖泥细菌共有属
Fig.4 Common genus of bacteria in pit mud in two factories
2.2 酒醅细菌群落结构多样性分析
2.2.1 酒醅细菌群落测序数据统计
浓香型白酒酒醅细菌高通量测序数据的平均值如表2所示。各厂区酒醅中细菌有效OTU数量随着发酵时间的增加呈现由多到少再到多的变化规律。两厂区细菌α多样性指数表明,酒醅中细菌群落的多样性和丰富度同样随发酵时间的增加由高到低再到高。表明2个厂区的酒醅随着发酵时间的增加,细菌群落变化规律一致。细菌样本的覆盖率均在0.99左右,证明测序结果能完整反映浓香型白酒酒醅的细菌物种组成信息。
表2 两厂区酒醅细菌群落测序统计
Table 2 Sequencing statistics of bacterial community in fermented grains of two factories
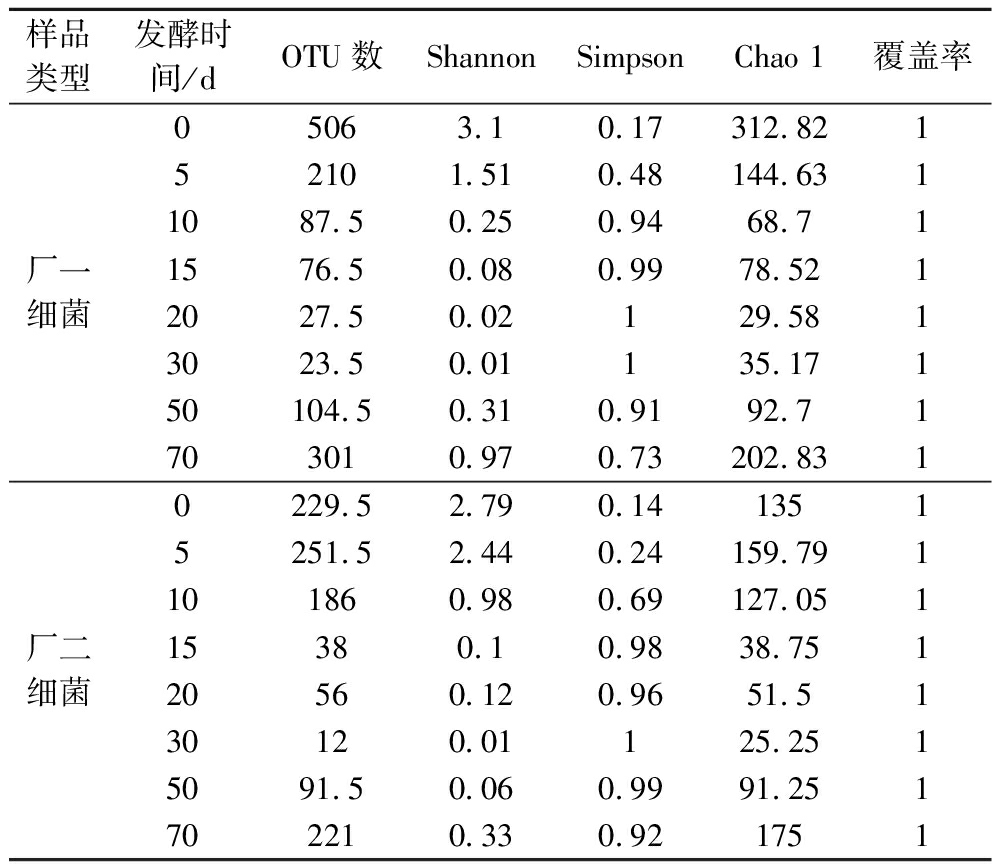
样品类型发酵时间/dOTU数ShannonSimpsonChao 1覆盖率厂一细菌05063.10.17312.82152101.510.48144.6311087.50.250.9468.711576.50.080.9978.5212027.50.02129.5813023.50.01135.17150104.50.310.9192.71703010.970.73202.831厂二细菌0229.52.790.1413515251.52.440.24159.791101860.980.69127.05115380.10.9838.75120560.120.9651.5130120.01125.2515091.50.060.9991.251702210.330.921751
2.2.2 酒醅发酵过程的细菌群落分析
总体水平上,2个厂区酒醅细菌中丰度最高的优势菌属均为乳酸杆菌属(89.43%,80.98%)(图5-a),说明两厂区酒醅的主要细菌属相同。厂一酒醅细菌优势菌属分别为乳酸杆菌属和芽孢杆菌属(1.25%)。厂二酒醅细菌优势菌属有4个,包括乳酸菌属、芽孢杆菌属(3.16%)、魏斯氏菌属(1.72%)、金黄杆菌属(1.77%)。
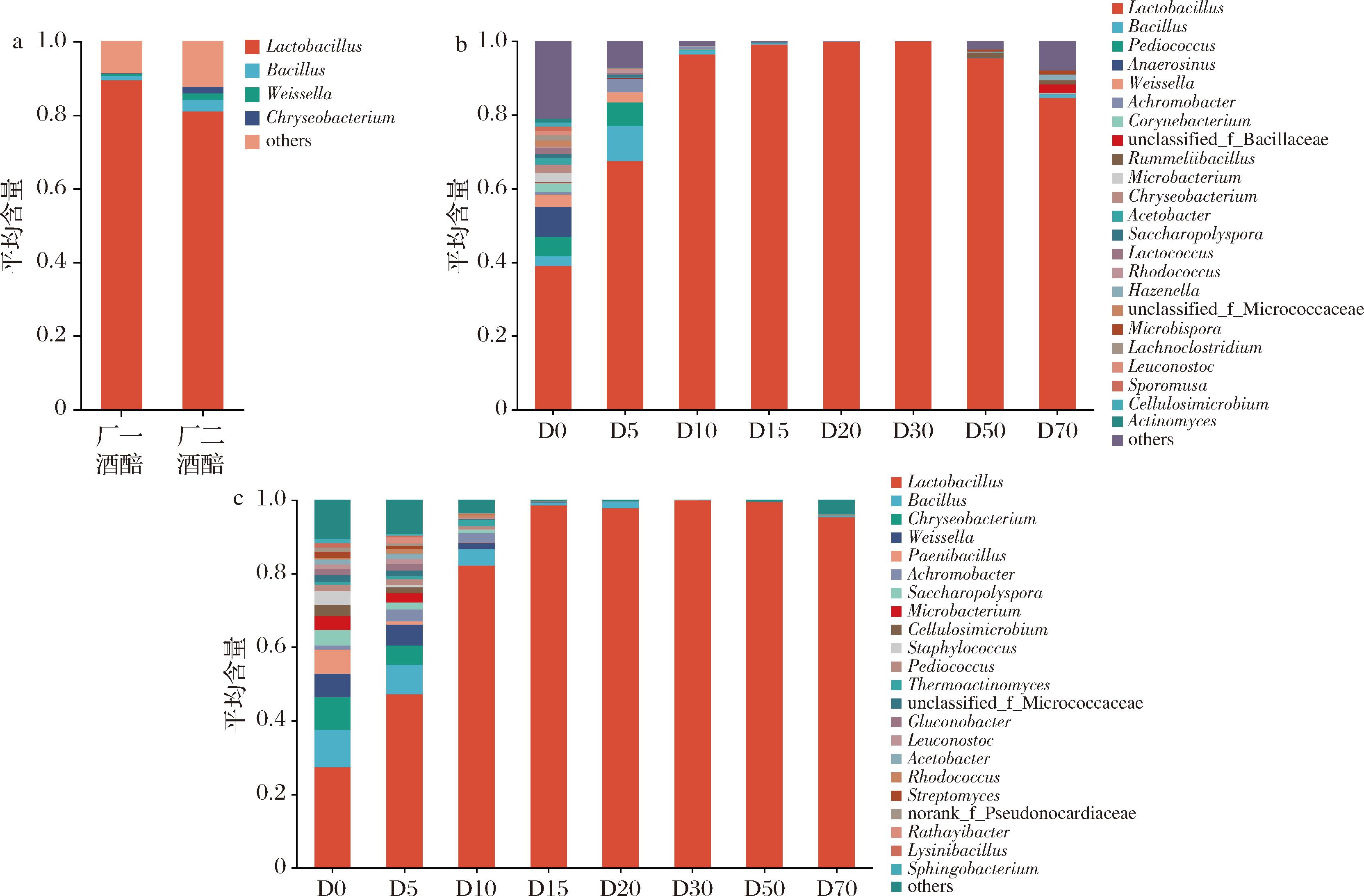
a-两厂区酒醅细菌属水平整体对比;b-厂一酒醅细菌属水平群落结构;c-厂二酒醅细菌属水平群落结构
图5 两厂区酒醅细菌平均含量随发酵过程的变化情况
Fig.5 The average content of bacteria in fermented grains in the two factories during the fermentation
厂一酒醅细菌群落结构随发酵时间的变化如图5-b所示,共检测到23个优势菌属。在发酵开始时(D0),酒醅优势菌属包括:乳酸杆菌属(38.96%)、Anaerosinus(8.20%)、球菌属(Pediococcus,5.25%)等。发酵中期(D10~D30),酒醅中的乳酸杆菌属细菌的相对丰度逐渐升高,直到98%左右,占绝对优势。发酵末期(D60~D70),厂一酒醅的细菌多样性稍有增加,但乳酸杆菌含量仍然占绝对优势。
厂二酒醅细菌群落结构随发酵时间的变化如图5-c所示,共检测到22个优势菌属。厂二酒醅在发酵开始时(D0),酒醅优势菌属包括:乳酸杆菌属(27.37%)、芽孢杆菌属(10.12%)、金黄杆菌属(8.91%)、魏斯氏菌属(Weissella,6.38%)等。乳酸杆菌属细菌的相对丰度在发酵中期(D10~D30)逐渐升高,达到99%;在发酵末期(D60~D70),酒醅细菌的多样性增加,乳酸杆菌属的相对丰度稍有下降,但仍然占绝对优势。本研究发现厂一和厂二酒醅细菌群落结构随发酵时间变化的趋势一致,且都以乳酸杆菌属为绝对优势菌属,说明2个厂区产酒品质稳定、风格统一。乳酸杆菌属一般在厌氧环境下繁殖,生长pH值为3.0~6.0,拥有较强的耐酸能力,能够利用糊精产生乳酸、乳酸乙酯等风味成分,增加酒体厚重感,在发酵中后期仍能大量繁殖[21],解释了本实验中乳酸菌属在发酵中后期丰度较高的原因。乔宗伟[22]研究四川浓香型白酒酒醅发酵规律发现,发酵一周后酒醅细菌以乳酸杆菌属为主。王海燕等[23]研究发现,江苏某厂浓香型白酒酒醅在发酵起始阶段微生物种类丰富,随着发酵时间的延长,酒醅细菌多样性下降,仅剩乳酸杆菌为优势菌种,本实验研究结果与其相同。芽孢杆菌属为两厂区酒醅发酵前期占有一定丰度的优势菌属,有研究证明芽孢杆菌为白酒酒醅中的功能产香菌[24]。
2.3 酒醅发酵过程中理化指标与细菌群落相关性分析
浓香型白酒酒醅发酵过程中,其水分、酒分、酸度、淀粉和还原糖等理化指标会随着发酵时间而产生变化,与酒醅中的微生物群落互相影响并与后续原酒的风味和质量息息相关。
由表3可知,厂一和厂二酒醅的水分含量在53%~65%,且随着发酵时间的变化,两个厂区酒醅的水分含量变化呈现相同的趋势,在发酵开始时(0~5 d)酒醅含水量有较大提升。在发酵第5~30天,酒醅含水量基本保持稳定。在发酵结束时(70 d),酒醅含水量下降,可能是发酵完成,水分蒸发导致。
表3 两个厂区酒醅发酵过程中的理化指标
Table 3 Physicochemical indicators during fermentation of fermented grains in two factories
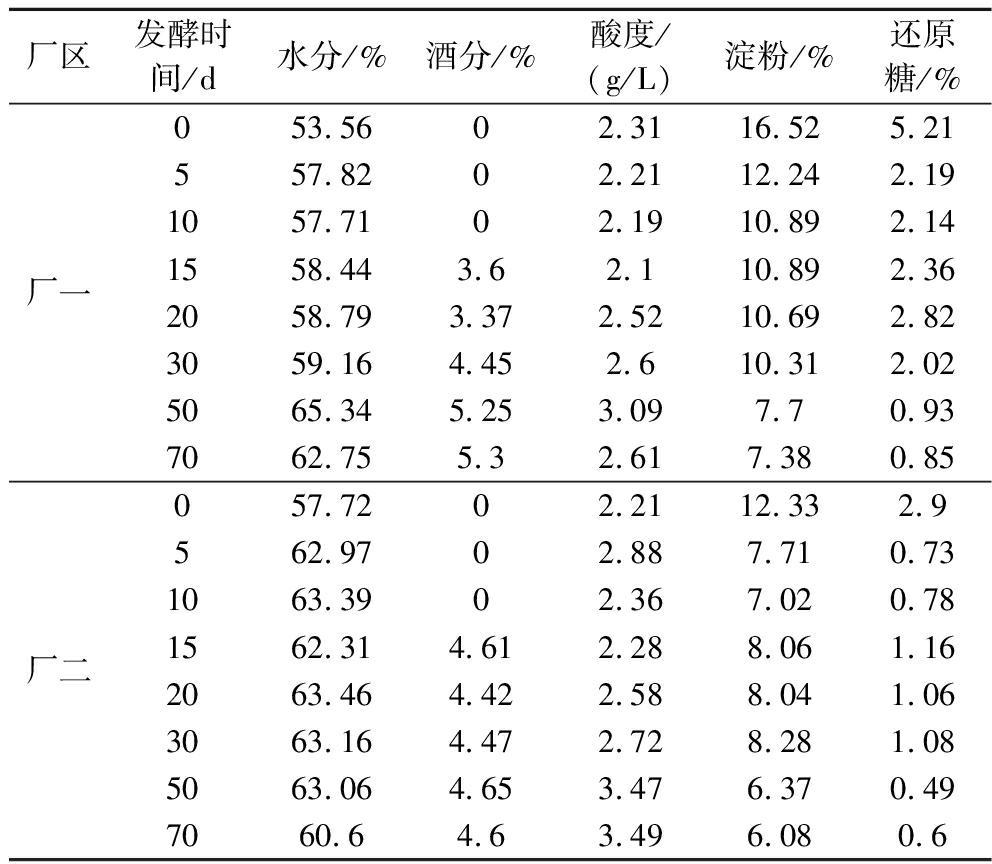
厂区发酵时间/d水分/%酒分/%酸度/(g/L)淀粉/%还原糖/%厂一053.5602.3116.525.21557.8202.2112.242.191057.7102.1910.892.141558.443.62.110.892.362058.793.372.5210.692.823059.164.452.610.312.025065.345.253.097.70.937062.755.32.617.380.85厂二057.7202.2112.332.9562.9702.887.710.731063.3902.367.020.781562.314.612.288.061.162063.464.422.588.041.063063.164.472.728.281.085063.064.653.476.370.497060.64.63.496.080.6
两厂区酒醅酒精含量的变化趋势一致。在发酵初期(0~10 d)两个厂区均未检测到酒精含量,主要是由于发酵初期窖池内氧气和淀粉等营养物质较为丰富,酵母主要起到糖化、降解淀粉的作用[23]。在发酵中期(15~30 d),两个厂区酒醅的酒精含量逐渐提升,并在发酵后期趋于稳定(50~70 d),原因是酵母菌在发酵中后期主要产生酒精和其他风味物质,在发酵末期酒精浓度达到一定值时,酿酒酵母的增殖受到抑制,发酵结束。
酸是浓香型白酒的重要呈味物质,也是合成多种白酒香味成分的前体物质。两厂区酒醅从入窖到发酵中期(0~30 d)的酸度都维持在一个较稳定的值,在发酵后期(50~70 d)两厂区酒醅的酸度均有所提升,可能与发酵后期酒醅微生物群落结构复杂度提升,优势菌数量增加有关。
酒醅中的淀粉是微生物发酵产生酒精的基础。还原糖是由淀粉水解产生,然后被酵母代谢生成酒精。淀粉含量和还原糖含量之间有着密切的关系,可以反映糖化和发酵速度的平衡关系[25],是酒醅发酵过程中的重要理化指标。厂二酒醅的初始淀粉含量和还原糖含量相比厂一较低,但在发酵结束时两厂区淀粉含量和还原糖含量相差不大。两厂区酒醅中淀粉和还原糖含量变化趋势一致,均在发酵初期(0~5 d)呈现快速降低的趋势;在发酵中期(10~30 d)保持稳定;在发酵中后期(30~70 d)均下降至较低的水平,证明两厂区酒醅发酵较为完全。
理化指标与群落相关性分析表明(图6),酒醅细菌中相对丰度最高的乳酸杆菌属与酒醅酒精含量呈现显著正相关(P<0.01)关系,与淀粉含量呈负相关,有报道证明乳酸菌在发酵过程中能够贡献乙醇、乳酸等重要风味物质[26],与本研究结论一致;高温放线菌属(Thermoactinomyces)、类芽孢杆菌属(Paenibacillus)、无色杆菌属(Achromobacter)、链霉菌属(Streptomyces)、金黄杆菌属(Chryseobacterium)与酒醅酒精含量呈现显著负相关(P<0.01)关系;糖多孢菌属(Saccharopolyspora)、葡萄球菌属(Staphylococcus)、片球菌属(Pediococcus)、明串珠菌属(Leuconostoc)、魏斯氏菌属(Weissella)、芽孢杆菌属(Bacillus)、葡萄糖酸菌属(Gluconobacter)、红球菌属(Rhodococcus)、醋酸菌属(Acetobacter)等9个属均与酒醅中淀粉含量和还原糖含量呈显著正相关,说明淀粉和还原糖是该菌属生长代谢必需物质,与水分和酒精含量呈显著负相关,解释了发酵15 d之后酒醅细菌多样性急剧下降的原因。酒醅细菌对酸度变化不敏感。
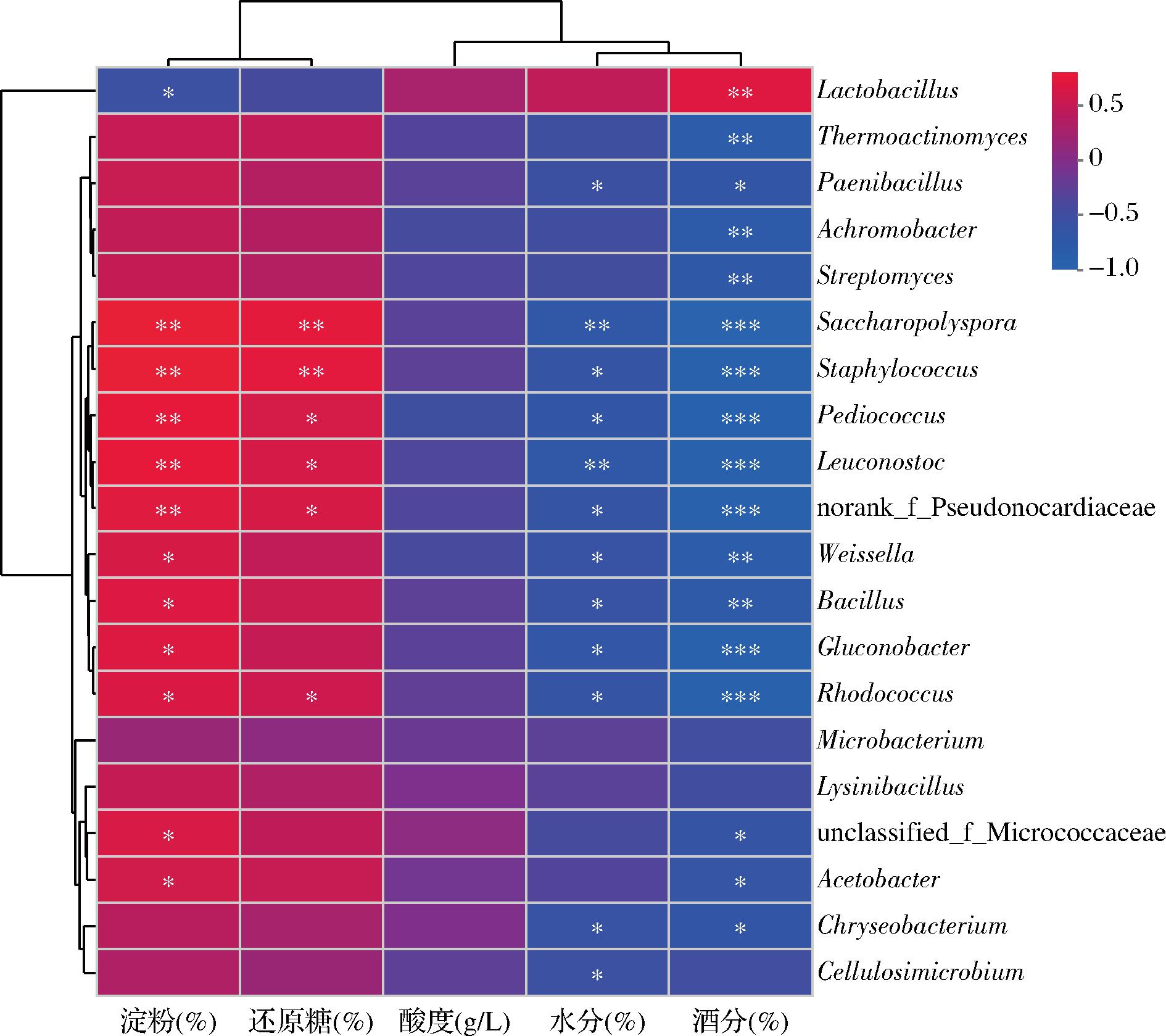
图6 酒醅优势细菌属与理化指标的相关性热图
Fig.6 Correlation heat map of dominant bacterial genera and physicochemical indicators in fermented grains
注:X轴和Y轴分别为环境因子和物种,通过计算获得相关性R值和P值。R值在图中以不同颜色展示,右侧图例是不同R值的颜色区间,P值若小于0.05则用*标出,*P≤0.05,**P≤0.01,***P≤0.001。
3 结论
本研究使用高通量测序手段对山东产区某浓香型白酒企业两个厂区的窖泥、酒醅样品的微生物群落组成和理化因子对微生物群落结构的影响进行研究。共检测出细菌47个属,窖泥细菌以棒状杆菌属、产己酸菌属、己酸互营菌属、乳酸菌属、芽孢杆菌属、Fastidiosipila等为主,与其他产区的浓香型白酒窖泥细菌组成存在一定差异;酒醅细菌以乳酸杆菌属占绝对优势。理化性质相性分析结果表明,酒精含量与乳酸杆菌属相对丰度呈现显著正相关(P<0.01);淀粉和还原糖含量与糖多孢菌属、葡萄球菌属、片球菌属、明串珠菌属、魏斯氏菌属、芽孢杆菌属的相对丰度呈显著正相关(P<0.05),以上菌属的相对丰度还与酒分呈显著负相关(P<0.05)。
本研究通过对山东产区浓香型白酒窖泥、酒醅细菌群落结构的剖析,明确了山东白酒产区窖泥和酒醅细菌群落特点,并初步分析了理化因子对酒醅细菌群落的影响。对探究细菌对窖泥老熟、白酒风味的影响以及酿酒关键微生物的培养条件均具有积极作用。
[1] 晓文. 2020年度全国酿酒产业产量数据[J].酿酒科技, 2021(2):96.
XIAO W.Output data of China alcoholic drinks industry in 2020[J].Liquor-Making Science &Technology, 2021(2):96.
[2] 胡景辉, 陈禹锜, 薛新新, 等.浓香型白酒发展概述[J].中国酿造, 2022, 41(6):24-30.
HU J H, CHEN Y Q, XUE X X, et al.Overview of development of strong-flavor Baijiu[J].China Brewing, 2022, 41(6):24-30.
[3] ZHANG Y Y, ZHU X Y, LI X Z, et al.The process-related dynamics of microbial community during a simulated fermentation of Chinese strong-flavored liquor[J].BMC Microbiology, 2017, 17(1):196.
[4] 唐云, 姚海刚, 李彦涛, 等.不同窖龄浓香型白酒窖泥细菌群落结构及其多样性分析研究[J].酿酒科技, 2022(7):93-98.
TANG Y, YAO H G, LI Y T, et al.Community structure and diversity of microorganisms in Nongxiang Baijiu pit mud of different ages[J].Liquor-Making Science &Technology, 2022(7):93-98.
[5] ZHANG H M, MENG Y J, WANG Y L, et al.Prokaryotic communities in multidimensional bottom-pit-mud from old and young pits used for the production of Chinese Strong-Flavor Baijiu[J].Food Chemistry, 2020, 312:126084.
[6] 翟磊, 于学健, 冯慧军, 等.宜宾产区浓香型白酒酿造生境中细菌的群落结构[J].食品与发酵工业, 2020, 46(2):18-24.
ZHAI L, YU X J, FENG H J, et al.Study on bacterial community structure in the brewing habitats of strong flavour Chinese Baijiu from Yibin region[J].Food and Fermentation Industries, 2020, 46(2):18-24.
[7] 熊亚. 泸州老窖不同窖龄窖泥中细菌及古菌种群多样性和系统发育研究[D].雅安:四川农业大学, 2014.
XIONG Y.Population diversity and phylogeny of bacteria and Archaea in different aged pit muds of Luzhou Laojiao cellar[D].Yaan:Sichuan Agricultural University, 2014.
[8] 王明跃, 张文学.浓香型白酒两个产区窖泥微生物群落结构分析[J].微生物学通报, 2014, 41(8):1498-1506.
WANG M Y, ZHANG W X.Analysis of microbial community structure in pit mud from two Chinese Luzhou-flavor liquor producing areas[J].Microbiology China, 2014, 41(8):1498-1506.
[9] 张春林, 杨亮, 李喆, 等.酱香型白酒二轮次堆积酒醅微生物群落与理化指标相关性研究[J].中国酿造, 2021, 40(11):31-36.
ZHANG C L, YANG L, LI Z, et al.Correlation between microbial community and physicochemical indexes in fermented grains of stacking fermentation process of the second rounds sauce-flavor Baijiu[J].China Brewing, 2021, 40(11):31-36.
[10] 胡晓龙, 余苗, 王康丽, 等.浓香型白酒窖泥微生物群落多样性及理化因素对其影响[J].食品研究与开发, 2021, 42(2):178-185; 204.
HU X L, YU M, WANG K L, et al.Diversity of microbial community and its correlation with physicochemical factors in Luzhou-flavor liquor pit mud[J].Food Research and Development, 2021, 42(2):178-185; 204.
[11] 高俊杰. 浓香型酒醅发酵过程中挥发性风味物质及细菌菌群结构的动态变化研究[D].济南:齐鲁工业大学, 2023.
GAO J J.Study on dynamic changes of volatile flavors and bacterial flora structure in Luzhou-flavor fermented grains during fermentation[D].Jinan:Qilu University of Technology, 2023.
[12] 胡晓龙, 冯大鸿, 张勇, 等.浓香型酒醅中梭菌群落演替及其与理化性质的相关性分析[J].食品与发酵工业, 2023, 49(5):94-100.
HU X L, FENG D H, ZHANG Y, et al.Dynamic clostridial community succession and its correlation with physicochemical factors in Jiupei for strong flavor Baijiu production[J].Food and Fermentation Industries, 2023, 49(5):94-100.
[13] 张大凤, 李可, 刘森, 等.中国浓香型白酒窖池糟醅中微生物群落演替分析[J].食品科学, 2012, 33(15):183-187.
ZHANG D F, LI K, LIU S, et al.Microbial community succession of Chinese Luzhou-flavor liquor lees[J].Food Science, 2012, 33(15):183-187.
[14] 曹润洁, 何宏魁, 葛向阳, 等.芝麻香型酒醅堆积过程中微生物结构变化分析[J].微生物学通报, 2019, 46(6):1371-1380.
CAO R J, HE H K, GE X Y, et al.Change of microbial community during stacking fermentation of sesame-flavor Jiupei[J].Microbiology China, 2019, 46(6):1371-1380.
[15] LIANG H P, LUO Q C, ZHANG A, et al.Comparison of bacterial community in matured and degenerated pit mud from Chinese Luzhou-flavour liquor distillery in different regions[J].Journal of the Institute of Brewing, 2016, 122(1):48-54.
[16] 张会敏, 王艳丽, 孟雅静, 等.浓香型白酒新、老窖池池壁泥与池底泥原核菌群结构分析[J].食品科学, 2020, 41(18):180-187.
ZHANG H M, WANG Y L, MENG Y J, et al.Analysis of prokaryotic community structures in bottom and wall muds from old and young pits used for production of strong-flavor Baijiu[J].Food Science, 2020, 41(18):180-187.
[17] 辜杨. 中国浓香型白酒酿造窖泥微生物多样性研究[D].无锡:江南大学, 2021.
GU Y.Study on microbial diversity in pit mud of Luzhou-flavor liquor brewing in China[D].Wuxi:Jiangnan University, 2021.
[18] HU X L, DU H, REN C, et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Applied and Environmental Microbiology, 2016, 82(8):2506-2515.
[19] CHEN L, LI Y Z, JIN L, et al.Analyzing bacterial community in pit mud of Yibin Baijiu in China using high throughput sequencing[J].PeerJ, 2020, 8:e9122.
[20] 姚惟琦, 陈茂彬, 镇达, 等.浓香型白酒酒醅中乳酸菌分离及其对模拟固态发酵的影响[J].酿酒, 2010, 37(3):37-41.
YAO W Q, CHEN M B, ZHEN D, et al.Isolation of lactate-producing microbes from fermented grains of Luzhou-flavor liquor and their effect on simulative solid-state fermentation[J].Liquor Making, 2010, 37(3):37-41.
[21] SINGER E, BUSHNELL B, COLEMAN-DERR D, et al.High-resolution phylogenetic microbial community profiling[J].The ISME Journal, 2016, 10(8):2020-2032.
[22] 乔宗伟. 中国浓香型白酒窖池微生物区系解析[D].成都:四川大学, 2005.
QIAO Z W.Microflora analysis of Luzhou-flavor liquor pits in China[D].Chengdu:Sichuan University, 2005.
[23] 王海燕, 张晓君, 徐岩, 等.浓香型和芝麻香型白酒酒醅中微生物菌群的研究[J].酿酒科技, 2008(2):86-89;91.
WANG H Y, ZHANG X J, XU Y, et al.Analysis of the bacterial community in fermented grains of strong aroma style and roasted sesame aroma style liquor[J].Liquor-Making Science &Technology, 2008(2):86-89;91.
[24] 张丽莺. 窖池微生态资源库的建立、管理及菌种保藏[D].成都:四川大学, 2006.
ZHANG L Y.Establishment, management and strain preservation of micro-ecological resource pool in pits[D].Chengdu:Sichuan University, 2006.
[25] 杨静, 宰红玉, 万春环, 等.浓香型白酒窖池内酒醅成分动态分析研究[J].酿酒, 2018, 45(1):55-59.
YANG J, ZAI H Y, WAN C H, et al.Dynamic analysis research Luzhou-flavor liquor cellar pool composition of fermented grains[J].Liquor Making, 2018, 45(1):55-59.
[26] DE ANGELIS M, CALASSO M, CAVALLO N, et al.Functional proteomics within the genus Lactobacillus[J].Proteomics, 2016, 16(6):946-962.