海带是来源最丰富的大型藻类之一,其独特的营养成分使其在近年来成为了食品研究的热点之一,并被大量开发成高附加值的食品及药物。海带中含有许多具有开发潜力的营养物质,包括多糖、蛋白质、维生素、矿物质等。此外,海带的其他成分,如海藻酸盐、褐藻胶、甘露醇等也在食品工业中有其特定的作用。作为食品配料,海带已经被广泛添加到各式各样的产品中,包括汤类,饮料,保健品等。其中,大量的鲜味成分更使得海带成为调味品中常见的配料。然而,其强烈的腥味给食品工业带来了巨大挑战,并限制海带在加工食品中的使用。海带的腥味主要由醛类,酮类,醇类物质组成,包括1-辛烯-3-酮、壬醛、(E)-2-壬烯醛、(E,Z)-2,6-壬二烯醛和1-辛烯-3-醇等[1-3]。因此,在开发海带系列产品时,寻找高效的去除腥味方法至关重要。
为了减轻海带等藻类的腥味,充分发挥其在食品工业中的潜力,研究人员探索了各种脱腥技术,包括物理、化学和生物脱腥技术。物理脱腥技术不对腥味物质的结构进行改变,只通过物理方法分离或掩盖腥味物质以降低腥味物质带来的不良风味,虽然相对其他方法安全性较高,通常此类方法不能从根本上去除腥味物质。在实际生产中,部分加工技术会对海带的营养完整性和风味产生不良影响,如蒸汽蒸馏法产生较大能耗且高温对热敏感功效成分产生破坏;活性炭吸附、环糊精包埋、微胶囊化等方法选择性较低,在降低腥味的同时也降低了海带天然的愉悦香气和味道[4-6];掩盖法利用其他风味对腥味进行掩盖,未能从根本上去除腥味,改变了海带的风味类型,如甘草被报道能有效掩盖海带腥味,但处理后带有甘草香气[7]。化学脱腥技术利用化学物质与腥味物质发生化学反应改变腥味物质的结构,从而降低腥味。此类方法通常使用酸、碱或氧化剂,如盐酸[4-5]、柠檬酸[4-5]、Ca(OH)2[7]等。此类过程中容易产生不易去除的化学残留,且容易产生较多的化学废弃物。生物脱腥法以其自然环保,高营养保留率,高安全性的优势逐渐成为了近年的研究热点[8-10]。目前关于海带生物脱腥的研究主要集中在以酿酒酵母和乳酸菌为基础的工艺开发。ZHU等[9]比较了酿酒酵母、戊糖片球菌和植物乳杆菌对海带发酵脱腥的效果,发现酿酒酵母脱腥效果最佳,不饱和醛脱除率达到91%,而戊糖片球菌和植物乳杆菌的相应脱除率为43%~55%。GONG等[11]报道了基于酿酒酵母的海带脱腥效果,发现经过酿酒酵母发酵后海带中的1-辛烯-3-醇和部分醛类几乎被完全脱除。WEI等[12]结合天然抗氧化剂浸泡和酿酒酵母发酵,使得不饱和醛和酮的脱除率达到72%。谷怡静[10]利用植物乳杆菌对海带进行发酵处理,在优化的发酵条件下,典型腥味化合物的脱除率达到39%~60%。此外,曲霉也被发现有一定的脱腥功能。SEO等[2]利用米曲霉发酵脱除海带的不良风味,经过4 d发酵后不良风味脱除率为72%。NIE等[13]在红曲霉中也发现了类似的脱腥效果。总体来说,酿酒酵母发酵脱腥效果最佳,对特定腥味物质可以完全脱除,但发酵产生的酒香味道影响了海带原有的香气,限制了该方法的使用,而基于乳酸菌和霉菌的生物脱腥方法对腥味物质的脱除率相对偏低。
因此,本研究首次提出了基于芽孢杆菌的发酵脱腥方法,并探讨了该方法相关的脱腥机理,为未来的海带深加工提出了可行的脱腥方案。通过解决海带香气带来的限制,使其成为一种多用途的营养配料,丰富应用场景,促进海带在食品工业中的进一步发展。
1 材料与方法
1.1 材料与试剂
干海带,产自福建省宁德市,为国内海带主要产区;地衣芽孢杆菌(Bacillus licheniformis)CICC 20227,中国工业微生物菌种保藏管理中心;Viscozyme L,诺唯赞公司;1-辛烯-3-酮(≥95%)、(E,E)-2, 4-癸二烯醛(≥95%),Aladdin(上海)有限公司;C7-C30正构烷烃,Sigma-Aldrich公司;甲醇(色谱纯),Honeywell公司;葡萄糖(分析纯)、甘油(分析纯)、细菌学蛋白胨(色谱纯)、盐酸、NaOH(分析纯)、二氯甲烷(分析纯),广州化学试剂厂。
1.2 仪器与设备
BSA822-CW电子秤天平,赛多利斯科学仪器(北京)有限公司;手持式pH计,梅特勒托利多公司;YXQ-100A立式蒸汽压力灭菌器,上海博迅公司;Exceed-Cc-16超纯水机,成都唐氏康宁科技发展有限公司;GHP-9160恒温培养箱、HZQ-X700C恒温振荡器,上海一恒科学仪器有限公司;ST16R冷冻离心机,赛默飞世尔科技公司;7890B-5977B气质联用仪、HP-Innowax毛细管色谱柱(60 m×0.25 mm×0.25 μm),安捷伦科技公司;MPS Robotic PSI多功能处理平台,Gerstel;50/30 μm DVB/CAR/PDMS Stableflex,固相微萃取头,美国Supelco公司。
1.3 实验方法
1.3.1 样品准备
干海带粉碎过60目筛,加入20倍质量的水,将pH值调至6.5,加入质量分数为5% Viscozyme L,55 ℃下酶解4 h后,100 ℃水浴锅中灭酶15 min。冷却后,破壁机处理6 min制成海带匀浆。
1.3.2 海带匀浆的发酵处理
1.3.2.1 培养基
NB培养基:牛肉浸膏 3 g/L,蛋白胨 5 g/L,葡萄糖 2.5 g/L,pH 7.2;
NA培养基:NB培养基加入20 g/L的琼脂,pH 7.2。
发酵培养基:海带匀浆加入5 g/L的细菌学蛋白胨和8 g/L的葡萄糖, pH 7.0~7.5。
1.3.2.2 种子菌悬液制备
将-20 ℃保存的20227甘油菌在NA培养基中划线,30 ℃培养24 h得到单菌落。挑取活化平板上的单菌落接种到NB培养基中,37 ℃、180 r/min培养活化24 h,菌液作为后期发酵所使用的种子菌悬液。
1.3.2.3 海带匀浆发酵
将种子菌悬液以5%的接种量接种到海带匀浆中,设定发酵参数:发酵温度为37 ℃,发酵转速220 r/min,发酵3 d,得到的海带匀浆发酵液-20 ℃保存备用。同时制备未接种海带匀浆以相同参数处理作为对照。
1.3.3 海带挥发性化合物成分分析
发酵脱腥处理后,将海带匀浆对照与发酵脱腥后的海带匀浆利用顶空固相微萃取(headspace-solid phase microextraction, HS-SPME)结合气相色谱-质谱联用(GC-MS)对海带挥发性化合物成分进行对比分析。
样品准备:分别取2 g海带匀浆与顶空瓶中,加入25 μL的内标溶液(32.88 mg/L的2-辛醇)中制成样品用于分析。
HS-SPME条件:采用前期优化的固相微萃取方法,将顶空瓶置于60 ℃平衡10 min后,将预老化的50/30 μm DVB/CAR/PDMS Stableflex固相微萃取头插入顶空瓶中在60 ℃下振荡萃取30 min。萃取后,在GC进样口解吸25 min进行色谱分析。
色谱条件:HP-Innowax毛细管色谱柱(60 m×0.25 mm×0.25 μm);进样口温度250 ℃;载气为高纯He,流速1.2 mL/min,分流比1∶10;程序升温:40 ℃保持5 min,以5 ℃/min的速度升至240 ℃,保持15 min。
质谱条件:采用电子轰击电离离子源;离子源能量70 eV;离子源温度250 ℃;传输线温度250 ℃;扫描范围为m/z 29~450。
数据处理:采用MassHunter软件,对比数据库(NIST2017)对挥发性化合物成分进行定性分析,结合线性保留指数(linear retention index,LRI),特征离子峰,保留匹配度大于70%的物质判断化合物成分。LRI以C6-C33正构烷烃在相同实验条件下计算得出。采用内标法计算化合物相对含量。
1.3.4 气味活度值(odor activity value, OAV)计算
采用OAV评估挥发性化合物对整体风味的影响,确定海带腥味的关键化合物[14-15]。相应化合物的OAV按公式(1)计算:
(1)
式中:Ci,待测化合物的相对含量,μg/kg;OTi,待测化合物在水中的气味阈值,μg/kg。OAV>1的化合物被认为对香气有重大影响[14-15]。
1.3.5 发酵脱腥机理分析
为分析腥味化合物脱除的潜在机理,选取1-辛烯-3-酮,2,4-癸二烯醛和辛醛作为代表性化合物进行研究。参照XU等[16]的方法并作适当修改。5%的种子菌悬液被接种于含蛋白胨和葡萄糖的培养基中,设定发酵参数:发酵温度为37 ℃,发酵转速220 r/min,发酵3 d完成菌液制备。将100 μL的单一化合物标准品甲醇溶液(100 mg/mL)和甲醇对照分别加入100 mL菌液中,继续在相同条件下发酵1 h。完成发酵后,使用二氯甲烷对发酵液进行萃取,并采用GC-MS分析发酵液的成分。同时,准备100 μg/mL的标准品溶液作为对照。
1.3.6 数据分析
采用MassHunter软件分析处理GC-MS数据,并利用NIST2017对物质匹配检索;采用Microsoft Excel绘制图表;采用Statistical Analysis System 9.3实验数据进行显著性分析。本研究过程中涉及的所有实验均进行3次重复。
2 结果与分析
2.1 发酵对海带匀浆挥发性化合物的影响
采用HS-SPME和GC-MS对提前制备的海带匀浆的挥发性化合物进行分析。基于数据库比对,结合保留指数和特征离子峰,从未发酵的海带匀浆中检出56种挥发性化合物,发酵后的海带匀浆中检出59种挥发性化合物,总离子流图如图1、图2所示。
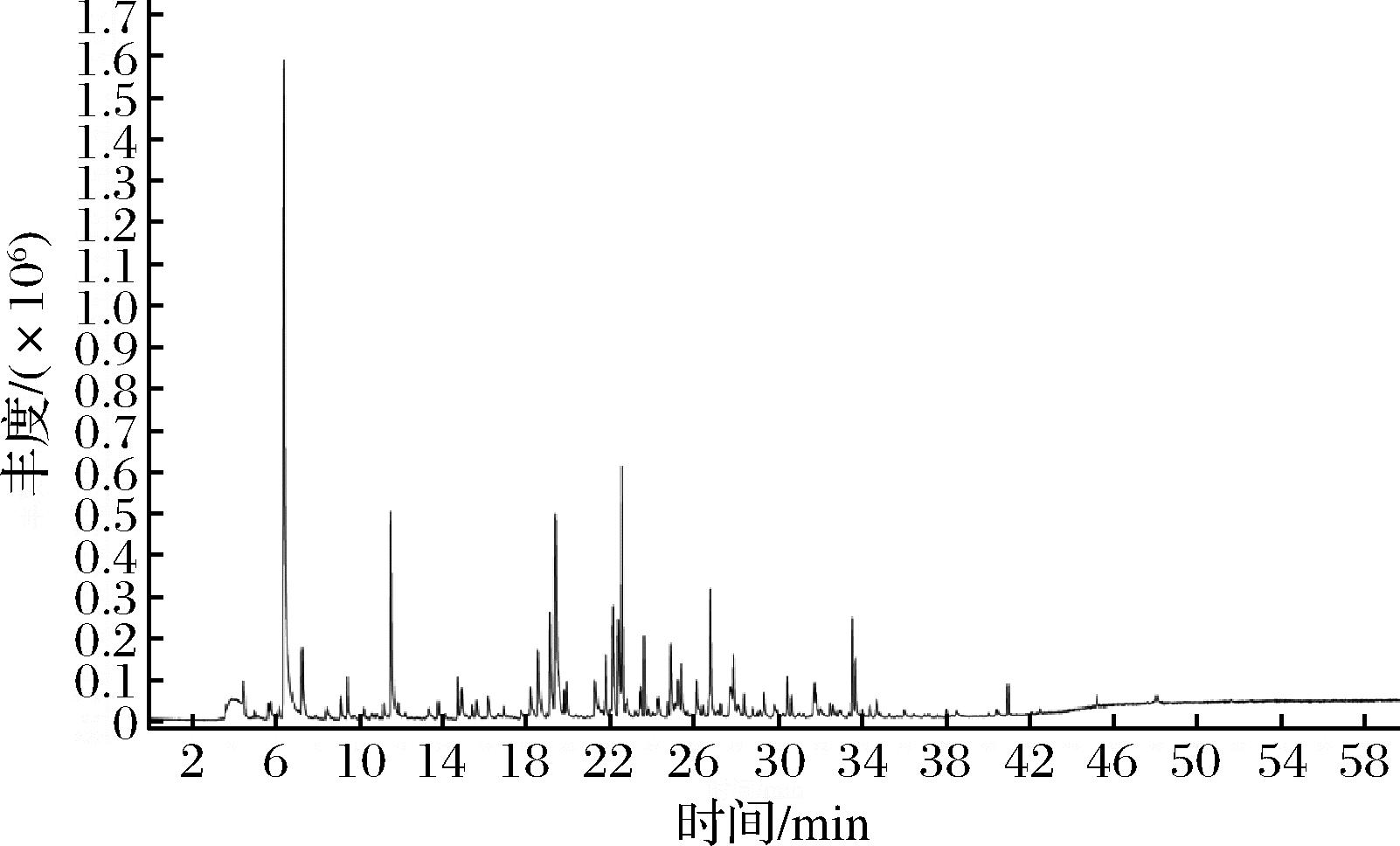
图1 未发酵海带匀浆挥发性化合物的总离子流图
Fig.1 Total ion chromatogram of volatile compounds in unfermented kelp homogenate
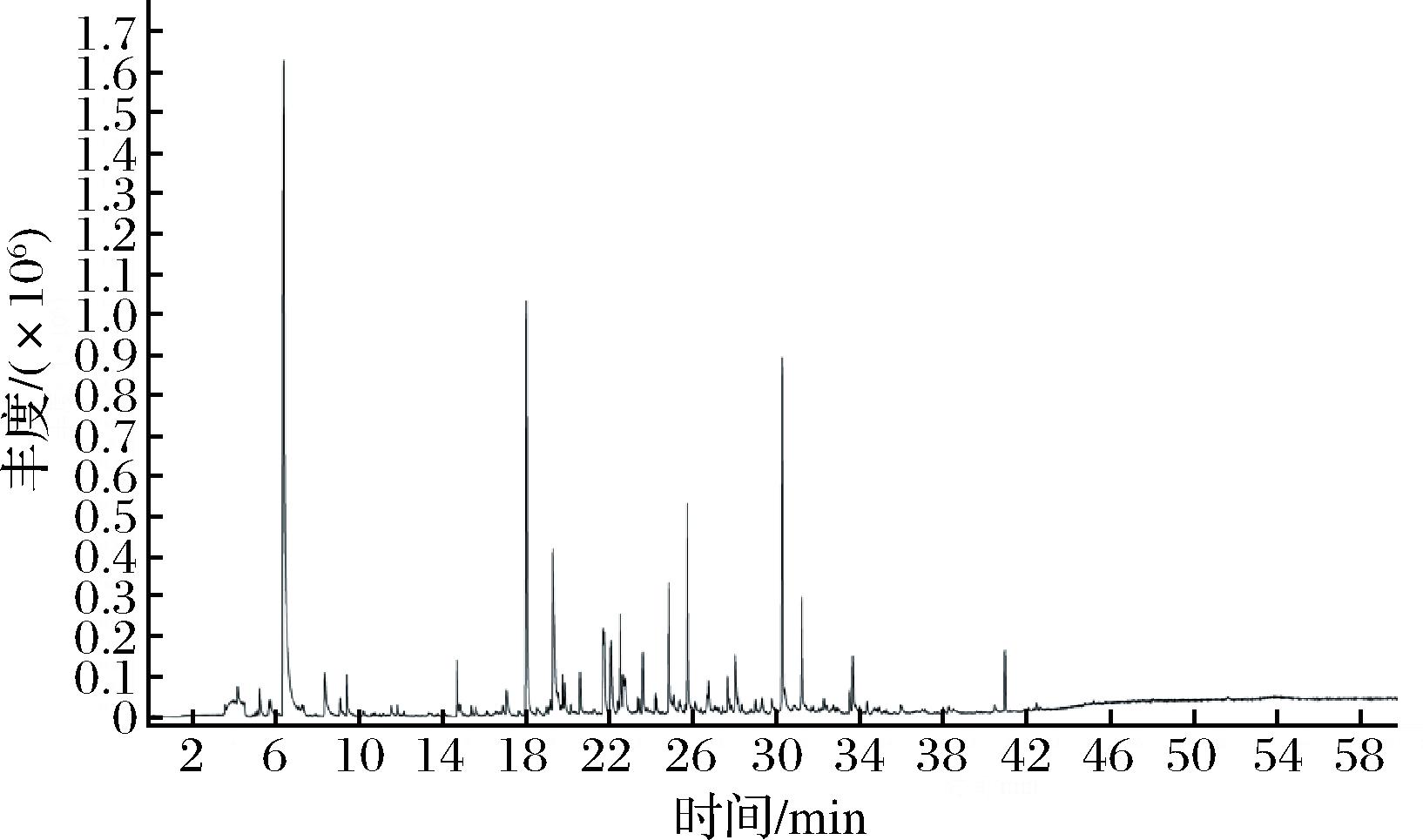
图2 发酵后海带匀浆挥发性化合物的总离子流图
Fig.2 Total ion chromatogram of volatile compounds in fermented kelp homogenate
虽然挥发性化合物数量变化较小,各类化合物的种类、含量及占比在发酵后发生了显著的变化(图3)。未发酵的海带匀浆的挥发性化合物组成为醛类19种、醇类14种、酮类4种、烷烃3种、烯烃4种、酯类6种、呋喃2种和杂环化合物4种。而发酵后挥发性物质组成为醛类4种、醇类16种、酮类11种、烷烃3种、烯烃4种、酯类6种、酸类4种、呋喃2种和杂环化合物9种。在含量方面,在两种主要化合物中,醛类化合物在发酵后出现了96.04%的下降,而醇类化合物未出现显著变化。其他化合物中,烷烃、烯烃、酯类和呋喃均出现显著下降,而酮类化合物和杂环化合物含量大幅上升,含量分别增加了711.46%和771.77%。同时,发酵过程还产生了发酵前不含的酸类化合物。从占比的角度看,在未发酵组中醛类和醇类化合物含量占比较高,分别为40.93%和29.75%,合计为70.68%。发酵后醛类化合物占比下降为1.23%,基本完全去除。值得注意的是,酮类、酸类和杂环类化合物均呈现较大幅度的提升,分别占发酵后挥发性化合物的28.57%、19.01%和19.11%。发酵前醛类化合物可见,地衣芽孢杆菌发酵大幅降低了以腥味化合物为主的醛类,同时产生了其他的挥发性化合物,改变了海带匀浆的风味。
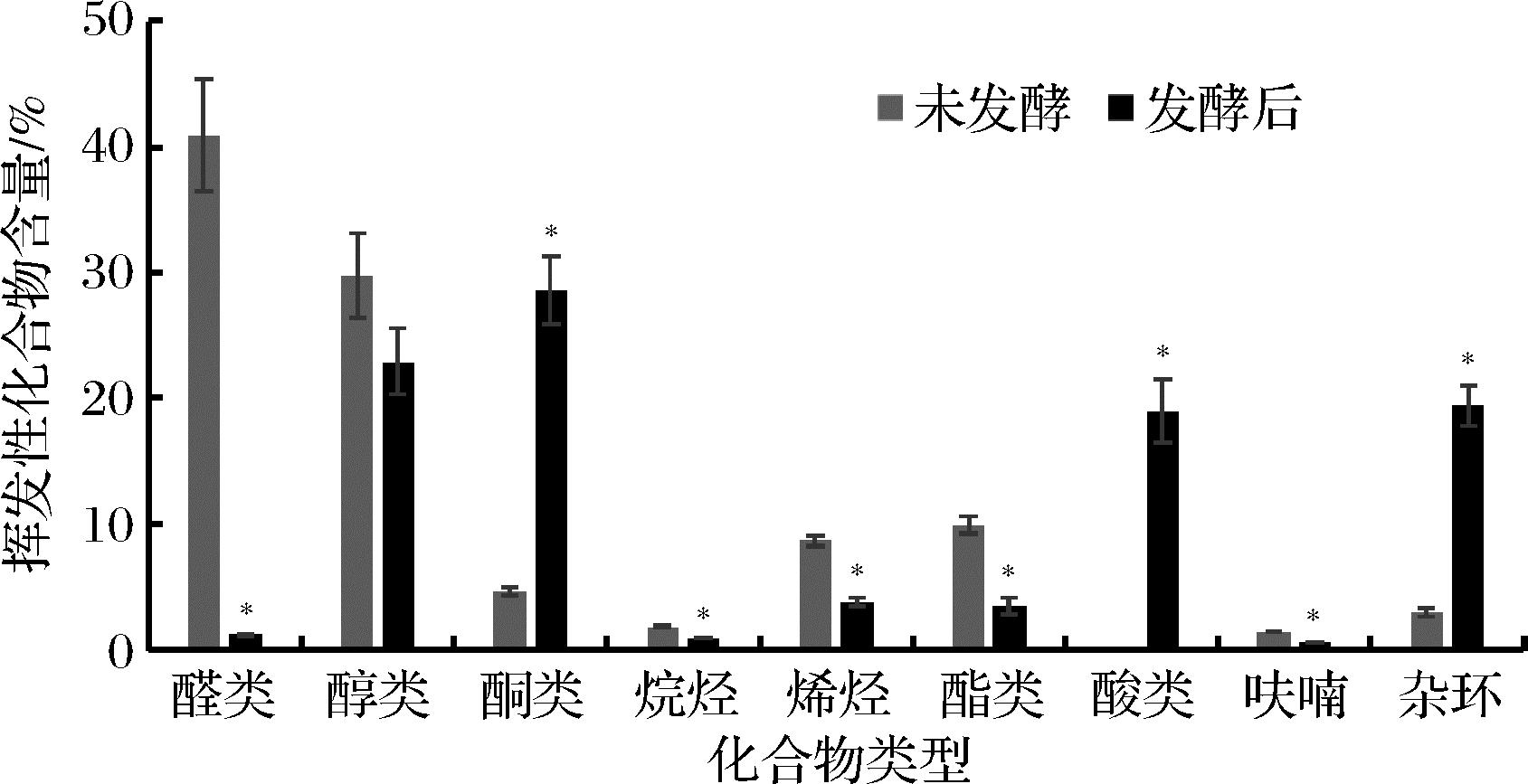
图3 未发酵与发酵后海带匀浆挥发性化合物类型
Fig.3 The types of volatile compounds of unfermented and fermented kelp homogenate
注:*代表发酵后与未发酵有显著性差异(P<0.05)。
为了进一步研究具体的挥发性化合物变化趋势,挥发性化合物的相对含量如表1所示。结果显示,海带匀浆中检出的腥味化合物为饱和及非饱和醛类,包括己醛、庚醛、辛醛、壬醛、(E)-2-庚烯醛、(E)- 2-辛烯醛、(E)-2-壬烯醛、(E,E)-2,4-壬二烯醛、(E,E)-2,6-壬二烯醛、(E,Z)-2,4-癸二烯醛、(E,E)-2,4-癸二烯醛等以及少数烯酮和烯醇,包括1-辛烯-3-酮和1-辛烯-3-醇,此结果与文献报道结果一致[3, 17]。
表1 未发酵与发酵后海带匀浆挥发性化合物的鉴定与定量分析
Table 1 Identification and quantification of the volatile compounds in unfermented and fermented kelp homogenate

分类序号CAS鉴定方法化合物名称含量/(μg/kg)未发酵发酵后含量变化醛类118829-55-5MS, LRI(E)-2-庚烯醛26.34±2.36ND∗↓266-25-1MS, LRI己醛24.82±2.361.83±0.15∗↓32548-87-0MS, LRI(E)- 2-辛烯醛16.43±1.481.53±0.22∗↓4100-52-7MS, LRI苯甲醛11.55±1.171.43±0.02∗↓5122-78-1MS, LRI苯乙醛7.45±2.89ND∗↓6124-19-6MS, LRI壬醛6.57±0.54ND∗↓73913-81-3MS, LRI(E)-2-癸烯醛6.51±0.61ND∗↓8124-13-0MS, LRI辛醛4.84±0.55ND∗↓918829-56-6MS, LRI(E)-2-壬烯醛4.27±0.46ND∗↓1025152-84-5MS, LRI(E,E)-2,4-癸二烯醛4.27±0.44ND∗↓11111-71-7MS, LRI庚醛4.08±0.39ND∗↓1225152-83-4MS, LRI(E,Z)-2,4-癸二烯醛2.31±0.26ND∗↓131576-87-0MS, LRI(E)-2-戊烯醛1.81±0.180.30±0.17∗↓14110-62-3MS, LRI戊醛1.51±0.11ND∗↓15505-57-7MS, LRI2-己烯醛1.28±0.14ND∗↓165910-87-2MS, LRI(E,E)-2,4-壬二烯醛1.25±0.15ND∗↓175973-71-7MS, LRI3,4-二甲基苯甲醛1.25±0.04ND∗↓1817587-33-6MS, LRI(E,E)-2,6-壬二烯醛1.13±0.00ND∗↓19498-60-2MS, LRI3-糠醛1.05±0.02ND∗↓醇类13391-86-4MS, LRI1-辛烯-3-醇27.49±2.1913.79±0.87∗↓218409-17-1MS, LRI(E)-2-辛烯-1-醇16.35±1.505.04±0.25∗↓364-17-5MS, LRI乙醇10.06±0.611.88±0.54∗↓4104-76-7MS, LRI2-乙基-1-己醇9.71±0.338.20±0.63560-12-8MS, LRI苯乙醇7.77±3.053.13±0.116111-87-5MS, LRI1-辛醇6.26±0.582.00±0.12∗↓74254-15-3MS1,2-丙二醇4.09±1.081.41±0.05896-76-4MS, LRI2,4-二叔丁基苯酚3.11±0.179.09±1.36∗↑9111-27-3MS, LRI1-己醇2.74±0.823.93±0.30101573-28-0MS, LRI3,6-二甲基-3-庚醇1.59±0.071.50±0.871131502-14-4MS, LRI(E)-2-壬烯-1-醇1.24±0.10ND∗↓1271-41-0MS, LRI1-戊醇1.1±0.111.42±0.17 13111-70-6MS, LRI1-庚醇1.05±0.04ND∗↓1498-00-0MS, LRI2-呋喃甲醇 1±0.141.58±0.10∗↑1524347-58-8MS, LRI2,3-丁二醇ND34.27±4.81∗↑1623708-56-7MS, LRI6-十一烷醇ND5.23±0.55∗↑1778-70-6MS, LRI芳樟醇ND1.52±0.07∗↑18556-82-1MS, LRI异戊烯醇ND1.13±0.09∗↑酮类14312-99-6MS, LRI1-辛烯-3-酮10.28±0.891.47±0.13∗↓238284-27-4MS, LRI3,5-辛二烯-2-酮2.07±0.22ND∗↓379-77-6MS, LRI反式-β-紫罗兰酮1.15±0.121.34±0.00∗↑41604-34-8MS, LRI6,10-二甲基-2-十一酮1.14±0.080.32±0.18∗↓5513-86-0MS, LRI乙偶姻ND72.17±7.12∗↑628123-56-0MS3,4-二羟基-3,4-二甲基-2,5-己二酮ND19.51±2.73∗↑7431-03-8MS, LRI2,3-丁二酮ND12.48±1.33∗↑8106-68-3MS, LRI3-辛酮ND4.47±0.05∗↑9110-43-0MS, LRI2-庚酮ND2.04±0.04∗↑105704-20-1MS, LRI2-羟基-3-戊酮ND1.74±0.15∗↑112371-19-9MS, LRI3-甲基-2-庚酮ND1.74±0.15∗↑12110-93-0MS, LRI6-甲基-5-庚烯-2-酮ND1.47±0.03∗↑烷烃1124-18-5MS, LRI癸烷2.64±0.262.75±0.06 2637-97-8MS, LRI2-碘-戊烷1.99±0.200.10±0.06∗↓31120-21-4MS, LRI十一烷1.12±0.121.25±0.10
续表1

分类序号CAS鉴定方法化合物名称含量/(μg/kg)未发酵发酵后含量变化烯烃11014-60-4MS, LRI1,3-双(1,1-二甲基乙基)-苯20.37±0.9712.26±1.31∗↓226456-76-8MS3,5,5-三甲基-2-己烯2.97±0.241.87±0.09∗↓31700-10- 3MS1,3-环辛二烯2.25±0.18ND∗↓419883-29-5MS(E,E)-1,3,5-十一碳三烯1.51±0.070.36±0.01∗↓555534-69-5MS(E)-2,2-二甲基-4-癸烯ND1.35±0.03∗↑酯类13050-69-9MS正己酸乙烯酯14.83±1.480.56±0.32∗↓2126-73-8MS磷酸三丁酯7.82±0.2912.27±2.4731000368-74-8MS甲酸2-丙基戊酯3.98±0.32ND∗↓493-58-3MS, LRI苯甲酸甲酯1.74±0.100.95±0.02∗↓5141-78-6MS, LRI乙酸乙酯1.45±0.090.06±0.03∗↓61000356-78-3MS邻苯二甲酸庚-4-基异丁酯1.22±0.050.67±0.15∗↓酸类110148-74-0MS3-羟基-异缬氨酸ND59.37±8.38∗↑2503-74-2MS, LRI3-甲基-丁酸ND12.05±1.60∗↑332391MS, LRI二乙基乙酸ND6.45±0.39∗↑463169-61-9MS2-甲基-戊酸ND1.13±0.14∗↑呋喃13777-69-3MS, LRI2-戊基呋喃2.85±0.030.69±0.03∗↓2109-99-9MS, LRI四氢呋喃1.61±0.131.89±0.15杂环化合物11000 222-86-6MS甲氧基-苯基-肟3.07±0.194.21±0.23∗↑213067-27-1MS, LRI2,6-二乙基吡嗪2.20±0.160.32±0.03∗↓313360-65-1MS, LRI3-乙基-2,5-二甲基-吡嗪2.19±0.154.20±0.32∗↑4109-08-0MS, LRI甲基吡嗪1.79±0.361.39±0.135123-32-0MS, LRI2,5-二甲基吡嗪ND46.59±3.88∗↑614667-55-1MS, LRI三甲基吡嗪ND19.25±1.71∗↑71124-11-4MS, LRI四甲基吡嗪ND2.34±0.31∗↑878210-68-1MS2-氧代-1-甲基-3-异丙基吡嗪ND1.20±0.00∗↑9931-86-2MS5-氮杂胞嘧啶ND1.14±0.26∗↑
注:*代表发酵后与未发酵有显著性差异(P<0.05);ND代表未检测到该物质;↑代表上升,↓代表下降。
醛类化合物相对阈值较低,尤其是不饱和醛对海带的整体香气贡献较大[17]。而在各类化合物中,发酵后出现最显著下降的是含量最高且对腥味贡献较大的醛类物质。在海带匀浆中检出的19种醛类化合物中有15种在发酵后未检出,剩余的4种去除率均高于83.33%。其中,与腥味相关的化合物己醛、壬醛、辛醛、庚醛、(E)-2-庚烯醛、(E)-2-辛烯醛、(E)-2-癸烯醛、(E)-2-壬烯醛、(E,E)-2,4-癸二烯醛、(E,E)-2,4-壬二烯醛和(E,E)-2,6-壬二烯醛的去除率均高于90.69%。可见,醛类化合物在发酵处理后出现了大幅且广谱的降低。因此,发酵过程中可能存在潜在的转化反应。
醇类化合物中,1-辛烯-3-醇具有蘑菇味和泥土味,据文献报道对腥味贡献较大[3]。在海带匀浆中,1-辛烯-3醇为含量最高的醇类化合物。在发酵后,虽然醇类化合物的总含量无显著变化,醇类化合物中对腥味贡献最大的1-辛烯-3醇的含量出现显著下降,相比未发酵的海带匀浆去除率为49.84%。同时,在部分化合物降低的同时,发酵也使其他醇酚类化合物出现显著增加。2,4-二叔丁基苯酚是一种具有特殊香气的酚类化合物,为微生物的代谢产物[18]。该化合物在发酵后含量上升192.31%,与DU等[19]的报道一致,可能对腥味的掩盖有特殊作用。另外,发酵过程还新生成了4种醇类化合物。其中,2,3-丁二醇含量最高,在发酵后的醇类化合物中占36%,其主要来源可能为菌种代谢产物[20]。
酮类化合物一般具有独特香气,对海带的整体风味有较大贡献。对比未发酵对照与发酵后的海带匀浆,酮类化合物总含量显著上升。然而,被公认与海带的腥味高度相关的1-辛烯-3-酮[17]含量相对未发酵下降了94.19%。反式-β-紫罗兰酮含量在发酵后出现显著提升,为发酵液提供了紫罗兰特殊的愉悦香气。酮类化合物的上升主要与新生成的化合物相关。其中较为显著的是乙偶姻和丁二酮,含量分别为72.17和12.48 μg/kg,共占酮类化合物的71.28%。乙偶姻与丁二酮均为菌种的代谢产物[20],分别具有酸奶味和奶香味。
除上述3种海带匀浆中的主要化合物外,有两种在未发酵样品中含量较低的化合物在发酵后出现了较大的提升。其中,杂环化合物出现了771.77%的显著增长,当中贡献最大的为吡嗪类化合物,包括3-乙基-2,5-二甲基-吡嗪,2,5-二甲基吡嗪,三甲基吡嗪,四甲基吡嗪。该类化合物普遍与烘烤味相关,可能为脱腥后的海带匀浆提供一定的风味掩盖及提升效果。吡嗪类由芽孢杆菌的胞外产物乙偶姻与氨基酸转化的氨经过非酶促反应生成[21]。
此外,海带匀浆中还检出了部分酸类、脂肪烃和酯类化合物,但由于此类物质香气阈值较高,对整体香气影响较小,在本研究中不进行进一步讨论。同时,还有少量的呋喃类化合物检出,由于含量相对较低,对匀浆的香气变化贡献也较小。
2.2 发酵对海带匀浆关键风味化合物的影响
香气化合物单体在整体香气中的贡献不仅取决于香气的含量,也与香气的阈值有关。通过计算OAV可表征单体化合物在整体香气中的贡献[16-17]。经过计算,本研究在未发酵及发酵后两组海带匀浆中共鉴定出17种OAV>1的挥发性化合物成分,定义为关键风味化合物。
如表2所示,未发酵海带匀浆中共筛选出15种关键风味化合物。在15种化合物中的13种与腥味相关,其中包括11种醛类,1种酮类和1种醇类。其中,由于其感官阈值极低,具有与腥味相关的1-辛烯-3-酮香气贡献最大。除1-辛烯-3-酮外,来源于多不饱和脂肪酸氧化的醛类化合物[17]为腥味的主要来源,主要为匀浆带来泥土味、油脂味、腐败味等不良感官。1-辛烯-3-醇也对腥味有一定的贡献,具有腥味和金属味。除腥味化合物外,海带匀浆中还有两种其他关键化合物,反式-β-紫罗兰酮和苯乙醛。虽然相对含量不高,反式-β-紫罗兰酮由于其极低的阈值,在低含量下仍对香气有极大的贡献,仅次于1-辛烯-3-酮,其紫罗兰特征香气为海带匀浆带来花果香气。苯乙醛同样带来花香、清香等愉悦香气。
表2 未发酵与发酵后海带匀浆挥发性化合物的OAV
Table 2 OAVs of the volatile compounds in unfermented and fermented kelp homogenate

序号CAS化合物名称阈值/(μg/kg)[22]OAV未发酵发酵后香气描述[3,9,23]14312-99-61-辛烯-3-酮0.0033 425.97 488.41 金属味、蘑菇味、泥土味279-77-6反式-β-紫罗兰酮0.007163.58 191.65 紫罗兰、花香325152-83-4(E,Z)-2,4-癸二烯醛0.040 57.69 -油脂味、蜡味425152-84-5(E,E)-2,4-癸二烯醛0.077 55.41 -油脂味、鸡油味518829-56-6(E)-2-壬烯醛0.190 22.47 -黄瓜味、油脂味、氧化味63391-86-41-辛烯-3-醇1.500 18.33 9.19 青草味、金属味、腥味75910-87-2(E,E)-2,4-壬二烯醛0.100 12.53 --8124-13-0辛醛0.590 8.20 -刺激性气味、生青菜味
续表2
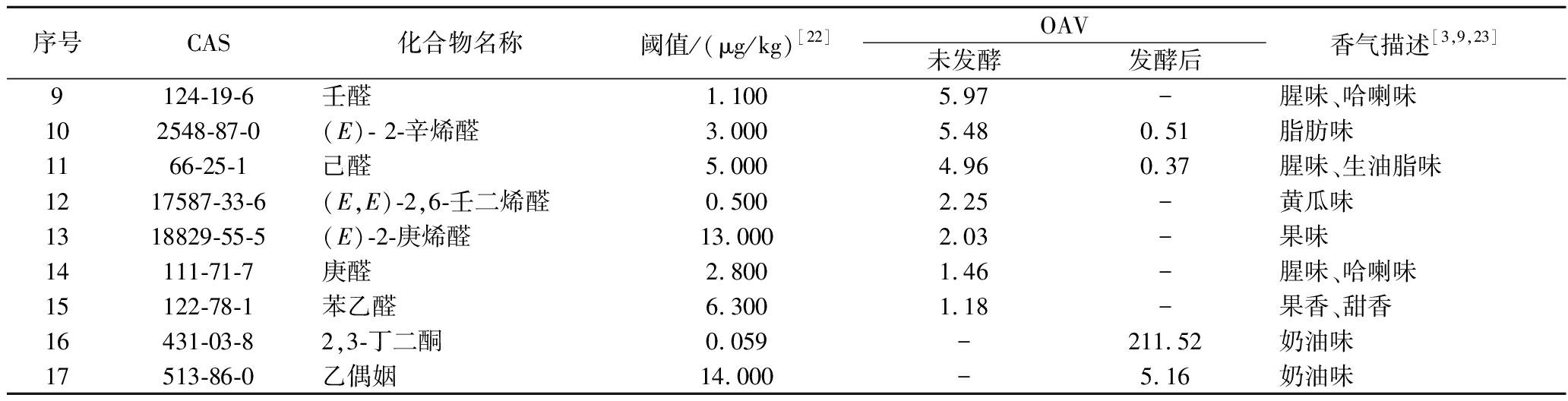
序号CAS化合物名称阈值/(μg/kg)[22]OAV未发酵发酵后香气描述[3,9,23]9124-19-6壬醛1.100 5.97 -腥味、哈喇味102548-87-0(E)- 2-辛烯醛3.000 5.48 0.51 脂肪味1166-25-1己醛5.000 4.96 0.37 腥味、生油脂味1217587-33-6(E,E)-2,6-壬二烯醛0.500 2.25 -黄瓜味1318829-55-5(E)-2-庚烯醛13.000 2.03 -果味14111-71-7庚醛2.800 1.46 -腥味、哈喇味15122-78-1苯乙醛6.300 1.18 -果香、甜香16431-03-82,3-丁二酮0.059 -211.52 奶油味17513-86-0乙偶姻14.000 -5.16 奶油味
注:-代表由于未检测到相应物质。
经过发酵后,关键风味化合物下降到5种。关键风味化合物中的醛类总OAV下降了99.51%。发酵后无醛类关键风味化合物,基本实现了完全脱除。另外两种腥味化合物,1-辛烯-3-酮和1-辛烯-3-醇也分别下降85.74%和49.84%。虽然在发酵后两者仍为关键化合物,但对整体香气的贡献大幅降低。在腥味化合物含量降低的同时,具有愉悦香气的反式-β-紫罗兰酮OAV显著提高。另外,发酵还新产生了两种关键风味化合物,分别为2,3-丁二酮和乙偶姻,两者均为菌种的代谢产物[20-21],为匀浆增加奶香味等愉悦香气。因此,发酵在降低醛类、醇类、酮类腥味化合物的同时,生成了其他产生愉悦香气的化合物,改善了海带匀浆的香气。
2.3 地衣芽孢杆菌发酵海带的脱腥机理初步研究
由于其高含量和低阈值,1-辛烯-3-酮为OAV最高的香气化合物成分。比较发酵前后的化合物含量变化,1-辛烯-3 -酮含量下降达到85.74%。为研究其含量降低的机理与反应路径,以1-辛烯-3-酮为底物进行短时间发酵以研究发酵前后的产物变化。未添加标准品的发酵液背景(A)、未发酵的1-辛烯-3-酮对照(B)、添加标准品的发酵液(C)的总离子流图如图4所示。扣除发酵液背景中检出的化合物后,发酵后样品中可检出少量剩余的1-辛烯-3-酮及由底物1号位双键还原产生的新产物3-辛酮。此现象与该化合物在酿酒酵母发酵中的转化现象相似。研究标明,酿酒酵母的还原酶提取物不可逆地催化了α,β-不饱和羰基的选择性还原,1-辛烯-3-酮催化成3-辛酮的转化率达到 90%[24-25]。这种还原酶随后被证实为烯酮还原酶(enone reductases, ERs),属于老黄酶(old yellow enzyme,OYE)家族。在芽孢杆菌中,类似的催化过程也曾经被报道。几种基于NADH或NADPH的OYE家族酶被认为具有对碳碳双键还原的活性[26-27]。ERs是生物体中普遍存在的转化酶[28-29],已有文献报道微生物发酵过程中ERs的转化特性。因此,推断以1-辛烯-3-酮为底物,3-辛酮的产生由1号位双键的加氢还原产生,该过程由ERs酶催化并由NADH作为氢原子供体和电子供体的反应过程(图5)。这也与表1中在发酵后被新检出的3-辛酮结果相对应。由于产生的3-辛酮香气阈值较高(21.40 μg/kg),3-辛酮在发酵后并没有被筛选为关键香气化合物。此结果也与其他生物脱腥的报道吻合。ZHU等[9]也曾报道在基于酿酒酵母发酵的海带生物脱腥研究中报道过1-辛烯-3-酮的消失与3-辛酮的产生,并将此与ERs的作用联系在一起。同时,此结果也可能同时解释了为什么许多含有α,β-不饱和羰基的醛和酮在发酵后含量显著下降。

图4 1-辛烯-3-酮发酵产物的总离子流图
Fig.4 Total ion chromatogram of the fermentation with 1-octen-3-one
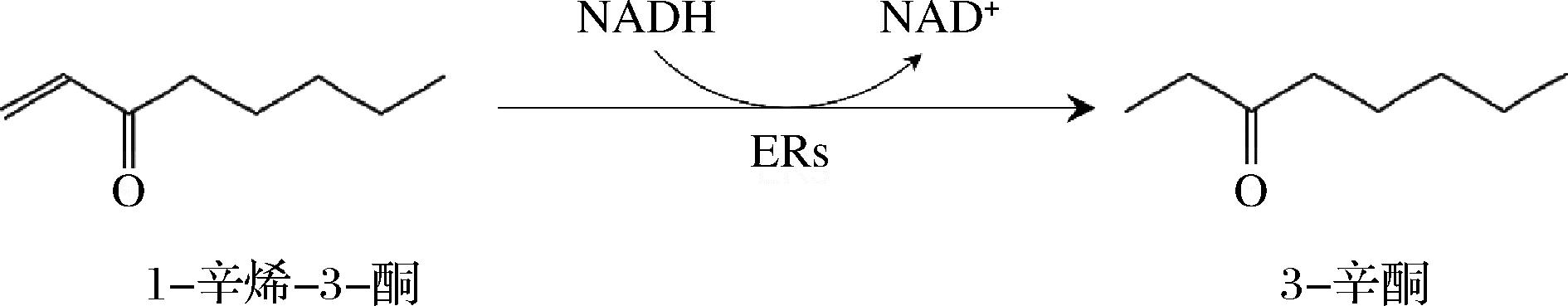
图5 1-辛烯-3-酮的潜在代谢通路
Fig.5 Putative metabolic pathway of 1-octen-3-one
除1-辛烯-3-酮外,对海带香气影响较大的香气化合物成分主要为不饱和醛。因此,选择OAV较高的(E,E)-2,4-癸二烯醛作为对象研究此类型化合物的转化机理。未添加标准品的发酵液背景(A)、未发酵的(E,E)-2,4-癸二烯醛对照(B)、添加标准品的发酵液(C)的总离子流图如图6所示。短时间发酵后样品中(E,E)-2,4-癸二烯醛被完全转化,产生新产物2,4-癸二烯-1-醇,即醛基被还原为羟基。VERMEULEN等[30]研究了微生物发酵的(E,E)-2,4-癸二烯醛还原过程。该研究认为,细菌在发酵过程中通过酶将醛基还原为羟基形成2,4-癸二烯-1-醇,而酵母则先还原醛基,进而还原双键最终形成饱和的癸醇。醛酮还原酶(aldo-keto reductases, AKRs)是广泛存在于多种生物体中的一种超家族,在动物、植物、微生物中作为糖代谢、固醇代谢、氨基酸代谢及二级代谢物生物合成中均扮演了重要的作用[31]。在芽孢杆菌中已有分离出相应的酶系[32-33]。根据其催化特点,推断(E,E)-2,4-癸二烯醛的醛基还原为羟基,转化为2,4-癸二烯-1-醇的转化通路为该酶催化(图7)。然而,在表1中并未观察到2,4-癸二烯-1-醇代谢产物的生成。其原因可能是2,4-癸二烯-1-醇在长时间发酵中通过加氢、酯化等反应被进一步代谢为其他产物,此变化在短时间实验过程中并未得到体现。
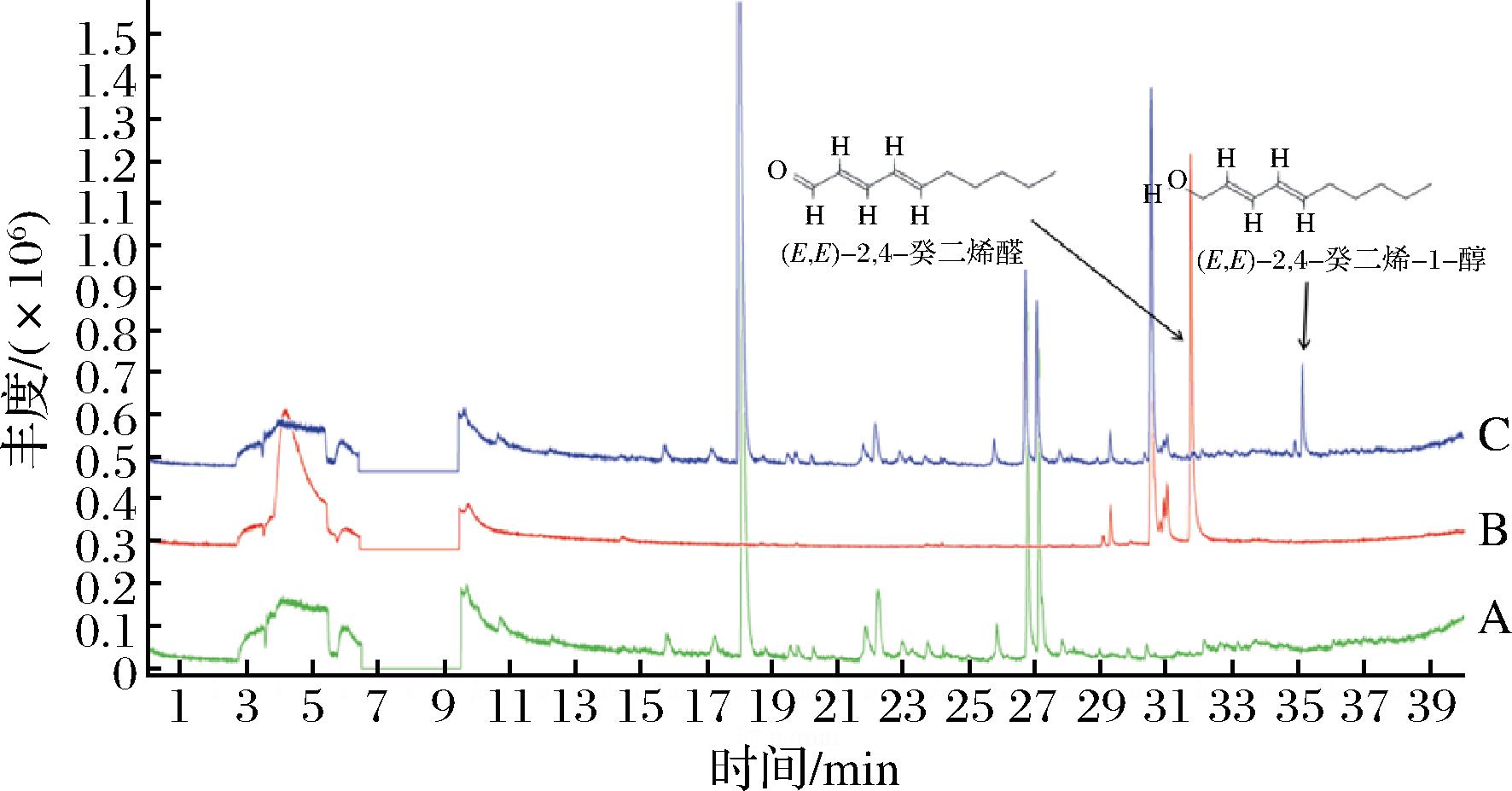
图6 (E, E)-2, 4-癸二烯醛发酵产物的总离子流图
Fig.6 Total ion chromatogram of the fermentation with (E, E)-2, 4-decadienal
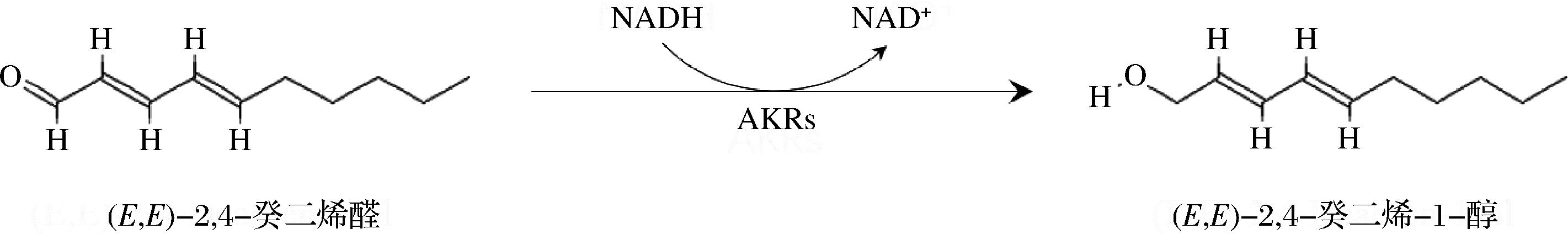
图7 (E, E)-2, 4-癸二烯醛的潜在代谢通路
Fig.7 Putative metabolic pathway of (E, E)-2, 4-decadienal
3 结论
针对海带制品中普遍带有的刺鼻腥味,本研究对基于地衣芽孢杆菌的生物发酵脱腥进行了系统性研究。利用HS-SPME与GC-MS,筛选了海带匀浆中的关键腥味物质,同时分析了生物发酵对相应化合物的去除效果。结果表明,地衣芽孢杆菌发酵对腥味化合物,尤其是其中的醛类化合物,有着高效而广谱的去除效果。在脱腥的同时,发酵还产生了或增加了反式-β-紫罗兰酮,2,3-丁二酮,乙偶姻,2,4-二叔丁基苯酚,芳樟醇和吡嗪类化合物,为海带匀浆增加了具有修饰、掩盖作用的愉悦香气。同时,还根据OAV计算筛选比较了发酵前后的关键香气化合物。结果表明,发酵后原海带匀浆中具有不良风味的醛类、醇类和酮类化合物均被显著降低,同时新增了2,3-丁二酮和乙偶姻两种具有良好风味的关键风味化合物。
最后,根据OAV的筛选结果选出了两种代表性腥味化合物,1-辛烯-3-酮和(E,E)-2,4-癸二烯醛,进行了机理研究。利用GC-MS对两者发酵后的产物进行了分析,成功筛选出两条相关的代谢通路:1)AKRs催化的醛类加氢还原成醇;2)ERs催化的烯酮类物质中的双键加氢还原。
本研究首次提出了以芽孢杆菌为基础的生物脱腥技术,并初步提出了两条潜在的反应通路。与现有的涉及酿酒酵母或其他微生物发酵的生物脱腥方法相比,本研究提出的工艺在避免由于酒精发酵对海带风味影响的同时,高效地脱除了关键的腥味化合物,脱除率达到86%~100%。同时,也了解到不同产地、品种的海带及其他藻类在成分和香气化合物组成上可能存在差别,进而影响脱腥工艺的效果。在未来的研究中对其他地区的海带仍需要进行进一步验证,以验证所优化的工艺对不同地区海带的适用性和稳定性。总的来说,本研究对丰富现有的海产品脱腥技术有着一定的现实意义,为工业化制备高质量的海带制品提供了理论指导。
[1] GARICANO VILAR E, O’SULLIVAN M G, KERRY J P, et al.Volatile compounds of six species of edible seaweed:A review[J].Algal Research, 2020, 45:101740.
[2] SEO Y S, BAE H N, EOM S H, et al.Removal of off-flavors from sea tangle (Laminaria japonica) extract by fermentation with Aspergillus oryzae[J].Bioresource Technology, 2012, 121:475-479.
[3] TAKAHASHI H, SUMITANI H, INADA Y, et al.Identification of volatile compounds of kombu (Laminaria spp.) and their odor description[J].Nippon Shokuhin Kagaku Kogaku Kaishi, 2002, 49(4):228-237.
[4] 崔蕊静,赵建功,王锋,等.海带冰淇淋的研制[J].食品工业,1996,17(1):10-12.
CUI R, ZHAO J, WANG F, el.The development of kelp ice cream[J].Food Industry, 1996,17(1):10-12.
[5] 王中凤,曾凡坤.海带饮料脱腥工艺研究[J].食品工业,1993,14(6):31.
WANF Z F, ZENG F K.Research on deodorisation process of kelp drink[J].Food Industry, 1993,14(6):31.
[6] BATISTA DE OLIVEIRA T T, MIRANDA DOS REIS I, BASTOS DE SOUZA M, et al.Microencapsulation of Spirulina sp.LEB-18 and its incorporation in chocolate milk:Properties and functional potential[J].LWT, 2021, 148:111674.
[7] 俞静芬,凌建刚,周安渊,等.海带脱腥工艺的研究[J].农产品加工(创新版),2009(4):20-21;26.
YU J, LING J, ZHOU A, et al.Smell Removal Process of Kelp[J].Innovational Edition of Farm Products Processing, 2009 (4):20-21;26.
[8] WANG J, ZHANG M, FANG Z X.Recent development in efficient processing technology for edible algae:A review[J].Trends in Food Science &Technology, 2019, 88:251-259.
[9] ZHU W Y, JIANG B, ZHONG F, et al.Effect of microbial fermentation on the fishy-odor compounds in kelp (Laminaria japonica)[J].Foods, 2021, 10(11):2532.
[10] 谷怡静. 海带生物脱腥及多糖提取、抗氧化应用[D].无锡:江南大学, 2022.
GU Y J.Biological deodorization, polysaccharide extraction and antioxidant application of kelp[D].Wuxi:Jiangnan University, 2022.
[11] GONG J N, WANG X L, NI H, et al.The volatile compounds change during fermentation of Saccharina japonica seedling[J].Foods, 2024, 13(13):1992.
[12] WEI R, JIANG B, CHEN J J, et al.Removal of fishy flavor in kelp (Laminaria japonica) by natural antioxidant soaking combined with microbial fermentation[J].Food Bioscience, 2024, 60:104212.
[13] NIE J L, FU X T, WANG L, et al.Impact of Monascus purpureus fermentation on antioxidant activity, free amino acid profiles and flavor properties of kelp (Saccharina japonica)[J].Food Chemistry, 2023, 400:133990.
[14] GROSCH W.Evaluation of the key odorants of foods by dilution experiments, aroma models and omission[J].Chemical Senses, 2001, 26(5):533-545.
[15] WANG Y J, SHAO L M, KANG X Y, et al.A critical review on odor measurement and prediction[J].Journal of Environmental Management, 2023, 336:117651.
[16] XU Y X, JIANG Z D, DU X P, et al.The identification of biotransformation pathways for removing fishy malodor from Bangia fusco-purpurea using fermentation with Saccharomyces cerevisiae[J].Food Chemistry, 2022, 380:132103.
[17] LIU L, ZHAO Y H, ZENG M Y, et al.Research progress of fishy odor in aquatic products:From substance identification, formation mechanism, to elimination pathway[J].Food Research International, 2024, 178:113914.
[18] ZHAO F Q, WANG P, LUCARDI R D, et al.Natural sources and bioactivities of 2, 4-di-tert-butylphenol and its analogs[J].Toxins, 2020, 12(1):35.
[19] DU X P, XU Y X, JIANG Z D, et al.Removal of the fishy malodor from Bangia fusco-purpurea via fermentation of Saccharomyces cerevisiae, Acetobacter pasteurianus, and Lactobacillus plantarum[J].Journal of Food Biochemistry, 2021, 45(5):e13728.
[20] PETROV K, PETROVA P.Current advances in microbial production of acetoin and 2, 3-butanediol by Bacillus spp[J].Fermentation, 2021, 7(4):307.
[21] XIAO Z J, LU J R.Generation of acetoin and its derivatives in foods[J].Journal of Agricultural and Food Chemistry, 2014, 62(28):6487-6497.
[22] VAN GEMERT L J.Odour Thresholds.Compilations of Odour Threshold Values in Air, Water and Other Media[M].Edition 2011.Zeist:Oliemans Punter &Partners BV, 2011.
[23] 洪林欣, 童星, 孙乐常, 等. 酶解前后牡蛎肉风味变化研究[J]. 食品与发酵工业, 2024, 50(20):120-128.
HONG L X, TONG X, SUN L C, et al. Study on flavor changes of oyster meat before and after enzymatic hydrolysis[J]. Food and Fermentation Industries, 2024, 50(20):120-128.
[24] WANNER P, TRESSL R.Purification and characterization of two enone reductases from Saccharomyces cerevisiae[J].European Journal of Biochemistry, 1998, 255(1):271-278.
[25] GUERCHE S L, DAUPHIN B, PONS M, et al.Characterization of some mushroom and earthy off-odors microbially induced by the development of rot on grapes[J].Journal of Agricultural and Food Chemistry, 2006, 54(24):9193-9200.
[26] SHENG X Q, YAN M, XU L, et al.Identification and characterization of a novel Old Yellow Enzyme from Bacillus subtilis str.168[J].Journal of Molecular Catalysis B:Enzymatic, 2016, 130:18-24.
[27] ZHANG H L, GAO X Z, REN J, et al.Enzymatic hydrogenation of diverse activated alkenes.Identification of two Bacillus old yellow enzymes with broad substrate profiles[J].Journal of Molecular Catalysis B:Enzymatic, 2014, 105:118-125.
[28] WANNER P, TRESSL R.H[J].European Journal of Biochemistry 1998, 255(1):271-8.
[29] HUANG M M, HU H H, MA L, et al.Carbon-carbon double-bond reductases in nature[J].Drug Metabolism Reviews, 2014, 46(3):362-378.
[30] VERMEULEN N, CZERNY M, G NZLE M G, et al.Reduction of (E)-2-nonenal and (E, E)-2, 4-decadienal during sourdough fermentation[J].Journal of Cereal Science, 2007, 45(1):78-87.
NZLE M G, et al.Reduction of (E)-2-nonenal and (E, E)-2, 4-decadienal during sourdough fermentation[J].Journal of Cereal Science, 2007, 45(1):78-87.
[31] ELLIS E M.Microbial aldo-keto reductases[J].FEMS Microbiology Letters, 2002, 216(2):123-131.
[32] YOSHIDA K, SEKI S, FUJIMURA M, et al.Cloning and sequencing of a 36-kb region of the Bacillus subtilis genome between the gnt and iol operons[J].DNA Research, 1995, 2(2):61-69.
[33] KUNST F, OGASAWARA N, MOSZER I, et al.The complete genome sequence of the gram-positive bacterium Bacillus subtilis[J].Nature, 1997, 390(6657):249-256.