青稞(Hordeum vulgare)属于禾本科,是大麦的变种,也被称为裸大麦,是中国藏族地区种植最广泛的作物,也是当地农牧民的主要食物[1];近年来研究表明青稞中含有丰富的生物活性物质,如γ-氨基丁酸、萜烯、甾醇、β-葡聚糖和酚类化合物等[1],其中酚类化合物具有清除自由基、降低血糖血脂、预防心血管疾病和抗癌[2]等作用而受到人们的关注。研究表明,青稞中酚类化合物主要存在于麸皮层中[3],但是当前人们为了改善青稞的粗糙口感,多采用碾减或磨粉的方式去除青稞麸皮从而造成了青稞中酚类物质的大量损失,降低了青稞的健康效应。全谷物能最大限度保留青稞中的酚类物质,然而由于青稞中酚类物质50%以上以结合态存在[4],难以提取出来,导致青稞在全谷物食品的开发过程中仍存在多酚生物利用度低的问题,严重影响其发挥功能活性。因此,采用适当的加工技术改变全谷青稞中酚类物质存在形式,提高其含量和生物活性是发挥酚类物质健康作用的有效途径,对全谷青稞健康产品开发利用具有一定的指导意义。
固态发酵是一种安全高效的加工方法,利用微生物代谢的酶类对细胞壁进行分解,促进多酚释放,增强其生物活性,已被广泛用于种子和谷物的加工处理[5]。已有报道采用米曲霉、乳杆菌、米根霉提高小麦[6]、水稻[6]、燕麦[7]的总酚和总黄酮含量,且发酵过程中抗氧化活性及糖苷酶抑制活性均有所提高。冠突散囊菌(Eurotium cristatum)俗称“金花”。其在发酵过程中会分泌多种胞外酶,包括多酚氧化酶、纤维素酶、果胶酶,从而产生色素和各种活性代谢产物[8]。冠突散囊菌多数应用于茶叶的加工,在谷物中的应用还在研究发展中。有限的报道证明通过固态发酵可有效地提升荞麦、甜荞、苦荞等谷物的酚类物质含量,以及具有提高谷物抗氧化活性和抑制糖脂代谢相关酶活力的效果[9]。而关于冠突散囊菌固态发酵全谷青稞对其多酚组成、含量及生物活性的相关研究未见报道。基于此,本研究以全谷青稞为原料,接种冠突散囊菌进行固态发酵,探究发酵对青稞酚类物质含量、组成的影响,并通过测定DPPH、ABTS阳离子自由基清除能力和铁离子还原能力(ferric ion reducing antioxidant power,FRAP)评价发酵过程中青稞的抗氧化作用;采用α-淀粉酶、α-糖苷酶与胰脂肪酶抑制活性评估其潜在的体外降血糖、降血脂活性,旨在明确冠突散囊菌在青稞全谷产品开发中的应用方向与潜力,为青稞的功能强化及青稞功能食品的加工利用提供科学依据。
1 材料与方法
1.1 材料与试剂
冠突散囊菌CICC 2099,由青海省青藏高原农产品加工重点实验室保存;囊谦黑青稞,于2023年8月14日在玉树市囊谦县采收,由青海省农林科学院作物育种栽培研究所提供;α-淀粉酶(3 700 U/g)、α-葡萄糖苷酶(100 U/3.8 mg)、福林酚(优级纯)、对硝基苯酚吡喃葡萄糖苷(4-nitrophenyl β-D-glucuronide,PNPG),北京索莱宝科技有限公司;酚酸标准品:纯度≥98.0%,上海源叶生物科技有限公司;DPPH、ABTS、2,4,6-三吡啶基三嗪[2,4,6-Tri(2-pyridyl)-s-triazine,TPTZ]、Trolox (水溶性维生素 E),美国 Sigma 公司。
1.2 仪器与设备
SX-500型蒸汽灭菌器,日本TOMY KOGYO公司产品;SW-CJ-2FD型双人单面净化工作台,苏州净化设备有限公司产品;LRH-150型生化培养箱,上海齐欣科学仪器有限公司;R-210型旋转蒸发仪,瑞士BUCHI公司;N4S型紫外线可见分光光度计,上海仪电分析仪器有限公司;DIONEX Ulti Mate 3000超高效液相色谱-Orbitrap质谱联用仪(UHPLC-MS),Thermo Fisher Scientific公司。
1.3 试验方法
1.3.1 菌种活化及种子液的制备
用接种环挑取平板上的冠突散囊菌,接种于200 mL的液体培养基中,28 ℃、180 r/min,恒温培养12 d,用于后续发酵。
1.3.2 冠突散囊菌发酵全谷青稞工艺流程及操作要点
选取颗粒饱满的全谷青稞籽粒,于室温下浸泡16 h后,蒸煮20 min至青稞无白芯,121 ℃灭菌20 min后冷却至室温。在超净工作台内将冠突散囊菌种子液接种于青稞上,于28 ℃培养12 d。将发酵完的样品真空冷冻干燥后,粉碎,置阴凉处保存备用。
1.3.3 青稞酚类物质的提取
1.3.3.1 游离态酚类化合物的提取
取1 g青稞粉,加入25 mL、80%(体积分数)的丙酮,25 ℃、100 kHz超声波处理30 min,4 000 r/min离心10 min,取上清液,残渣以同样方法提取。合并上清液,在45 ℃下减压旋转蒸干,用甲醇定容至10 mL,用0.45 μm有机滤头过滤,即为游离态提取液。
1.3.3.2 结合态酚类化合物的提取
将20 mL正己烷加入游离酚残渣中,以2 000 r/min离心5 min,弃去上清液,将17 mL、11%(体积分数)的盐酸-甲醇溶液加入到沉淀物中,70 ℃水浴1 h,加入20 mL乙酸乙酯,合并两次提取液,于45 ℃下旋转蒸干,甲醇定容至10 mL,用0.45 μm有机滤头过滤,即为结合态提取液。
1.3.4 酚类物质含量测定
1.3.4.1 总酚含量的测定
参考Folin-Ciocalteu测定法。总酚含量以100 g样品中(干重)没食子酸当量计(mg GAE/100 g DW)。
1.3.4.2 总黄酮含量的测定
参照杨希娟等[10]的方法。总黄酮含量以每100 g提取物 (干重) 中儿茶素当量计 (mg TE/100 g DW)。
1.3.5 酚类物质组成分析
采用UHPLC-MS对发酵前后全谷青稞样品的酚酸组分进行定性定量分析。色谱条件:Hypersil GOLD a Q(100 mm×2.1 mm)色谱柱;流动相A:1%甲酸,流动相B:乙腈;梯度洗脱;0~18 min,2%~65% B;18~20 min,65%~95% B;20~21 min,95% B;21~23 min,95%~2% B;23~25 min,2% B;流速0.3 μL/min;进样量3 μL。
1.3.6 体外抗氧化活性测定
DPPH自由基清除能力、FRAP、ABTS阳离子自由基清除能力测定参照文献[11]的方法。
1.3.7 体外抑制α-淀粉酶、α-葡萄糖苷酶活性测定
1.3.7.1 α-淀粉酶抑制率测定
取500 μL提取液与等体积α-淀粉酶溶液(2.0 U/mL)混合,37 ℃孵育10 min后,加入500 μL可溶性淀粉(100 g/L),37 ℃孵育10 min,添加1 mL 3,5-二硝基水杨酸,终止反应,沸水浴5 min,加入10 mL蒸馏水稀释。540 nm波长处测定吸光值,计算公式如(1)所示。
α-淀粉酶酶活抑制率![]()
(1)
式中:A1,实验组吸光值;A2,空白组吸光值;A3,对照组吸光值。
1.3.7.2 α-葡萄糖苷酶抑制率测定
取40 μL不同多酚提取物、30 μL α-葡萄糖苷酶溶液(0.4 U/mL)加入96孔板,37 ℃混合孵育10 min,每孔加入30 μL 5 mmol/L PNPG, 37 ℃混合孵育30 min,加入100 μL Na2CO3溶液(1 mol/L)终止反应。测定405 nm波长处的吸收值,并根据公式(2)计算。
α-葡萄糖苷酶酶活抑制率![]()
(2)
式中:A1,实验组吸光值;A2,空白组吸光值;A3,对照组吸光值。
1.3.7.3 体外抑制胰脂肪酶活性测定
参照佐兆杭等[12]的方法,胰脂肪酶抑制率按公式(3)计算。
胰脂肪酶抑制率![]()
(3)
式中:A1,实验组吸光值;A2,空白组吸光值;A3,对照组吸光值。
1.4 数据处理
采用Design Expert 13、SPSS 26、Origin 2021、GraphPad Prism 9进行数据分析。测定结果以“平均值±标准差”表示。
2 结果与分析
2.1 冠突散囊菌发酵对青稞酚类物质含量的影响
由表1可知,青稞结合酚含量为265.50 mg/100 g,高于游离酚含量(241.25 mg/100 g),表明青稞多酚主要以结合态形式存在,与YANG等[4]的研究结果一致。经冠突散囊菌发酵后,青稞游离酚含量出现大幅增加,而结合酚含量显著降低。发酵青稞游离酚含量达到其结合酚的2.24倍,是未处理组青稞游离酚含量的2.17倍。此结果显著高于猴头菌固态发酵使得青稞游离酚含量提高了1.40倍的报道[13]。焦捷等[14]用羊肚菌固态发酵青稞,结果显示青稞结合酚含量显著降低,这与本研究结果一致。冠突散囊菌发酵青稞多酚的变化可能是菌体分泌的胞外酶(如蛋白酶、多酚氧化酶等)与基质相互作用,打断了与青稞中大分子结合多酚的共价键,降低了细胞壁对多酚的阻滞和束缚[15],使部分结合酚转化为游离酚,从而促进游离态酚酸释放,显著提高了游离酚含量。
表1 青稞酚酸和黄酮含量 单位:mg/100 g
Table 1 Phenolic and flavonoid content of highland barley

指标未处理发酵处理酚含量游离酚241.25±2.49b523.92±9.40a结合酚265.50±6.58a233.73±3.39b总酚506.75±8.20b757.98±6.06a黄酮含量游离黄酮28.24±0.97b62.90±3.81a结合黄酮24.45±1.72a22.83±0.66a总黄酮52.69±2.66b85.73±4.38a
注:不同字母表示发酵前后样品之间的差异显著性(P<0.05)。
未处理青稞中游离黄酮高于结合黄酮,但经冠突散囊菌发酵后青稞游离黄酮含量显著增加,结合黄酮含量下降为22.83 mg/100 g。发酵组青稞游离黄酮含量达到其结合黄酮含量的2.75倍,是未处理青稞的2.23倍。此结果显著高于马贺等[13]关于猴头菌固态发酵青稞使得游离态黄酮含量增加了51.23%的报道。与未处理青稞相比,发酵青稞的总酚(757.98 mg/100 g)和总黄酮(85.73 mg/100 g)含量分别增加了49.58%和62.71%。LIU等[16]采用姬松茸固态发酵青稞,发现发酵后青稞总酚、总黄酮含量分别增加21.85%和62.61%。ZHOU等[17]通过桑黄发酵青稞,显示发酵后青稞总黄酮含量提高了62.40%。相比上述研究结果,本研究中发酵青稞总酚、总黄酮含量的提升更为显著。综上所述,冠突散囊菌固态发酵能够充分释放青稞多酚,有望成为新型青稞功能性食品开发的优质原料。
2.2 冠突散囊菌发酵对全谷青稞酚类物质组成的影响
由表2可知,未处理组青稞中共检出17种酚类物质,发酵组共检出21种酚类物质,表明冠突散囊菌发酵有助于增加青稞多酚的丰富度。与未处理组相比,发酵青稞游离态酚类化合物总量(86.39±1.08) mg/100 g提高了25.42 %,但其结合酚总量显著降低可能原因是固态发酵过程中青稞部分结合酚会被微生物利用和转化,从而导致结合酚含量降低。
表2 发酵前后青稞酚酸和黄酮组成及含量 单位:mg/100 g
Table 2 Composition and content of phenolic acids and flavonoids in highland barley before and after fermentation

酚类物质名称未处理发酵处理游离酚结合酚总酚游离酚结合酚总酚羟基苯甲酸没食子酸 0.19±0.01Bd0.66±0.03Aa0.86±0.14Bc1.61±0.05Ac0.89±0.02Aa2.51±0.03Ac苯甲酸 0.01±0.00Be0.84±0.02Aa0.84±0.02Bc0.95±0.01Ae0.65±0.02Bb1.60±0.03Ad香草酸3.65±0.07Aa0.03±0.01Bc3.68±0.08Aa1.15±0.03Bd0.27±0.02Ad1.42±0.05Bd丁香酸 0.95±0.05Bb0.29±0.03Ab1.24±0.07Bb5.44±0.13Aa0.37±0.01Ac5.81±0.14Aa对羟基苯甲酸0.36±0.09Bc0.02±0.01Bc0.39±0.03Bd3.24±0.16Ab0.16±0.03Ae3.40±0.00Ab水杨酸ND0.19±0.01Abc0.19±0.01Ade0.15±0.04Af0.06±0.01Bf0.21±0.04Ae藜芦酸0.06±0.01BeND0.06±0.01Be0.22±0.02Af0.06±0.05Af0.29±0.01Ae羟基苯甲酸总量5.22±0.17B2.03±0.15A7.25±0.02B12.78±0.23A2.45±0.04A15.24±0.19A羟基肉桂酸阿魏酸9.16±0.02Aa30.63±0.39Aa39.79±0.41Aa7.78±0.01Ba5.11±0.10Ba12.89±0.11B咖啡酸0.03±0.01Bc0.02±0.01Bb0.04±0.00Bc0.81±0.02Ab0.21±0.05Ab1.02±0.02A反式-4-羟基肉桂酸0.72±0.01Ab0.71±0.02Ab1.43±0.03Ab0.39±0.01Bc0.27±0.01Bb0.66±0.00B2-羟基肉桂酸ND0.35±0.01Ab0.35±0.01Ac0.06±0.01Bd0.04±0.00Bb0.10±0.01B羟基肉桂酸总量9.90±0.02A31.71±0.41A41.61±0.42A9.04±0.02B5.63±0.10B14.67±0.08B黄酮根皮素NDNDND9.54±0.08Aa0.08±0.00Aa9.62±0.08Aa木犀草素0.02±0.01Ba0.03±0.01Baa0.04±0.01Ba0.86±0.02Ab0.12±0.02Aa0.97±0.01Ab黄酮类总量0.02±0.010.03±0.010.04±0.0110.40±0.060.20±0.0210.6±0.07黄酮醇杨梅素NDNDND0.17±0.02Ab0.22±0.01Aa0.39±0.01A槲皮素NDNDND0.07±0.01Ac0.11±0.03Ab0.18±0.02A山奈酚ND0.51±0.02Aa0.51±0.02Aa0.32±0.03Aa0.13±0.02Bb0.46±0.05A芦丁 0.17±0.06AaND0.17±0.06Ab0.21±0.02AbND0.21±0.02A黄酮醇总量0.18±0.06B0.51±0.02A0.69±0.04B0.77±0.01A0.46±0.05A1.35±0.02A黄烷醇儿茶素18.00±0.23BbND18.00±0.23Bb38.95±0.21Aa0.24±0.01Aa39.19±0.20Aa原花青素B235.56±1.13AaND35.56±1.13Aa14.36±0.59BbND14.36±0.59Bb表儿茶素NDNDND0.07±0.02Ac0.12±0.01Ab0.19±0.01Ac黄烷醇总量53.56±0.91AND53.56±0.91A53.38±0.78A0.36±0.01A53.74±0.78A黄烷酮柚皮苷 0.02±0.01AND0.02±0.01A0.02±0.00A0.01±0.00A0.03±0.00A黄烷酮总量0.02±0.01AND0.02±0.01A0.02±0.00A0.01±0.00A0.03±0.00A总酚类物质68.88±1.14B34.27±0.25A103.15±1.49A86.39±1.08A9.11±0.08B95.51±1.00B
注:大写字母表示发酵前后样品之间的差异显著性(P<0.05);小写字母表示同一样品酚酸组成之间的差异显著性(P<0.05);ND表示未检出。
未处理组青稞酚酸主要为羟基肉桂酸,其中阿魏酸含量最高,达到羟基肉桂酸总量的95.63%;黄酮主要为黄烷醇,其中原花青素B和儿茶素含量分别达到黄烷醇总量的66.39%和33.61%。经冠突散囊菌发酵后青稞酚酸主要为羟基苯甲酸,其中丁香酸和对羟基苯甲酸的含量分别占羟基苯甲酸总量的33.99%和22.31%;黄酮主要为黄烷醇,其中儿茶素含量最高,达到黄烷醇总量的72.93%。与未处理组相比,发酵后青稞中羟基苯甲酸、黄酮、黄酮醇、黄烷酮含量增加,其中羟基苯甲酸类的没食子酸、丁香酸、对羟基苯甲酸含量分别提高了2.92倍、4.69倍和8.72倍,黄酮类的根皮素含量达到(9.54±0.077) mg/100 g,黄酮醇类的芦丁含量提高了1.75倍,黄烷酮类的儿茶素含量提高了2.18倍。然而,发酵后羟基肉桂酸含量显著降低,其中阿魏酸含量降低了67.60%,可能原因是阿魏酸会附着在细胞壁上,但发酵产生的代谢酶类会破坏植物细胞壁结构,从而导致结合型阿魏酸含量降低[18]。综合而言,青稞中儿茶素含量在发酵过程中显著提高,原花青素含量则显著减少,有研究证实儿茶素可由原花青素的降解或没食子酸的生物转化合成[19];且在发酵过程中丁香酸的甲基化和脱羟基化可生成没食子酸,进一步分解代谢后经过脱羧和脱羟基转化为儿茶素[20];而儿茶素被微生物分解代谢后又可通过脱羟基转化为苯甲酸[21]。此外,仅在发酵青稞中检测出根皮素、杨梅素、槲皮素、表儿茶素等酚酸物质,可能与冠突散囊菌发酵会诱导谷物细胞壁的结构破坏有关,致使不溶性的结合酚酸与细胞壁大分子的酯或醚键在发酵过程中释放出来[22]。
综上所述,冠突散囊菌发酵能够富集青稞中的酚类物质,其中没食子酸、丁香酸、对羟基苯甲酸、儿茶素的含量增加显著,相比未处理青稞分别提高达2.92、4.69、8.72和2.17倍,且发酵青稞根皮素含量达到了9.62 mg/100 g,原花青素保留率达到40.38%,可见冠突散囊菌固态发酵在保持和提升青稞多酚上具有明显优势。ZHANG等[23]采用超声波胁迫萌发富集青稞多酚,发现处理后青稞儿茶素含量提高了1.81倍,而芦丁、阿魏酸、原花青素B2含量分别降低了55.96%、22.81%、21.54%。本研究中青稞多酚的富集和释放明显优于上述文献报道。研究表明,没食子酸和儿茶素是天然的抗氧化剂[24];丁香酸的活性作用广泛,如抗炎、抗癌和护肝等[25]。上述多种酚类物质的增加是更好发挥青稞生物活性的重要物质基础。
2.3 冠突散囊菌发酵对青稞多酚体外抗氧化活性的影响
图1显示,发酵前后青稞游离酚的DPPH、ABTS阳离子自由基清除能力、FRAP均高于结合酚,这可能是由于青稞中游离酚和结合酚中单体多酚的组成和含量不同,从而导致游离酚和结合酚抗氧化活性的不同[26]。与未处理青稞相比,发酵后青稞游离酚的DPPH、ABTS阳离子自由基清除能力、FRAP分别提高了23.12%、36.11%、58.03%;结合酚分别提高了60.05%、108.64%、34.22%。据报道,冠突散囊菌固态发酵能够显著提高葛根[27]、荞麦[28]的抗氧化能力,这与本研究结果一致,这可能与发酵提高了青稞中总酚水平有关。

a-DPPH自由基清除能力;b-ABTS阳离子自由基清除能力;c-FRAP
图1 发酵处理对青稞多酚体外抗氧化活性的影响
Fig.1 Effect of fermentation treatment on antioxidant activity of highland barley polyphenols in vitro
2.4 冠突散囊菌发酵对青稞多酚体外酶抑制活性的影响
2.4.1 α-淀粉酶抑制率
由图2可知,α-淀粉酶抑制率与青稞多酚质量浓度呈正相关。随着多酚质量浓度的不断增加,α-淀粉酶抑制率逐渐增加并趋于稳定。与未处理组相比,冠突散囊菌发酵青稞的游离酚、结合酚对α-淀粉酶具有更强的抑制作用。半抑制浓度(half-inhibitory concentration, IC50)数值越低,表明其抑制效果越显著。未处理青稞游离酚、结合酚对α-淀粉酶活力抑制率的IC50分别为(0.198±0.01) g/L、(0.290±0.02) g/L,而发酵后分别为(0.160±0.00) g/L、(0.193±0.01) g/L,进一步证实发酵后青稞多酚抑制α-淀粉酶活性显著强于发酵前青稞多酚,这与刘善鑫[29]的发现一致。综上所述,冠突散囊菌固态发酵全谷青稞可作为功能性食品,具有改善餐后血糖的潜力。
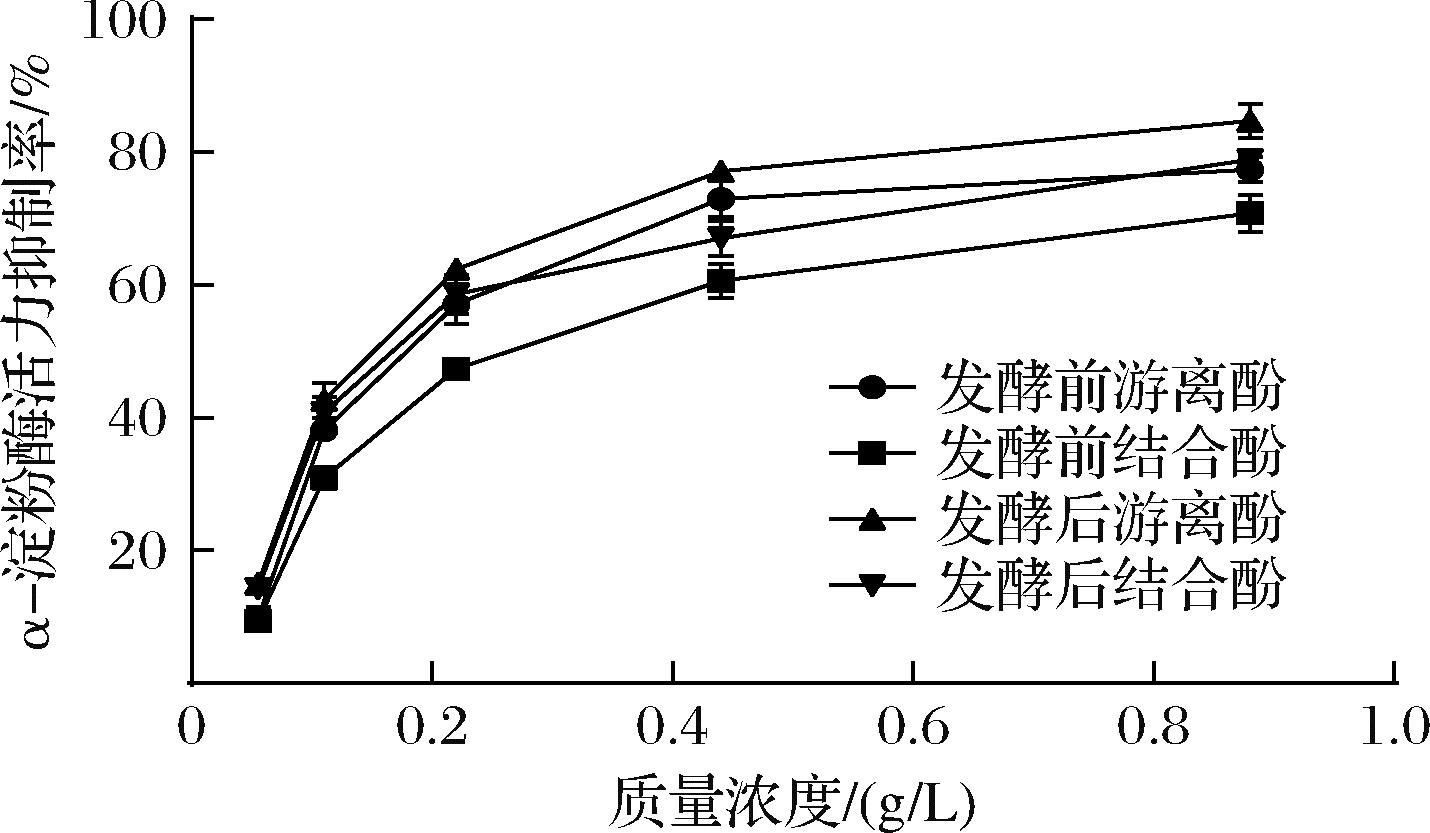
图2 发酵处理对青稞多酚体外α-淀粉酶抑制率的影响
Fig.2 Effect of fermentation treatment on α-amylase inhibition rate of highland barley polyphenols in vitro
2.4.2 α-葡萄糖苷酶抑制率
人体内的α-葡萄糖苷酶是糖代谢的关键酶,在糖的消化吸收中发挥重要作用。由图3可知,随着酚类物质质量浓度的增加, 其对α-葡萄糖苷酶的抑制活性不断增强。发酵后青稞游离酚、结合酚对α-葡萄糖苷酶抑制率的IC50分别为(0.185±0.01) g/L、(0.217±0.02) g/L,较未发酵青稞降低了0.098 g/L和0.079 g/L,说明发酵后青稞多酚具有更强的α-葡萄糖苷酶抑制活性。XIAO等[28]发现荞麦经冠突散囊菌发酵后,提取物质量浓度为0.40 g/L时,其α-葡萄糖苷酶抑制率约为62.86%。本研究结果显示,发酵青稞游离酚和结合酚质量浓度为0.44 g/L时,α-葡萄糖苷酶抑制率分别达到71.05%和70.06%,与现有报道基本一致。上述结果表明,冠突散囊菌固态发酵全谷青稞具有潜在的降血糖功能,可作为糖尿病特殊膳食产品开发的基料。
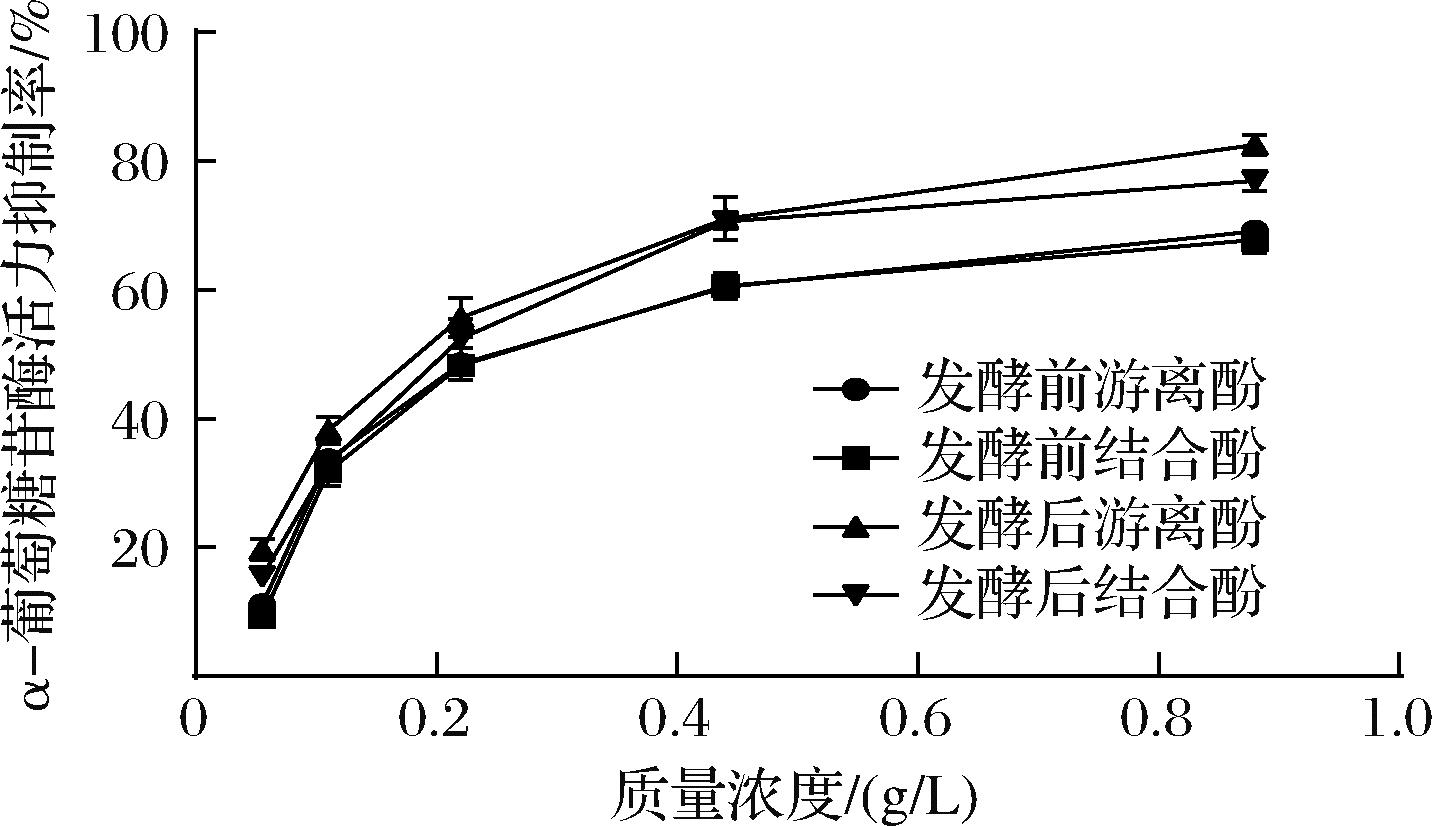
图3 发酵处理对青稞多酚体外α-葡萄糖苷酶抑制率的影响
Fig.3 Effect of fermentation treatment on α-glucosidase inhibition rate of highland barley polyphenols in vitro
2.3.3 胰脂肪酶抑制率
胰脂肪酶由胰腺分泌,在机体对脂质的消化吸收过程中起关键作用,因此抑制胰脂肪酶活性,能够有效减少营养物质的吸收,进而达到防治肥胖症的目的[30]。由图4可知,发酵后青稞游离酚、结合酚对胰脂肪酶抑制率较未处理青稞分别提高了9.94%和2.92%, IC50分别达到(0.279±0.01) g/L、(0.433±0.02) g/L。LU等[31]的研究表明,冠突散囊菌发酵显著增强了小麦麸皮的胰脂肪酶抑制活性。刘善鑫[29]发现冠突散囊菌发酵后燕麦对脂肪酶抑制率最高可达67.9%。上述报道与本研究结果一致。综上,冠突散囊菌固态发酵可提高青稞酚类物质对胰脂肪酶抑制活性,预示该发酵青稞可作为良好的功能性降脂食品及原料。
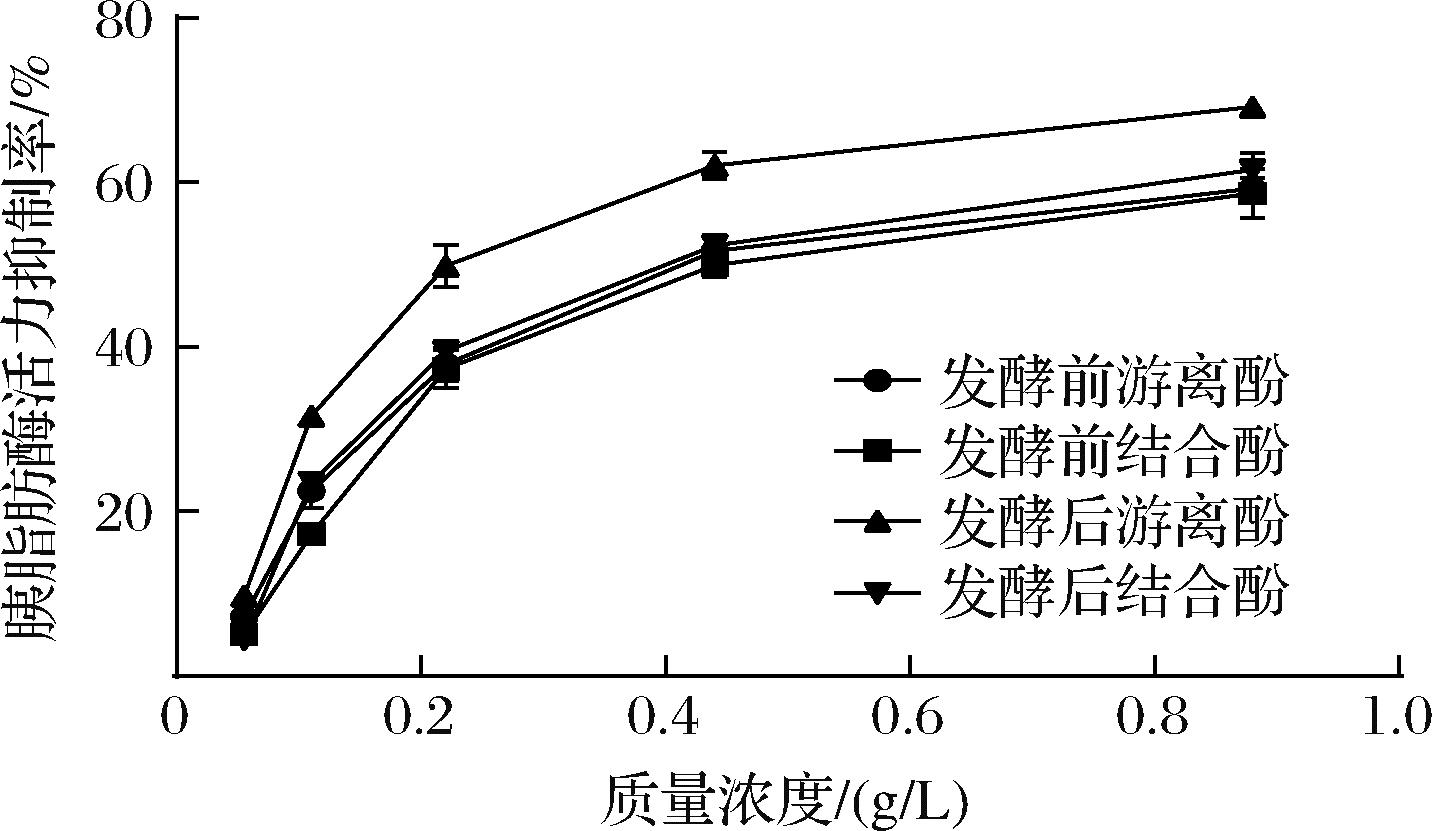
图4 发酵处理对青稞多酚体外胰脂肪酶抑制率的影响
Fig.4 Effect of fermentation treatment on pancreatic lipase inhibition rate of highland barley polyphenols in vitro
3 结论
本研究发现,全谷青稞经冠突散囊菌发酵后总酚、总黄酮类含量显著增加。发酵青稞中酚酸主要为羟基苯甲酸,黄酮主要为黄烷醇,而固态发酵显著提高了没食子酸、丁香酸、对羟基苯甲酸以及儿茶素的含量。与未经发酵处理的青稞相比,多酚提取物的DPPH自由基、ABTS阳离子自由基、FRAP清除能力分别提高了37.47%、60.78%以及48.24%。发酵后青稞游离酚对α-淀粉酶、α-葡萄糖苷酶及胰脂肪酶的抑制率分别达到84.67%、82.53%、69.21%,结合酚对上述酶的抑制率分别达到78.86%、79.73%、61.59%,相比未处理青稞显著提升。总体来看,冠突散囊菌固态发酵能有效地释放全谷青稞中的多酚,与姬松茸及桑黄固态发酵青稞相比,对青稞多酚含量的提升更为显著,但其富集程度与冠突散囊菌固态发酵甜荞与燕麦相比略低,推测原因是在预处理过程中,甜荞和燕麦样品的粉碎处理使冠突散囊菌更易附着在基质表面,更有利于多酚释放。值得注意的是,经过冠突散囊菌发酵后的青稞在体外抗氧化以及酶抑制活性方面优于甜荞和燕麦,在提升青稞抗氧化、预防糖尿病和抗肥胖等方面有一定优势,有望用于开发新型功能性食品或营养保健品。然而,本研究仅基于体外试验探究了发酵对青稞多酚释放及生物活性的影响,尚未对其作用机理及其活性成分在体内的变化规律进行研究。后续应进一步通过体外模拟消化探究发酵对青稞酚类物质利用度的影响,并通过动物试验验证其体内活性,为其在糖尿病、肥胖症等疾病的具体应用提供系统的理论依据。
[1] HONG Q Y, CHEN G J, WANG Z R, et al.Effects of different thermal processing methods on bioactive components, phenolic compounds, and antioxidant activities of Qingke (highland hull-less barley)[J].Food Science and Human Wellness, 2023, 12(1):119-129.
[2] WANG B, NIE C, LI T T, et al.Effect of boiling and roasting on phenolic components and their bioaccessibilities of highland barley[J].Food Research International, 2022, 162:112137.
[3] 杨希娟.不同粒色青稞品质评价及酚类物质组成与生物活性研究[D].杨凌:西北农林科技大学,2019.
YANG X J.Quality evaluation and phenolic composition of colored highland barley and its biological activity research[D].Yangling:Northwest A &F University, 2019.
[4] YANG X J, DANG B, FAN M T.Free and bound phenolic compound content and antioxidant activity of different cultivated blue highland barley varieties from the Qinghai-Tibet Plateau[J].Molecules, 2018, 23(4):879.
[5] HEO S J, KIM A J, PARK M J, et al.Nutritional and functional properties of fermented mixed grains by solid-state fermentation with Bacillus amyloliquefaciens 245[J].Foods, 2020, 9(11):1693.
[6] SAHARAN P, SADH P K, SINGH DUHAN J.Comparative assessment of effect of fermentation on phenolics, flavanoids and free radical scavenging activity of commonly used cereals[J].Biocatalysis and Agricultural Biotechnology, 2017, 12:236-240.
[7] WU H, LIU H N, MA A M, et al.Synergetic effects of Lactobacillus plantarum and Rhizopus oryzae on physicochemical, nutritional and antioxidant properties of whole-grain oats (Avena sativa L.) during solid-state fermentation[J].LWT, 2022, 154:112687.
[8] WANG X, CUI Y Y, SANG C W, et al.Fungi with potential probiotic properties isolated from Fuzhuan brick tea[J].Food Science and Human Wellness, 2022, 11(3):686-696.
[9] 姜良珍, 王罗, 杨涛, 等.冠突散囊菌及其发酵应用研究进展[J].食品工业科技, 2022, 43(4):454-462.
JIANG L Z, WANG L, YANG T, et al.Research progress on Eurotium cristatum and its fermentation application[J].Science and Technology of Food Industry, 2022, 43(4):454-462.
[10] 杨希娟, 党斌, 樊明涛.溶剂提取对青稞中不同形态多酚组成及抗氧化活性的影响[J].食品科学, 2018, 39(24):239-248.
YANG X J, DANG B, FAN M T.Effect of different extraction solvents on phenolic profiles and antioxidant activities of hulless barley[J].Food Science, 2018, 39(24):239-248.
[11] 李思楠,王萌,安宇,等.复合菌种发酵制备白芸豆多肽工艺优化及其抗氧化活性分析[J/OL].食品工业科技,1-13[2024-07-29].https://doi.org/10.13386/j.issn1002-0306.2024010304.
LI S N, WANG M, AN Y, et al.Process optimization and antioxidant activity analysis of white kidney bean polypeptides prepared by composite strain fermentation[J/OL].Science and Technology of Food Industry,1-13[2024-07-29].https://doi.org/10.13386/j.issn1002-0306.2024010304.
[12] 佐兆杭, 徐炳政, 宫雪, 等.藜麦粉的抗氧化能力及体外降糖降脂特性研究[J].山西农业科学, 2022, 50(11):1511-1518.
ZUO Z H, XU B Z, GONG X, et al.Study on antioxidant ability and hypoglycemic and lipid-lowering properties of quinoa powder in vitro[J].Journal of Shanxi Agricultural Sciences, 2022, 50(11):1511-1518.
[13] 马贺, 孙培利, 雷梅英, 等.猴头菌固态发酵青稞基质活性成分及抗氧化能力研究[J].食品安全质量检测学报, 2022, 13(20):6764-6771.
MA H, SUN P L, LEI M Y, et al.Study on bioactive compounds and antioxidant capacity in Hordeum vulgare Linn.substrate under solid-state fermentation with Hericium erinaceus[J].Journal of Food Safety &Quality, 2022, 13(20):6764-6771.
[14] 焦捷, 雷梅英, 王树林.羊肚菌固态发酵青稞的营养、活性成分及抗氧化特性变化研究[J].食品与发酵科技, 2023, 59(4):37-43.
JIAO J, LEI M Y, WANG S L.Study on changes of nutrition, active components and antioxidant properties of highland barley solid-fermented by Morchella[J].Food and Fermentation Science &Technology, 2023, 59(4):37-43.
[15] 陈如扬, 樊子依, 潘一玲, 等.冠突散囊菌对植物酚类物质的生物转化及生物活性的影响[J].食品研究与开发, 2022, 43(8):193-201.
CHEN R Y, FAN Z Y, PAN Y L, et al.Eurotium cristatum biotransformation plant phenolic compounds and affects their biological activities:A review[J].Food Research and Development, 2022, 43(8):193-201.
[16] LIU B, LU H Y, SHU Q, et al.The influence of different pretreatment methods of highland barley by solid-state fermentation with Agaricus sinodeliciosus var.chaidam ZJU-TP-08 on its nutrient content, functional properties and physicochemical characteristics[J].Journal of Fungi, 2022, 8(9):940.
[17] ZHOU X L, WANG J Y, SHAO G G, et al.Bidirectional solid-state fermentation of highland barley by edible fungi to improve its functional components, antioxidant activity and texture characteristics[J].Plant Foods for Human Nutrition, 2024, 79(2):308-315.
[18] DE VILLA R, ROASA J, MINE Y, et al.Impact of solid-state fermentation on factors and mechanisms influencing the bioactive compounds of grains and processing by-products[J].Critical Reviews in Food Science and Nutrition, 2023, 63(21):5388-5413.
[19] SHIN H Y, KIM S M, LEE J H, et al.Solid-state fermentation of black rice bran with Aspergillus awamori and Aspergillus oryzae:Effects on phenolic acid composition and antioxidant activity of bran extracts[J].Food Chemistry, 2019, 272:235-241.
[20] ZAHID H F, ALI A, LEGIONE A R, et al.Probiotic yoghurt enriched with mango peel powder:Biotransformation of phenolics and modulation of metabolomic outputs after in vitro digestion and colonic fermentation[J].International Journal of Molecular Sciences, 2023, 24(10):8560.
[21] S NCHEZ-PAT
NCHEZ-PAT N F, CUEVA C, MONAGAS M, et al.In vitro fermentation of a red wine extract by human gut microbiota:Changes in microbial groups and formation of phenolic metabolites[J].Journal of Agricultural and Food Chemistry, 2012, 60(9):2136-2147.
N F, CUEVA C, MONAGAS M, et al.In vitro fermentation of a red wine extract by human gut microbiota:Changes in microbial groups and formation of phenolic metabolites[J].Journal of Agricultural and Food Chemistry, 2012, 60(9):2136-2147.
[22] LI Y, LUO D, LI T, et al.Application of cellulase for contributing phenolic release and conversion in oats (Avena sativa L.) during microbial fermentation[J].Applied Biochemistry and Biotechnology, 2023, 195(7):4277-4291.
[23] ZHANG J, GUO J L, DANG B, et al.Enhancement of polyphenols and antioxidant activity in germinated black highland barley by ultrasonication[J].Molecules, 2023, 28(9):3679.
[24] 焦龙, 冯慧珍, 赵淑怡, 等.新型水溶性没食子酸衍生物的合成及其对冷藏南美白对虾的抗氧化保鲜性能[J].食品科学, 2024, 45(18):197-206.
JIAO L, FENG H Z, ZHAO S Y, et al.Synthesis and antioxidant activity of a novel water-soluble Gallic acid derivative and its effect on preserving refrigerated litopenaeus vannamei[J].Food Science, 2024, 45(18):197-206.
[25] LUO Q Q, GONG P F, SHI R Y, et al.Syringic acid alleviates dextran sulfate sodium-induced colitis in mice by modulating gut microbiota[J].Journal of Agricultural and Food Chemistry, 2023, 71(22):8458-8470.
[26] CHARLTON N C, MASTYUGIN M, TÖRÖK B, et al.Structural features of small molecule antioxidants and strategic modifications to improve potential bioactivity[J].Molecules, 2023, 28(3):1057.
[27] 杜静, 王琪琪, 王云胜, 等.冠突散囊菌发酵对葛根的活性物质和抗氧化活性的影响[J].食品工业科技, 2021, 42(1):121-125;131.
DU J, WANG Q Q, WANG Y S, et al.Effect on bioactive components and antioxidant activity of Pueraria lobata fermented by Eurotium cristatum[J].Science and Technology of Food Industry, 2021, 42(1):121-125;131.
[28] XIAO Y, WU X, YAO X S, et al.Metabolite profiling, antioxidant and α-glucosidase inhibitory activities of buckwheat processed by solid-state fermentation with Eurotium cristatum YL-1[J].Food Research International, 2021, 143:110262.
[29] 刘善鑫.冠突散囊菌发酵燕麦主要功能性成分及燕麦功效分析[D].长沙:湖南农业大学,2019.
LIU S X.Analysis on main functional components and oat efficacy of oat fermented by Eurotium cristatum[D].Changsha:Hunan Agricultural University, 2019.
[30] GIL-RODR GUEZ A M, BERESFORD T P.Lipase inhibitory activity of skim milk fermented with different strains of lactic acid bacteria[J].Journal of Functional Foods, 2019, 60:103413.
GUEZ A M, BERESFORD T P.Lipase inhibitory activity of skim milk fermented with different strains of lactic acid bacteria[J].Journal of Functional Foods, 2019, 60:103413.
[31] LU X J, JING Y, LI Y Y, et al.The differential modulatory effects of Eurotium cristatum on the gut microbiota of obese dogs and mice are associated with improvements in metabolic disturbances[J].Food &Function, 2021, 12(24):12812-12825.