骨骼发育是一个复杂且动态的过程,其中涉及多种细胞和生长因子[1]。而骨骼发育不良是一类影响骨和软骨组织组成与结构的发育性疾病,会诱发骨质疏松在内的多种骨骼相关疾病,主要表现包括肢端畸形、身材矮小、关节松弛、骨密度异常等[2]。
肠道菌群被称为人体内的“第二基因组”,维持人体与肠道微生物良好的共生关系,对人体健康至关重要[3]。近年来,越来越多的研究已经证明,肠道菌群可以调节骨骼发育[4-6]。进一步的研究表明,肠道菌群可以通过调节钙的吸收和免疫系统来影响骨骼发育[7-8]。钙是动物体内含量最多的矿物元素,对骨骼完整性和代谢平衡起着重要作用[9]。肠道菌群的代谢产物可直接促进钙吸收,也可增大肠上皮吸收面积,进而促进肠道钙的吸收。免疫系统与骨骼系统之间的关系被称为“骨免疫学”,当机体的免疫功能失调时,可导致骨代谢异常。肠道菌群可以调节宿主免疫相关细胞因子,降低骨吸收标志物和激活剂的水平,防止骨质流失,且骨形成标志物也显著增加。
奶粉一般是以新鲜牛乳为主要原料,富含优质的蛋白质、碳水化合物和多种矿物质。每天喝适量的奶粉可以促进儿童的生长发育,补充钙与维生素D。本试验2种奶粉含有不同量的膳食纤维及其他活性成分,这些成分可以改变肠道菌群的组成,进而影响骨骼发育[10-11]。因此,本实验建立骨骼发育不良模型对比2种奶粉对骨骼发育的影响及其肠道菌群介导的机制。
1 材料与方法
1.1 动物、材料与试剂
40只3周龄雌性ICR小鼠,购自成都达硕实验动物有限公司,实验动物生产许可证号:SCXK(川)2020-030。实验饲料为美国AIN-93G标准饲料,购于北京博泰宏达生物技术有限公司。
奶粉1、奶粉2,市售。
地塞米松磷酸钠注射液,辰欣药业股份有限公司;小鼠Ⅰ型胶原N端前肽(type I procollagen N-terminal propeptide,PINP)试剂盒、小鼠碱性磷酸酶(alkaline phosphatase,ALP)试剂盒、小鼠抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRACP)试剂盒、小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒、小鼠白细胞介素-1β(interleukin 1,IL-1β)试剂盒、小鼠白细胞介素-6(interleukin 6,IL-6)试剂盒、小鼠白细胞介素-10(interleukin10,IL-10)试剂盒,江苏酶免实业有限公司;钙测试盒,南京建成生物工程研究所。
1.2 仪器与设备
荧光酶标仪,赛默飞世尔科技公司;1176型小动物Micro-CT扫描影像系统,德国SkyScan公司;MiSeq PE300高通量测序平台,美国Illumina公司。
1.3 实验方法
1.3.1 奶粉的配方和营养成分
奶粉1配料表:生牛乳、乳糖、全脂乳粉、脱脂乳粉、脱盐乳清粉、浓缩乳清蛋白粉(WPC80)、低聚果糖、维生素K2、维生素B1(盐酸硫胺素)、维生素B2(核黄素)、维生素B6(盐酸吡哆醇)、维生素B12(氰钴胺)、维生素C(L-抗坏血酸)、烟酸、叶酸、泛酸(D-泛酸钙)、生物素(D-生物素)、胆碱(氯化胆碱)、牛磺酸、左旋肉碱(L-肉碱)、二十二碳六烯酸油脂、花生四烯酸油脂、CaCO3、FeSO4、葡萄糖酸锌、亚硒酸钠、叶黄素、乳铁蛋白、酵母β-葡聚糖(添加量20.0 mg/100 g)、水解蛋黄粉(添加量50.0 mg/100 g)、初乳碱性蛋白(添加量50.0 mg/100 g)、燕窝酸(添加量10.0 mg/100 g)、磷脂酰丝氨酸(添加量11.0 mg/100 g)、动物双歧杆菌Bb-12(添加量≥1.0×108 CFU/100 g)。
奶粉2配料表:生牛乳、脱脂乳粉、脱盐乳清粉、乳糖、植物油、低聚异麦芽糖、低聚半乳糖、低聚果糖、骨胶原蛋白肽、初乳碱性蛋白、酵母β-葡聚糖、水解蛋黄粉、N-乙酰神经氨酸、二十二碳六烯酸、花生四烯酸、动物双歧杆菌Bb-12、乳酸菌粉(乳双歧杆菌、短双歧杆菌、发酵乳杆菌、鼠李糖乳杆菌、植物乳杆菌、嗜酸乳杆菌、长双歧杆菌)、氯化胆碱、叶黄素、牛磺酸、左旋肉碱、富硒酵母、L-抗坏血酸钠、dl-α-醋酸生育酚、醋酸视黄酯、胆钙化醇、D-泛酸钙、盐酸硫胺素、盐酸叱哆醇、叶酸、氰钴胺、核黄素、烟酰胺、D-生物素、维生素K2、MgSO4、FeSO4、ZnSO4、CaCO3。每100 g添加:骨胶原蛋白肽200 mg,初乳碱性蛋白100 mg,酵母β-葡聚糖100 mg,水解蛋黄粉50 mg,N-乙酰神经氨酸10 mg,动物双歧杆菌Bb-12、乳双歧杆菌、短双歧杆菌、发酵乳杆菌、鼠李糖乳杆菌、植物乳杆菌、嗜酸乳杆菌、长双歧杆菌均为1.0×108 CFU。2种奶粉的营养成分如表1。
1.3.2 动物实验
实验方案经四川农业大学伦理委员会批准,并严格按照四川农业大学《实验动物保护和使用规则》执行。小鼠在温度20~25 ℃、相对湿度50%~60%的环境下,给予12 h光照/12 h黑暗交替条件,自由饮食、饮水,适应性喂养1周后,将小鼠按体质量随机分为4组:正常对照组(CON)、地塞米松组(DEX)、地塞米松+奶粉1组(DEX+MP1)、地塞米松+奶粉2组(DEX+MP2),分组后继续喂养8周。CON组和DEX组饲喂标准纯化日粮,DEX+MP1组和DEX+MP2组饲喂定制纯化日粮(日粮中添加质量分数为5%的奶粉)。模型组和处理组按照1 mg/kg的剂量肌肉注射地塞米松磷酸钠注射液,注射量为100 μL,每周3次,建立骨骼发育不良模型,CON组肌肉注射等量的NaCl注射液。
表1 两种奶粉的营养成分表
Table 1 Nutritional composition of two kinds of milk powder

项目奶粉1奶粉2每100 g营养素参考值/%每100 g营养素参考值/%能量1 913 kJ231 918 kJ23蛋白质18.0 g3018.5 g31脂肪18.0 g3018.4 g31碳水化合物54.8 g1852.8 g18膳食纤维(低聚半乳糖+以低聚果糖计)1.2 g53.1 g12钠300 mg15350 mg18维生素A450 μg RE56475 μg RE59维生素D7.5 μg1506.5 μg130维生素E4.50 mg α-TE323.45 mg α-TE25维生素K42.0 μg5350.0 μg62维生素B10.20 mg140.59 mg42维生素B21.02 mg731.00 mg71维生素B60.20 mg140.34 mg24维生素B121.50 μg632.20 μg92维生素C25.0 mg2525.0 mg25烟酸2.90 mg213.25 mg23叶酸55 μg23165 μg DFE41泛酸0.90 mg183.42 mg68生物素5.0 μg174.5 μg15胆碱100.0 mg22100.0 mg22镁--77 mg26钙1 000 mg1251 000 mg125铁9 mg609.0 mg60锌9 mg609.0 mg60硒10 μg2010.0 μg20乳铁蛋白10.0 mg---牛磺酸40.0 mg-35.0 mg-左旋肉碱6.3 mg-8.0 mg-叶黄素150.0 μg-150 μg-二十二碳六烯酸18.0 mg-10.0 mg-花生四烯酸26.0 mg-13.0 mg-
注:-表示该成分不存在。
1.3.3 体质量及采食量的测定
实验开始时每天记录每组小鼠的采食量,根据次日的余粮算出每只小鼠的日均采食量。小鼠禁食12 h后测量体质量,每周1次。
1.3.4 样品采集
饲喂8周后,收集粪便于冻存管中,放入液氮,转入-80 ℃冰箱保存待测。对小鼠注射戊巴比妥钠(200 mg/kg BW)将其麻醉,摘眼球取血液样品于管中,静置1~2 h,4 ℃下3 000 r/min离心15 min,吸取上清液,放入-20 ℃冰箱待测。小鼠脱颈处死后解剖,取股骨、胫骨,剔除多余肌肉筋膜及结缔组织后放于10%(体积分数)的甲醛固定液中待测。
1.3.5 股骨和胫骨的骨重、骨长的测定
用电子天平对骨组织的骨重进行测量;用游标卡尺对骨组织的骨长进行测量。
1.3.6 骨微结构的测定
取固定液中的股骨通过Micro-CT扫描影像系统进行扫描,扫描股骨远端的骨小梁部分,分辨率为9 μm,计算骨密度(bone mineral density,BMD)、骨小梁数量(trabecular number,Tb.N)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁分离度(trabecular separation,Tb.Sp)。
1.3.7 血清PINP、ALP、TRACP、钙含量的测定
将收集的血清按试剂盒说明书操作步骤测定PINP、ALP、TRACP、钙的含量。
1.3.8 血清中炎症因子含量的测定
将收集的血清按试剂盒说明书操作步骤测定TNF-α、IL-1β、IL-6、IL-10的含量。
1.3.9 16S rRNA高通量测序及微生物多样性分析
将收集的粪便样本,寄送至北京百迈客生物科技有限公司进行高通量测序文库的构建和Illumina MiSeq测序。使用PowerSoilRDNA Isolation Kit 试剂盒提取粪便中的细菌总DNA。对16s RNA基因V3~V4区域片段进行扩增,扩增产物进行高通量测序。使用Usearch软件对Reads在97.0%的相似度水平下进行聚类、获得操作分类单元。进一步采用α多样性分析、β多样性分析、物种组成及差异分析等方法获得微生物相关信息。
1.4 数据处理与分析
实验数据用平均值±标准差表示。采用SPSS 26进行单因素方差分析,通过Duncan检验进行显著性分析,P<0.05表示显著差异,采用Origin 9.1软件绘图,采用Hiplot进行皮尔逊相关性分析并做图。
2 结果与分析
2.1 奶粉对小鼠生长指数的影响
如图1-a所示,小鼠饲养8周后,与CON组相比,DEX组小鼠体质量下降;与DEX组相比,2种奶粉添加后体质量有所增加。与CON组相比,DEX组采食量显著降低;而添加奶粉1后采食量有所增加,并在添加奶粉2后达到显著水平,表明注射地塞米松会导致小鼠采食量下降,进而降低体质量,而奶粉的添加改善了小鼠的采食量。
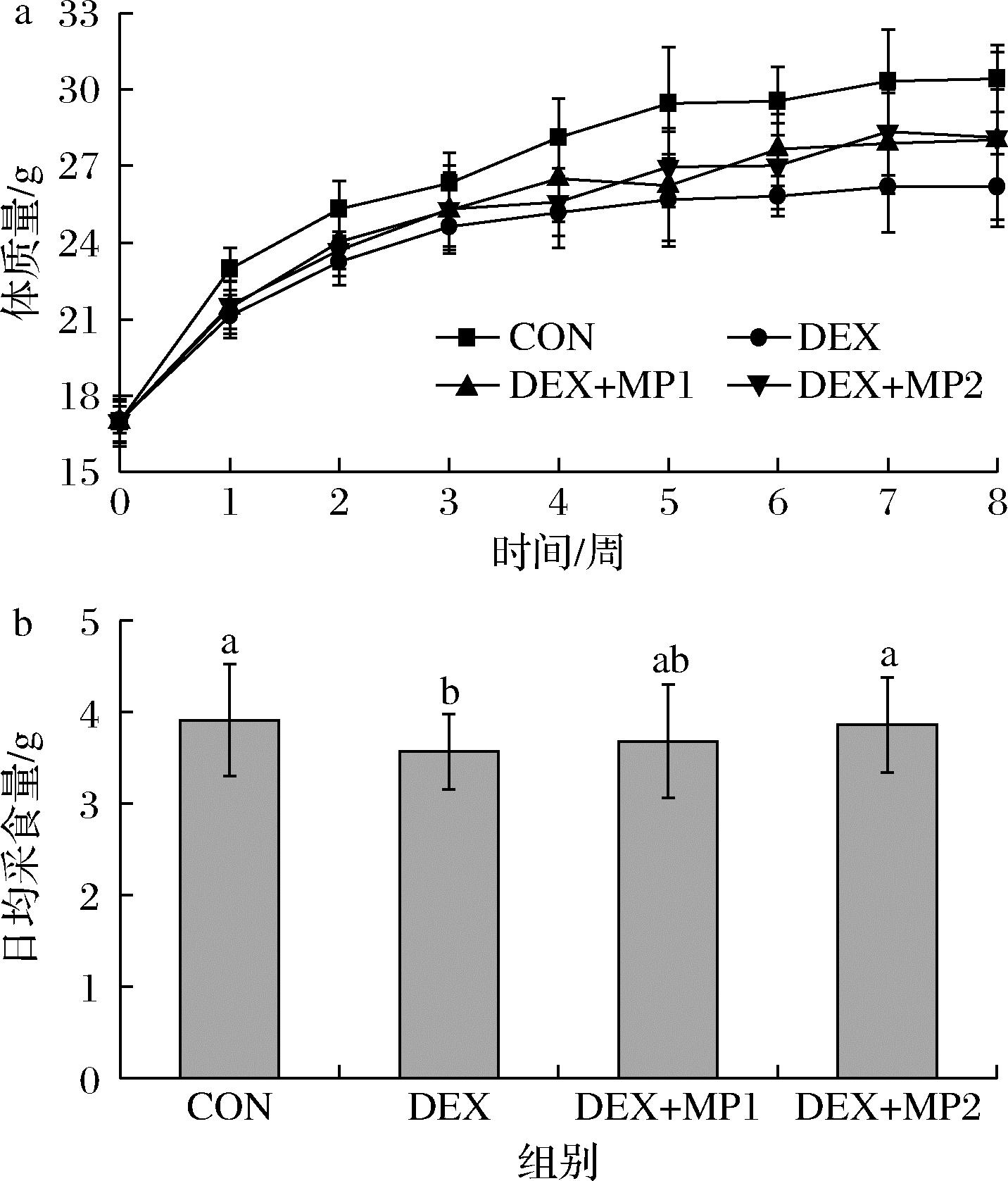
a-奶粉对小鼠体质量的影响;b-小鼠的日均采食量
图1 奶粉对小鼠生长指数的影响
Fig.1 Effect of milk powder on growth index of mice 注:同一指标,不同小写字母表示差异显著(P<0.05)(下同)。
2.2 奶粉对小鼠骨组织的影响
如图2所示,与CON组相比,DEX组的骨长、骨重显著下降;与DEX组相比,2种奶粉添加后股骨骨长和骨重有明显改善,而胫骨骨组织无显著变化,且2种奶粉之间没有显著差异。
2.3 奶粉对小鼠骨微结构的影响
BMD是评价骨质量和骨强度的重要指标,骨微结构是骨小梁的三维构筑及小梁间连接程度的统称。图3反映了各组小鼠的骨微结构,与CON组相比,DEX组的BMD显著下降,Tb.sp显著增加。而与DEX组相比,2种奶粉添加后都显著增加了BMD,并降低了Tb.sp,表明奶粉的添加可以改善骨微结构。此外,DEX+MP1组的Tb.N显著高于其他3组,表明奶粉1对骨微结构的改善效果优于奶粉2。
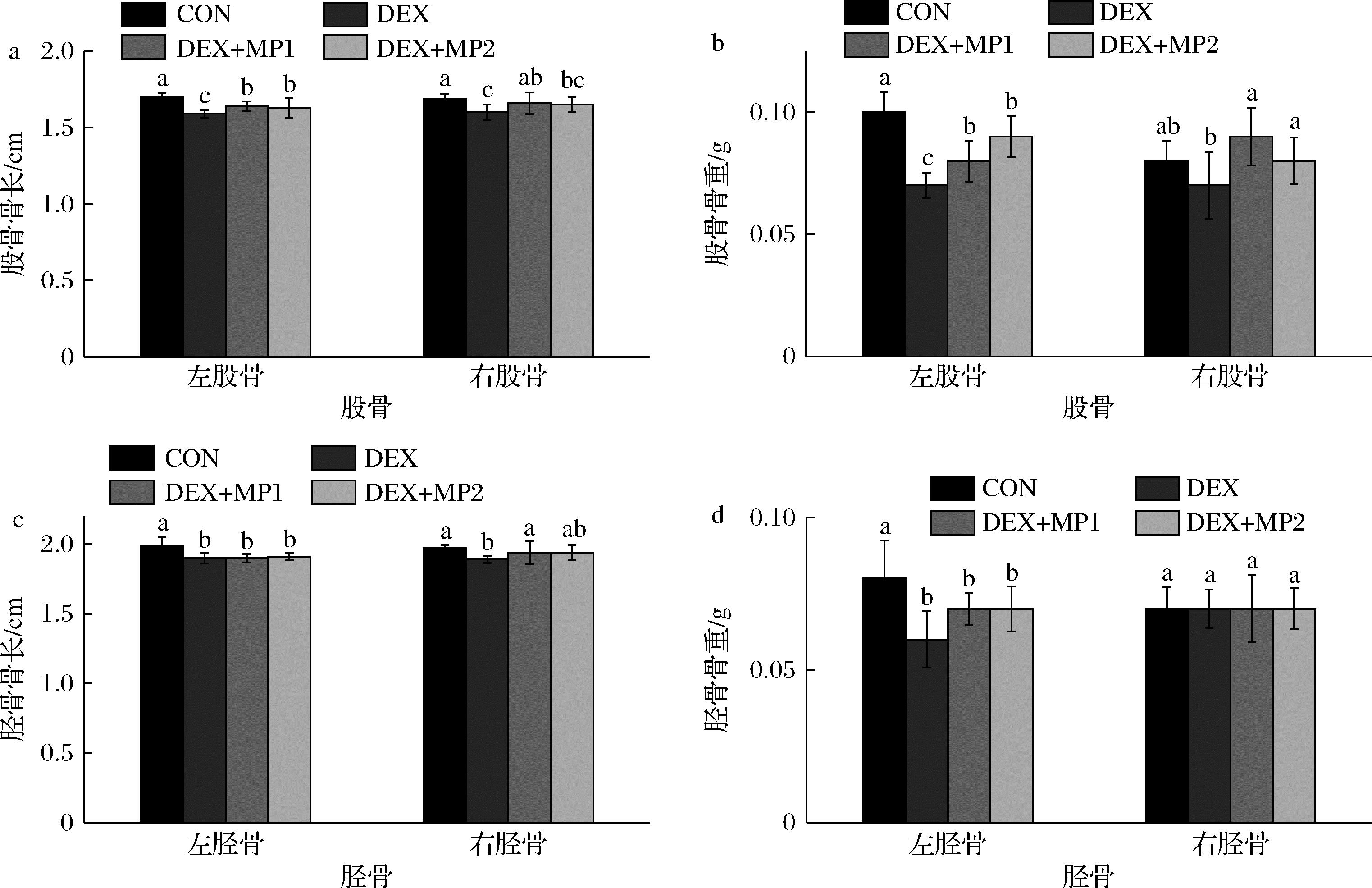
a-股骨骨长;b-股骨骨重;c-胫骨骨长;d-胫骨骨重
图2 奶粉对小鼠骨组织的影响
Fig.2 Effect of milk powder on bone tissue of mice
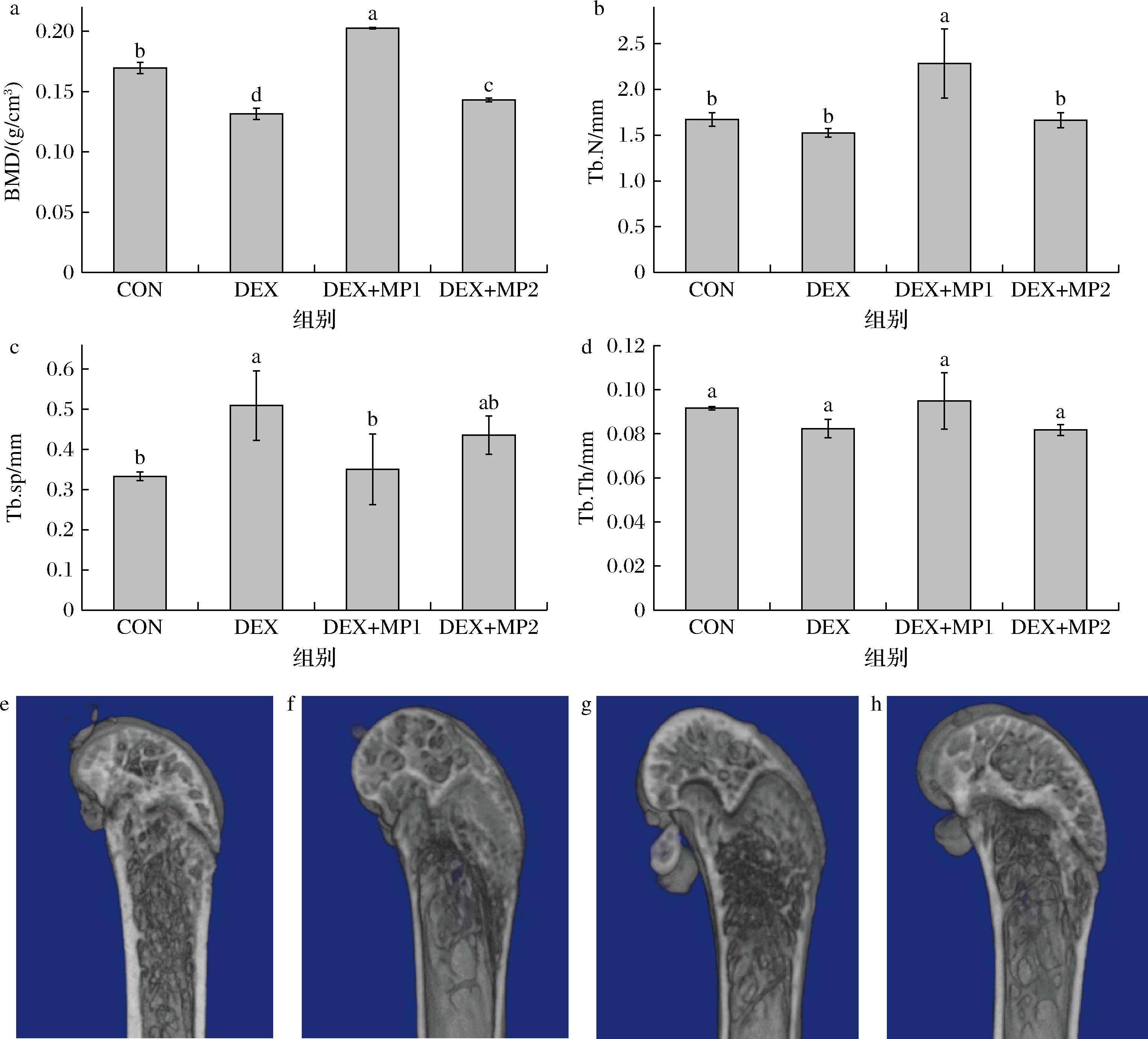
a-BMD;b-Tb.N;c-Tb.sp;d-Tb.Th;e-CON组骨结构照片;f-DEX组骨结构照片;g-DEX+MP1组骨结构照片;h-DEX+MP2组骨结构照片
图3 奶粉对小鼠骨微结构的影响
Fig.3 Effect of milk powder on bone microstructure of mice
2.4 奶粉对小鼠血清骨转换标志物及钙含量的影响
骨转换标志物反映骨形成和骨吸收水平及其活跃程度,PINP和ALP属于骨形成标志物,TRACP属于骨吸收标志物。图4-a~图4-c反映了小鼠血清中骨转换标志物的含量差异。与CON组相比,DEX组的PINP含量显著增加,TRACP含量显著下降。与DEX组相比,2种奶粉添加后都显著增加了ALP和TRACP的含量,表明2种奶粉添加后促进了骨形成和骨吸收标志物的形成。此外,与DEX+MP1组相比,DEX+MP2组显著增加了PINP和TRACP的含量。结果表明,2种奶粉添加后都会提高骨转换速率,奶粉2的效果更显著。与CON组相比,DEX组血清中钙含量显著降低;与DEX组相比,2种奶粉添加后血清中钙的含量显著增加(图4-d),表明奶粉的添加促进了血清中钙的吸收,且2种奶粉之间没有显著差异。

a-PINP;b-ALP;c-TRACP;d-钙含量
图4 奶粉对小鼠血清骨转换标志物及钙含量的影响
Fig.4 Effect of milk powder on serum bone turnover markers and calcium content in mice
2.5 奶粉对小鼠血清中炎症因子的影响
炎症因子参与机体的生理及病理过程,IL-1β、IL-6和TNF-α属于促炎细胞因子,IL-10属于抗炎细胞因子,促炎细胞因子会刺激骨吸收,还能加强其他细胞因子的作用。图5反映了血清中炎症因子的含量,与CON组相比,DEX组IL-1β、IL-6含量显著增加,IL-10含量显著降低;与DEX组相比,2种奶粉添加后降低了IL-1β的含量,增加了IL-10的含量,表明奶粉的添加通过降低促炎细胞因子水平和增加抗炎细胞因子水平来促进骨骼发育。此外,与DEX+MP1组相比,DEX+MP2组降低了IL-6和IL-10的含量,表明奶粉1可能是通过增加抗炎细胞因子的含量促进骨骼发育,奶粉2可能是通过降低促炎细胞因子的含量促进骨骼发育。
2.6 奶粉对小鼠肠道菌群的影响
2.6.1 α多样性分析
α多样性反映单个样品物种丰度及多样性,ACE指数衡量物种丰度即物种数量的多少,Shannon指数和Simpson指数衡量物种多样性,受样品群落中物种丰度和物种均匀度的影响。结果如表2所示,与CON组相比,DEX组中的多样性指数无显著变化,表明地塞米松对α多样性没有显著影响。与DEX组相比,2种奶粉添加后多样性有所下降,表明奶粉的添加降低了由地塞米松引起的肠道菌群紊乱。此外,与DEX+MP1组相比,DEX+MP2组的多样性显著下降,表明奶粉2的添加降低了物种多样性。
表2 奶粉对小鼠肠道菌群α多样性的影响(n=6)
Table 2 Effect of milk powder on α diversity of intestinal flora in mice(n=6)
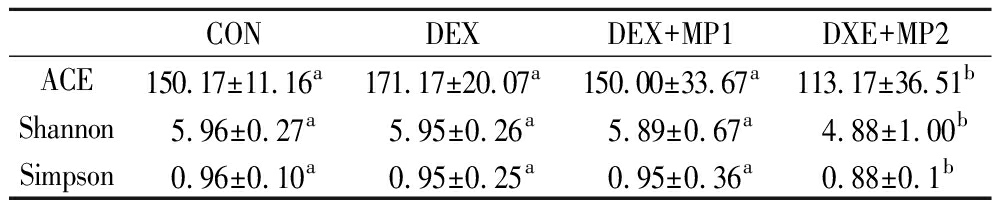
CONDEXDEX+MP1DXE+MP2ACE150.17±11.16a171.17±20.07a150.00±33.67a113.17±36.51bShannon5.96±0.27a5.95±0.26a5.89±0.67a4.88±1.00bSimpson0.96±0.10a0.95±0.25a0.95±0.36a0.88±0.1b
注:同一指标,不同小写字母表示差异显著(P<0.05)。
2.6.2 β多样性分析
β多样性反映各组小鼠肠道菌群组成的相似性或差异性。
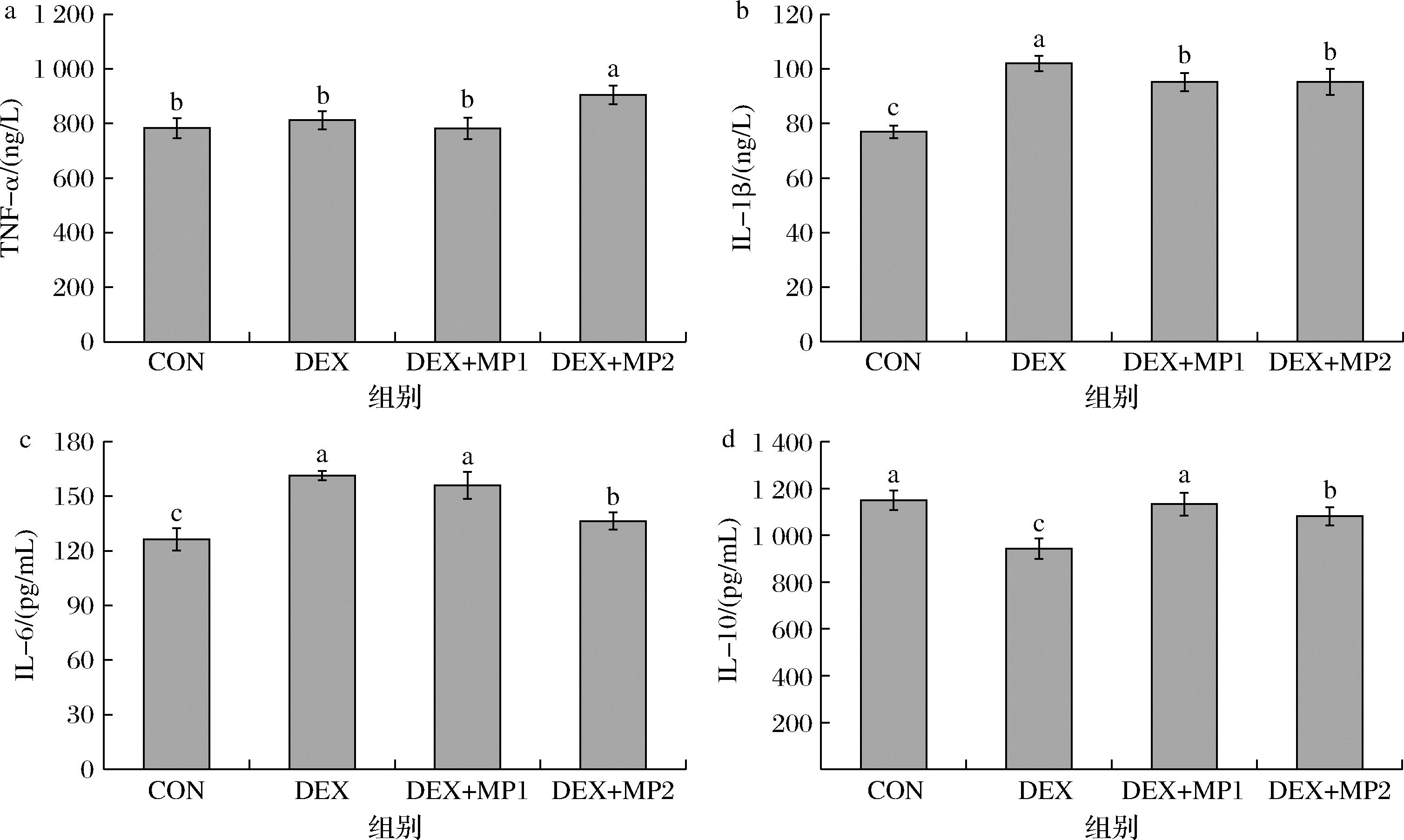
a-TNF-a;b-IL-1β;c-IL-6;d-IL-10
图5 奶粉对小鼠血清炎症因子含量的影响
Fig.5 Effect of milk powder on serum inflammatory factors in mice
如图6-a所示,各组出现明显分离,与DEX组相比,DEX+MP1组和DEX+MP2组微生物群落向右偏移,表明2种奶粉的添加在一定程度上能改变肠道菌群的结构。与DEX+MP1组相比,DEX+MP2组与DEX组表现出更远的距离,表明奶粉2的添加会显著改变肠道菌群的组成。非加权组平均法的结果也表明,不同样本之间的物种组成存在较大差异(图6-b)。
2.6.3 肠道微生物菌落组成分析
图7-a为门水平上各组的物种组成分类柱状图,其中Firmicutes和Bacteroidota是丰度最高的2个菌门。比较组间丰度变化发现,与CON组相比,DEX组增加了Bacteroidota和Verrucomicrobiota的相对丰度;与DEX组相比,2种奶粉添加后增加了Firmicutes和Verrucomicrobiota的相对丰度,降低了Bacteroidota的相对丰度。此外,奶粉2的添加显著增加了Firmicutes的相对丰度,降低了Bacteroidota的相对丰度。在属水平上,如图7-b所示,与CON组相比,DEX组中Lactobacillus和Bacteroides的相对丰度增加,unclassified_Desulfovibrionaceae的相对丰度降低。与DEX组比较,DEX+MP1组Akkermansia和Alloprevotella的相对丰度增加,Lactobacillus、unclassified_Muribaculaceae和Alistipes的相对丰度降低;DEX+MP2组Lactobacillus和Lachnoclostridium的相对丰度增加,unclassified_Muribaculaceae和Alistipes的相对丰度降低。进行LEfSe分析确定了各组间的差异物种(图7-c和图7-d)。在属水平上,奶粉1处理增加了f__Prevotellaceae,s__Prevotella_sp__canine_oral_taxon_226,g__Alloprevotella的丰度。奶粉2处理增加了g__Lachnoclostridium的丰度。
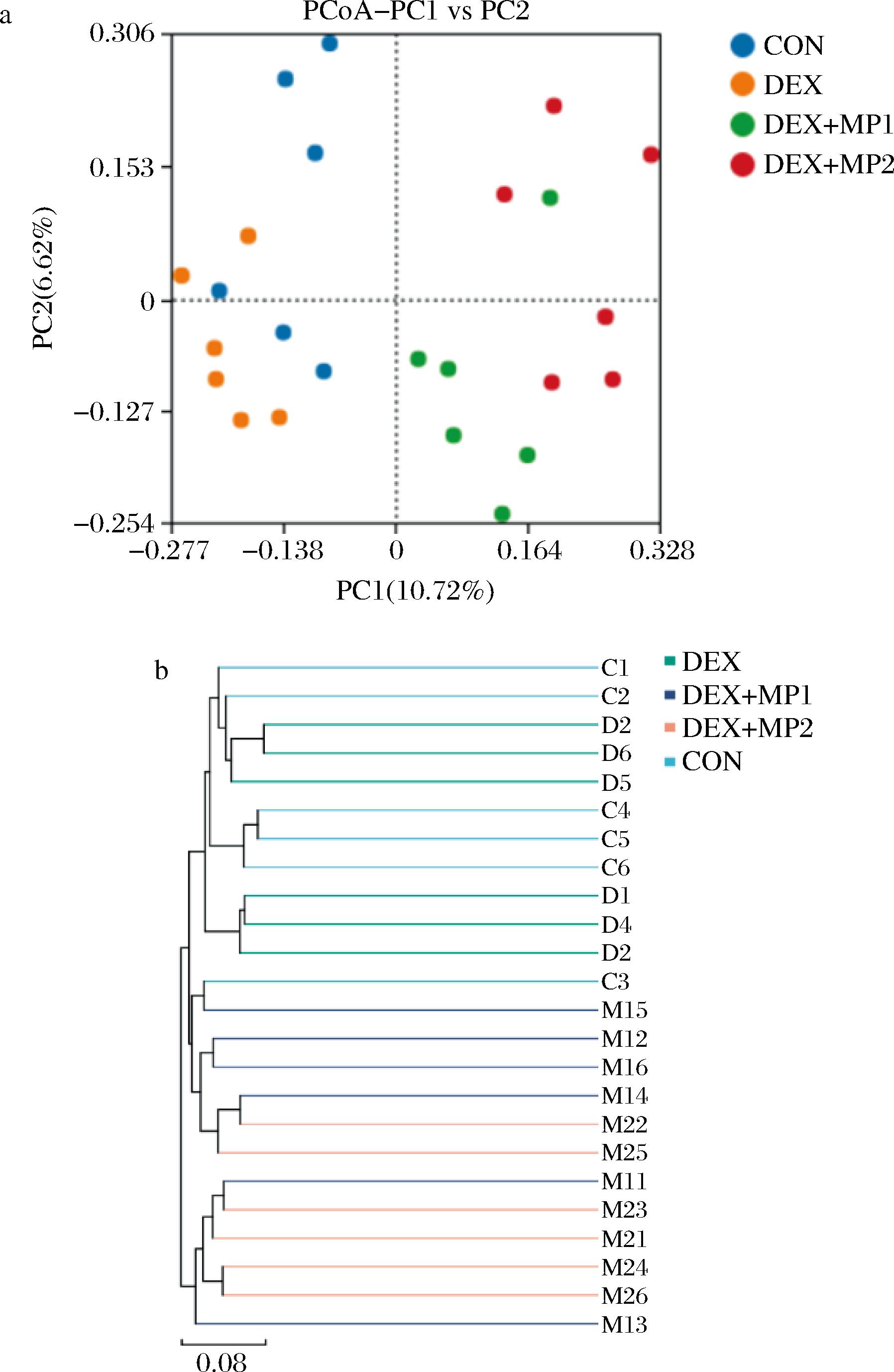
a-主坐标分析;b-非加权组平均法
图6 奶粉对小鼠肠道菌群β多样性的影响
Fig.6 Effect of milk powder on β diversity of intestinal flora in mice

a-门水平肠道菌群结构;b-属水平肠道菌群结构;c-组间差异物种LDA值分布柱状图;d-组间差异物种进化分支图
图7 各组小鼠肠道微生物菌群组成及差异物种分析
Fig.7 Composition of intestinal microflora and analysis of different species of mice in each group
2.7 骨相关生物学指标与肠道菌群相关性分析
为了寻找骨相关指标与肠道菌群之间可能存在的联系,我们进行了皮尔逊相关性分析(图8)。结果表明,在属水平上,并不是所有的生物学变化都与微生物群落的变化相关。在血清骨转换标志物方面,血清PINP与Alistipes呈负相关;血清ALP与unclassified_Muribaculaceae、Muribaculum和Alistipes呈负相关;血清TRACP与unclassified_Muribaculaceae和Alistipes呈负相关。这些结果说明血清骨转换标志物与不同肠道菌群之间存在相关性,肠道菌群可能参与调控骨转换标志物水平。
3 讨论
骨骼发育不良,也称为骨软骨发育不良,其特征是骨骼严重受累,伴有软骨和骨骼生长异常,导致骨长度、骨形状或骨密度异常[12-13]。研究表明[14-15],长期使用糖皮质激素会导致骨质流失,在糖皮质激素的长期作用下,成骨和破骨细胞凋亡增加,骨转换下降,骨密度降低,骨骼生长受到抑制。而地塞米松作为糖皮质激素的一种,可以使生长板静止带和肥大带软骨细胞糖皮质激素受体表达增强,抑制骨骼纵向生长,进而我们使用地塞米松对小鼠构建骨骼发育不良模型[16]。本实验中,通过地塞米松刺激致使小鼠产生骨骼发育不良反应,导致小鼠体质量和采食量下降。2种奶粉添加后,体质量和采食量均有所增加,这可能与奶粉本身的性质与所含能量有关。2种奶粉的添加使股骨组织和骨微结构得到改善,表明2种奶粉的添加缓解了地塞米松对小鼠骨骼生长的抑制,这与张会丰等[15]的研究结果类似。此外,奶粉1对骨微结构的改善效果优于奶粉2,可能与奶粉1中所含二十二碳六烯酸含量有关。二十二碳六烯酸属于n-3多不饱和脂肪酸,研究表明长期补充n-3脂肪酸对骨微结构产生有利影响[17]。另有研究表明摄入较多的n-3脂肪酸与较高的股骨密度之间存在关联[18]。
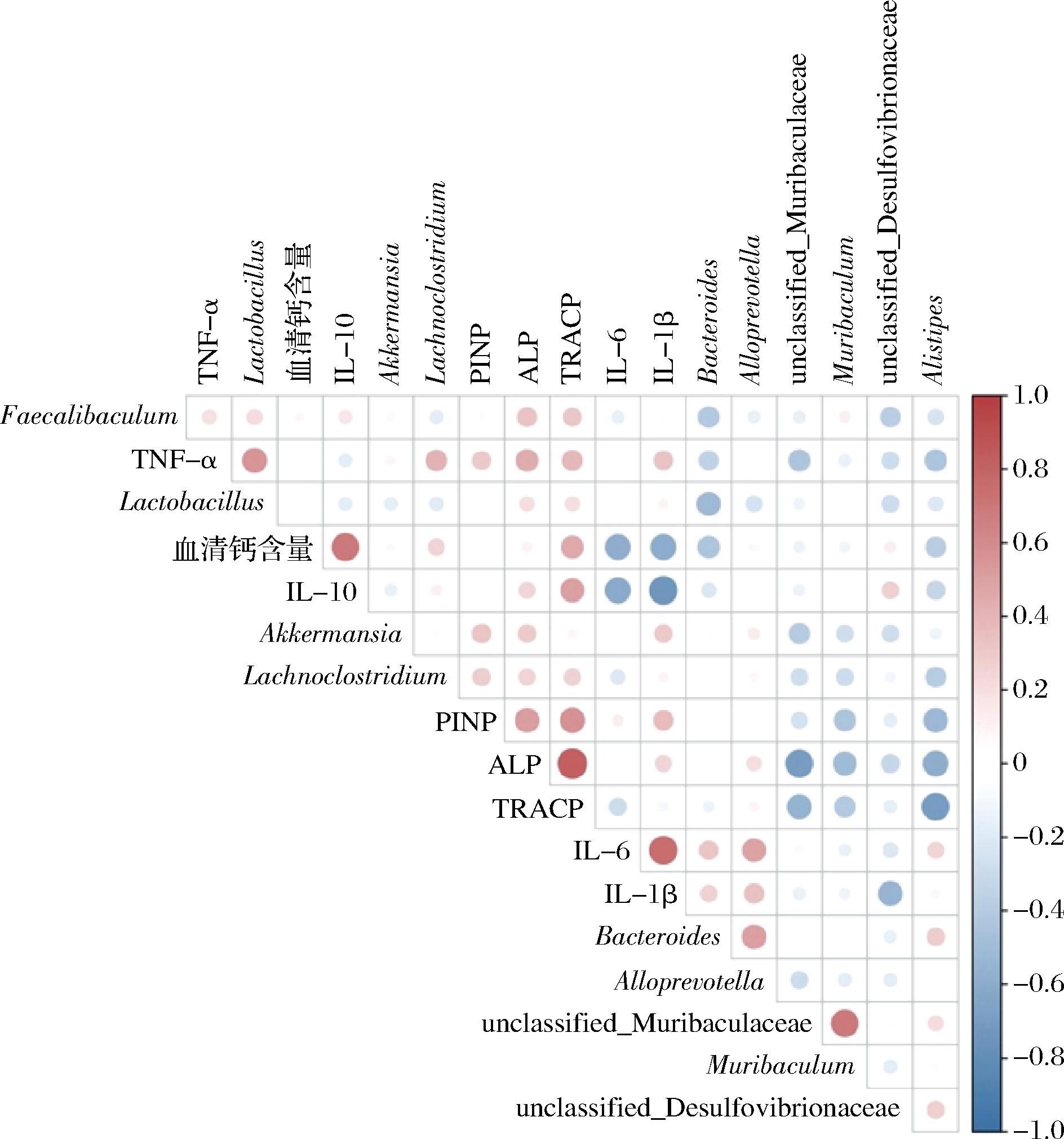
图8 骨相关生物学指标与肠道菌群相关性分析
Fig.8 Correlation analysis between bone-related biological indicators and intestinal flora
此外,我们进一步分析了血清骨转换指标。ALP可以比较确切地反映骨形成功能状态,其含量升高说明骨形成增加[19],TRACP主要来源于破骨细胞,且被认为直接参与破骨细胞的骨吸收过程,与其他酶一起参加骨基质中固体钙磷矿化物的降解[20]。在本研究中,2种奶粉添加后显著提高骨转换速率,进而改善小鼠的骨骼发育情况。而地塞米松处理后的小鼠骨形成标志物增加,可能是成骨细胞和破骨细胞参与骨重建,使骨转换率升高。皮尔逊相关性分析的结果表明,Alistipes和unclassified_Muribaculaceae与血清骨转换标志物呈负相关关系,表明这2种菌可能参与调节骨骼发育。研究表明[21-22],温暖暴露能防止骨质流失,而温暖暴露后Muribaculaceae在属水平上明显减少;饲粮中添加魔芋低聚糖对骨骼健康有益,而Alistipes的相对丰度却降低,这些研究表明这2种菌可能会抑制骨骼发育。血清中的钙与骨骼中的钙保持动态平衡,血钙含量的测定能反映出骨组织的代谢情况[23]。有研究表明地塞米松能够抑制肠道对钙的吸收[24]。2种奶粉添加后血清中钙的含量显著增加,表明奶粉可以通过增加肠钙的吸收,从而升高血钙水平,有助于新骨形成。
低浓度炎症环境能够激发细胞外基质和多细胞因子的聚集,调控损伤附近的间充质干细胞向成骨细胞分化,促进骨组织的再生修复[25]。而随着炎症反应的加剧和持续,间充质干细胞的活性及成骨分化能力受到抑制[26]。而抗炎细胞因子对破骨细胞生成的有抑制作用,对成骨细胞分化有促进作用。在本研究中,奶粉1显著增加了抗炎细胞因子含量,奶粉2显著降低了促炎细胞因子含量。这可能是由于奶粉1中添加了磷脂酰丝氨酸和动物双歧杆菌Bb-12,奶粉2中添加了乳酸菌粉。有研究表明[27-28],磷脂酰丝氨酸和动物双歧杆菌作用于机体,可使机体中IL-10含量增加。左玲玲[29]的研究表明,乳酸菌发酵的食物能够有效地降低机体的IL-6等促炎细胞因子含量。表明这2种奶粉可以通过增加抗炎细胞因子水平,降低促炎细胞因子水平来调节骨骼发育。
近年来,肠道菌群与人类健康和疾病的密切关系受到越来越多的关注,有研究表明肠道菌群可以促进正常骨骼健康和抑制骨质流失[22]。文章分析了各组小鼠粪便中的肠道菌群,主坐标分析和非加权组平均法结果显示,4组微生物群落出现明显分离。2种奶粉添加后都降低了由地塞米松引起的肠道菌群紊乱而导致的多样性增加,改变了群落组成。这与杨茜等[30]的研究结果类似,地塞米松的添加会使小鼠的肠道菌群紊乱,且地塞米松作为碳源和能源促进部分肠道菌群的代谢。此外,奶粉2的添加显著改变了物种多样性,这可能与奶粉2中的膳食纤维含量有关。SO等[10]的研究结果表明低聚果糖和低聚半乳糖可有效增加双歧杆菌和乳酸杆菌的丰度,抑制有害细菌增殖,但对α多样性没有明显影响。PATEL等[11]的研究结果表明低聚异麦芽糖可以促进双歧杆菌等的增殖。
Firmicutes和Bacteroidota作为肠道菌群的两大优势菌门,其平衡在宿主生理活动中起重要作用[31]。有研究表明[32-33],BMD与Firmicutes的比例呈正相关,与Bacteroidota的比例呈负相关。在本研究中,从门水平来看,2种奶粉添加后Firmicutes的比例增加,Bacteroidota的比例降低,这与WANG等[34]的研究结果类似。此外,奶粉1添加后增加了Verrucomicrobiota的比例,Verrucomicrobiota是一种有益细菌,广泛分布于健康的人体肠道中,可以控制炎症[35]。从属水平来看,奶粉1添加后增加了Akkermansia和Alloprevotella的相对丰度,降低了unclassified_Muribaculaceae的相对丰度,这与CHEVALIER等[22]的研究结果一致。LIU等[36]的研究表明,Akkermansia可能含有一些促成骨和抗破骨功能的分子,对骨骼健康产生有益作用。WANG等[37]的研究结果表明,Prevotella可改善破骨细胞的骨吸收,防止骨丢失,促进骨骼发育。奶粉2添加后增加了Lactobacillus和Lachnoclostridium的相对丰度。研究表明[38],Lactobacillus reuteri是一种具有抗炎和骨骼健康特性的益生菌,添加L. reuteri可防止成骨细胞成熟标志物的抑制。Lachnoclostridium被发现是一种可以将乳酸发酵为短链脂肪酸的菌株[39],进而通过降低肠道pH值、增加调节性T细胞的分化能力和诱导胰岛素样生长因子-1的产生来调节骨骼发育[40-41]。
4 结论
本研究中2种奶粉都能调节骨骼发育,但调控机制存在差异。奶粉1主要通过改善骨微结构,增加抗炎细胞因子的含量,而奶粉2主要通过提高血清骨转换速率,降低促炎细胞因子的含量,不同的调节机制可能与奶粉的配方不同有关。在调节肠道菌群方面,奶粉1上调了Akkermansia和Alloprevotella的相对丰度,而奶粉2上调了Lactobacillus和Lachnoclostridium的相对丰度,这些差异可能与不同奶粉配方的独特组成有关。2种奶粉比较而言,奶粉1能直接促进骨组织和改善骨微结构,具有更直接促进骨骼发育的效果。
[1] KUTTAPITIYA A, ASSI L, LAING K, et al.Microarray analysis of bone marrow lesions in osteoarthritis demonstrates upregulation of genes implicated in osteochondral turnover, neurogenesis and inflammation[J].Annals of the Rheumatic Diseases, 2017, 76(10):1764-1773.
[2] 吴南. 骨骼发育不良的遗传学研究进展[J].中华骨与关节外科杂志, 2021, 14(5):365-370. WU N.Advances in the genetics of skeletal dysplasias[J].Chinese Journal of Bone and Joint Surgery, 2021, 14(5):365-370.
[3] ZHU B L, WANG X, LI L J.Human gut microbiome:The second genome of human body[J].Protein &Cell, 2010, 1(8):718-725.
[4] PACIFICI R.Role of gut microbiota in the skeletal response to PTH[J].The Journal of Clinical Endocrinology and Metabolism, 2021, 106(3):636-645.
[5] GUO D J, LIU W W, ZHANG X, et al.Duck egg white-derived peptide VSEE (val-ser-glu-glu) regulates bone and lipid metabolisms by Wnt/β-catenin signaling pathway and intestinal microbiota[J].Molecular Nutrition &Food Research, 2019,63(24):e1900525.
[6] TOMCZYK-WARUNEK A, DUBIEL A, POLESZAK E, et al.Disorders of the intestinal flora and it is effect on skeletal system diseases[J].Wiadomo ci Lekarskie, 2020, 73(9):1835-1839.
ci Lekarskie, 2020, 73(9):1835-1839.
[7] WEAVER C M.Diet, gut microbiome, and bone health[J].Current Osteoporosis Reports, 2015, 13(2):125-130.
[8] RUBINSTEIN M R, WANG X W, LIU W, et al.Fusobacterium nucleatum promotes colorectal carcinogenesis by modulating E-cadherin/β-catenin signaling via its FadA adhesin[J].Cell Host &Microbe, 2013, 14(2):195-206.
[9] 汪晓娜. 日龄、钙和1, 25∶(OH)2∶D3对肉鸡生长性能、骨骼发育及小肠钙转运蛋白基因表达的影响[D].郑州:河南农业大学, 2021. WANG X N.Effects of age, calcium and 1, 25-(OH)2-D3 on growth performance, bone development and small intestinal calcium transporter gene expression in broilers[D].Zhengzhou:Henan Agricultural University, 2021. [10] SO D, WHELAN K, ROSSI M, et al.Dietary fiber intervention on gut microbiota composition in healthy adults:A systematic review and meta-analysis[J].The American Journal of Clinical Nutrition, 2018, 107(6):965-983.
[11] PATEL S, GOYAL A.Functional oligosaccharides:Production, properties and applications[J].World Journal of Microbiology and Biotechnology, 2011, 27(5):1119-1128.
[12] MARZIN P, CORMIER-DAIRE V.New perspectives on the treatment of skeletal dysplasia[J].Therapeutic Advances in Endocrinology and Metabolism,2020.DOI:10.1177/2042018820904016.
[13] MORTIER G R,COHN D H, CORMIER-DAIRE V, et al.Nosology and classification of genetic skeletal disorders:2019 revision[J].American Journal of Medical Genetics.Part A, 2019, 179(12):2393-2419.
[14] 王诗玮, 李玉姝.糖皮质激素诱导骨坏死[J].中华骨质疏松和骨矿盐疾病杂志, 2021, 14(4):404-411. WANG S W, LI Y S.Glucocorticoid-induced osteonecrosis[J].Chinese Journal of Osteoporosis and Bone Mineral Research, 2021, 14(4):404-411.
[15] 张会丰, 王卫平, 杨毅, 等.地塞米松对大鼠骨骼纵向生长的直接抑制作用[J].中国儿童保健杂志, 2007, 15(5):500-501;504. ZHANG H F, WANG W P, YANG Y, et al.Direct inhibition of dexamethasone on the longitudinal growth of bone in rats[J].Chinese Journal of Child Health Care, 2007, 15(5):500-501;504.
[16] 张会丰. 糖皮质激素抑制骨骼纵向生长机制的研究[D].上海:复旦大学, 2007. ZHANG H F.Study on the mechanism of glucocorticoid inhibits the longitudinal growth of skeleton in rats[D].Shanghai:Fudan University, 2007.
[17] BONNET N, FERRARI S L.Effects of long-term supplementation with omega-3 fatty acids on longitudinal changes in bone mass and microstructure in mice[J].The Journal of Nutritional Biochemistry, 2011, 22(7):665-672.
[18] ROUSSEAU JAMES H, ALISON K, KENNY ANNE M.Self-reported dietary intake of omega-3 fatty acids and association with bone and lower extremity function[J].Journal of the American Geriatrics Society, 2009, 57(10):1781-1788.
[19] 谌红珊, 胡藩, 刘冬梅, 等.中老年人群骨密度与血钙、血磷、骨转换指标的关系[J].中国老年学杂志, 2017, 37(2):380-382. CHEN H S, HU F, LIU D M, et al.Relationship between bone mineral density and blood calcium, blood phosphorus and bone turnover index in middle-aged and elderly people[J].Chinese Journal of Gerontology, 2017, 37(2):380-382.
[20] EICK G N, DEVLIN M J, CEPON-ROBINS T J, et al.A dried blood spot-based method to measure levels of tartrate-resistant acid phosphatase 5b (TRACP-5b), a marker of bone resorption[J].American Journal of Human Biology, 2019, 31(3):e23240.
[21] AI T Y, HAO L L, SHANG L C, et al.Konjac oligosaccharides modulate the gut environment and promote bone health in calcium-deficient mice[J].Journal of Agricultural and Food Chemistry, 2021, 69(15):4412-4422.
[22] CHEVALIER C, KIESER S, ÇOLAKO LU M, et al.Warmth prevents bone loss through the gut microbiota[J].Cell Metabolism, 2020, 32(4):575-590.
LU M, et al.Warmth prevents bone loss through the gut microbiota[J].Cell Metabolism, 2020, 32(4):575-590.
[23] 成娟. 血清维生素D水平与PCOS患者胰岛素抵抗、骨代谢的相关性分析[J].中国医学工程, 2022, 30(2):40-43. CHENG J.Correlation between serum vitamin D and insulin resistance, bone metabolism in PCOS patients[J].China Medical Engineering, 2022, 30(2):40-43.
[24] KIM M H, LEE G S, JUNG E M, et al.The negative effect of dexamethasone on calcium-processing gene expressions is associated with a glucocorticoid-induced calcium-absorbing disorder[J].Life Sciences, 2009, 85(3-4):146-152.
[25] LIU H R, LI D F, ZHANG Y, et al.Inflammation, mesenchymal stem cells and bone regeneration[J].Histochemistry and Cell Biology, 2018, 149(4):393-404.
[26] LEE J, BYUN H, MADHURAKKAT PERIKAMANA S K, et al.Current advances in immunomodulatory biomaterials for bone regeneration[J].Advanced Healthcare Materials, 2019, 8(4):e1801106.
[27] 钱刚. 磷脂酰丝氨酸在围术期神经认知障碍中作用的研究[D].济南:山东大学, 2020. QIAN G.Study on the role of phosphatidylserine in perioperative neurocognitive impairment[D].Jinan:Shandong University, 2020.
[28] 白晓晔. 干酪乳杆菌Zhang和动物双歧杆菌乳亚种V9发酵乳缓解便秘机制研究[D].呼和浩特:内蒙古农业大学, 2020. BAI X Y.Study on the mechanism of relieving constipation by fermented milk of Lactobacillus casei Zhang and Bifidobacterium animalis subsp.lactis V9[D].Hohhot:Inner Mongolia Agricultural University, 2020.
[29] 左玲玲. 乳酸菌发酵豆奶的蛋白结构表征及其致敏性的细胞学评估[D].南昌:南昌大学, 2019. ZUO L L.Characterization of protein structure of soymilk fermented by lactic acid bacteria and cytological evaluation of its sensitization[D].Nanchang:Nanchang University, 2019.
[30] 杨茜, 李晓愚, 斯丹, 等.饮水中地塞米松污染对小鼠肠道菌群的影响[J].南方医科大学学报, 2016, 36(2):238-243. YANG X, LI X Y, SI D, et al.Effect of dexamethasone contamination in drinking water on intestinal flora in mice[J].Journal of Southern Medical University, 2016, 36(2):238-243.
[31] BRUCE-KELLER A J, SALBAUM J M, LUO M, et al.Obese-type gut microbiota induce neurobehavioral changes in the absence of obesity[J].Biological Psychiatry, 2015, 77(7):607-615.
[32] LI C, HUANG Q, YANG R, et al.Gut microbiota composition and bone mineral loss—Epidemiologic evidence from individuals in Wuhan, China[J].Osteoporosis International, 2019, 30(5):1003-1013.
[33] TU M Y, HAN K Y, CHANG G R L, et al.Kefir peptides prevent estrogen deficiency-induced bone loss and modulate the structure of the gut microbiota in ovariectomized mice[J].Nutrients, 2020, 12(11):3432.
[34] WANG J H, WANG Y Y, GAO W J, et al.Diversity analysis of gut microbiota in osteoporosis and osteopenia patients[J].PeerJ, 2017, 5:e3450.
[35] ZHANG Y Q, LEE F Y, BARRERA G, et al.Activation of the nuclear receptor FXR improves hyperglycemia and hyperlipidemia in diabetic mice[J].Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(4):1006-1011.
[36] LIU J H, CHEN C Y, LIU Z Z, et al.Extracellular vesicles from child gut microbiota enter into bone to preserve bone mass and strength[J].Advanced Science, 2021, 8(9):2004831.
[37] WANG Z X, CHEN K, WU C C, et al.An emerging role of Prevotella histicola on estrogen deficiency-induced bone loss through the gut microbiota-bone axis in postmenopausal women and in ovariectomized mice[J].The American Journal of Clinical Nutrition, 2021, 114(4):1304-1313.
[38] ZHANG J, MOTYL K J, IRWIN R, et al.Loss of bone and Wnt10b expression in male type 1 diabetic mice is blocked by the probiotic Lactobacillus reuteri[J].Endocrinology, 2015, 156(9):3169-3182.
[39] LEMAIRE M, DOU S, CAHU A, et al.Addition of dairy lipids and probiotic Lactobacillus fermentum in infant formula programs gut microbiota and entero-insular axis in adult minipigs[J].Scientific Reports, 2018, 8:11656.
[40] YAN J, HERZOG J W, TSANG K, et al.Gut microbiota induce IGF-1 and promote bone formation and growth[J].Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(47):E7554-E7563.
[41] ARPAIA N, CAMPBELL C, FAN X Y, et al.Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation[J].Nature, 2013, 504(7480):451-455.