白酒糟是白酒生产过程中的主要副产物,年产量高达2 000万t,形成了巨大的副产物资源。白酒糟中不仅含有丰富的粗纤维、粗淀粉、粗蛋白等基础化学成分,还富含酚类、酸类、醇类、酯类、醛酮类、活性肽、氨基酸、多糖和吡嗪类等功能活性物质,具有较高的研究价值和利用价值[1]。在全球资源短缺的背景下,实现白酒糟的资源化利用和高值化利用日益迫切。目前白酒糟的资源化利用主要集中于生产饲料和肥料[2],这主要是利用白酒糟中丰富的基础化学成分,而活性成分的研究与开发利用是未来白酒糟实现高值化利用的有效途径。
多酚是广泛存在于植物和谷物中的活性物质,具有抗炎、抗氧化和调节短链脂肪酸等重要作用[3]。目前,关于白酒糟多酚的研究主要集中于游离酚提取条件的探究、抗氧化活性的评定及少数几种酚酸化合物的鉴定。曹新志等[4]以无水乙醇作为提取剂,当料液比1∶11(g∶mL)、提取时间8 h、提取温度75 ℃时白酒糟多酚的提取率最高;王兴东[5]采用福林酚比色法测得白酒糟中游离酚的含量为4.78 mg/g,进一步的研究表明白酒糟多酚对ABTS阳离子自由基具有较好的清除效果;WANG等[6]测定了白酒糟游离酚对DPPH自由基和ABTS阳离子自由基的半抑制浓度分别为16.21、5.73 μg/mL,并在白酒糟中检出阿魏酸、表儿茶素、对羟基苯甲酸、咖啡酸、丁香酸、槲皮素和没食子酸等8种多酚化合物。现有的研究为白酒糟多酚的提取、抗氧化活性的评定及多酚化合物的鉴定奠定了基础,但关于白酒糟结合酚的功能活性及白酒糟多酚对短链脂肪酸的调节作用的研究还未见报道。
本研究以酱香型白酒糟和清香型白酒糟为原料,通过超声辅助溶剂法联合碱解法提取其游离酚和结合酚,测其多酚含量,利用高效液相色谱-四级杆飞行时间串联质谱仪(high-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry,HPLC-Q-TOF-MS)联用技术鉴定游离酚和结合酚化合物组成结构,通过对DPPH自由基的清除能力、ABTS阳离子自由基的清除能力和对铁离子的还原能力(ferric ion reducing antioxidant power,FRAP)对抗氧化活性进行评定,并通过体外模拟胃肠道消化模型探究游离酚和结合酚对短链脂肪酸的影响,旨在对白酒糟多酚的活性功能进行较全面的评定,以期为实现白酒糟的高值化利用提供有利的科学依据。
1 材料与方法
1.1 材料与试剂
酱香型白酒糟,取自MT酒业股份有限公司;清香型白酒糟,取自LP酒业股份有限公司。样品在50 ℃恒温条件下干燥至恒重,粉碎过60目筛,于-20 ℃条件下保存。
甲酸(HPLC>98.0%),梯希爱化成工业发展有限公司;甲醇(色谱级),美国BCR试剂公司;没食子酸、原儿茶酸、对羟基苯甲酸、表儿茶素、咖啡酸、丁香酸、紫杉叶素、对香豆酸、阿魏酸、杨梅素、槲皮素、橙皮素、肉桂酸、山奈酚(均为HPLC≥98%)、DPPH、ABTS、2,4,6-三吡啶基三嗪(2,4,6-tripyridin-2-yl-1,3,5-triazine,TPTZ)、水溶性维生素E(Trolox)、吐温-80、氯化血红素、维生素K1、L-半胱氨酸、刃天青,索莱宝生物科技有限公司;酵母膏、蛋白胨、胰酶(S10031,胰蛋白酶活力≥4 000 U/g,胰淀粉酶活力≥7 000 U/g,胰脂肪酶活力≥4 000 U/g)、猪胆盐(S30895,胆酸含量≥60%),上海源叶生物科技有限公司;胃蛋白酶(P7000),美国Sigma-Aldrich公司。
1.2 仪器与设备
Agilent 6545 LC/Q-TOF四极杆飞行时间液质联用仪、ZORBAX Eclipse Plus C18(RRHD)1.8 μm毛细管柱,美国Agilent公司;ACQUITY液相色谱仪,美国Waters公司;LAI-3厌氧培养箱,上海龙跃仪器设备有限公司;SuPerMax多功能酶标仪,上海闪谱生物科技有限公司;GC9720 plus气相色谱仪,浙江福立分析仪器股份有限公司。
1.3 实验方法
1.3.1 游离酚和结合酚的提取测定及结构解析
参考谢星等[7]的方法并稍作修改,提取白酒糟中的游离酚和结合酚。称取5 g酒糟粉,按料液比1∶20(g∶mL)加入体积分数为60%的乙醇溶液,在超声功率420 W条件下提取30 min,4 ℃、5 000×g条件下离心10 min,收集上清液,得到白酒糟的游离酚提取液。向提取完游离酚的酒糟残渣中按料液比1∶40(g∶mL)加入2 mol/L NaOH溶液,充入N2隔绝O2,于摇床中(25 ℃, 180 r/min)消化4 h。消化结束后,将pH值调至2.0±0.2,加入乙酸乙酯萃取至上清液无色,旋转浓缩除去溶剂后得到白酒糟的结合酚提取液。用福林酚法测定提取液中多酚的含量,以没食子酸为标准样品制作标准曲线,回归方程为y=0.089 1x+0.088 3,相关系数R2=0.999 8。
参考焦阳[8]的方法并稍作修改,利用HPLC-Q-TOF-MS技术鉴定游离酚和结合酚化合物组成结构。液相条件:Waters ACQUITY超高效液相系统,使用SymmetryC18色谱柱(4.6 mm×150 mm, 5 μm),流速0.4 mL/min,柱温35 ℃,进样量3 μL,流动相为0.1%甲酸水溶液(A)和甲醇(B),梯度洗脱程序为:0~3 min,5%~20% B;3~13 min,20% B;13~17 min,20%~30% B;17~18 min,30%~40% B;18~20 min,40% B;20~21 min,40%~42% B;21~22 min,42%~44% B;22~23 min,42%~47% B;23~25 min,47%~50% B;25~35 min,50%~80% B;35~46 min,80% B;46~47.1 min,5% B;47.1~56 min,5% B。
质谱条件:通过电喷雾电离源(electrospray ionization,ESI)在负离子模式下对色谱系统中分离的洗脱液进行电离,获取质谱数据。雾化气体温度设为250 ℃,雾化气体流速11 L/min,喷雾器压力设定为45 psi,毛细管电压3 500 V,碎裂电压135 V,一级离子扫描范围50~1 000 m/z。
1.3.2 DPPH自由基清除能力的测定
参考蒋雨心等[9]的方法并稍作修改。用无水乙醇配制0.4 mg/mL的Trolox标准溶液,分别吸取0、10、20、30、40、50 μL Trolox标准溶液于离心管中,向离心管中依次加入100、90、80、70、60、50 μL蒸馏水,随后加入1.9 mL 0.04 mg/mL的DPPH标准溶液[用80%(体积分数)甲醇溶液溶解],摇匀,避光反应30 min,在517 nm波长处测量吸光度值,以浓度和吸光度值制作标准曲线方程。DPPH自由基的清除能力以单位质量酒糟粉中Trolox当量表示(μg Trolox/g)。
1.3.3 FRAP的测定
参考冯晓文等[10]的方法并稍作修改。用无水乙醇配制0.4 mg/mL的Trolox标准溶液,分别吸取0、10、20、30、40、50 μL Trolox标准溶液于离心管中,向离心管中依次加入50、40、30、20、10、0 μL蒸馏水,随后加入2.45 mL 10 mmol/L的TPTZ溶液(用40 mmol/L盐酸溶解),摇匀,避光反应30 min,在593 nm波长处测量吸光度值,以浓度和吸光度值制作标准曲线方程。FRAP以单位质量酒糟粉中Trolox当量FRAP表示(μg Trolox/g)。
1.3.4 ABTS阳离子自由基清除能力的测定
参考蒋雨心等[9]的方法并稍作修改。用无水乙醇配制0.24 mg/mL的Trolox标准溶液,分别吸取0、10、20、30、40、50 μL Trolox标准溶液于离心管中,向离心管中依次加入100、90、80、70、60、50 μL蒸馏水,随后加入900 μL ABTS阳离子自由基溶液,摇匀,避光反应30 min,在734 nm波长处测量吸光度值,以浓度和吸光度值制作标准曲线方程。ABTS阳离子自由基清除能力以单位质量酒糟粉中Trolox当量表示(μg Trolox/g)。
1.3.5 模拟小肠消化及结肠发酵
参考CHENG等[11]的方法并稍作修改,将1 mg/mL的白酒糟多酚提取液的pH值调至2.0,加入280 μL模拟胃液(0.01 mol/ L盐酸配制的胃蛋白酶溶液,酶活力≥250 U/mg solid),37 ℃消化1 h,消化结束后,立即将pH值调至6.5,随后加入6 mL模拟小肠消化液(由2 mg/mL胆盐和10 mg/mL胰酶溶液按体积比1∶3混合得到),于37 ℃继续消化2 h。
收集2名健康志愿者的粪便,按1∶9(g∶mL)加入0.01 mol/L无菌磷酸盐缓冲液(8 g NaCl、0.2 g KCl、1.15 g Na2HPO4、1.93 g Na2HPO4·12H2O、0.2 g KH2PO4、0.5 g L-半胱氨酸盐,加1 L蒸馏水,pH值调至7.4,经灭菌后制得),充分混匀后,经纱布过滤制得粪便悬浮液。将低剂量(0.711 mL)、中剂量(1.420 mL)和高剂量(2.842 mL)的多酚提取液分别按1∶18、1∶8和1∶4的体积比加入无菌厌氧培养基,随后加入1.5 mL粪便菌悬液[12]。将混合体系置于厌氧培养箱中(90% N2、5% CO2、5% H2、37 ℃)分别发酵24 h和48 h,发酵结束后,于10 000×g离心5 min,收集上清液用于短链脂肪酸分析。
1.3.6 短链脂肪酸的分析
参考TANG等[13]的方法,对短链脂肪酸进行测定。准确吸取800 μL上清液于离心管中,加入80 μL浓度为0.79 mol/L的2-乙基丁酸作为内标,再加入160 μL体积分数为50%的浓硫酸,充分混匀后,于4 ℃条件下酸化1 h,随后加入800 μL乙酸乙酯萃取10 min。萃取结束后,于13 000×g离心5 min,收集有机层对短链脂肪酸进行测定。测定条件如下:使用火焰检测器(flame ionization detector, FID)进行检测,毛细管色谱柱的型号为DB-WAX(30 m×0.25 mm×0.25 μm),检测器温度为250 ℃,样品进样量1 μL,分流比10∶1,初始温度设为105 ℃,持续3 min,然后以10 ℃/min升温至170 ℃,再以70 ℃/min升温至240 ℃,持续7 min。
1.4 数据分析
使用SPSS 26.0进行统计分析,GraphPad Prism 9.0绘制柱状图,Chiplot 0.2绘制主成分分析图,OmicStudio在线工具绘制相关性网络热图。
2 结果与分析
2.1 酱香型和清香型白酒糟多酚含量
没食子酸标准曲线见电子增强出版附图1(https://doi.org/10.13995/j.cnki.11-1802/ts.037469,下同),2种香型白酒糟多酚含量见表1。酱香型和清香型白酒糟的多酚含量差异显著(P<0.05),酱香型白酒糟的游离酚和结合酚含量分别为(5.67±0.10)、(3.03±0.01) mg/g,清香型白酒糟的游离酚和结合酚含量分别为(5.27±0.04)、(1.87±0.02) mg/g。已报道的白酒糟总酚含量为3.50~6.80 mg/g[5-6],与本研究相比偏低,这可能与提取方法相关。先前的研究直接用有机溶剂或水浸提白酒糟多酚,没有经酸解或碱解,导致大部分与膳食纤维、蛋白质和淀粉共价结合的结合态多酚没有被提取[14]。本研究采用超声辅助溶剂法联合碱解法分别提取游离酚和结合酚,这可能使多酚提取的更彻底。超声提取可通过“空化效应”破坏组织或细胞,提高传质速率,促进多酚的释放[15],而碱解可高效地将多酚与细胞壁连接的糖苷键和酯键断裂,促进结合酚的大量释放[16]。IZADIFAR[17]使用超声辅助溶剂法使酒糟多酚的提取率提高14.29%;HUANG等[16]观察到碱解的后麦麸结构松散,充满孔,原纤维素结构完全丢失。
此外,酱香型和清香型白酒糟的游离酚含量均高于结合酚(表1),这可能与样品的粉碎有关,粉碎过程可促进结合酚向游离酚的转化。结合酚主要以醚键、酯键或糖苷键与纤维素、半纤维素和木质素共价结合,而粉碎过程中的热效应可使多酚与细胞壁之间的共价作用或非共价作用解除,导致结合酚向游离酚的转化。卫子颜等[18]研究表明粉碎可促进米糠的结合酚向游离酚的转化。结果表明,酱香型白酒糟的多酚含量高于清香型白酒糟,且在同一白酒糟样品中,游离酚的含量高于结合酚。
表1 酱香型和清香型白酒糟多酚含量 单位:mg/g
Table 1 Polyphenol content in sause-flavored and light-flavored Baijiu distiller’s grain

样品游离酚结合酚酱香型白酒糟5.67±0.10a3.03±0.01a清香型白酒糟5.27±0.04b1.87±0.02b
注:同一列中不同字母表示差异显著(P<0.05)。
2.2 酱香型和清香型白酒糟多酚化合物组成
质谱鉴定结果见电子增强出版附图2,多酚化合物的组成和含量测定结果见表2。由主成分分析结果可知(电子增强出版附图3),酱香型白酒糟和清香型白酒糟中多酚化合物存在明显差异。酱香型白酒糟中共检出14种多酚化合物,游离酚14种、结合酚8种,其中杨梅素、表儿茶素和对羟基苯甲酸在游离酚中的含量分别为(377.72±16.76)、(350.66±13.65)、(87.26±0.74) μg/g,阿魏酸(2 206.35±32.86) μg/g是结合酚中含量最高的多酚化合物。清香型白酒糟中共检出11种多酚化合物,游离酚10种,结合酚8种,香豆酸(2 331.17±15.53) μg/g和原儿茶酸(552.18±5.15) μg/g分别是游离酚和结合酚中含量最高的多酚化合物。阿魏酸广泛存在于谷物中[19],2种香型的白酒糟中均含有丰富的阿魏酸[酱香型白酒糟游离酚为(60.44±0.47) μg/g;酱香白酒糟结合酚含量为(2 206.35±32.86) μg/g;清香型白酒糟游离酚含量为(831.52±5.75) μg/g;清香型白酒糟结合酚含量为(156.54±1.77) μg/g]。关于白酒糟多酚的研究,王鑫等[20]在酱香型白酒糟中检出阿魏酸、肉桂酸和丁香酸等多酚化合物;WANG等[6]在清香型白酒糟中检测的8种多酚化合物中,表儿茶素(562.7 μg/g)和阿魏酸(518.2 μg/g)含量较高。
结果表明,酱香型白酒糟和清香型白酒糟中含有丰富的多酚化合物,杨梅素和阿魏酸分别是酱香型白酒糟游离酚和结合酚中含量最高的多酚化合物,而对香豆酸和原儿茶酸分别是清香型白酒糟的游离酚和结合酚中含量最高的多酚化合物。
表2 酱香型和清香型白酒糟多酚化合物组成及含量测定结果 单位:μg/g
Table 2 Composition and content of polyphenolic compounds in sauce-flavored and light-flavored Baijiu distiller’s grain

酚类化合物保留时间/min分子式质荷比(m/z)误差/ppm前驱离子类型酱香型酒糟清香型酒糟游离酚含量/(μg/g)结合酚含量/(μg/g)游离酚含量/(μg/g)结合酚含量/(μg/g)没食子酸12.157C7H6O5169.014 10.6[M-H]-52.15±0.75---原儿茶酸39.443C7H6O4153.019 40.6[M-H]-38.71±0.22561.03±9.9129.32±0.09552.18±5.15对羟基苯甲酸39.905C7H6O3137.024 72.2[M-H]-287.26±0.74355.31±18.4644.88±5.57385.16±0.24表儿茶素40.609C15H14O6289.072 42.1[M-H]-350.66±13.65321.62±7.34107.19±0.20460.26±3.98咖啡酸18.590C9H8O4179.035 00.0[M-H]-57.19±0.40253.22±4.53112.50±0.88258.32±5.71丁香酸26.024C9H10O5197.045 40.5[M-H]-38.38±8.1428.59±2.0431.64±0.6447.21±0.49紫杉叶素26.512C15H12O7303.051 41.3[M-H]-91.56±0.36144.06±0.73-192.08±0.86对香豆酸27.342C9H8O3163.040 41.8[M-H]-29.10±0.26439.52±6.442 331.17±15.5389.68±0.42阿魏酸27.902C10H10O4193.050 81.0[M-H]-60.44±0.472 206.35±32.86831.52±5.75156.54±1.77杨梅素31.143C15H10O8317.030 40.3[M-H]-377.72±16.76-283.24±5.17-槲皮素31.416C15H10O7301.035 20.7[M-H]-56.28±0.47-11.95±0.18-橙皮素31.977C16H14O6301.072 11.0[M-H]-14.76±2.05-8.02±0.24-肉桂酸35.363C9H8O2147.044 54.7[M-H]-4.80±0.41---山奈酚38.326C15H10O6285.040 70.7[M-H]-22.44±0.28---
注:-表示未检出。
2.3 酱香型和清香型白酒糟多酚抗氧化活性
如图1所示,酱香型和清香型白酒糟的游离酚抗氧化活性更加接近,而清香型白酒糟的结合酚抗氧化活性与其他样品抗氧化活性差异大(图1-a)。由图1-b可知,2种香型白酒糟多酚的抗氧化活性存在显著差异(P<0.05),且酱香型白酒糟游离酚的抗氧化活性>清香型白酒糟游离酚>酱香型白酒糟结合酚>清香型白酒糟结合酚。酱香型白酒糟的游离酚对ABTS阳离子自由基、DPPH自由基的清除能力和FRAP分别为(486.34±14.51)、(124.43±2.00)、(105.46±0.64) μg Trolox/g;结合酚对ABTS阳离子自由基、DPPH自由基的清除能力和FRAP分别为(429.85±2.09)、(124.58±11.50)、(54.42±2.37) μg Trolox/g。清香型白酒糟的游离酚对ABTS阳离子自由基、DPPH自由基的清除能力和FRAP分别为(472.19±12.52)、(117.16±2.05)、(100.53±0.65) μg Trolox/g;结合酚对ABTS阳离子自由基、DPPH自由基的清除能力和FRAP分别为(239.69±0.40)、(85.36±4.20)、(27.73±0.70) μg Trolox/g。关于白酒糟多酚抗氧化活性的研究,WANG等[6]和毕静等[21]也报道了白酒糟多酚具有较强的抗氧化活性。

a-主成分分析图;b-游离酚和结合酚抗氧化活性;c-游离酚和结合酚抗氧化活性比较气泡图
图1 白酒糟的抗氧化活性
Fig.1 Antioxidant activity of distiller’s grain 注:不同字母代表差异性显著(P<0.05)。
此外,本研究中,酱香型白酒糟游离酚的多酚含量>清香型白酒糟游离酚>酱香型白酒糟结合酚>清香型白酒糟结合酚(表1),与抗氧化活性保持相同的趋势,这表示抗氧化活性的强弱可能与多酚含量密切相关。抗氧化活性与多酚含量之间的正相关关系被广泛报道[11-13]。XIANG等[22]研究表明有色小麦的抗氧化活性强于白色小麦,归因于有色小麦具有更高的多酚含量。此外,抗氧化活性可能与多酚化合物有关。槲皮素、杨梅素和表儿茶素较强的抗氧化、抗炎等生物活性被广泛报道[23-25]。在酱香型和清香型白酒糟中,槲皮素、杨梅素和表儿茶素具有较高的浓度,而在其结合酚中未检测到槲皮素和杨梅素,这可能是导致酱香型和清香型白酒糟的游离酚具有较高抗氧化活性的原因之一。
结果表明,2种香型白酒糟的多酚具有良好的抗氧化活性,且酱香型白酒糟多酚的抗氧化活性比清香型白酒糟强,而同一香型白酒糟的游离酚抗氧化活性强于结合酚。
2.4 抗氧化活性和多酚化合物间相关性分析
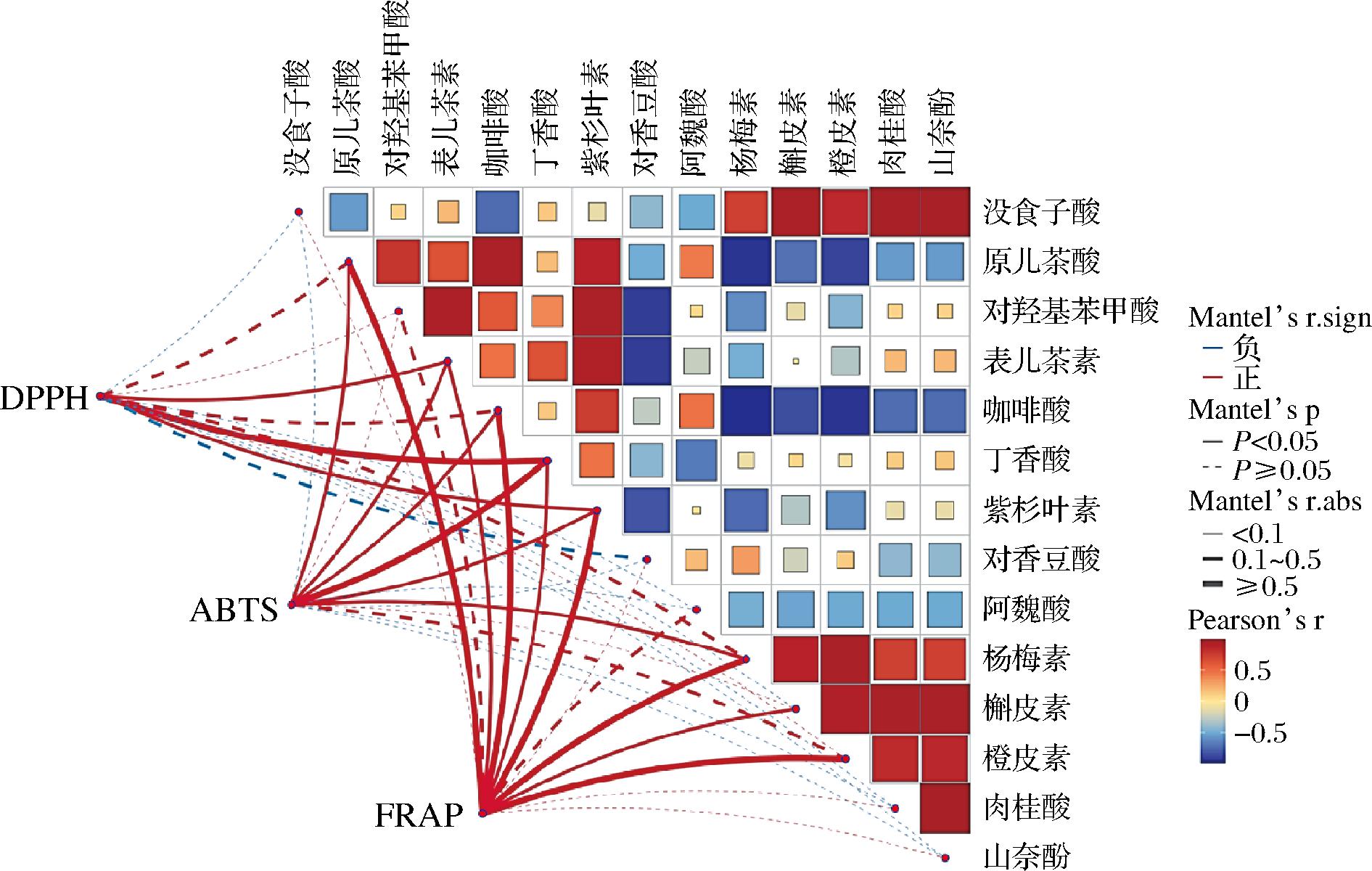
图2 抗氧化活性与多酚化合物间相关性分析
Fig.2 Correlation analysis between antioxidant activity and polyphenolic compounds
由图2可知,DPPH自由基的清除能力与表儿茶素、丁香酸和紫杉叶素呈显著正相关(P<0.05);ABTS阳离子自由基的清除能力与原儿茶酸、表儿茶素、咖啡酸、丁香酸、紫杉叶素和杨梅素呈显著正相关(P<0.05);FRAP的还原能力与原儿茶酸、表儿茶素、咖啡酸、丁香酸、紫杉叶素、杨梅素、槲皮素和橙皮素呈显著正相关(P<0.05)。表明上述多酚化合物在发挥抗氧化活性方面具有重要贡献。在以往的研究中,槲皮素和表儿茶素对抗氧化的积极作用已被广泛报道。槲皮素因其独特的分子结构(B环中的邻苯二酚基团;C环上与4-氧代基共轭的2,3-双键;杂环中C3、C5位的羟基)而具有强抗氧化活性[25]。槲皮素可抑制线粒体膜的通透性和活性氧的生成,增加线粒体膜电位,从而有效减少线粒体的氧化损伤[26]。马健等[27]研究表明,表儿茶素与ABTS阳离子自由基、DPPH自由基、羟自由基、超氧阴离子自由基的清除能力和FRAP呈正相关关系。
上述结果表明,抗氧化活性与多酚化合物密切相关,表儿茶素、槲皮素、杨梅素、丁香酸、紫杉叶素、原儿茶酸、咖啡酸和橙皮素在白酒糟多酚的抗氧化活性中可能发挥重要作用。
2.5 酱香型和清香型白酒糟多酚对短链脂肪酸的影响
短链脂肪酸是肠道微生物发酵难以消化的碳水化合物产生的重要代谢物,不仅可为结肠、回肠细胞提供能量来源,还能酸化肠道环境,抑制有害微生物生长,维持机体的肠道健康[12]。多酚可通过调节肠道微生物生长,促进短链脂肪酸的产生。标准曲线方程、短链脂肪酸标准品和样品的气相色谱图见电子增强出版附图4,酱香型白酒糟与清香型白酒糟多酚对短链脂肪酸的影响见图3。总的来说,与空白组相比,酱香型和清香型白酒糟的游离酚和结合酚对乙酸、丙酸、丁酸和戊酸有积极促进作用(P<0.05)。乙酸、丙酸和丁酸占总短链脂肪酸的90%以上,其广泛的活性功能被大量报道,如促进肠道黏膜生长,维持黏膜屏障的完整性,保持肠道环境的稳态[11]。本研究中,酱香型和清香型白酒糟的游离酚和结合酚显著促进乙酸、丙酸和丁酸的产生(P<0.05),尤其在模拟发酵24 h时,清香型白酒糟的游离酚中丁酸含量[(0.38±0.10) mmol/L]是空白组[(0.99±0.05) mmol/L]的2.65倍。模拟发酵48 h时,酱香型白酒糟的游离酚中乙酸含量[(260.82±2.88) mmol/L]是空白组[(501.13±36.16) mmol/L]的1.92倍;清香型白酒糟的游离酚中丙酸含量[(0.57±0.07) mmol/L]是空白组[(1.18±0.27) mmol/L]的2.09倍(电子增强出版附图5)。相似的研究表明,蓝莓果渣多酚提取物在体外模拟过程中可调节肠道微生物结构,促进乙酸、丙酸和丁酸含量增加[11, 13]。此外,在酱香型和清香型白酒糟的游离酚和结合酚中含有丰富的表儿茶素、原儿茶酸和阿魏酸(表1)。ZHOU等[12]研究表明主要短链脂肪酸(乙酸、丙酸和丁酸)与表儿茶素、原儿茶酸和阿魏酸呈显著正相关关系,暗示了上述多酚化合物在促进短链脂肪酸产生中有重要作用。
此外,短链脂肪酸的产生与肠道微生物的组成和丰度密切相关。例如,Lactobacillus、Bifidobacterium、Ruminococcus、Prevotella、Bacteroides、Clostridium及Streptococcus可代谢产生乙酸[28];多酚化合物能促进Megasphaera和Faecalibacterium生长,而Megasphaera和Faecalibacterium能将结肠中可发酵的碳水化合物转换为丙酸[29]。相似的研究表明,蓝莓渣多酚可通过调节肠道菌群结构影响短链脂肪酸的分泌水平[13],表明酱香型和清香型白酒糟的游离酚和结合酚可能调节了肠道微生物,从而促进短链脂肪酸的增加。上述分析表明,酱香型和清香型白酒糟的游离酚和结合酚对短链脂肪酸具有积极的促进作用。
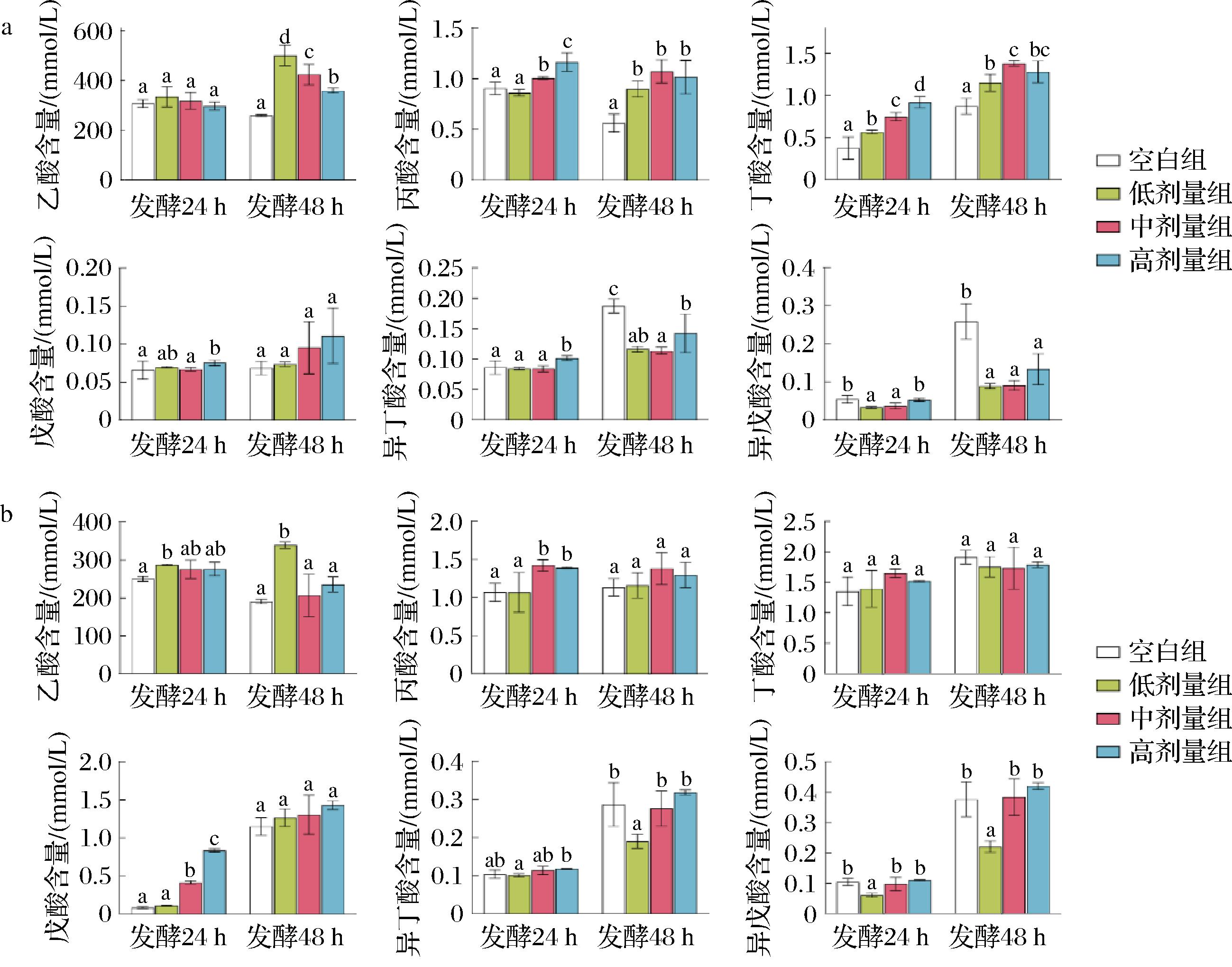

a-酱香型白酒糟游离酚;b-酱香型白酒糟结合酚;c-清香型白酒糟游离酚;d-清香型白酒糟结合酚
图3 酱香型和清香型白酒糟多酚对短链脂肪酸的影响
Fig.3 Effect of polyphenols from sauce-flavored and light-flavored Baijiu distiller’s grain on short-chain fatty acids
3 结论
酱香型白酒糟游离酚和结合酚的含量分别为5.67 mg/g和3.03 mg/g,清香型白酒糟游离酚和结合酚的含量分别为5.27 mg/g和1.87 mg/g。酱香型和清香型白酒糟的多酚化合物存在差异,杨梅素(377.72 μg/g)和阿魏酸(2 206.35 μg/g)分别是酱香型白酒糟的游离酚和结合酚中含量最高的多酚化合物,而清香型白酒糟的游离酚和结合酚中含量最高的多酚化合物分别为对香豆酸(2 331.17 μg/g)和原儿茶酸(552.18 μg/g)。酱香型白酒糟多酚具有更高的抗氧化活性,且DPPH自由基的清除能力与表儿茶素、丁香酸和紫杉叶素呈显著正相关,ABTS阳离子自由基的清除能力与原儿茶酸、表儿茶素、咖啡酸、丁香酸、紫杉叶素和杨梅素呈显著正相关,FRAP与原儿茶酸、表儿茶素、咖啡酸、丁香酸、紫杉叶素、杨梅素、槲皮素和橙皮素呈显著正相关。此外,酱香型和清香型白酒糟多酚还促进了短链脂肪酸的产生,在模拟发酵24 h时,清香型白酒糟的游离酚和酱香型白酒糟的结合酚分别使丁酸和戊酸的浓度提高了2.65倍和10.22倍,而在模拟发酵48 h时,酱香型白酒糟和清香型白酒糟的游离酚分别使乙酸和丙酸的浓度提高了1.92倍和2.09倍。该研究表明酱香型白酒糟和清香型白酒糟中含有丰富的多酚化合物,且具有良好的活性功能,可为高值化利用白酒糟提供有利的科学依据。
[1] 时伟, 郑红梅, 何珺珺, 等.白酒糟中功能因子及其提取技术的研究进展[J].中国酿造, 2020, 39(7):1-6. SHI W, ZHENG H M, HE J J, et al.Advances in functional factors in Baijiu distiller’s grain and its extraction techniques[J].China Brewing, 2020, 39(7):1-6.
[2] LIU Y Z, LIU S P, HUANG C H, et al.Chinese Baijiu distiller’s grains resourcing:Current progress and future prospects[J].Resources, Conservation and Recycling, 2022, 176:105900.
[3] GOWD V, KARIM N, SHISHIR M R I, et al.Dietary polyphenols to combat the metabolic diseases via altering gut microbiota[J].Trends in Food Science &Technology, 2019, 93:81-93.
[4] 曹新志, 游见明, 熊俐, 等.郎酒酒糟中总酚的提取与检测方法的优化[J].中国酿造, 2011, 30(7):137-140. CAO X Z, YOU J M, XIONG L, et al.Optimization of extraction and detection methods of total phenol from Langjiu Liquor vinasse[J].China Brewing, 2011, 30(7):137-140.
[5] 王兴东. 贵州茅台镇酒糟与酒曲化学成分及生物活性研究[D].贵阳:贵州大学, 2016. WANG X D.Study on chemical constituents and biological activities of distiller’s grains and distiller’s yeast in Maotai Town, Guizhou Province[D].Guiyang:Guizhou University, 2016.
[6] WANG X, WANG S S, HUANG S S, et al.Purification of polyphenols from distiller’s grains by macroporous resin and analysis of the polyphenolic components[J].Molecules, 2019, 24(7):1284.
[7] 谢星, 王乐怀, 林文静, 等.响应面优化提取海蒿子多酚及其抗氧化和抗糖尿病活性分析[J/OL].食品与发酵工业, 2023. https://doi.org/10.13995/j.cnki.11-1802/ts.034740. XIE X, WANG L H, LIN W J, et al.Optimization of extraction of phenolics from sargassum pallidum by response surface methodology and its antioxidant and antidiabetic activities[J/OL].Food and Fermentation Industries, 2023. https://doi.org/10.13995/j.cnki.11-1802/ts.034740.
[8] 焦阳. 基于UPLC-QQQ-MS/MS和循环伏安法的猕猴桃疏果多酚鉴定及功能特性研究[D].杨凌:西北农林科技大学, 2019. JIAO Y.UPLC-QQQ-MS/MS and cyclic voltammetry based phenolic identification in thinned young kiwifruit and its functional characteristic study[D].Yangling:Northwest A &F University, 2019.
[9] 蒋雨心, 范方宇, 杨晓玲, 等.葡萄籽提取物/茶多酚对海藻酸钠纳米复合膜性能的影响[J/OL].食品与发酵工业, 2024. https://doi.org/10.13995/j.cnki.11-1802/ts.036350. JIANG Y X, FAN F Y, YANG X L, et al.Effect of grape seed extract/tea polyphenols on performance of sodium alginate nanocomposite films[J/OL].Food and Fermentation Industries, 2024. https://doi.org/10.13995/j.cnki.11-1802/ts.036350. [10] 冯晓文, 赵晓涵, 潘骁琦, 等.体外模拟消化对海洋鱼骨胶原低聚肽结构和抗氧化活性的影响[J].食品与发酵工业, 2022, 48(5):173-179. FENG X W, ZHAO X H, PAN X Q, et al.The effect of simulated digestion in vitro on structure and antioxidant activity of marine fish bone collagen oligopeptides[J].Food and Fermentation Industries, 2022, 48(5):173-179.
[11] CHENG Y, WU T, CHU X Q, et al.Fermented blueberry pomace with antioxidant properties improves fecal microbiota community structure and short chain fatty acids production in an in vitro mode[J].LWT, 2020, 125:109260.
[12] ZHOU D, ZHONG J, HUANG Y G, et al.Effect of free and bound polyphenols from Rosa roxburghii Tratt distiller’s grains on moderating fecal microbiota[J].Food Chemistry:X, 2023, 19:100747.
[13] TANG S X, CHENG Y X, WU T, et al.Effect of Lactobacillus plantarum-fermented mulberry pomace on antioxidant properties and fecal microbial community[J].LWT, 2021, 147:111651.
[14] OKARTER N, LIU R H.Health benefits of whole grain phytochemicals[J].Critical Reviews in Food Science and Nutrition, 2010, 50(3):193-208.
[15] SUN Y, LU J F, LI J Q, et al.Optimization of ultrasonic-assisted extraction of polyphenol from areca nut (Areca catechu L.) seeds using response surface methodology and its effects on osteogenic activity[J].Ultrasonics Sonochemistry, 2023, 98:106511.
[16] HUANG W J, TIAN F L, WANG H, et al.Comparative assessment of extraction, composition, and in vitro antioxidative properties of wheat bran polyphenols[J].LWT, 2023, 180:114706.
[17] IZADIFAR Z.Ultrasound pretreatment of wheat dried distiller’s grain (DDG) for extraction of phenolic compounds[J].Ultrasonics Sonochemistry, 2013, 20(6):1359-1369.
[18] 卫子颜, 谢勇, 王朦朦, 等.超微粉碎对米糠多酚的组成及抗氧化活性的影响[J].食品与发酵工业, 2022,48(14):138-144. WEI Z Y, XIE Y, WANG M M, et al.Effect of ultrafine grinding on the composition and antioxidant activity of phenolic compounds in rice bran[J].Food and Fermentation Industries, 2022, 48(14):138-144.
[19] SIBHATU H K, JABASINGH S A, YIMAM A, et al.Ferulic acid production from brewery spent grains, an agro-industrial waste[J].LWT, 2021, 135:110009.
[20] 王鑫, 刘微微, 曹学丽.酶法提取白酒糟中酚酸物质工艺[J].食品科学, 2011, 32(24):114-119. WANG X, LIU W W, CAO X L.Enzymatic extraction of phenolic components from distiller’s grains[J].Food Science, 2011, 32(24):114-119.
[21] 毕静, 冯悦, 王静, 等.固态发酵对白酒糟总酚含量及抗氧化活性的影响[J].广东化工, 2022, 49(23):102-105. BI J, FENG Y, WANG J, et al.Effects of solid-state fermentation on total phenol content and antioxidant activity of white distiller’s grains[J].Guangdong Chemical Industry, 2022, 49(23):102-105.
[22] XIANG J L, APEA-BAH F B, NDOLO V U, et al.Profile of phenolic compounds and antioxidant activity of finger millet varieties[J].Food Chemistry, 2019, 275:361-368.
[23] QU Z H, LIU A L, LI P H, et al.Advances in physiological functions and mechanisms of (-)-epicatechin[J].Critical Reviews in Food Science and Nutrition, 2021, 61(2):211-233.
[24] SONG X, TAN L, WANG M, et al.Myricetin:A review of the most recent research[J].Biomedicine &Pharmacotherapy, 2021, 134:111017.
[25] DINI I, GRUMETTO L.Recent advances in natural polyphenol research[J].Molecules, 2022, 27(24):8777.
[26] DANIEL O O, ADEOYE A O, OJOWU J, et al.Inhibition of liver mitochondrial membrane permeability transition pore opening by quercetin and vitamin E in streptozotocin-induced diabetic rats[J].Biochemical and Biophysical Research Communications, 2018, 504(2):460-469.
[27] 马健, 徐成成, 任小盈, 等.信阳红红茶的酚类成分及抗氧化能力分析[J].食品研究与开发, 2022, 43(14):88-96. MA J, XU C C, REN X Y, et al.Analysis of phenols and antioxidant capacity of Xinyanghong black tea[J].Food Research and Development, 2022, 43(14):88-96.
[28] REY F E, FAITH J J, BAIN J, et al.Dissecting the in vivo metabolic potential of two human gut acetogens[J].The Journal of Biological Chemistry, 2010, 285(29):22082-22090.
[29] YU M, LI Z M, CHEN W D, et al.Microbiome-metabolomics analysis investigating the impacts of dietary starch types on the composition and metabolism of colonic microbiota in finishing pigs[J].Frontiers in Microbiology, 2019, 10:1143.