燃料乙醇是一种清洁能源,可以作为化石燃料的替代品,进而降低人们对化石能源的依赖。随着国内石油需求的增加,以燃料乙醇等替代能源为代表的能源供应多元化战略已成为中国能源政策的一个方向[1]。我国生物质燃料乙醇主要以玉米、陈化粮和木薯等作为生产原料,以木薯为原料发酵法生产燃料乙醇时,每生产1 t乙醇就会产生8~12 t的废水,传统的处理方法将蒸馏废液经固液分离、厌氧消化后仍难以达到排放标准,目前企业多采用序批式活性污泥法(sequencing batch reactor activated sludge process, SBR)进一步处理废水,使SBR出水的水质达标后排入污水管网。如何实现废水综合利用是燃料乙醇产业面临的突出问题,而开发燃料乙醇废水资源化回用技术,实现废水零排放,不仅能消除废水的污染问题,还可以降低生产成本[2-3]。对此,研究者们开展了大量工作,ZHANG等[4]利用两级厌氧处理木薯乙醇生产废水,使废水可全部回用到乙醇发酵并在13次回收中稳定运行;YANG等[5]采用离子交换树脂处理经厌氧-好氧消化后的乙醇废水,开发了乙醇废水的新型全回收工艺。但迄今为止,关于SBR出水再利用的研究成果很少。为了实现SBR出水的资源化回用,助力乙醇行业的可持续发展,有必要探索SBR出水经济高效的资源化回用方法。
O3是一种强氧化剂且制备成本低廉,可以高效氧化降解污水中的各种有害组分[6-7]。由于O3自身稳定性差容易自行分解[8],因此在使用O3处理污水时不会产生残留问题,被视为一种高性价比的水处理手段。本文采用O3氧化的方式处理SBR出水,并开展乙醇发酵试验,以期为SBR出水资源化回用于乙醇发酵、实现燃料乙醇清洁生产探索一种新的途径。
1 材料与方法
1.1 实验材料
1.1.1 菌种
市售安琪耐高温活性酿酒酵母。
1.1.2 SBR出水
由太仓新太酒精有限公司提供。
1.1.3 培养基
种子培养基(g/L):葡萄糖20,酵母膏8.5,NH4Cl 1.3,MgSO4·7H2O 0.1,CaCl2 0.06。葡萄糖发酵培养基(g/L):葡萄糖150,蛋白胨5,酵母膏5,尿素0.5,KH2PO4 1.5,MgSO4·7H2O 0.65。
1.1.4 仪器与设备
BF-CS-310臭氧发生器,广州百丰环保科技有限公司;SBA-40D生物传感器,山东省科学院生物研究所;ICAP TQ电感耦合等离子体质谱仪,赛默飞世尔科技公司。
1.2 实验方法
1.2.1 SBR出水的O3氧化处理
取250 mL SBR出水于锥形瓶中,以10 g/h通入O3,反应温度为25 ℃,原始pH。
1.2.2 种子培养
将生长状况良好的斜面酵母转接至含有200 mL种子培养基的培养瓶中,30 ℃、200 r/min培养24 h。
1.2.3 乙醇发酵
将体积分数为10%的酵母种子液接种到装有葡萄糖发酵培养基的250 mL三角瓶中,发酵栓封口,并在发酵栓中加入4%(体积分数)的稀H2SO4,放入恒温培养箱,30 ℃培养48 h。
1.2.4 酿酒酵母细胞形态观察
将体积分数为10%的酵母种子液接种到含有100 mg/L NO2-(NaNO2)的葡萄糖发酵培养基中,培养24 h后离心收集细胞,预处理方法参照文献[9],扫描电子显微镜观察酵母细胞形态。
1.3 分析方法
1.3.1 乙醇含量测定
采用蒸酒法[10]测定乙醇含量。
1.3.2 残葡萄糖测定
将发酵液离心后取上清液,使用去离子水稀释100倍,SBA生物传感器测定葡萄糖含量。
1.3.3 酵母的计数与死亡率测定
美兰染色后采用血球计数法测定酵母数与死亡率[11]。
1.3.4 无机离子测定
采用电感耦合等离子体质谱仪测定。
1.3.5 转录组数据测序
将体积分数为10%的酵母种子液接种到含有100 mg/L NO2-(NaNO2)的葡萄糖发酵培养基中,培养24 h后,离心收集酵母细胞(6 000 r/min,4 ℃,5 min),弃上清液后用预冷的PBS缓冲液洗涤菌体沉淀2次,于-80 ℃冰箱储存。转录组学检测与分析由武汉华大基因科技股份有限公司完成。
2 结果与分析
2.1 SBR出水直接回用对乙醇发酵的影响
分别以自来水和SBR出水作为拌料水进行乙醇发酵,以自来水为对照组,发酵时间为48 h。每8 h取样测定乙醇产量、残糖与酵母细胞数,评估不同发酵系统的差异。如表1所示,在整个发酵周期中,以SBR出水作为拌料水进行乙醇发酵时,发酵液中乙醇浓度明显低于对照组,且在16~32 h时差异最明显。通过对酵母数的统计发现,SBR出水会导致发酵24 h的酵母细胞数减少46.2%。而通过对残糖含量的分析发现,发酵24 h时残糖的质量浓度比对照组高52.7%,乙醇产量相比对照组减少了54.8%。表明SBR出水直接回用会降低酵母活力并阻碍生长,抑制乙醇发酵。
表1 SBR出水直接回用对乙醇发酵的影响
Table 1 Effect of direct reuse of SBR effluent on ethanol fermentation
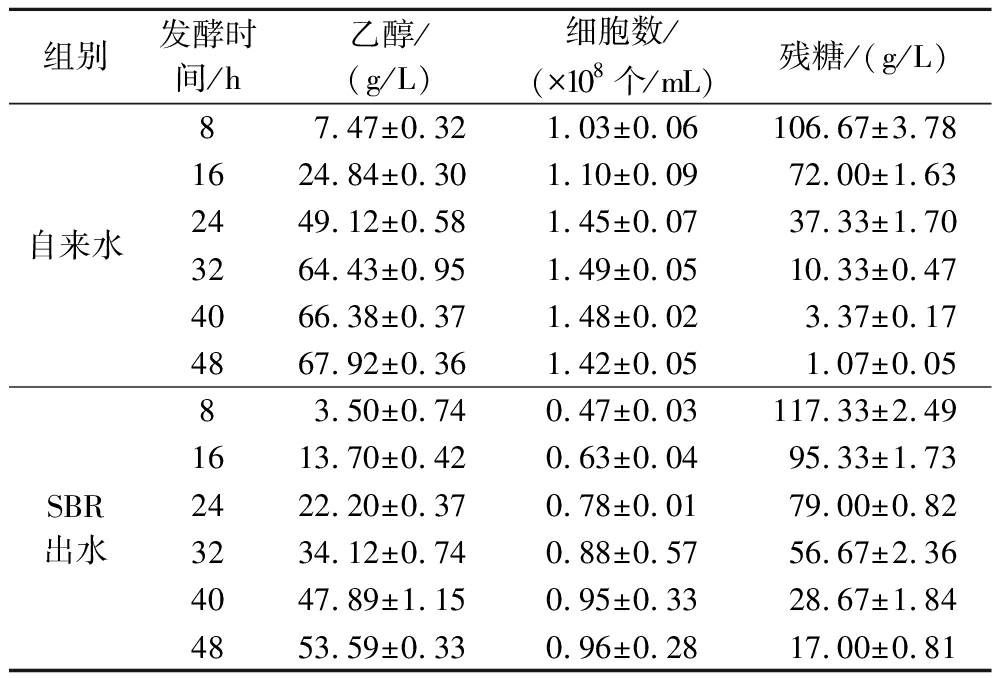
组别发酵时间/h乙醇/(g/L)细胞数/(×108个/mL)残糖/(g/L)自来水87.47±0.321.03±0.06106.67±3.781624.84±0.301.10±0.0972.00±1.632449.12±0.581.45±0.0737.33±1.703264.43±0.951.49±0.0510.33±0.474066.38±0.371.48±0.023.37±0.174867.92±0.361.42±0.051.07±0.05SBR出水83.50±0.740.47±0.03117.33±2.491613.70±0.420.63±0.0495.33±1.732422.20±0.370.78±0.0179.00±0.823234.12±0.740.88±0.5756.67±2.364047.89±1.150.95±0.3328.67±1.844853.59±0.330.96±0.2817.00±0.81
2.2 SBR出水O3氧化后回用对乙醇发酵的影响
将O3氧化不同时间(5、10、15、20 min)的SBR出水回用于乙醇发酵,探究O3氧化是否可以解除SBR出水的抑制性。发酵系统的失重源自乙醇发酵途径CO2的散失,单位时间内发酵系统的失重可以反映酵母的发酵速率[2]。如图1所示,随着O3氧化时间的增加,SBR出水的毒性不断减弱,氧化20 min时,SBR出水回用乙醇发酵,其发酵速率与乙醇产量和对照组无明显差异,说明O3氧化可在短时间内去除其发酵毒性,实现SBR出水的全回用。
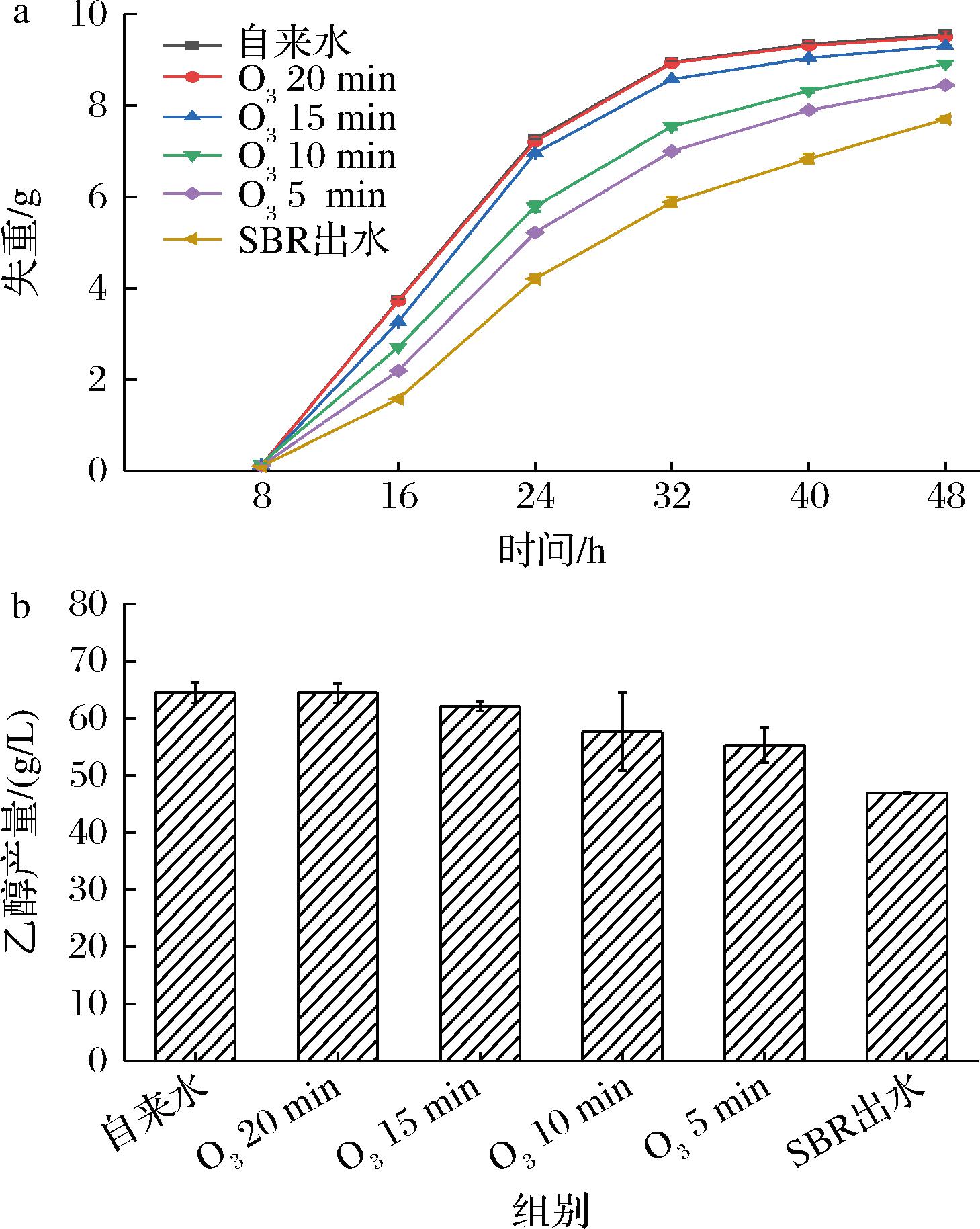
a-失重;b-乙醇产量
图1 SBR出水氧化不同时间后回用对乙醇发酵的影响
Fig.1 Effect of reuse of SBR effluent treated by oxidation for different time on ethanol fermentation
2.3 SBR出水中抑制组分探究
SBR出水进行水质分析结果如表2所示,SBR出水呈碱性,水中化学需氧量(chemical oxygen demand, COD)值仅为794.8 mg/L、电导率达到6.36 ms/cm,表明水中有机物浓度较低,但含有浓度较高的无机组分。
表2 SBR出水的水质分析
Table 2 Water quality analysis of SBR effluent

浊度/NTUpH值电导率/(ms/cm)氨氮/(mg/L)COD/(mg/L)SBR出水33.24±0.218.30±0.056.36±0.01 37.55±0.24794.80±5.29
对O3氧化20 min后SBR出水中的无机离子进行测定,结果如表3所示,O3氧化后SBR出水中大部分无机离子变化不显著,只有NO3-浓度显著升高,而NO2-在短时间内被去除,表明水溶液中NO2-被O3高效地氧化为NO3-,这一实验现象和NAUMOV等[12]的研究结论基本一致。为检验NO2-与NO3-对乙醇发酵的影响,根据SBR出水中NO2-、NO3-的浓度,在去离子水中分别进行外源添加并开展乙醇发酵实验。结果如图2所示,NO3-在检测质量浓度(54.13 mg/L)下对乙醇发酵无显著影响,即使NO3-质量浓度达到300 mg/L时仍未对发酵产生抑制作用,表明NO3-不是SBR出水中的乙醇发酵抑制物。但在检测质量浓度(104.83 mg/L)下的NO2-使发酵速率显著降低,乙醇产量也相应受到抑制,发酵48 h的乙醇产量降低了23%。上述实验结果表明,NO2-是SBR出水中抑制乙醇发酵的主要物质。
表3 O3氧化前后SBR出水中无机离子
Table 3 Inorganic ions concentrations in SBR effluent before and after ozone oxidation
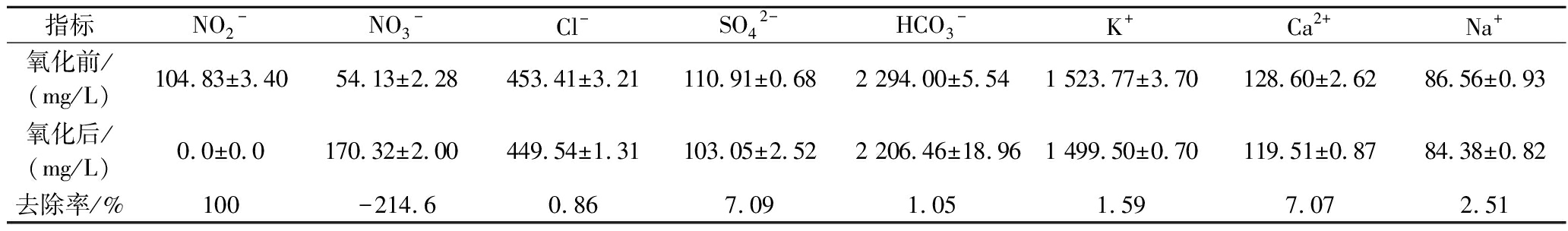
指标NO2-NO3-Cl-SO42-HCO3-K+Ca2+Na+氧化前/(mg/L)104.83±3.4054.13±2.28453.41±3.21110.91±0.682 294.00±5.541 523.77±3.70128.60±2.6286.56±0.93氧化后/(mg/L)0.0±0.0170.32±2.00449.54±1.31103.05±2.522 206.46±18.961 499.50±0.70119.51±0.8784.38±0.82去除率/%100-214.60.867.091.051.597.072.51
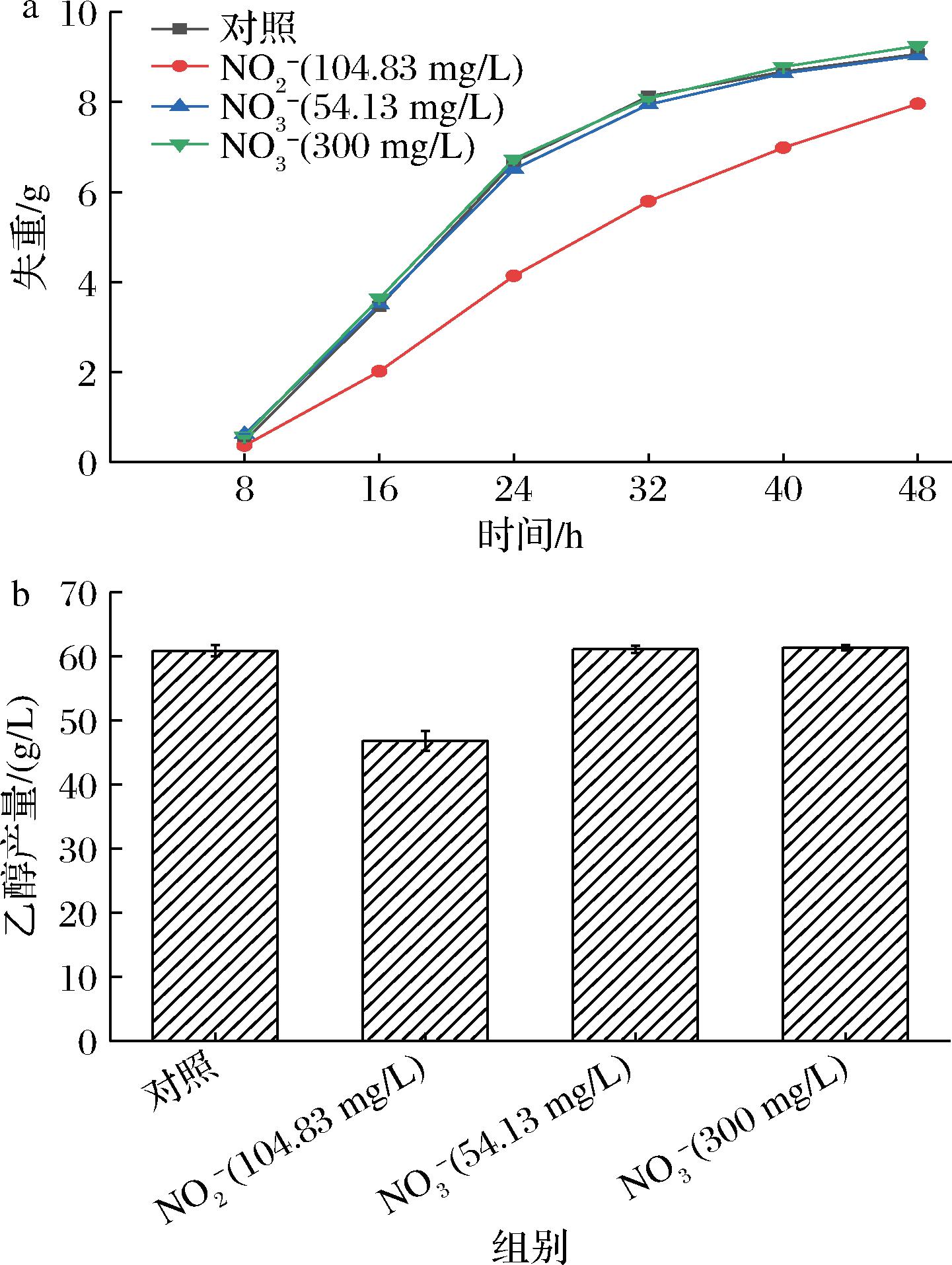
a-失重;b-乙醇产量
图2 NO2-离子与NO3-离子对酿酒酵母乙醇发酵的影响
Fig.2 Effects of NO2- and NO3- on ethanol fermentation by Saccharomyces cerevisiae
SBR通过在反应器中曝气、沉降、排放等阶段进行周期性的操作,使有机物在反应器内获得充分的生物降解,能够有效去除废水中的COD、生化需氧量(biochemical oxygen demand, BOD),达到水质处理的目的[13]。其中,硝化和反硝化是SBR中最重要的过程之一,受环境变量调控。在有氧环境下,氨氧化菌和亚硝酸盐氧化菌可将污水中的氨氮转化为亚硝酸盐氮和硝酸盐氮,而在无氧或缺氧条件下,反硝化细菌则将亚硝酸盐氮和硝酸盐氮还原为氮氧化物或N2。但在实际应用中,受废水进水量与水质的影响,系统水力负荷会改变硝化与反硝化之间菌群的平衡,在高pH、高水温、低溶解氧等条件下,使亚硝酸盐氧化菌受抑制,导致NO2-积累[14-15]。
2.4 NO2-抑制乙醇发酵机理的探究
2.4.1 NO2-对乙醇发酵的影响
为探究NO2-抑制乙醇发酵的机理,以去离子水为对照组,通过在发酵培养基中外源添加不同浓度的NO2-,测定24 h酵母细胞死亡率与细胞数,并在发酵48 h时测定乙醇产量与残糖含量。结果如图3所示,NO2-质量浓度为5 mg/L时便对乙醇发酵产生了抑制作用,使发酵24 h时的酵母数降低了31.6%,最终发酵乙醇产量降低了1.7%。随着NO2-浓度的升高,抑制作用显著增强,添加15、50、100、300 mg/L NO2-,分别使24 h的酵母数降低了39.2%、46.3%、53.1%与71.1%,最终乙醇产量分别降低了2.9%、11.8%、21.4%与64.8%,大量葡萄糖在发酵液中无法被利用。酵母死亡率也随NO2-浓度的增加而不断上升。添加100 mg/L NO2-,此时接近SBR出水中NO2-浓度,酵母死亡率达到17.2%,远高于对照组中3.5%。说明酵母细胞受到NO2-的胁迫无法正常生长繁殖,导致酵母数显著减少,死亡率上升,细胞活性被抑制,因此对葡萄糖利用率降低,酵母乙醇发酵受到抑制。
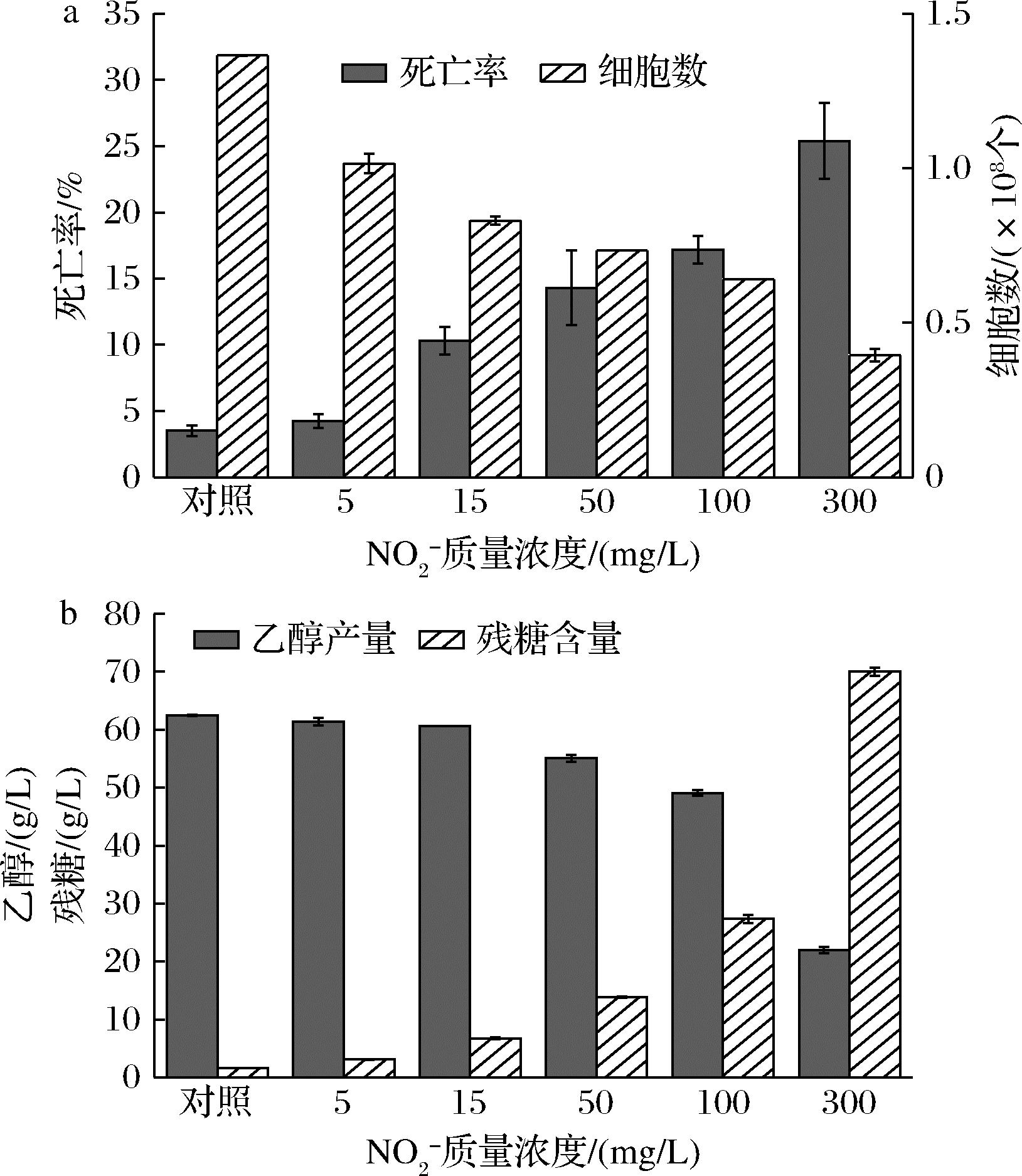
a-死亡率、细胞数;b-乙醇、残糖质量浓度
图3 NO2-对酿酒酵母乙醇发酵的影响
Fig.3 Effect of nitrite on ethanol fermentation by S. cerevisiae
2.4.2 NO2-对酵母细胞形态的影响
利用场发射扫描电子显微镜(field emission scanning electron microscopy, FESEM)观察自来水、SBR出水、O3氧化20 min后SBR出水与外源添加100 mg/L NO2-去离子水回用乙醇发酵时酵母的细胞形态。结果如图4所示,以自来水拌料进行乙醇发酵时酵母细胞表面光滑、平整、饱满(图4-a);SBR出水直接回用的酵母细胞出现些许空洞、胞间粘连、部分细胞内容物外泄的情况(图4-b),和NO2-质量浓度为100 mg/L时细胞形态相似(图4-d);SBR出水经过O3氧化20 min后回用的酵母细胞(图4-c)与自来水拌料酵母形态一致(图4-a)。上述实验结果表明NO2-能够改变酿酒酵母正常细胞形态,导致细胞死亡和发酵过程受阻,是SBR出水中的主要抑制物,而O3氧化的方法可去除NO2-,避免其对发酵的抑制毒性。

a-自来水;b-SBR出水;c-O3氧化20 min后SBR出水; d-100 mg/L NO2-去离子水
图4 不同处理组中酿酒酵母的FESEM图
Fig.4 FESEM photographs of S. cerevisiae in different groups
2.4.3 NO2-对酵母影响的转录组学研究
酵母细胞的生理代谢与其基因的转录密切相关。在NO2-胁迫下,酵母细胞生长环境发生了改变。利用转录组学分析了NO2-胁迫组与对照组的代谢差异,并筛选|log2FC|≥1且Q<0.05的基因作为差异表达基因(differentially expressed genes,DEGs)。结果显示共检测出了299个DEGs,包括251个上调DEGs和48个下调DEGs(图5)。
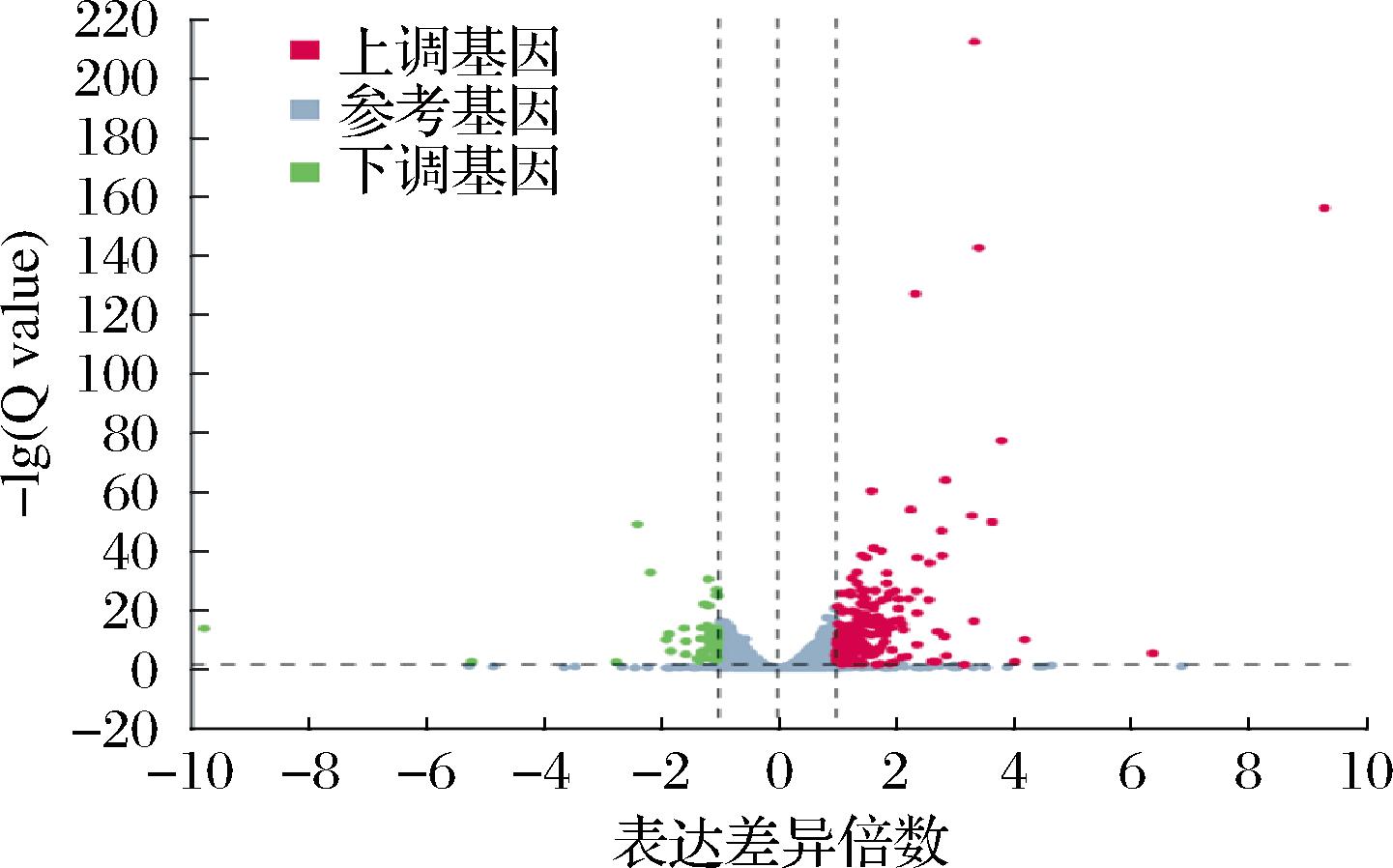
图5 DEGs火山图
Fig.5 DEGs volcano map
通过KEGG功能富集分析发现(图6),NO2-胁迫组上调的部分DEGs富集到了糖酵解途径。经过NO2-的诱导,催化丙酮酸降解为乙醛和CO2的PDC5(编码丙酮酸脱羧酶)上调3.65倍。研究表明,乙醛能够增加酵母对NO2-的相对抗性,这意味着PDC5表达量的提高将促使酵母产生更多的乙醛用以细胞的解毒[16-17]。TDH2基因编码甘油醛-3-磷酸脱氢酶,可以催化3-磷酸甘油醛转化为1,3-二磷酸甘油酸[18]。NO2-胁迫组中TDH2基因转录上调了2.06倍,这可能是由于NO2-使酿酒酵母中甘油醛-3-磷酸脱氢酶失活,抑制了糖酵解途径并导致了ATP耗竭[19],酿酒酵母通过上调TDH2的转录水平维持了细胞生命活动。
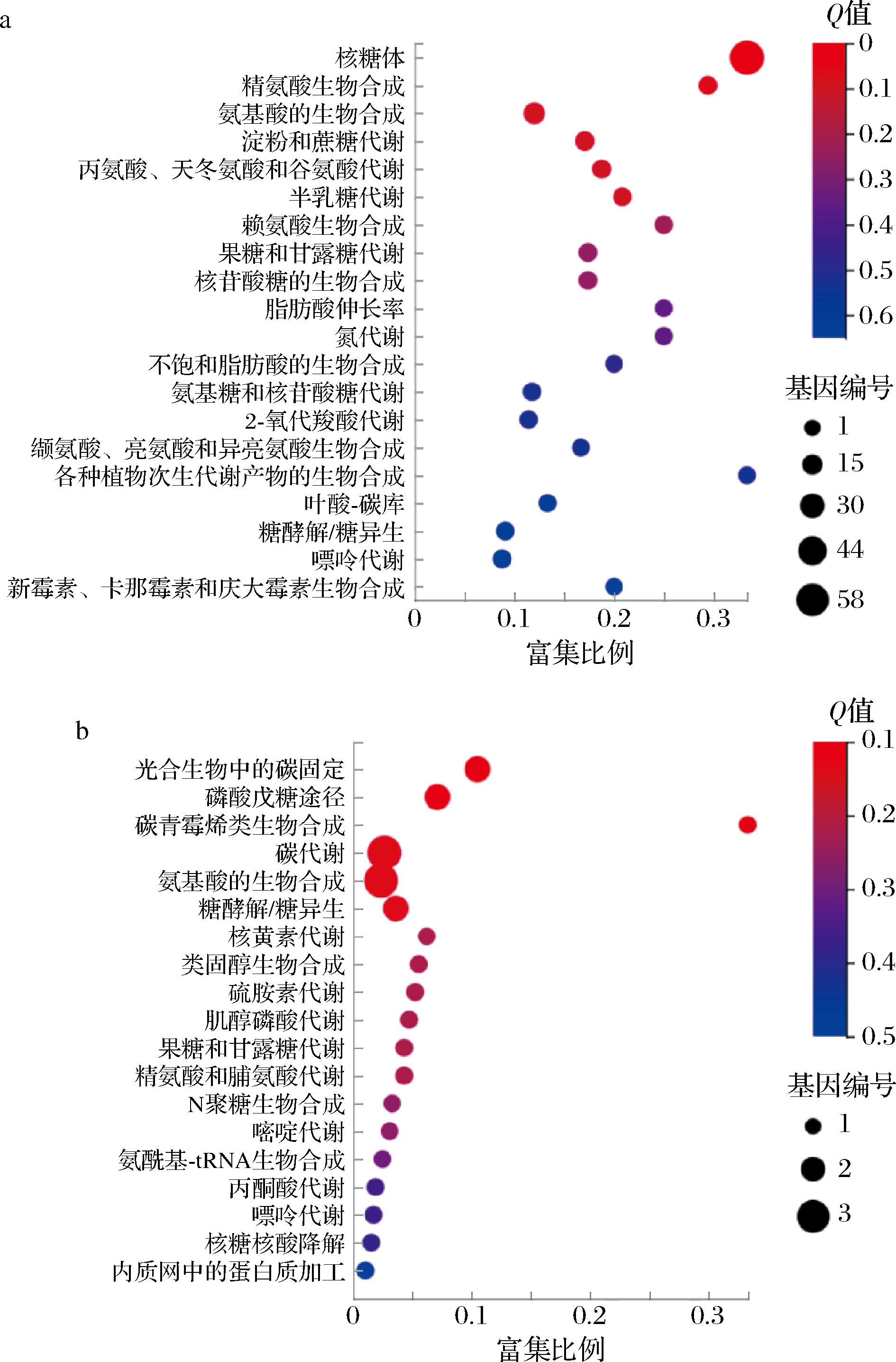
a-上调基因;b-下调基因
图6 DEGs KEGG富集分析
Fig.6 KEGG pathway analysis of DEGs
此外,发现磷酸戊糖途径(pentose phosphate pathway, PPP)中部分DEGs发生下调。PPP是糖代谢的重要途径,由TKL2编码的转酮酶可在PPP和糖酵解之间建立可逆联系,促进NADPH和5-磷酸核糖的合成用于细胞生长[20]。胁迫组TKL2的转录水平显著下调了1.37倍,意味着NO2-离子的添加可能造成PPP通量减小,5-磷酸核糖与辅因子NADPH的合成减弱,进而影响了细胞正常代谢。三羧酸循环(tricarboxylic acid cycle, TCA循环)是三大物质转化的枢纽,是生物体将糖类等物质氧化获得能量的最有效的途径[21-22]。其中,用于调节TCA循环速率的关键酶异柠檬酸脱氢酶基因(IDH2)与琥珀酸脱氢酶基因(SDH9)在胁迫组转录下调,这表明加入NO2-后,TCA循环的通量减小,进而影响了NADH与ATP的合成,抑制了酵母的生命活动。以上结果表明,NO2-胁迫下,酿酒酵母的磷酸戊糖途径与TCA循环途径受到了抑制,进而影响了菌体的生长和乙醇的发酵。
3 结论
本研究通过对SBR出水进行水质分析,结合外源添加实验,确定了NO2-是导致SBR出水无法回用的原因,并揭示了NO2-对酵母细胞的毒性机理,发现 NO2-会破坏正常的酵母细胞形态,使酵母的磷酸戊糖途径与TCA循环通量减小,从而阻碍细胞生长,抑制乙醇发酵。为实现SBR出水的资源化回用,本文采用O3氧化的方式处理SBR出水,O3在废水处理领域作为一种常见的处理手段,与离子交换、反渗透膜等废水处理工艺相比具有成本低廉且绿色无污染等优点,SBR出水中NO2-在氧化作用下被高效转化为NO3-,而NO3-在300 mg/L时仍不会对酵母产生影响,从而避免了对乙醇发酵的毒性,确定了O3氧化作为一种经济高效的处理手段可以将SBR出水回用到乙醇生产中,对未来真正实现燃料乙醇产业的无废清洁生产提供了理论基础与发展方向。
[1] 王同, 晁伟, 陈超超, 等.基于多种生产路线的燃料乙醇研究现状与展望[J].酿酒科技, 2022(12):97-102. WANG T, CHAO W, CHEN C C, et al.Research status and prospect of fuel ethanol based on multiple production routes[J].Liquor-Making Science &Technology, 2022(12):97-102.
[2] 盛玄玄. 燃料乙醇蒸发冷凝水资源化技术的研究[D].无锡:江南大学, 2021. SHENG X X.Study on resource utilization technology of fuel ethanol condensate[D].Wuxi:Jiangnan University, 2021.
[3] 盛玄玄, 张建华, 黄河, 等.蒸发冷凝水经臭氧处理后回用于乙醇发酵的可行性研究[J].食品与发酵工业, 2021, 47(24):132-136. SHENG X X, ZHANG J H, HUANG H, et al.Investigation on reutilization of condensate treated by O3 oxidation in ethanol fermentation[J].Food and Fermentation Industries, 2021, 47(24):132-136.
[4] ZHANG Q H, LU X, TANG L, et al.A novel full recycling process through two-stage anaerobic treatment of distillery wastewater for bioethanol production from cassava[J].Journal of Hazardous Materials, 2010, 179(1-3):635-641.
[5] YANG X C, WANG K, WANG H J, et al.Novel process combining anaerobic-aerobic digestion and ion exchange resin for full recycling of cassava stillage in ethanol fermentation[J].Waste Management, 2017, 62:241-246.
[6] 牟洁. 臭氧氧化技术在水处理中的应用研究[J].环境与发展, 2018, 30(1):81-82. MOU J.Application of ozone oxidation technology in water treatment[J].Environment and Development, 2018, 30(1):81-82.
[7] SINGH S, SETH R, TABE S, et al.Oxidation of emerging contaminants during pilot-scale ozonation of secondary treated municipal effluent[J].Ozone:Science &Engineering, 2015, 37(4):323-329.
[8] WERT E C, ROSARIO-ORTIZ F L, DRURY D D, et al.Formation of oxidation byproducts from ozonation of wastewater[J].Water Research, 2007, 41(7):1481-1490.
[9] 赵雪梅, 伍时华, 龙秀锋, 等.丁香醛对酿酒酵母乙醇发酵过程和理化特性的影响[J].食品与发酵工业, 2022, 48(16):188-195. ZHAO X M, WU S H, LONG X F, et al.Effects of syringaldehyde on ethanol fermentation and physicochemical properties of Saccharomyces cerevisiae[J].Food and Fermentation Industries, 2022, 48(16):188-195. [10] 王玉炯, 苏建宇, 贾士儒.发酵工程研究进展[M].银川:宁夏人民出版社, 2007. WANG Y J, SU J Y, JIA S R.Research Progress in Fermentation Engineering[M].Yinchuan:Ningxia People’s Publishing House, 2007.
[11] 穆英健, 侯红霞, 聂斌.酵母死亡率检测方法的差异性分析[J].中外酒业·啤酒科技, 2019(21):13-18. MU Y J, HOU H X, NIE B.Difference analysis of detection methods of yeast mortality[J].Global Alcinfo, 2019(21):13-18.
[12] NAUMOV S, MARK G, JAROCKI A, et al.The reactions of nitrite ion with ozone in aqueous solution-new experimental data and quantum-chemical considerations[J].Ozone:Science &Engineering, 2010, 32(6):430-434.
[13] DONOSO-BRAVO A, ROSENKRANZ F, VALDIVIA V, et al.Anaerobic sequencing batch reactor as an alternative for the biological treatment of wine distillery effluents[J].Water Science and Technology, 2009, 60(5):1155-1160.
[14] LANGONE M, YAN J A, HAAIJER S C M, et al.Coexistence of nitrifying, anammox and denitrifying bacteria in a sequencing batch reactor[J].Frontiers in Microbiology, 2014, 5:28.
[15] WANG J Y, ZHANG C S, RONG H W.Analysis and succession of nitrifying bacteria community structure in sequencing biofilm batch reactor[J].Applied Microbiology and Biotechnology, 2014, 98(10):4581-4587.
[16] SCHMITT H D, CIRIACY M, ZIMMERMANN F K.The synthesis of yeast pyruvate decarboxylase is regulated by large variations in the messenger RNA level[J].Molecular and General Genetics MGG, 1983, 192(1-2):247-252.
[17] STOPPANI A O M.Pyruvate metabolism in Saccharomyces cerevisiae[J].Nature, 1951, 167(4251):653-654.
[18] HINZE H, HOLZER H.Effect of sulfite or nitrite on the ATP content and the carbohydrate metabolism in yeast[J].Zeitschrift Für Lebensmittel-Untersuchung Und Forschung, 1985, 181(2):87-91.
[19] MAIER K, HINZE H, LEUSCHEL L.Mechanism of sulfite action on the energy metabolism of Saccharomyces cerevisiae[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1986, 848(1):120-130.
[20] SCHAAFF-GERSTENSCHL GER I, MANNHAUPT G, VETTER I, et al.TKL2, a second transketolase gene of Saccharomyces cerevisiae[J].European Journal of Biochemistry, 1993, 217(1):487-492.
GER I, MANNHAUPT G, VETTER I, et al.TKL2, a second transketolase gene of Saccharomyces cerevisiae[J].European Journal of Biochemistry, 1993, 217(1):487-492.
[21] FERNIE A R, CARRARI F, SWEETLOVE L J.Respiratory metabolism:Glycolysis, the TCA cycle and mitochondrial electron transport[J].Current Opinion in Plant Biology, 2004, 7(3):254-261.
[22] AKRAM M.Citric acid cycle and role of its intermediates in metabolism[J].Cell Biochemistry and Biophysics, 2014, 68(3):475-478.