5-羟甲基糠醛(5-hydroxymethylfurfural,HMF)是一种常见的食品内源性有害物。在食品中,HMF的形成途径主要有2种。第一种是通过焦糖化反应形成[1],如蔗糖热分解形成葡萄糖和呋喃果糖阳离子,后者在高温下快速形成HMF[2];葡萄糖热分解形成3-脱氧奥苏糖(3-deoxyglucosone,3-DG),3-DG再脱水环化形成HMF;果糖热分解既能形成呋喃果糖阳离子,也能形成3-DG,进一步形成HMF[3]。第二种是美拉德反应途径形成,即还原糖和氨基酸形成不稳定的席夫碱,通过1,2-烯醇化和脱水转化为3-DG,继而形成HMF[4]。HMF的形成受pH值、食品成分、温度、加工或储存时间和水分活度等因素的影响[5]。
尽管低浓度的HMF具有体外抗氧化性、抗过敏、抗炎等作用[4],但是高浓度的HMF对眼睛、皮肤和上呼吸道黏膜等具有刺激作用,会对胃上皮细胞造成损伤[6]。长期摄入HMF还会提高小鼠肝细胞腺瘤的发病率[7],引起肾脏毒性、肾小管上皮细胞变性[8]等危害。近期研究发现,HMF在体内可通过磺基转移酶代谢为5-亚磺酰甲基糠醛(5-sulfoxymethyfurfural,SMF),SMF是一种已知的诱变剂和致癌物[9],能够与DNA形成加合物,造成DNA损伤[10]。而且由于肾脏的再吸收,SMF不能通过尿液正常排出体外,会在血液中不断积累,与细胞中的蛋白质和DNA反应[11]。
HMF在食品中的含量较高,平均膳食暴露水平达到6 000 μg/d,超过联合食品添加剂专家委员会(Joint FAO/WHO Expert Committee on Food Additives,JECFA)规定的每日允许摄入量(540 μg/d)10多倍[12]。其中,谷物食品、乳制品和咖啡等是人体摄入HMF的主要来源,在麦片和饼干中HMF含量分别为6.9~240.5 mg/kg[13]和1.65~82.78 mg/kg[14],乳制品中含量为37~891 mg/L[15],咖啡中的含量高达110~2 480 mg/kg[16]。HMF也存在于水果和蔬菜制品中,其在干制水果中含量为30~2 200 mg/kg[17],脱水蔬菜中含量为0.04~58.6 mg/kg[18]。在调味品中,HMF的含量也较高,其在中国传统发酵醋中的含量可达26.83~455.13 mg/L[19]。国际食品法典委员会规定蜂蜜中HMF的含量应当小于40 mg/kg(热带地区蜂蜜小于80 mg/kg),国际果汁生产者联合会则建议果汁中HMF的含量应在5~10 mg/L(浓缩果汁中限量为25 mg/L)[20]。鉴于此,采取一定措施降低食品中HMF含量,保障消费者饮食健康,已成为食品安全研究的趋势。
多酚化合物是一类广泛存在于植物中,具有抗氧化、抗炎、抗癌等多种生物活性[21]的次生代谢物。研究表明,多酚类化合物既能够有效消减丙酮醛、乙二醛和丙烯醛等羰基化合物[22-25],抑制晚期糖化终末产物(advanced glycation end products,AGEs)的形成[26],也能够减少HMF的含量[27-29]。如:表儿茶素[30-31]能够通过与HMF形成加合物的方式消减HMF;而表没食子儿茶素没食子酸酯[32]和槲皮素[33]则能够通过抑制3-DG的形成,从而降低HMF含量。目前相关的研究主要集中在儿茶素类物质,其余多酚类化合物对HMF的消减效果与机制尚未清楚。据此,本研究比较了10种多酚对HMF的消减效果,筛选出消减效果显著的根皮素(phloretin,Phl),探究根皮素在焦糖化反应体系中对HMF的影响,并将其应用于广式月饼中,研究根皮素对月饼中HMF含量、感官特性和色度的影响,并进一步采用HPLC-MS/MS技术,推测根皮素消减HMF的机理。本研究发现了根皮素对HMF具有消减作用,并推测其对HMF的消减机理,为根皮素控制食品中HMF含量提供理论研究依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
5-羟甲基糠醛(98%),北京百灵威科技有限公司;芹菜素(98%)、柚皮素(98%)、木犀草素(98%)、橙皮素(98%)、漆黄素(98%)、黄芩素(98%)、槲皮素(96%)、白藜芦醇(98%)、杨梅素(98%)、根皮素(98%),安耐吉试剂有限公司;NaH2PO4(99%)、Na2HPO4(99%)、果糖(99%)、葡萄糖(98%)、蔗糖(99%),天津市大茂化学试剂厂;3-脱氧奥苏糖(95%),加拿大TRC多伦多研究化学品公司;甲醇(色谱级),德国默克试剂有限公司;甲醇(分析级),广州光华科技股份有限公司;乙酸(色谱级),天津科密欧;邻苯二胺(99%),上海麦克林生化科技有限公司;根皮素(食品级,98%),广东金骏康生物技术有限公司;低筋小麦粉,益海嘉里金龙鱼粮油食品股份有限公司;花生油,山东鲁花集团有限公司;食用枧水、月饼糖浆,上海枫未实业有限公司;红豆沙馅料,广州酒家利口福;鸡蛋,当地超市。
1.1.2 仪器与设备
SHA-BA型水浴恒温振荡器,江苏省金坛市宏华仪器厂;ME-104/02型电子天平、FE28-CN型pH计,梅特勒-托利多公司;DF-101S型集热式恒温加热磁力搅拌器,上海力辰邦西仪器科技有限公司;LC-20AT高效液相色谱仪、LC-MS8045三重四极杆液相色谱-质谱联用仪[配有电喷雾离子源(electrospray ionization,ESI)],日本岛津仪器公司;XW-80A微型漩涡混合仪,上海沪西分析仪器厂有限公司;TS7010型分光色度仪,深圳市三恩时科技有限公司;电烤箱,广州汇利。
1.2 实验方法
1.2.1 不同多酚对HMF的消减效果
用100 mmol/L、pH 6.0磷酸盐缓冲液(phosphate buffered saline,PBS)配制1 mmol/L的HMF溶液,以甲醇分别配制40 mmol/L的芹菜素、柚皮素、木犀草素、橙皮素、漆黄素、黄芩素、槲皮素、白藜芦醇、杨梅素和根皮素溶液。分别取2 mL HMF溶液和0.5 mL多酚溶液混合在带盖钢管中,加入PBS至总体积为4 mL,HMF和多酚反应浓度为0.5 mmol/L和5 mmol/L,钢管置于180 ℃油浴锅中反应20 min。相同反应条件下,以不添加多酚的样品为对照组。反应结束后迅速取出钢管,冰水浴冷却至室温,将样品移取到10 mL容量瓶中,用甲醇定容,测定样品液中HMF的含量。每个样品平行3组。消减率按公式(1)计算:
消减率/%=[(对照组含量-实验组含量)/对照组含量]×100
(1)
1.2.2 根皮素浓度和反应时间对HMF消减效果的影响
取2 mL PBS(100 mmol/L、pH 6.0)配制的1 mmol/L 的HMF溶液和0.5 mL根皮素甲醇溶液(浓度分别为4、20、40、80 mmol/L)置于钢管中,加入PBS至总体积为4 mL,混合均匀,于180 ℃油浴锅中分别反应10、20、30 min。反应液中HMF反应浓度为0.5 mmol/L,根皮素浓度分别为0.5、2.5、5、10 mmol/L。以不添加根皮素的样品为对照组。反应结束后迅速取出钢管,冰水浴冷却至室温,将样品移取到10 mL容量瓶中,用甲醇定容,测定HMF的含量。每个样品平行3组。
1.2.3 根皮素对焦糖化反应体系中HMF和3-DG的消减效果
用PBS(100 mmol/L、pH 6.0)配制葡萄糖、果糖、蔗糖溶液(浓度分别为100、100、200 mmol/L),取4 mL糖溶液于钢管中,再加入0.011 2 g根皮素,混合均匀,使根皮素的反应浓度为10 mmol/L。在180 ℃油浴锅中分别反应10、20、30 min。以糖溶液单独加热为对照组。反应结束后迅速取出钢管,冰水浴冷却至室温,将样品移取到10 mL容量瓶中,用甲醇定容,测量HMF和3-DG含量。每个样品平行3组。
1.2.4 广式月饼样品制作
广式月饼的制作参考蔡卓[34]的方法。饼皮配方为51.0 g低筋小麦粉,13.0 g花生油,35.0 g转化糖浆,1.0 g枧水。饼皮中分别添加0.3%、0.6%、1.0%、2.0%和4.0%(质量分数)的根皮素,以不添加根皮素为对照组。先将转化糖浆、枧水和花生油搅拌均匀,加入过100目筛的低筋小麦粉和根皮素,和成面团,室温放置120 min。将面团分成每份20 g,均匀压平,包裹30 g红豆沙,搓圆封口,用模具按压成型放入烤盘,在月饼上方喷少许纯净水。烤箱在200 ℃(上下火相同)预热30 min,放入月饼烘烤5 min,取出在表面刷一层蛋黄水,再放入烤箱复烤15 min,取出,冷却后用包装盒密封,室温下保存。
1.2.5 饼皮中HMF和3-DG的提取
取室温保存3 d的月饼,将饼皮和馅料分离,参考OU等[26]的方法进行前处理。称取4.0 g粉碎的饼皮至50 mL离心管中,加入正己烷10 mL,涡旋10 min,10 000 r/min离心10 min,除去上清液;重复上述操作3次,将样品放置在通风橱中过夜,挥干剩余正己烷。脱脂后的样品加入5 mL 80%甲醇水,高速涡旋5 min,10 000 r/min离心10 min,取出上清液,重复提取3次,合并上清液,测量HMF和3-DG含量。每个样品平行3组。
1.2.6 月饼的感官评价
取回软后的月饼进行定量描述评价,评价小组由12名接受过训练的食品科学专业研究生组成(8名女性和4名男性,年龄22~26岁)。参照标准GB/T 19855—2015《月饼》中广式月饼的感官要求,分别以形态、色泽、气味、滋味和油润度为指标制订评分标准,如表1所示。
1.2.7 月饼色度的测定
取室温保存4 d的月饼样品,使用色度仪测定饼面、侧面、底面和生面团的L*、a*和b*值,使用前用标准黑板和标准白板校正,参照五点取样法每组样品测量5次,平行3组。
表1 月饼感官评分标准
Table 1 Sensory evaluation criteria of moon cake

评价项目描述分值权重/%形态外观饱满,表面微凸,轮廓分明,花纹清晰8~10外观较平整,侧面无收缩,轮廓分明,花纹清晰4~7外观不平整,饼身塌斜,无月饼轮廓,饼皮破裂1~315色泽色泽均匀,饼面棕黄或棕红,腰部乳黄或黄色,底部棕黄不焦8~10色泽较均匀,整体呈棕黄色4~7色泽不均匀,底部焦黑,饼面黄偏白,侧面偏白1~315气味气味浓郁,有明显的广式月饼风味,无异味8~10气味较浓郁,有广式月饼风味,无异味4~7无广式月饼风味,有异味1~330滋味具有广式月饼特有滋味,滋味香甜,口感细腻均一8~10具有广式月饼特有滋味,甜度中等,口感一般4~7无广式月饼特有滋味,滋味苦涩,口感粗糙不一1~330油润度饼皮油亮有光泽8~10饼皮较有油光4~7饼皮暗淡无油光1~310
1.2.8 检测方法
1.2.8.1 HMF的检测
参考QI等[30]的检测方法,稍作修改。取1 mL样品用0.22 μm有机系滤膜过滤,采用HPLC法测定HMF含量。检测条件:Welch Ultimate AQ-C18色谱柱(4.6 mm×250 mm,5 μm);进样体积10 μL;流动相体积分数0.1%乙酸水溶液(A相),甲醇(B相);洗脱程序:0~10 min:10%~70% B;10~13 min:70% B;13~20 min:70%~90% B;20~24 min:90% B;24~25 min:90%~10% B;25~37 min:10% B;流速0.5 mL/min;柱温40 ℃;检测波长284 nm。
1.2.8.2 HMF与根皮素加合物的检测
采用HPLC-MS/MS分析HMF与根皮素形成的加合物。HPLC的色谱条件同1.2.8.1节,质谱条件:电喷雾离子源(electrospray ionization,ESI),扫描范围m/z 50~1 050;离子源温度300 ℃,去溶剂化温度250 ℃,毛细管电压4 kV,扫描速率7 500 u/sec,碰撞能量15 V。
1.2.8.3 3-DG的检测
参考ZHANG等[35]的衍生方法,稍作修改。取1 mL样品与0.1 mL 1 mol/L邻苯二胺甲醇溶液混合,60 ℃水浴避光反应4 h。衍生后样品用0.22 μm有机系滤膜过滤,采用HPLC法测定3-DG的含量。检测条件:ZORBAX SB-Aq色谱柱(4.6 mm×250 mm,5 μm);进样体积10 μL;流动相体积分数0.1%乙酸水溶液(A相),甲醇(B相);洗脱程序:0~15 min:28%~43% B;15~30 min:43%~75% B;30~35 min:75% B;35~35.5 min:75%~28% B;35.5~40 min:28% B;流速:0.8 mL/min;柱温40 ℃;检测波长317 nm。
1.3 数据处理
实验数据采用Excel 2019软件处理,以平均值±标准差表示。使用SPSS 22软件对结果进行单因素方差分析,采用Duncan检验,显著性水平为P<0.05。使用OriginPro 2021软件绘图。
2 结果与分析
2.1 十种多酚在模拟条件下对HMF的消减效果
研究发现,多酚类化合物能够消除活泼羰基化合物[22-23],其中根皮素、杨梅素和白藜芦醇等具有高效的消减效果。本研究选取了10种常见多酚,包括黄酮、黄酮醇、二氢查尔酮等不同结构,探究不同多酚在模拟条件下对HMF的消减效果。结果如图1所示,根皮素对HMF消减效果最好,消减率为18.10%;其次为杨梅素(9.95%)和黄芩素(8.97%)。在已有的研究中,QI等[30]发现HMF与表儿茶素的比例从2∶0.86升高到2∶8.6时,180 ℃反应10 min后,HMF的残留率从60%降低到18%,其对HMF的消减率高于根皮素,但两者研究的反应体系(包括反应体积、反应pH和反应容器)不同,本研究是4 mL PBS溶液(pH 6.0)在带盖钢管中密封加热反应,而QI等[30]是0.25 mL溶液在敞口试管中加热反应。根皮素的高效消减率可能与其A环含有间苯三酚结构有关,有研究[22, 24]表明A环含有间苯三酚结构的多酚与丙烯醛、丙酮醛等羰基化合物的反应活性更高,其A环上的任何一个羟基被取代均会降低多酚消减羰基化合物的活性。ZHU等[25]研究同样表明,多酚的C环是开环结构,比闭环结构更活泼,在相同反应条件下,C环是闭环的橙皮素对丙烯醛的消减率为7%,而打开C环后,其对丙烯醛的消减率提升到99%。因此,可能是由于根皮素结构的反应活性更高,其更容易与HMF反应。
2.2 根皮素浓度和反应时间对HMF消减效果的影响
根皮素是存在于苹果、梨和草莓中的一种二氢查尔酮[36],对丙酮醛和乙二醛具有高效的消减能力[37],但其对HMF的消减效果尚未清楚。本论文探究根皮素浓度和反应时间对HMF消减效果的影响,结果如图2所示。0.5 mmol/L根皮素对HMF(0.5 mmol/L)消减效果不明显(HMF含量无显著变化),根皮素浓度从2.5 mmol/L增加到10 mmol/L,HMF消减效果显著提升,消减率从5.07%提升至39.73%(反应30 min时),增加了近7倍,可见根皮素对HMF的消减作用表现出浓度依赖。随着反应时间的延长,HMF的消减率也显著增加,根皮素浓度为10 mmol/L时,反应30 min的消减率较10 min(18.39%)增加了1倍多。表明根皮素对HMF的消减效果与反应时间成正比,这与表儿茶素对HMF的消减效果相类似[30]。
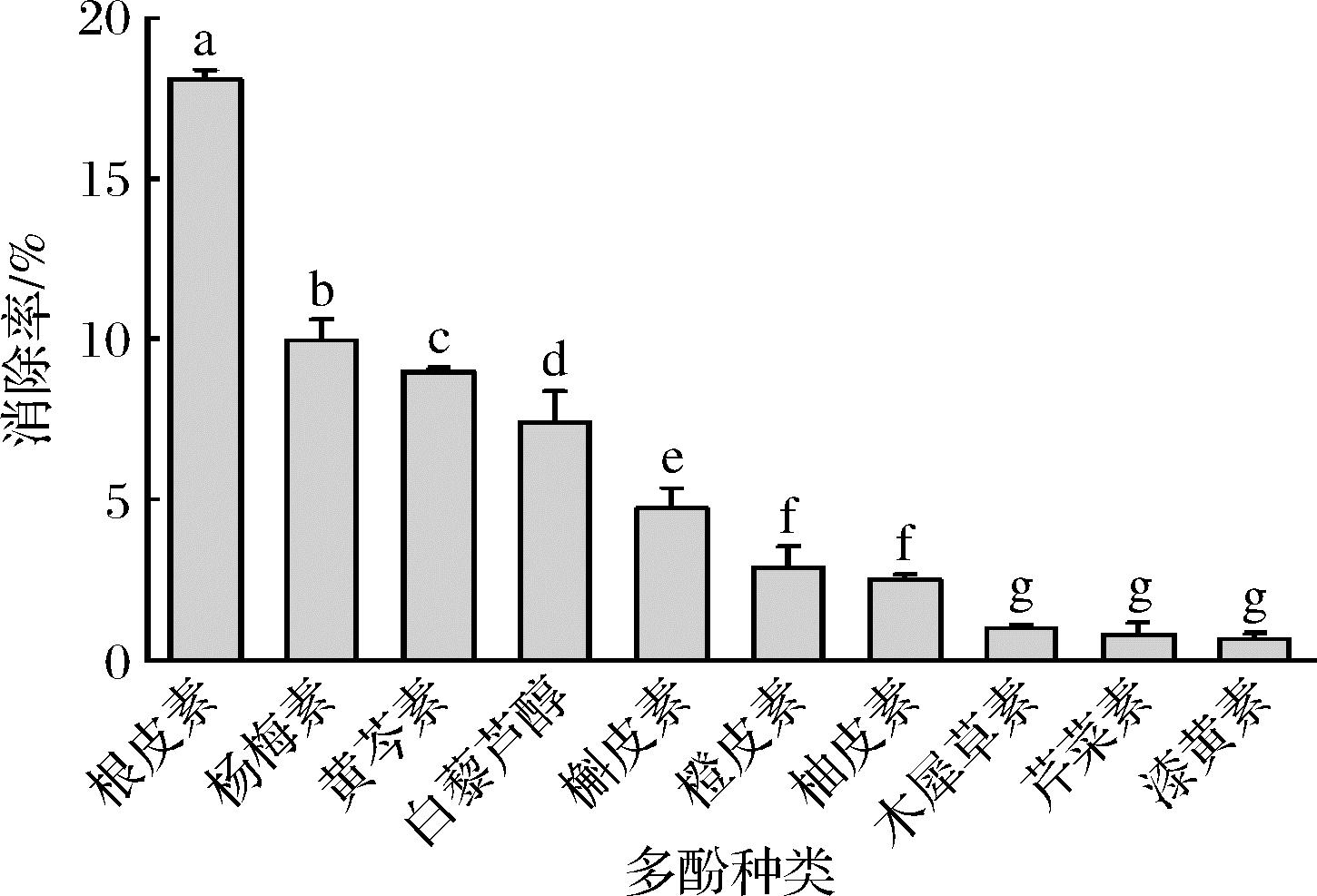
图1 十种多酚对HMF的消减效果
Fig.1 The mitigation effect of ten polyphenols on HMF 注:小写英文字母不同表示具有显著性差异(P<0.05)(下同)。
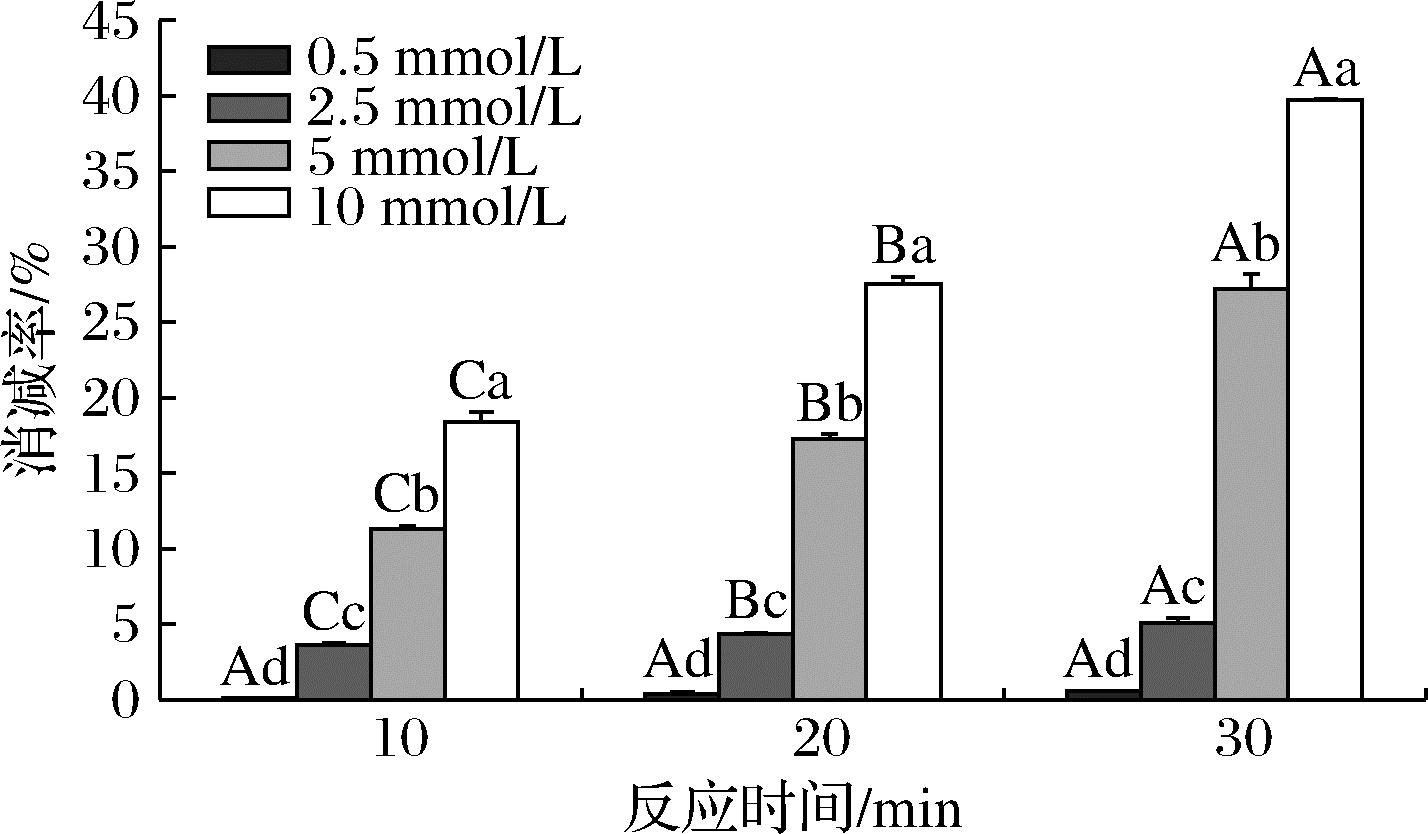
图2 不同浓度根皮素和反应时间对HMF的消减效果
Fig.2 The mitigation effect of different phloretin concentrations and reaction times on HMF elimination 注:大写英文字母不同表示不同反应时间具有显著性差异(P<0.05), 小写英文字母不同表示不同浓度具有显著性差异(P<0.05)。
2.3 根皮素对焦糖化反应体系中HMF和3-DG形成的影响
HMF能够通过美拉德反应和焦糖化反应形成,这两种途径都由糖(葡萄糖、果糖或蔗糖)作为前体[38]。因此,本研究选取上述3种糖为代表,进一步探究根皮素在焦糖化反应中对HMF形成过程的影响。
由表2可知,在3种糖反应中,根皮素的添加显著减少了HMF的含量,在反应10 min时消减率最高,葡萄糖和果糖体系中消减率分别为57.78%和47.51%。反应20 min和30 min后,消减率下降为38.78%和26.68%(以葡萄糖体系为例)。可能是反应10 min时,HMF生成量较低,相对来说根皮素过量存在,在糖与根皮素反应样品中能检测到剩余的根皮素。在反应20 min和30 min时,HMF的生成量显著增加,其含量较10 min时分别增加了59和237倍(以葡萄糖加热为例),根皮素与HMF的物料比缩小,HMF消减率随之下降。在蔗糖体系中,反应10 min时HMF含量低于检测定量限,而30 min时的含量大约是20 min时的37倍,这与蔗糖需要先分解成葡萄糖和呋喃果糖阳离子,阳离子再转化为HMF有关[2]。蔗糖体系中反应30 min时,HMF消减率为27.86%,HMF含量减少了78.43 mg/L。
表2 焦糖化反应中HMF含量 单位:mg/L
Table 2 Content of HMF in caramelization reaction
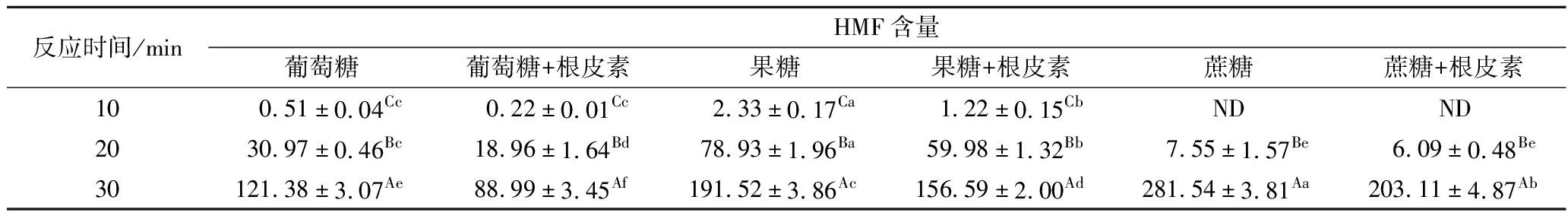
反应时间/minHMF含量葡萄糖葡萄糖+根皮素果糖果糖+根皮素蔗糖蔗糖+根皮素100.51±0.04Cc0.22±0.01Cc2.33±0.17Ca1.22±0.15CbNDND2030.97±0.46Bc18.96±1.64Bd78.93±1.96Ba59.98±1.32Bb7.55±1.57Be6.09±0.48Be30121.38±3.07Ae88.99±3.45Af191.52±3.86Ac156.59±2.00Ad281.54±3.81Aa203.11±4.87Ab
注:ND表示含量低于液相检测定量限(S/N<10);大写英文字母不同表示同一列具有显著性差异(P<0.05),小写英文字母不同表示同一行具有显著性差异(P<0.05)(表3同)。
3-DG是HMF的前体物质之一[3],TU等[32]研究发现表没食子儿茶素没食子酸酯能够抑制3-DG的形成,有效降低HMF含量。表3结果显示,在3种糖反应中,根皮素的添加显著减少了3-DG的含量,反应10 min时消减效果最好,葡萄糖、果糖和蔗糖体系消减率分别为37.33%、24.26%和25.45%。这与体系中HMF的变化趋势一致,表明根皮素能够抑制HMF前体物质3-DG的形成。此外,在葡萄糖和果糖体系中,3-DG的含量先增加后减少,可能是反应前期3-DG先形成积累,反应后期逐渐转变为HMF,从而导致反应30 min时3-DG含量下降,而HMF含量则显著增加[30]。
表3 焦糖化反应中3-DG含量 单位:mg/L
Table 3 Content of 3-DG in caramelization reaction

反应时间/min3-DG含量葡萄糖葡萄糖+根皮素果糖果糖+根皮素蔗糖蔗糖+根皮素1038.14±0.17Ac23.90±0.71Cd59.49±1.39Ba45.06±0.82Bb3.63±0.28Ce2.71±0.30Ce2040.36±1.13Ad31.30±0.71Be68.18±1.85Aa58.05±1.20Ab48.16±0.99Bc40.37±0.82Bd3039.21±1.43Ad34.18±0.37Ad53.32±1.31Cb45.71±1.43Bc182.80±3.75Aa165.26±5.82Aa
2.4 根皮素对广式月饼中HMF和3-DG形成的影响
广式月饼是一种传统的中华美食,蔡卓[34]研究发现相较于曲奇、鸡仔饼和杏仁饼等食品,广式月饼中含有较高的HMF,含量达到50.43 mg/kg。并且,广式月饼制作原料中氨基酸含量较低[39],果葡糖浆和蔗糖糖浆(月饼糖浆主要成分)含量高,焦糖化反应是烘培过程中形成HMF的主要途径[40]。前期预实验结果发现,市售红豆沙月饼饼皮中HMF含量高于馅料约10倍。因此,本研究将根皮素添加到广式月饼饼皮中,参考HU等[40]的多酚添加量,设置从低到高5组添加量对比。
由图3可知,随着根皮素添加量增加,饼皮中HMF含量显著下降,消减率分别为46.18%、57.84%、81.74%、83.82%和89.07%。表明在月饼饼皮中,根皮素对HMF的消减率与其添加量成正比,添加量为0.6%时,就能使HMF含量减少一半以上。3-DG是一种活泼的二羰基化合物,除脱水转化为HMF外,还会与蛋白质的氨基结合形成AGEs,AGEs能够在体内积累,与糖尿病、心血管疾病和神经退行性疾病等有关联[41],对人体健康产生危害。饼皮中3-DG含量为(760.11±16.21) mg/kg,是HMF含量(20.28±0.48) mg/kg的37倍多。随着根皮素添加量增加,3-DG含量缓慢下降,消减率分别为3.66%、6.34%、11.23%、29.14%和38.63%。当根皮素添加量为4%时,3-DG消减量达到了293.67 mg/kg。表明根皮素在广式月饼中可有效减少HMF和3-DG含量,这与模拟体系中的研究结果一致。
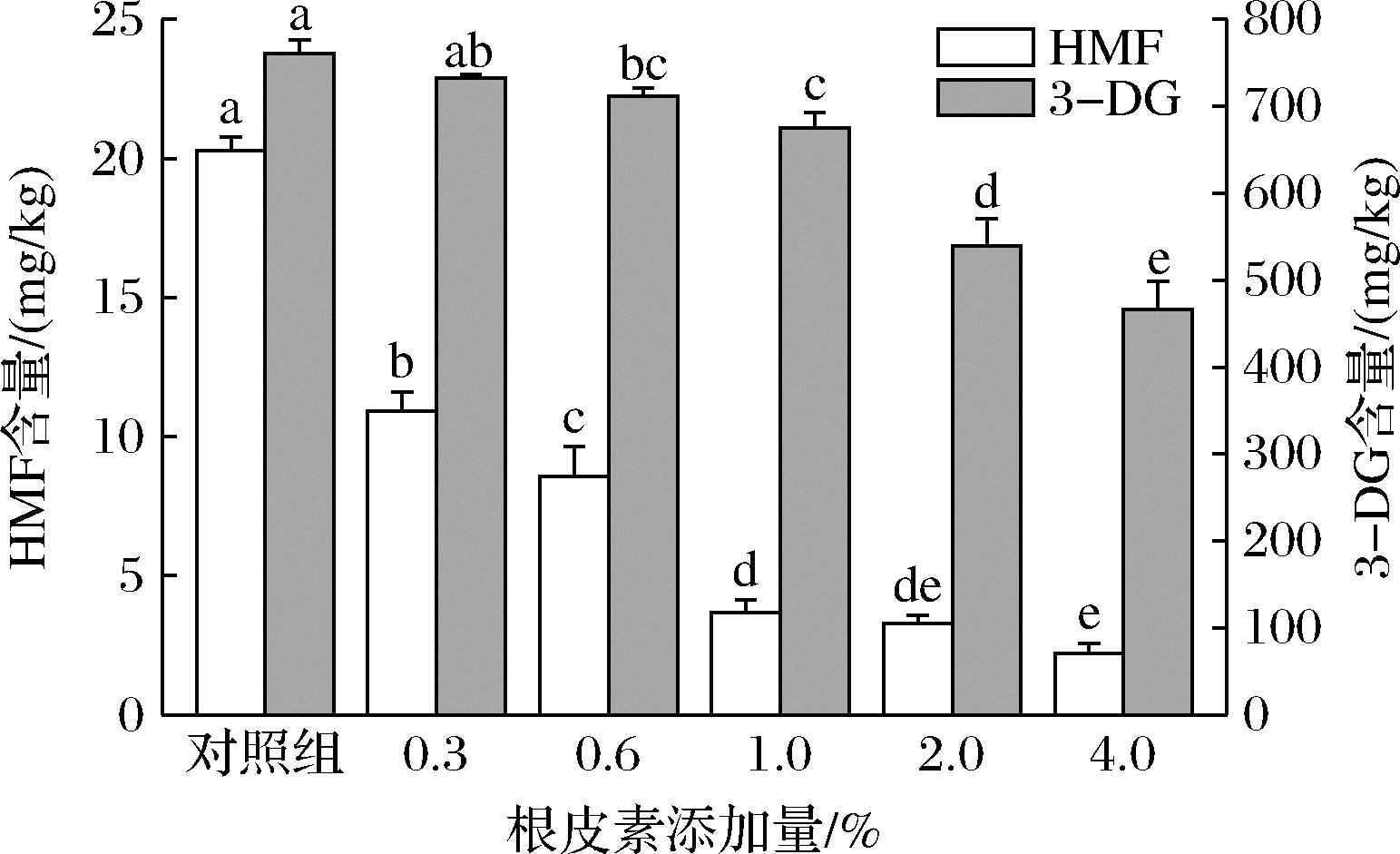
图3 广式月饼饼皮中HMF和3-DG含量
Fig.3 HMF and 3-DG content in the crust of Cantonese-style moon cake
2.5 根皮素与HMF加合物分析
上述研究表明,根皮素能有效消减HMF。为此,本研究在模拟体系中采用HPLC检测了HMF-根皮素反应产物(图4-a),在284 nm下发现除HMF(保留时间15.9 min)和根皮素(保留时间24.6 min)外,28.2 min时出现一个明显的新物质峰。该物质的二级质谱结果(负离子模式)如图4-b,其分子质量为656(m/z 655.15[M-H]-),其分子离子峰的质荷比符合1分子HMF与2分子根皮素脱水形成加合物(HMF-Di-Phl)的量。碎片离子m/z 273.10([M-H]-)为根皮素,碎片离子m/z 381.05([M-274-H]-)则由加合物脱去1分子根皮素产生。根皮素A环中的C3和C5位置是捕获羰基化合物的亲核位点[37],HMF具有一个活性醛基,能够与多酚A环上的亲核位点发生芳香亲电取代反应[30-31]。因C3和C5两个结合位点的存在,根皮素与HMF存在3种可能的互作方式,推测HMF-Di-Phl的结构如图4-c。在焦糖化反应体系和广式月饼中均检测到了m/z 655.15([M-H]-)组分存在,可见,根皮素能够与HMF反应形成加合物,从而降低体系中HMF含量。

a-HPLC谱图;b-HMF-Di-Phl二级质谱图;c-HMF-Di-Phl二级结构
图4 根皮素与HMF反应液HPLC谱图,HMF-Di-Phl二级质谱图和结构
Fig.4 The HPLC spectrum of phloretin and HMF reaction, the MS2 spectrum and structure of the HMF-Di-Phl
2.6 根皮素对月饼感官特性的影响
对添加根皮素月饼的形态、色泽、气味、滋味和油润度5个方面进行定量描述评价,结果如图5所示。根皮素添加量≤0.6%时,对滋味无显著影响,当添加量≥1.0%时,月饼饼皮出现苦涩味,滋味评分显著下降(P<0.05)。这与HU等[40]的研究结果相类似,当儿茶素添加量>1.0%时,黄油曲奇出现明显涩味。这与多酚类物质本身具有一定苦涩味有关[42]。随着根皮素添加量增加,月饼形态、色泽、气味和油润度评分虽略有下降,但无显著区别。由表4可知,当根皮素添加量<1.0%时,月饼感官评价总分与对照组无显著性区别;添加量>1.0%时,感官评价总分显著降低。
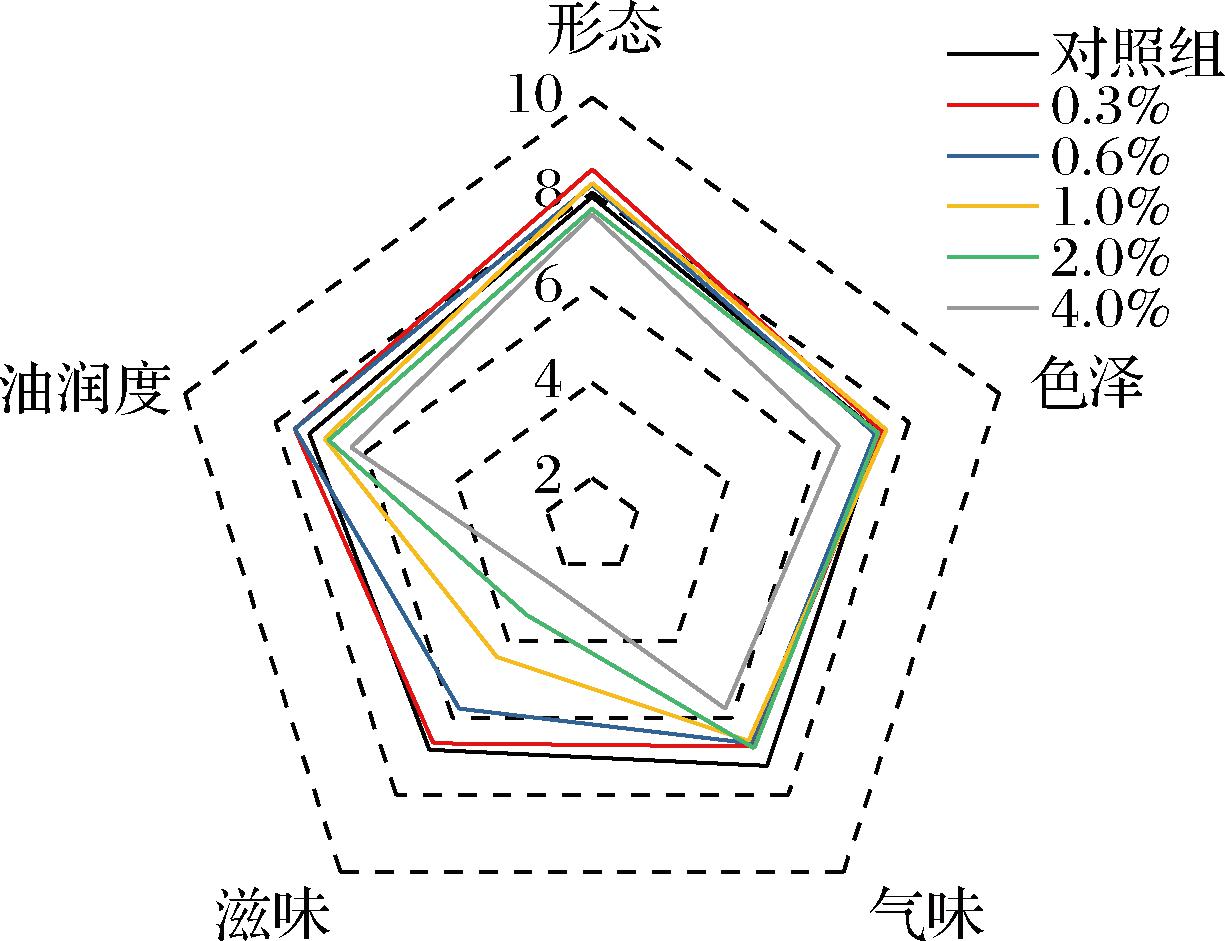
图5 月饼感官评价结果雷达图
Fig.5 Radar plot of sensory results of moon cake
表4 月饼感官评价总分
Table 4 The total sensory score of moon cake
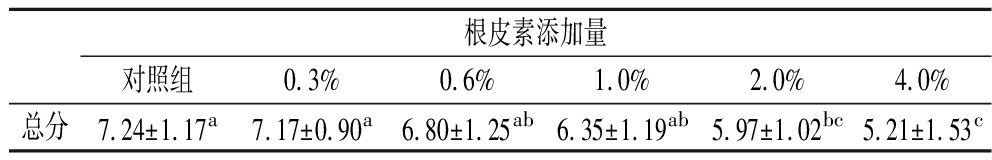
根皮素添加量对照组0.3%0.6%1.0%2.0%4.0%总分7.24±1.17a7.17±0.90a6.80±1.25ab6.35±1.19ab5.97±1.02bc5.21±1.53c
2.7 根皮素对月饼色度的影响
月饼不同部位的色度有所区别,通常饼面呈棕黄或棕红,侧面为乳黄或黄色,底面为棕黄不焦。分别测定月饼3个部位的L*、a*和b*值,结果如图6所示。随着根皮素含量增加,饼面(图6-a)L*值逐渐上升,a*和b*值先上升后降低,添加量为0.6%时红黄色度值最高,表现出褐变程度最深,其后逐渐偏白。对于侧面(图6-b)和底面(图6-c),低浓度和高浓度添加量,呈现出不同的变化趋势。添加量<1.0%时,侧面L*值随根皮素含量增加而下降、a*和b*值逐渐上升,底面L*值和b*值逐渐下降、a*值上升。侧面和底面表现出红黄色度增加,可能是根皮素加热发生氧化褐变,导致褐变程度加深[28]。添加量>1.0%时,侧面L*值上升、a*和b*值显著下降,底面L*、a*和b*值均显著上升。侧面和底面表现出亮度增加,颜色偏白。根皮素本身是白色粉末,随着含量的增加,生面团(图6-d)中L*值显著增加,a*和b*值下降,导致生面团颜色逐渐偏白。此外,HMF是焦糖化反应中棕色聚合物的前体物质,其含量与食品的褐变程度相关[43],根皮素含量>1.0%时,HMF含量下降了80%以上,可能导致褐变类物质形成减少。综上所述,根皮素添加量<1.0%时促进饼皮的褐变程度,>1.0%时反而降低褐变程度。
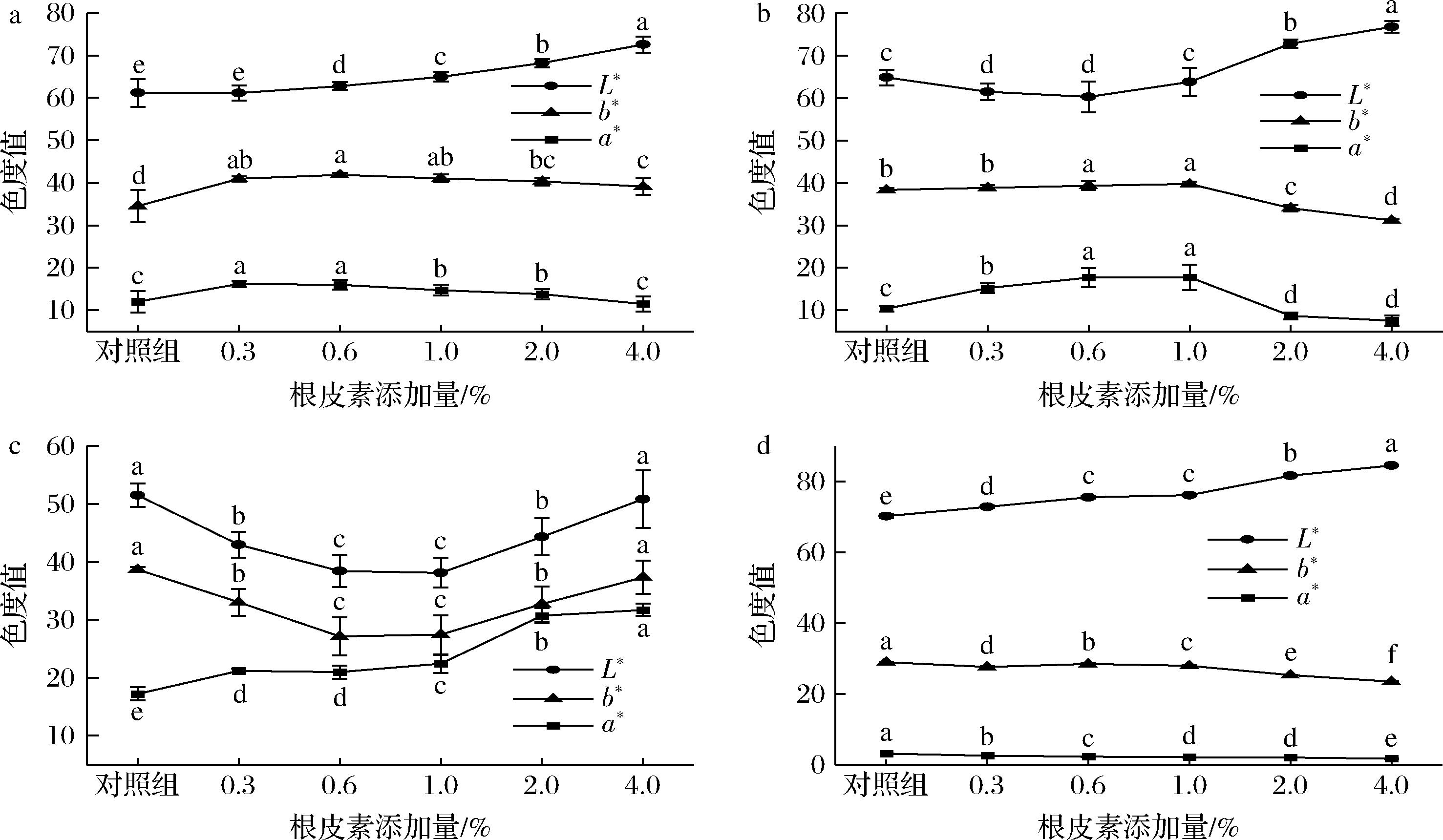
a-饼面;b-侧面;c-底面;d-生面团
图6 月饼饼面、侧面、底面和生面团的L*、a*、b*值
Fig.6 The L*, a*, b*values of moon cake surface, side, bottom and raw dough
3 结论
本研究表明,根皮素在模拟体系和广式月饼中均能有效降低HMF含量。在模拟体系下,根皮素在10种多酚中对HMF消减效果最好,其消减率与浓度和反应时间成正比;在3种焦糖化反应体系中,根皮素显著减少HMF和3-DG含量,葡萄糖体系反应10 min时消减率最高;在月饼中,根皮素同样显著降低饼皮中的HMF和3-DG含量,随着根皮素添加量的增加,消减率显著提升。当根皮素添加量<1.0%时,促进饼皮表面、侧面和底面的褐变程度,且对月饼感官评价无显著性影响。对模拟体系和食品体系的研究表明:根皮素对HMF存在2种消减机理,其一是根皮素直接捕获HMF,2分子根皮素与1分子HMF脱水形成加合物;其二是根皮素抑制前体物质3-DG的形成,从而减少了HMF的含量。
[1] NGUYEN H T, VAN DER FELS-KLERX H J, PETERS R J B, et al.Acrylamide and 5-hydroxymethylfurfural formation during baking of biscuits:Part I:Effects of sugar type[J].Food Chemistry, 2016, 192:575-585.
[2] PEREZ LOCAS C, YAYLAYAN V A.Isotope labeling studies on the formation of 5-(hydroxymethyl)-2-furaldehyde (HMF) from sucrose by pyrolysis-GC/MS[J].Journal of Agricultural and Food Chemistry, 2008, 56(15):6717-6723.
[3] 温超, 王紫梦, 石星波, 等.食品中丙烯酰胺与5-羟甲基糠醛的研究进展[J].食品科学, 2015, 36(13):257-264. WEN C, WANG Z M, SHI X B, et al.A review of acrylamide and 5-hydroxymethylfurfural in foods[J].Food Science, 2015, 36(13):257-264.
[4] LEE C H, CHEN K T, LIN J A, et al.Recent advances in processing technology to reduce 5-hydroxymethylfurfural in foods[J].Trends in Food Science &Technology, 2019, 93:271-280.
[5] 李军, 涂宗财, 沙小梅, 等.反应条件对牛血清白蛋白-葡萄糖体系糖基化产物形成的影响[J].食品与发酵工业, 2019, 45(5):87-93;100. LI J, TU Z C, SHA X M, et al.Effects of reaction conditions on the formation of glycosylation products of bovine serum albumin-glucose system[J].Food and Fermentation Industries, 2019, 45(5):87-93;100.
[6] QIU Y T, LIN X R, CHEN Z Z, et al.5-hydroxymethylfurfural exerts negative effects on gastric mucosal epithelial cells by inducing oxidative stress, apoptosis, and tight junction disruption[J].Journal of Agricultural and Food Chemistry, 2022, 70(12):3852-3861.
[7] MONIEN B H, FRANK H, SEIDEL A, et al.Conversion of the common food constituent 5-hydroxymethylfurfural into a mutagenic and carcinogenic sulfuric acid ester in the mouse in vivo[J].Chemical Research in Toxicology, 2009, 22(6):1123-1128.
[8] BAUER-MARINOVIC M, TAUGNER F, FLORIAN S, et al.Toxicity studies with 5-hydroxymethylfurfural and its metabolite 5-sulphooxymethylfurfural in wild-type mice and transgenic mice expressing human sulphotransferases 1A1 and 1A2[J].Archives of Toxicology, 2012, 86(5):701-711.
[9] OU J Y, ZHENG J, HUANG J Q, et al.Interaction of acrylamide, acrolein, and 5-hydroxymethylfurfural with amino acids and DNA[J].Journal of Agricultural and Food Chemistry, 2020, 68(18):5039-5048.
[10] MONIEN B H, ENGST W, BARKNOWITZ G, et al.Mutagenicity of 5-hydroxymethylfurfural in V79 cells expressing human SULT1A1:Identification and mass spectrometric quantification of DNA adducts formed[J].Chemical Research in Toxicology, 2012, 25(7):1484-1492. [11] SHAPLA U M, SOLAYMAN M, ALAM N, et al.5-Hydroxymethylfurfural (HMF) levels in honey and other food products:Effects on bees and human health[J].Chemistry Central Journal, 2018, 12(1):35.
[12] 张泽宇, 曹雁平, 朱雨辰.缓解食品中丙烯酰胺和5-羟甲基糠醛形成的研究进展[J].食品工业科技, 2020, 41(12):324-333;347. ZHANG Z Y, CAO Y P, ZHU Y C.Mitigation strategies on acrylamide and 5-hydroxymethylfurfural in foods[J].Science and Technology of Food Industry, 2020, 41(12):324-333;347.
[13] CAPUANO E, FOGLIANO V.Acrylamide and 5-hydroxymethylfurfural (HMF):A review on metabolism, toxicity, occurrence in food and mitigation strategies[J].LWT-Food Science and Technology, 2011, 44(4):793-810.
[14] PETISCA C, HENRIQUES A R, PÉREZ-PALACIOS T, et al.Study of hydroxymethylfurfural and furfural formation in cakes during baking in different ovens, using a validated multiple-stage extraction-based analytical method[J].Food Chemistry, 2013, 141(4):3349-3356.
[15] XING Q Q, FU X F, LIU Z M, et al.Contents and evolution of potential furfural compounds in milk-based formula, ultra-high temperature milk and pasteurised yoghurt[J].International Dairy Journal, 2021, 120:105086.
[16] CHOUDHARY A, KUMAR V, KUMAR S, et al.5-Hydroxymethylfurfural (HMF) formation, occurrence and potential health concerns:Recent developments[J].Toxin Reviews, 2021, 40(4):545-561.
[17] MURKOVIC M, PICHLER N.Analysis of 5-hydroxymethylfurfual in coffee, dried fruits and urine[J].Molecular Nutrition &Food Research, 2006, 50(9):842-846.
[18] RUFI N-HENARES J A, GARC
N-HENARES J A, GARC A-VILLANOVA B, GUERRA-HERN
A-VILLANOVA B, GUERRA-HERN NDEZ E.Occurrence of furosine and hydroxymethylfurfural as markers of thermal damage in dehydrated vegetables[J].European Food Research and Technology, 2008, 228(2):249-256.
NDEZ E.Occurrence of furosine and hydroxymethylfurfural as markers of thermal damage in dehydrated vegetables[J].European Food Research and Technology, 2008, 228(2):249-256.
[19] GONG M, ZHOU Z L, YU Y J, et al.Investigation of the 5-hydroxymethylfurfural and furfural content of Chinese traditional fermented vinegars from different regions and its correlation with the saccharide and amino acid content[J].LWT-Food Science and Technology, 2020, 124:109175.
[20] FARAG M R, ALAGAWANY M, BIN-JUMAH M, et al.The toxicological aspects of the heat-borne toxicant 5-hydroxymethylfurfural in animals:A review[J].Molecules, 2020, 25(8):1941.
[21] BEHZAD S, SUREDA A, BARRECA D, et al.Health effects of phloretin:From chemistry to medicine[J].Phytochemistry Reviews, 2017, 16(3):527-533.
[22] LO C Y, HSIAO W T, CHEN X Y.Efficiency of trapping methylglyoxal by phenols and phenolic acids[J].Journal of Food Science, 2011, 76(3):H90-H96.
[23] ZHU Q, ZHENG Z P, CHENG K W, et al.natural polyphenols as direct trapping agents of lipid peroxidation-derived acrolein and 4-hydroxy-trans-2-nonenal[J].Chemical Research in Toxicology, 2009, 22(10):1721-1727.
[24] ZHU Q, LIANG C P, CHENG K W, et al.Trapping effects of green and black tea extracts on peroxidation-derived carbonyl substances of seal blubber oil[J].Journal of Agricultural and Food Chemistry, 2009, 57(3):1065-1069.
[25] ZHU Y D, WANG W X, HUANG Q J, et al.Metabolic Investigation on the Interaction mechanism between dietary dihydrochalcone intake and lipid peroxidation product acrolein reduction[J].Molecular Nutrition &Food Research, 2022, 66(9):e2101107.
[26] OU J Y, TENG J, EL-NEZAMI H S, et al.Impact of resveratrol, epicatechin and rosmarinic acid on fluorescent AGEs and cytotoxicity of cookies[J].Journal of Functional Foods, 2018, 40:44-50.
[27] 刘黄友. 天然植物黄酮对美拉德模拟体系中丙烯酰胺及5-羟甲基糠醛的协同抑制研究[D].长春:吉林大学, 2018. LIU H Y.Inhibition of acrylamide and 5-hydroxymethylfurfural formation by natural plant flavonoids in the Maillard systems[D].Changchun:Jilin University, 2018.
[28] ZHANG X C, CHEN F, WANG M F.Impacts of selected dietary polyphenols on caramelization in model systems[J].Food Chemistry, 2013, 141(4):3451-3458.
[29] QI Y J, ZHANG H, WU G C, et al.Reduction of 5-hydroxymethylfurfural formation by flavan-3-ols in Maillard reaction models and fried potato chips[J].Journal of the Science of Food and Agriculture, 2018, 98(14):5294-5301.
[30] QI Y J, ZHANG H, ZHANG H, et al.Epicatechin adducting with 5-hydroxymethylfurfural as an inhibitory mechanism against acrylamide formation in Maillard reactions[J].Journal of Agricultural and Food Chemistry, 2018, 66(47):12536-12543.
[31] ZHU H K, POOJARY M M, ANDERSEN M L, et al.Trapping of carbonyl compounds by epicatechin:Reaction kinetics and identification of epicatechin adducts in stored UHT milk[J].Journal of Agricultural and Food Chemistry, 2020, 68(29):7718-7726.
[32] TU A T, LIN J A, LEE C H, et al.Reduction of 3-deoxyglucosone by epigallocatechin gallate results partially from an addition reaction:The possible mechanism of decreased 5-hydroxymethylfurfural in epigallocatechin gallate-treated black garlic[J].Molecules, 2021, 26(16):4746.
[33] ZHANG Y N, AN X N.Inhibitory mechanism of quercetin against the formation of 5-(hydroxymethyl)-2-furaldehyde in buckwheat flour bread by ultra-performance liquid chromatography coupled with high-resolution tandem mass spectrometry[J].Food Research International, 2017, 95:68-81.
[34] 蔡卓. 广式月饼中5-HMF的形成规律与控制[D].广州:华南农业大学, 2018. CAI Z.The study of 5-HMF and its control technology in a Cantonese moon cake system[D].Guangzhou:South China Agricultural University, 2018.
[35] ZHANG Z H, ZOU Y Y, WU T G, et al.Chlorogenic acid increased 5-hydroxymethylfurfural formation when heating fructose alone or with aspartic acid at two pH levels[J].Food Chemistry, 2016, 190:832-835.
[36] 魏丽娜, 赵静, 罗仓学, 等.根皮素的制备、结构修饰及生理活性研究进展[J].食品与发酵工业, 2019, 45(17):278-285. WEI L N, ZHAO J, LUO C X, et al.Preparation, structural modification and physiological activities of phloretin:A review[J].Food and Fermentation Industries, 2019, 45(17):278-285.
[37] SHAO X, BAI N S, HE K, et al.Apple polyphenols, phloretin and phloridzin:New trapping agents of reactive dicarbonyl species[J].Chemical Research in Toxicology, 2008, 21(10):2042-2050.
[38] 张玉玉, 张兴, 章慧莺, 等.3种单糖模拟体系中5-羟甲基糠醛的形成动力学分析[J].食品科学, 2014, 35(17):41-47. ZHANG Y Y, ZHANG X, ZHANG H Y, et al.Kinetic studies on 5-hydroxymethylfurfural formation in three kinds of monosaccharide solution model systems during thermal processing[J].Food Science, 2014, 35(17):41-47.
[39] 杨月月. 不同面筋含量小麦淀粉及蛋白质特性分析[D].郑州:河南工业大学, 2018. YANG Y Y.Analyses of starch and protein characteristics of wheat with different gluten contents[D].Zhengzhou:Henan University of Technology, 2018.
[40] HU H Y, WANG Y T, HUANG Y S, et al.Natural antioxidants and hydrocolloids as a mitigation strategy to inhibit advanced glycation end products (AGEs) and 5-hydroxymethylfurfural (HMF) in butter cookies[J].Foods, 2022, 11(5):657.
[41] 孔盈斐, 梁迎岗, 熊前进, 等.多酚对食源性晚期糖基化终末产物及其诱导的相关疾病的抑制作用研究进展[J].食品科学, 2022, 43(13):227-236. KONG Y F, LIANG Y G, XIONG Q J, et al.Inhibitory effects of polyphenols on dietary advanced glycation end products and related diseases:A review[J].Food Science, 2022, 43(13):227-236.
[42] LEY J P, DESSOY M, PAETZ S, et al.Identification of enterodiol as a masker for caffeine bitterness by using a pharmacophore model based on structural analogues of homoeriodictyol[J].Journal of Agricultural and Food Chemistry, 2012, 60(25):6303-6311.
[43] SERRA-CAYUELA A, AGUILERA-CURIEL M A, RIU-AUMATELL M, et al.Browning during biological aging and commercial storage of Cava sparkling wine and the use of 5-HMF as a quality marker[J].Food Research International, 2013, 53(1):226-231.