罗非鱼又名非洲鲫鱼,原产于非洲。因生长速度快,肉质鲜美,被引入我国大量养殖。我国罗非鱼加工产业发达,但在加工过程中,大量的组织被当作下脚料丢弃[1]。这些下脚料中,鱼皮因富含胶原蛋白和糖胺聚糖等高附加值产品[2],是提取高附加值生物材料的理想原料[3]。
糖胺聚糖又名黏多糖,是一类由多个二糖结构单元构成的长链线性复杂多糖,包括硫酸软骨素(chondroitin sulfate,CS)、硫酸皮肤素(dermatan sulfate,DS)、透明质酸(hyaluronic acid,HA)、硫酸乙酰肝素(heparan sulfate, HS)等[4]。其中鱼皮中富含的DS是一种硫酸化糖胺聚糖,主要由N-乙酰半乳糖胺和L-艾杜糖醛酸以β-1,4或β-1,3键连接的二糖组成。DS具有伤口修复、抗炎、抗病毒、抗血栓等活性[5],具有广阔应用前景。商品化DS主要从猪皮、猪肠黏膜、牛皮中获取,近年,由于陆生动物来源的DS存在疯牛病、口蹄疫等风险,以鱼皮为原料[6]提取的水生动物来源DS受到广泛关注。
目前,鱼皮DS及胶原蛋白的提取通常是分开进行的,提取鱼皮DS一般采用碱提取和酶提取等方法。这些方法的提取温度通常在50 ℃以上,长时间的碱、高温处理易对胶原蛋白的结构造成破坏[7],不利于胶原蛋白提取,造成资源的浪费。因此,本研究采用在较低温度下酶提酸促溶的方法对罗非鱼皮DS与胶原蛋白进行同时提取,反应条件温和,避免了高温、强酸、强碱对DS与胶原蛋白结构的破坏。同时,通过单因素试验及双指标响应面法对工艺条件进行优化,使DS得率与胶原蛋白提取率都能达到较高水平,实现罗非鱼皮DS及胶原蛋白的同时提取。
1 材料与方法
1.1 材料与试剂
罗非鱼皮,广东省湛江市恒诚生物科技有限公司,清洗后-20 ℃保存;木瓜蛋白酶(800 U/mg)、中性蛋白酶(100 U/mg)、碱性蛋白酶(200 U/mg)、胰蛋白酶(250 U/mg)、胃蛋白酶(3 000 U/mg),上海源叶生物科技有限公司;阿利新蓝8GX,美国Sigma公司;硫酸皮肤素标准品、硫酸软骨素标准品、透明质酸标准品、L-羟脯氨酸标准品,中国药品生物制品检定所;SDS-PAGE凝胶快速配制试剂盒、SDS-PAGE 蛋白上样缓冲液,上海碧云天生物技术有限公司;Amberlite FPA98Cl树脂,陶氏化学公司;NaCl、醋酸等均为分析纯,西陇科学股份有限公司。
1.2 仪器与设备
HH-8CJ恒温磁力搅拌水浴锅,常州市金坛友联仪器研究所;Thermo Lynx 6000高速落地离心机,赛默飞世尔科技有限公司;TU-1901紫外可见分光光度计,北京普析通用仪器有限公司;TENSOR 27傅里叶红外光谱仪,德国Bruker公司;GelDoc XR+凝胶成像系统,美国伯乐公司。
1.3 实验方法
1.3.1 鱼皮的预处理
将罗非鱼皮洗净,去除多余的鳞片及鱼肉等杂质,鱼皮的脱脂参考蒋丽等[8]的方法略作改动,在料液比1∶4(g∶mL)、pH 9、加酶量0.5%、39 ℃条件下用脂肪酶脱脂1 h。再将处理后的鱼皮用0.1 mol/L NaOH溶液浸泡12 h除去杂蛋白及色素, 蒸馏水清洗至中性。剪成约1 cm×1 cm的小块并经破壁机粉碎备用。
1.3.2 鱼皮DS与胶原蛋白的同时提取
经过处理的鱼皮加入适量的水进行酶解,酶解结束后加入醋酸调至pH值为3,继续提取30 min,促进胶原蛋白溶出,最后沸水浴灭酶。8 000 r/min离心20 min取上清液,加入NaCl溶液使浓度为0.9 mol/L,4 ℃盐析过夜,离心分离得到胶原蛋白沉淀及含DS的上清液。胶原蛋白沉淀用适量0.5 mol/L醋酸溶解,于0.1 mol/L醋酸中透析1 d,再于蒸馏水中透析1 d,每隔6 h换水一次,冷冻干燥得到罗非鱼皮胶原蛋白。含DS的上清液浓缩后经3 kDa透析袋脱盐1 d,pH值调至8,过滤取澄清液,50 ℃下在Amberlite FPA98Cl树脂柱中吸附上样,然后用蒸馏水洗至洗脱液接近无色,分别用0.3、0.5 mol/L的NaCl溶液,以1 mL/min的流速依次洗脱,收集0.5 mol/L NaCl溶液洗脱组分,用阿利新蓝法检测管中DS含量,收集含有DS的洗脱液。透析袋透析2 d,冷冻干燥得到罗非鱼皮DS。
1.3.3 蛋白酶的筛选
取10 g鱼皮,加入300 mL蒸馏水,分别加入5 000 U/g的木瓜蛋白酶、中性蛋白酶、2709碱性蛋白酶、胰蛋白酶、胃蛋白酶,在各自适宜pH下30 ℃酶解24 h。以DS得率及胶原蛋白提取率为指标,筛选出酶解提取最适宜的酶。
1.3.4 单因素试验
以DS得率及胶原蛋白提取率为指标,加酶量、料液比、提取时间、提取温度为单因素,探究单因素对同时提取效果的影响。
1.3.5 响应面优化
综合单因素试验结果,选取加酶量、提取时间、提取温度作为影响因素,DS得率及胶原蛋白提取率为响应值,采用 Box-Behnken 实验设计和响应曲面分析优化同时提取效果。试验因素及水平如表1所示。
表1 Box-Behnken 实验因素及水平表
Table 1 Factors and levels in response surface design
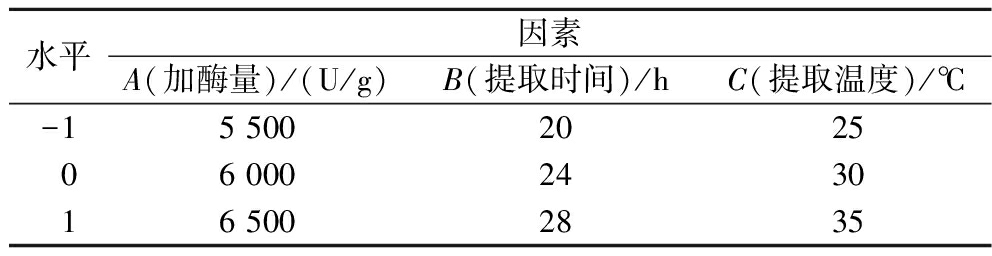
水平因素A(加酶量)/(U/g)B(提取时间)/hC(提取温度)/℃-15 500202506 000243016 5002835
1.3.6 DS得率的测定
参考张虹等[9]的方法略作改动,取0.1 mL样液,1.5 mL阿利新蓝染液染色10 min,于480 nm处测定吸光度,对照DS标准曲线计算样液DS含量,如公式(1)所示:
Y1=ρ×V×100/m
(1)
式中:Y1,DS得率,mg/100 g;ρ,DS含量,mg/mL;V,DS样液体积,mL;100,100 g鱼皮;m,鱼皮质量,g。
1.3.7 醋酸纤维素薄膜电泳
参考左格格等[10]的方法略作改动,取HA、CS、DS标准品及罗非鱼皮DS样品各5 mg,用蒸馏水配制成5 mg/mL。用点样器点样后,在7 mA电流下电泳30 min,阿利新蓝染色液染色20 min,最后用2%醋酸水溶液脱色30 min。
1.3.8 胶原蛋白提取率的测定
参照杨碧仙等[11]的方法测定样品中的羟脯氨酸含量。通过测定胶原蛋白中羟脯氨酸的含量,乘以羟脯氨酸换算系数,就可计算得到胶原蛋白的含量,如公式(2)、公式(3)所示:
m=ρ×C×V×11.1×10-6
(2)
Y2 =m1/m2×100
(3)
式中:m,胶原蛋白含量,g;ρ,羟脯氨酸含量,μg/mL;C,稀释倍数;V,样品体积,mL;11.1,羟脯氨酸与胶原蛋白的换算系数;Y2,胶原蛋白提取率,%;m1,样品中胶原蛋白质量,g;m2,罗非鱼皮中胶原蛋白总量,g。
1.3.9 聚丙烯酰胺凝胶电泳
参考CAO等[12]的方法,略作改动。使用分离胶浓度为8%(质量分数),浓缩胶浓度为5%(质量分数)。将罗非鱼皮胶原蛋白溶于0.5 mol/L醋酸配制成5 mg/mL的胶原蛋白液,与5×样品缓冲液混合,100 ℃加热8 min,4 000 r/min离心5 min,取15 μL上清液上样。以80 V电压浓缩20 min,至样品在浓缩胶中浓缩成一条线后,电压调为100 V继续电泳90 min。电泳后用考马斯亮蓝R-250染色凝胶,并用脱色液脱色至分离胶背景无色,进行凝胶成像系统分析。
1.3.10 傅里叶变换红外光谱扫描
将冻干样品与干燥的KBr置于玛瑙研钵中磨成细腻的粉末,装样,手动压片,对样品在4 000~500 cm-1内进行扫描图谱,分辨率为2 cm-1。
1.3.11 数据处理
所有实验均重复3次,结果使用JMP Pro 16软件进行差异显著性分析(P<0.05),采用Origin 2021和 Design-Expert 8.0等软件进行数据统计分析及绘图。
2 结果与分析
2.1 蛋白酶的筛选结果
选取5种蛋白酶,并比较其对同时提取效果的影响,其中木瓜蛋白酶、中性蛋白酶的酶解pH值为7,碱性蛋白酶、胰蛋白酶的酶解pH值为8,胃蛋白酶的酶解pH值为3。如图1所示,中性蛋白酶对DS的提取效果最好,显著高于其他4种酶,对胶原蛋白的提取也有较好效果;胃蛋白酶被广泛应用于胶原蛋白的提取[13],对胶原蛋白的提取效果最好,所得到的罗非鱼皮胶原蛋白提取率最高,但其对DS的提取效果较差,综合考虑选择中性蛋白酶用于DS与胶原蛋白的同时提取。
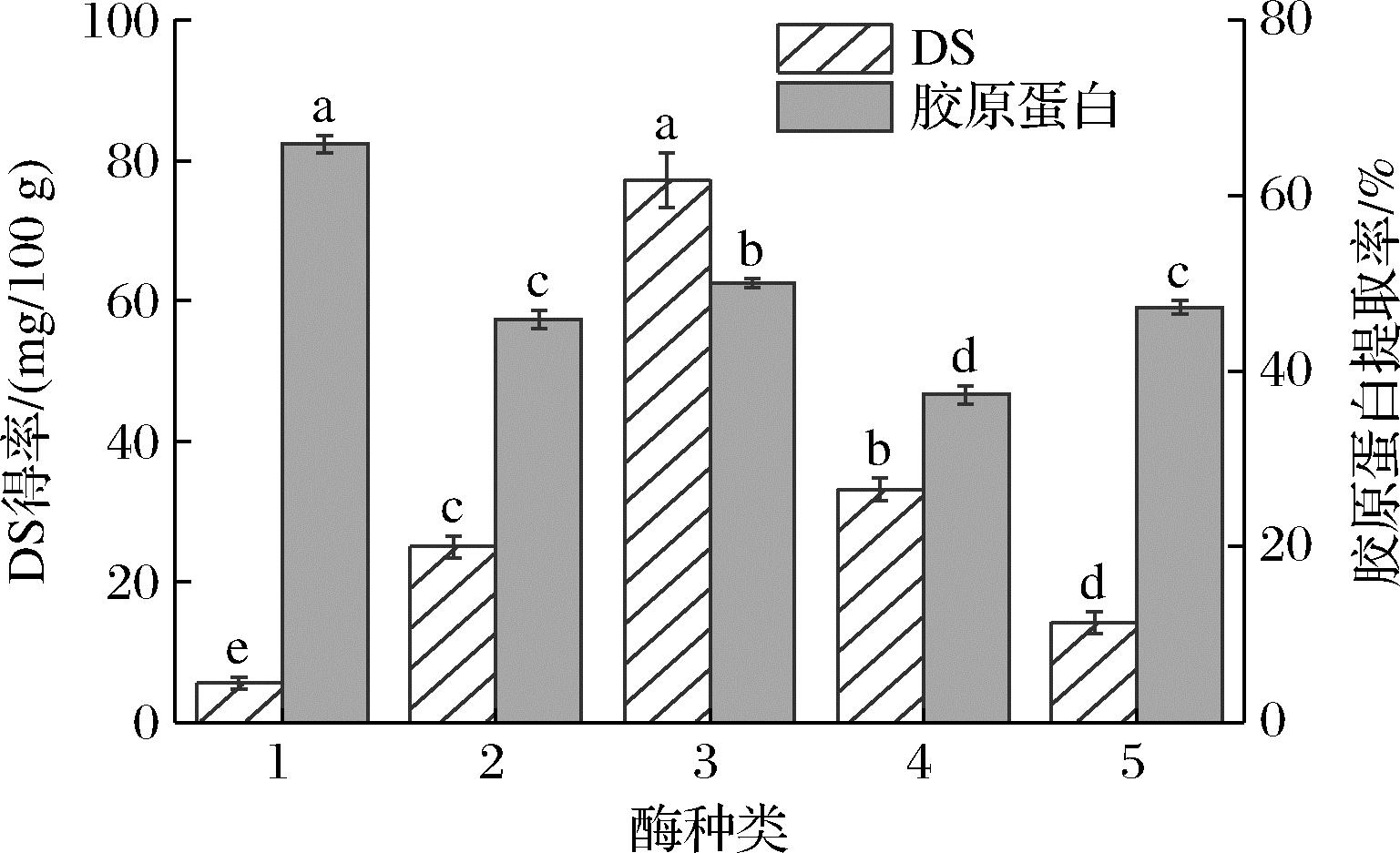
1-胃蛋白酶;2-木瓜蛋白酶;3-中性蛋白酶;4-碱性蛋白酶; 5-胰蛋白酶
图1 酶种类对DS得率及胶原蛋白提取率的影响
Fig.1 Effect of enzyme species on DS yield and collagen extraction rate 注:图中小写字母表示差异显著(P<0.05)(下同)。
2.2 单因素试验结果
2.2.1 加酶量对同时提取效果的影响
在提取时间24 h、提取温度30 ℃、料液比1∶30 (g∶mL)的酶解条件下,比较不同加酶量(3 000、4 000、5 000、6 000、7 000、8 000 U/g)对DS得率及胶原蛋白提取率的影响。如图2所示,随着加酶量的增加,蛋白酶与鱼皮的接触机会增多,DS得率及胶原蛋白的提取率呈现显著上升趋势,在加酶量达到6 000 U/g后,酶与底物的接触趋于饱和,DS得率的上升趋于平缓,而胶原蛋白的提取率由于过量的酶导致胶原蛋白水解,呈现下降的趋势。在加酶量为6 000和7 000 U/g时,DS得率及胶原蛋白的提取率变化不显著,考虑到蛋白酶的过量使用会影响胶原蛋白的纯度,本试验的加酶量选择为6 000 U/g。
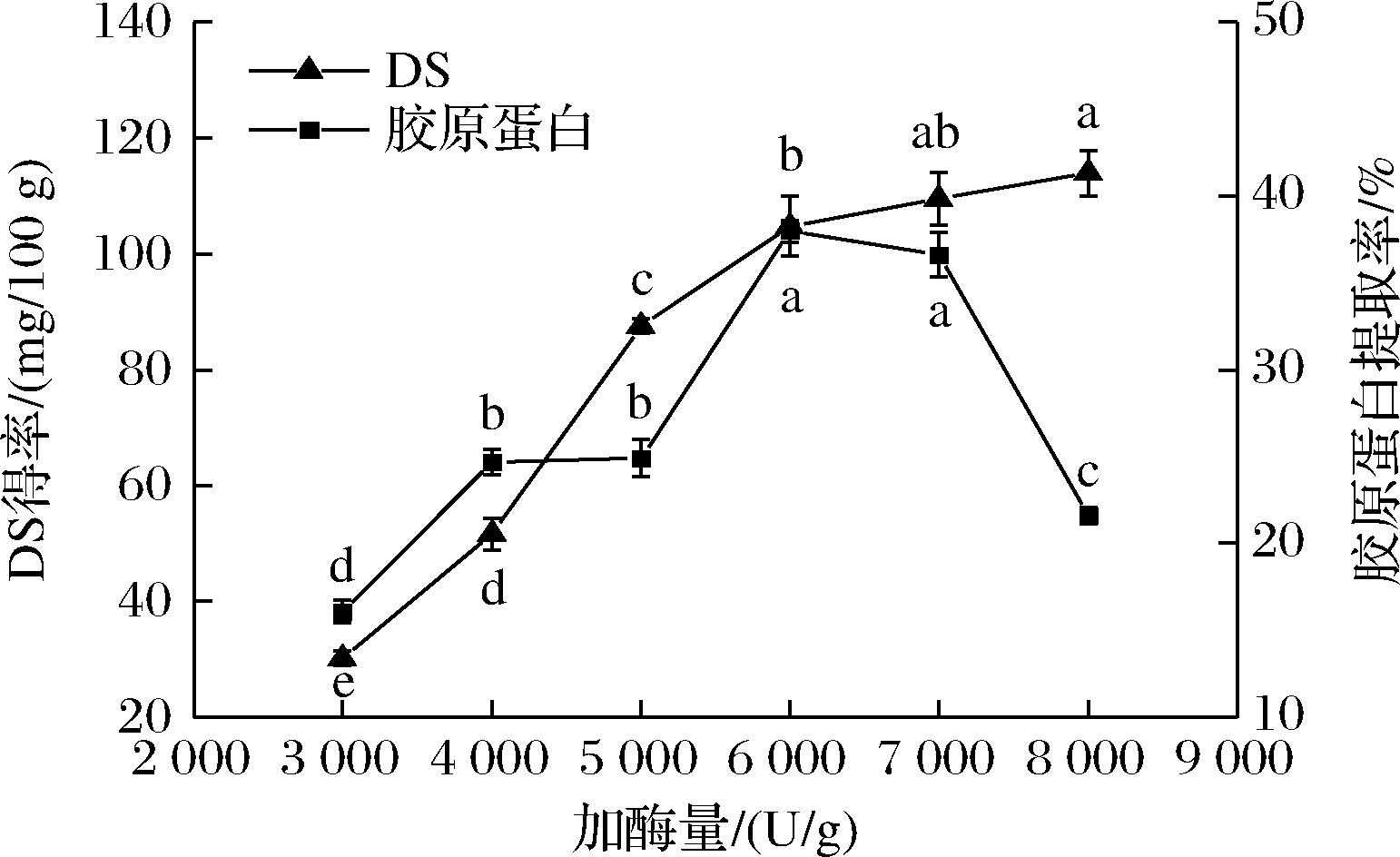
图2 加酶量对DS得率及胶原蛋白提取率的影响
Fig.2 Effect of enzyme addition on DS yield and collagen extraction rate
2.2.2 提取时间对同时提取效果的影响
在加酶量6 000 U/g、提取温度30 ℃、料液比1∶30(g∶mL)的酶解条件下,比较不同提取时间(8、16、24、32、40 h)对DS得率及胶原蛋白提取率的影响。如图3所示,提取时间为8~24 h时,由于提取时间较短,酶对蛋白的水解不充分,DS未被完全释放,随着提取时间的延长,胶原蛋白非螺旋区被水解,胶原蛋白持续溶出,与DS连接的蛋白充分水解,DS持续释放,DS得率及胶原蛋白提取率呈显著上升趋势,在提取时间为24 h时,DS得率及胶原蛋白提取率均达到最大值,延长提取时间,导致了DS的水解及胶原蛋白的过度酶解,DS得率及胶原蛋白提取率逐渐下降。本试验的提取时间选择为24 h。

图3 提取时间对DS得率及胶原蛋白提取率的影响
Fig.3 Effect of extraction time on DS yield and collagen extraction rate
2.2.3 提取温度对同时提取效果的影响
在加酶量6 000 U/g、提取时间24 h、料液比1∶30(g∶mL)的酶解条件下,比较不同提取温度(10、20、30、40、50 ℃)对DS得率及胶原蛋白提取率的影响。如图4所示,提取温度为10~30 ℃时,温度的升高加速了蛋白酶的酶解反应速率,DS得率显著上升,30 ℃后,得率上升趋势减缓;提取温度为10~20 ℃时,胶原蛋白提取率有显著增加,在提取温度为20 ℃时达到提取率最大值,在提取温度为20~30 ℃时,胶原蛋白提取率略有下降,但变化不明显,继续提高温度,由于过高的温度导致胶原蛋白变性,无法再通过盐析进行分离,胶原蛋白提取率有明显下降。综合考虑,本试验的提取温度在30 ℃为佳。
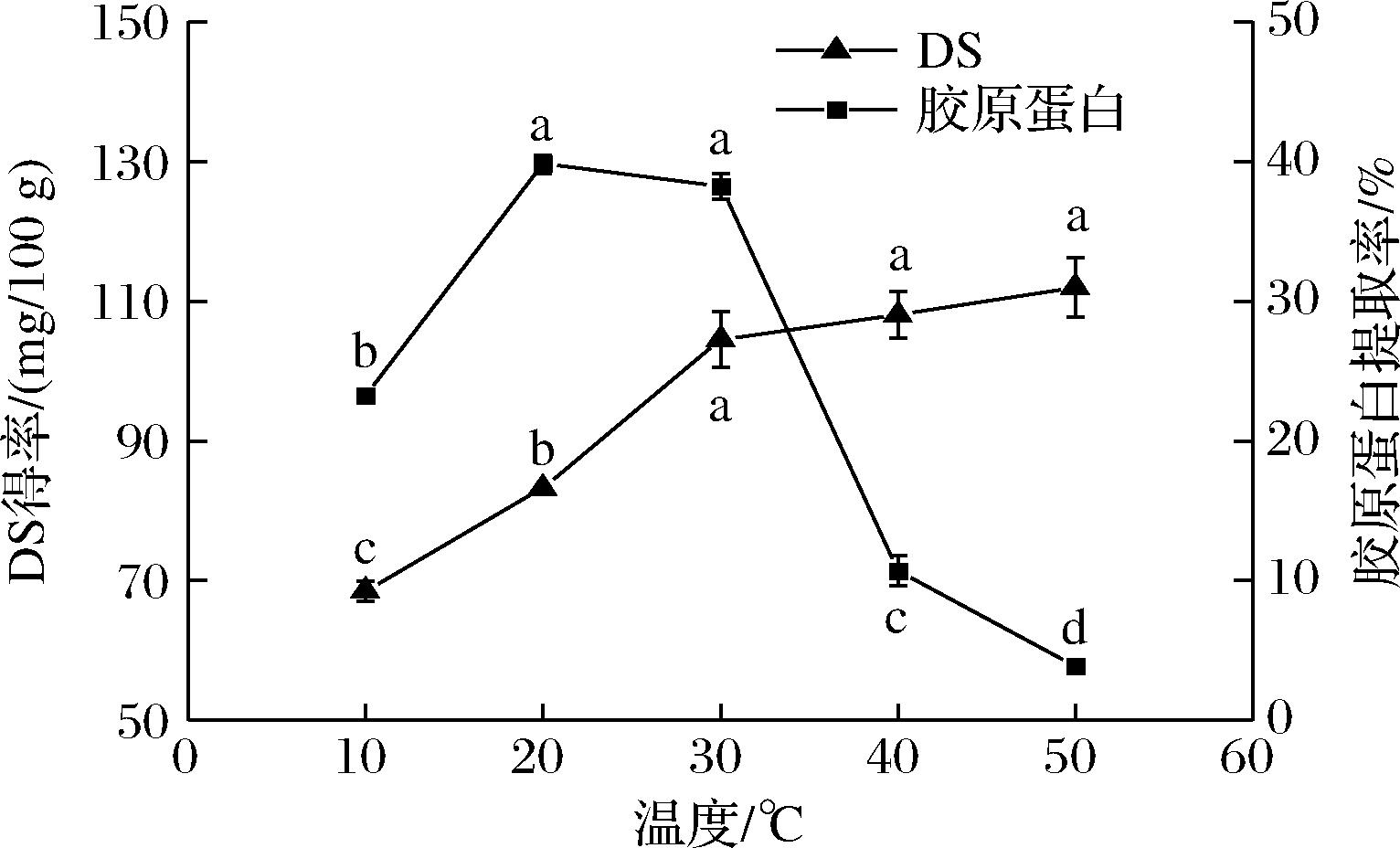
图4 提取温度对DS得率及胶原蛋白提取率的影响
Fig.4 Effect of extraction temperature on DS yield and collagen extraction rate
2.2.4 料液比对同时提取效果的影响
在加酶量6 000 U/g、提取时间24 h、提取温度30 ℃的酶解条件下,比较不同料液比[1∶10、1∶20、1∶30、1∶40、1∶50(g∶mL)]对DS得率及胶原蛋白提取率的影响(图5)。

图5 料液比对DS得率及胶原蛋白提取率的影响
Fig.5 Effect of the liquid ratio on DS yield and collagen extraction rate
如图5所示,料液比为1∶10~1∶40(g∶mL)时,DS得率及胶原蛋白提取率随料液比的增大显著上升,在1∶40(g∶mL)时DS得率及胶原蛋白提取率出现最大值,随后开始下降。在较低的料液比下,酶解液黏度较大,不利于通过搅拌使蛋白酶与底物充分接触,但过大的料液比会增加后续分离纯化的成本。考虑经济效益和实验的实际操作性,本试验将料液比固定为1∶40(g∶mL)。
2.3 响应面试验结果分析
2.3.1 响应面试验设计与结果
根据单因素实验结果,采用Box-Behnken模型进行二次多元回归方程设计,进一步优化同时提取工艺。试验设计及结果如表2所示。
表2 响应面试验设计及结果
Table 2 Response surface experimental design and results

序号因素ABCDS得率[mg/(100 g)]胶原蛋白提取率/%1110121.9840.61210-197.8946.023000123.2750.91401-1112.9950.145000129.2152.18601177.4812.027000127.7449.98810178.6211.219-10-1115.0253.00100-1164.4918.15110-1-1101.4853.7212-10161.3812.6513000120.6951.5214-1-10121.5441.6015000123.8349.36161-10101.4341.5517-110116.3939.49
2.3.2 DS得率的响应面结果分析
由表2中试验数据得到多元拟合回归方程加酶量(A)、提取时间(B)、提取温度(C)为:Y1=124.95-1.80A+4.99B-18.18C+6.42AB+8.59AC+0.37BC-5.25A2-4.37B2-31.47C2
由表3可知,此回归模型P<0.000 1,模型极显著。失拟项P=0.469 5>0.05不显著,表示模型对实验的拟合度较高。回归方程的相关系数R2=0.989 3,校正决定系数R2=0.975 5,变异系数为3.30%<10%,说明罗非鱼皮DS的提取实际值和预测值有较好的拟合相关性,试验的重复性较好。3个因素对罗非鱼皮DS得率的影响为C>B>A,其中B、C为极显著因素,A为不显著因素。交互项AB、AC极显著,BC不显著,二次项C2极显著,A2、B2显著,表明这3个单因素对DS得率的影响不是简单的线性关系,二次项和交互作用均对DS得率有较大影响。
表3 DS得率回归方程方差分析
Table 3 Analysis of variance for regression equations with DS yields
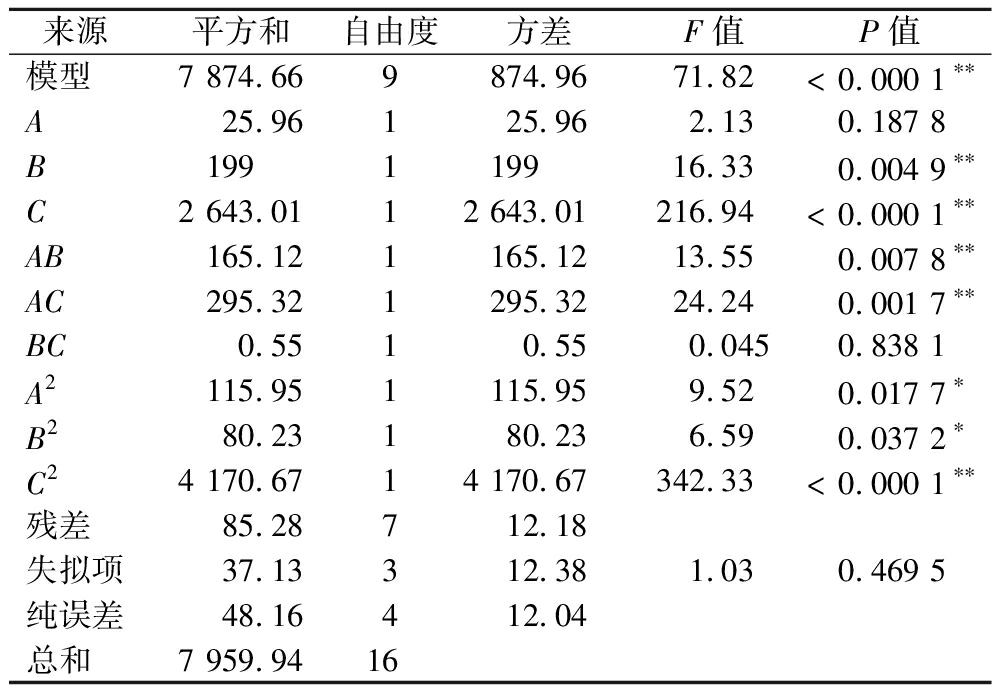
来源平方和自由度方差F值P值模型7 874.669874.9671.82< 0.000 1∗∗A25.96125.962.130.187 8B199119916.330.004 9∗∗C2 643.0112 643.01216.94< 0.000 1∗∗AB165.121165.1213.550.007 8∗∗AC295.321295.3224.240.001 7∗∗BC0.5510.550.0450.838 1A2115.951115.959.520.017 7∗B280.23180.236.590.037 2∗C24 170.6714 170.67342.33< 0.000 1∗∗残差85.28712.18失拟项37.13312.381.030.469 5纯误差48.16412.04总和7 959.9416
注:*, P<0.05为差异显著;**,P<0.01为差异极显著(表4同)。
2.3.3 胶原蛋白提取率的响应面结果分析
由表2中试验数据得到多元拟合回归方程加酶量(A)、提取时间(B)、提取温度(C)为:Y2=50.79-0.92A-1.60B-18.61C+0.29AB+1.38AC-0.64BC-6.38A2-3.59B2-13.69C2
由表4可知,此回归模型P<0.000 1,模型极显著。失拟项P=0.093 4>0.05不显著,表示模型对实验的拟合度较高。回归方程的相关系数R2=0.994 3,校正决定系数R2=0.987 0,变异系数为4.50%<10%,说明罗非鱼皮胶原蛋白的提取实际值和预测值有较好的拟合相关性,试验的重复性较好。
表4 胶原蛋白提取率回归方程方差分析
Table 4 Analysis of variance for regression equation with collagen extraction rate
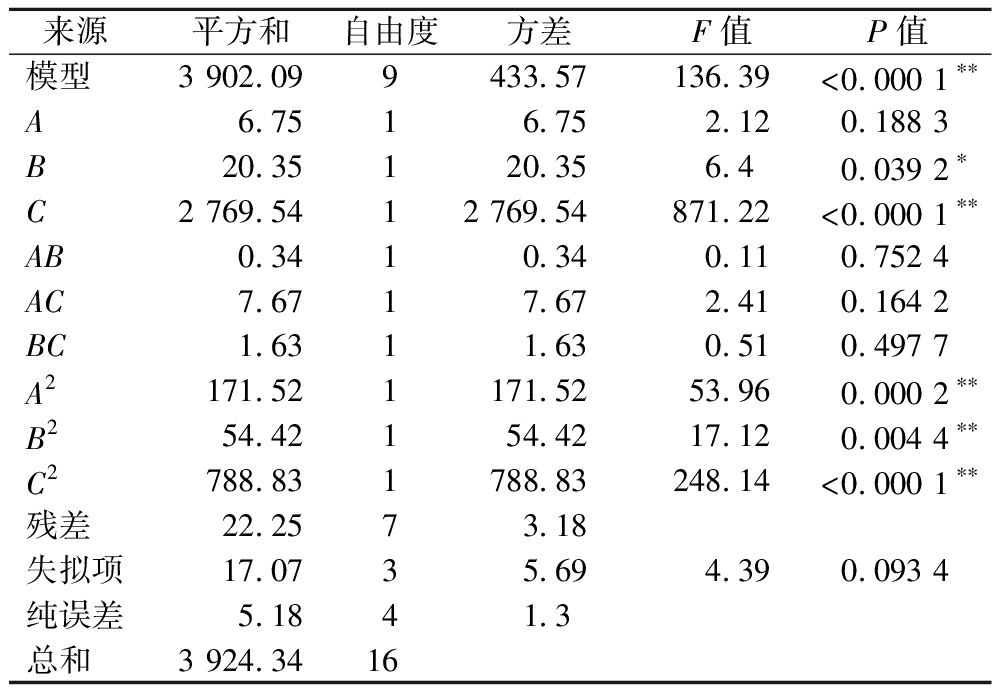
来源平方和自由度方差F值P值模型3 902.099433.57136.39<0.000 1∗∗A6.7516.752.120.188 3B20.35120.356.40.039 2∗C2 769.5412 769.54871.22<0.000 1∗∗AB0.3410.340.110.752 4AC7.6717.672.410.164 2BC1.6311.630.510.497 7A2171.521171.5253.960.000 2∗∗B254.42154.4217.120.004 4∗∗C2788.831788.83248.14<0.000 1∗∗残差22.2573.18失拟项17.0735.694.390.093 4纯误差5.1841.3总和3 924.3416
3个因素对罗非鱼皮胶原蛋白提取率的影响为C>B>A,其中C为极显著因素,B为显著因素,A为不显著因素。交互项AB、AC、BC不显著,二次项C2极显著,A2、B2显著,表明这3个单因素之间的交互作用不明显,对胶原蛋白提取率的影响不是简单的线性关系。
2.3.4 验证实验
通过响应曲面分析得到罗非鱼皮DS及胶原蛋白的最佳提取条件为:中性蛋白酶加酶量5 925.36 U/g,提取时间25.79 h,提取温度28.47 ℃,料液比1∶40(g∶mL),在此条件下,罗非鱼皮DS得率为128.99 mg/100 g,胶原蛋白提取率为53.88%。考虑到实际操作的可行性,将提取工艺修改为:中性蛋白酶加酶量5 930 U/g,提取时间25.8 h,提取温度28.5 ℃,料液比1∶40(g∶mL),在此条件下罗非鱼皮DS得率为132.12 mg/100 g(湿重计),胶原蛋白提取率为53.14%,与预测值接近,进一步证明了该模型的可行性。
2.4 醋酸纤维素薄膜电泳分析
由于不同的糖胺聚糖之间的电荷密度存在差异,在醋酸纤维素薄膜上的迁移率不同,因此可以通过电泳图上条带的分布情况判断样品中含有的糖胺聚糖种类。条带的灰度则可以反映糖胺聚糖的含量,根据条带的深浅可以初步判断样品所含糖胺聚糖的组成。由图6可知,罗非鱼皮DS样品的迁移率与DS、HA一致,DS显色条带下方有较淡条带,这与SALLES等[14]报道的HS显色条带出现位置一致。DS显色条带颜色较深,HA、HS显色条带较浅,说明罗非鱼皮DS样品的主要成分为DS,还含有少量HA、HS。
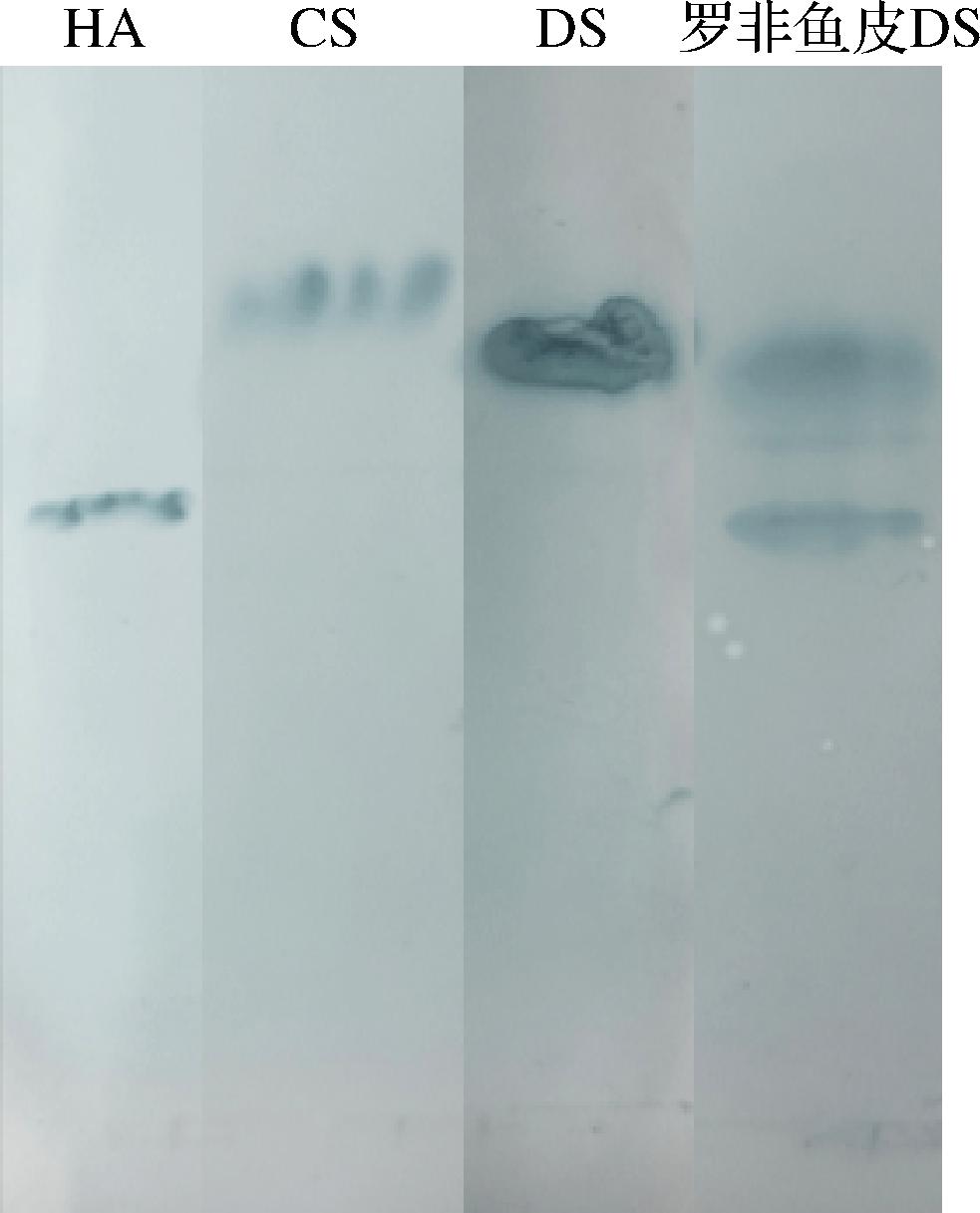
图6 罗非鱼皮DS的电泳图谱
Fig.6 The cellulose acetate membrane electrophoresis of DS from tilapia skin
2.5 聚丙烯酰胺凝胶电泳分析
由图7可知,中性蛋白酶与胃蛋白酶酶解的罗非鱼皮胶原蛋白均含2条α链(α1与α2)和1条β链,可以初步判断出两者均为典型的Ⅰ型胶原蛋白[15]。2种胶原蛋白均在相对分子质量为130和110 kDa附近分别出现α1链和α2链,2条链的灰度比接近2∶1,这与Ⅰ型胶原蛋白典型的[α1]2α2结构一致[16]。与胃蛋白酶相比,中性蛋白酶酶解的罗非鱼皮胶原蛋白α链以下出现的低分子电泳条带较少,表明中性蛋白酶在酶解过程中对胶原蛋白降解作用较小,对胶原蛋白结构的保留更完整。
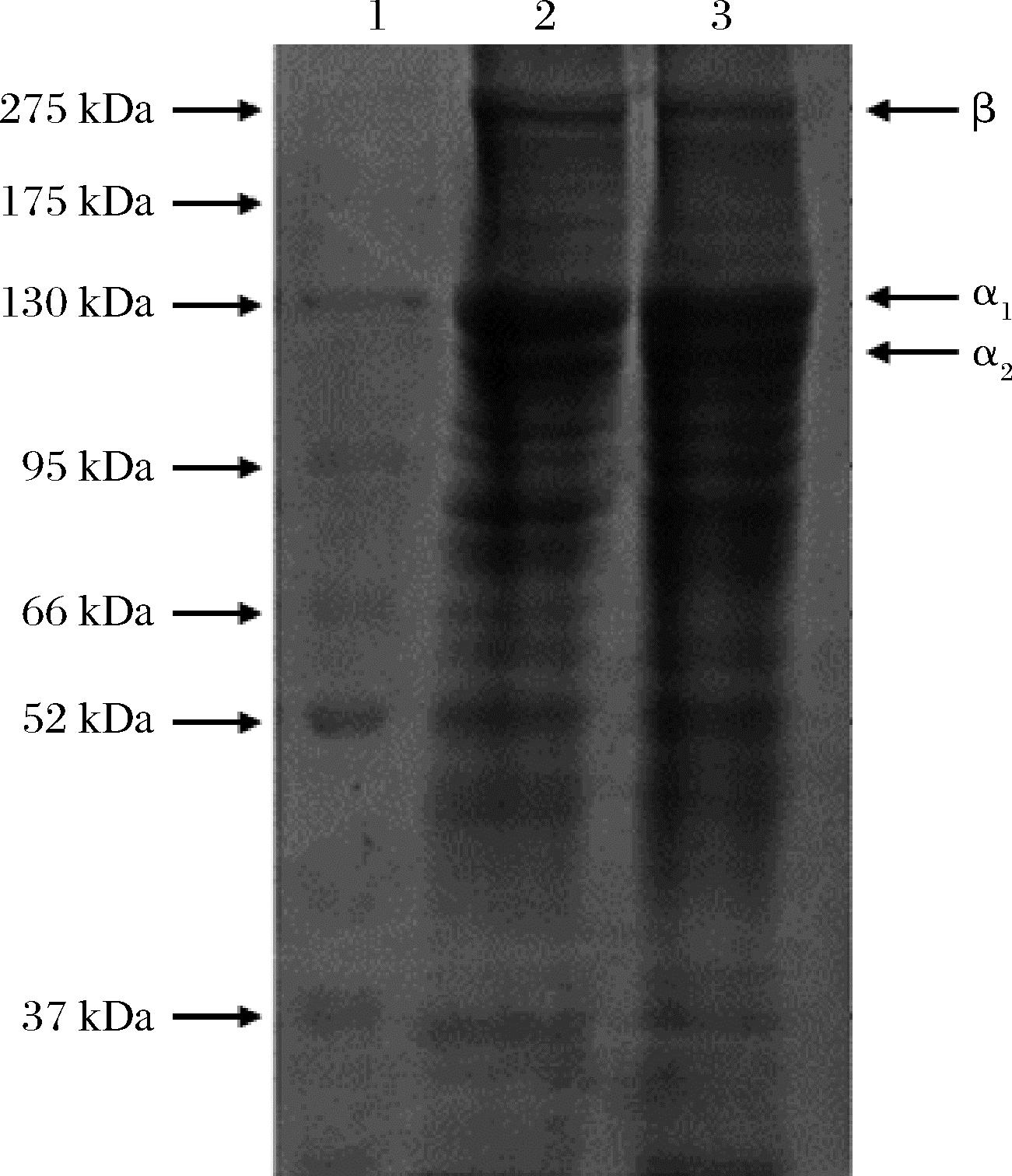
1-Marker;2-中性蛋白酶酶解胶原蛋白; 3-胃蛋白酶酶解胶原蛋白
图7 罗非鱼皮胶原蛋白的电泳图谱
Fig.7 SDS-PAGE pattern of collagens from tilapia skin
2.6 红外光谱扫描分析
2.6.1 DS红外光谱扫描分析
由图8可知,罗非鱼皮DS样品在3 421.65 cm-1处有较宽吸收峰,为O—H和N—H的伸缩振动[17];1 641.39 cm-1处为乙酰氨基中的C![]() O伸缩振动峰[18],1 419.58 cm-1处有C—N 伸缩振动峰,表明了乙酰氨基的存在[19];1 240.20和 856.38 cm-1的吸收分别为S
O伸缩振动峰[18],1 419.58 cm-1处有C—N 伸缩振动峰,表明了乙酰氨基的存在[19];1 240.20和 856.38 cm-1的吸收分别为S![]() O伸缩振动和C—O—S轴向配位伸缩振动,表明罗非鱼皮DS中存在硫酸基团[20];1 053.11 cm-1处的吸收峰,为糖环上的C—O—C和C—O—H的C—O振动峰[21],927.74 cm-1处的吸收峰为吡喃糖的非对称伸缩振动峰[22]。综上分析,罗非鱼皮DS样品是一种含有乙酰氨基和硫酸基,构型为α型吡喃糖的糖胺聚糖。
O伸缩振动和C—O—S轴向配位伸缩振动,表明罗非鱼皮DS中存在硫酸基团[20];1 053.11 cm-1处的吸收峰,为糖环上的C—O—C和C—O—H的C—O振动峰[21],927.74 cm-1处的吸收峰为吡喃糖的非对称伸缩振动峰[22]。综上分析,罗非鱼皮DS样品是一种含有乙酰氨基和硫酸基,构型为α型吡喃糖的糖胺聚糖。
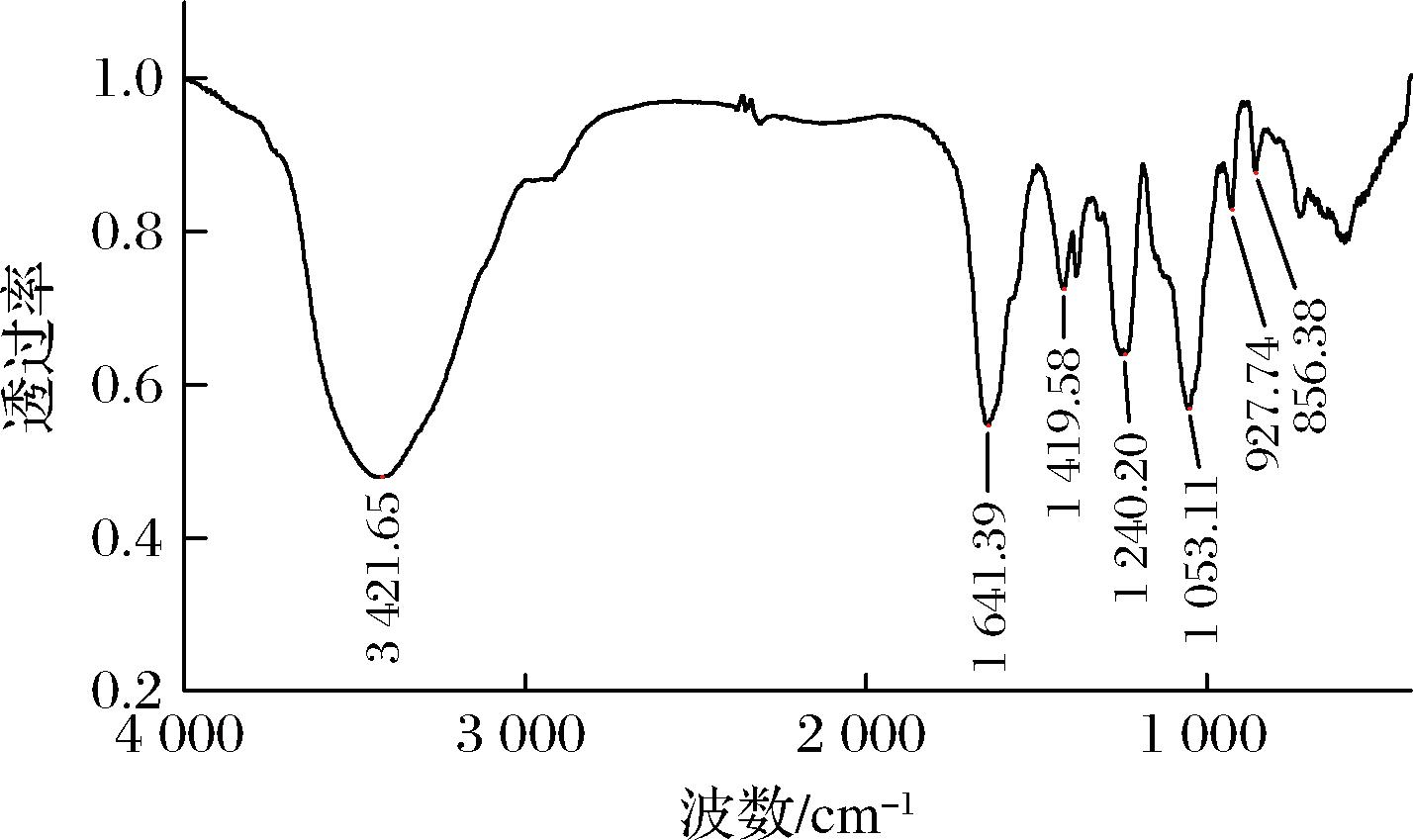
图8 罗非鱼皮DS红外谱图
Fig.8 FTIR spectra of DS from tilapia skin
2.6.2 胶原蛋白红外光谱扫描分析
如图9所示,罗非鱼皮胶原蛋白具有典型的胶原蛋白红外光谱特征吸收峰,即酰胺A、B以及Ⅰ、Ⅱ、Ⅲ吸收峰,与张正雨等[23]报道的罗非鱼皮酶溶性胶原蛋白的吸收峰一致。酰胺A的吸收峰在3 400~3 440 cm-1,为N—H的伸缩振动峰,当N—H基团参与胶原蛋白肽链间氢键形成时,吸收峰会移动到3 300 cm-1附近[24]。罗非鱼皮胶原蛋白酰胺A吸收峰出现在3 325.21 cm-1,说明其结构中含有氢键。酰胺B带的吸收峰是由分子中CH2基团的不对称伸缩振动形成的,出现在2 933.67 cm-1。酰胺Ⅰ带属于C![]() O伸缩振动峰,可用来分析蛋白质的二级结构[25],由β-折叠、无规则卷曲、α-螺旋和β-转角产生的扭转振动峰,分别位于1 600~1 640、1 640~1 650、1 650~1 660、1 660~1 670 cm-1[26]。罗非鱼皮胶原蛋白酰胺Ⅰ带出现在1 654.89 cm-1,表明其二级结构主要由α-螺旋组成。酰胺Ⅱ带由于C—N伸缩振动与N—H弯曲振动的影响,出现在1 543.02 cm-1,这与AHMED等[24]研究结果一致。罗非鱼皮胶原蛋白酰胺Ⅲ带出现在1 240.20 cm-1,表明其螺旋结构完整[27]。酰胺Ⅲ带处的峰值与为1 456.23 cm-1处的比值(0.91)接近1,说明罗非鱼皮胶原蛋白三螺旋结构较完整[28]。上述结果表明,中性蛋白酶提取的罗非鱼皮胶原蛋白的三螺旋结构保留完整,破坏较小。
O伸缩振动峰,可用来分析蛋白质的二级结构[25],由β-折叠、无规则卷曲、α-螺旋和β-转角产生的扭转振动峰,分别位于1 600~1 640、1 640~1 650、1 650~1 660、1 660~1 670 cm-1[26]。罗非鱼皮胶原蛋白酰胺Ⅰ带出现在1 654.89 cm-1,表明其二级结构主要由α-螺旋组成。酰胺Ⅱ带由于C—N伸缩振动与N—H弯曲振动的影响,出现在1 543.02 cm-1,这与AHMED等[24]研究结果一致。罗非鱼皮胶原蛋白酰胺Ⅲ带出现在1 240.20 cm-1,表明其螺旋结构完整[27]。酰胺Ⅲ带处的峰值与为1 456.23 cm-1处的比值(0.91)接近1,说明罗非鱼皮胶原蛋白三螺旋结构较完整[28]。上述结果表明,中性蛋白酶提取的罗非鱼皮胶原蛋白的三螺旋结构保留完整,破坏较小。
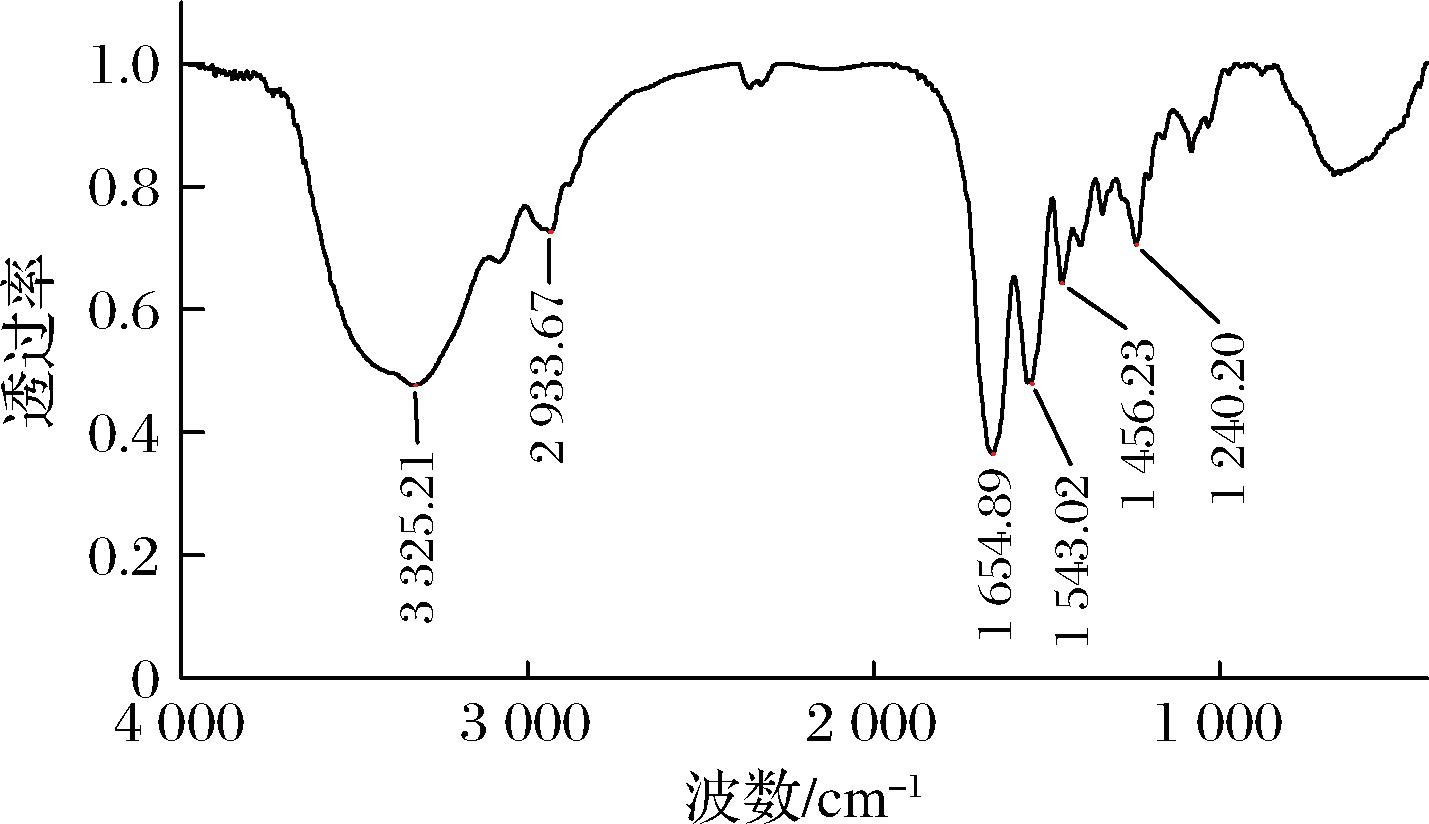
图9 罗非鱼皮胶原蛋白红外谱图
Fig.9 FTIR spectra of collagen from tilapia skin
3 结论
实验通过单因素试验和响应面法优化罗非鱼皮DS及胶原蛋白同时提取的工艺,最优的提取工艺为中性蛋白酶加酶量5 930 U/g,提取时间25.8 h,提取温度28.5 ℃,料液比1∶40(g∶mL),罗非鱼皮DS得率可达132.12 mg/100 g(湿重计),胶原蛋白提取率可达53.14%,与预测值接近,说明响应面法建立的模型稳定可靠。醋酸纤维素薄膜电泳结果显示罗非鱼皮DS样品除含有DS外,还含有少量HA、HS杂质。聚丙烯酰胺凝胶电泳结果显示罗非鱼皮胶原蛋白为典型的Ⅰ型胶原蛋白。红外光谱扫描结果显示罗非鱼皮DS及胶原蛋白的结构完整,其中罗非鱼皮DS样品中还含有其他种类的糖胺聚糖,有待进一步纯化。结果表明优化后的同时提取工艺具有较高的可行性,同时提取制备的DS及胶原蛋白具备典型特征,为罗非鱼皮DS及胶原蛋白在食品和生物医药等领域中的应用提供了一定理论依据。
[1] 赵雲, 桂朗, 陈良标.罗非鱼产业发展现状[J].中国水产, 2020(10):46-48. ZHAO Y, GUI L, CHEN L B.Current situation of tilapia industry development[J].China Fisheries, 2020(10):46-48.
[2] 杨树奇, 曾少葵, 周春霞, 等.3种鱼皮的基本成分及氨基酸组成分析[J].广东海洋大学学报, 2010, 30(1):97-100. YANG S Q, ZENG S K, ZHOU C X, et al.Analysis of proximate and amino acid composition of three fish skins[J].Journal of Guangdong Ocean University, 2010, 30(1):97-100.
[3] 苏永昌, 刘淑集, 刘智禹, 等.罗非鱼下脚料营养成分的分析及评价[J].食品工业科技, 2017, 38(14):285-288;293. SU Y C, LIU S J, LIU Z Y, et al.Analysis and evaluation of nutritional components in tilapia byproduct[J].Science and Technology of Food Industry, 2017, 38(14):285-288;293.
[4] SILA A, BOUGATEF H, CAPITANI F, et al.Studies on European eel skin sulfated glycosaminoglycans:Recovery, structural characterization and anticoagulant activity[J].International Journal of Biological Macromolecules, 2018, 115:891-899.
[5] VALCARCEL J, NOVOA-CARBALLAL R, PÉREZ-MART N R I, et al.Glycosaminoglycans from marine sources as therapeutic agents[J].Biotechnology Advances, 2017, 35(6):711-725.
N R I, et al.Glycosaminoglycans from marine sources as therapeutic agents[J].Biotechnology Advances, 2017, 35(6):711-725.
[6] RODRIGUES J A G, QUINDERÉ A L G, DE QUEIROZ I N L, et al.Purificação, caracterização físico-química e atividade anticoagulante de glicosaminoglicanos isolados da pele de tilápia do nilo (Oreochromis niloticus)[J].Acta Scientiarum Technology, 2011, 33(3):233-242.
[7] 肖瑞祺. 不同物种皮肤来源的胶原蛋白和糖胺聚糖的结构与免疫活性研究[D].济南:山东大学, 2021. XIAO R Q.Study on the structure and immune activity of collagen and glycosaminoglycan from different species of skin[D].Jinan:Shandong University, 2021.
[8] 蒋丽, 陆剑锋, 吕顺, 等.响应面法优化罗非鱼皮酶法脱脂工艺[J].食品工业科技, 2016, 37(6):211-215. JIANG L, LU J F, LYU S, et al.Optimization of enzymatic defatted conditions of tilapia skin by response surface methodology[J].Science and Technology of Food Industry, 2016, 37(6):211-215.
[9] 张虹, 廖文娟.鮟鱇鱼皮硫酸皮肤素的提取[J].食品与发酵工业, 2009, 35(2):166-171. ZHANG H, LIAO W J.Extract of dermatan sulfate from the skin of goosefish(Lophius litulon)[J].Food and Fermentation Industries, 2009, 35(2):166-171. [10] 左格格,钟赛意,陈菁等.罗非鱼加工副产物不同部位硫酸软骨素的制备、理化性质及结构表征[J].食品科学,2022,43(24):67-73. ZUO G G, ZHONG S Y, CHEN J, et al.Preparation, physicochemical properties and structural characterization of chondroitin sulfate from tilapia processing by-products[J]. Food Science, 2022,43(24):67-73.
[11] 杨碧仙, 曹宇, 范琴芳, 等.大鲵皮胶原蛋白制备工艺优化及其抗氧化活性研究[J].食品工业科技, 2020, 41(5):195-200. YANG B X, CAO Y, FAN Q F, et al.Study on optimization of extraction technology of the collagen from Andrias davidianus skin and its antioxidant activity[J].Science and Technology of Food Industry, 2020, 41(5):195-200.
[12] CAO W Q, SHI L F, WENG W Y.Histological distribution and characterization of collagen in European eel (Anguilla anguilla) muscle[J].Journal of Aquatic Food Product Technology, 2020, 29(1):121-131.
[13] AHMED M, VERMA A K, PATEL R.Collagen extraction and recent biological activities of collagen peptides derived from sea-food waste:A review[J].Sustainable Chemistry and Pharmacy, 2020, 18:100315.
[14] SALLES T C, RODRIGUES J A G, BARCELLOS P G, et al.Inhibition of thrombin generation by dermatan sulfate isolated from the skin of Oreochromis niloticus[J].Revista Brasileira De Ciências Agrárias - Brazilian Journal of Agricultural Sciences, 2017, 12(1):98-104.
[15] 邢瀚文, 韩玮, 施文正, 等.响应面法优化固态发酵制备罗非鱼皮胶原蛋白的工艺[J].食品与发酵工业, 2020, 46(20):120-126. XING H W, HAN W, SHI W Z, et al.Optimization of tilapia skin collagen preparation with solid-state fermentation by response surface methodology[J].Food and Fermentation Industries, 2020, 46(20):120-126.
[16] SAMIEI M H, JAMILI S, NIKUKAR H, et al.Isolation and evaluation of collagen from the fish (Thunnus tonggol) skin:A biological material for medical tissue engineering[J].Journal of Shahid Sadoughi University of Medical Sciences, 2022, 21(2):568-589.
[17] CHEN J, ZHOU S Y, WANG Z, et al.Anticoagulant and anti-inflammatory effects of a degraded sulfate glycosaminoglycan from swimming bladder[J].Food Research International, 2022, 157:111444.
[18] BEN MANSOUR M, MAJDOUB H, BATAILLE I, et al.Polysaccharides from the skin of the ray Raja radula.Partial characterization and anticoagulant activity[J].Thrombosis Research, 2009, 123(4):671-678.
[19] ZHOU C, MI S, LI J, et al.Purification, characterisation and antioxidant activities of chondroitin sulphate extracted from Raja porosa cartilage[J].Carbohydrate Polymers, 2020, 241:116306.
[20] LI J H, LI S, WU L M, et al.Ultrasound-assisted fast preparation of low molecular weight fucosylated chondroitin sulfate with antitumor activity[J].Carbohydrate Polymers, 2019, 209:82-91.
[21] KRICHEN F, BOUGATEF H, SAYARI N, et al.Isolation, purification and structural characterestics of chondroitin sulfate from smooth hound cartilage:In vitro anticoagulant and antiproliferative properties[J].Carbohydrate Polymers, 2018, 197:451-459.
[22] BEN MANSOUR M, DHAHRI M, HASSINE M, et al.Highly sulfated dermatan sulfate from the skin of the ray Raja montagui:Anticoagulant activity and mechanism of action[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2010, 156(3):206-215.
[23] 张正雨, 李傲婷, 王凤林, 等.刺参体壁及罗非鱼皮酶促溶性胶原蛋白特性的对比研究[J].食品科学, 2017, 38(21):55-60. ZHANG Z Y, LI A T, WANG F L, et al.Comparative studies on characteristics of pepsin-soluble collagen from sea cucumber (Stichopus japonicas) body wall and tilapia (Oreochromis niloticus) skin[J].Food Science, 2017, 38(21):55-60.
[24] AHMED R, HAQ M, CHUN B S.Characterization of marine derived collagen extracted from the by-products of bigeye tuna (Thunnus obesus)[J].International Journal of Biological Macromolecules, 2019, 135:668-676.
[25] AHMED M, ANAND A, VERMA A K, et al.In-vitro self-assembly and antioxidant properties of collagen type I from Lutjanus erythropterus, and Pampus argenteus skin[J].Biocatalysis and Agricultural Biotechnology, 2022, 43:102412.
[26] 黄丹丹, 马良, 韩霜, 等.超声预处理影响金枪鱼皮胶原酶解工艺及机理初探[J].食品与发酵工业, 2017, 43(4):141-146. HUANG D D, MA L, HAN S, et al.The effect of ultrasonic pretreatment on hydrolysate of Tuna skin and study on its mechanism[J].Food and Fermentation Industries, 2017, 43(4):141-146.
[27] SONG W K, LIU D, SUN L L, et al.Physicochemical and biocompatibility properties of type I collagen from the skin of Nile Tilapia (Oreochromis niloticus) for biomedical applications[J].Marine Drugs, 2019, 17(3):137.
[28] LI J, WANG M C, QIAO Y Y, et al.Extraction and characterization of type I collagen from skin of tilapia (Oreochromis niloticus) and its potential application in biomedical scaffold material for tissue engineering[J].Process Biochemistry, 2018, 74:156-163.