姜黄素类脂溶性生物活性物质有很强的生理活性,但由于它们自身结构的疏水性,基本不溶于水且稳定性很差,导致其应用受到限制[1-2]。纳米结构脂质载体(nanostructure lipid carriers,NLC)是在固体脂质纳米粒(solid lipid nanopaticals,SLN)的基础上发展而来的一种具有特殊结构的纳米脂质载体[3]。它在制备中使用液体脂质和固体脂质组成混合脂质作为油相,易形成不完美晶形,从而有负载率高、稳定性好及能够控制活性物质释放等突出优点[4]。基于以上优点,目前NLC作为一种负载生物活性物质及营养物质的脂质载体在食品、医药、化妆品等方面都有广泛的应用[5]。在NLC制备中,生物活性物质与载体原料及载体原料之间的相容性是影响体系稳定性和负载率的关键因素。基于此,近年来有很多的研究致力于NLC的工艺优化,通过单因素试验、正交试验等筛选优化实验材料,使用差示扫描量热(differential scanning calorimetry,DSC)、傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)等方法对其相容性进行研究[6]。熊文慧[7]探究了番茄红素的配方组成,得到了番茄红素-单硬脂酸甘油酯-牡丹籽油-酪蛋白酸钠的纳米脂质体系,包封率高达(99.76±0.14)%,且稳定性较好,通过DSC和FTIR也表明番茄红素可以很好地包埋在这个体系中。ARAUJO等[8]探究了固体脂质与液体脂质的比例对NLC结构的影响,使用2种不同的液体脂质探究与固体脂质的相容性,从而筛选出较优的液体脂质,并且证明在体系中加入表面活性剂吐温-80利于形成更小的结构。但是这种实验优化方法既费时又费力,对实验结果也很难预测。因此,找到可以快速筛选材料种类以及配方配比的方法尤为重要。
分子模拟技术不仅能够观察到实验可能产生的现象,而且可以探究实验过程中分子间的相互作用机理,还能够直观地观察到各个结构之间的连接状态[9],因而在很多领域中得到广泛关注和应用。耗散粒子动力学(dissipative particle dynamics,DPD)是分子模拟技术中的一种介观模拟方法,用于模拟乳液、微乳液等复杂流体的行为,研究聚合物之间的聚集状态和连接方式[10]。近年来,有研究者将其用于探究药物分子与载体之间的相互作用,筛选适合特定药物的载体物质,但在食品载体体系中运用DPD探究机理的研究很少。
据此,本研究选用符合国家食品安全标准的固液脂质原料和表面活性剂等,以姜黄素为负载营养物,利用DPD模拟来计算负载物与固液脂质以及表面活性剂之间的溶解度参数和相互作用力,预测它们的相容性来筛选适合的原料,再通过正交试验验证,并对制备的姜黄素NLC进行粒径和微观形态表征。研究结果可为NLC载运体系制备提供理论基础及数据参考。
1 实验部分
1.1 模拟方法
1.1.1 体系分子粗粒化
在DPD模拟中首先要将体系中的分子进行粗粒化,根据分子内官能团性质、体积等,将分子中的基团分成若干个珠子,并保持分子特性不变[11]。本实验选用的固体脂质为单硬脂酸甘油酯,液体脂质为中链甘油三酯(medium chain triglycerides,MCT)油、葵花籽油、甜橙油,表面活性剂为卵磷脂、泊洛沙姆188、吐温-80。将单硬脂酸甘油酯划分为长链烃基(A)、极性基团(C)以及连接部分(B);表面活性剂具有两亲性,将卵磷脂划分为亲水基团(B、N、PS)和亲油基团(A),泊洛沙姆分为(EO、PO)两个珠子,吐温-80分为亲水基团(H、F、J)和亲油基团(D);姜黄素是一个对称结构,分成(Q、M)两个珠子;分别用一个珠子代替MCT油(O1)、葵花籽油(O2)、甜橙油(O3)以及水(W)。各分子的粗粒化如图1所示。
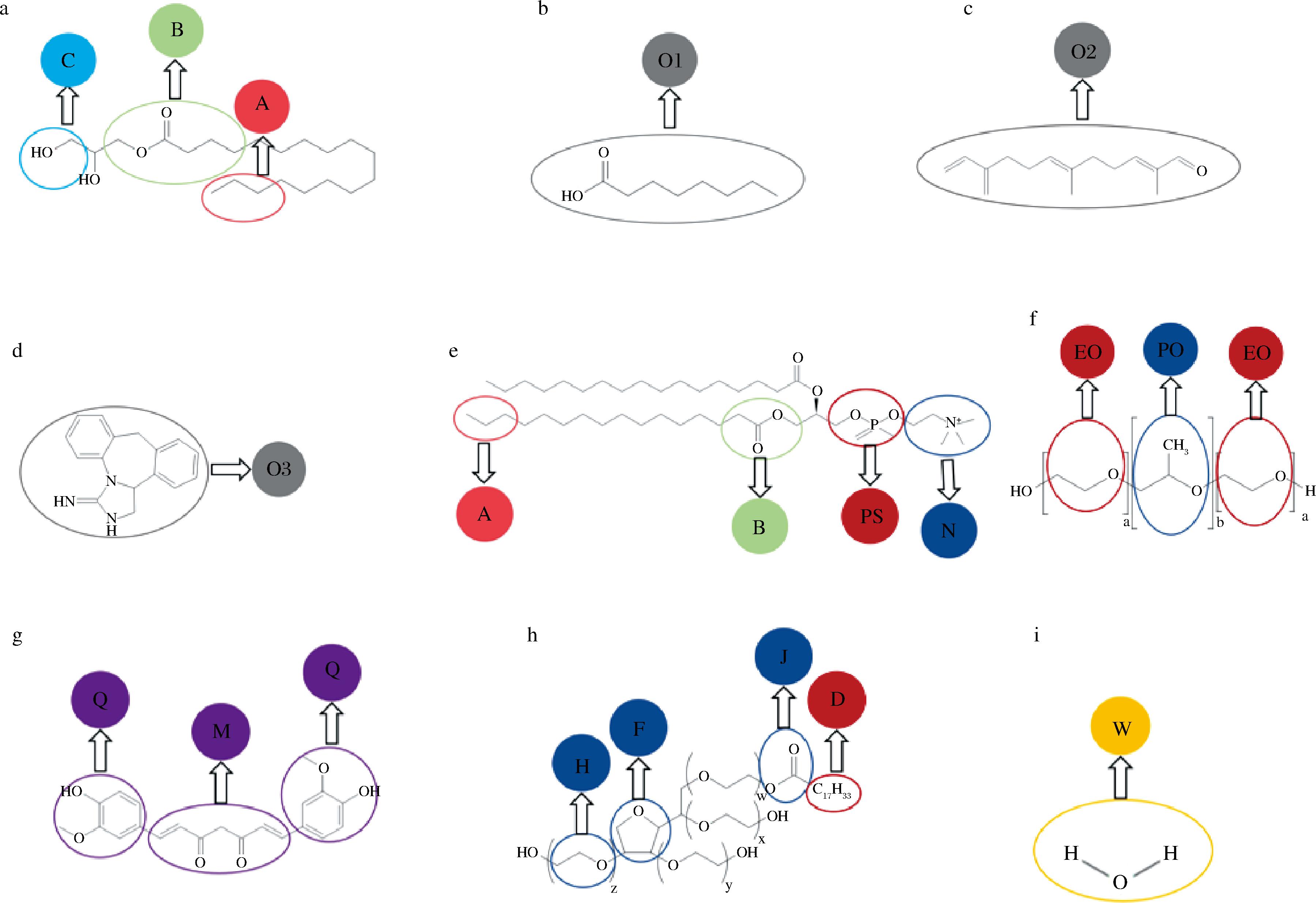
a-单硬脂酸甘油酯;b-中链甘油三酯;c-葵花籽油;d-甜橙油;e-大豆卵磷脂;f-泊洛沙姆;g-姜黄素;h-吐温-80;i-水
图1 材料的分子结构及其粗粒化
Fig.1 Molecular structure and coarse-granulation of materials
1.1.2 相互作用参数
对各组分粗粒化完成后,用Materials Studio 6.0软件中的Amorphous Cell模块计算各珠子在298 K的溶解度参数以及各珠子的摩尔体积,进而计算珠子间的相互作用参数。
同种珠子之间的相互作用参数aiiρ=75kBT,当珠子密度ρ=3时,可得aii=25。珠子间的相互作用力aij与Flory-Huggins参数xij之间存在线性关系[12],如公式(1)所示:
aij=aii+3.27xij
(1)
式中:xij,Flory-Huggins参数。
主要用分子动力学计算溶解度参数的方法来求Flory-Huggins参数,其计算方式如公式(2)所示:
式中:δi和δj,各个珠子的溶解度参数;V,珠子的摩尔体积;R,理想气体常数;T,热力学温度。
对于NLC中各珠子的溶解度参数和摩尔体积如表1所示:
表1 DPD模拟中各珠子的溶解度参数及摩尔体积
Table 1 Solubility parameters and molar volume of beads in DPD simulation
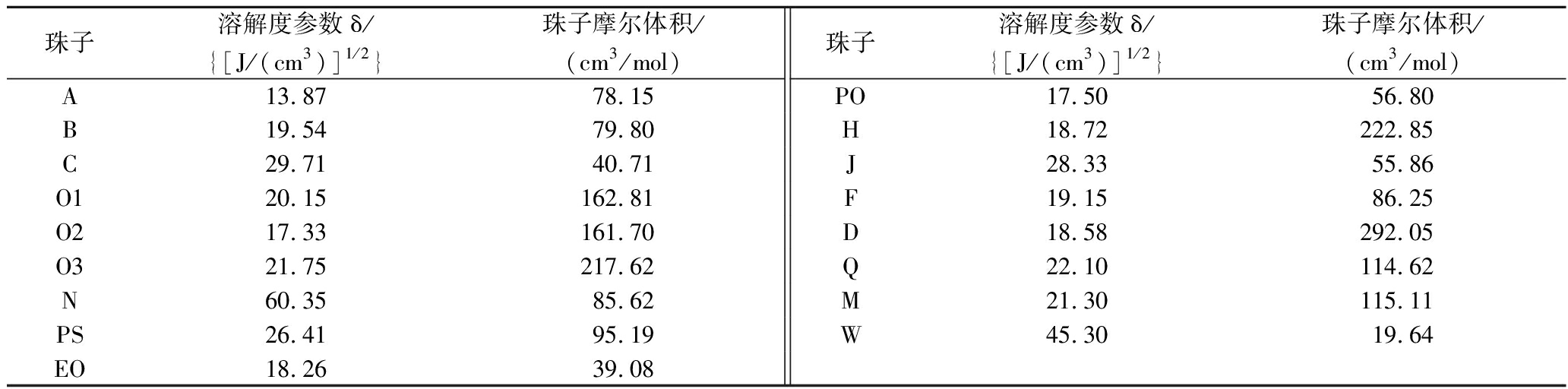
珠子溶解度参数δ/{[J/(cm3)]1/2}珠子摩尔体积/(cm3/mol)珠子溶解度参数δ/{[J/(cm3)]1/2}珠子摩尔体积/(cm3/mol)A13.8778.15PO17.5056.80B19.5479.80H18.72222.85C29.7140.71J28.3355.86O120.15162.81F19.1586.25O217.33161.70D18.58292.05O321.75217.62Q22.10114.62N60.3585.62M21.30115.11PS26.4195.19W45.3019.64EO18.2639.08
根据表1中各个珠子的溶解度参数和摩尔体积,用公式(2)计算出Flory-Huggins参数,然后再进一步利用公式(1)计算出相互作用参数aij,结果如表2所示。
表2 珠子间的相互作用参数aij
Table 2 The interaction parameters between beads

ABCO1O2O3NPSEOPOHJFDQMWA25.00B28.3525.00C44.6733.2225.00O131.2725.0637.2725.00O226.8925.7845.47/25.00O337.1125.9635.79//25.00N258.44206.81103.25580.28327.06354.6925.00PS83.1130.4525.9831.6738.9829.48162.4525.00EO26.4925.1331.9025.4825.1127.06//25.00PO26.1725.3834.5926.6225.0028.27//25.0425.00H29.6725.1346.0025.5225.4926.67////25.00J43.4831.9125.1234.6542.3632.81////41.9825.00F28.0225.0234.3425.1625.5426.35////25.0433.9125.00D30.4225.2352.1925.7425.4728.38////25.0146.8125.0825.00Q33.6125.8430.9325.6929.1525.03218.2327.5726.4927.3927.5429.3626.1528.3225.00M32.0425.4032.2725.2427.8825.04226.8928.6225.9426.6426.4830.5725.6126.9925.1025.00W88.7368.5634.68101.15118.62111.7940.7352.0453.3363.98138.0039.3472.76171.7872.6676.1925.00
注:图中“/”表明这两个珠子不会在同一个体系中出现。
1.2 实验方法
1.2.1 材料与试剂
单硬脂酸甘油酯(纯度≥95%)、卵磷脂(纯度≥90%),广州市齐湘生物技术有限公司;中链甘油三酯,广州耶商贸易公司;姜黄素(纯度≥90%),上海源叶生物科技有限责任公司;无水乙醇,广东光华科技股份有限公司。
1.2.2 仪器与设备
AH-BASIC高压均质机,江苏ATS工业系统有限公司;FJ200高速分散均质搅拌机,上海弗鲁克流体机械制造有限公司;UV-2500紫外可见分光光度计,德国斯派克分析仪器公司;纳米粒度及Zeta电位分析仪,英国Malvern公司;高速离心机,美国Beckman Coulter公司;MP41+MDX4光学显微镜,广州市明美光电技术有限公司。
1.2.3 NLC制备
量取蒸馏水置于烧杯中,在水中加入表面活性剂卵磷脂,混匀即得到水相,备用。称取姜黄素、单硬脂酸甘油酯和MCT油混合后,将混合物加热到85 ℃(比固体脂质熔点高5 ℃)制得姜黄素悬液。将加热后的油相立即与加热到相同温度的水相按比例混合,将混合液在14 000 r/min下剪切处理3 min后,利用高压均质机在一定压力下均质后迅速冷却即得到NLC。
1.2.4 包封率的测定
姜黄素对照品:准确称取姜黄素10.2 mg,置于100 mL棕色容量瓶中,无水乙醇溶解并定容至刻度,混匀,即得0.102 mg/mL的姜黄素溶液。
标准曲线绘制:精密量取上述姜黄素溶液100、200、300、400、500、600、700 μL于100 mL棕色量瓶中,加无水乙醇稀释,定容、摇匀,即得1.02、2.04、3.06、4.08、5.10、6.12、7.14 μg/mL的系列标准溶液。以无水乙醇作空白,在432 nm处测定吸光度,以吸光度(A)对浓度(C)进行线性回归。
包封率测定:将姜黄素脂质体溶液1 mL离心30 min,分离下层沉淀,加无水乙醇溶解定容至100 mL,测得姜黄素含量(A1);另外,将相同姜黄素脂质体溶液1 mL直接加无水乙醇溶解定容至100 mL,测得姜黄素含量(A2),包封率的计算如公式(3)所示:
包封率/%=A1/A2×100
(3)
1.2.5 NLC粒径的测定
利用纳米粒度及Zeta-电位分析仪测定姜黄素NLC的粒径。样品在测试前先使用去离子水对原乳液稀释100倍,润洗后吸取适量(约为比色皿的1/3)的待测液加入石英比色皿中,测试的参数为:水的折射率1.33,测试温度25 ℃,每个样品平行测定3次,取平均值。
1.2.6 NLC电位的测定
利用纳米粒度及Zeta电位分析仪测定NLC的电位。样品在测试前先使用去离子水对原样稀释100倍,润洗后吸取适量(约恰好将比色皿装满)的待测液加入专用的比色皿中,测试参数为:水的折射率1.33,测试温度25 ℃,每个样品平行测定3次,取平均值。
1.2.7 NLC的微观结构
将姜黄素NLC用去离子水稀释10倍后,取15 μL的稀释液滴到显微镜载玻片的中间位置并盖上盖玻片,静置10 s,使用光学显微镜在10倍的放大倍数下观察姜黄素NLC的微观状态,并用数字图像分析软件MS Shot软件拍照保存图像。
1.3 统计分析
本文涉及到的实验和模拟如无特殊说明均进行3组平行实验或3次模拟,使用Origin 2019 Pro软件计算标准差并作图,使用SPSS软件对数据进行差异显著性分析。
2 结果与分析
2.1 液体脂质种类对NLC形成的影响
图2是以单硬脂酸甘油酯为固体脂质,分别以MCT油、葵花籽油、甜橙油为液体脂质所得3种姜黄素NLC体系的聚集状态以及截面图。为了更好地观察载体结构,隐藏了水分子。模拟中设置脂质总量占体系的9%(质量分数,下同),单硬脂酸甘油酯与液体脂质比例设置为1∶3(质量比,下同),液体脂质占总脂质含量的25%(质量分数,下同),姜黄素含量占脂质含量的1%。
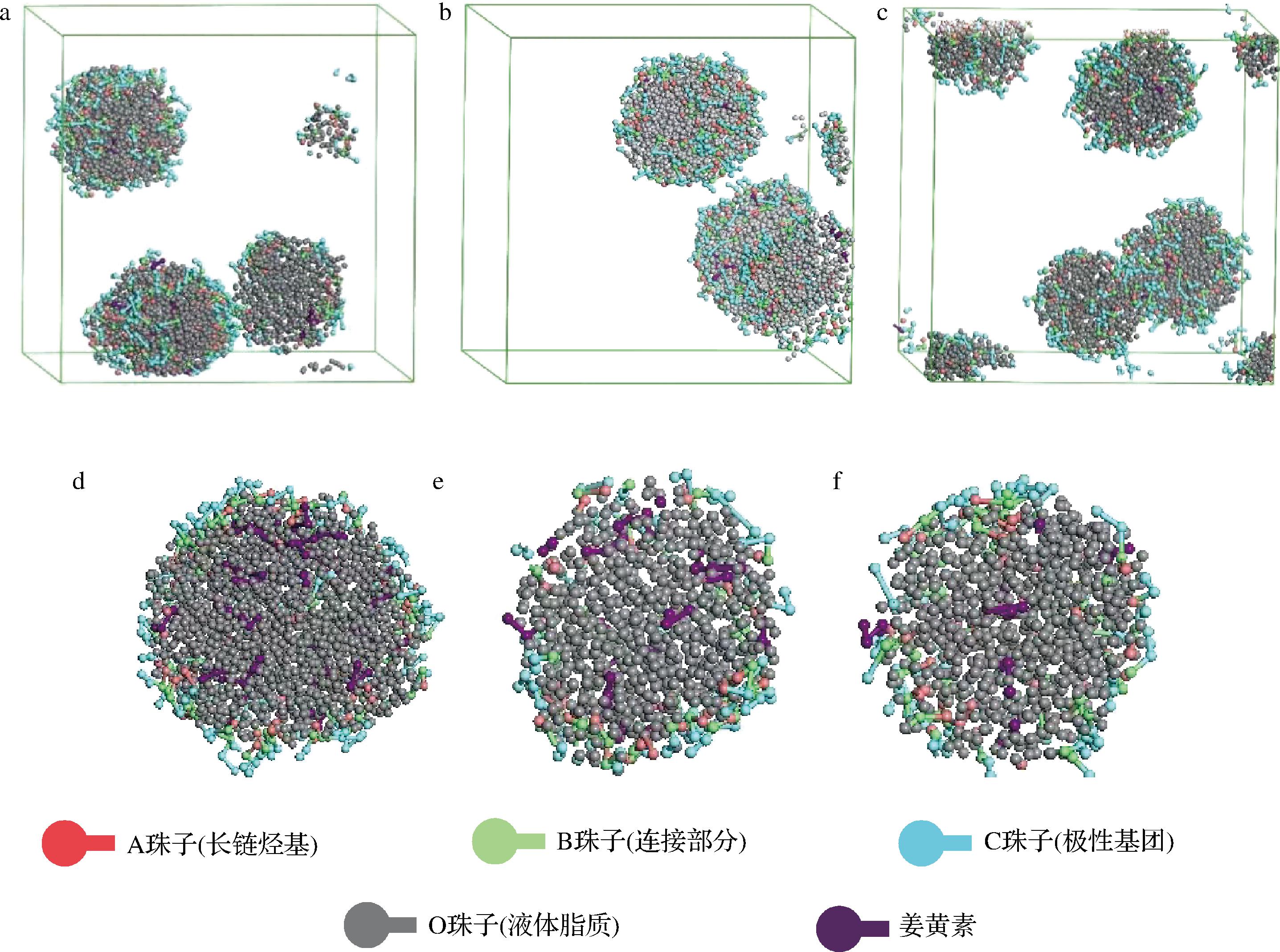
a-MCT油NLC的聚集图;b-葵花籽油NLC的聚集图;c-甜橙油NLC的聚集图;d-MCT油NLC的截面图; e-葵花籽油NLC的截面图;f-甜橙油NLC的截面图
图2 不同液体脂质形成NLC的聚集图与截面图
Fig.2 Aggregation and cross section of NLC formed by different liquid lipids
从图2中可以看出,3个体系都能很好的聚集成球,但单硬脂酸甘油酯-葵花籽油NLC和单硬脂酸甘油酯-甜橙油NLC两种体系所负载的姜黄素大部分分布在脂质载体的表面,而单硬脂酸甘油酯-MCT油NLC负载的姜黄素大部分被包埋在脂质载体中间,仅有少量在载体表面。从截面图中也可以看出单硬脂酸甘油酯-MCT油体系形成的NLC更为紧密,这可能是由于MCT油作为一种通过化学合成方法获得的油脂,溶解性、黏度、表面张力与天然的植物油有所区别,而且MCT油脂肪酸链长比较短,亲水性也比较高,能够更好地与单硬脂酸甘油酯结合[13]。
2.2 液体脂质含量对NLC形成的影响
液体脂质含量对NLC形成有很大的影响,液体脂质对营养物的溶解度比固体脂质要高,所以在脂质体系中液体脂质的含量越高,营养物的负载率就越高,但是液体脂质的添加量也不可以无限增加[14]。有研究表明,过高的液体脂质含量可能会造成营养物质的突释,使营养物暴露在载体体系的表面,达不到最佳的效果[15]。根据上述实验结果,选择MCT油作为液体脂质,设置3∶1、2∶1、1∶1、1∶2、1∶3(质量比,下同)的固液脂质比例,采用DPD模拟的方法,探究不同液体脂质含量对NLC形成的影响,以筛选单硬脂酸甘油酯-MCT油NLC中适合的固液脂质比例。
从图3中可以看出,不同比例的固液脂质影响脂质载体的粒径。固体脂质含量较高时,形成的脂质载体的粒径较大,随着液体脂质含量的增加,引起脂质载体表面张力的改变,粒径变小。APOSTOLOU等[14]研究中表明固体脂质含量高时,颗粒大小有增加的趋势。图3所示,当固液脂质比例在1∶1时,形成的粒径最小,但是所形成的球状结构不规则。从截面图中可以看出,固液脂质比例为3∶1和2∶1时,单硬脂酸甘油酯不只是分布在NLC的表面,在球状结构的内部也存在。固液脂质比例在1∶2和1∶3时形成的球状结构较好,但当比例为1∶2时,有少量的姜黄素分布在NLC的表面。熊文慧[7]的研究也表明,NLC载体体系中液体脂质含量越高时体系的平均粒径越小,稳定性越好。麦琬婷等[16]的研究结果也表明液体脂质比固体脂质含量高时粒径小、包封率和载药量高。综上所述,选择1∶3作为合适的固液脂质比例。


a-3∶1比例形成的NLC聚集图;b-2∶1比例形成的NLC聚集图;c-1∶1比例形成的NLC聚集图;d-1∶2比例形成的NLC聚集图; e-1∶3比例形成的NLC聚集图;f-3∶1比例形成的NLC截面图;g-2∶1比例形成的NLC截面图; h-1∶1比例形成的NLC截面图;i-1∶2比例形成的NLC截面图;j-1∶3比例形成的NLC截面图
图3 不同固液脂质比例形成的NLC聚集形态图及截面图
Fig.3 NLC aggregation morphology and section of different solid-liquid lipid ratios
2.3 姜黄素用量对NLC形成的影响
在制备纳米结构脂质载体时,因营养物的加入会影响脂质载体的成型,营养物的添加量也是影响脂质载体结构及其性能的一个重要因素,用量过大或过少都可能会造成营养物的突释,导致营养物分布不均甚至不能包埋在载体中[17]。设置姜黄素含量分别占脂质含量的1%、3%、5%(质量分数,下同)作为模拟条件,用DPD模拟探究不同含量的姜黄素对NLC形成的影响,结果见图4。
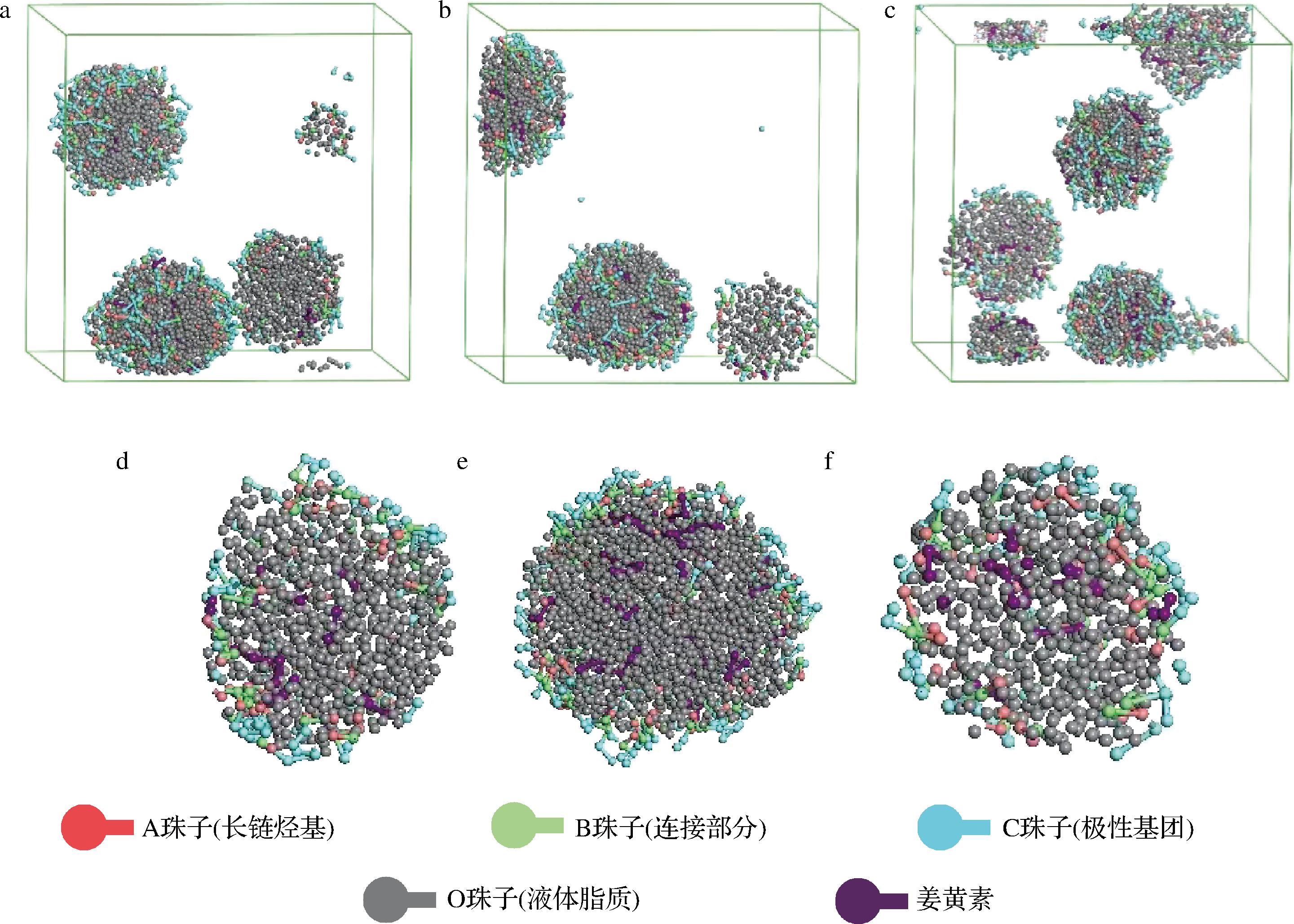
a-姜黄素1%NLC的聚集图;b-姜黄素3%NLC的聚集图;c-姜黄素5%NLC的聚集图;d-姜黄素1%NLC的截面图; e-姜黄素3%NLC的截面图;f-姜黄素5%NLC的截面图
图4 不同姜黄素含量形成的NLC的聚集图与截面图
Fig.4 Aggregation and cross section of NLC with different curcumin contents
从图4中可以看出,在相同的盒子大小下,姜黄素添加量不同所形成的NLC的粒径也有很大差别,姜黄素含量在3%时粒径相对较小。在体系中加入的营养物会与其他组分相互作用,可能导致形成的脂质载体的形态各不相同,同时营养物添加量不同也可能导致其在脂质载体中的分布位置发生改变。根据已有文献可知,营养物的添加量对载体体系的负载率影响较为明显,李达鸿[18]探究了不同番茄红素添加量对番茄红素纳米乳液包封率的影响,结果表明营养物添加量过低或过高都会导致负载率较低。在单硬脂酸甘油酯-MCT油体系中,姜黄素含量占脂质含量1%和3%时,姜黄素都基本上被包埋在NLC中。姜黄素含量过多就会使过剩的部分被排除到脂质载体的表面。营养物本身也是参与形成NLC的一个部分,所以适当的添加量不仅能够形成良好的球状结构,而且不会造成营养物浪费。
2.4 表面活性剂种类及用量对NLC形成的影响
为了使脂质载体更加稳定,在制备脂质载体的过程中通常会加入表面活性剂,以降低溶液的表面张力[19]。表面活性剂的种类包括离子型表面活性剂、非离子型表面活性剂以及两亲性表面活性剂。本实验选择卵磷脂、泊洛沙姆188、吐温-80三种表面活性剂,探究其种类和用量对基于单硬脂酸甘油酯-MCT油的NLC体系形成的影响。
2.4.1 卵磷脂作为表面活性剂对NLC形成的影响
卵磷脂是一种两亲性表面活性剂,也是比较温和的表面活性剂,它在分子的一端同时存在酸性基团和碱性基团[20]。卵磷脂的碳氢链可以镶嵌入单硬脂酸甘油酯中,形成外壳包裹固体脂质和液体脂质,其亲水基团带有负电荷,与单硬脂酸甘油酯的羟基作用,产生静电斥力来稳定体系[11]。从图5中可以看出,卵磷脂在脂质载体表面分布比较均匀,在含量为4%时就能很好地将脂质载体覆盖住,说明其是较适宜制备NLC的表面活性剂。卵磷脂含量也会影响脂质载体的聚集形态以及粒径,当卵磷脂的含量升高至8%时,粒径明显增大,而且形成的球形结构没有含量为4%和6%时好。
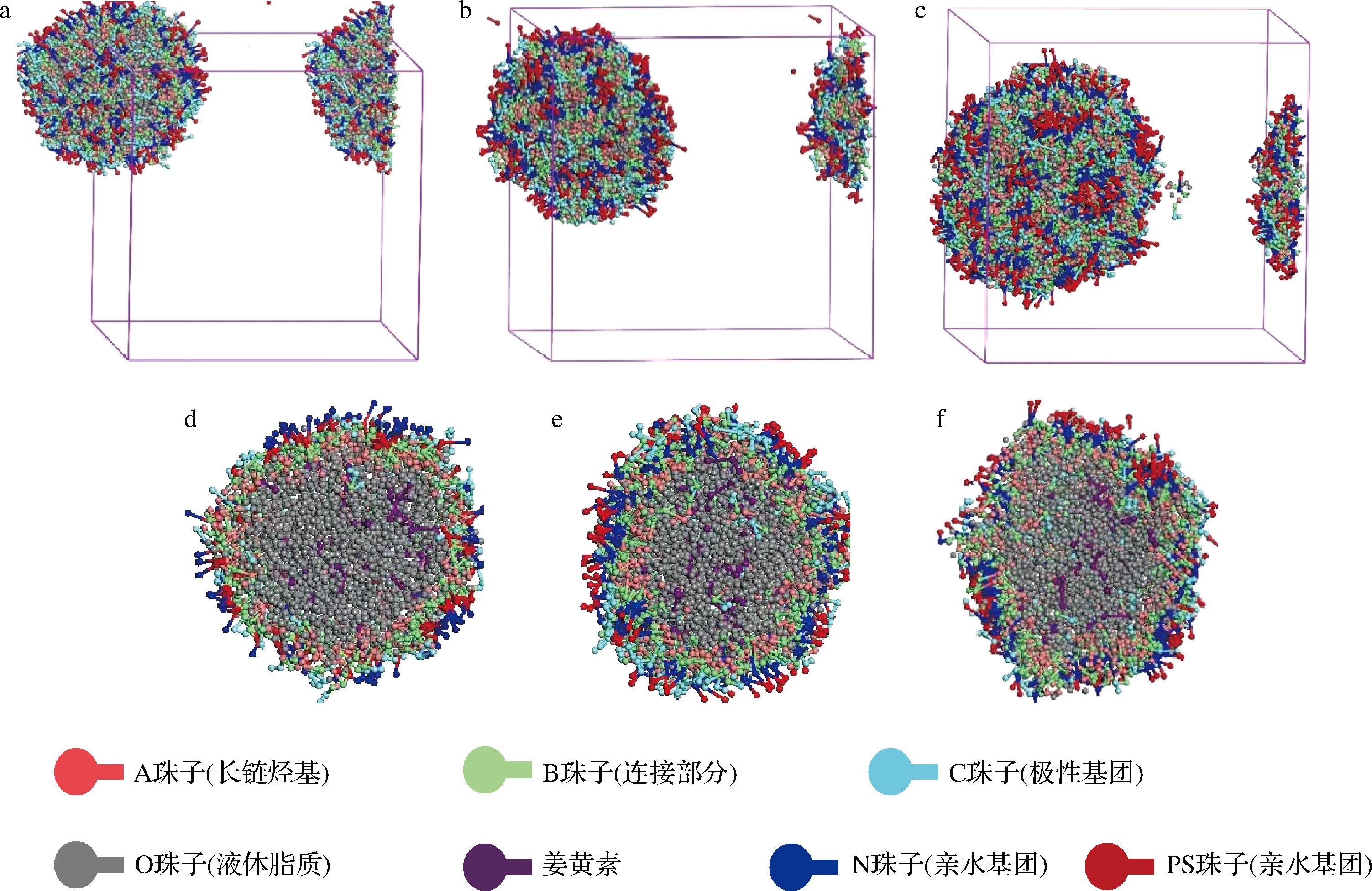
a-4%卵磷脂NLC的聚集图;b-6%卵磷脂NLC的聚集图;c-8%卵磷脂NLC的聚集图;d-4%卵磷脂NLC的截面图; e-6%卵磷脂NLC的截面图;f-8%卵磷脂NLC的截面图
图5 不同卵磷脂含量对NLC形成的影响
Fig.5 Effects of different lecithin contents on NLC formation
2.4.2 泊洛沙姆作为表面活性剂对NLC形成的影响
亲水亲油平衡值(hydrophilic-Lipophilic Balance,HLB)表示表面活性剂分子中亲水基和亲油基之间的大小和力量平衡程度的量。泊洛沙姆188是一类HLB值为16的高分子非离子表面活性剂,有较强的表面活性,它的聚氧乙烯链具有相对亲水性,聚氧丙烯链具有相对亲油性[21]。从图6中可以看出,3个不同浓度的泊洛沙姆188均与单硬脂酸甘油酯和MCT油混溶在一起,并没有作为表面活性剂覆盖在球形结构的表面,反而是姜黄素大都分布在表面。从表1的溶解度参数中可以看出泊洛沙姆188两个珠子的溶解度分别为18.26、17.50(J/cm3)1/2,与单硬脂酸甘油酯和MCT油珠子的溶解度参数非常相近,这可能是导致这几种物质混溶在一起,没有形成球壳结构的原因。从模拟结果初步判断泊洛沙姆188可能不适合作为单硬脂酸甘油酯-MCT油这一体系的表面活性剂。

a-4%泊洛沙姆NLC的聚集图;b-6%泊洛沙姆NLC的聚集图;c-8%泊洛沙姆NLC的聚集图;d-4%泊洛沙姆NLC的截面图; e-6%泊洛沙姆NLC的截面图;f-8%泊洛沙姆NLC的截面图
图6 不同泊洛沙姆188含量对NLC形成的影响
Fig.6 Influence of different poloxamer 188 contents on NLC formation
2.4.3 吐温-80作为表面活性剂对NLC形成的影响
吐温-80是一种非离子型小分子表面活性剂,因其极易在油水界面展开,降低表面张力能力强,形成的脂质载体的粒径也较小,且对pH和离子强度不敏感,因此在有关载体的制备研究中被广泛使用[22]。本实验在模拟时设置吐温-80用量分别为4%、6%、8%,结果发现吐温-80加入到脂质载体中后,与泊洛沙姆类似,也出现了与单硬脂酸甘油酯和MCT油的混溶现象。从表1溶解度参数中也可以看出,将吐温-80根据性质划分的4个珠子的溶解度参数与单硬脂酸甘油酯以及MCT油的溶解度参数数值相差不大,各个珠子之间的相互作用力也较小,所以极易混到一起,产生了图7中所出现的混溶现象。ROHMAH等[23]以棕榈硬脂和棕榈油为固液脂质,以吐温-80为液体脂质制备负载β-胡萝卜素的纳米结构脂质载体通过响应面法就可以得到粒径为166 nm的良好载体体系,可能是由于棕榈硬脂、棕榈油与吐温-80之间有较强的相互作用,能够形成较好的球壳结构将β-胡萝卜素包封在脂质载体中。
综上所述,对于姜黄素-单硬脂酸甘油酯-MCT油体系来说,在这3种表面活性剂中,效果较好的是两亲性表面活性剂卵磷脂,能够稳定在NLC的表面,从而形成很好的球壳结构。另外,从模拟结果可以看出,表面活性剂的含量并不是越高越好,较高的表面活性剂含量也会造成体系的不稳定。就卵磷脂而言,在姜黄素-单硬脂酸甘油酯-MCT油体系中含量到达8%时,体系粒径增大,而且在表面分布不均匀,形成的球形也不规则,所以在选择一种较好的表面活性剂的同时也要注意其用量。
2.5 负载姜黄素NLC的制备
根据DPD模拟得到的结果进行正交试验。在制备NLC时采用高压均质的方法,压力的过大和过小都会对原料的物理、化学及结构性质产生不同的影响进而影响负载量,所以在正交试验时将均质压力也作为一个实验因素。本实验选用L9(34)正交试验表,考察固液脂质比例、姜黄素含量、卵磷脂含量、高压均质压力4个因素对姜黄素负载率的影响,结果及分析如表4、表5所示。
表3 正交试验因素水平表
Table 3 Level table of orthogonal experimental factors

水平固液脂质比例姜黄素含量/%卵磷脂含量/%均质压力/MPa11∶2136021∶3348031∶455100

a-4%吐温-80 NLC的聚集图;b-6%吐温-80 NLC的聚集图;c-8%吐温-80 NLC的聚集图;d-4%吐温-80 NLC的截面图; e-6%吐温-80 NLC的截面图;f-8%吐温-80 NLC的截面图
图7 不同吐温-80含量对NLC形成的影响
Fig.7 Influence of different Tween-80 content on NLC formation
表4 正交试验结果
Table 4 Orthogonal experimental results
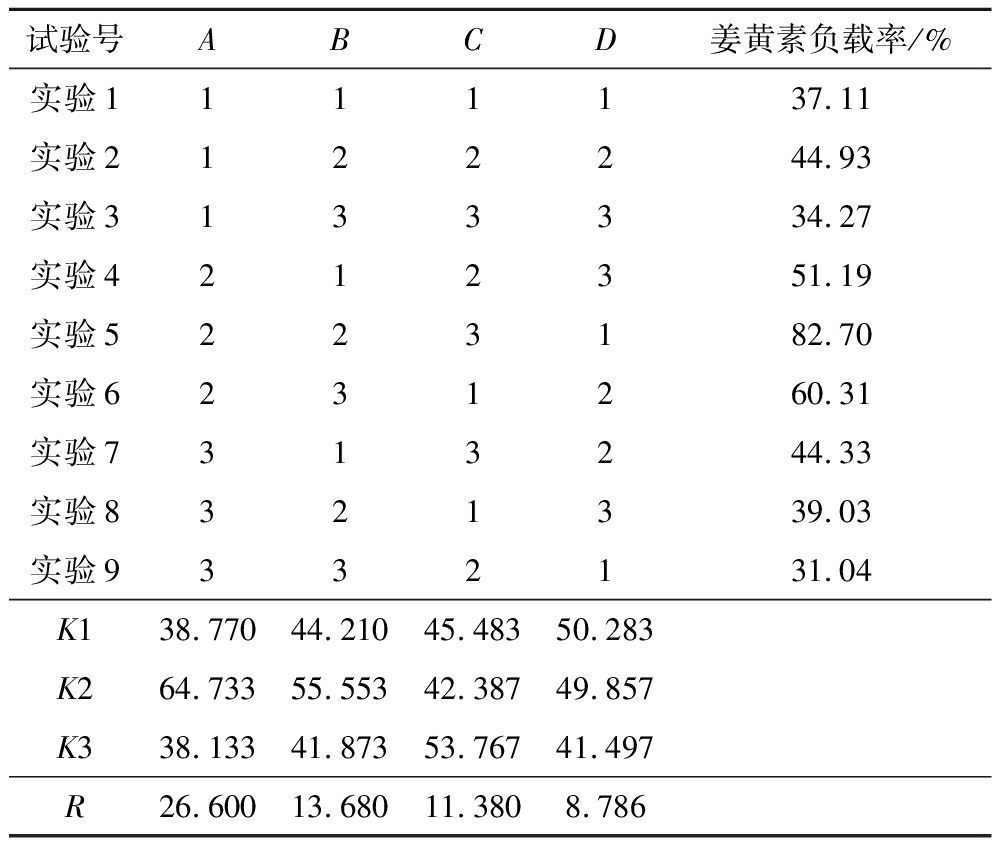
试验号ABCD姜黄素负载率/%实验1111137.11实验2122244.93实验3133334.27实验4212351.19实验5223182.70实验6231260.31实验7313244.33实验8321339.03实验9332131.04K138.77044.21045.48350.283K264.73355.55342.38749.857K338.13341.87353.76741.497R26.60013.68011.3808.786
表5 正交试验方差分析表
Table 5 Analysis of variance of orthogonal experiment
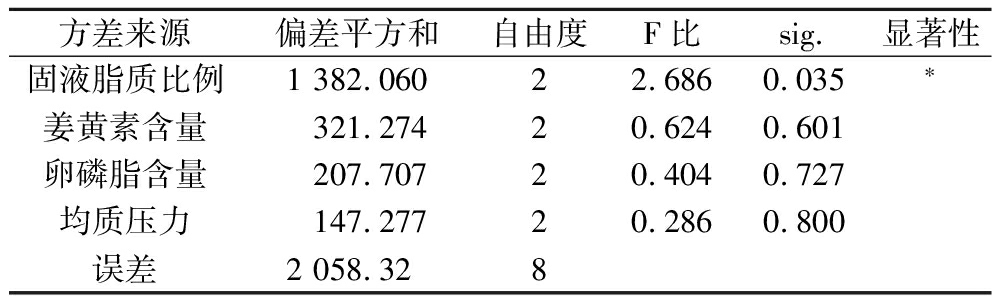
方差来源偏差平方和自由度F比sig.显著性固液脂质比例1 382.06022.6860.035∗姜黄素含量321.27420.6240.601卵磷脂含量207.70720.4040.727均质压力147.27720.2860.800误差2 058.328
注:*表示具有显著性差异,P<0.05。
从表4中可以得到RA>RB>RC>RD,表明这4个因素中,对姜黄素负载率影响大小顺序是:固液脂质比例>姜黄素含量>卵磷脂含量>均质压力,其中固液脂质比例对姜黄素负载率的影响较为明显。从方差分析表5中可以看出固液脂质比例的sig.<0.05,说明固液脂质比例对姜黄素负载率的影响显著,而其他因素的sig.>0.1,说明其他3个因素对姜黄素负载率影响较小。DPD模拟结果与正交试验结果均表明固液脂质比例为1∶3,姜黄素占总脂质含量3%时形成的NLC效果最好。另外,在DPD模拟中发现,随着卵磷脂含量的增大,形成的NLC的粒径也随着增大,最适宜的含量为4%,但在正交试验中得到的最佳卵磷脂含量为5%。由于模拟中没有设置卵磷脂含量为5%这一条件,所以根据正交试验结果,选择卵磷脂含量为5%,再次进行模拟,结果如图8所示。从图中可以看出以5%卵磷脂为乳化剂形成的姜黄素NLC结构更规则,姜黄素分布较集中,基本被包裹在脂质中心。ZHU等[24]也在研究中使用卵磷脂作为乳化剂代替蛋白,结果表明卵磷脂含量为5%和7%时提高了乳液的物理稳定性,降低了平均粒径,提高了ζ电位值,特别是含量为5%的卵磷脂显示出更高的脂肪消化率和程度。综上,选定A2B2C2D1即固液脂质比例为1∶3,姜黄素含量3%,卵磷脂含量5%,均质压力60 MPa作为制备姜黄素纳米结构脂质载体的优化工艺条件。

a-聚集图;b-截面图
图8 卵磷脂含量为5%形成的姜黄素NLC
Fig.8 Curcumin NLC formed by 5% lecithin
2.6 姜黄素NLC的粒径、Zeta电位及微观形态
根据DPD模拟与正交试验得到的最优原料配比进行NLC的制备。一般来说,粒径<500 nm时,体系就可以被认定为纳米结构。从图9-a中可以看出,姜黄素NLC的平均粒径在(233.8±2.4) nm,体系PDI值为0.19±0.2,表明制备的姜黄素NLC体系粒径较小且均匀。图9-b可以看出,新鲜制备的姜黄素NLC液滴清晰可见,分散均匀,体系中没有明显的液滴聚集现象。
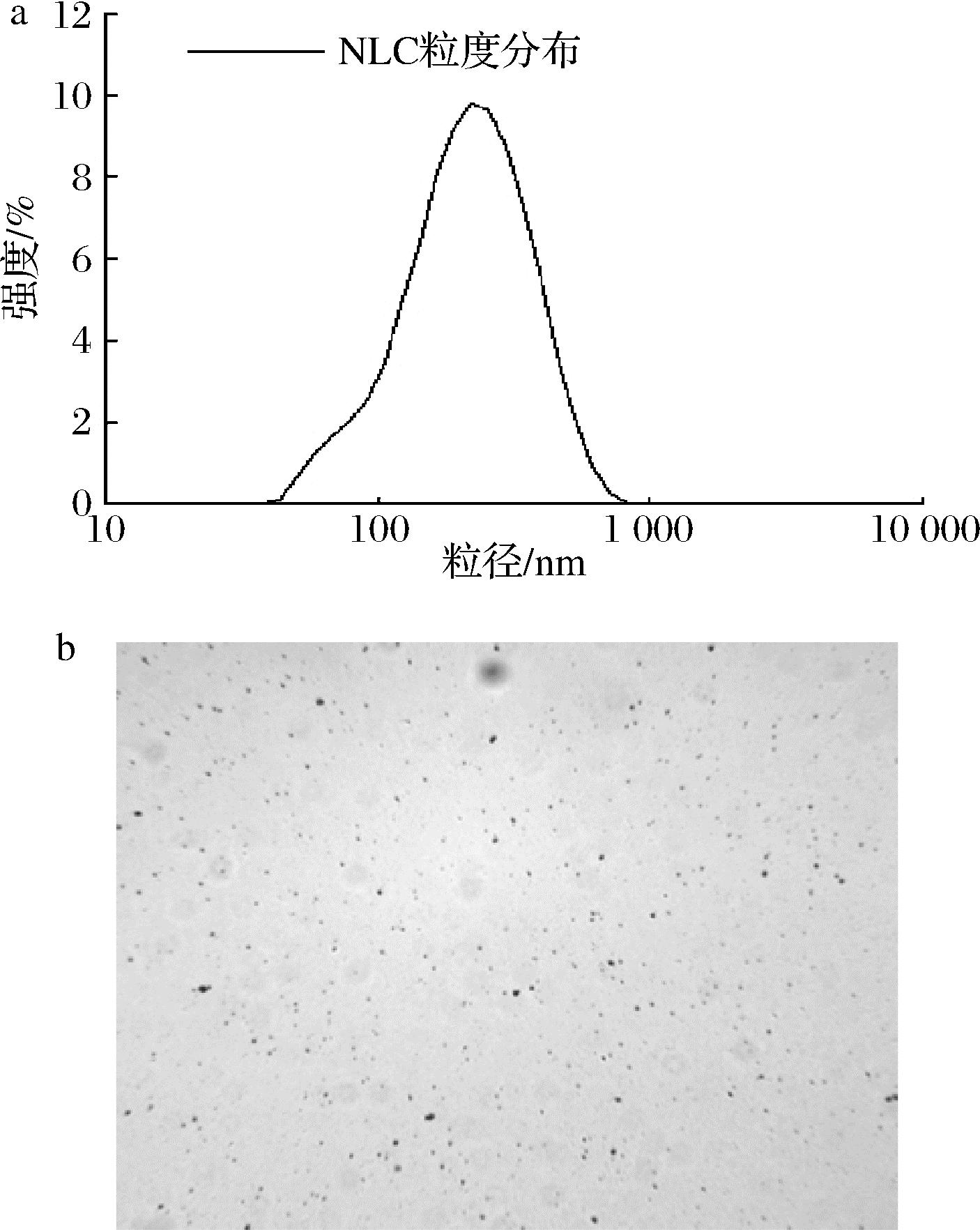
a-粒径分布图;b-光学显微镜图(×10)
图9 姜黄素NLC的粒径分布图及光学显微镜图
Fig.9 Particle size distribution and optical microscopy of curcumin NLC
使用纳米粒径及Zeta电位分析仪测定新鲜制备的姜黄素NLC的电位。王佳丽等[25]研究认为当Zeta电位低于-30 mV或者高于30 mV时,体系倾向于静电稳定;当电位处于-30 mV~30 mV时,体系更容易聚集或凝结。本实验制备的姜黄素NLC电位为(-38.2±0.6) mV,体系带有比较高的表面负电荷,体系由静电斥力以及空间位阻共同发挥作用对其进行稳定。
3 结论
本研究利用DPD模拟与正交试验结合筛选适合制备NLC的固液脂质和表面活性剂等原料种类以及用量,并对其进行表征。结果表明:姜黄素在单硬脂酸甘油酯-MCT油脂质载体中能较好地包封在液体脂质中,不会明显地暴露在表面;随着液体脂质含量的增加,引起脂质载体表面张力的改变,粒径也会随之改变,固液脂质含量比例为1∶3时,形成NLC粒径较小;姜黄素含量过多或过少都可能会造成NLC突释,本实验中选择3%含量较为合适;在单硬脂酸甘油酯-MCT油脂质载体中,选择4%的卵磷脂作为表面活性剂能很好地形成球壳结构附着在脂质载体表面;正交试验结果表明模拟结果与实验结果相符,因此选择单硬脂酸甘油酯-MCT油-卵磷脂制备脂质载体,当固液脂质比例为1∶3,姜黄素含量3%,卵磷脂含量5%,均质压力60 MPa时,姜黄素包封率最高为85.06%。此时NLC粒径为(233.8±2.4)nm,Zeta电位为(-38.2±0.6)mV,微观结构表明体系均匀分散,无聚集现象。
[1] 高鹏, 许尨, 马海然, 等.姜黄素药食特性研究进展[J].农产品加工, 2021(18):72-74;78. GAO P, XU M, MA H R, et al.Research of curcumin characteristics of medicine[J].Farm Products Processing, 2021(18):72-74;78.
[2] 任爽, 董文霞, 刘锦芳, 等.食品运载体系包埋姜黄素的研究进展[J].食品科学, 2021, 42(9):264-274. REN S, DONG W X, LIU J F, et al.Progress in food delivery systems used for curcumin encapsulation[J].Food Science, 2021, 42(9):264-274.
[3] GU L Y, SUN R, WANG W J, et al.Nanostructured lipid carriers for the encapsulation of phloretin:Preparation and in vitro characterization studies[J].Chemistry and Physics of Lipids, 2022, 242:105150.
[4] 李新甜, 徐亚元, 张钟元, 等.基质结构对纳米结构脂质载体中叶黄素生物利用度的调控机制[J].食品科学, 2022, 43(12):130-138. LI X T, XU Y Y, ZHANG Z Y, et al.Regulatory effect of matrix structures on bioaccessibility of lutein loaded into nanostructured lipid carriers[J].Food Science, 2022, 43(12):130-138.
[5] ELMOWAFY M, AL-SANEA M M.Nanostructured lipid carriers (NLCs) as drug delivery platform:Advances in formulation and delivery strategies[J].Saudi Pharmaceutical Journal, 2021, 29(9):999-1012.
[6] 孙清瑞. 碘纳米粒催化番茄红素反—顺构型转化及纳米结构脂质载体[D].无锡:江南大学, 2016. SUN Q R.E/Z isomerization of lycopene catalyzed by iodine-nanoparticles and lycopene-loaded nanostructured lipid carriers[D].Wuxi:Jiangnan University, 2016.
[7] 熊文慧. 番茄红素纳米结构脂质载体工艺优化及生物可给率[D].无锡:江南大学, 2019. XIONG W H.Process optimization and bioavailability of lycopene nanostructured lipid carriers[D].Wuxi:Jiangnan University, 2019.
[8] ARAUJO V H S, DA SILVA P B, SZLACHETKA I O, et al.The influence of NLC composition on curcumin loading under a physicochemical perspective and in vitro evaluation[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2020, 602:125070.
[9] 崔咏梅. BmimPF6/DMF/H2O微乳液的耗散粒子动力学模拟及应用研究[D].青岛:青岛科技大学, 2021. CUI Y M.Dissipative particle dynamics simulation and application of BmimPF6/DMF/H2O microemulsion[D].Qingdao:Qingdao University of Science &Technology, 2021. [10] YANG C F, YIN L, YUAN C, et al.DPD simulations and experimental study on reduction-sensitive polymeric micelles self-assembled from PCL-SS-PPEGMA for doxorubicin controlled release[J].Colloids and Surfaces B:Biointerfaces, 2021, 204:111797.
[11] 晋兴华. 分子模拟方法优化脂质纳米给药系统结构与性能的研究[D].天津:天津大学, 2009. JIN X H.Molecular simulation methods to optimize structure and properties of lipid nanoparticle delivery system[D].Tianjin:Tianjin University, 2009.
[12] LIANG X P, WU J Q, YANG X G, et al.Investigation of oil-in-water emulsion stability with relevant interfacial characteristics simulated by dissipative particle dynamics[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2018, 546:107-114.
[13] 卢宇欣, 陈雪帆.中链甘油三酯的制备、分析及应用研究进展[J].食品与发酵工业, 2022, 48(24):352-358. LU Y X, CHEN X F.Research progress on preparation, analysis, and application of medium-chain triglyceride[J].Food and Fermentation Industries, 2022, 48(24):352-358.
[14] APOSTOLOU M, ASSI S, FATOKUN A A, et al.The effects of solid and liquid lipids on the physicochemical properties of nanostructured lipid carriers[J].Journal of Pharmaceutical Sciences, 2021, 110(8):2859-2872.
[15] 林云伟. 南极磷虾油基纳米结构脂质载体的制备及性质研究[D].广州:华南理工大学, 2020. LIN Y W.Preparation and characterization of nanostructured lipid carriers containing Antarctic krill oil[D].Guangzhou:South China University of Technology, 2020.
[16] 麦琬婷, 钟华帅, 苏晓丹, 等.Box-Behnken响应面优化蛇葡萄素纳米结构脂质载体处方工艺及体外评价[J].中草药, 2022, 53(16):4982-4991. MAI W T, ZHONG H S, SU X D, et al.Formulation optimization of ampelopsin nanostructured lipid carriers by Box-Behnken response surface method and in vitro evaluation[J].Chinese Traditional and Herbal Drugs, 2022, 53(16):4982-4991.
[17] 孙洁洁, 杨国宝, 范月月, 等.奥拉帕尼纳米结构脂质载体处方优化及性质考察[J].军事医学, 2021, 45(6):431-436. SUN J J, YANG G B, FAN Y Y, et al.Optimization of the formula and characterization of olaparib-loaded nanostructured lipid carriers[J].Military Medical Sciences, 2021, 45(6):431-436.
[18] 李达鸿. 以OSA变性淀粉为乳化剂的番茄红素纳米乳液的构建及其特性研究[D].广州:华南农业大学, 2017. LI D H.Preparation and characterization of lycopene nanoe mulsion using OSA modified starch as emulsifier[D].Guangzhou:South China Agricultural University, 2017.
[19] WITAYAUDOM P, KLINKESORN U.Effect of surfactant concentration and solidification temperature on the characteristics and stability of nanostructured lipid carrier (NLC) prepared from rambutan (Nephelium lappaceum L.) kernel fat[J].Journal of Colloid and Interface Science, 2017, 505:1082-1092.
[20] BOT F, COSSUTA D, O’MAHONY J A.Inter-relationships between composition, physicochemical properties and functionality of lecithin ingredients[J].Trends in Food Science &Technology, 2021, 111:261-270.
[21] BOLLENBACH L, BUSKE J, M DER K, et al.Poloxamer 188 as surfactant in biological formulations - an alternative for polysorbate 20/80?[J].International Journal of Pharmaceutics, 2022, 620:121706.
DER K, et al.Poloxamer 188 as surfactant in biological formulations - an alternative for polysorbate 20/80?[J].International Journal of Pharmaceutics, 2022, 620:121706.
[22] HOU K H, XU Y Y, CEN K Y, et al.Nanoemulsion of cinnamon essential oil Co-emulsified with hydroxypropyl-β-cyclodextrin and Tween-80:Antibacterial activity, stability and slow release performance[J].Food Bioscience, 2021, 43:101232.
[23] ROHMAH M, RAHARJO S, HIDAYAT C, et al.Application of response surface methodology for the optimization of β-carotene-loaded nanostructured lipid carrier from mixtures of palm stearin and palm olein[J].Journal of the American Oil Chemists’ Society, 2020, 97(2):213-223.
[24] ZHU X M, WANG Q, LENG Y B, et al.Lecithin alleviates protein flocculation and enhances fat digestion in a model of infant formula emulsion[J].Food Chemistry, 2021, 346:128918.
[25] 王佳丽, 董绪燕, 魏芳, 等.纳米结构脂质载体的研究进展及其在食品中的应用[J].中国农业科技导报, 2012, 14(6):91-97. WANG J L, DONG X Y, WEI F, et al.Research progress of nanostructured lipid carriers(NLC) and its application in food industry[J].Journal of Agricultural Science and Technology, 2012, 14(6):91-97.