亚胺还原酶(imine reductase,IRED)是一种立体选择性极高、底物选择性广泛、转化效率极高、反应条件温和的氧化还原酶[1-2]。在辅酶NADPH参与下,可将前手性的亚胺不对称合成为相应的手性胺,可用于手性伯胺、仲胺和叔胺产物的合成[3-4]。亚胺还原酶通过实现碳氮双键间的不对称加成反应,满足许多药物分子和农药的关键中间体的生物合成[5-7]。通过分子生物学、基因工程技术等现代生物技术,异源表达获得的亚胺还原酶,可催化多种环亚胺反应合成S型或R型的手性胺。
高密度发酵(high cell density cultivation,HCDC)指在一定培养条件下,应用一定的培养技术和设备,尽可能地提高菌体的生物量,获得较高的外源蛋白产量。高密度发酵可以提高单位体积发酵液中菌体的生物量,提高产物的比生产率以相应的减少发酵罐的体积,缩短生产周期,降低生产成本,提高生产效率[8-13]。大肠杆菌的培养环境简单、生长周期短、成本低,具有清晰的遗传背景,是目前合成生物学领域中研究最成熟的表达系统之一[14-17],因此选用大肠杆菌作为重组亚胺还原酶的宿主有利于其工业化生产制备。
亚胺还原酶用于亚胺还原反应,该步骤离不开还原型辅酶的参与,而辅酶价格昂贵,导致工业化生产成本激增。实际上,工业化进行生物法亚胺还原反应往往会利用合成生物学手段构建能实现体内或者体外的辅酶再生系统以提供辅酶,而在构建体内辅酶再生系统时,除了要考虑亚胺还原酶本身的酶活力和产量外,还需要考虑再生系统的活力,因此,本研究综合考虑酶活力和酶产量对高密度发酵进行“快速”探究,通过2 L发酵体系对自建菌株BL21(DE3)/pET-28a-IRED进行发酵种子液接种量和诱导条件优化,确定了不同的接种量、诱导时机、诱导剂浓度和诱导温度对亚胺还原酶酶活力的影响,并在50 L发酵罐上进行20 L发酵体系放大,为酶促反应制备手性胺的工业化提供技术支持。
1 材料与方法
1.1 材料与试剂
菌株BL21(DE3)/pET-28a-IRED由本公司构建和保藏。
酵母提取物,Oxoid;胰蛋白胨,生工生物工程(上海)股份有限公司;琼脂,BioFroxx;硫酸铵、七水合硫酸镁、一水合硫酸锰,西陇科学股份有限公司;NaCl、葡萄糖、KH2PO4,广东光华科技股份有限公司;玉米浆干粉,北京鸿润宝顺科技有限公司;FeSO4·7H2O、异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactoside,IPTG)和硫酸卡那霉素,上海麦克林生化科技股份有限公司。
LB培养基(g/L):酵母提取物5、胰蛋白胨10、NaCl 5,固体培养基加入20 g/L琼脂,121 ℃灭菌15 min。
种子培养基(g/L):葡萄糖40、(NH4)2SO4 2、KH2PO4 2、MgSO4·7H2O 1、酵母提取物20、玉米浆干粉2、FeSO4·7H2O 0.08、MnSO4·H2O 0.08,115 ℃灭菌20 min,灭菌后冷却加入终质量浓度为100 μg/mL的硫酸卡那霉素。
发酵培养基(g/L):葡萄糖40、(NH4)2SO4 1.8、KH2PO4 3、MgSO4·7H2O 2、酵母提取物1、玉米浆干粉2、FeSO4·7H2O 0.08、MnSO4·H2O 0.08,115 ℃灭菌20 min,灭菌后冷却加入终质量浓度为100 μg/mL的硫酸卡那霉素。
1.2 仪器与设备
DGLS-35B立式蒸汽灭菌器,江苏登冠医疗器械有限公司;5 L发酵罐、三联5 L发酵罐、50 L发酵罐,上海保兴生物设备工程有限公司;UV755B紫外可见光光度计,上海佑科仪器仪表有限公司;HP/Agilent 1100高效液相色谱仪,美国Agilent公司。其余仪器设备如超净工作台、培养箱、摇床等为常规微生物实验仪器设备。
1.3 实验方法
1.3.1 种子液培养
取20 ℃保藏的BL21(DE3)/pET28aIRED甘油菌在LB固体培养基上划线,37 ℃倒置培养16 h;挑取单菌落于2 mL LB液体培养基中,37 ℃,200 r/min振荡培养6 h,得到一级种子液。一级种子液按1%接种量接种至200 mL种子培养基中,37 ℃,200 r/min振荡培养12 h,获得二级种子液。
1.3.2 发酵培养
将二级种子液按10%接种量接种至5 L发酵罐(发酵体系为2 L),初始转速为200 r/min,温度为37 ℃,通气量为4 L/min,罐压为0.05 MPa,pH值为7,开启pH自动调节、消泡剂自动感应、转速自动控制和温度自动控制,用14%(体积分数)氨水调节pH值。当溶氧下降到30%以下时,设置溶氧串级转速,使溶氧值保持在30%~35%。当转速达到800 r/min,溶氧回升时,开始向发酵体系中恒速流加800 g/L葡萄糖溶液,流加速度为10 mL/h。当OD600值达到12时,降温至20 ℃,并加入终浓度为0.4 mmol/L的IPTG进行诱导。当OD600值下降10个单位时,结束发酵。
1.3.3 发酵条件优化
优化种子液接种量:种子液分别以4%、6%、8%、10%和12%的接种量接种到发酵体系中,其他条件保持不变,测定发酵结束时OD600值和酶活力。
优化诱导时机:发酵过程中,分别在OD600达到12、30、50时进行诱导,其他条件保持不变,测定发酵结束时OD600值和酶活力。
优化诱导剂使用量:诱导阶段,IPTG终浓度分别为0.1、0.4、0.8 mmol/L,其他条件保持不变,测定发酵结束时OD600值和酶活力。
优化诱导温度:诱导阶段,设置诱导温度分别为16、20、25、30、37 ℃,其他条件保持不变,测定发酵结束时OD600值和酶活力。
所有试验设3个平行,所得数据为3个平行试验的均值。所得数据利用Origin 9.0绘制。
1.3.4 检测方法
菌体浓度测定:吸取适量菌液,稀释后控制吸光度在0.2~0.8,用分光光度计测定该菌液在波长600 nm处的吸光值(OD600值)。
酶活力测定:亚胺还原酶活力单位定义为:在30 ℃、pH值为7.5条件下,每分钟消耗1 μmol麦斯明所需的粗酶量为1个活力单位(U/g)。
亚胺还原酶活力反应体系(mg/mL):麦斯明0.5,葡萄糖0.925,亚胺还原酶全细胞25,GDH(商业用酶)0.005,NAD 0.022 5,0.1 mol/L磷酸盐溶液作缓冲液,30 ℃,200 r/min,反应0.5 h。
液相检测方法:采用高效液相色谱法测定麦斯明含量,色谱条件如下:流动相A为pH值9.5的0.15%(质量分数)乙酸氨,流动相B为100%乙腈,色谱柱为Xtimate C18(4.6 mm×250 mm,5 μm),检测波长:254 nm,流速1 mL/min;柱温30 ℃;进样量5 μL,梯度洗脱,梯度情况见表1。
表1 高效液相色谱法检测麦斯明含量梯度洗脱流动相情况
Table 1 Gradient elution conditions for the detection of myosmine content by high-performance liquid chromatography

时间/min流动相A/%流动相B/%095510554515485220955
1.3.5 扩大发酵体系至20 L
根据1.3.3节优化的发酵条件,其他条件不变,将发酵体系扩大至20 L,比较2 L发酵体系和20 L发酵体系的发酵情况,测定发酵结束时OD600值和酶活力。
2 结果与分析
2.1 发酵条件优化
2.1.1 接种量优化
发酵体系中接种量对BL21(DE3)/pET-28a-IRED菌体生物量和酶活力的影响,结果见图1。菌体生物量随着接种量增高而增高。有文献表明,接种量较低时,菌体生长缓慢,在相同时间内菌体生物量的积累较低,导致酶产量降低,酶活力较低;接种量较高时,菌体对新环境的适应能力增强,菌体快速繁殖,产量高,酶活力较高[8],与本研究结果一致。虽然12%接种量的菌体生物量最高,但与10%接种量的酶活力差异不明显,且考虑到繁殖速度过快,菌体会提早进入衰老,发生自溶而影响发酵效果[18],确定10%为最佳接种量。
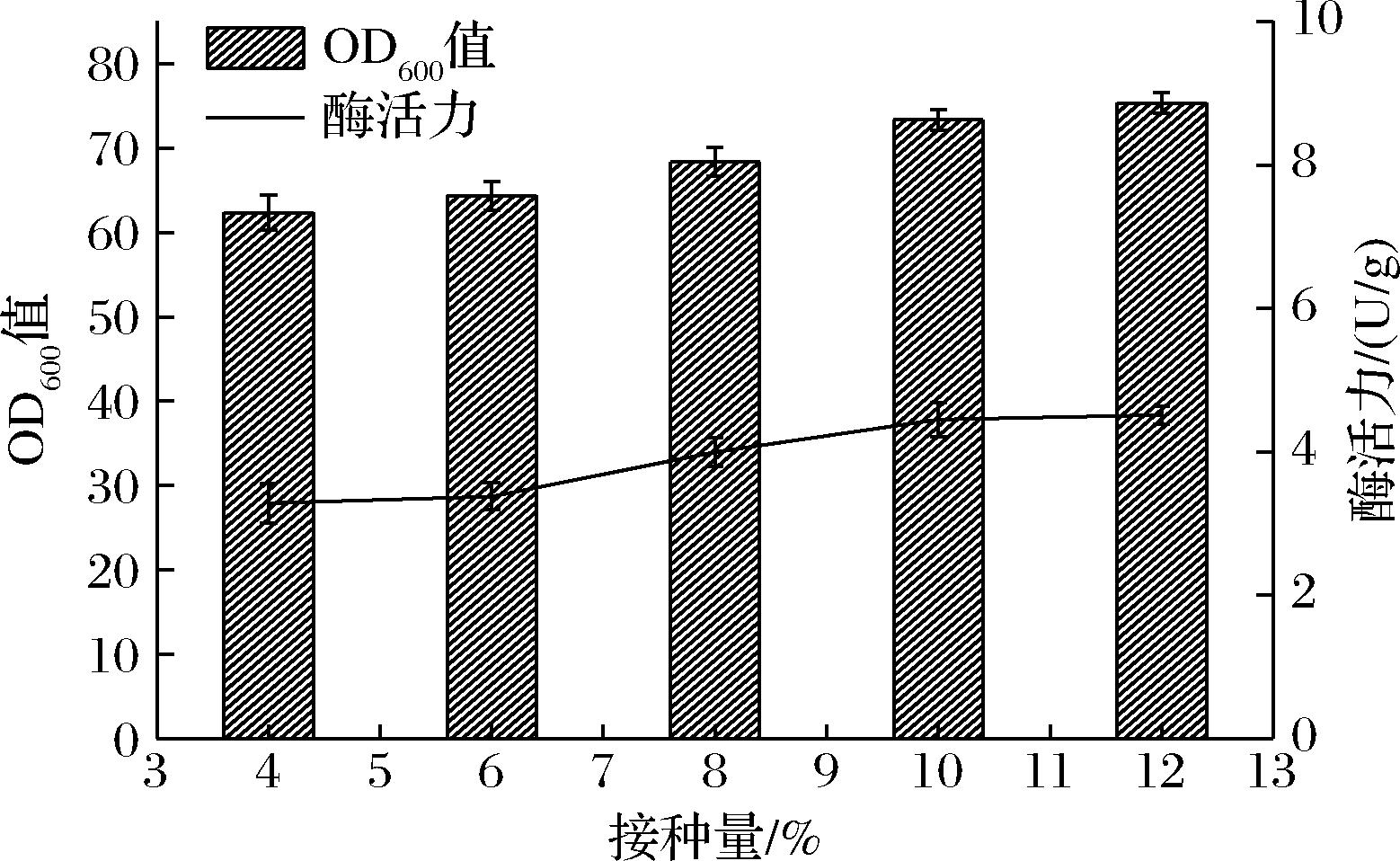
图1 接种量对IRED菌体生物量和酶活力的影响
Fig.1 Effects of inoculation amount on the biomass and enzyme activity of IRED strains
2.1.2 诱导时机对IRED表达量的影响
诱导时机对BL21(DE3)/pET-28a-IRED菌体生物量和酶活力的影响,结果见表2。分别在OD600值达到12、30和50时加入0.4 mmol/L IPTG进行诱导,诱导温度为20 ℃,诱导16 h后测定酶活力。结果表明,诱导时机较晚时,虽然获得的菌体量大,但菌体过老,代谢缓慢,导致蛋白表达量下降,酶活力降低;而诱导时机较早时,虽然低温诱导导致菌体生长迟缓,获得的菌体量较低,但单位酶活性好,发酵时间短。综合时间、用电等成本,以及达到快速高密度发酵的目的,最终确定最佳诱导时机为OD600值达到12 h。
表2 诱导时机对IRED菌体浓度和酶活力的影响
Table 2 Effects of induction timing on the cell density and enzyme activity of IRED strains
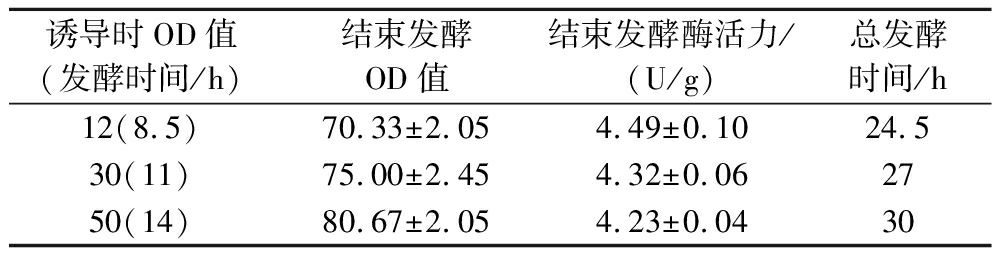
诱导时OD值(发酵时间/h)结束发酵OD值结束发酵酶活力/(U/g)总发酵时间/h12(8.5)70.33±2.054.49±0.1024.530(11)75.00±2.454.32±0.062750(14)80.67±2.054.23±0.0430
2.1.3 诱导剂使用量对IRED表达量的影响
诱导剂IPTG的使用量对BL21(DE3)/pET28a-IRED菌体生物量和酶活力的影响,结果见表3。IPTG的终浓度与菌体生物量相关,IPTG使用量过低,诱导效果较差,蛋白表达不足,导致酶活力下降;而IPTG使用量过高时,对菌体有毒害作用,并且会增加异源蛋白错误折叠的概率,导致非可溶性蛋白增加,增加菌体生长负担,进而使菌体生长缓慢,最终得到较低的生物量[19-21],因此确定最佳的诱导剂IPTG使用量为0.4 mmol/L。
表3 IPTG终浓度对IRED菌体生物量和酶活力的影响
Table 3 Effects of final IPTG concentration on the biomass and enzyme activity of IRED strains
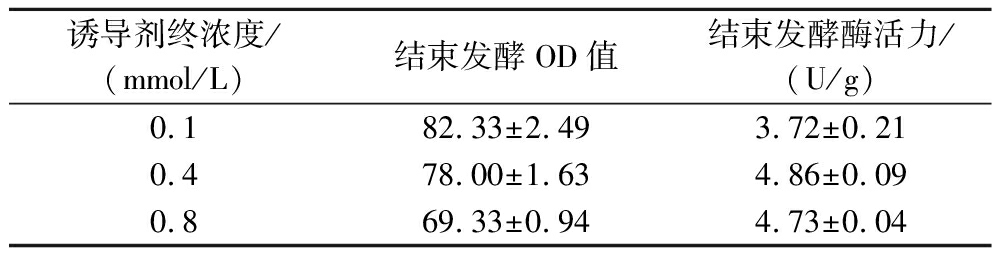
诱导剂终浓度/(mmol/L)结束发酵OD值结束发酵酶活力/(U/g)0.182.33±2.493.72±0.210.478.00±1.634.86±0.090.869.33±0.944.73±0.04
2.1.4 诱导温度对IRED表达量的影响
诱导温度对BL21(DE3)/pET28a-IRED菌体生物量和酶活力的影响,结果见表4。诱导温度为20 ℃时IRED酶活力最高,16 ℃诱导酶活力次之。37 ℃诱导虽获得最大的生物量,但酶活力较低,推测是温度过高,虽有利于菌体生长,但菌体生长过快不利于蛋白表达,导致重组蛋白错误折叠,从而形成包涵体,酶活力下降,而且温度过高也会导致菌体提早衰老[22-23]。而过低温度诱导时菌体生物量降低,菌体生长缓慢,发酵结束时酶活力不高,这可能是因为低温诱导延缓菌体生长,延长蛋白的表达时间,有利于增加外源蛋白的表达,同时低温表达可以降低多肽的合成速度,提供充裕的时间用于肽链正确空间折叠,在一定程度上减少无生物活性的包涵体的形成[24-25]。因此,确定诱导温度20 ℃为最佳诱导温度。
表4 诱导温度对IRED菌体浓度和酶活力的影响
Table 4 Effects of induction temperature on the cell density and enzyme activity of IRED strains
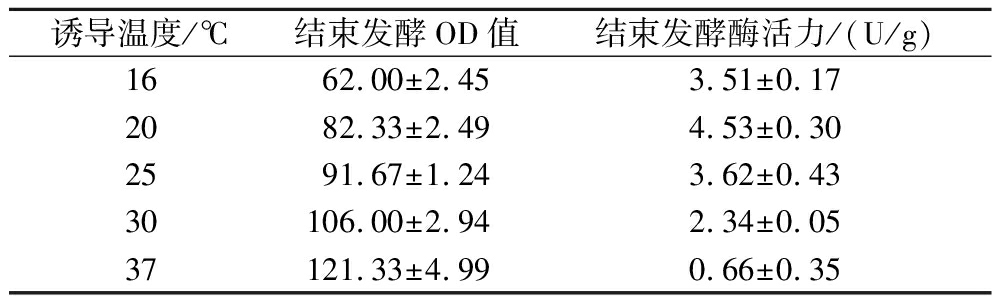
诱导温度/℃结束发酵OD值结束发酵酶活力/(U/g)1662.00±2.453.51±0.172082.33±2.494.53±0.302591.67±1.243.62±0.4330106.00±2.942.34±0.0537121.33±4.990.66±0.35
2.2 扩大发酵体系至20 L
根据2 L发酵罐优化得到的发酵条件,进行20 L放大发酵培养,并比较2 L和20 L发酵体系的发酵结果。如图2所示,20 L发酵体系在发酵12 h时(诱导3 h),酶活力随着时间逐渐上升,并在发酵21 h时(诱导12 h)酶活力达到最高,为4.56 U/g;随后在发酵22 h(诱导13 h)后酶活力开始下降,在发酵24 h(诱导15 h)时酶活力趋于稳定至发酵结束。20 L发酵体系发酵结果与2 L发酵体系基本一致,说明发酵体系放大成功,为进一步放大发酵体系以实现亚胺还原酶快速高产量制备的工业化生产提供数据基础。
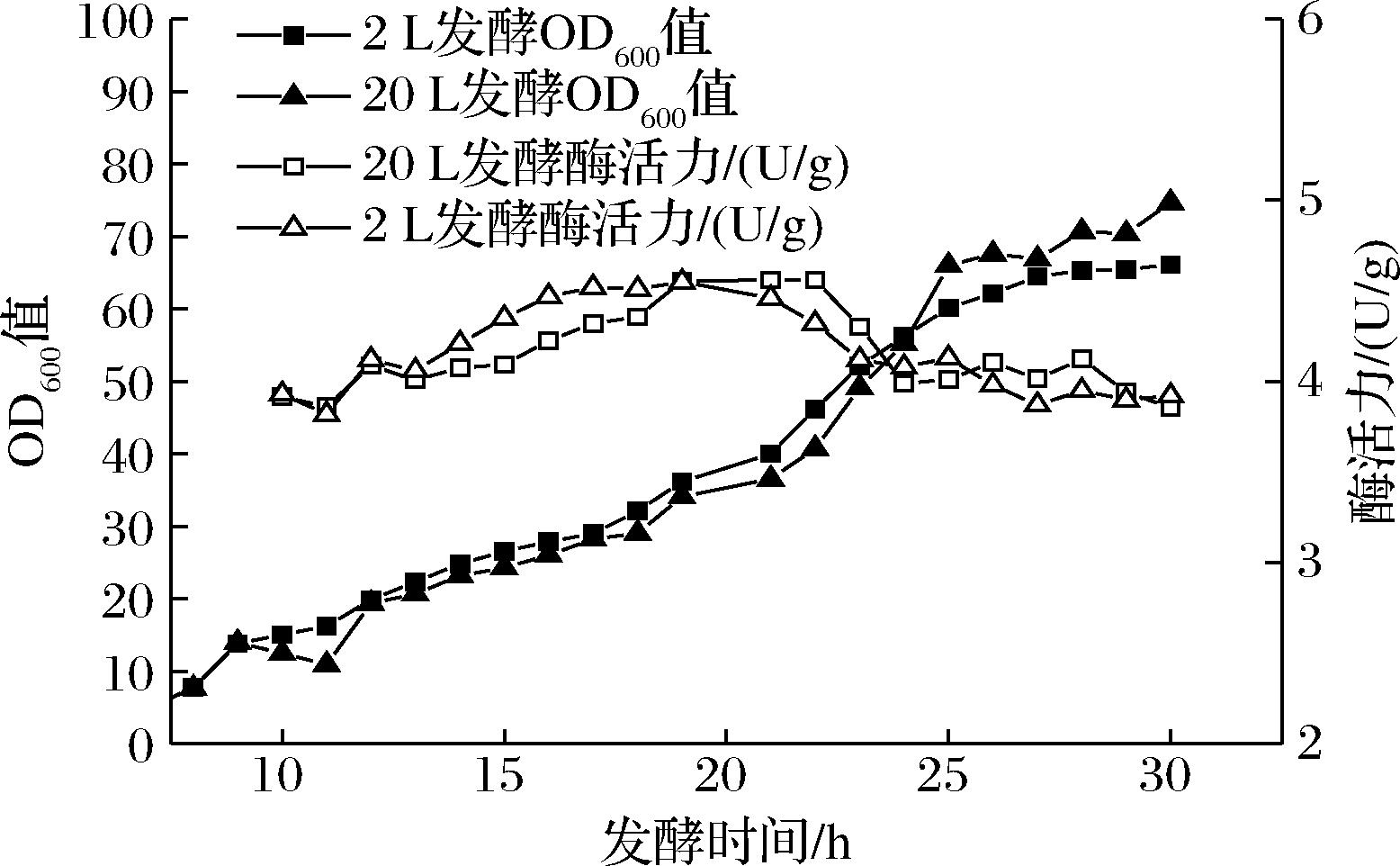
图2 2 L/20 L发酵体系生长曲线和酶活力变化情况
Fig.2 Growth curve and enzyme activity changes in 2 L/20 L fermentation system
3 结论与讨论
亚胺还原酶可用于合成手性胺,手性胺广泛存在于天然产物、农业化学品、临床药物和表面活性剂中,在医药领域,超过70%药物是手性胺及其衍生物,在农业领域,存在手性胺结构单元的农用化学品约20%[26-27]。目前,未见有通过高密度发酵培养重组菌制备亚胺还原酶的报道。本研究先对2 L发酵体系制备亚胺还原酶进行接种量、诱导时机、诱导剂浓度和诱导温度对重组菌的生物量和亚胺还原酶的酶活力进行研究,确定本研究自行构建的BL21(DE3)/pET-28a-IRED重组菌发酵最佳接种量为10%,最佳诱导条件为当OD600值达到12时,在20 ℃下加入终浓度为0.4 mmol/L IPTG,以此条件放大至20 L发酵体系进行发酵培养,发酵结束时(发酵21 h,诱导12 h)菌体生物量OD600值为74,酶活力为4.56 U/g。发酵条件的优化以及20 L扩发发酵的顺利进行,为进一步放大发酵体系以实现亚胺还原酶快速高产量制备的工业化生产奠定基础。
[1] 曹文斌, 李昊, 陈飞飞, 等.亚胺还原酶的改造及其催化合成1-苯基-1, 2, 3, 4-四氢异喹啉的性能[J].华东理工大学学报(自然科学版), 2022, 48(4):511-518. CAO W B, LI H, CHEN F F, et al.Modification and characterization of imine reductases for synthesis of 1-phenyl-1, 2, 3, 4-tetrahydro-isoquinoline[J].Journal of East China University of Science and Technology, 2022, 48(4):511-518.
[2] PATIL M D, GROGAN G, BOMMARIUS A, et al.Oxidoreductase-catalyzed synthesis of chiral amines[J].ACS Catalysis, 2018, 8(12):10985-11015.
[3] 李骥璇. 亚胺还原酶辅酶再生体系的构建及定点突变的研究[D].北京:清华大学, 2019. LI J X.Co-expressed system construction and site-directed mutagenesis of imine reductase[D].Beijing:Tsinghua University, 2019.
[4] 杨璐, 瞿旭东.亚胺还原酶在手性胺合成中的应用[J].合成生物学, 2022, 3(3):516-529. YANG L, QU X D.Application of imine reductase in the synthesis of chiral amines[J].Synthetic Biology Journal, 2022, 3(3):516-529.
[5] 程峰, 李清华, 李恒, 等.NAD(P)H依赖型氧化还原酶不对称还原胺化制备手性胺的研究进展[J].生物工程学报, 2020, 36(9):1794-1816. CHENG F, LI Q H, LI H, et al.NAD(P)H-dependent oxidoreductases for synthesis of chiral amines by asymmetric reductive amination of ketones[J].Chinese Journal of Biotechnology, 2020, 36(9):1794-1816.
[6] GUO F, BERGLUND P.Transaminase biocatalysis:Optimization and application[J].Green Chemistry, 2017, 19(2):333-360.
[7] MATHEW S, YUN H.ω-transaminases for the production of optically pure amines and unnatural amino acids[J].ACS Catalysis, 2012, 2(6):993-1001.
[8] 刘国锋. 大肠杆菌高密度发酵产木聚糖酶发酵条件优化[J].中国酿造, 2017, 36(12):63-67. LIU G F.Optimization of high density fermentation conditions of Escherichia coli for xylanase production[J].China Brewing, 2017, 36(12):63-67.
[9] 李娜, 杨江华, 韦宇拓.植物乳杆菌ZJ316高密度发酵条件优化[J].中国酿造, 2021, 40(5):43-48. LI N, YANG J H, WEI Y T.Optimization of high-density fermentation conditions for Lactobacillus plantarum ZJ316[J].China Brewing, 2021, 40(5):43-48. [10] 冀成法, 刘忠, 马鲁南, 等.重组大肠杆菌高密度、高表达研究进展[J].生物技术, 2022, 32(2):246-251. JI C F, LIU Z, MA L N, et al.Review of high density fermentation and high expression of engineering E.coli[J].Biotechnology, 2022, 32(2):246-251.
[11] 沈加彬. 重组大肠杆菌产活性短肽高密度发酵研究[J].发酵科技通讯, 2022, 51(4):211-216. SHEN J B.Study on high cell density cultivation in recombinant E.coli for production of active short chain polypeptide[J].Bulletin of Fermentation Science and Technology, 2022, 51(4):211-216.
[12] 刘开放, 席志文, 黄林娜, 等.布拉酵母高密度发酵培养基及发酵工艺优化[J].食品科学, 2019, 40(8):56-62. LIU K F, XI Z W, HUANG L N, et al.Optimization of high cell density fermentation of Saccharomyces boulardii for enhanced biomass production[J].Food Science, 2019, 40(8):56-62.
[13] 王振东. 乳酸片球菌IMAU94388的高密度培养研究[D].内蒙古:内蒙古农业大学, 2020. WANG Z D.Study on high cell density culture of Pediococcus acidilactici IMAU94388[D].Inner Mongolia:Inner Mongolia Agricultural University, 2020.
[14] PONTRELLI S, CHIU T Y, LAN E I, et al.Escherichia coli as a host for metabolic engineering[J].Metabolic Engineering, 2018, 50:16-46.
[15] DONG X B, TANG B, LI J, et al.Expression and purification of intact and functional soybean (Glycine max) seed ferritin complex in Escherichia coli[J].Journal of Microbiology and Biotechnology, 2008, 18(2):299-307.
[16] 徐冰, 马江锋, 梁丽亚, 等.基于高密度培养的反复分批发酵法生产丁二酸[J].化工学报, 2011, 62(9):2595-2599. XU B, MA J F, LIANG L Y, et al.Succinic acid production by repeated batch fermentation based on high density culture[J].CIESC Journal, 2011, 62(9):2595-2599.
[17] NUC P, NUC K.Recombinant protein production in Escherichia coli[J].Postepy Biochemii, 2006, 52(4):448-456.
[18] 张震, 熊海波, 徐庆阳.大肠杆菌高密度培养发酵L-色氨酸[J].食品与发酵工业, 2019, 45(23):15-20. ZHANG Z, XIONG H B, XU Q Y.L-tryptophan fermentation by high cell density culture of Escherichia coli[J].Food and Fermentation Industries, 2019, 45(23):15-20.
[19] 艾正文. 基于大肠杆菌表达系统制备β-酪蛋白研究[J].食品工业科技, 2023, 44(16):131-138. AI Z W.Preparation of β-casein based on Escherichia coli expression system[J].Science and Technology of Food Industry, 2023, 44(16):131-138.
[20] 满在伟, 崔慧慧, 李锦, 等.谷氨酸棒杆菌表达大肠杆菌来源海藻糖酶[J].食品研究与开发, 2022, 43(24):181-187. MAN Z W, CUI H H, LI J, et al.Expression of trehalase from Escherichia coli by Corynebacterium glutamicum[J].Food Research and Development, 2022, 43(24):181-187.
[21] 周卫强, 何太波, 唐堂, 等.工程大肠杆菌异源表达D-阿洛酮糖3-差向异构酶的诱导工艺研究[J].发酵科技通讯, 2019, 48(4):192-196. ZHOU W Q, HE T B, TANG T, et al.Study of induction process for heterologous expression of D-psicose 3-epimerasein engineering Escherichia coli[J].Bulletin of Fermentation Science and Technology, 2019, 48(4):192-196.
[22] 叶姣, 陈长华, 夏杰, 等.温度对重组大肠杆菌生长及外源蛋白表达的影响[J].华东理工大学学报, 2002, 28(4):364-367. YE J, CHEN C H, XIA J, et al.Effect of temperature on the growth of recombinant E.coli and on the expression of recombinant protein[J].Journal of East China University of Science and Technology, 2002, 28(4):364-367.
[23] 赵翔, 钟浩, 孙超, 等.表达NADP+型甲酸脱氢酶重组大肠杆菌的高密度发酵研究[J].发酵科技通讯, 2020, 49(2):72-75. ZHAO X, ZHONG H, SUN C, et al.Study on high density fermentation of recombinant Escherichia coli expressing NADP+-dependent formate dehydrogenase[J].Bulletin of Fermentation Science and Technology, 2020, 49(2):72-75.
[24] 张丽, 应向贤, 毛王伟, 等.裂殖酵母醛酮还原酶基因的克隆与诱导表达条件优化[J].发酵科技通讯, 2018, 47(3):161-165. ZHANG L, YING X X, MAO W W, et al.Cloning, over-expression and optimization of induction conditions of an aldo-keto reductase from Schizosaccharomyces pombe[J].Bulletin of Fermentation Science and Technology, 2018, 47(3):161-165.
[25] 陈阿娜, 叶生梅, 孟娜, 等.外源蛋白在大肠杆菌中高效可溶性表达和胞外分泌策略研究综述[J].安徽农学通报, 2015, 21(13):25-27. CHEN A N, YE S M, MENG N, et al.Advances of soluble and extracellular overexpression of heterologous proteins in Escherichia coli[J].Anhui Agricultural Science Bulletin, 2015, 21(13):25-27.
[26] 杨璐, 邓子新, 瞿旭东.亚胺还原酶(IRED)制备手性胺的研究进展[J].南京工业大学学报(自然科学版), 2019, 41(6):807-814. YANG L, DENG Z X, QU X D.Progress in the preparation of chiral amines by imine reductase (IRED)[J].Journal of Nanjing Tech University (Natural Science Edition), 2019, 41(6):807-814.
[27] 李骥璇, 余磊, 李京美, 等.S-亚胺还原酶和葡萄糖脱氢酶共表达系统的构建及手性胺的合成[J].生物技术通报, 2019, 35(1):105-111. LI J X, YU L, LI J M, et al.Construction of co-expression system of S-imine reductase and glucose dehydrogenase and synthesis of chiral amine[J].Biotechnology Bulletin, 2019, 35(1):105-111.