辅酶Q10(coenzyme Q10,CoQ10)因具有抗氧化、缓解体力疲劳、提高人体免疫力、辅助降血脂等多种功能活性而被广泛报道[1-3]。然而,作为一种高分子质量化合物,CoQ10在水中溶解性差,小肠直接吸收水平低,导致其直接口服生物利用率低;同时CoQ10的稳定性还受到光、热等环境因素的挑战,这限制了CoQ10作为膳食补充剂在保健食品中的应用[2]。目前,运用制剂新技术开发高含量、高稳定的CoQ10保健食品已成为研究热点。
基于脂质基质的载体递送技术在提高脂溶性活性成分的溶解性,保护其免受环境因素导致的降解,防止与其他食品成分的相互作用,提高其口服生物可接受率上成效显著[4]。脂质体为具有两亲性分子(磷脂)双层结构的球状囊泡,可同时包裹亲水性与亲脂性活性成分,是最具有代表性的一类脂质递送系统[5]。脂质体已广泛应用于活性成分,如姜黄素[6-7]和β-胡萝卜素[8-9]等的包封。
目前,脂质体的制备工艺大多遵循使磷脂分子暴露于水相环境从而自组装形成双层囊泡结构的思路。为了实现目标,常用的方法有2种:其一是薄膜分散法(溶剂蒸发法),即先将磷脂分子制备成薄脂质片,再暴露于水相环境制备脂质体;其二为乙醇注入法(溶剂分散法),即在水性环境中以受控方式引入磷脂乙醇溶液以形成脂质体[10]。然而此类方法制备的脂质体多以微米级的多层囊泡形式存在,过大的粒径和过高的多分散系数对脂质体的稳定性和活性成分递送效果均产生不利影响,因此有必要采用粒径控制技术将脂质体的粒径控制在亚微米级别[10]。以高压均质、超声波和微射流为代表的新型物理加工技术是减小脂质体粒径,降低其多分散系数的有效策略,且同时兼具成熟、安全和高效的优势,在脂质体生产中具有充足潜力[10-11]。
本研究拟制备脂质体来提高CoQ10的稳定性和生物可接受率,并探究高压均质处理对脂质体的粒径、电位、包封率和微观形态等特征参数的影响。进一步考察所制备脂质体储藏稳定性以及模拟体外消化中CoQ10生物可接受率的差异,阐明高压均质技术作为CoQ10脂质体制备新技术的潜力,为CoQ10膳食补充剂相关产品开发提供理论参考与技术支撑。
1 材料与方法
1.1 材料与试剂
CoQ10、中链酸甘油酯(medium chain triglycerides,MCT)、大豆磷脂, 浙江天草生物科技股份有限公司;维生素E,丰益油脂科技有限公司;95%乙醇,南昌卓耀实业有限公司;胃蛋白酶、胰酶,美国Sigma公司;乙腈、异丙醇、正己烷、盐酸等,国药集团化学试剂有限公司。
1.2 仪器与设备
AH-Pilot高压均质机,安拓思纳米技术(苏州)有限公司;Nano-ZS90纳米粒度仪,英国Malvern Instruments公司;JEM-1230透射电子显微镜,日本电子株式会社;Agilent 1260高效液相色谱仪,美国Agilent公司;FE20型pH计,梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 CoQ10脂质体的制备
采用乙醇注入法结合高压均质技术制备。在50 ℃水浴条件下将20 g CoQ10溶于10 g MCT中,制成CoQ10油溶液。将油溶液滴入到溶解有98.3 g大豆磷脂和0.7 g维生素E的300 g乙醇溶液中,在50 ℃水浴搅拌至澄清,作为制备脂质体的乙醇相。将乙醇相缓慢注入870 g水中形成乳化液。乳化液在流速40 L/h、预设固定压力(0/50/100 MPa)条件下进行1次高压均质处理,再于45 ℃下减压蒸发除去乙醇相,得到CoQ10脂质体混悬液。将脂质体混悬液再于相同条件下高压均质处理2个循环,并灌装于棕色玻璃瓶,经85 ℃水浴杀菌30 min,即得CoQ10脂质体样品。脂质体样品根据均质压力差异进行命名,分别为0 MPa:CoQ10-LP-Ⅰ、50 MPa:CoQ10-LP-Ⅱ、100 MPa:CoQ10-LP-Ⅲ。
1.3.2 粒径、电位与微观结构
称取10 mg脂质体样品,用4 mL去离子水稀释,于室温 (25 ℃)下平衡30 min后,使用激光粒度仪测量其粒径、多分散指数和电位,使用透射电镜观察其微观结构。
1.3.3 包封率
精密称取0.2 g脂质体样品,加入2 mL正己烷振荡萃取未包封的CoQ10,10 000 r/min离心10 min,吸取上层正己烷定容至10 mL,测量CoQ10的含量。CoQ10脂质体样品的包封率(encapsulation efficiency,EE)按公式(1)计算:
式中:minitial,初始添加的CoQ10总质量,mg;munloaded,未包封CoQ10的质量,mg。
CoQ10含量的测定采用HPLC进行,色谱柱选择C18柱(150 mm×4.6 mm,5 μm),流动相由乙腈和异丙醇(65∶10,体积比)组成,流速1.0 mL/min,检测波长275 nm,进样量20 μL,柱温35 ℃。
1.3.4 贮藏稳定性
将 CoQ10脂质体样品置于40 ℃条件下贮藏30 d,每10 d记录其粒径、CoQ10保留率、酸价和过氧化值。
CoQ10保留率(retention rate,RR)按公式(2)计算:
式中:EEt,特定时间CoQ10-LP样品的包封率,%;EEinitial,CoQ10-LP样品的初始包封率,%。
酸价和过氧化值的测定分别参照GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》和GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》的方法进行。
1.3.5 体外消化特性
取新鲜制备的CoQ10脂质体样品进行模拟体外消化实验,并以等含量的CoQ10粉末作为对照。取7.5 mL脂质体与7.5 mL人工唾液混合,调节pH值至6.8,在37 ℃下孵育2 min后,加入2 mL含有15.3 mg/L胃蛋白酶的模拟胃液,用盐酸将混合物调节至pH 2.5,在37 ℃下孵育2 h以模拟胃消化过程。收集30 mL胃消化食糜,加入1.5 mL模拟肠液和3.5 mL胆盐溶液,将pH值调节至7.0,加入2.5 mL胰酶溶液(36 mg /mL)在37 ℃下孵育2 h以模拟小肠消化。
在小肠消化的特定时间间隔,取适量消化食糜,于15 000 r/min离心30 min,分离并吸取上清液0.1 mL,加入0.1 mL乙醇振荡均匀,用1 mL正己烷萃取,10 000 r/min离心10 min分离正己烷,用前述HPLC方法测量CoQ10的量。根据公式(3)计算CoQ10的生物可接受率:
生物可接受率![]()
式中:mmicelle,胶束中CoQ10的质量,mg;minitial,样品中CoQ10的质量,mg。
1.4 数据统计与分析
所有数据均以3个独立实验的平均值±标准差表示,利用Origin进行绘图,利用SPSS 17.0对数据进行Duncan差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 CoQ10脂质体的表征
如图1-a所示,所制备的脂质体样品均为具有半透明外观的液体制剂,且随均质压力的提高,样品的透明度有所提升,这与脂质体粒径随均质压力下降,从而引起的悬浮液中大颗粒光散射现象减弱有关[12]。CoQ10-LP-Ⅰ粒径为(538.26±11.25) nm,多分散指数0.247±0.044;CoQ10-LP-Ⅱ的粒径为(240.21±7.23) nm,多分散指数为0.138±0.027;对于CoQ10-LP-Ⅲ,粒径则进一步下降为(130.17±3.13) nm,多分散指数0.096±0.011。多分散指数是脂质体粒径分布集中程度的度量[12]。随着样品制备过程均质压力的增加,粒径和多分散指数呈下降的趋势,说明在更高的均质压力条件下,微通道中强大的剪切力、冲击力和空化力使脂质体分散成更小且更均匀的颗粒[13-14]。磷脂分子构成的双层球状囊泡为亲脂性活性成分提供了嵌入空间和吸附位点[15]。如图1-b所示,所有脂质体样品的包封率均为96%左右,代表脂质体有效改善了CoQ10溶解性,实现较高水平包封。同时,各脂质体样品电位值(约-30 mV)无显著差异(P>0.05),这不同于CHUNG等[16]所报道的脂质体电位绝对值和包封率随均质压力和次数增大而降低的规律,其原因可能是后者所选择的更大的均质压力梯度和样品材料性质差异。
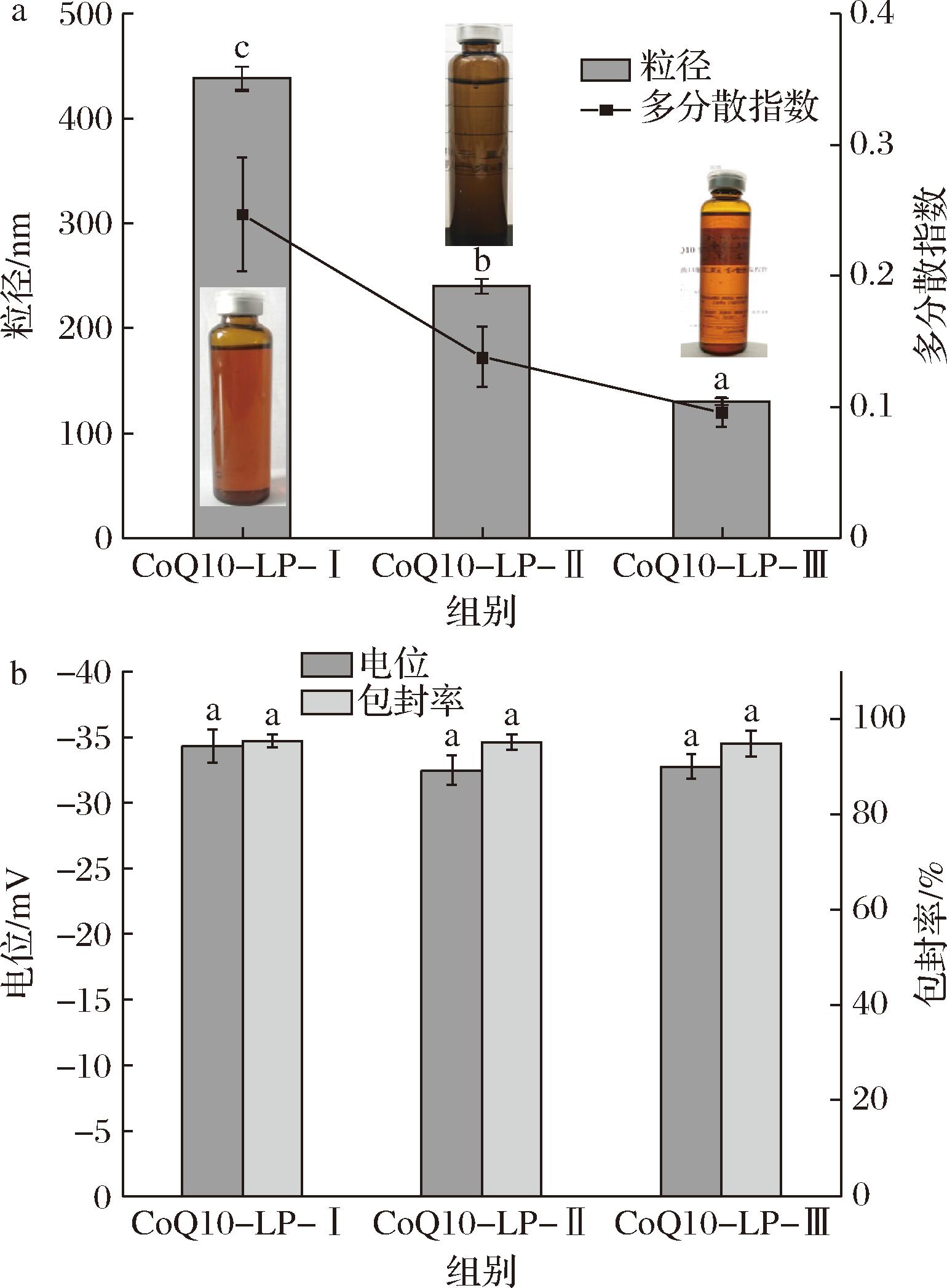
a-外观、粒径与多分散指数;b-电位与包封率
图1 脂质体的表征
Fig.1 Characterization of liposomes 注:相同颜色柱子上不同小写字母者表示差异显著(P<0.05)。
如图2所示,无压力条件(0 MPa)下制备的脂质体样品CoQ10-LP-Ⅰ具有最大的囊泡结构,且形状规整度较差,表面粗糙程度更高。相比之下,压力条件(50和100 MPa)下的CoQ10-LP-Ⅱ和CoQ10-LP-Ⅲ样品均为表面光滑、形状近圆的较小囊泡,这与粒径测量结果相一致。
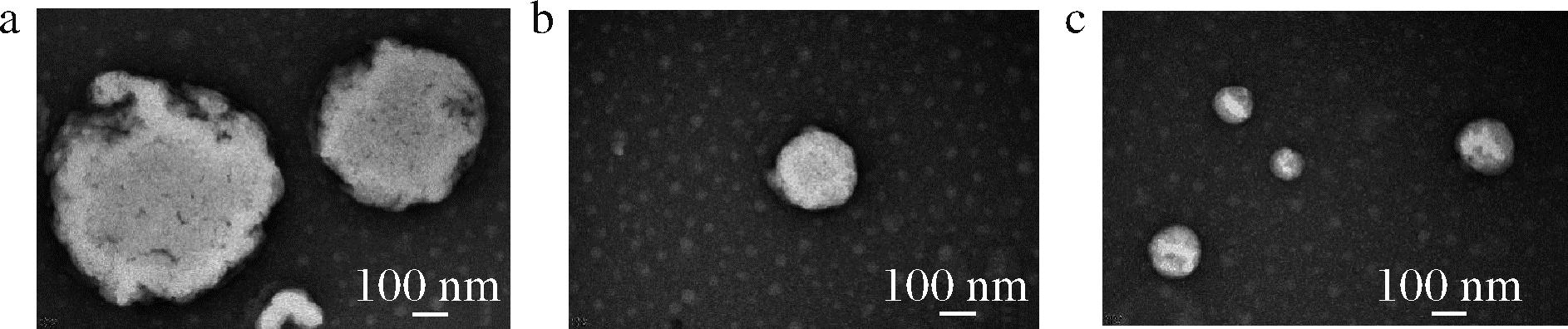
a-CoQ10-LP-Ⅰ;b-CoQ10-LP-Ⅱ;c-CoQ10-LP-Ⅲ
图2 CoQ10脂质体的微观结构
Fig.2 Microstructure of CoQ10 liposomes
2.2 稳定性分析
如图3所示,粒径分析表明,脂质体在贮藏期间粒径呈增大趋势,这与贮藏期间脂质体聚集、絮凝、聚结和颗粒融合,导致形成较大的囊泡有关[17-18]。在贮藏终点,CoQ10-LP-Ⅰ/Ⅱ/Ⅲ粒径分别增大至(650.12±18.30)、(351.02±18.12)、(331.64±15.53) nm,其中CoQ10-LP-Ⅲ粒径增幅最大。对此可能的原因是更高的均质压力在将脂质体破碎成更小粒径颗粒的同时,增大了比表面积,从而导致界面厚度下降,脂质体物理稳定性降低[19]。此外,脂质体在贮藏期间的聚集、絮凝和融合对脂质体的酸价和过氧化值均造成了不利影响。CoQ10-LP-Ⅰ的酸价和过氧化值均高于其余脂质体样品,说明50 MPa和100 MPa条件的高压均质处理在一定程度上改善了脂质体的贮藏稳定性。此外,相较于CoQ10-LP-Ⅱ,100 MPa处理的CoQ10-LP-Ⅲ具有更高的酸价和过氧化值[分别为(38.27±2.63) mg/g和(1.33±0.02) g/100 g]。可能是两方面原因导致:其一是囊泡融合过程中发生的脂质氧化;其二则是过度加工,即过高均质压力导致的更高频率碰撞和更高压力阀门温度对脂质氧化稳定性的潜在破坏[19-20],这说明过高压力的均质处理对脂质体的贮藏稳定性具有负面作用。
值得注意的是,CoQ10在贮藏过程中保留率的变化并未显示出与均质压力的关联趋势,且贮藏终点各样品保留率均维持在较高水平(>85%),证明脂质体是CoQ10稳态化递送的有效手段。
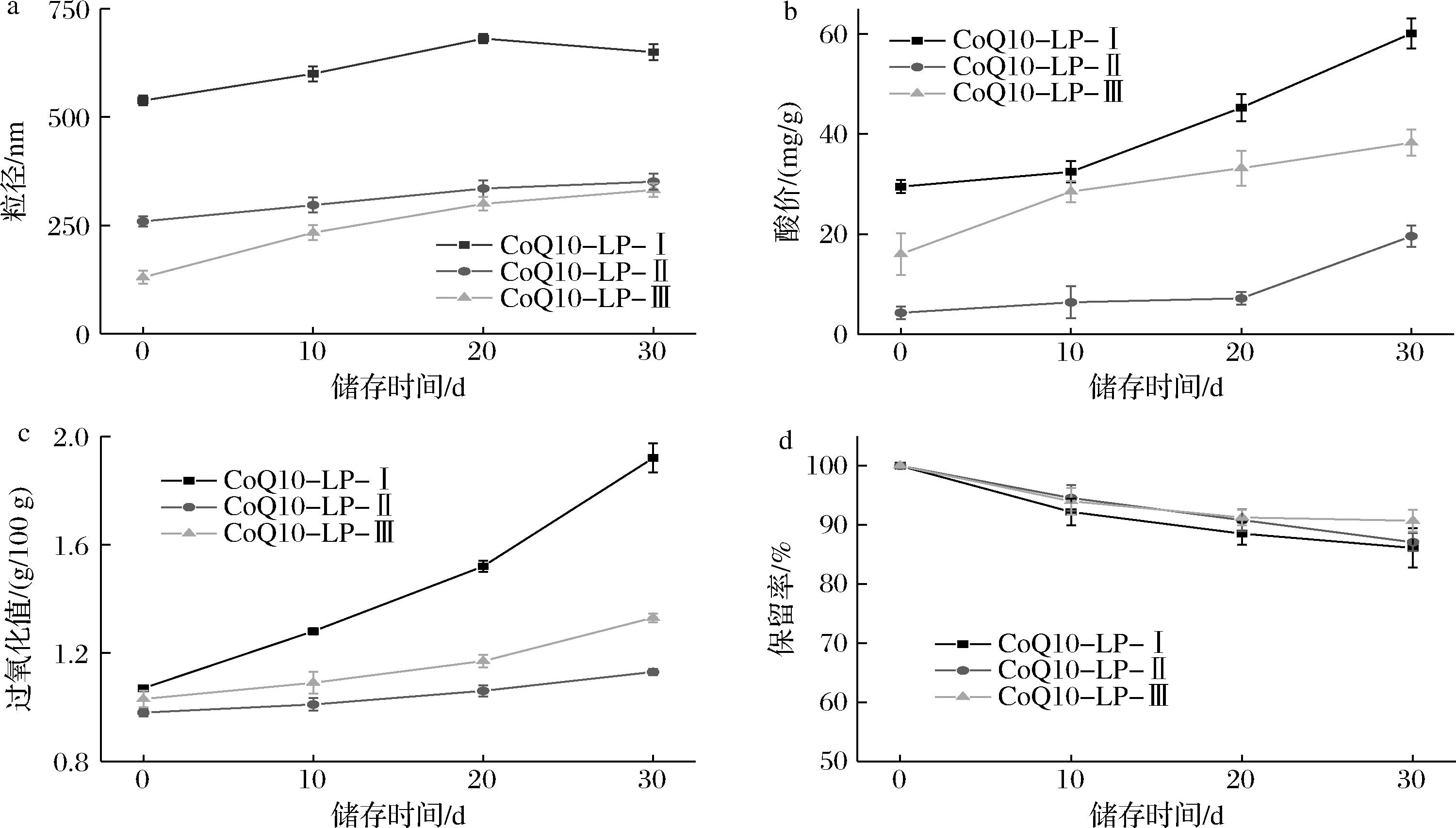
a-粒径;b-酸价;c-过氧化值;d-CoQ10保留率
图3 CoQ10脂质体贮藏稳定性的变化
Fig.3 Changes in storage stability of CoQ10 liposomes
2.3 模拟体外消化特性
脂质载体在消化过程中伴随着油脂消化释放出的游离脂肪酸在胆盐作用下胶束重组,为亲脂性活性成分提供增溶的疏水区域,从而提高其生物可接受率[21]。研究考察了模拟肠道消化实验终点的胶束相外观图像,并根据胶束中CoQ10含量计算其生物可接受率。如图4-a所示,CoQ10原料对照组的胶束相外观为澄清透明状,几乎无颜色,绝大部分CoQ10经离心而沉淀到离心管底部,说明绝大部分未被有效利用。相比之下,脂质体组胶束相均呈淡黄色,代表其所包封的CoQ10在在消化过程中被转移至胶束相,能够被生物体所吸收利用。生物可接受率的测算从数值层面展示了脂质体包封对CoQ10生物利用的提高程度(图4-b),其中原料对照组生物可接受率数值趋近于0,几乎不能被生物利用,这与其直接口服生物利用率极低相对应[22]。脂质体包封后,CoQ10-LP-Ⅰ/Ⅱ/Ⅲ生物可接受率分别提升为(20.86±1.26)%、(31.97±1.62)%和(31.61±2.72)%,说明脂质体包封对CoQ10生物可接受率提升显著。此外,50、100 MPa压力均质处理的脂质体胶束相颜色更深,生物可接受率更高,说明高压均质处理对CoQ10脂质体生物可接受率的改善具有积极意义。
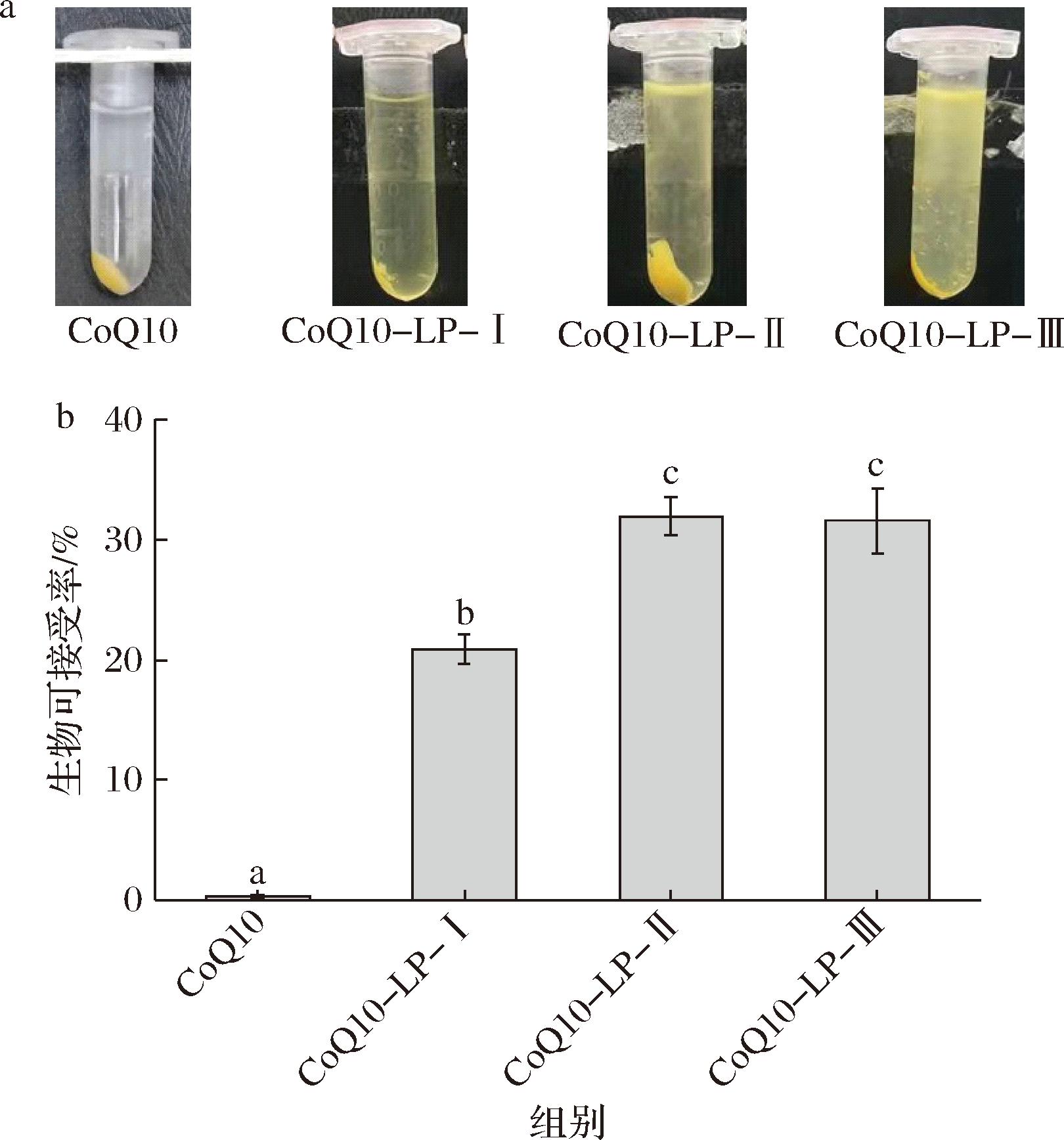
a-消化终点胶束相外观;b-CoQ10生物可接受率
图4 CoQ10脂质体的模拟体外消化特性
Fig.4 In vitro digestion properties of CoQ10 liposomes
3 结语
本研究使用脂质体包封的方式改善CoQ10的稳定性和生物可接受率,并研究了均质处理条件对脂质体理化特性、稳定性和消化特性的影响。表征结果表明,均质处理有效降低了脂质体的粒径和多分散指数,对脂质体的电位和包封率几乎未造成影响。稳定性分析显示,均质处理对脂质体的贮藏稳定性有一定程度的改善,但过高的均质压力可能对脂质体的酸价和过氧化值造成不利影响。模拟体外消化实验表明,脂质体包封对CoQ10生物可接受率提升显著,同时均质处理对生物可接受率也具有积极意义。综上,使用高压均质手段构建脂质体是实现CoQ10高稳定、高生物可接受率递送的有效手段,对开发CoQ10营养保健产品具有重要参考意义。
[1] GUTIERREZ-MARISCAL F M, YUBERO-SERRANO E M, VILLALBA J M, et al.Coenzyme Q10: From bench to clinic in aging diseases, a translational review[J].Critical Reviews in Food Science and Nutrition, 2019, 59(14):2240-2257.
[2] MARTELLI A, TESTAI L, COLLETTI A, et al.Coenzyme Q10:Clinical applications in cardiovascular diseases[J].Antioxidants, 2020, 9(4):341.
[3] FAROUGH S, KARAA A, WALKER M A, et al.Coenzyme Q10 and immunity:A case report and new implications for treatment of recurrent infections in metabolic diseases[J].Clinical Immunology, 2014, 155(2):209-212.
[4] BARROSO L, VIEGAS C, VIEIRA J, et al.Lipid-based carriers for food ingredients delivery[J].Journal of Food Engineering, 2021, 295:110451.
[5] LARGE D E, ABDELMESSIH R G, FINK E A, et al.Liposome composition in drug delivery design, synthesis, characterization, and clinical application[J].Advanced Drug Delivery Reviews, 2021, 176:113851.
[6] TAI K D, RAPPOLT M, HE X Y, et al.Effect of β-sitosterol on the curcumin-loaded liposomes:Vesicle characteristics, physicochemical stability, in vitro release and bioavailability[J].Food Chemistry, 2019, 293:92-102.
[7] TAI K D, RAPPOLT M, MAO L K, et al.Stability and release performance of curcumin-loaded liposomes with varying content of hydrogenated phospholipids[J].Food Chemistry, 2020, 326:126973.
[8] LIU X, WANG P, ZOU Y X, et al.Co-encapsulation of vitamin C and β-carotene in liposomes:Storage stability, antioxidant activity, and in vitro gastrointestinal digestion[J].Food Research International, 2020, 136:109587.
[9] BAI C Q, ZHENG J X, ZHAO L, et al.Development of oral delivery systems with enhanced antioxidant and anticancer activity:Coix seed oil and β-carotene coloaded liposomes[J].Journal of Agricultural and Food Chemistry, 2019, 67(1):406-414. [10] SHAH S, DHAWAN V, HOLM R, et al.Liposomes:Advancements and innovation in the manufacturing process[J].Advanced Drug Delivery Reviews, 2020, 154-155:102-122.
[11] ZHANG Y R, HE W, DU Y W, et al.Dimeric artesunate phospholipid-conjugated liposomes as promising anti-inflammatory therapy for rheumatoid arthritis[J].International Journal of Pharmaceutics, 2020, 579:119178.
[12] CHEN H W, FANG W P.A novel method for the microencapsulation of curcumin by high-pressure processing for enhancing the stability and preservation[J].International Journal of Pharmaceutics, 2022, 613:121403.
[13] AJEESHKUMAR K K, ANEESH P A, RAJU N, et al.Advancements in liposome technology:Preparation techniques and applications in food, functional foods, and bioactive delivery:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(2):1280-1306.
[14] BELTR N J D, RICAURTE L, ESTRADA K B, et al.Effect of homogenization methods on the physical stability of nutrition grade nanoliposomes used for encapsulating high oleic palm oil[J].LWT, 2020, 118:108801.
N J D, RICAURTE L, ESTRADA K B, et al.Effect of homogenization methods on the physical stability of nutrition grade nanoliposomes used for encapsulating high oleic palm oil[J].LWT, 2020, 118:108801.
[15] NAKHAEI P, MARGIANA R, BOKOV D O, et al.Liposomes:Structure, biomedical applications, and stability parameters with emphasis on cholesterol[J].Frontiers in Bioengineering and Biotechnology, 2021, 9:705886.
[16] CHUNG S K, SHIN G H, JUNG M K, et al.Factors influencing the physicochemical characteristics of cationic polymer-coated liposomes prepared by high-pressure homogenization[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2014, 454:8-15.
[17] YU J Y, CHUESIANG P, SHIN G H, et al.Post-processing techniques for the improvement of liposome stability[J].Pharmaceutics, 2021, 13(7):1023.
[18] CHEN L P, WU Z M, WU X W, et al.The application of coarse-grained molecular dynamics to the evaluation of liposome physical stability[J].AAPS PharmSciTech, 2020, 21(5):138.
[19] 李贞, 张开屏, 刘海英, 等.超高压均质提高豌豆蛋白稳定的乳状液的物理和氧化稳定性[J].粮食与油脂, 2021, 34(8):53-56. LI Z, ZHANG K P, LIU H Y, et al.Improvement of physical and oxidative stability of pea protein stabilized emulsion by ultra high pressure homogenization[J].Cereals &Oils, 2021, 34(8):53-56.
[20] HEBISHY E, BUFFA M, JUAN B, et al.Ultra high-pressure homogenized emulsions stabilized by sodium caseinate:Effects of protein concentration and pressure on emulsions structure and stability[J].LWT, 2017, 76:57-66.
[21] TAN C, ZHANG Y T, ABBAS S, et al.Modulation of the carotenoid bioaccessibility through liposomal encapsulation[J].Colloids and Surfaces B:Biointerfaces, 2014, 123:692-700.
[22] BANUN V J, REWATKAR P, CHAUDHARY Z, et al.Protein nanoparticles for enhanced oral delivery of coenzyme-Q10:In vitro and in silico studies[J].ACS Biomaterials Science &Engineering, 2023, 9(6):2846-2856.