柑橘(Citrus reticulata Blanco.)为芸香科柑橘属植物,是全世界种植的最重要水果作物之一,每年全世界柑橘类水果废弃物的数量几乎占新鲜水果的一半,对环境造成了严重污染[1]。柑橘富含类黄酮、类柠檬苦素、生物碱等生物活性物质,其中类柠檬苦素是柑橘类水果废物(种子、果皮为主)的重要成分。柠檬苦素、诺米林和黄柏酮是柑橘类柠檬苦素的3种主要苷元[2]。现代研究表明,柠檬苦素具有消炎、抗病毒、抗癌、抗氧化作用,诺米林和黄柏酮在癌症和病毒的治疗中也表现出重要作用[2-3]。
目前,柠檬苦素类化合物主要采用液-固萃取[4-5]、超声辅助萃取[6-7]和微波辅助萃取[8-9]进行提取,在这个过程中会使用有机溶剂(例如甲醇、丙酮和二氯甲烷),这些试剂具有易挥发、易燃、有毒对环境和人体健康有害等缺点[10]。自ABBOTT等[11]发现季铵盐和酰胺在低温下能形成透明均匀的液体,首次提出了共晶溶剂的概念。作为绿色可持续溶剂,天然低共熔溶剂(natural deep eutectic solvents,NADESs)是在深共熔溶剂(deep eutectic solvents,DESs)之后出现的,氢键受体(hydrogen-bond acceptor, HBA)和氢键供体(hydrogen-bond donor, HBD)主要通过分子间氢键结合,通过调节HBAs与HBDs的类型和摩尔比,可以获得不同理化性质的NADESs[12]。NADESs的熔点极低,具有绿色、无毒、生物降解性好等优点,克服了传统有机溶剂易挥发、毒性大的缺点[13-14]。因此NADESs在天然成分提取中的应用越来越多,例如提取酚类[15]、黄酮类[16]、生物碱[17]、多糖[18]和植物色素[19]等物质,其中以氯化胆碱为氢键受体的研究较多[20]。
本研究采用超声辅助提取法提取柑橘籽中的柠檬苦素类化合物,共制备了13种NADESs,筛选出最佳提取溶剂。采用响应面法对液固比、含水量、提取时间和提取温度进行优化,得到最佳提取工艺,旨在建立一种绿色环保的类柠檬苦素的提取方法,为柑橘类水果废弃物的开发利用提供一定的理论支撑。
1 材料与方法
1.1 实验材料与试剂
柑橘籽,实验室自制;柠檬苦素、诺米林和黄柏酮标准品(HPLC≥98%),上海源叶生物科技有限公司;尼罗红,上海麦克林生化科技有限公司;用于制备NADESs的试剂包括氯化胆碱(ChCl,98%)、柠檬酸(Ca,≥99.5%)、DL-乳酸(La,85%~90%)、二氯乙酸(Bca,95%),上海麦克林生化科技有限公司;丙二酸、DL-酒石酸、蔗糖、葡萄糖为分析纯,成都市科隆化学品有限公司;乙二醇、丙三醇、脲素、甲酸、无水乙醇为分析纯,重庆川东化工(集团)有限公司;1,2-丙二醇,国药集团化学试剂有限公司;甲醇、乙腈(HPLC),上海星可高纯溶剂有限公司。
1.2 仪器与设备
Milli-Q AdvantageA10超纯水系统,美国Millipore;NDJ-5S数字显示黏度计,中国LICHEN-BX有限公司;S230 Seven Compact电导率仪,梅特勒-托利多仪器(上海)有限公司;PHSJ-3F雷磁pH计,上海仪电科学仪器股份有限公司;cary50紫外分光光度计,美国Agilent公司;SB5200D型超声波清洗器,宁波新芝仪器公司;UPLC色谱仪(2996PDA检测器),美国Waters公司;IECCL31R台式冷冻离心机,德国Thermo Fisher公司;SZCL智能型数字式恒温加热磁力搅拌器,郑州科泰有限公司。
1.3 实验方法
1.3.1 样品预处理
收集实验室废弃柑橘籽,洗净后,45 ℃热风风干,粉碎后过40目筛,然后加入4倍体积石油醚,常温振荡2次,每次10 h,除去石油醚后,放置通风橱挥发至无醚味,获得脱脂柑橘种籽粉末,密封保存备用。
1.3.2 天然低共熔溶剂的制备
根据摩尔比,将氢键受体与氢键供体混合,在60~80 ℃加热搅拌制备13种不同的NADESs,详见表1。
表1 NADESs 的组成
Table 1 Composition of the NADESs
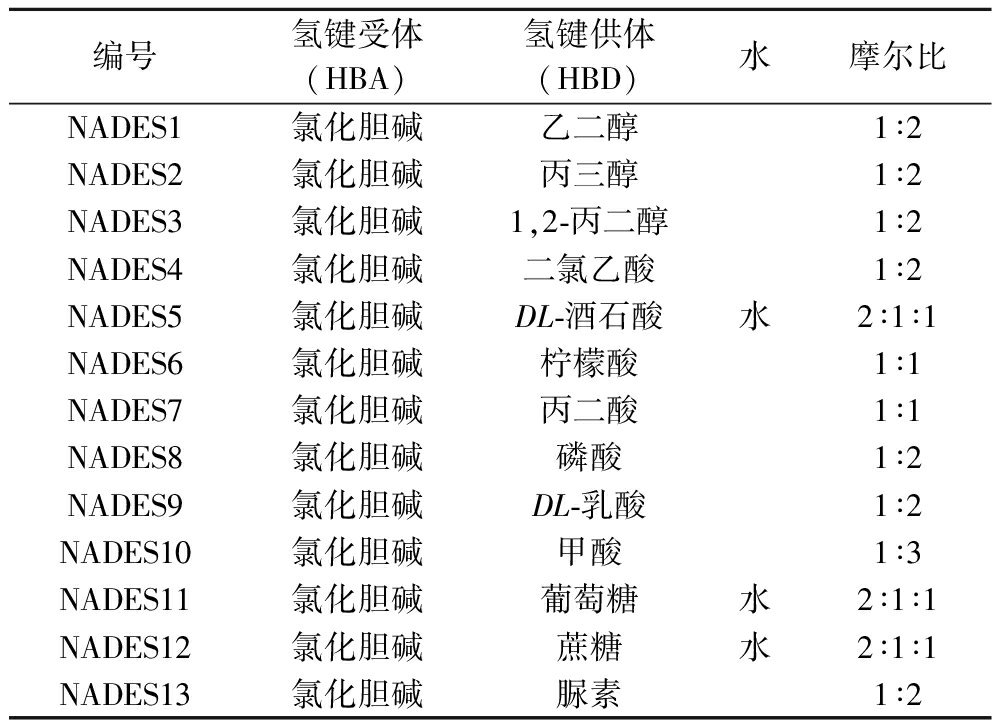
编号氢键受体(HBA)氢键供体(HBD)水摩尔比NADES1氯化胆碱乙二醇1∶2NADES2氯化胆碱丙三醇1∶2NADES3氯化胆碱1,2-丙二醇1∶2NADES4氯化胆碱二氯乙酸1∶2NADES5氯化胆碱DL-酒石酸水2∶1∶1NADES6氯化胆碱柠檬酸1∶1NADES7氯化胆碱丙二酸1∶1NADES8氯化胆碱磷酸1∶2NADES9氯化胆碱DL-乳酸1∶2NADES10氯化胆碱甲酸1∶3NADES11氯化胆碱葡萄糖水2∶1∶1NADES12氯化胆碱蔗糖水2∶1∶1NADES13氯化胆碱脲素1∶2
1.3.3 天然低共熔溶剂的理化性质
1.3.3.1 极性测定
参照伏琳玥等[21]的方法,使用尼罗红染料作为溶剂显色探针,添加到NADESs中,在400~800 nm波长下光谱扫描,记录最大吸收波长,尼罗红极性参数ENR计算见公式(1):
式中:ENR,尼罗红极性参数,kcal/mol;h,普朗克常数;c,真空光速,m/s;NA,阿伏加德罗常数;λmax,最大紫外吸收波长。
1.3.3.2 黏度测定
黏度测试在室温下使用数字黏度计进行。所需的转子为1#、2#、3#和4#,在6、12、30、60 r/min下测量,测量值和满值之间的百分比值为15%~85%,确保精确度。
1.3.3.3 pH和电导率测定
使用pH计在室温下检测NADESs的pH。
电导率仪首先用0.000 56 mol/L KCl溶液在室温下进行校准,所有后续测试在室温下进行。
1.3.4 柠檬苦素类化合物的提取
采用超声波辅助提取法提取柑橘籽中的柠檬苦素类化合物。具体操作方法如下:称取脱脂柑橘种籽粉末0.5 g,在离心管中加入5 mL NADESs(30%含水量,体积分数),在50 ℃下超声波提取30 min(功率200 W,频率40 kHz)。提取后,将混合物以8 000 r/min离心8 min,在HPLC分析之前,用甲醇将上清液进行稀释定量,每组实验重复3次。
作为对照样品,用体积分数80%乙醇溶剂按以上述操作方法提取柠檬苦素类化合物。其得率按公式(2)计算:
得率![]()
式中:ρ,NADESs待测液中柠檬苦素、诺米林和黄柏酮的质量浓度,mg/mL;V,样品体积,mL;N,稀释倍数;m,称取脱脂柑橘种籽粉末质量,g。
1.3.5 类柠檬苦素含量测定
参照孟鹏等[22]的超高效液相色谱方法并作适当修改。色谱柱为ACQUITY UPLC BEH C18分析柱(2.1 mm×100 mm,1.7 μm);洗脱程序:进样量3 μL;柱温35 ℃;流速0.3 mL/min;检测波长210 nm;流动相为V(乙腈)∶V(水) =40∶60。
标准曲线的绘制:柠檬苦素、诺米林和黄柏酮用纯甲醇定容至10 mL,制得母液,然后稀释为0.1、0.2、0.5、1、2、5、10、20、50 mg/L一系列混标,绘制标准曲线,试验结果见表2。
表2 柠檬苦素、诺米林和黄柏酮的标准曲线和线性范围
Table 2 Standard curve and linear range of limonin, nomilin and phellodendron ketone

化合物名称标准曲线R2线性范围/(mg/L)柠檬苦素y=3 516.24x-448.730.999 60.5~50诺米林y=2 641.76x-328.250.998 90.5~50黄柏酮y=13 293.01x+2 730.890.999 00.2~50
1.3.6 单因素试验
从1.3.4节提取结果中筛选出类柠檬苦素得率最高的NADES组合,分别以选取的NADES摩尔比(2∶1、1∶1、1∶3、1∶4、1∶5)、含水量(10%、20%、30%、40%、50%、60%)、液固比[10∶1、20∶1、30∶1、40∶1、50∶1(mL∶1g)]、提取时间(10、20、30、50、60 min)及提取温度(20、30、40、50、60 ℃) 为变量进行单因素试验。
1.3.7 响应面优化实验设计
依据Box-Behnken实验设计原则,同时结合单因素试验结果,选取4个因素:(A)含水量、(B)液固比、(C)提取时间和(D)提取温度,各取3个水平分别记为水平-1、0、1,进行响应曲面分析试验,响应面实验因素与水平设计见表3。
表3 响应面实验因素与水平设计
Table 3 Response surface experimental factors and level design
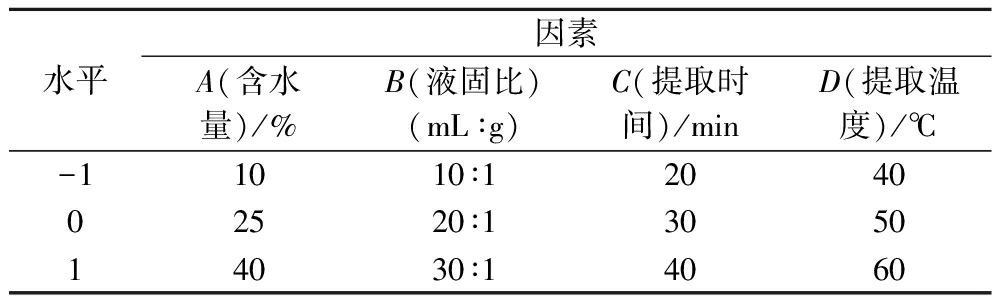
水平因素A(含水量)/%B(液固比)(mL∶g)C(提取时间)/minD(提取温度)/℃-11010∶1204002520∶1305014030∶14060
1.4 数据分析
所有数据点均为重复3次实验的“平均值±标准偏差”。数据采用Excel 2019、Design-Expert 10.0.7进行响应面实验设计及数据统计,使用Origin 2021进行图表绘制。
2 结果与分析
2.1 NADESs理化性质
制备的13种NADESs在室温下均为透明均匀的液体。NADESs的物理和化学性质随着HBDs和HBAs的类型和摩尔比而变化。制备的NADESs的极性参数、黏度、电导率和pH如表4所示。物质的溶解度和熔点受极性影响,采用尼罗红极性参数ENR来确定NADESs的极性(电子版增强出版附图1所示https://doi.org/10.13995/j.cnki.11-1802/ts.033762)。ENR 值越小,NADESs的极性越强,13种NADESs极性表现为有机酸基>胺基>糖基>醇基。NADESs黏度降低可以增加液-液传质作用,提高天然产物提取效率。在制备的13种NADESs中,除NADESs10外,醇基NADESs的黏度较小,蔗糖、柠檬酸作为氢键供体时,NADESs黏度最大,可能是因为存在更强大的三维分子间氢键网络。从电导率的角度来看,除NADES10外,醇基NADESs表现出更高的电导率,其中NADES6与NADES12虽然形成了无色均一的低共熔混合物,但黏度过大,在室温下流动性差,无法准确测量电导率和pH。NADESs的pH 受氢键供体影响较大,由表看出,氯化胆碱-醇基、氯化胆碱-糖类的NADESs体系为弱酸性到弱碱性,氯化胆碱-有机酸的NADESs为酸性,氯化胆碱-脲素的NADESs为碱性。
表4 十三种NADESs的极性参数、黏度、电导率和pH
Table 4 Polarity parameters, viscosity, conductivity and pH of 13 NADESs
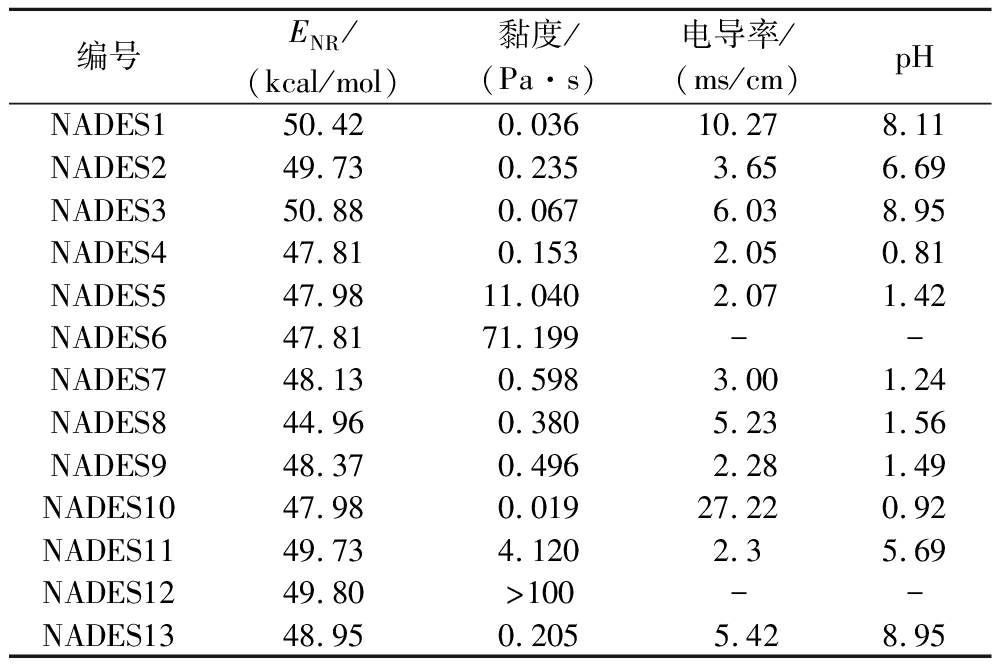
编号ENR/(kcal/mol)黏度/(Pa·s)电导率/(ms/cm)pHNADES150.420.03610.278.11NADES249.730.2353.656.69NADES350.880.0676.038.95NADES447.810.1532.050.81NADES547.9811.0402.071.42NADES647.8171.199--NADES748.130.5983.001.24NADES844.960.3805.231.56NADES948.370.4962.281.49NADES1047.980.01927.220.92NADES1149.734.1202.35.69NADES1249.80>100--NADES1348.950.2055.428.95
2.2 NADESs 提取柑橘籽柠檬苦素类化合物的比较
制备了由HBA(氯化胆碱)和4类HBDs(有机酸、多元醇、糖和胺)组成的13种不同的NADESs来提取柑橘籽的柠檬苦素类化合物。提取参数设定为液固比10 mL/g,含水量30%,提取时间30 min,提取温度50 ℃,超声波功率200 W。柠檬苦素、诺米林和黄柏酮是柑橘籽中主要的柠檬苦素类化合物,以其为评价指标,结果如图1和电子版增强出版附表1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.033762)。
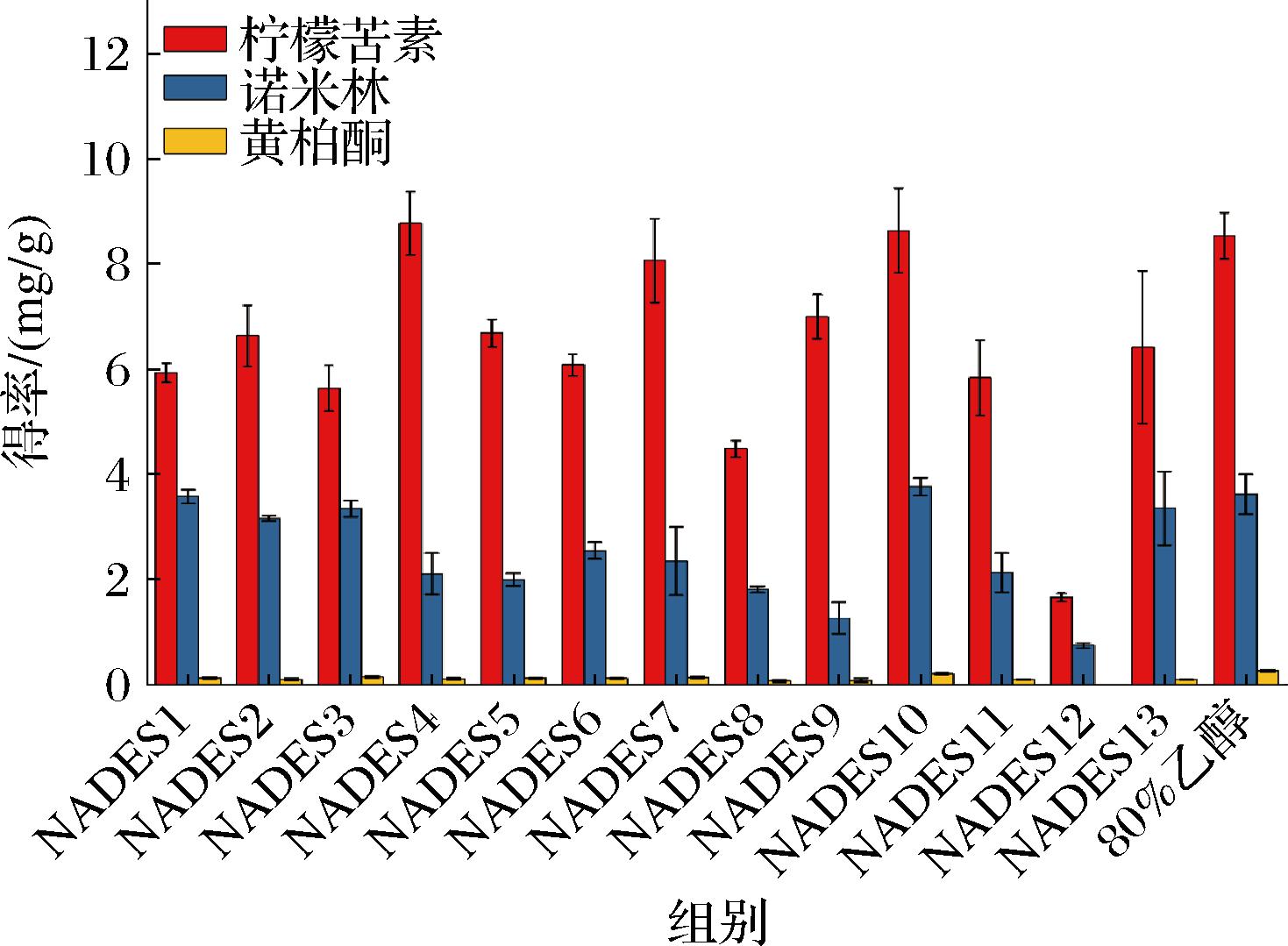
图1 不同NADESs对柑橘籽中柠檬苦素、 诺米林和黄柏酮的得率
Fig.1 The yield of limonin, nomilin and phellodendron ketone in citrus seeds by different NADESs
NADESs的类型对从柑橘籽中提取柠檬苦素类化合物的效率有显著影响。以有机酸为氢键供体的低黏度NADESs表现出较好的提取率,NADES10提取效率最高[柠檬苦素为(8.64±0.81) mg/g、诺米林为(3.77±0.17) mg/g、黄柏酮为(0.26±0.02) mg/g]。有机酸基NADESs可以更好地破坏和溶解细胞壁,这是提高提取率的原因之一[23],另一方面柑橘籽中类柠檬苦素主要是柠檬苦素,其在酸性条件下容易发生闭环反应,较低的pH可以促进柠檬苦素D环内酯水解酶催化柠檬苦素A环内酯转化成柠檬苦素[24],从而提高类柠檬苦素化合物的总量。NADES5和6虽然其pH值低,但其高黏度影响了传质效果,导致提取率较低。对醇基的 NADESs,羟基的增加使醇更容易与氯化胆碱形成分子内氢键,导致黏度增加,提取率降低[12]。此外,为了评估NADES作为常规溶剂的可能替代品,与80%乙醇的提取效率进行比较,结果显示与传统溶剂获得的结果相当。综上所述,选择氯化胆碱和甲酸制备的NADES作为提取柠檬苦素类化合物的溶剂。
2.3 单因素试验结果
由于柠檬苦素、诺米林和黄柏酮的提取趋势一致,所以在优化提取工艺时,提取率以3种物质的总和计算。单因素试验结果表明,3种成分的总含量在NADES11摩尔比为1∶4、提取温度50 ℃、提取时间30 min、含水量20%、液固比10∶1(mL∶g)时达到最高(图2)。
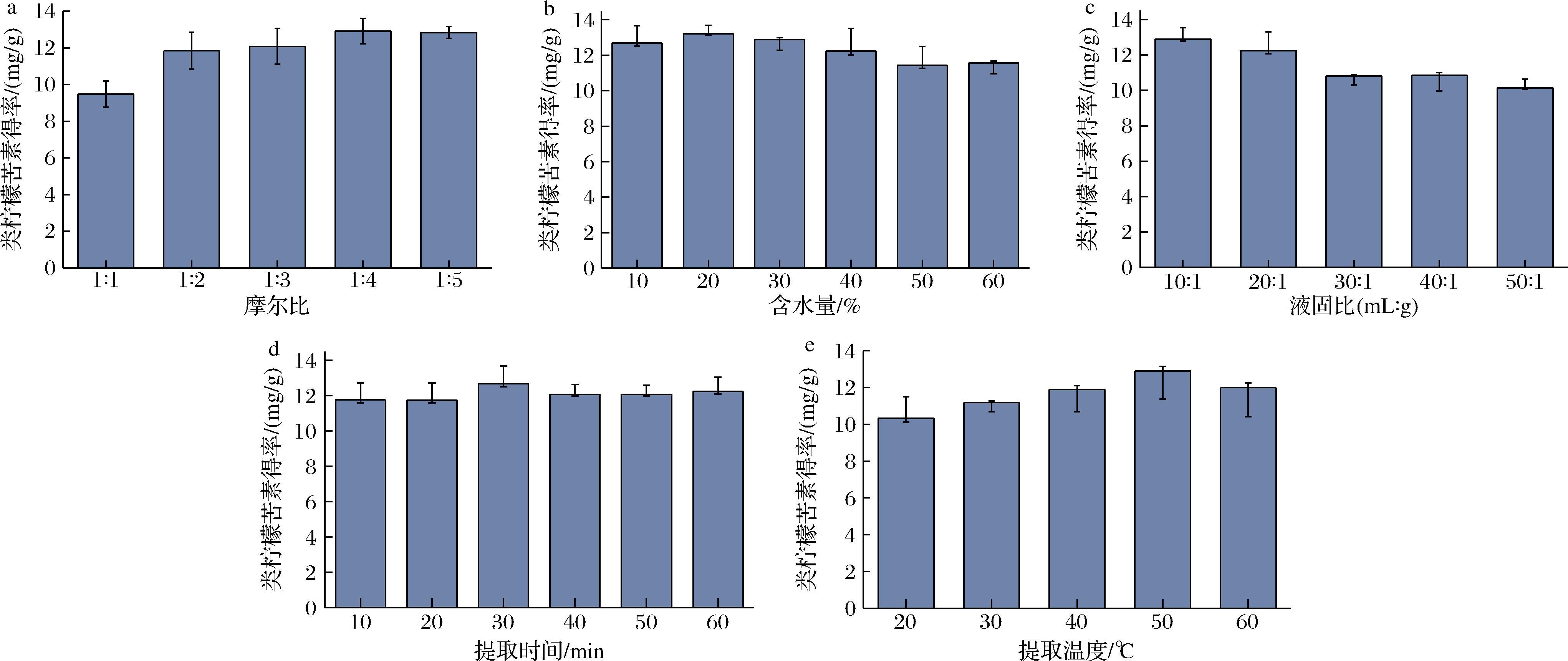
a-摩尔比;b-含水量;c-液固比;d-提取时间;e-提取温度
图2 摩尔比、含水量、液固比、提取时间和提取温度对类柠檬苦素总含量的影响
Fig.2 Effects of molar ratio, water content, solid-liquid ratio, extraction time and extraction temperature on the total content of limonoids
2.4 响应面实验结果分析
2.4.1 回归方程模型与方差分析
根据2.3节结果分析,设定氯化胆碱与甲酸摩尔比为1∶4,选取含水量(A)、液固比(B)、提取时间(C)、提取温度(D)作为单因素,以柠檬苦素类化合物得率为响应值,进行响应面优化实验,Box-Behnken实验设计与结果见电子版增强出版附表2所示(https://doi.org/10.13995/j.cnki.11-1802/ts.033762)。运用Design expert 10.0.7数据分析软件对试验数据进行多元回归拟合,得到二次多项回归方程如下:
Y得率=8.88-0.81A-1.12B-0.047C-0.32D+0.15AB-0.68AC-0.025AD+0.34BC+0.043BD+0.99CD+1.17A2+1.3B2-0.04C2+1.47D2。
得率模型回归方差分析(ANOVA)的结果见表5。由表5可知该回归模型极显著(P<0.01),失拟项不显著(P=0.078>0.05),模型拟合程度好,表明可用该模型对得率进行分析和预测。同时模型回归系数R2=0.950 7,调节后的R2=0.901 4,表明模型与实际提取过程具有较高的拟合度,方程可靠性较高。
表5 得率模型及回归系数的回归分析结果
Table 5 Regression analysis results of yield model and regression coefficient
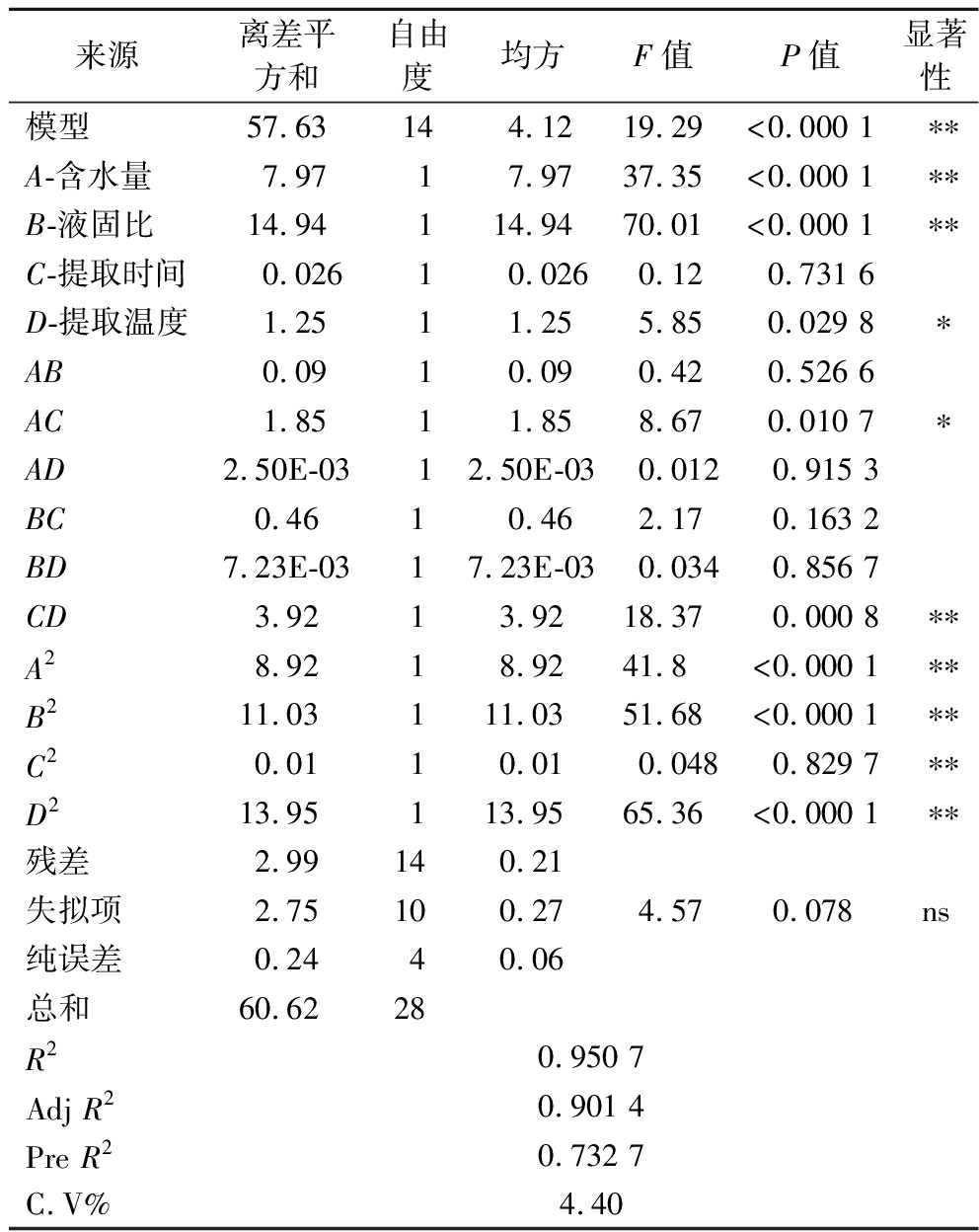
来源离差平方和自由度均方F值P值显著性模型57.63144.1219.29<0.000 1∗∗A-含水量7.9717.9737.35<0.000 1∗∗B-液固比14.94114.9470.01<0.000 1∗∗C-提取时间0.02610.0260.120.731 6D-提取温度1.2511.255.850.029 8∗AB0.0910.090.420.526 6AC1.8511.858.670.010 7∗AD2.50E-0312.50E-030.012 0.915 3BC0.4610.462.17 0.163 2BD7.23E-0317.23E-030.034 0.856 7CD3.9213.9218.37 0.000 8∗∗A28.9218.9241.8<0.000 1∗∗B211.03111.0351.68<0.000 1∗∗C20.0110.010.0480.829 7∗∗D213.95113.9565.36<0.000 1∗∗残差2.99140.21失拟项2.75100.274.570.078ns纯误差0.2440.06总和60.6228R20.950 7Adj R20.901 4Pre R20.732 7C.V%4.40
注:P<0.01为极显著,用**表示,P<0.05为显著,用*表示,P>0.05为不显著,用ns表示。
通过分析方差数据可以看出,一次项含水量、液固比对得率具有极显著影响(P<0.01),提取温度对得率具有显著影响(P<0.05),分析各因素的主效应关系为:B>A>D>C,即液固比>含水量>提取温度>提取时间。其二次项交互作用CD对得率具有极显著的影响(P<0.01),AC对得率具有显著的影响(P<0.05),AB、AD、BC、BD对得率的影响不显著(P>0.05)。
2.4.2 响应面分析及最佳工艺验证
利用Design Expert 10.0.7软件得到响应面图,可以直观分析各因素间的交互作用强弱。由图3可知,A与C、C与D之间对类柠檬苦素的提取均有显著影响,且C与D之间相应曲面倾斜度最高,说明提取温度和提取时间的交互作用对类柠檬苦素的得率有极显著影响,含水量与提取时间的交互作用次之。响应曲面陡峭程度为CD>AC>BC>AB>BD>AD,这与方差分析结果一致。
根据回归方程模型,得到预测的最优条件为:含水量12.038%、液固比10.229∶1(mL∶g)、提取时间33.909 min、提取温度59.852 ℃。本着成本节约及最大限度提取有效成分的原则,将该条件依据实验实际情况修正为含水量12%、液固比10∶1(mL∶g)、提取时间34 min、提取温度60 ℃,在此最优条件下经3次平行试验实际得率为(13.87±0.28) mg/g,与预测值总得率为14.47 mg/g,在5%偏差范围内相差不大,证实了预测值和实验值之间的良好相关性。
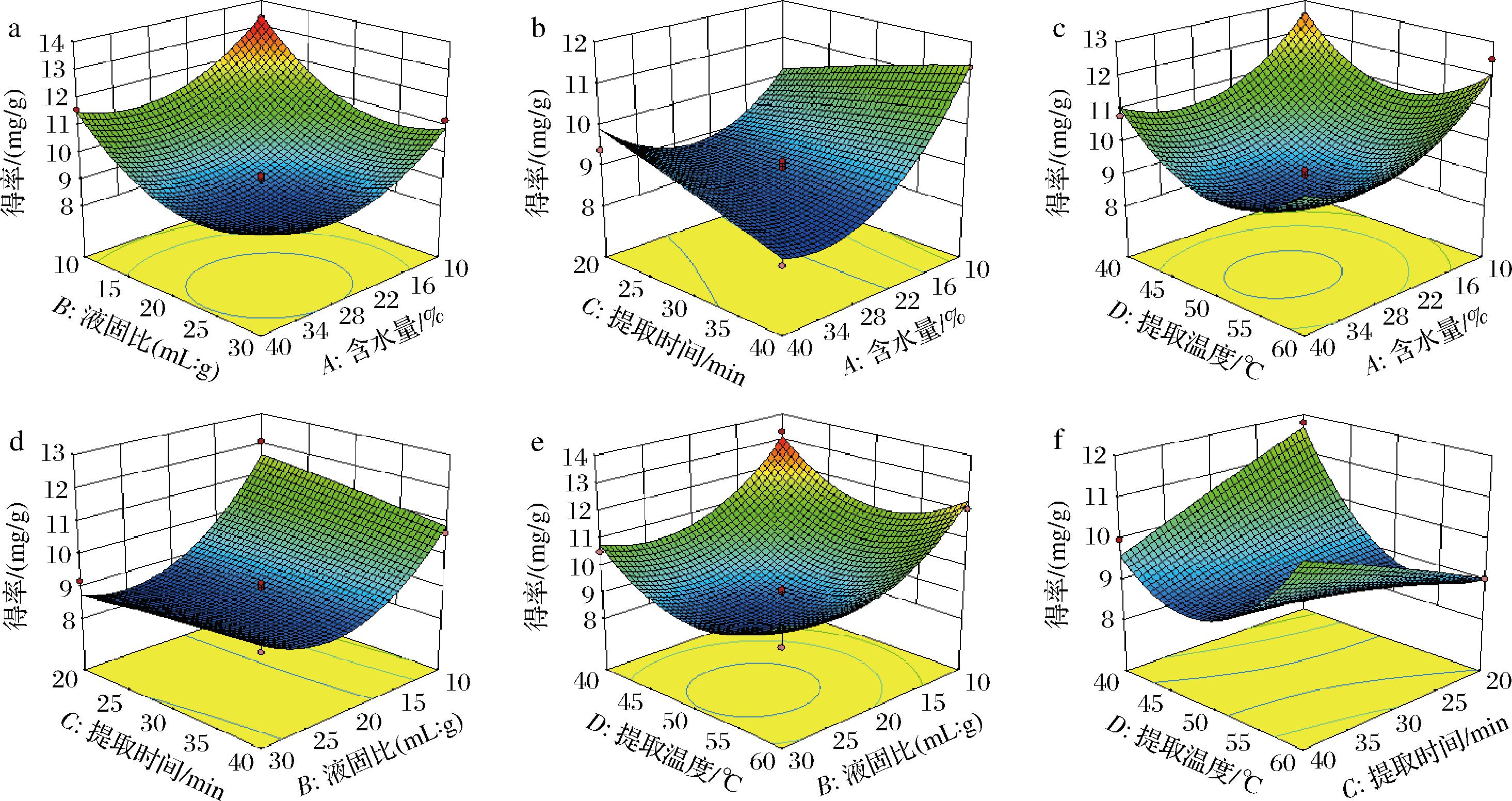
a-液固比-含水量;b-提取时间-含水量;c-提取温度-含水量;d-提取时间-液固比;e-提取温度-液固比;f-提取温度-提取时间
图3 各因素对目标成分总提取效率影响的响应曲面图
Fig.3 Response surface diagram of the influence of various factors on the total extraction efficiency of target components
3 结论
综上所述,建立了一种基于天然低共熔溶剂的绿色有效提取方法,并成功应用于柑橘籽中柠檬苦素类化合物的提取。对NADESs的极性、黏度、pH和电导率理化性质进行测定,在制备的13种NADESs中,氯化胆碱-甲酸(摩尔比1∶4)对柠檬苦素、诺米林和黄柏酮的提取效率最好。通过响应面法确定最优提取工艺为液固比10∶1(mL∶g)、含水量12% (体积分数)、提取温度60 ℃、提取时间34 min,在此条件下类柠檬苦素提取率为13.87 mg/g。NADESs 显示了其作为提取天然产物中生物活性物质的溶剂的潜力,为柑橘水果废弃物的开发利用提供了新型环保的研究方法。
[1] MAHATO N, SHARMA K, SINHA M, et al.Bio-sorbents, industrially important chemicals and novel materials from citrus processing waste as a sustainable and renewable bioresource:A review[J].Journal of Advanced Research, 2020, 23:61-82.
[2] SHI Y S, ZHANG Y, LI H T, et al.Limonoids from citrus:Chemistry, anti-tumor potential, and other bioactivities[J].Journal of Functional Foods, 2020, 75:104213.
[3] GUALDANI R, CAVALLUZZI M M, LENTINI G, et al.The chemistry and pharmacology of citrus limonoids[J].Molecules, 2016, 21(11):1530.
[4] QIN S, LV C H, WANG Q S, et al.Extraction, identification, and antioxidant property evaluation of limonin from pummelo seeds[J].Animal Nutrition, 2018, 4(3):281-287.
[5] VIKRAM A, JAYAPRAKASHA G K, PATIL B S.Simultaneous determination of citrus limonoid aglycones and glucosides by high performance liquid chromatography[J].Analytica Chimica Acta, 2007, 590(2):180-186.
[6] YU H, WANG C, DENG S T, et al.Optimization of ultrasonic-assisted extraction and UPLC-TOF/MS analysis of limonoids from lemon seed[J].LWT, 2017, 84:135-142.
[7] DE PAULA J A M, BRITO L F, CAETANO K L F N, et al.Ultrasound-assisted extraction of azadirachtin from dried entire fruits of Azadirachta indica A.Juss.(Meliaceae) and its determination by a validated HPLC-PDA method[J].Talanta, 2016, 149:77-84.
[8] NANA O, MOMENI J, BOYOM F F, et al.Microwave-assisted extraction as an advanced technique for optimisation of limonoid yields and antioxidant potential from Trichilia roka (Meliaceae)[J].Current Research in Green and Sustainable Chemistry, 2021, 4:100147.
[9] SUTTIARPORN P, CHOOMMONGKOL V.Microwave-assisted improved extraction and purification of anticancer nimbolide from Azadirachta indica (neem) leaves[J].Molecules, 2020, 25(12):2913. [10] G MEZ-URIOS C, VI
MEZ-URIOS C, VI AS-OSPINO A, PUCHADES-COLERA P, et al.Sustainable development and storage stability of orange by-products extract using natural deep eutectic solvents[J].Foods, 2022, 11(16):2457.
AS-OSPINO A, PUCHADES-COLERA P, et al.Sustainable development and storage stability of orange by-products extract using natural deep eutectic solvents[J].Foods, 2022, 11(16):2457.
[11] ABBOTT A P, CAPPER G, DAVIES D L, et al.Novel solvent properties of choline chloride/urea mixtures[J].Chemical Communications, 2003(1):70-71.
[12] ZUO J L, MA P R, GENG S Q, et al.Optimization of the extraction process of flavonoids from Trollius ledebouri with natural deep eutectic solvents[J].Journal of Separation Science, 2022, 45(3):717-727.
[13] ZUO J L, GENG S Q, KONG Y Z, et al.Current progress in natural deep eutectic solvents for the extraction of active components from plants[J].Critical Reviews in Analytical Chemistry, 2023, 53(1):177-198.
[14] QIN H, HU X T, WANG J W, et al.Overview of acidic deep eutectic solvents on synthesis, properties and applications[J].Green Energy &Environment, 2020, 5(1):8-21.
[15] JURI T, MI
T, MI I
I N, POTKONJAK A, et al.The evaluation of phenolic content, in vitro antioxidant and antibacterial activity of Mentha piperita extracts obtained by natural deep eutectic solvents[J].Food Chemistry, 2021, 362:130226.
N, POTKONJAK A, et al.The evaluation of phenolic content, in vitro antioxidant and antibacterial activity of Mentha piperita extracts obtained by natural deep eutectic solvents[J].Food Chemistry, 2021, 362:130226.
[16] ZHANG H L, HAO F L, YAO Z F, et al.Efficient extraction of flavonoids from Polygonatum sibiricum using a deep eutectic solvent as a green extraction solvent[J].Microchemical Journal, 2022, 175:107168.
[17] JIANG Z M, WANG L J, GAO Z, et al.Green and efficient extraction of different types of bioactive alkaloids using deep eutectic solvents[J].Microchemical Journal, 2019, 145:345-353.
[18] ZHANG W D, CHENG S B, ZHAI X N, et al.Green and efficient extraction of polysaccharides from Poria cocos F.A.wolf by deep eutectic solvent[J].Natural Product Communications, 2020, 15(2):1-10.
[19] DA SILVA D T, PAULETTO R, DA SILVA CAVALHEIRO S, et al.Natural deep eutectic solvents as a biocompatible tool for the extraction of blueberry anthocyanins[J].Journal of Food Composition and Analysis, 2020, 89:103470.
[20] 何瑞阳, 王锋, 苏小军, 等.玉竹多糖低共熔溶剂提取工艺优化及其抗氧化和抗糖基化活性研究[J].食品与发酵工业, 2022, 48(8):190-198. HE R Y, WANG F, SU X J, et al.Optimization of extraction process of Polygonatum odoratum polysaccharide by deep eutectic solvent and its antioxidant and anti glycosylation activities[J].Food and Fermentation Industries, 2022, 48(8):190-198.
[21] 伏琳玥, 刘学.基于低共熔溶剂分离黑种草子油中抗氧化活性物质[J].中国油脂, 2021, 46(11):44-49. FU L Y, LIU X.Separation of antioxidant activity components from black cumin seed oil by deep eutectic solvents[J].China Oils and Fats, 2021, 46(11):44-49.
[22] 孟鹏, 郑宝东.超高效液相色谱法快速并同时检测金柑中柠檬苦素和诺米林[J].中国食品学报, 2013, 13(2):177-181. MENG P, ZHENG B D.Study on rapid simultaneous determination of limonin and nomilin in kumquat using ultra-performance liquid chromatography[J].Journal of Chinese Institute of Food Science and Technology, 2013, 13(2):177-181.
[23] WANG J Q, JING W Q, TIAN H Y, et al.Investigation of deep eutectic solvent-based microwave-assisted extraction and efficient recovery of natural products[J].ACS Sustainable Chemistry &Engineering, 2020, 8(32):12080-12088.
[24] HUANG S J, DONG T T, XIONG B, et al.Variation in the content and composition of limonoids in fruits of four pomelo varieties during fruit development:The natural debittering process in pomelo fruits[J].Journal of Food Composition and Analysis, 2021, 100:103928.