魔芋葡甘聚糖(konjac glucomannan, KGM)是我国西南贫困山区重要经济作物魔芋的主要成分,是一种优质的膳食纤维,具有高分子材料特性和多种生理活性功能,广泛应用于食品、医药、生物材料等领域[1-2]。然而,KGM水溶胶稳定性较差,其凝胶制品易脱水收缩,这些缺点限制了其应用范围[3]。为更好满足生产需求,改性是重要技术手段,其中化学改性最为普遍。磷酸魔芋葡甘聚糖酯(konjac glucomannan phosphate ester, KGMP)是KGM经过化学改性获得的衍生物,具有良好的生物相容性、亲水性及生物可降解性,逐渐在一些功能材料中使用,且其稳定性、持水性、成膜性和抗霉菌能力均较好,pH适用范围广泛,在食品工业应用前景广阔[4-5]。KGM和KGMP的应用主要是利用其在水中加热溶胀表现的性质,如KGM作为胶凝剂或增稠剂添加于果冻、果酱、胶基糖果、火腿肠等,就需要产品具有适宜的流变性能和较好的透明度;添加于冰激凌、速冻水饺、汤圆等冷冻食品中,就需要保持较好的质构又不影响口感。因此,于水溶液中溶胀的透明度、流变性、凝胶产品的析水率等,是KGM和KGMP生产应用的重要特性。
单一多糖作为食品添加剂往往只能满足食品部分性能要求,多糖胶之间的共混合性对研究多元体系中大分子交互作用及其流变学性质、改良胶的功能特性、降低成本、扩大其应用领域具有重要的理论和实际意义[6]。本团队前期经过真空-微波联合辅助半干法制备了不同取代度(degrees of substitution, DS)的KGMPs, DS值分别为 0.046、0.131、0.201,并发现KGMP水溶液黏度随DS的增加而降低,透光率随DS增加而增加[7]。流变特性分析发现,KGMPs的黏度对温度敏感,具有较好的抗剪切性能,原因是KGMPs的改性基团磷酸根是亲水性强的基团,具有较强的吸湿性和保湿性,在开发凝胶食品和保水剂方面具有潜在应用前景[4]。温成荣等[8]研究了磷酸盐酯化改性KGM的稳定性及其在果冻中的应用,表明酯化改性KGM能降低果冻的脱液收缩率,提高果冻的质量。KGMP较KGM具有更好的保水性和保湿性能,其与卡拉胶的复配溶液在KCl共混作用下,是否能形成凝胶,其性能(如硬度、弹性、保水性及透明度)如何,都还未知。因此,研究KGMP与卡拉胶复配的性质,为开发一种高保水、弹性好、透明度高的软凝胶型果冻产品具有重要的现实意义。
本文通过KGM、KGMP1(DS 0.046)、KGMP2(DS 0.131)、KGMP3(DS 0.201)分别与卡拉胶复配,添加KCl后在加热-冷却条件下形成凝胶,采用FTIR、流变仪、质构仪等分析复配体系的凝胶性能,筛选出凝胶应用价值较好的KGMP及其在不同阴阳离子和蔗糖溶液中流变性能的变化。旨在为开发KGMP新的应用领域,提高热可逆凝胶产品保水性和品质提供依据。
1 材料与方法
1.1 材料与试剂
魔芋精粉(KGM含量为78.98%,符合NY/T 494—2010魔芋粉),重庆康佳客有限公司。卡拉胶、KCl、蔗糖、柠檬酸均为食品级,山东中森生物技术有限公司;其他化学试剂均为分析纯,成都科龙化工试剂厂。
1.2 仪器与设备
MCR302流变仪,奥地利安东帕公司;SY-10真空冷冻干燥机,北京松源华兴科技发展有限公司;Spectrum 100傅立叶红外光谱仪,美国Perkin Elmer公司;DHG-9140电热恒温培养箱,上海齐欣科学仪器有限公司;TA.Plus物性测定仪,英国stable micro system 公司;UV-2450紫外分光光度计,日本岛津公司;HWS-24电热恒温水浴锅,上海齐欣科学仪器有限公司;Spectrum 100 红外光谱仪,美国Perkin Elmer公司。
1.3 试验方法
1.3.1 KGMP的制备
按实验室方法自制[7]。磁力搅拌器100 r/min,将NaH2PO4和Na2HPO4(摩尔比2∶1)与质量分数6%的尿素加入蒸馏水搅拌均匀。用3 mol/L HCl和NaOH溶液调节pH值至5.0,将溶液均匀喷射到搅拌的KGM,混合均匀,混合量比例分别为n(磷酸盐)∶n(KGM)=0.52、0.62、0.72。所得混合物真空处理29 s,置于微波反应器300 W, 100 ℃ 处理7 min,然后用体积分数为50% 乙醇洗涤3~4次,再分别用体积分数70%、80%、100%乙醇梯度洗涤,滤去洗液。将滤饼于45 ℃鼓风干燥箱烘干过夜,经粉碎过100目筛获得不同DS的KGMPs。经测定,KGMP1、KGMP2、KGMP3 DS 分别为0.046、0.131、0.201。将样品置于变色硅胶的干燥器中储存,备用。
1.3.2 复配凝胶的配制
KGM/KGMPs(DS 0.046、0.131、0.201)、卡拉胶和KCl分别按质量比1∶1∶1,配制成质量分数0.5%胶液,水浴加热30 min,充分溶解成均匀复配溶胶。静置片刻,用隔离网去除表面泡沫并过滤去混合胶液内气泡和杂质,分装至塑胶杯,置于25 ℃恒温箱形成凝胶,并在测试前保持6 h。将混合凝胶分别编码为KGM-KC、KGMP1-KC、KGMP2-KC和KGMP3-KC。
1.3.3 复配胶的透光率测定
将KGM/KGMPs(DS 0.046、0.131、0.201)、卡拉胶和KCl按质量比1∶1∶1,配制成质量分数为1%溶液,沸水浴溶胀30 min,冷却至25 ℃。以蒸馏水为空白对照,用紫外分光光度计全波长扫描,选取最大吸收波数测定样品透光率。
1.3.4 复配凝胶性能测定
1.3.4.1 红外光谱测定
将上述样品真空冷冻干燥72 h,粉碎过筛,收集200目筛下物,与KBr混合研磨。采用KBr压片法,以空气为对照,扫描波长400~4 000 cm-1,分辨率4 cm-1,扫描累加32次。
1.3.4.2 动态温度扫描
流变仪配备几何传感器和锥板(50 mm直径,1° 锥角和1.0 mm间隙),使用应力控制流变仪评估复合凝胶的流变学特征。除特殊说明外,所有流变学测试在25 ℃进行。参考HU等[9]的方法修改,将上述样品复配凝胶放入动态流变仪测定平台,设置应变为1%[10],角频率为1 Hz。程序设置:样品先从60 ℃~100 ℃ 程序升温,再从100 ℃~25 ℃降温,速度变化速率均为2.5 ℃/min。温度扫描参数包括储能模量(G′)和损耗模量(G″)随温度的变化。
1.3.4.3 质构特性测定[11]
采用TPA模式,测定复配凝胶样品及在28 ℃储藏1、3、5、7、10 d硬度变化。探头P/0.5;测试前速度2.00 mm/s,测试速度1.00 mm/s,测试后速度1.00 mm/s;测试形变40%;测试循环次数2。
1.3.4.4 析水率测定
复配凝胶于28 ℃放置6 h、1、3、5、7、10 d,测定其析水率。待测凝胶精确称重,其质量为m1(g);从杯中倒出放置纱布上,用纱布包裹,轻轻挤压除去水分,再次精确称重,其质量为m2(g)。复配凝胶的析水率计算见公式(1):
析水率![]()
1.3.5 KGMP水溶胶抗介质特性
参考ZHONG等[12]的方法,准确称取0.500 g KGM和KGMP,分别配成质量分数为1%的溶液,60 ℃水浴溶胀1 h,在25 ℃保温备用。分别将0.02 mol/L的MgCl2、KCl、CaCl2和FeCl3加入到100 g KGMP溶液,研究不同阳离子对KGMP流变性质的影响;0.02 mol/L NaCl、Na2SO4、NaNO3和NaH2PO4分别加入100 g KGMP溶液,研究不同阴离子对KGMP流变性影响;KGMP与蔗糖摩尔比分别设置为3∶1、3∶2、3∶3,研究小分子糖对KGMP流变性能影响。静态剪切流变特性及动态黏弹性的测定参照前期试验方法[4]。
1.3.6 数据处理
所有试验结果平行测定3次,分析结果表示为平均值±标准偏差。利用t-检验或单方差分析进行方差分析,采用SPSS 17.0 和Origin 8.1软件分析数据。所有的统计分析中,P<0.05为显著差异。
2 结果与分析
2.1 复配胶透光率分析
透明度的高低一定程度上影响着产品的用途,通常透明度的高低由溶胶的透光率表示。KGM、KGMPs与卡拉胶复配胶的透光率如图1所示。
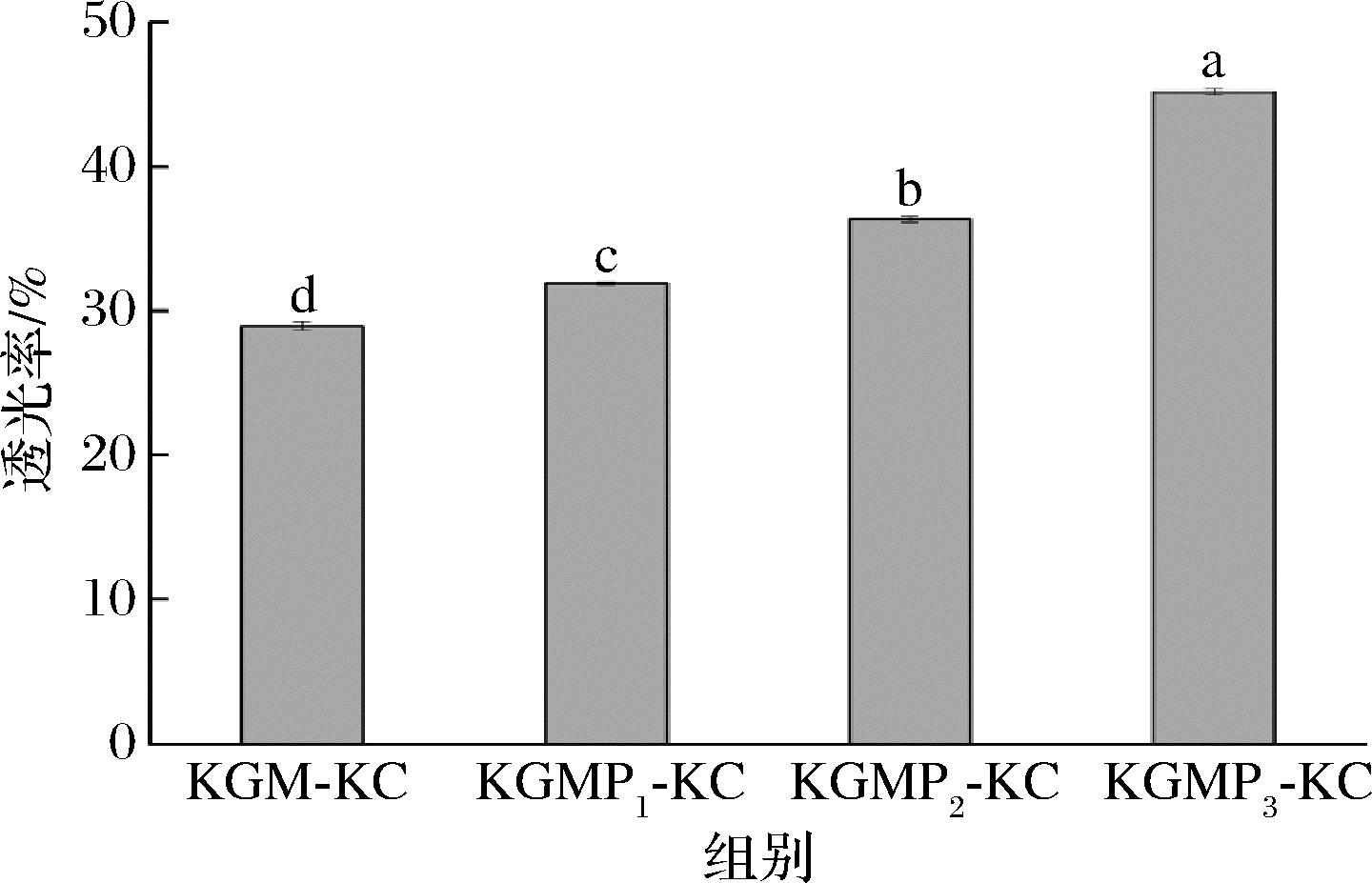
图1 KGM-KC和KGMPs-KC复配胶的透光率比较
Fig.1 Comparison on transmittance of mixtures of KGM-KC and KGMPs-KC
与KGM-KC相比,KGMPs-KC的透光率显著增加(P<0.05),且随着DS的增大,KGMP-KC的透光率逐渐升高(P<0.05)。刘丹等[7]研究发现,KGMP的透光率高于KGM,且随着DS的增加而增加。卡拉胶透明度高,在500 nm透光率为83.5%,且复配胶液随KGM浓度增加而降低[13]。溶液的透明度直接反映复配胶与水分子之间亲和力的大小,KGMP是阴离子型魔芋衍生物,带负电荷的磷酸基团引起相邻KGMP分子之间产生排斥作用,降低链间缔合,增加了水与KGMP相互作用,故与卡拉胶复配后仍形成具有高透光率的胶液[14]。夏玉红等[15]采用微波法制备的羧甲基魔芋葡甘聚糖极易溶于水形成透明溶液,主要是因为—CH2COOH基团的引入,氢键增多,使得改性产物溶解性增加。
2.2 复配凝胶红外光谱分析
KGMPs与卡拉胶复配凝胶的红外光谱如图2。KGM-KC、KGMP1-KC、KGMP2-KC、KGMP3-KC羟基伸缩振动峰分别为3 417、3 411、3 409和3 425 cm-1,KGMP1-KC、KGMP2-KC按酯化程度的增加向低波数方向发生位移,但KGMP3-KC向高波数方向发生一定的位移。2种高聚物复配后,羟基伸缩振动峰增强并向低波数方向位移,分子间的氢键必定增强,分子间相互作用一定增大[16-17]。魏玉等[17]研究发现魔芋胶与κ-卡拉胶复配后羟基伸缩振动峰处于κ-卡拉胶和魔芋胶的羟基伸缩振动峰之间,说明卡拉胶和魔芋胶分子间发生相互作用,协同增效形成凝胶。主要是卡拉胶残基上有半酯式硫酸盐基团而成为一种阴离子型分子电解质,分子中的 O-SO3- 能与魔芋胶形成分子间氢键所致。最终形成以κ-卡拉胶网络为主、魔芋胶穿插其中的结构。因此,氢键的存在对复配体系起到了非常重要的增容作用[10]。本实验出现这一现象的原因是复配凝胶体系中磷酸基团增加到一定程度时,阴离子的磷酸根与卡拉胶的SO3H产生静电排斥作用,增大KGMP与卡拉胶分子间距,减弱了KGMP与卡拉胶之间的相互作用,表现为复配体系的凝胶强度减弱。在3 200~3 400 cm-1处羟基伸缩振动峰更宽,表明随着KGM酯化程度的增加,引入更多的磷酸基团,KGMP与卡拉胶复配凝胶的水分含量更高[18]。此外,复配体系中主要基团的峰位没有变化,表明KGM/KGMP与卡拉胶之间没有生成新的化学键。呼娜[19]对板栗淀粉的酯化改性研究也发现,酯化改性只在原板栗淀粉分子中添加了新的磷酸基团,其原有结构并没有被破坏。
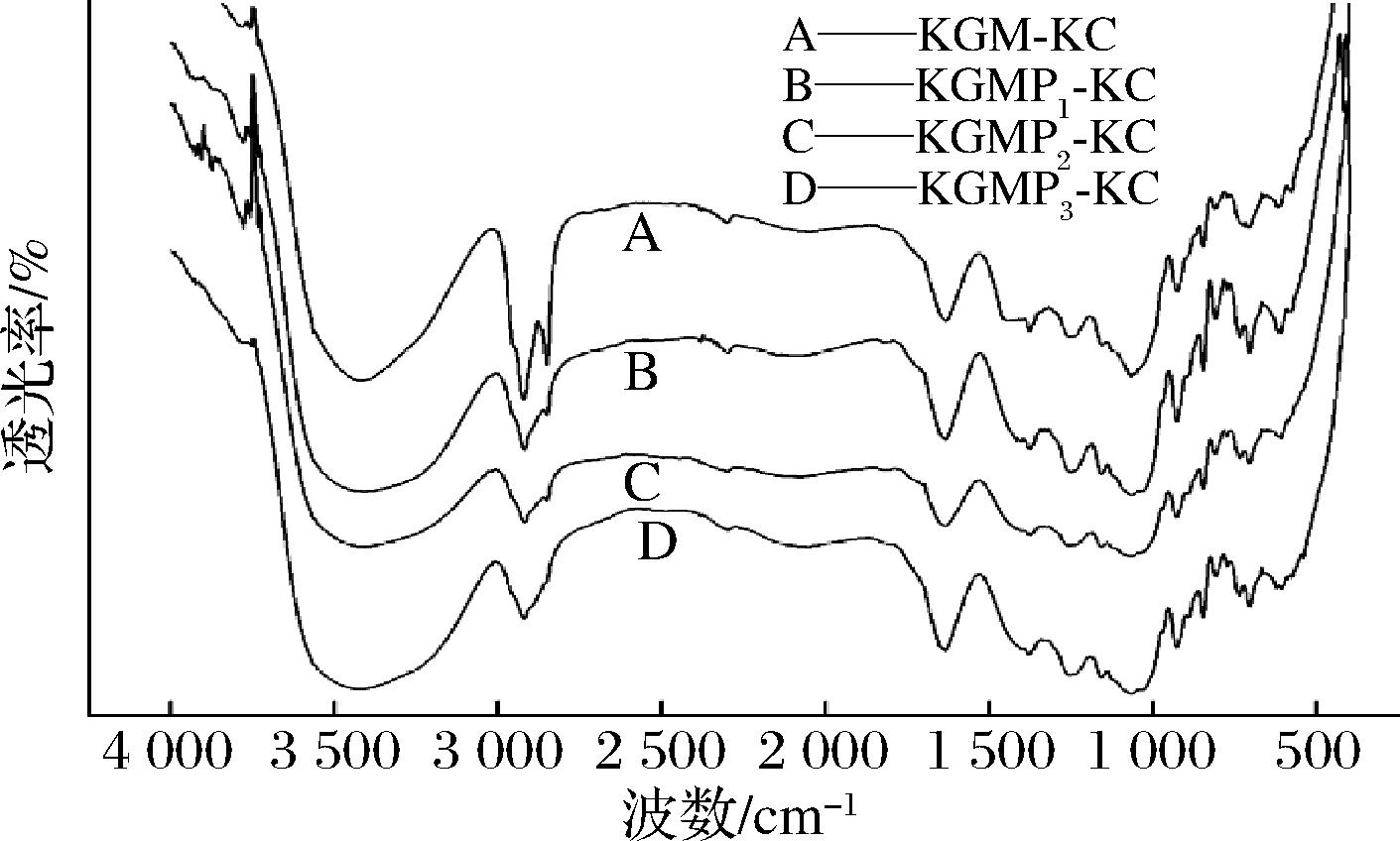
图2 KGM/KGMPs与卡拉胶复配凝胶红外光谱图
Fig.2 FTIR spectra of KGM and KGMPs with carrageenan mixture gels
2.3 复配凝胶的动态扫描分析
图3为KGM/KGMPs-KC复配凝胶体系在降温过程中的G′和G″随温度的变化。降温扫描试验,90 ℃时,复配体系G″>G′,此时胶液呈液态,为流胶。当温度以2.5 ℃/min的速率匀速下降,复配体系的G′和G″快速升高,其中G′的增幅明显大于G″,当G′=G″时,达到凝胶形成的临界点,此时的温度定义为凝胶温度[19]。随着温度继续下降,分子间逐渐呈现牢固的网络结构,形成凝胶。KGMPs-KC凝胶复配体系的G′和G″变化趋势与KGM-KC复配体系变化趋势相同。复配胶分子在受热状态下,激活的分子激烈运动使黏弹性均处于较低水平,随着温度的逐渐降低,分子运动减慢,分子重排,最终成为具有稳定化合键的牢固凝胶网络结构。
KGM-KC及KGMPs-KC凝胶均属于热可逆凝胶,在受热后重新转变为熔融态。图3正方形连线为KGM/KGMPs-KC复配凝胶体系在升温过程中的G′和G″随温度的变化。升温扫描试验的温度变化范围设定为25~90 ℃,在25 ℃时,G′远大于G″,当温度以2.5 ℃/min的升温速率匀速上升后,G′和G″先是缓慢下降;当温度达到60 ℃左右时,G′和G″快速下降,但G′的降幅明显大于G″;当G′=G″时,达到凝胶融化的临界点,此时的温度定义为融化温度[20]。进一步证明了KGMPs-KC凝胶复配体系的G′和G″变化趋势与KGM-KC复配体系变化趋势相同。KGM-KC及KGMPs-KC凝胶的融化温度明显高于凝胶温度的现象,称为滞后现象,复配凝胶的许多应用优越性就是因为它的这种高滞后性。
与KGM-KC相比,KGMPs-KC的凝胶温度降低,从41 ℃降低到38 ℃,但随着DS增加,KGMPs-KC凝胶温度没有显著变化。且KGMP3-KC在25~100 ℃温度范围内有从固态转为熔融态的过程,说明KGMPs-KC中也形成了以卡拉胶网络结构为主、KGMP穿插其中的结构[7]。
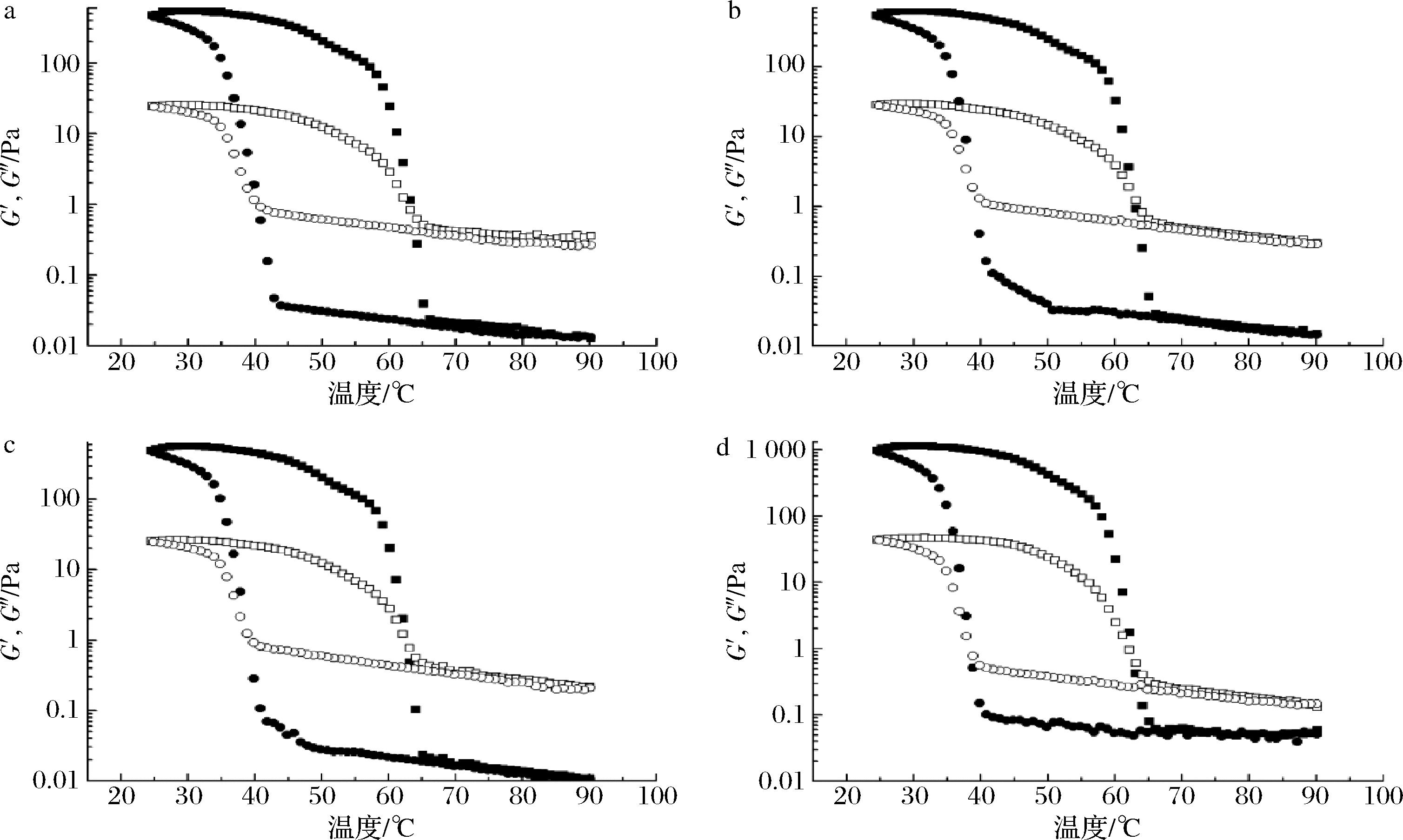
a-KGM-KC;b-KGMP1-KC;c-KGMP2-KC;d-KGMP3-KC
图3 复配凝胶的升温(正方形)和降温(圆形)扫描时温度对储能模量G′(实心)和损耗模量G″(空心)的影响
Fig.3 Temperature dependence of the storage (solid) and loss (open) moduli on heating (square) and cooling (circle) of mixtures
2.4 复配凝胶的质构特性
KGM-KC和KGMPs-KC复配凝胶在28 ℃放置1 d的质构特性结果见表1。由表可知,KGMPs-KC复配凝胶的黏附性和内聚性高于KGM-KC,且随DS增大而不断增大。原因是随DS增加,引入KGM中亲水性磷酸基团不断增多,KGMP分子体积不断增大[18]。此外,高温下,伴随副反应交联反应,少量磷酸基团使得KGM分子交联在一起形成一个空间网络结构,使黏附性和内聚性提高[19]。KGMPs-KC的硬度、胶黏性和咀嚼性低于KGM-KC,且随着DS的增加而降低。原因是磷酸基团取代了KGM分子羟基上的氢,阻碍了KGM分子间的缔合作用,降低了KGM分子的结晶度,使得KGM结构变得松弛,原有的紧密结构被破坏。此外,刘芳[21]研究表明,不带电荷的KGM在与卡拉胶发生竞争性反应时,KGM与卡拉胶要优于卡拉胶的自交联,这种交联发生会增强网络结构,提高凝胶强度。对于此复配体系,卡拉胶的冷却过程中,分子链经历了从卷曲到双螺旋的构象转换过程,在与K+结合后变得更稳定。然后发生竞争性反应,螺旋结构可自交联或与KGM分子链交联。因KGM酯化改性后引入带负电荷的磷酸基团,卡拉胶与卡拉胶的交联要优于卡拉胶与KGM的交联,这样的交联发生,网络结构降低[21-22]。因此KGMPs-KC凝胶的硬度、胶黏性和咀嚼性降低。严文莉[3]的研究也发现添加DS为0.005 7的磷酸酯化魔芋葡甘聚糖可一定程度改善鱼糜凝胶的质构特性,添加DS为0.002 1的羧甲基魔芋葡甘聚糖可显著提高鱼糜凝胶的持水力,使鱼糜凝胶中水分分布具有更好的均一性和网络结构的致密性。
表1 KGM-KC、KGMP1-KC、KGMP2-KC和KGMP3-KC复配凝胶的质构分析结果
Table 1 TPA parameters of mixtures of KGM-KC, KGMP1-KC, KGMP2-KC, and KGMP3-KC
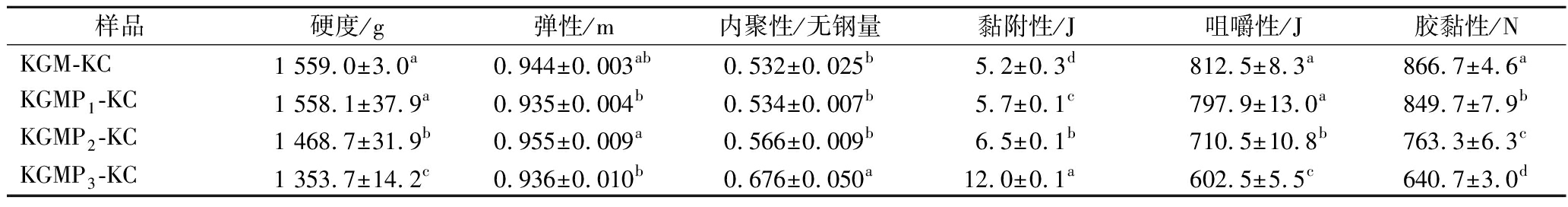
样品硬度/g弹性/m内聚性/无钢量黏附性/J咀嚼性/J胶黏性/NKGM-KC1 559.0±3.0a0.944±0.003ab0.532±0.025b5.2±0.3d812.5±8.3a866.7±4.6aKGMP1-KC1 558.1±37.9a0.935±0.004b0.534±0.007b5.7±0.1c797.9±13.0a849.7±7.9bKGMP2-KC1 468.7±31.9b0.955±0.009a0.566±0.009b6.5±0.1b710.5±10.8b763.3±6.3cKGMP3-KC1 353.7±14.2c0.936±0.010b0.676±0.050a12.0±0.1a602.5±5.5c640.7±3.0d
注:同一列中不同小写字母表示差异具有统计学意义(P<0.05)。
图4表示KGM/KGMPs-KC复配凝胶硬度随时间的变化。形成的复配凝胶在放置10 d,与KGM-KC相比,KGMP1-KC和KGMP2-KC的硬度更好。原因是KGM分子改性后引入了亲水性强的磷酸基团,能够提升KGMP的保水性[8],故在较长时间的放置过程中,其硬度变化缓慢。
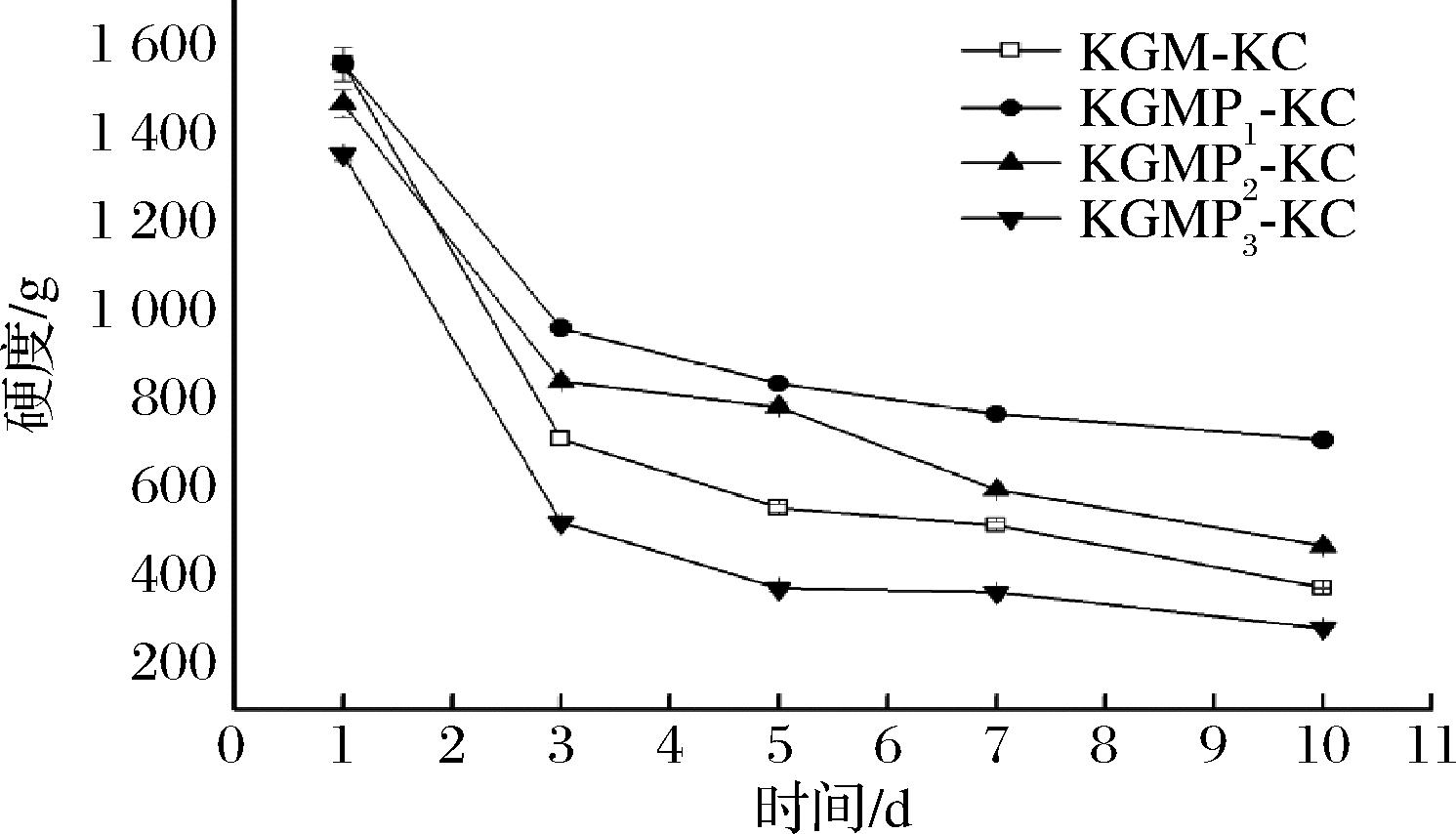
图4 KGM-KC和KGMPs-KC复配凝胶的硬度
Fig.4 Hardness of KGM-KC and KGMPs-KC
2.5 复配凝胶的析水率
如图5所示,与KGM相比,KGMP与卡拉胶复配凝胶的析水率随DS的增加显著降低(P<0.05)。原因是KGMP引入亲水性磷酸基团,能与水分子形成氢键,结合能力较强,失水速率减缓[8,15]。这与我们前期的研究结果一致,即KGMP的吸湿率和保湿率随DS的增加而上升[4]。也有研究表明,微波改性KGM所得产物羧甲基葡甘聚糖吸湿性和保水性均显著性提高[3]。本研究形成的复配凝胶放置10 d,与KGM-KC相比,KGMPs-KC稳定性更好,且随DS增加,效果更明显。
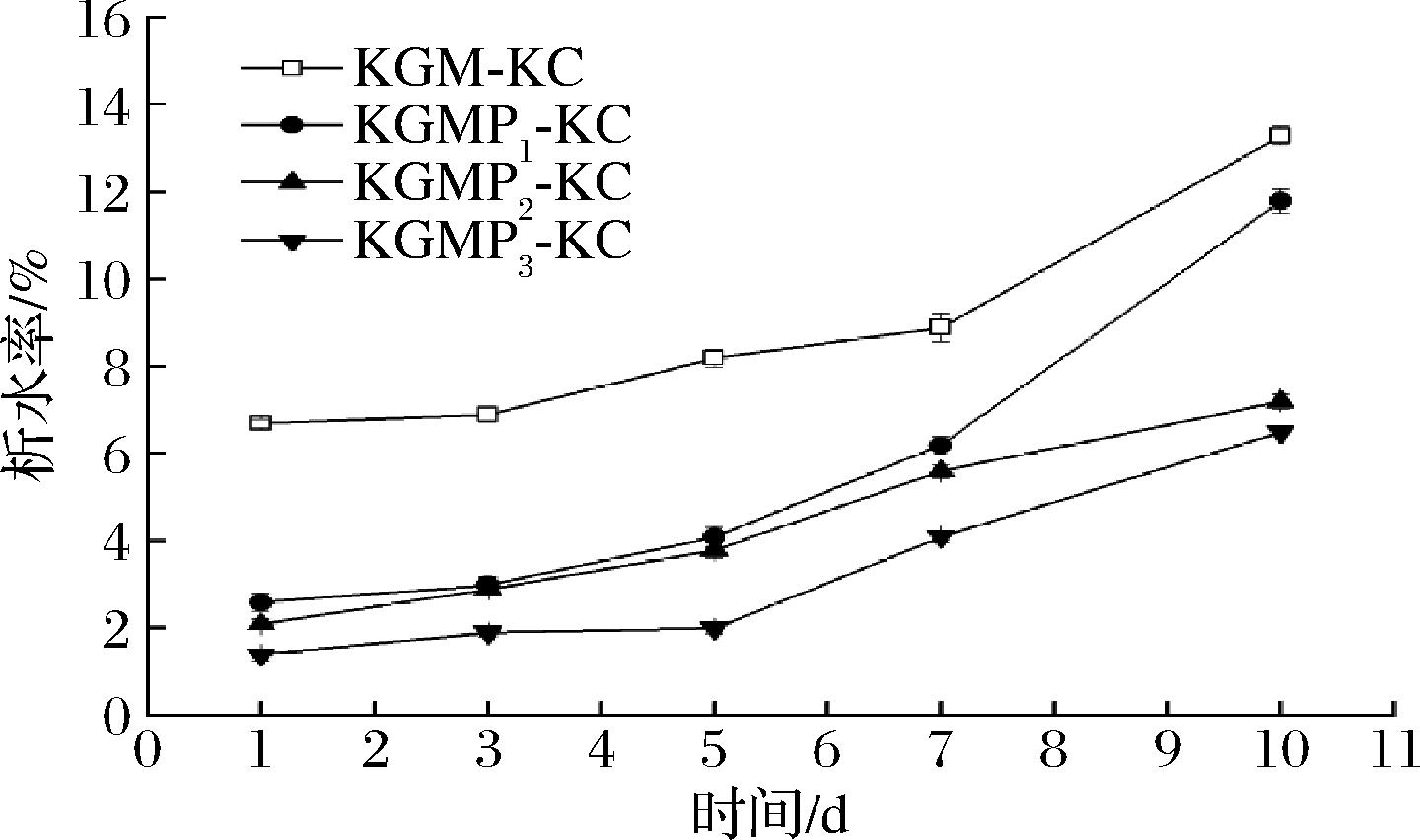
图5 KGM-KC和KGMPs-KC复配凝胶的析水率
Fig.5 Syneresis of KGM-KC and KGMPs-KC
综上所述复配凝胶特性分析,KGMP3是比较适合用于制备果冻等凝胶制品的原料。
2.6 KGMP3水溶胶抗介质特性
2.6.1 不同阴阳离子对KGMP3流变特性的影响
2.6.1.1 静态剪切流变分析
不同阴阳离子对KGMP3溶胶稳态剪切流变行为的影响如图6。
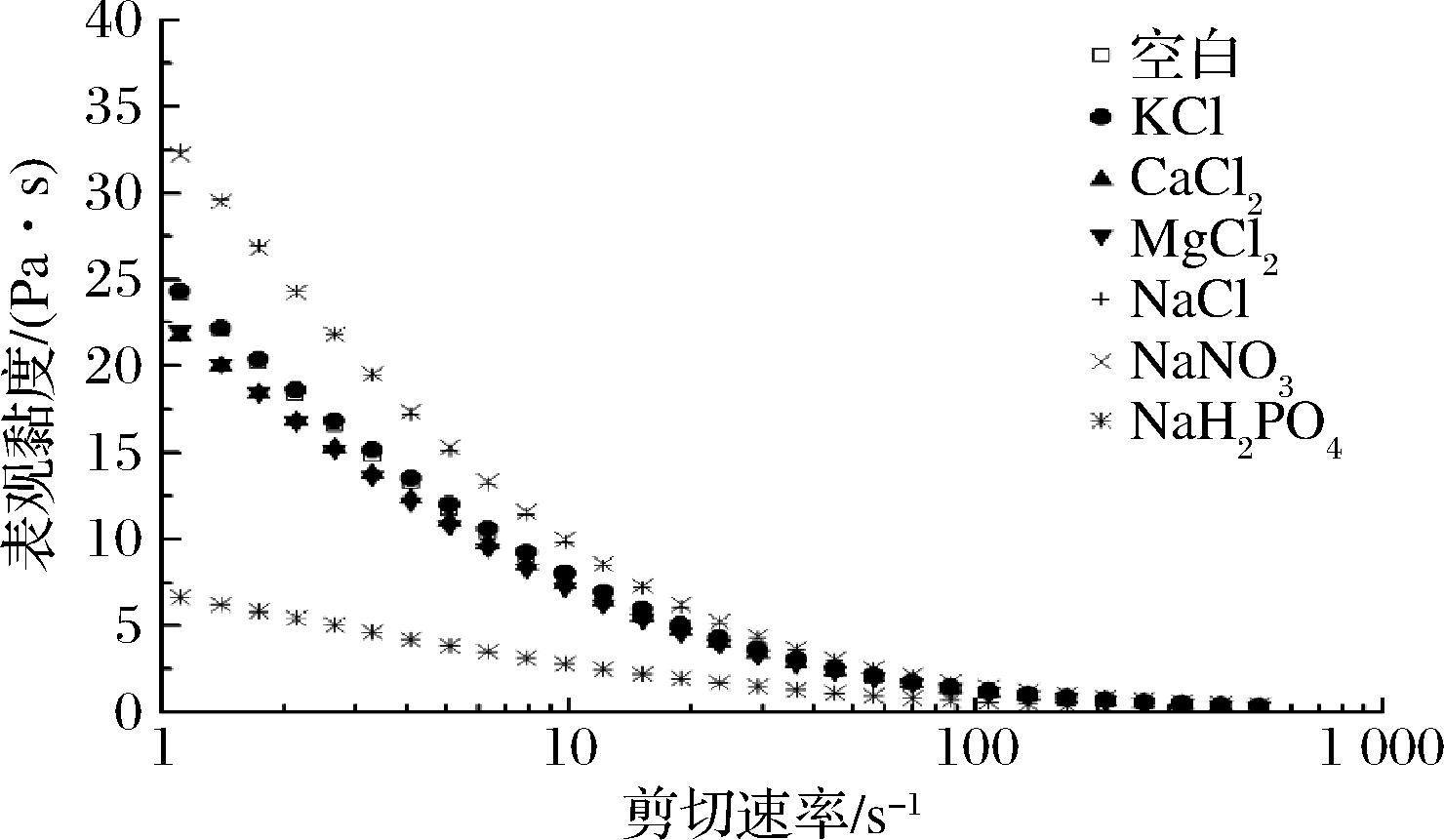
图6 不同阴阳离子与KGMP3的表观黏度 随剪切速率变化曲线
Fig.6 Apparent viscosity as a function of shear rate for KGMP3with various cations and anions melts
样品在阴阳离子溶液中均表现出非牛顿流体的性质。采用Carreau模型将不同阴阳离子对KGMP3溶胶稳态剪切流变曲线进行拟合,拟合参数结果如表2。K+对KGMP3溶胶的零表观黏度(η0)影响不大,而Ca2+和Mg2+降低了KGMP3溶胶的η0,原因可能是KGM酯化改性后,羟基被亲水性更强的磷酸基团取代,阳离子的加入屏蔽了KGMP上磷酸基团产生的排斥作用,当亲水基团与阳离子结合后,KGMP与水的结合程度迅速降低,无法形成稳固的结构,在一定的剪切速率条件下,导致KGMP η0降低,且η0随着离子的价数增加而降低[12]。Cl-和NO3- 显著增加了KGMP3溶胶的η0(P<0.05),而Cl-和NO3- 之间无显著性差异(P>0.05)。YIN等[23]研究表明NaCl和NaNO3产生的盐析作用增强了水结构扰动或离子与聚合物上特定位点之间的强相互作用。由于改性后的KGM分子的亲水性增强,且Cl-和NO3- 的引入对磷酸基团无影响,因此溶胶的η0增加。H2PO4-显著降低了KGMP3溶胶的η0(P<0.05),原因是NaH2PO4的存在,会对KGMP3产生盐析作用,使KGM大分子的无规线团的末端距减小,分子链收缩,KGMP3在水中的流动性增强,黏度下降。有研究发现,不同改性方法和改性程度的KGM分子特性有显著差异,与 KGM 相比,魔芋葡甘聚糖-丙烯酸接枝共聚物分子质量显著增加,磷酸魔芋葡甘聚糖分子质量显著降低,而羧甲基魔芋葡甘聚糖和脱乙酰魔芋葡甘聚糖的分子质量无显著变化[3]。NaH2PO4在水中呈弱酸性,会引起KGM分子链的断裂,分子质量降低,大分子的流动性提高,黏度下降[24]。
表2 不同阴阳离子与KGMP3的表观黏度随剪切 速率变化曲线Carreau模型拟合参数
Table 2 The fitting parameters of KGMP3with various cations and anionsbasing on the Carreau model
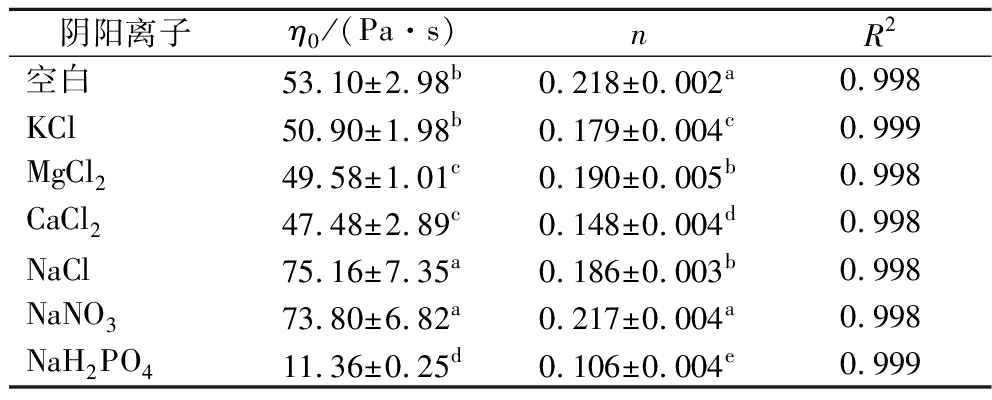
阴阳离子η0/(Pa·s)nR2空白53.10±2.98b0.218±0.002a0.998KCl50.90±1.98b0.179±0.004c0.999MgCl249.58±1.01c0.190±0.005b0.998CaCl247.48±2.89c0.148±0.004d0.998NaCl75.16±7.35a0.186±0.003b0.998NaNO373.80±6.82a0.217±0.004a0.998NaH2PO411.36±0.25d0.106±0.004e0.999
注:同一列中不同小写字母表示差异显著(P<0.05)。
2.6.1.2 动态扫描频率分析
KGMP3分别与KCl、CaCl2和MgCl2的G′及G″随频率的变化如图7-a和图7-b。在较低频率下,KGMP3分子链在长时间振荡期间解开;而在较高频率下,KGMP3分子在短暂的振荡期间不能解开并形成临时的网络结构。因此,溶胶从低频率的类似 “液体” 行为(即G′<G″)转变为高频率的类似 “固体” 行为(即G′>G″)[23]。从图7-a和图7-b可知,KCl和CaCl2对KGMP3溶胶的影响不大,其G′和G″的变化趋势相同。角频率在0.628~5.26 rad/s范围内时,KCl和CaCl2对KGMP3溶胶的损耗因子(tan δ)大于1(即G′<G″),表明黏性在体系中占主要地位,溶胶呈现 “液体” 行为。而CaCl2对KGMP3溶胶影响显著,交点角频率升至9.50 rad/s,表明黏性性质对KGMP3溶胶的影响更大,溶液显示出更像 “液体” 的行为。
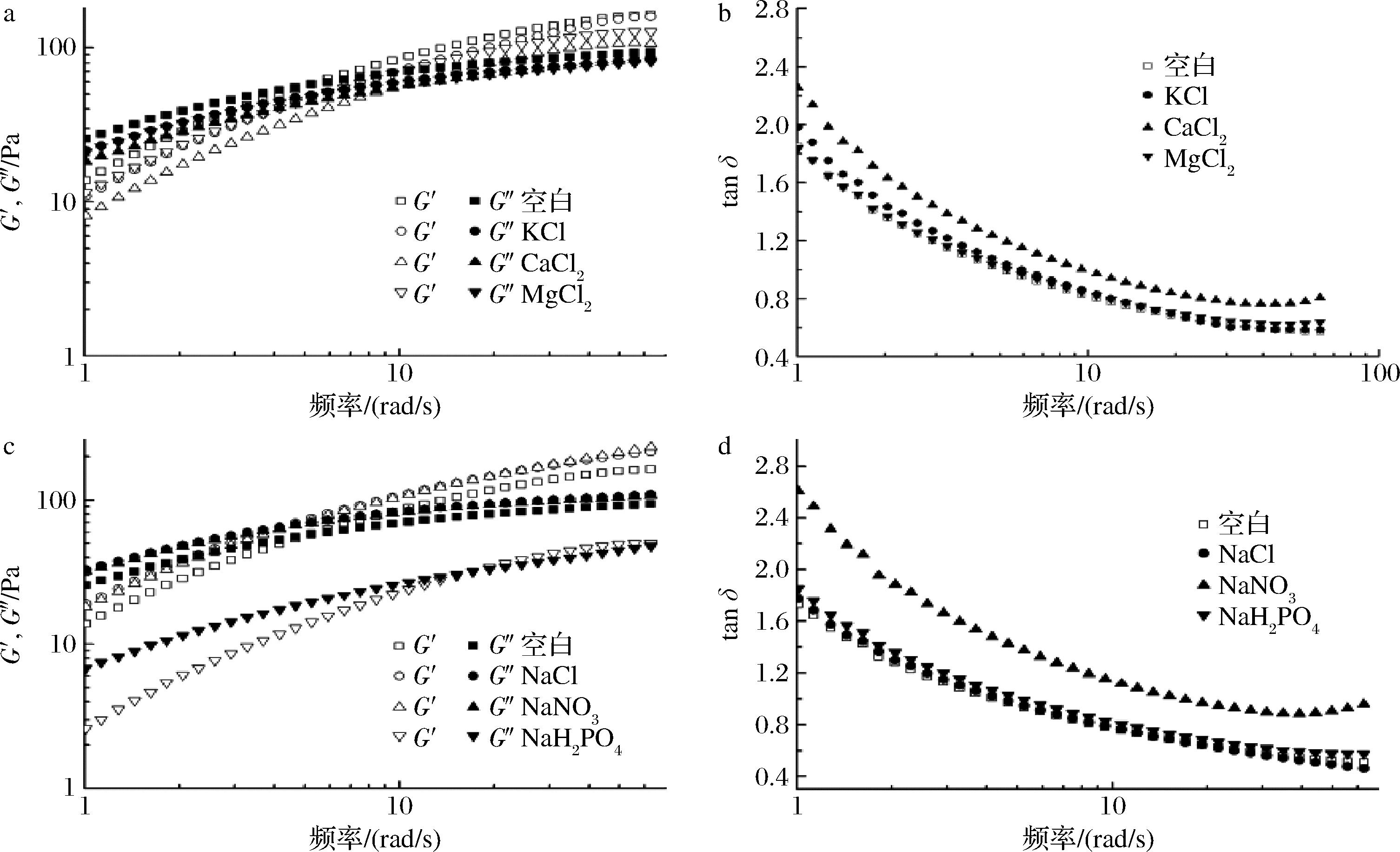
a、b-阳离子;c、d-阴离子
图7 不同阴离子和阳离子与KGMP3的动态频率变化曲线
Fig.7 Dynamic frequency sweep of KGMP3 solution with various cations and anions
KGMP3分别与NaCl、NaNO3和NaH2PO4的G′和G″及tan δ随频率的变化如图7-c和图7-d。不同阴离子对KGMP3溶胶的G′和G″的变化趋势相同。角频率在0.628~4.16 rad/s范围内,NaCl、NaNO3对KGMP3溶胶的tan δ>1(即G′<G″),而NaH2PO4的交点(tan δ=1)在向高频的方向移动,在15.2 rad/s的范围内tan δ>1,表明KGMP3分子链的临时网络结构减弱。原因是KGMP3体系中存在大量亲水性的磷酸基团,强烈的盐析效应可以增加KGMP3的溶解度,因而溶胶呈现出趋向于 “液体” 的行为[23]。
2.6.2 蔗糖对KGMP3流变特性的影响
2.6.2.1 静态剪切流变分析
KGMP3与蔗糖在不同混合比例下的稳态剪切流变曲线如图8所示。对于所有溶胶样品,表观黏度均随着剪切速率的增大而降低,说明溶胶具有剪切变稀的性质。在同样的剪切速率下,含蔗糖溶胶的表观黏度小于纯KGMP溶胶的表观黏度,但随着体系中蔗糖含量的增加,磷酸基团降低,表观黏度增加,原因是蔗糖的强亲水作用,和溶胶体系里的水分子以氢键结合,降低了水分活度[25]。
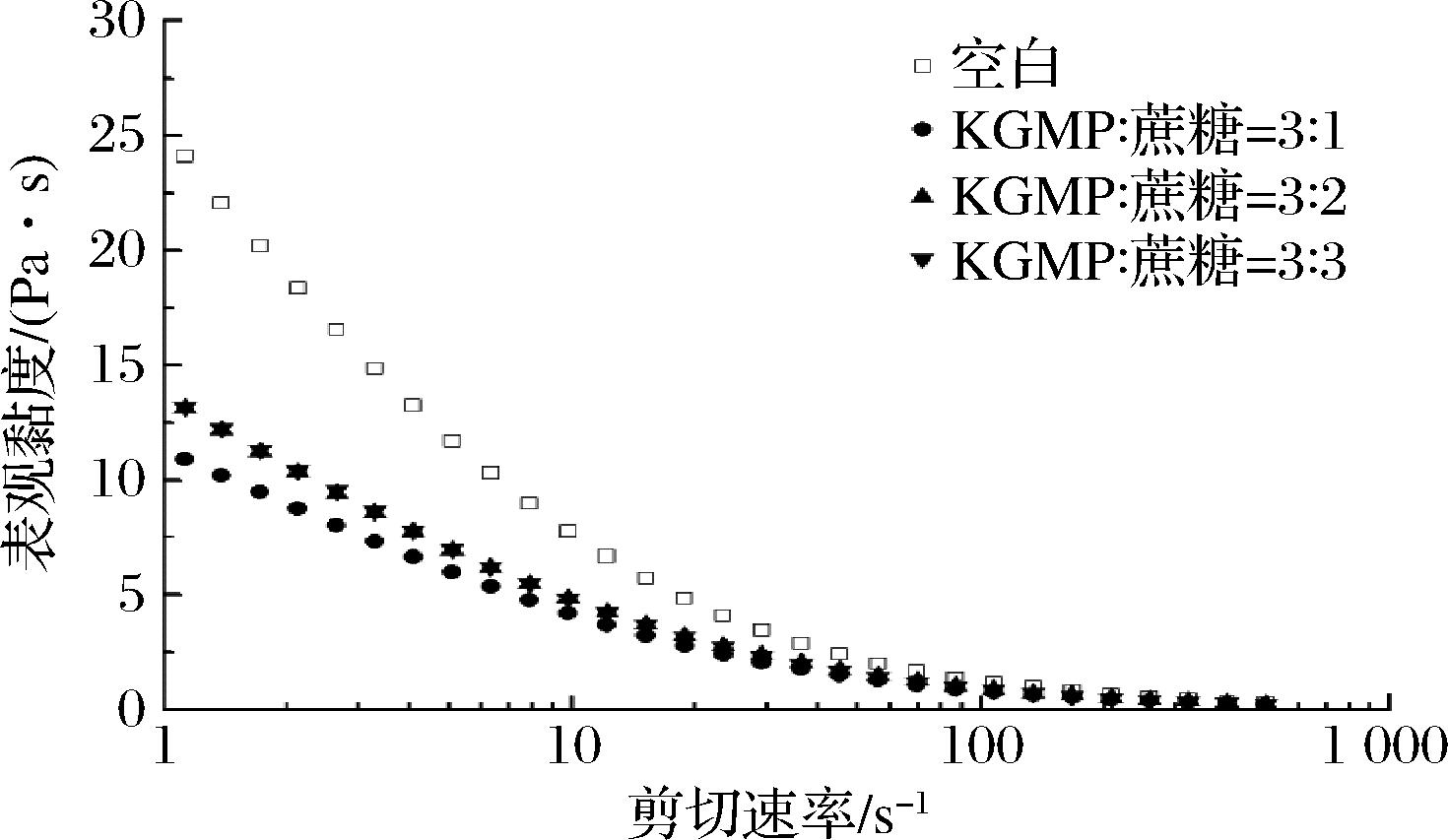
图8 KGMP3与蔗糖不同混合比的表观黏度 随剪切速率变化曲线
Fig.8 Apparent viscosity as a function of shear rate for KGMP3 solution and KGMP3/sucrose mixture at different mixing ratios
用Carreau模型对KGMP3与蔗糖在不同混合比例下的稳态剪切流变曲线进行拟合分析时,决定系数R2>0.99,说明Carreau模型和流变数据的相关性很好,拟合的流变参数见表3。所有溶胶样品的流体行为指数均小于1,说明KGMP3溶胶是假塑性流体,具有剪切变稀的性质。蔗糖显著降低KGMP的η0(P<0.05)。原因是糖的水化作用导致可利用水分子的减少,磷酸基团的排斥作用使得分子间距增大,减少KGMP分子间的相互作用,η0下降[26]。
表3 KGMP3与蔗糖不同混合比的表观黏度随剪切 速率变化曲线Carreau模型拟合参数
Table 3 The fitting parameters of KGMP3 solution and KGMP3/sucrose mixture at different mixing ratios basing on the Carreau model
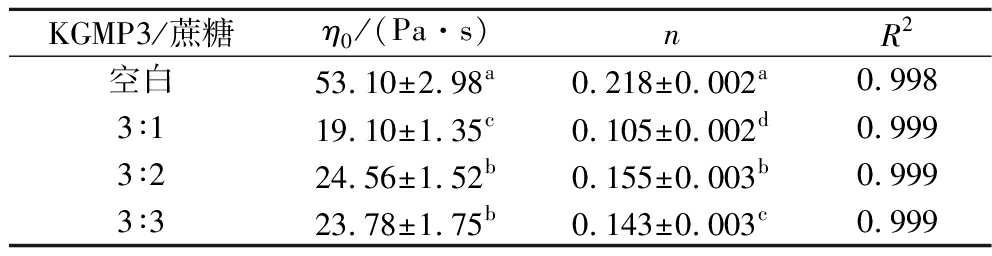
KGMP3/蔗糖η0/(Pa·s)nR2空白53.10±2.98a0.218±0.002a0.9983∶119.10±1.35c0.105±0.002d0.9993∶224.56±1.52b0.155±0.003b0.9993∶323.78±1.75b0.143±0.003c0.999
注:同一列中不同小写字母表示差异显著 (P<0.05)。
2.6.2.2 动态频率扫描分析
KGMP3与蔗糖不同混合比下G′, G″及tanδ的变化如图9。
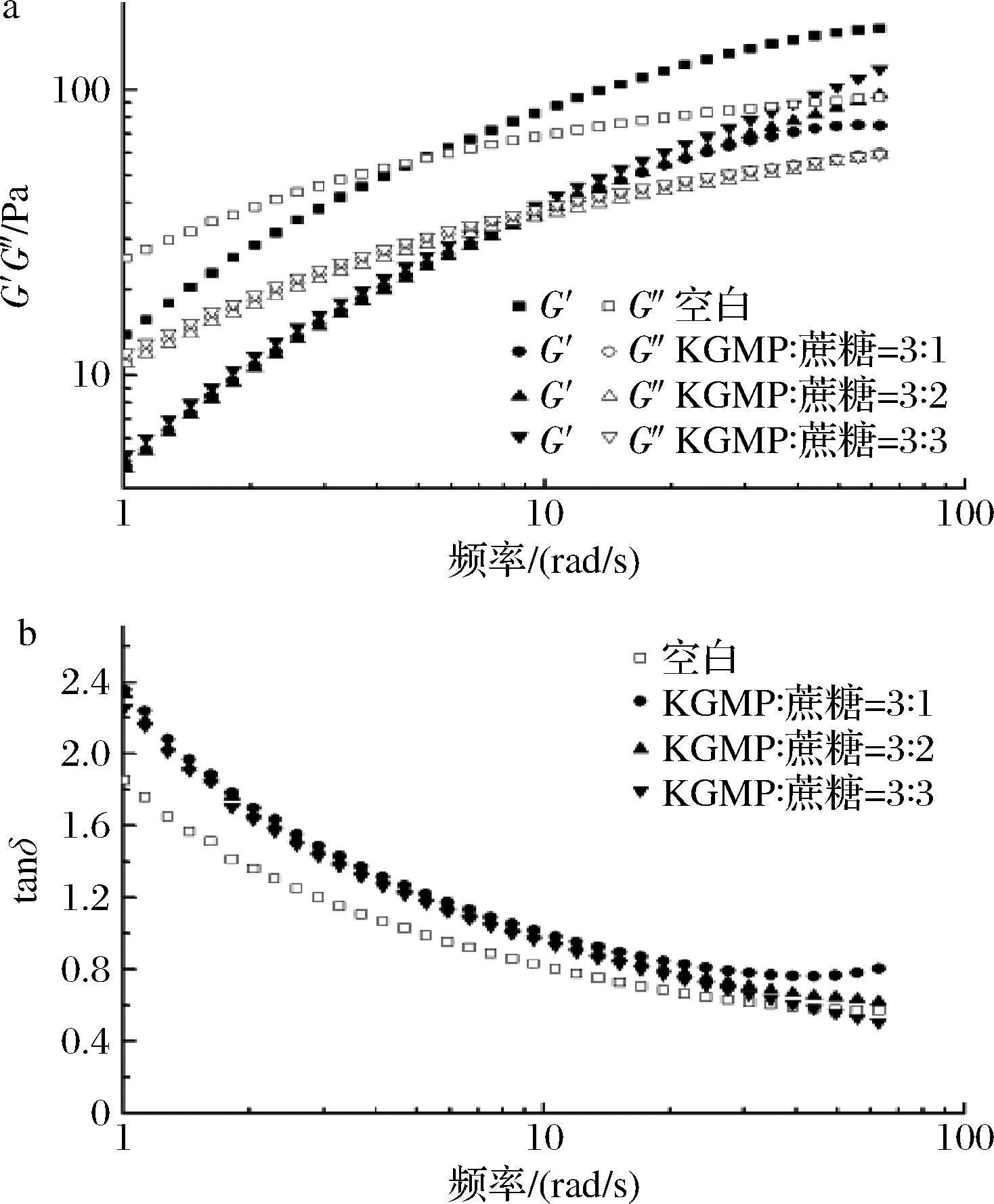
a-G′, G″;b-tanδ
图9 KGMP3与蔗糖不同混合比的动态频率变化曲线
Fig.9 Dynamic frequency sweep of KGMP3 solution and KGMP3/sucrose mixture at different mixing ratios
溶胶均从低频率的类似 “液体” 行为(即G′<G″)转变为高频率的类似 “固体” 行为(即G′>G″);随着频率的增加,KGMP3溶胶的G′逐渐增大;蔗糖的加入使KGMP3溶胶的G′和G″均降低;与G′相比,添加蔗糖到KGMP3溶胶后G″值变化更明显,这表明蔗糖对KGMP3-蔗糖混合物的黏性特性的影响比弹性特性更明显[27]。G′值降低的原因是糖和磷酸基团竞争水分,糖的水化作用导致可利用水分子的减少,磷酸基团的排斥作用使得分子间距增大,减少KGMP3分子间的相互作用,这是KGMP3溶胶弹性性质的基础[28]。
3 结论
通过对不同DS的KGMPs与卡拉胶复配的凝胶特性及KGMP3在不同阴阳离子及蔗糖溶液中流变性能的变化研究,发现KGMPs与卡拉胶有明显的协同增效作用,DS为0.201的KGMP3与卡拉胶复配后,共混凝胶体的硬度、内聚性、析水率、透光率等特性均具有较好的应用价值,且改善其脱液收缩的现象。KGMP3的黏度和假塑性受到阴阳离子类型和价态的影响,其中NaH2PO4对KGMP3溶胶影响最显著,蔗糖能使KGMP3的η0降低,但随着体系中蔗糖含量的增加,η0增加。后续在 KGMP-KC复配胶凝胶特性的分析试验中,需进一步研究 KGMP、卡拉胶及KCl三者之间的相互作用机理及KGMP 用于果冻制作的安全性和防腐、杀菌手段,确定果冻的货架期和保质期,为KGMP的实际应用奠定基础。
[1] ZHANG Y, ZHAO Y, YANG W F, et al.Structural complexity of Konjac glucomannan and its derivatives governs the diversity and outputs of gut microbiota[J].Carbohydrate Polymers, 2022, 292:119639.
[2] ZHANG Q, ZHONG D, SUN R, et al.Prevention of loperamide induced constipation in mice by KGM and the mechanisms of different gastrointestinal tract microbiota regulation[J].Carbohydrate Polymers, 2021, 256:117418.
[3] 严文莉. 改性魔芋葡甘聚糖对鲢鱼糜凝胶特性的影响及增强机制[D].武汉:华中农业大学, 2022. YAN W L.The effect of modified kgm on the gel properties of silver carp surimi and mechanism for surimi gelation enhancement[D].Wuhan:Huazhong Agricultural University, 2022.
[4] DENG L L, PENG Y B, LI Y, et al.Physical, chemical, and rheological properties of konjac glucomannan phosphate ester[J].Journal of Food Engineering, 2023, 358:111685.
[5] CHEN F, HUANG G L.Preparation and immunological activity of polysaccharides and their derivatives[J].International Journal of Biological Macromolecules, 2018, 112:211-216.
[6] LI P Y, BAI Y, YANG Y J, et al.Structural characterization of exopolysaccharide produced by Streptococcus thermophilus and rheology of mixed protein-polysaccharide systems[J].Food Bioscience, 2023, 55:102961.
[7] 刘丹, 邓利玲, 郑连姬, 等.高取代度磷酸魔芋葡甘聚糖酯的制备[J].食品与发酵工业, 2019, 45(8):149-155. LIU D, DENG L L, ZHENG L J, et al.Preparation of konjac glucomannan phosphate ester with high degree of substitution[J].Food and Fermentation Industries, 2019, 45(8):149-155.
[8] 温成荣, 陈清萍, 黄丹, 等.魔芋胶磷酸酯化的影响因素研究[C]//中国化学会第八届天然有机化学学术研讨会论文集:济南, 2010:254. WEN C R, CHEN Q P, HUANG D, et al.Study on the influencing factors of konjac gum phosphorylation[C]//Proceedings of the 8th Natural Organic Chemistry Academic Symposium of the Chinese Chemical Society: Jinan, 2010:254.
[9] HU Y, TIAN J, ZOU J, et al.Partial removal of acetyl groups in konjac glucomannan significantly improved the rheological properties and texture of konjac glucomannan and κ-carrageenan blends[J].International Journal of Biological Macromolecules, 2019, 123:1165-1171. [10] 姜海鑫, 黄叶群, 郑萍云, 等.魔芋葡甘聚糖/表面脱乙酰甲壳素纳米纤维复合凝胶的制备及流变性能[J].食品科学, 2022, 43(16):1-8. JIANG H X, HUANG Y Q, ZHENG P Y, et al.Preparation and rheological properties of konjac glucomannan/surface deacetylated chitin nanofiber composite gels[J].Food Science, 2022, 43(16):1-8.
[11] TONG Q Y, CHEN L, WANG W J, et al.Effects of konjac glucomannan and acetylated distarch phosphate on the gel properties of pork meat myofibrillar proteins[J].Journal of Food Science and Technology, 2018, 55(8):2899-2909.
[12] ZHONG G, MENG F B, LI Y C, et al.Structure and rheological characterization of konjac glucomannan octenyl succinate (KGOS)[J].Food Hydrocolloids, 2018, 77:386-396.
[13] 贺雪姣. 低限度降解魔芋胶与κ-卡拉胶的复配研究及应用[D].无锡:江南大学, 2012. HE X J.Research and application of the interaction between the limitied hydrolyzed konjac glucomannan andκ-carrageenan[D].Wuxi:Jiangnan University, 2012.
[14] YANG L P, ZHOU Y B, ZHENG X Y, et al.Determination of optimum experimental conditions for preparation and functional properties of hydroxypropylated, phosphorylated and hydroxypropyl-phosphorylated glutinous rice starch[J].International Journal of Biological Macromolecules, 2017, 105:317-327.
[15] 夏玉红, 律冉, 钟耕, 等.微波法制备羧甲基魔芋葡甘聚糖的工艺及产物性能研究[J].食品科学, 2010, 31(14):47-52. XIA Y H, LV R, ZHONG G, et al.Microwave heating for the dry preparation of carboxymethyl konjac glucomannan and its properties[J].Food Science, 2010, 31(14):47-52.
[16] 吴刚. 材料结构表征及应用[M].北京:化学工业出版社, 2004:209-445. WU G.Characterization and Application of Material Structure[M].Beijing: Chemical Industry Press, 2004:209-445.
[17] 魏玉, 王元兰, 胡云楚.κ-卡拉胶与魔芋胶共混凝胶的质构特性研究[J].食品科学, 2010, 31(5):96-100. WEI Y, WANG Y L, HU Y C.Textural properties of κ-carrageenan-konjac gum compound gel[J].Food Science, 2010, 31(5):96-100.
[18] LI X, JIANG F T, NI X W, et al.Preparation and characterization of konjac glucomannan and ethyl cellulose blend films[J].Food Hydrocolloids, 2015, 44:229-236.
[19] 呼娜. 板栗淀粉磷酸酯的工艺优化及特性研究[D].北京:北京林业大学, 2014. HU N.Studies on process optimization and properties of phosphorylated chestnut starch[D].Beijing:Beijing Forestry University, 2014.
[20] SU Y J, ZHANG M Z, CHANG C H, et al.The effect of citric-acid treatment on the physicochemical and gel properties of konjac glucomannan from Amorphophallus bulbifer[J].International Journal of Biological Macromolecules, 2022, 216:95-104.
[21] 刘芳. 沙菜高凝胶性能卡拉胶提胶机理的研究[D].广州:华南理工大学, 2001. LIU F.Studies on the mechanism of extracting high gelation property carrageenan from Hypnea[D].Guangzhou:South China University of Technology, 2001.
[22] 王元兰, 黄寿恩, 魏玉.κ-卡拉胶与魔芋胶复配胶的流变性能及其微观结构研究[J].中国食品学报, 2012, 12(7):49-54. WANG Y L, HUANG S E, WEI Y.Rheological properties and microstructure of κ-carrageenan-konjac gum mixed gel[J].Journal of Chinese Institute of Food Science and Technology, 2012, 12(7):49-54.
[23] YIN W C, ZHANG H B, HUANG L, et al.Effects of the lyotropic series salts on the gelation of konjac glucomannan in aqueous solutions[J].Carbohydrate Polymers, 2008, 74(1):68-78.
[24] 程哲琼. 两类离子化变性淀粉浆料的性能研究[D].无锡:江南大学, 2006. CHENG Z Q.Studies on the sizing behavior of two kinds of ionized starch sizes[D].Wuxi:Jiangnan University, 2006.
[25] 尹显锋. 魔芋粉的化学改性及其在凝固型酸奶中的应用研究[D].雅安:四川农业大学, 2006. YIN X F.Study on chemical modification of konjac flour and its application in solidified yogurt[D].Yaan:Sichuan Agricultural University, 2006.
[26] ACHAYUTHAKAN P, SUPHANTHARIKA M.Pasting and rheological properties of waxy corn starch as affected by guar gum and xanthan gum[J].Carbohydrate Polymers, 2008, 71(1):9-17.
[27] ZHOU D N, ZHANG B, CHEN B, et al.Effects of oligosaccharides on pasting, thermal and rheological properties of sweet potato starch[J].Food Chemistry, 2017, 230:516-523.
[28] CHEN L, TONG Q Y, REN F, et al.Pasting and rheological properties of rice starch as affected by pullulan[J].International Journal of Biological Macromolecules, 2014, 66:325-331.