碱韭(Allium polyrhizum Turcz.ex Regel)又名碱葱、扎蒙,是百合科(Liliaceae)葱属(Allium)多年生草本植物。分布范围较广,我国北方几乎所有省区均有天然碱韭分布,资源丰富,开发利用潜力巨大。碱韭既是西北地区人们日常生活中一种常见的、独特的调味品,又是蒙古族饮食文化中主要的野生蔬菜植物,常以腌制和“奶+蔬菜植物”方式食用。除作为一种风味独特的绿色食品外,全草及种子均可入药,有解毒、化瘀、消炎消肿、健胃、利尿等功效,具有抑制“赫依”、补血强身等作用,是一种药食同源植物[1-2]。对碱韭药理研究发现,黄酮类化合物是碱韭的主要活性物质之一[3-4]。黄酮类化合物具抗菌消炎、抗肿瘤、抗氧化、延缓衰老、调节人体分泌等多种功效,且安全性能高[5-10]。但黄酮类化合物属于一类植物次生代谢物质,在人体内不能直接合成,必须通过食物或药物摄入。如今人们对添加了黄酮类物质的保健食品的需求日益增加,对黄酮类化合物的种类和纯度也有了更高的要求。从营养和药用角度来看,不同种类的黄酮类物质的功能不同,且不同生物中所含的黄酮类物质的种类及含量差异较大。因此,对从不同天然植物中提取、分离、纯化独特的黄酮类物质,以及如何能够高效地提取相关黄酮类化合物的研究备受关注。
天然植物中黄酮类化合物的提取方法很多,有单一提取法[11]、辅助提取法[12],还有多种方法的耦合提取法[13],其中超声波作为一种新型、高效的技术手段,由于具有提取效率高、操作相对简便等特点,受到研究者的广泛关注。其原理主要是利用超声波产生的振动、热作用、空化效应及搅拌等作用,对植物样品施加强压以促进其细胞壁破坏,释放出胞内物质,促使黄酮类物质从植物组织内部溶解出来,提高提取效率。此外,与其他提取方法相比,超声波提取法可有效减少高温影响,显著缩短提取时间,具有安全性高和效率高的优点[14-17]。由于不同植物具有各自的独特性,超声波辅助提取法在提取黄酮类物质的实际应用中,对不同材料的具体操作工艺具有不同的要求,需要依据实际情况进行优化探索[18-19]。已有研究结果表明,实验室常用的总黄酮的优选方法有单因素法、正交设计法、Box-Behnken响应面法等[20-21]。其中,响应面法考虑了试验的随机误差,在寻优时可对各个水平进行连续性分析,可采用相应数学模型拟合,具有简便、精度高等优点,应用广泛[22-24]。碱韭作为一种具有巨大开发潜力的“药食同源”植物,超声波辅助提取法加以正交试验、响应面法优化对其黄酮类化合物的提取效果如何,尚未见报道。试验对天然碱韭总黄酮的提取工艺进行探索优化,并测定和分析碱韭总黄酮的抗氧化活性和还原能力,旨在为进一步充分开发利用碱韭提供科学依据。
1 材料与方法
1.1 材料与仪器
材料:天然碱韭于2021年8月采自鄂尔多斯市达拉特旗,采后将根、叶、花清洁并分离,室内自然阴干,经粉碎后过60目筛,密封低温冷藏备用。前期研究发现碱韭黄酮主要存在于叶中,因此取碱韭叶进行提取工艺研究。
试剂:芦丁标准品(纯度≥98%),西安汇普森亚环生物科技有限公司;无水乙醇、抗坏血酸、邻菲罗啉、铁氰化钾、FeCl3、AlCl3、无水乙酸钠、冰乙酸(分析纯),国药试剂有限公司;DPPH,Sigma公司;ABTS、二丁基羟基甲苯、三羟甲基氨基甲烷,Rhawn公司;NaH2PO4、K2S2O8、双氧水、邻苯三酚,天津南开允公和成技术有限公司;Na2HPO4、FeSO4、三氯乙酸,济南高达通达化工有限公司;实验用水为二次蒸馏水。
仪器:N4S紫外可见分光光度计,上海仪电分析仪器有限公司;TB-114电子分析天平,河南信陵仪器设备有限公司;S30L数控超声波清洗器,上海仪天科学仪器有限公司;H/T16MM台式高速离心机,南北仪器有限公司;QE-200高速多功能粉碎机,上海罗纳迪科学仪器有限公司;LGJ-10A真空冷冻干燥机,上海利萨德仪器制造有限公司。
1.2 试验方法
1.2.1 碱韭总黄酮的提取及含量的测定
准确称取1.0 g碱韭叶粉末,以乙醇为溶剂采用超声波辅助提取法对碱韭黄酮进行提取。提取后过滤,收集滤液至棕色瓶中,得到试验的样品提取液。
依据前期碱韭总黄酮测定方法的研究结果,选择乙醇作为提取溶剂进行超声波辅助提取,采用AlCl3比色法[25]进行总黄酮含量测定并计算总黄酮提取率。测定条件为:将1 mL提取液置于10 mL具刻度试管中,加入0.1 mol/L的AlCl3溶液0.8 mL,再加入pH 4.4的NaAC-HAC缓冲液2 mL,用30%(体积分数)乙醇定容至10 mL,以1 mL蒸馏水代替样品提取液作为相应的空白对照。摇匀后,室温下静置25 min,在405 nm下测定吸光度值。以芦丁为标样,回归方程A=0.102 8c+0.007 4,相关系数R2=0.999 4。
总黄酮提取率按公式(1)计算:
式中:Y,总黄酮提取率,%;ρ1,标准曲线计算得出的待测液中总黄酮质量浓度,mg/mL;V1,测定样品液体积,mL;V,样品提取液总体积,mL;V2,显色液总体积,mL;m,称取碱韭粉末质量,g。
1.2.2 单因素提取方法
准确称取1.0 g碱韭叶进行超声波辅助提取,每个水平做3次重复。单因素及水平设定如下:
乙醇浓度(A):提取温度60 ℃,提取时间20 min,料液比1∶40(g∶mL),功率300 W(固定反应条件)。对设定乙醇体积分数(10%、40%、60%、70%、80%)的黄酮提取率进行测定考察分析。
提取温度(B):提取时间20 min,乙醇体积分数70%,料液比1∶40(g∶mL),功率300 W(固定反应条件)。对设定不同温度(30、40、50、60、70 ℃)的黄酮提取率进行考察分析。
提取时间(C):提取温度60 ℃,乙醇体积分数70%,料液比1∶40(g∶mL),功率300 W(固定反应条件)。对设定不同提取时间(10、20、30、40、50、60 min)的黄酮提取率进行考察分析。
料液比(D):提取温度60 ℃,提取时间20 min,乙醇体积分数70%,功率300 W(固定反应条件)。对设定不同料液比[1∶10、1∶20、1∶30、1∶40、1∶50(g∶mL)]的黄酮提取率进行考察分析。
提取功率(E):提取时间40 min,提取温度60 ℃,乙醇体积分数70%,料液比1∶40(g∶mL)(固定反应条件)。对设定不同功率(250、300、350、400、450 W)的黄酮提取率进行考察分析。
1.2.3 正交试验优化总黄酮提取工艺
在单因素试验基础上,以总黄酮的提取率为指标,采用L16 (45)正交试验设计,见表1,确定乙醇浓度(A)、提取温度(B)、提取时间(C)、料液比(D)和超声功率(E)的最佳组合,从而对碱韭总黄酮的提取条件进行优化。
表1 总黄酮提取的正交试验因素水平
Table 1 Factors and levels of orthogonal experiment for total flavonoids extraction
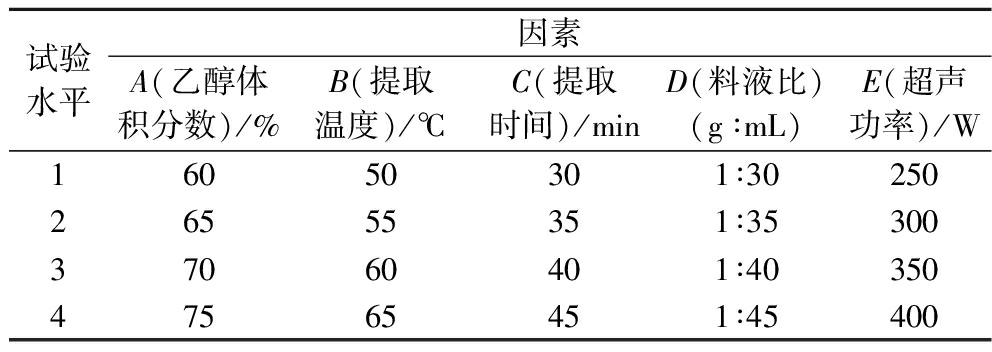
试验水平因素A(乙醇体积分数)/%B(提取温度)/℃C(提取时间)/minD(料液比)(g∶mL)E(超声功率)/W16050301∶3025026555351∶3530037060401∶4035047565451∶45400
1.2.4 响应面优化总黄酮提取工艺
在单因素试验、正交试验的基础上,经显著性分析,采用Design Expert 12.0建立5因素3水平的Box-Behnken模型,以乙醇浓度(A)、提取温度(B)、提取时间(C)、料液比(D)和超声功率(E)为试验因素,总黄酮提取率为响应值,进一步确定最佳提取工艺,自变量因素编码及水平(表2)。
表2 Box-Behnken试验设计因素水平
Table 2 Factors and levels of Box-Behnken experiment design
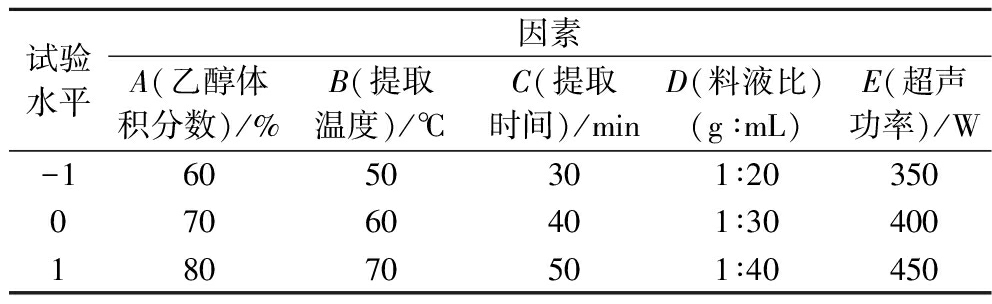
试验水平因素A(乙醇体积分数)/%B(提取温度)/℃C(提取时间)/minD(料液比)(g∶mL)E(超声功率)/W-16050301∶2035007060401∶3040018070501∶40450
1.2.5 抗氧化指标测定
称取碱韭叶、花、根粉末,按照最优提取工艺,得到各部位总黄酮提取液。提取液去乙醇后以真空冷冻干燥得到各部位总黄酮提取物。分别准确称取0.2、0.4、0.6、0.8、1.0、1.2 mg对照品维生素C和各部位总黄酮提取物溶于100 mL水中,配制0.2、0.4、0.6、0.8、1.0、1.2 mg/mL质量浓度梯度的维生素C溶液和各部位碱韭总黄酮溶液。分别以DPPH法、邻二氮菲法、邻苯三酚法、ABTS法对应测定DPPH自由基、·OH、·O2-、ABTS阳离子自由基清除率;以铁氰化钾法检测其还原能力[26-27]。
1.3 数据分析
试验结果以平均值±标准差表示,采用Design Expert 12.0、SPSS 20.0软件统计分析试验数据。采用Excel 2016软件制图。
2 结果与分析
2.1 碱韭总黄酮提取的单因素试验结果
从碱韭总黄酮提取的单因素试验结果(图1)可以看出:从单因素的角度出发,70%乙醇体积分数为碱韭总黄酮提取最佳体积分数,最佳提取温度60 ℃,最佳提取时间40 min,最佳料液比1∶30 (g∶mL),超声功率400 W。利用SPSS 20.0软件对单因素的5个因素进行方差分析,由表3可知,5个因素在单因素试验中均P<0.01,差异极显著。

a-乙醇体积分数;b-料液比;c-提取温度;d-提取时间;d-提取功率
图1 各因素水平对总黄酮提取率的影响
Fig.1 Effects of various factors and levels on extraction rate of total flavonoids
表3 单因素试验方差分析
Table 3 Variance analysis of single factor experiment
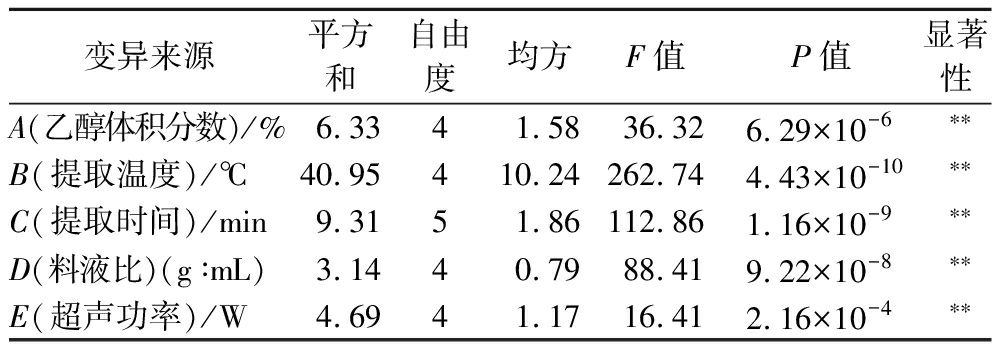
变异来源平方和自由度均方F值P值显著性A(乙醇体积分数)/%6.3341.5836.326.29×10-6∗∗B(提取温度)/℃40.95410.24262.744.43×10-10∗∗C(提取时间)/min9.3151.86112.861.16×10-9∗∗D(料液比)(g∶mL)3.1440.7988.419.22×10-8∗∗E(超声功率)/W4.6941.1716.412.16×10-4∗∗
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)(下同)。
2.2 正交试验优化碱韭总黄酮的提取工艺
正交试验优化碱韭总黄酮的提取工艺如表4所示,提取工艺优化过程中,以L16(45)正交试验设计,并对结果进行直观分析。R值与该因素对提取率影响呈正相关。提取率受各因素的影响程度由大到小依次为:B>C>A>E>D。最佳工艺组合为A1B2C1D1E1,乙醇体积分数60%,提取温度55 ℃,提取时间30 min,料液比1∶30(g∶mL),超声功率250 W,在该提取条件下碱韭叶总黄酮提取率(4.86±0.11)%,相对标准偏差(relative standard deviation,RSD)为2.32%,表明精密度良好。
对正交试验结果进行方差分析,结果如表5所示。通过F临界值和F比可判定该因素对碱韭总黄酮提取率的差异显著与否。5个因素均对碱韭总黄酮提取率的影响不显著。
表4 正交试验结果及直观分析
Table 4 Orthogonal experiment results and range analysis of extraction of total flavonoids
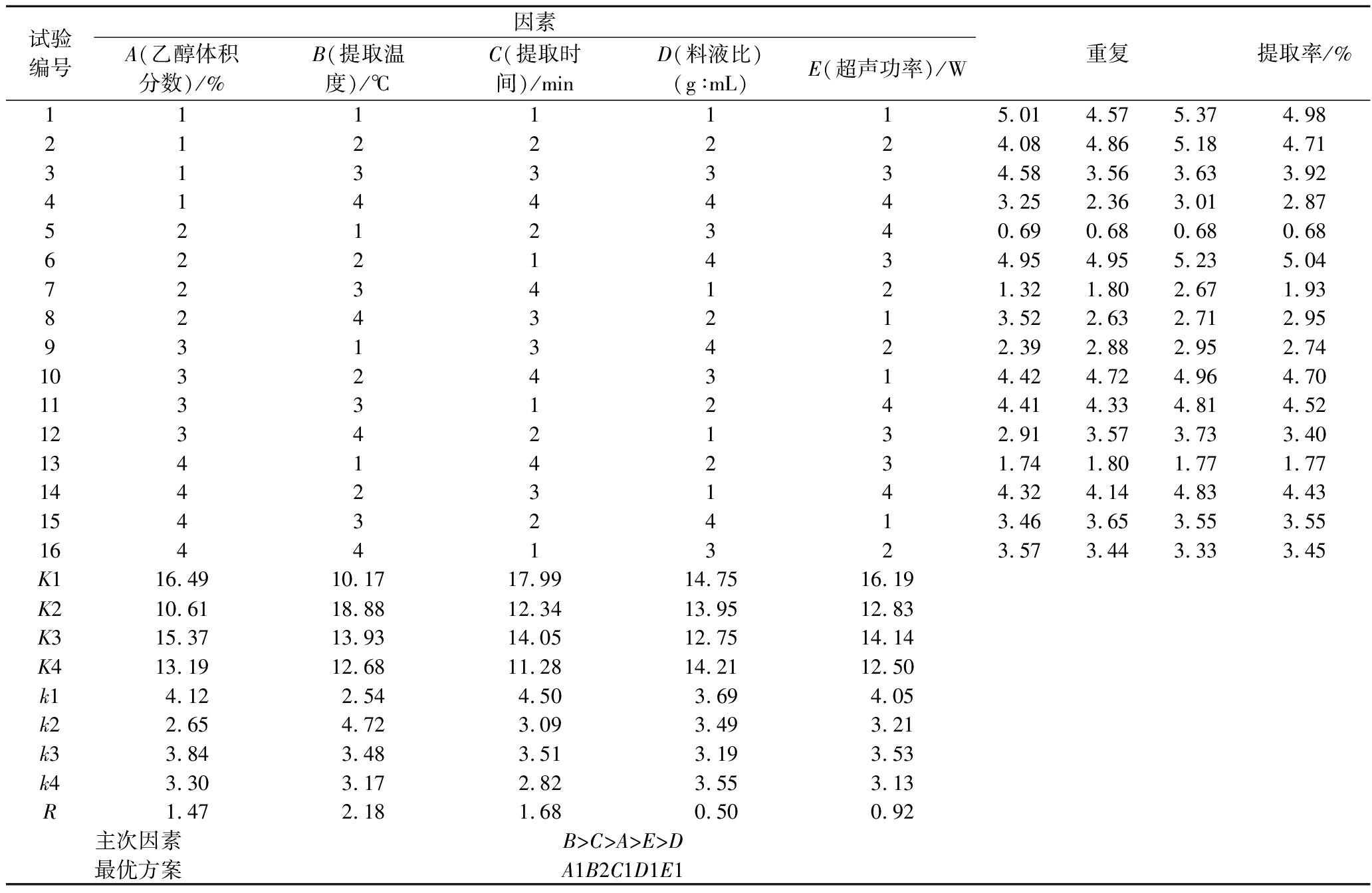
试验编号因素A(乙醇体积分数)/%B(提取温度)/℃C(提取时间)/minD(料液比)(g∶mL)E(超声功率)/W重复提取率/%1111115.014.575.374.982122224.084.865.184.713133334.583.563.633.924144443.252.363.012.875212340.690.680.680.686221434.954.955.235.047234121.321.802.671.938243213.522.632.712.959313422.392.882.952.7410324314.424.724.964.7011331244.414.334.814.5212342132.913.573.733.4013414231.741.801.771.7714423144.324.144.834.4315432413.463.653.553.5516441323.573.443.333.45K116.4910.1717.9914.7516.19K210.6118.8812.3413.9512.83K315.3713.9314.0512.7514.14K413.1912.6811.2814.2112.50k1 4.122.544.503.694.05k22.654.723.093.493.21k33.843.483.513.193.53k43.303.172.823.553.13R1.472.181.680.500.92主次因素B>C>A>E>D最优方案A1B2C1D1E1
表5 正交试验结果方差分析
Table 5 Variance analysis of orthogonal experiment results
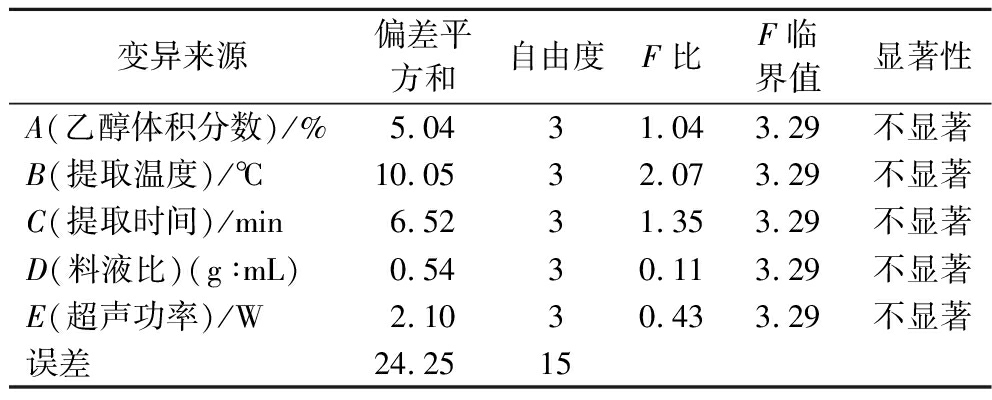
变异来源偏差平方和自由度F比F临界值显著性A(乙醇体积分数)/%5.0431.043.29不显著B(提取温度)/℃10.0532.073.29不显著C(提取时间)/min6.5231.353.29不显著D(料液比)(g∶mL)0.5430.113.29不显著E(超声功率)/W2.1030.433.29不显著误差24.2515
2.3 响应面法对提取工艺的优化
响应面法试验结果见表6,为降低试验中不可控制因素对试验的干扰,中点试验重复BLOCK设置为2个,由表可知试验共有46个试验点(包括40个因析点和6个零点),采用软件Design Expert 12.0对所得数据进行回归分析,分析结果见表7。
利用多元回归拟合,得到总黄酮提取率(Y)与乙醇体积分数(A)、提取温度(B)、提取时间(C)、料液比(D)和超声功率(E)的回归方程为Y(%)=4.680-0.136 5A-0.152 1B+0.057 9C+0.086 9D-0.124 4E+0.075 8AB+0.003 5AC+0.032 5AD+0.034 2AE+0.074 5BC-0.054 0BD-0.042 2BE+0.000 3CD+0.020 3CE+0.011 2DE-0.125 5A2-0.267 0B2-0.159 8C2-0.072 2D2-0.238 2E2,对该回归方程进行方差分析,拟合度和可信度较高,该模型差异达到极显著水平(P<0.01),失拟项不显著(P>0.05),决定系数R2为0.84,变异系数值=3.42%<10.00%,可用于设计范围内的预测。通过5个影响因素的F值大小可得各因素对碱韭叶总黄酮提取率的影响大小为:B>A>E>D>C。模型一次项中具极显著水平(P<0.01)的有A、B和E,显著水平(P<0.05)的有D;二次项A2达到显著水平(P<0.05),B2和C2的回归系数均达到极显著水平(P<0.01)。响应曲面坡度陡峭与平滑程度对应因素改变敏感程度[28],各因素交互作用对碱韭叶中总黄酮提取率影响的等高线以及响应曲面如图2所示。碱韭叶总黄酮的提取率受各因素交互影响作用不明显。
表6 Box-Behnken试验结果
Table 6 Box-Behnken experimental results
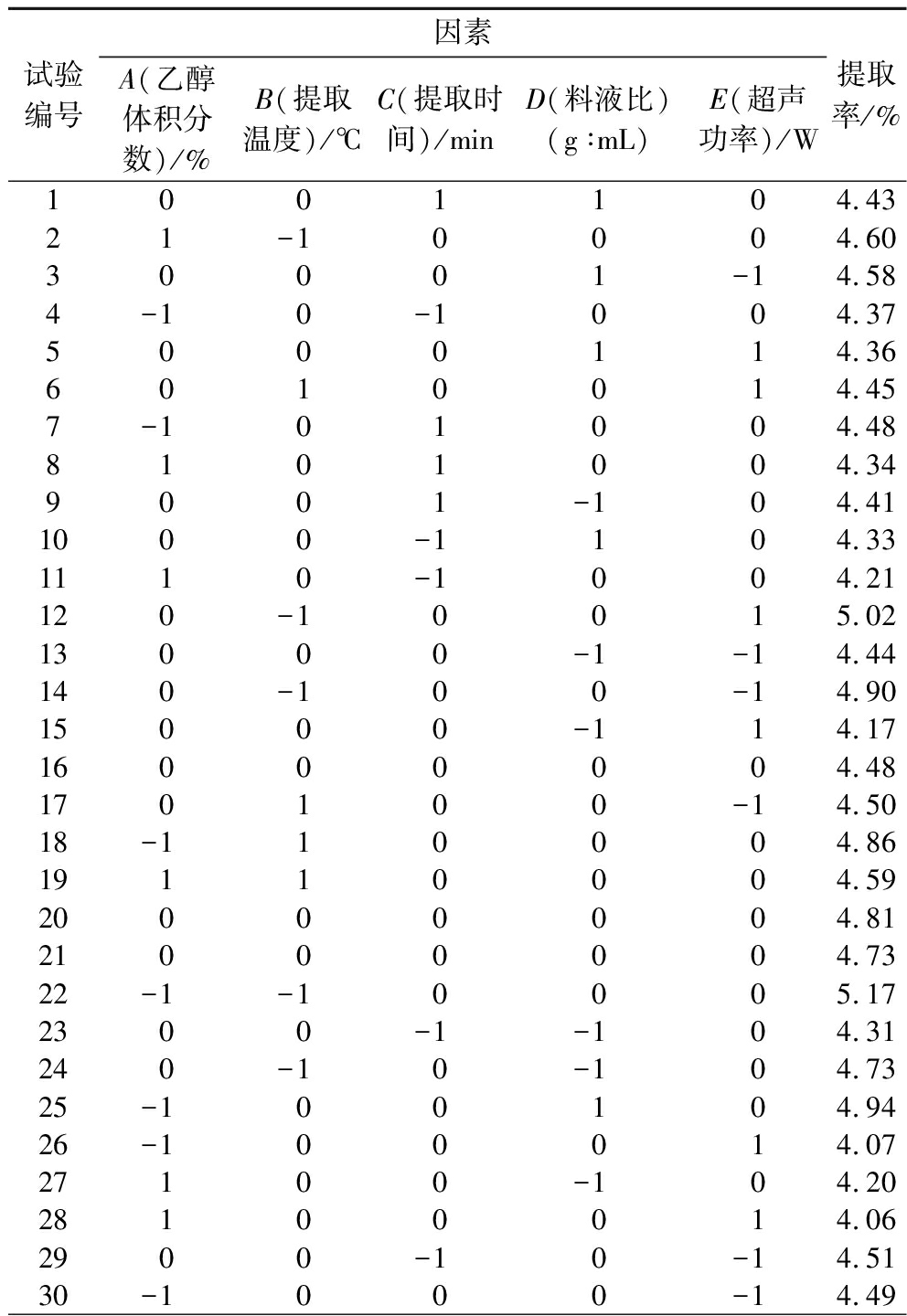
试验编号因素A(乙醇体积分数)/%B(提取温度)/℃C(提取时间)/minD(料液比)(g∶mL)E(超声功率)/W提取率/%1001104.4321-10004.6030001-14.584-10-1004.375000114.366010014.457-101004.488101004.349001-104.411000-1104.331110-1004.21120-10015.0213000-1-14.44140-100-14.9015000-114.1716000004.48170100-14.5018-110004.8619110004.5920000004.8121000004.7322-1-10005.172300-1-104.31240-10-104.7325-100104.9426-100014.0727100-104.2028100014.062900-10-14.5130-1000-14.49
续表6
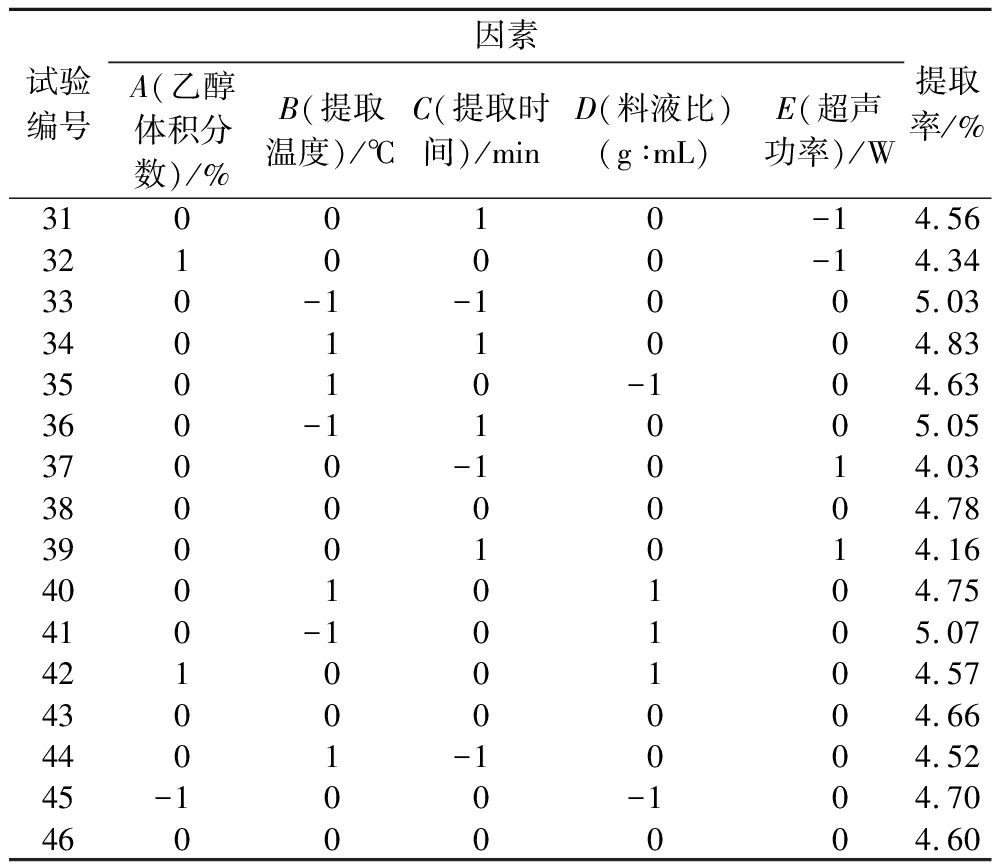
试验编号因素A(乙醇体积分数)/%B(提取温度)/℃C(提取时间)/minD(料液比)(g∶mL)E(超声功率)/W提取率/%310010-14.56321000-14.34330-1-1005.0334011004.8335010-104.63360-11005.053700-1014.0338000004.7839001014.1640010104.75410-10105.0742100104.5743000004.664401-1004.5245-100-104.7046000004.60
表7 Box-Behnken试验结果方差分析
Table 7 Variance analysis of Box-Behnken experiment results
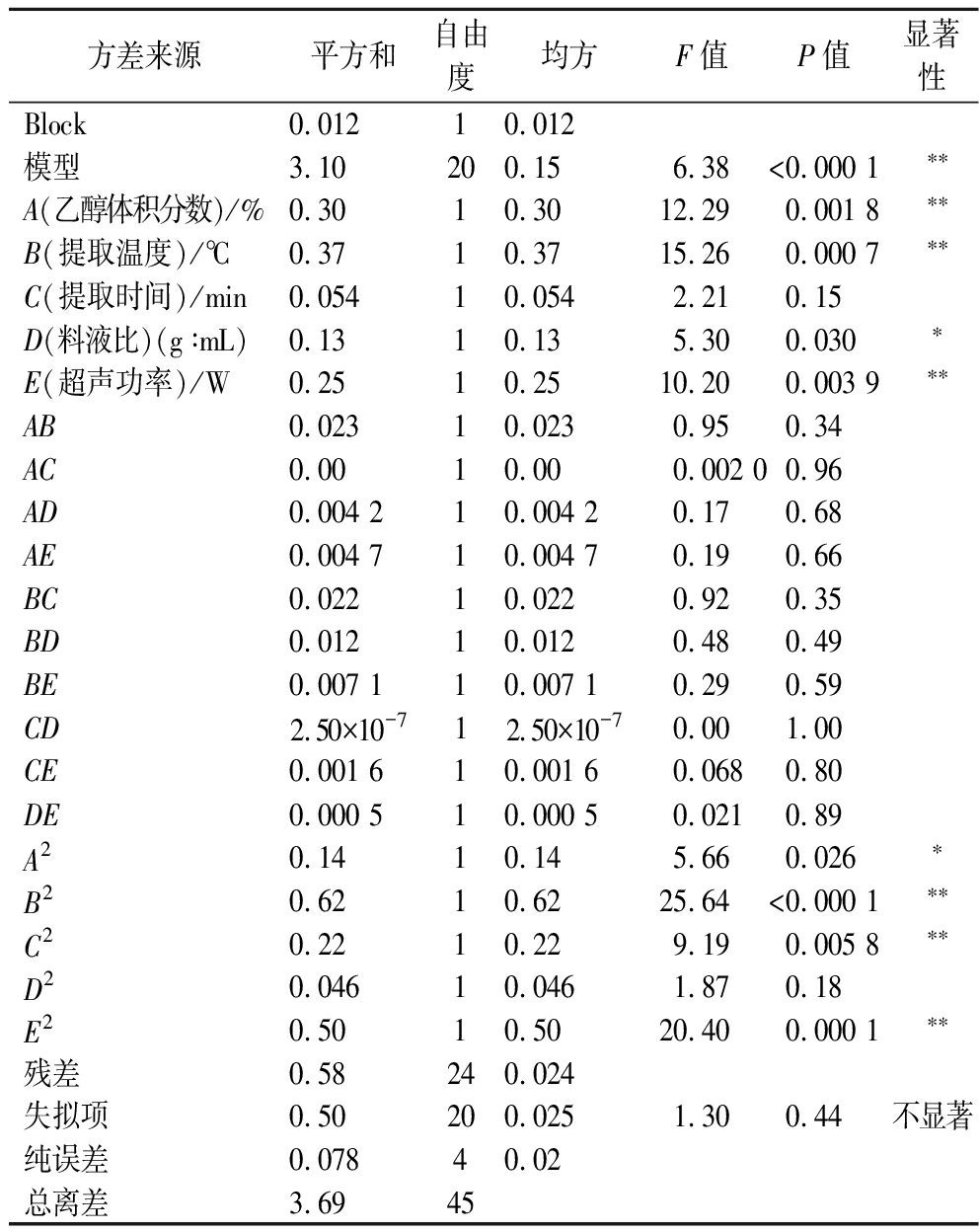
方差来源平方和自由度均方F值P值显著性Block0.012 10.012 模型3.10200.156.38<0.000 1∗∗A(乙醇体积分数)/%0.3010.3012.290.001 8∗∗B(提取温度)/℃0.3710.3715.260.000 7∗∗C(提取时间)/min0.05410.0542.210.15D(料液比)(g∶mL)0.1310.135.300.030∗E(超声功率)/W0.2510.2510.200.003 9∗∗AB0.02310.0230.950.34AC0.0010.000.002 00.96AD0.004 210.004 20.170.68AE0.004 710.004 70.190.66BC0.02210.0220.920.35BD0.01210.0120.480.49BE0.007 110.007 10.290.59CD2.50×10-712.50×10-70.001.00CE0.001 610.001 60.0680.80DE0.000 510.000 50.0210.89A20.1410.145.660.026∗B20.6210.6225.64<0.000 1∗∗C20.2210.229.190.005 8∗∗D20.04610.0461.870.18E20.5010.5020.400.000 1∗∗残差0.58240.024失拟项0.50200.0251.300.44不显著纯误差0.07840.02总离差3.6945
通过软件对二次多项式回归方程进行分析预测,碱韭叶总黄酮超声波辅助提取法的最佳提取工艺条件:提取温度50.00 ℃,提取时间39.30 min,乙醇体积分数62.28%,料液比1∶38.04 (g∶mL),超声功率389.44 W,在该条件下碱韭叶总黄酮提取率为5.24%。结合实际操作情况,将最佳提取工艺再次优化改为:提取温度50 ℃,提取时间40 min,乙醇体积分数60%,料液比1∶40 (g∶mL),超声功率400 W,以此工艺建立的数学模型,设置6次重复验证试验,获得的碱韭叶总黄酮提取率的实际测得值为(5.47±0.035)%,预测值为5.22%,RSD为0.65%。按照上述修正条件提取碱韭叶总黄酮,将提取液浓缩,冷冻干燥得到总黄酮粉末,按照AlCl3比色法检测并计算纯度,总黄酮纯度(%)=碱韭叶总黄酮质量/碱韭叶总黄酮粉末质量×100,计算得碱韭叶总黄酮纯度为(34.59±0.13)%。

a-乙醇体积分数和提取温度;b-乙醇体积分数和提取时间;c-乙醇体积分数和料液比;d-乙醇体积分数和超声功率; e-提取温度和提取时间;f-提取温度和料液比;g-提取温度和超声功率;h-提取时间和料液比; i-提取时间和超声功率;j-料液比和超声功率
图2 各因素交互作用总黄酮提取率的等高线与响应面图
Fig.2 Contour and response surface plots showing the interactive effects of extraction conditions on total flavonoids extraction rate
2.4 体外抗氧化活性检测
2.4.1 碱韭总黄酮对DPPH自由基、ABTS阳离子自由基、·O2-和·OH的清除作用
如图3所示,0.2~1.2 mg/mL碱韭总黄酮能够有效清除DPPH自由基、ABTS阳离子自由基、·O2-和·OH,最高清除率分别为87.87%、98.86%、91.68%和98.35%。碱韭不同部位提取的总黄酮对DPPH自由基和ABTS阳离子自由基的清除作用随浓度的增加而降低,对·O2-和·OH的清除作用则随浓度的增加而增加。各部位总黄酮的总体清除效果为叶>花>根。在质量浓度≤0.4 mg/mL时,碱韭叶总黄酮对DPPH自由基的清除作用最佳,与维生素C清除效果相近(P>0.05)。经SPSS 20.0软件计算碱韭叶、花、根总黄酮和维生素C对DPPH自由基清除的IC50值分别为2.490、1.116、0.555、5.543×10-11 mg/mL。在质量浓度≤0.6 mg/mL,碱韭叶和花总黄酮对ABTS阳离子自由基的清除作用明显,清除效果显著高于维生素C(P<0.05)。IC50值分别为3.23、2.08、34.19、0.10 mg/mL。在质量浓度≥0.6 mg/mL,碱韭叶、花、根总黄酮对·O2-的清除作用均明显高于维生素C(P<0.05)。IC50值分别为0.320、0.426、0.638、0.770 mg/mL。在质量浓度≥0.6 mg/mL,碱韭叶、花总黄酮对·OH的清除作用均高于维生素C,随着浓度增加其清除效果显著高于维生素C(P<0.05)。碱韭叶、花、根总黄酮和维生素C对·OH的IC50值分别为0.025、6.567×10-6、0.021、861.345 mg/mL。表明,碱韭黄酮对4种自由基均有一定的清除作用,叶和花的清除效果优于根。IC50值是指自由基清除率为50%时,抗氧化剂的浓度值,IC50值越小抗氧化能力越好。由IC50值可知,碱韭总黄酮的自由基清除能力十分显著,对·O2-和·OH的清除率高于维生素C,清除效果优于对DPPH自由基和ABTS阳离子自由基的清除效果。
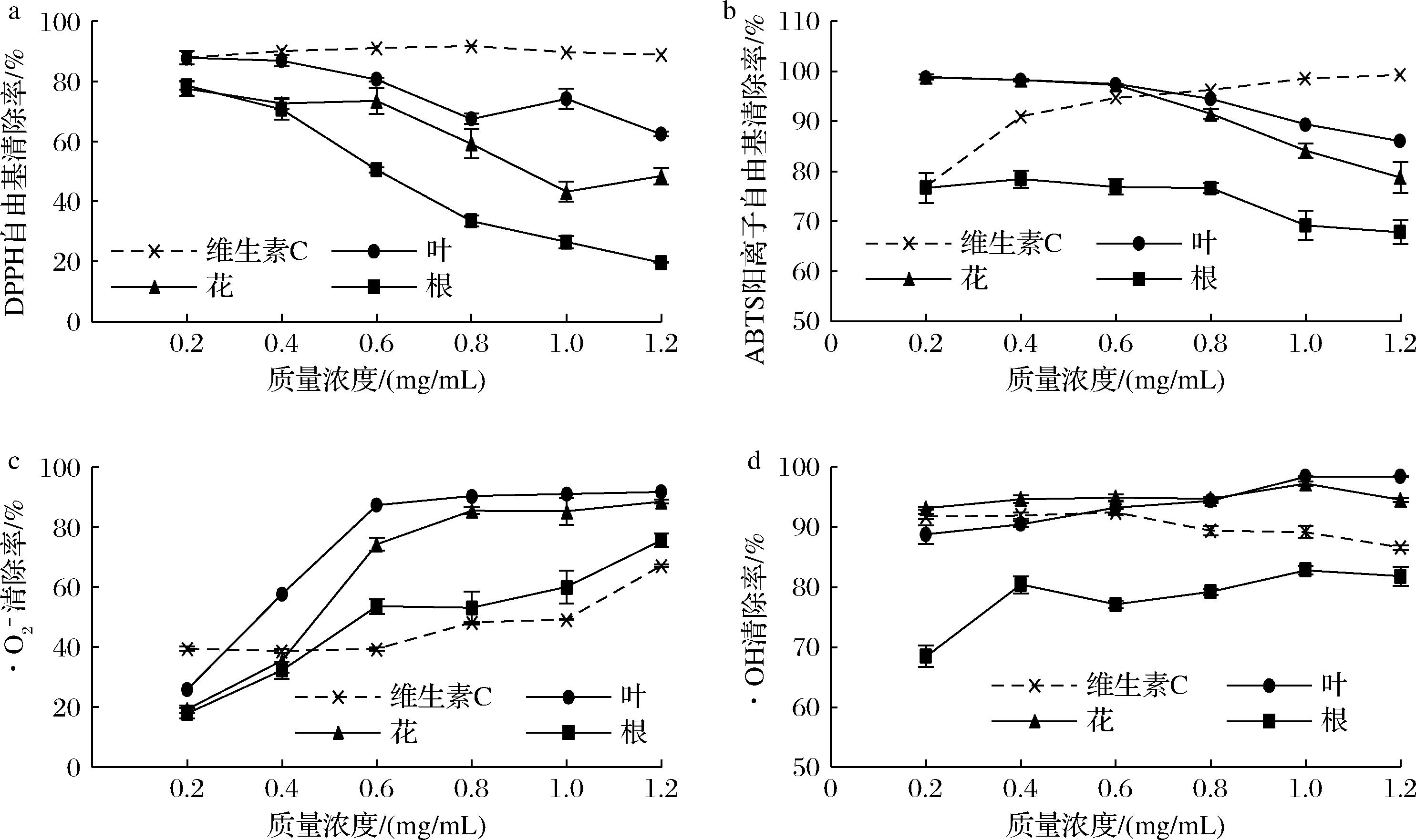
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-·O2-清除率;d-·OH清除率
图3 不同浓度碱韭总黄酮对自由基的清除率
Fig.3 Free radical scavenging rate of total flavonoids from Allium polyrhizum Turcz.ex Regel at different concentration
2.4.2 碱韭总黄酮的还原能力
碱韭总黄酮的还原能力的测定结果如图4所示。
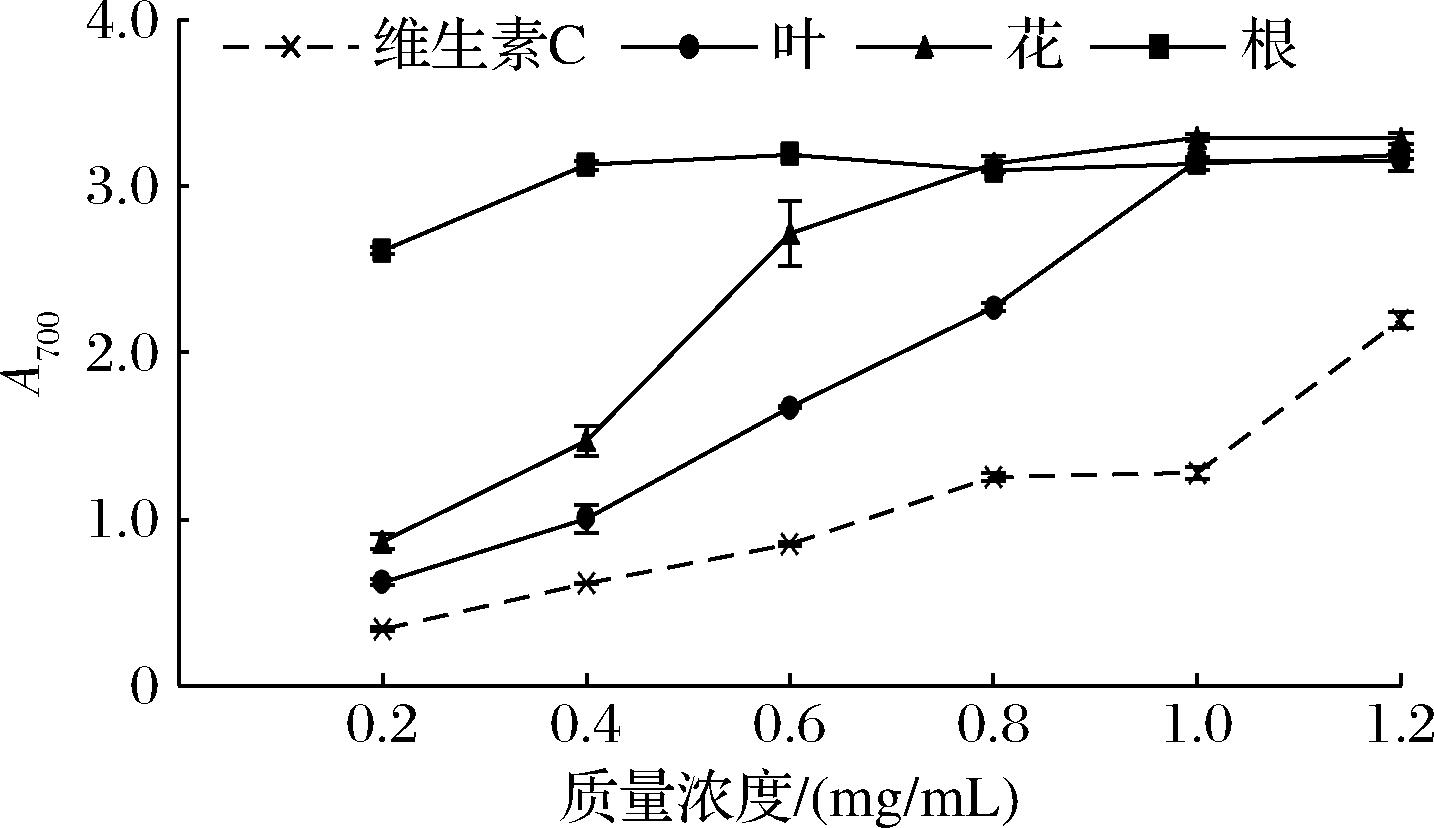
图4 不同浓度碱韭总黄酮的还原能力
Fig.4 Reducing ability of total flavonoids from Allium polyrhizum Turcz.ex Regel at different concentration
在0.2~1.2 mg/mL,碱韭不同部位提取的总黄酮的还原能力随浓度的增加而增加,通过试验得出,提取物质量浓度与总黄酮还原能力存在剂量效益关系,随着质量浓度在0.2~1.0 mg/mL范围内的升高,碱韭总黄酮还原能力逐渐增强。各部位总黄酮的还原能力均大于维生素C,且还原能力为根>花>叶。
3 讨论
天然碱韭在我国整个北疆分布广泛,营养和药用价值突出,其所富含的黄酮类化合物尤其引人关注[3, 29]。探索出安全高效、得率较高的提取工艺是碱韭黄酮有效开发利用的基础。前期研究显示,超声波辅助提取碱韭总黄酮的方法效果较好且安全便捷[14-16]。试验采用超声波辅助提取碱韭总黄酮,通过单因素、正交试验、响应面法分析,各因素对提取率的影响程度由大到小分别为:单因素:提取温度>提取时间>料液比>乙醇体积分数>超声功率;正交试验:提取温度>提取时间>乙醇体积分数>超声功率>料液比;响应面法:提取温度>乙醇体积分数>超声功率>料液比>提取时间。影响碱韭总黄酮提取率的主要因素是提取温度,这可能与温度对平衡浓度的影响较大有关,温度升高使质量传递过程加快,黄酮在碱韭表面的脱附作用增强,达到平衡的时间缩短[30],而温度过高则引起黄酮类化合物结构被氧化破坏导致其提取率降低,这与响应面法提取温度与提取时间的交互作用结果相一致。同时,温度升高有助于加速超声波产生的热作用、空化效应等作用,促进其细胞壁破坏,释放出胞内物质,提高黄酮的提取效率。对比正交试验和响应面法,各因素对提取率的影响程度变化基本一致,唯一的差别在于提取时间,造成这种差异可能与提取时间在正交试验中对总黄酮提取率的影响不显著,在响应面试验中与其他因素交互作用不明显有关。由响应面曲线可以看出当提取时间在30~40 min时,黄酮提取率变化趋于平缓,变化幅度较小。
许多研究报道中对植物黄酮的提取采用乙醇热回流法,但通过碱韭黄酮提取试验[参照洋葱最优试验条件进行[31],准确称取1.0 g碱韭叶粉加80%(体积分数)乙醇30 mL,在80 ℃下回流提取2.5 h,总黄酮提取率达(3.46±0.71)%]表明,无论是用正交试验,还是用响应面法,黄酮提取率均极显著(P<0.01)高于乙醇热回流法,分别达到其1.55倍和1.74倍。由于温度是影响碱韭总黄酮提取的主要因素,而乙醇热回流法存在遇热不稳定的情况,由此可能导致提取率较低且提取效果不稳定。超声波辅助提取技术可有效解决这一缺陷,试验稳定性和可重复性明显提升。由试验结果可知,响应面法总黄酮提取率较正交试验提高了0.60%,极显著优于正交试验(P<0.01)。超声波辅助提取可有效提高碱韭总黄酮的提取率,响应面法确定的提取工艺参数模型具有代表性,通过该法得到的总黄酮提取率高于同样超声波辅助提取法测得的《中国药典》记录植物韭菜籽[19]以及洋葱[31]、沙葱[32]的总黄酮提取率,能够高效提取碱韭中的黄酮类化合物,且碱韭黄酮具有较高的开发利用价值。与其他提取方法相比,该法通过超声波空穴作用和加速介质质点运动过程,促进乙醇穿透植物组织,使黄酮类物质获得较高的加速度和动能,加速黄酮溶解于乙醇中。可有效减少高温影响,显著缩短提取时间,具有安全性高和效率高的优点,随着超声波技术的不断发展和完善,必将在天然产物有效成分提取领域发挥更大的作用。
自由基是影响细胞衰老凋亡的最重要的因素之一,如何有效清除体内过量自由基是营养学领域的一个研究热点。IC50值可以有效评价黄酮类化合物的抗氧化活性,通常将IC50值低于10 mg/mL作为黄酮类化合物具有良好抗氧化活性的重要指标[33]。通过体外抗氧化活性试验研究表明,碱韭总黄酮对4种自由基均有一定的清除作用,其中叶和花的清除效果优于根,这与碱韭总黄酮在不同部位的含量分布相一致。由IC50值可知,碱韭总黄酮对·O2-和·OH的清除率明显高于维生素C,表明碱韭黄酮与维生素C相比,在清除不同自由基方面各有优劣,碱韭黄酮具有成为一种优质天然抗氧化剂的潜质,有望从食品抗氧化剂及防腐剂等方面得到开发利用。除了自由基清除能力以外,还原能力也是物质衡量抗氧化能力的重要指标。对碱韭不同部位还原能力测定结果显示,碱韭叶、花、根提取的总黄酮的还原能力均大于维生素C,表明碱韭黄酮的抗氧化性总体上优于维生素C。然而,与总黄酮含量及对·O2-等4种自由基清除能力表现不同的是,碱韭各部分还原能力表现为根>花>叶的情况,根部黄酮含量低却显示出最高的还原力。这可能与碱韭不同部位黄酮类化合物的种类和分子结构不同有关。不同分子抗氧化的机制不同,如采用直接清除自由基、螯合金属离子、抑制脂质氧化作用、激活体内抗氧化酶活性等[34]。如果根部黄酮类化合物分子的结构是某种高活力形式的分子,在不同的抗氧化性测定方法中,其有可能在含量低的情况下反而在某些抗氧化指标方面表现出高活性[35-36]。植物不同部位黄酮类化合物抗氧化性在不同指标上出现不同表现,这种情况不仅碱韭上如此,前人在沙葱[32]、金莲花[37]、粉绿铁线莲[38]等相关研究中均有类似报道。然而,碱韭黄酮类分子如何具体分类,不同黄酮分子实现抗氧化性的机制如何,许多研究目前还不够清晰,需要进一步深入探讨。
4 结论
试验通过单因素、正交试验、响应面法设计的综合比较,确定了超声波辅助提取碱韭总黄酮最佳提取工艺条件为:乙醇体积分数60%,提取温度50 ℃,提取时间40 min,料液比1∶40 (g∶mL),超声功率400 W。此时总黄酮提取率可达(5.47±0.035)%。该法优于传统乙醇热回流法,与其他提取方法相比,具有减少高温影响,安全性能高,提取时间短的优势。体外抗氧化活性研究表明,碱韭总黄酮有较强的体外抗氧化作用,能够有效清除DPPH自由基、ABTS阳离子自由基、·O2-和·OH,对·O2-和·OH的清除效果优于对DPPH自由基和ABTS阳离子自由基的清除效果,叶和花的清除效果优于根。各部位总黄酮的还原能力均大于维生素C,且还原能力根>花>叶。天然碱韭总黄酮含量较为可观,有较强的体外抗氧化作用,且资源量充足,是一种值得开发利用的药用和食用植物资源。本试验为进一步分离、鉴定黄酮单体成分和其生物活性成分提供最优提取方案。在后期的研究中可以使用碱韭叶作为研究对象进行总黄酮的提取,并进一步研究发掘碱韭总黄酮的其他生物功效,为碱韭黄酮的深入开发利用提供理论依据和实践参考,也可为其他植物中的黄酮类化合物提取提供有益参考。
[1] 布林特古斯. 蒙古族食谱[M].赤峰:内蒙古科学技术出版社, 1987. BRINTGUS.Mongolian Recipes[M].Chifeng:Iinner Mongolia Science and Technology Press, 1994.
[2] 马毓泉.内蒙古植物志[M].呼和浩特:内蒙古人民出版社, 1994. MA Y Q.Flora iMtramongolica[M].Hohhot:Inner Mongolian People’s Press, 1994.
[3] 赵鹏, 董贵成, 门中华.内蒙古地区野生碱韭花期主要营养成分研究[J].北方园艺, 2016(14):152-156. ZHAO P, DONG G C, MEN Z H.Research on the main nutrition ingredients during flowering period of wild Allium polyrhizum turcz.ex regel in inner Mongolia[J].Northern Horticulture, 2016(14):152-156.
[4] 赵鹏, 秦永林, 门中华, 等.内蒙古野生碱韭食用花中营养成分分析[J].现代食品科技, 2016, 32(12):292-297. ZHAO P, QIN Y L, MEN Z H, et al.Analyses of nutritional ingredients in edible flowers of wild Allium polyrhizum Turcz.ex Regel from inner Mongolia[J].Modern Food Science and Technology, 2016, 32(12):292-297.
[5] NIU Q, GAO Y M, LIU P H.Optimization of microwave-assisted extraction, antioxidant capacity, and characterization of total flavonoids from the leaves of Alpinia oxyphylla Miq[J].Preparative Biochemistry &Biotechnology, 2020, 50(1):82-90.
[6] XIA G H, LI X H, ZHANG Z, et al.Effects of fermentation treatments on Polygonatum odoratum flavones’ antioxidant activities[J].Saudi Journal of Biological Sciences, 2021, 28(9):5011-5016.
[7] LUO D, MU T H, SUN H N.Profiling of phenolic acids and flavonoids in sweet potato (Ipomoea batatas L.) leaves and evaluation of their anti-oxidant and hypoglycemic activities[J].Food Bioscience, 2021, 39:100801.
[8] DOBRZYNSKA M, NAPIERALA M, FLOREK E.Flavonoid nanoparticles:A promising approach for cancer therapy[J].Biomolecules, 2020, 10(9):1268.
[9] SERAFINI M, PELUSO I, RAGUZZINI A.Flavonoids as anti-inflammatory agents[J].Proceedings of the Nutrition Society, 2010, 69(3):273-278. [10] XIAO J B.Dietary flavonoid aglycones and their glycosides:Which show better biological significance?[J].Critical Reviews in Food Science and Nutrition, 2015, 57:1874-1905.
[11] 杨洋, 韦小英.柚皮黄酮类化合物提取方法和抗氧化性的研究[J].食品与发酵工业, 2002, 28(6):9-12. YANG Y, WEI X Y.Study on the extraction method of flavonoid compound in pomelo peel and it’s antioxidation property[J].Food and Fermentation Industries, 2002, 28(6):9-12.
[12] 吴小勇, 游耿, 杨公明.绿豆种皮总黄酮的提取及抗氧化能力研究[J].食品与发酵工业, 2010, 36(10):214-216. WU X Y, YOU G, YANG G M.Study on the extraction condition and antioxidant activity of total flavonoids in mungbean skin[J].Food and Fermentation Industries, 2010, 36(10):214-216.
[13] XU L, HE W J, LU M, et al.Enzyme-assisted ultrasonic-microwave synergistic extraction and UPLC-QTOF-MS analysis of flavonoids from Chinese water chestnut peels[J].Industrial Crops and Products, 2018, 117:179-186.
[14] YAO Q A, SHEN Y F, BU L, et al.Ultrasound-assisted aqueous extraction of total flavonoids and hydroxytyrosol from olive leaves optimized by response surface methodology[J].Preparative Biochemistry &Biotechnology, 2019, 49(9):837-845.
[15] 谢明杰, 宋明, 邹翠霞, 等.超声波提取大豆异黄酮[J].大豆科学, 2004, 23(1):75-76;74. XIE M J, SONG M, ZOU C X, et al.Extraction on soybean isoflavone by ultrosonic wave[J].Soybean Science, 2004, 23(1):75-76;74.
[16] 宣伟. 黄酮类化合物的研究进展[J].中国林副特产, 2017(1):66-69. XUAN W.The research progess of flavonoids compound[J].Forest by-Product and Speciality in China, 2017(1):66-69.
[17] 伍钢, 彭密军, 彭爱华, 等.超声波与微波提取桔皮中橙皮苷的对比研究[J].生物质化学工程, 2009, 43(5):26-30. WU G, PENG M J, PENG A H, et al.Comparative study of hesperidin from orange peel by ultrasonic extraction and microwave-assisted extraction[J].Biomass Chemical Engineering, 2009, 43(5):26-30.
[18] 贾楠, 赵二劳, 范建凤, 等.洋葱黄酮超声波辅助提取工艺优化及其抗氧化活性研究[J].河南工业大学学报(自然科学版), 2015, 36(2):62-65;70. JIA N, ZHAO E L, FAN J F, et al.Optimization of ultrasonic-assisted extraction technology and antioxidant activities of onion flavonoids[J].Journal of Henan University of Technology(Natural Science Edition), 2015, 36(2):62-65;70.
[19] 郭奎彩, 胡国华.超声提取韭菜籽总黄酮及其抗氧化活性研究[J].中国食品添加剂, 2014(4):47-52. GUO K C, HU G H.Study on ultrasonic extraction and antioxidant activity of flavonoids from Allium tuberosum seed[J].China Food Additives, 2014(4):47-52.
[20] 陈况况, 帕塔尔·尼牙孜, 章宏慧, 等.响应面法优化水芹黄酮提取工艺及其成分研究[J].中国食品学报, 2014, 14(11):83-89. CHEN K K, PATAER·N Y Z, ZHANG H H, et al.Optimization of flavonoids extration from Oenanthe javanica by response surface methodology and the study on chemical compositions[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(11):83-89.
[21] 赵刚, 顾佳丽, 励建荣.Plackett-Burman设计及响应面法优化芹菜中总黄酮的超声提取工艺[J].中国食品学报, 2017, 17(8):147-155. ZHAO G, GU J L, LI J R.Optimization of ultrasonic extraction conditions of total flavonoids from Apium graveolens by plackett-burman design and response surface analysis[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(8):147-155.
[22] 陶彩霞, 肖锟钰, 涂济源, 等.Box-Behnken响应面法优化姜半夏产地加工炮制一体化工艺[J].中国医院药学杂志, 2022, 42(19):2002-2007. TAO C X, XIAO K Y, TU J Y, et al.Box-behnken response surface methodology to optimize the integrated processing technology in Jiang Banxia[J].Chinese Journal of Hospital Pharmacy, 2022, 42(19):2002-2007.
[23] 景智波, 田建军, 赵丽华, 等.Box-Behnken优化培养条件提高乳酸菌产脂肪酶活性[J].中国食品学报, 2020, 20(10):124-133. JING Z B, TIAN J J, ZHAO L H, et al.Optimization of culture conditions by Box-Behnken for improving the lipase activity in lactic acid bacteria[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(10):124-133.
[24] 曾海蓉, 李婷娜, 冉倩, 等.基于熵权法结合Box-Behnken响应面法优化桂枝芍药知母颗粒复方提取工艺[J].中草药, 2020, 51(1):84-90. ZENG H R, LI T N, RAN Q, et al.Optimization of extraction process of compound Guizhi Shaoyao Zhimu Granules by combination of response surface methodology with entropy weight method[J].Chinese Traditional and Herbal Drugs, 2020, 51(1):84-90.
[25] 乐薇, 吴士筠.AlCl3比色法测定箬叶总黄酮含量[J].黑龙江农业科学, 2015(2):98-101. YUE W, WU S J.Determination of total flavonoids from Indocalamus leaves by AlCl3colorimetric method[J].Heilongjiang Agricultural Sciences, 2015(2):98-101.
[26] 杨永涛. 罗布麻总黄酮的提取、分离纯化及其抗氧化性能研究[D].广州:华南理工大学, 2018. YANG Y T.Study on extraction, purification and antioxidant activity of total flavonoids from Apocynum venetum[D].Guangzhou:South China University of Technology, 2018.
[27] 邓梦琴. 菠萝蜜果皮总黄酮的提取、分离纯化、结构鉴定及其抗氧化活性研究[D].广州:华南农业大学, 2016. DENG M Q.Extraction, purification, structure identification and antioxidant activity of total flavonoids from jackfruit peel[D].Guangzhou:South China Agricultural University, 2016.
[28] 秦晶晶, 钱慧琴, 赵媛, 等.柿叶总黄酮提取工艺优化及其抗氧化活性[J].食品工业科技, 2020, 41(13):32-38;45. QIN J J, QIAN H Q, ZHAO Y, et al.Optimization of the extraction technology of total flavonoids and in vitro antioxidant activity of extract from persimmon leaves[J].Science and Technology of Food Industry, 2020, 41(13):32-38;45.
[29] 刘一杰, 薛永常.植物黄酮类化合物的研究进展[J].中国生物工程杂志, 2016, 36(9):81-86. LIU Y J, XUE Y C.The research progress of flavonoids in plants[J].China Biotechnology, 2016, 36(9):81-86.
[30] 张喜峰, 杜玉雕, 罗光宏, 等.超声波辅助提取锁阳黄酮及其动力学分析[J].甘肃农业大学学报, 2019, 54(1):209-216. ZHANG X F, DU Y D, LUO G H, et al.Optimization and kinetics for ultrasonic-assisted extraction flavonoid from Cynomorium songaricum rupr[J].Journal of Gansu Agricultural University, 2019, 54(1):209-216.
[31] 蒋少华, 王文亮, 弓志青, 等.洋葱皮中类黄酮不同提取工艺的比较[J].食品科技, 2014, 39(8):191-195. JIANG S H, WANG W L, GONG Z Q, et al.Comparison of different technology for extracting flavonoids from onion skin[J].Food Science and Technology, 2014, 39(8):191-195.
[32] 萨茹丽, 木其尔, 王翠芳, 等.沙葱不同部位提取物总黄酮含量及其体外抗氧化、抗菌活性研究[J].食品工业科技, 2014, 35(22):124-127;134. SA R L, MU Q E, WANG C F, et al.Effect of the different parts of Allium mongolicum Regel extraction’s total flavonoids content and antioxidant, antibacterial effects in vitro[J].Science and Technology of Food Industry, 2014, 35(22):124-127;134.
[33] LEE Y L, YEN M T, MAU J L.Antioxidant properties of various extracts from Hypsizigus marmoreus[J].Food Chemistry, 2007, 104(1):1-9.
[34] 任红, 郑少杰, 张小利, 等.基于不同抗氧化机制的黄酮类化合物构效关系研究进展[J].食品工业科技, 2016, 37(2):384-388. REN H, ZHENG S J, ZHANG X L, et al.Research progress on the structure-activity relationship of flavonoid compounds based on different antioxidant mechanism[J].Science and Technology of Food Industry, 2016, 37(2):384-388.
[35] 程琳茗, 李炳伦, 严爱娟, 等.凹叶景天不同部位醇提物总黄酮含量测定及其体外抗氧化活性比较[J].现代医药卫生, 2013, 29(14):2096-2097. CHENG L M, LI B L, YAN A J, et al.Content determination of total flavonoids in alcohol extract from different parts of Sedum emarginatum migo and comparison of their in vitro antioxidant activities[J].Journal of Modern Medicine &Health, 2013, 29(14):2096-2097.
[36] 欧阳吾乐, 雷福红, 杨亚晋, 等.4种竹叶营养成分分析及其黄酮提取物体外抗氧化活性研究[J].天然产物研究与开发, 2019, 31(10):1 669-1674;1830. OUYANG W L, LEI F H, YANG Y J, et al.Analysis of nutritional components of four bamboo leaves and antioxidant activity of flavonoid extracts in vitro[J].Natural Product Research and Development, 2019, 31(10):1 669-1674;1830.
[37] 刘洋, 周鸿立, 马先红, 等.大兴安岭金莲花不同部位黄酮抗氧化活性研究[J].食品研究与开发, 2017, 38(14):7-11. LIU Y, ZHOU H L, MA X H, et al.Total flavonoids antioxidation activity of Trollius chinensis bunge in different parts[J].Food Research and Development, 2017, 38(14):7-11.
[38] 古丽巴哈尔·阿巴拜克力.新疆粉绿铁线莲不同部位总黄酮的抗氧化活性[J].食品科学, 2010, 31(23):18-21. GULIBAHAER ABABAIKELI.Antioxidant activity of total flavonoids from different organs of Clematis glauca Willd.in Xinjiang[J].Food Science, 2010, 31(23):18-21.