乙醇酸(HOCH2COOH)又称羟基乙酸,作为最简单的α-羟基酸,同时具有酸和醇的优良性质[1],使其在医药、化妆品、纺织、食品等领域应用广泛。乙醇酸具有出色的水溶性、中强酸度等特性,使其很容易被皮肤吸收,从而达到去角质、保湿、清洁、肌肤抗氧化的功效。在材料包装领域,乙醇酸聚合生成的可降解聚合物聚乙醇酸(polyglycolic acid, PGA)[2]以及乙醇酸和乳酸聚合生成的聚乳酸-羟基乙酸共聚物[poly (lactic-co-glycolic acid), PLGA][3]都具有良好生物降解性、缓释性和生物相容性,被美国食品和药品管理局批准用于多种治疗用途,如:手术缝合,皮肤移植等。此外,乙醇酸还因为具有极强的水溶性,可以通过化学反应清除设备中的钙盐、镁盐、铁垢等以达到除垢的目的,且乙醇酸腐蚀性较小,所以常用70%的乙醇酸水溶液作为清洗剂,广泛应用于金属设备及管道清洗去除污垢。
目前国内主要采取化学法大规模合成乙醇酸,如氯乙酸法、甲醛氰化法、甲醛氢羧基化法、草酸酯加氢水解法等[4]。但上述方法多少存在反应条件苛刻、催化剂成本高,产物分离精制要求高等缺点,且化学法制备乙醇酸主要为70%水溶液,其浓缩生产晶体级乙醇酸时,会有较大损耗,以至于医药行业的乙醇酸原料必须从强生等外国公司进口。近年来,通过改造工程菌株代谢生产生物基乙醇酸得到广泛关注,DENG等[5]在大肠杆菌中过表达乙醇酸合成途径关键酶(例如乙醛酸还原酶、柠檬酸合酶和异柠檬酸裂合酶)以及敲除竞争途径,使得乙醇酸产量可达到65.5 g/L。YU等[6]构建NADPH和碳流量协同体系将乙醇酸产量提高至73.3 g/L。不过目前全生物法合成乙醇酸依旧存在发酵成本较高等问题,限制了其工业化生产应用,尤其缺乏对下游分离纯化技术的相关报道。
本研究中,利用重组大肠杆菌Mgly71(MG1655 DE3,harboring PJUN-5 and PJUN-YA),在摇瓶水平上对乙醇酸发酵培养基成分进行优化,通过响应面法获得最优营养组合,重点考察玉米芯水解液(corncobs hydrolysate, CCH)等低廉生物质成分,开展5 L发酵罐水平初步放大验证,并进行下游生物分离纯化初步研究,以期为生物基乙醇酸的规模化生产应用奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌种
大肠杆菌Mgly71(MG1655 DE3,ΔldhAΔglcBΔaceBΔaldAΔglcDEFΔicdΔglcC,harboring PJUN-5 and PJUN-YA),本实验室保存。
1.1.2 培养基
LB种子培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10。
M9发酵培养基(g/L):Na2HPO4 6.78,KH2PO4 3,NH4Cl 1,NaCl 0.5,MgSO4 0.24(单独灭菌),CaCl2 0.01,蛋白胨8,酵母粉2,葡萄糖8。
优化培养基(g/L):CaCl2 6.66×10-3,MgS04·7H2O 1.2×10-2,ZnCl2 0.13×10-3,MnCl2·4H2O 0.04×10-3,KH2PO4 4.5,玉米芯水解液13,NH3·H2O 0.78,酵母粉1.5,胰蛋白胨8.5,NaCl 0.5,Na2HPO4 25.45。
1.1.3 仪器与设备
UV-1800紫外可见分光光度计,翱艺仪器(上海)有限公司;1260 Ⅱ高效液相色谱系统,美国安捷伦有限公司;HYL-C3组合式摇床,太仓市强乐实验设备有限公司;5424台式高速离心机,德国Eppendorf(艾本德)公司;G154DWS立式压力蒸汽灭菌锅,美国致微有限公司。
1.2 实验方法
1.2.1 发酵液的检测
取1 mL发酵液,10 000 r/min离心2 min后取上清液过0.22 μm滤膜。利用高效液相色谱定量检测葡萄糖、乙醇酸、乙醛酸、乳酸和乙酸。其中葡萄糖检测器为示差检测器,其余有机酸物质的检测用紫外检测器(210 nm)。检测参数为:柱温35 ℃,流动相5 mmol/L稀硫酸,流速0.6 mL/min,进样量20 μL。
1.2.2 荧光检测
将培养的菌液取50 μL置于底透壁黑的96孔板,并用PBS稀释3倍进行单细胞荧光检测。绿色荧光激发波长为485 nm,发射波长为528 nm,吸收波长为600 nm。
1.3 培养方法
1.3.1 菌株筛选
将电转得到的Mgly71菌株在37 ℃摇床孵育培养1 h后,涂布于含有链霉素、氨苄青霉素的琼脂平板上。挑取较大的存活单菌落(菌落直径>1 mm),在48孔板中培养发酵24 h后,细胞以4 000 r/min离心5 min。将上清液、对数期的MglyC-GP6细胞培养液以1∶10的比例转移到96孔深孔板中,以诱导传感器pGBS-PffS-sfgfp中sfGFP的表达。在30 ℃继续培养6 h后,测量混合物的荧光。
1.3.2 种子培养
将保存于-80 ℃冰箱的菌种在固体LB培养基进行划线,在37 ℃恒温培养箱培养14~16 h;挑取单菌落于装有10 mL LB培养基的50 mL锥形瓶中,37 ℃培养12~13 h作为一级种子液;按2%接种量接种于装有50 mL LB培养基的250 mL锥形瓶中,培养9 h作为二级种子液。
1.3.3 发酵培养
将事先培养好的种子液以2%的接种量接种于装有50 mL M9发酵培养基的250 mL锥形瓶中,并添加相应的抗生素,37 ℃,250 r/min条件下培养。
1.4 培养基优化
1.4.1 单因素试验
以乙醇酸(glycolic acid,GA)产量为响应值,依次对碳源种类、无机氮源种类、有机氮源比例、金属离子种类等影响因素进行单因素试验。
1.4.2 Plackett-Burman(PB)实验
根据单因素试验结果,确定乙醇酸发酵培养基的关键影响因素的添加量,采用Design Expert 11软件进行实验设计、数据分析,每组实验重复3次,结果取平均值。
1.4.3 中心组合设计(central composite design, CCD)和响应面分析(response surface methodology, RSM)
根据PB实验,确定3个对乙醇酸产量显著影响因素。借助Design Expert 11软件进行CCD实验设计、模型建立,每组实验重复3次,结果取平均值。
1.5 5 L发酵罐验证
在优化培养基的基础上,选择初始装液量2.5 L,接种量为5%,转速为380 r/min,发酵温度37 ℃,加入一定氨苄青霉素和链霉素使其终质量浓度分别为100、50 mg/L。发酵期间以氨水调控pH为7.0,调节通气量和转速控制溶氧为30%。
1.6 乙醇酸分离纯化
1.6.1 发酵液预处理
发酵结束后,将发酵液121 ℃灭菌20 min,10 000 r/min离心20 min,收集上清液,按照1.2.1节中方法测定乙醇酸浓度。
1.6.2 活性炭脱色发酵液条件优化
发酵液中色素成分复杂,一般通过对发酵液进行全波长扫描,以其中最大吸收峰的位置对应波长的吸光值变化作为脱色效果的参考依据;以液相检测来确认分离纯化各个步骤溶液中乙醇酸的浓度[7]。脱色率和乙醇酸损失率的计算如公式(1)和公式(2)所示:
式中:D,脱色率,%;A0,脱色前吸光值;Ae,脱色后吸光值;R,乙醇酸损失率,%;C0,脱色前乙醇酸浓度,g/L;Ce,脱色后乙醇酸浓度,g/L;V0,脱色前发酵液体积,mL;Ve,脱色后发酵液体积,mL。
在预处理后的发酵上清液中,加入6 g/100 mL的活性炭,在40 ℃、1 000 r/min条件下反应60 min,真空抽滤后测定滤液的吸光度和乙醇酸浓度,计算脱色率和乙醇酸损失率。在此基础上,依次探究活性炭添加量(1、2、3、4、5、7、9、11 g/100 mL)、脱色温度(20、30、40、50、60、70 ℃)、脱色时间(0.5、1、2、3、4 h)对脱色率、乙醇酸损失率的影响。
1.6.3 脱色液的脱盐和提纯
取50 mL乙醇酸发酵液加入4 mL氨水,室温搅拌2 h。加入1.97 g Ca(OH)2(30%,质量分数),40 ℃反应6 h,取沉淀加入14 mL硫酸(1.84 mol/L)进行酸化,55 ℃搅拌2 h,离心取50 mL酸化上清液加入浓氨水至上清液为中性,加入乙醇酸体积3倍的无水异丙醇,于室温下搅拌0.5 h后进行抽滤,将滤液进行常压脱醇,至料温40~75 ℃后进行高真空(2~8 kPa)回收醇,料温在40~75 ℃时停止回收。
1.6.4 乙醇酸的结晶和检测
将获得的料液以1 ℃/min开始降温析晶,当温度降到0~20 ℃时停止降温,在此温度下恒温保持1 h,随后进行恒温抽滤,所得滤饼用少许冰水淋洗,即为乙醇酸湿品,进而在低温高真空条件下获得高纯度的固体乙醇酸。
2 结果与分析
2.1 工程菌株的确定
本实验室前期成功在大肠杆菌体内构建了乙醇酸生产途径[5],本研究从已构建的Mgly71菌株出发,利用乙醇酸生物传感器pGBS-PffS-sfgfp[8],筛选1株生产乙醇酸性能较好的Mgly71菌株,作为本研究工程菌株。结果如图1所示。生物传感器pGBS-PffS-sfgfp拟合性验证结果显示荧光强度与乙醇酸浓度呈正比趋势,相关系数高达0.90,证明该方法能较为快速准确检测乙醇酸。验证成功后通过转化Mgly7菌株进行筛选,根据单细胞荧光值进行摇瓶复筛。最后,在复筛得到的25株菌株中存在3株乙醇酸产量大于1.3 g/L的Mgly71菌株,其中最高产量为1.33 g/L,故选择该菌株为出发菌株。
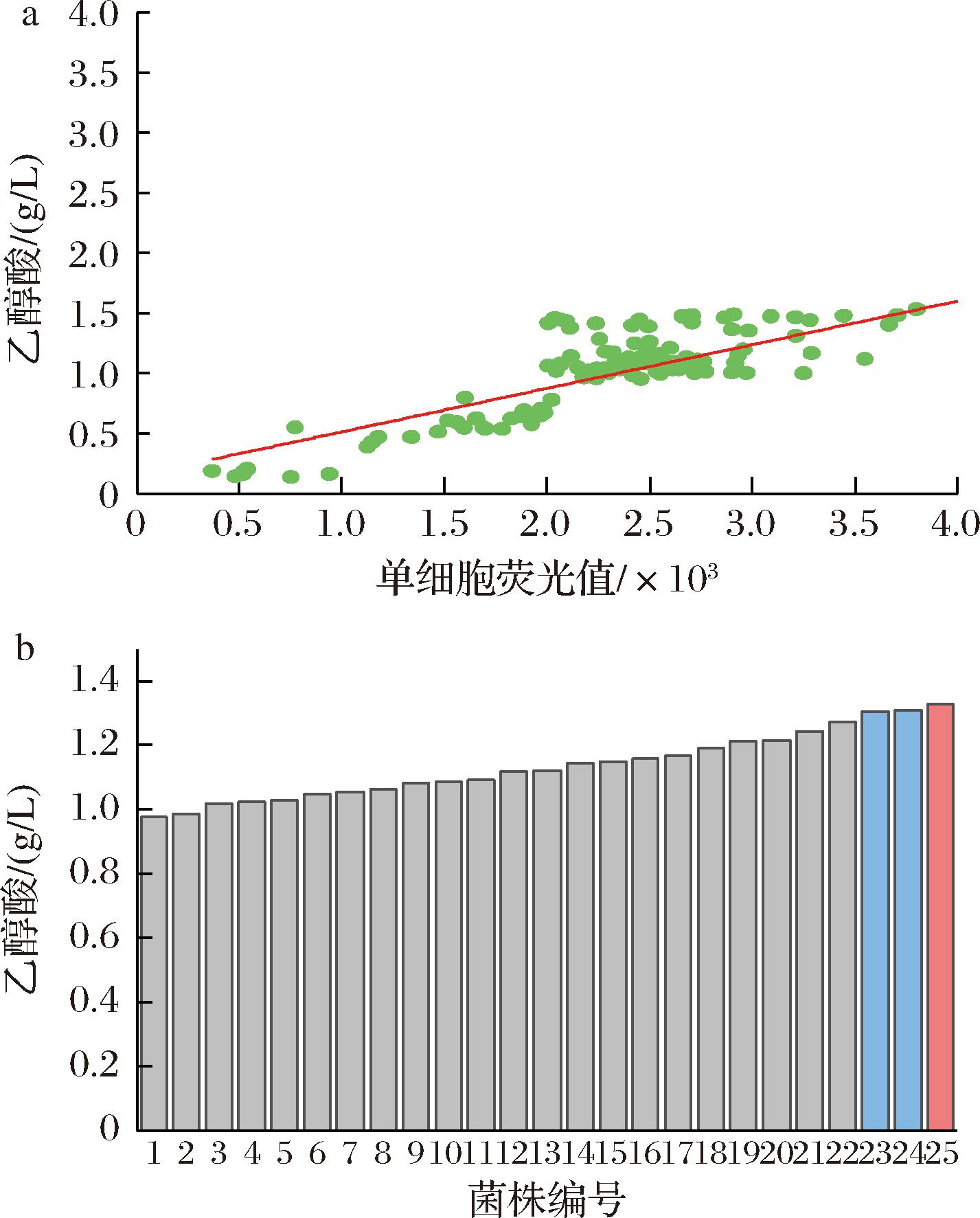
a-生物传感器pGBS-PffS-sfgfp筛选下荧光和 乙醇酸浓度之间的相关性验证;b-Mgly71工程菌株筛选
图1 生物传感器pGBS-PffS-sfgfp筛选下荧光和 乙醇酸浓度之间的相关性验证和Mgly71工程菌株筛选
Fig.1 Validation of the fit of the biosensor pGBS-PffS-sfgfp and screening of the engineered strain Mgly7
2.2 培养基优化
2.2.1 单因素试验
2.2.1.1 培养基碳源的优化
在微生物发酵过程中,碳源为微生物生长代谢提供了细胞的碳架以及细胞生命活动所需的能量。本实验以相同碳摩尔浓度的果糖、半乳糖、木糖、玉米芯水解液、麦芽糖、乳糖替换M9发酵培养基中的葡萄糖,摇瓶发酵24 h后测定菌体浓度与乙醇酸产量,不同碳源对菌体的生长和乙醇酸产量影响情况如图2-a所示,葡萄糖作为常见的速效碳源,最适合菌体生长,但在乙醇酸产量方面,果糖、半乳糖、玉米芯水解液、木糖作为碳源的效果均明显更好,产量分别可达2.14、1.94、1.8、1.75 g/L,这可能是因为葡萄糖的高效代谢速率超出乙醛酸还原酶的酶催化能力导致产生大量副产物乙酸,抑制了乙醇酸产物的形成。酶解玉米芯水解液中除主要碳源外还含有多种营养物质[9],有利于乙醇酸产量的提高。从成本考虑,半乳糖和果糖价格约为葡萄糖的25倍,木糖价格约为葡萄糖的10倍,而玉米芯水解液来源于农业废弃物玉米芯[10],价格低廉。因此选择玉米芯水解液作为最终碳源,碳源浓度对乙醇酸产量的影响如图2-b所示,随着碳源浓度的增加,菌体的乙醇酸产量呈现先增后降的趋势,当玉米芯水解液添加量为10 g/L时,乙醇酸产量最高,达到2.02 g/L。因此选择10 g/L的玉米芯水解液作为碳源。
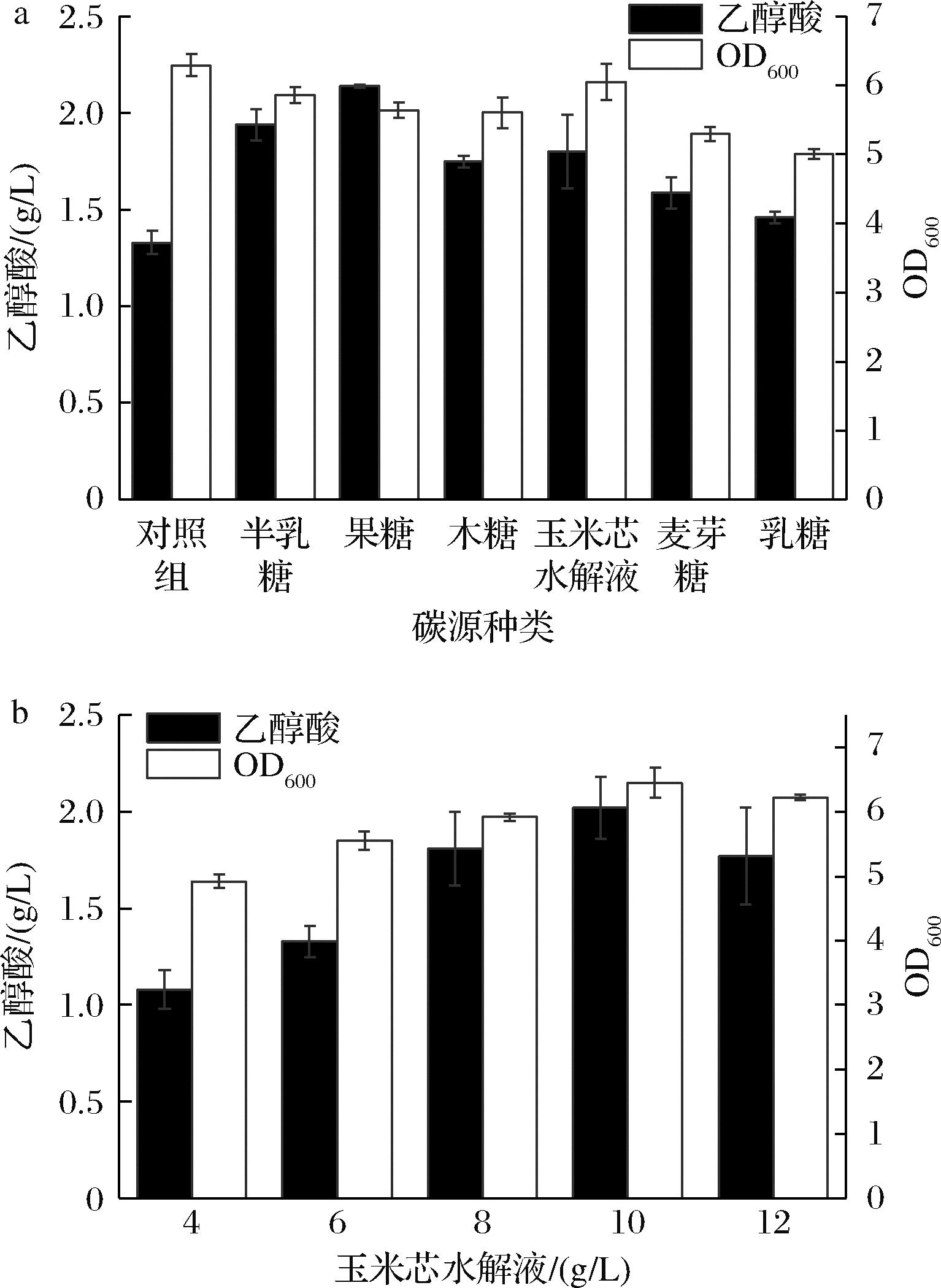
a-碳源种类;b-玉米芯水解液(CCH)添加量
图2 碳源对工程大肠杆菌发酵乙醇酸的影响
Fig.2 Effect of carbon source on fermentation of glycolic acid by engineering Escherichia coli
2.2.1.2 培养基氮源的优化
氮源是微生物生长的必需物质,对于生长偶联型菌株的影响巨大[11]。本实验室前期发现混合氮源更有利于菌体生长和乙醇酸产量的提高[12]。本研究在此基础上分别探究无机氮源种类和有机氮源比例对菌株的影响。以相同摩尔质量的磷酸二氢铵、磷酸氢二铵、硫酸铵、氨水替换M9发酵培养基中的氯化铵,摇瓶发酵24 h后测定菌体浓度与乙醇酸产量,结果如图3-a所示,不同无机氮源对菌体生长影响较小,因为无机氮源作为速效氮源,可以满足微生物前期生长需求,而有机氮源则满足菌体中后期生长需要[11]。以氨水作为无机氮源时,乙醇酸产量最高,达到2.1 g/L,虽然添加氨水导致培养基初始pH提高,在前期明显抑制了菌体的生长,但在后期菌体浓度差距不大,因此选择0.66 g/L氨水作为无机氮源。
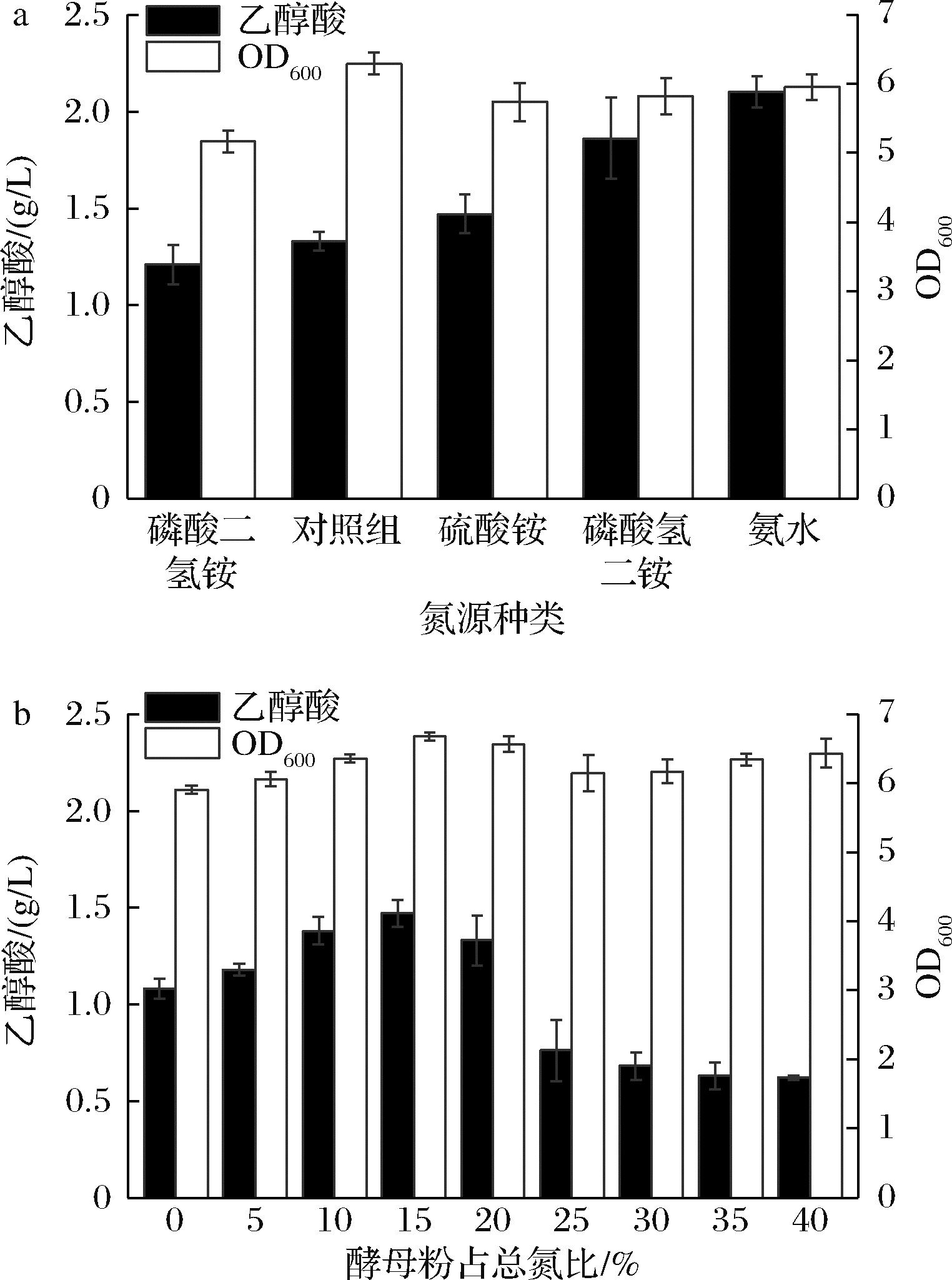
a-氮源种类;b-酵母粉浓度
图3 氮源对工程大肠杆菌发酵乙醇酸的影响
Fig.3 Effect of nitrogen source on fermentation of glycolic acid by engineering E. coli
以酵母粉和蛋白胨组成的混合有机氮源不仅能够提供氮源,还含有丰富的矿物质、维生素以及氨基酸等菌体生长所需营养物质。固定有机氮源的浓度为10 g/L,以不同酵母粉占总氮比例的混合氮源开展研究。结果如图3-b所示,酵母粉占总氮比例为15%时,乙醇酸产量最高,可达1.47 g/L。因此选择0.66 g/L氨水、8.5 g/L蛋白胨和1.5 g/L酵母粉作为最佳混合氮源。
2.2.1.3 培养基金属离子的优化
在M9发酵培养基中分别添加0.43 mg/L CuCl2·2H2O、0.1 mg/L MnCl2·4H2O、0.14 g/L FeCl2·4H2O、1.64 mg/L ZnCl2来探究金属离子对菌体的影响,摇瓶发酵24 h后测定菌体浓度与乙醇酸产量。结果如图4-a所示,从菌体的整体生长情况而言,除了CuCl2·2H2O以外其他金属离子的加入都明显的有利于菌体的生长,有研究表明,细胞内游离的铜离子可通过破坏蛋白质、脂质等物质导致细胞死亡[13]。在乙醇酸产量上,MnCl2·4H2O的添加对乙醇酸的产量稍有提高,达到1.4 g/L。因M9发酵培养基中本身含有MgSO4·7H2O、CaCl2,且研究表明[14-18],金属离子如Mg2+、Mn2+、Zn2+是常见酶的辅因子,Mg2+是细胞壁形成的重要金属离子;Ca2+是菌体生长和产酶所必需的物质;Mn2+在一定浓度下可以促进大肠杆菌的生长,故对ZnCl2、MgSO4·7H2O、CaCl2、MnCl2·4H2O 4种金属离子进行浓度优化,结果如图4-b~图4-e所示,ZnCl2、MgSO4·7H2O、CaCl2、MnCl2·4H2O 4种金属离子分别在0.16、12.3、5.5、0.05 mg/L下对乙醇酸的产量提高最明显,分别达到1.4、1.39、1.47、1.43 g/L,且金属离子浓度大于上述浓度时,乙醇酸产量有明显下降,所以确定上述浓度为各金属离子最佳浓度。
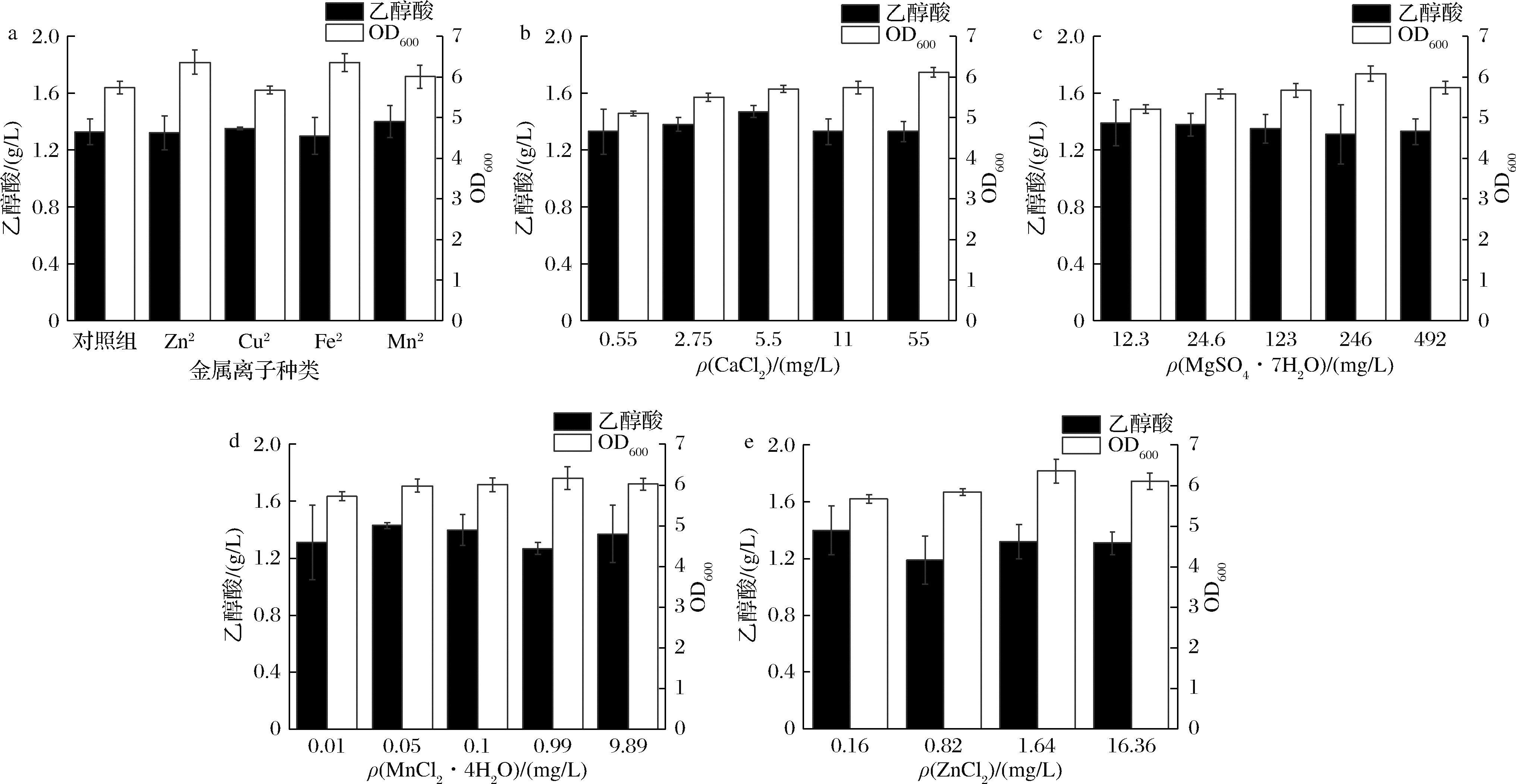
a-金属离子种类;b-CaCl2质量浓度;c-MgSO4·7H2O质量浓度;d-MnCl2·4H2O质量浓度;e-ZnCl2质量浓度
图4 金属离子对工程大肠杆菌发酵乙醇酸的影响
Fig.4 Effect of metal ions on fermentation of glycolic acid by engineering E. coli
2.2.2 Plackett-Burman实验
PB实验的实验设计和结果如表1所示,方差分析结果如表2所示,模型达到显著水平(P<0.05),筛选出实验条件下对乙醇酸产量影响显著的因素依次为X1(Na2HPO4),X2(玉米芯水解液)。
表1 PB实验结果
Table 1 PB experimental results
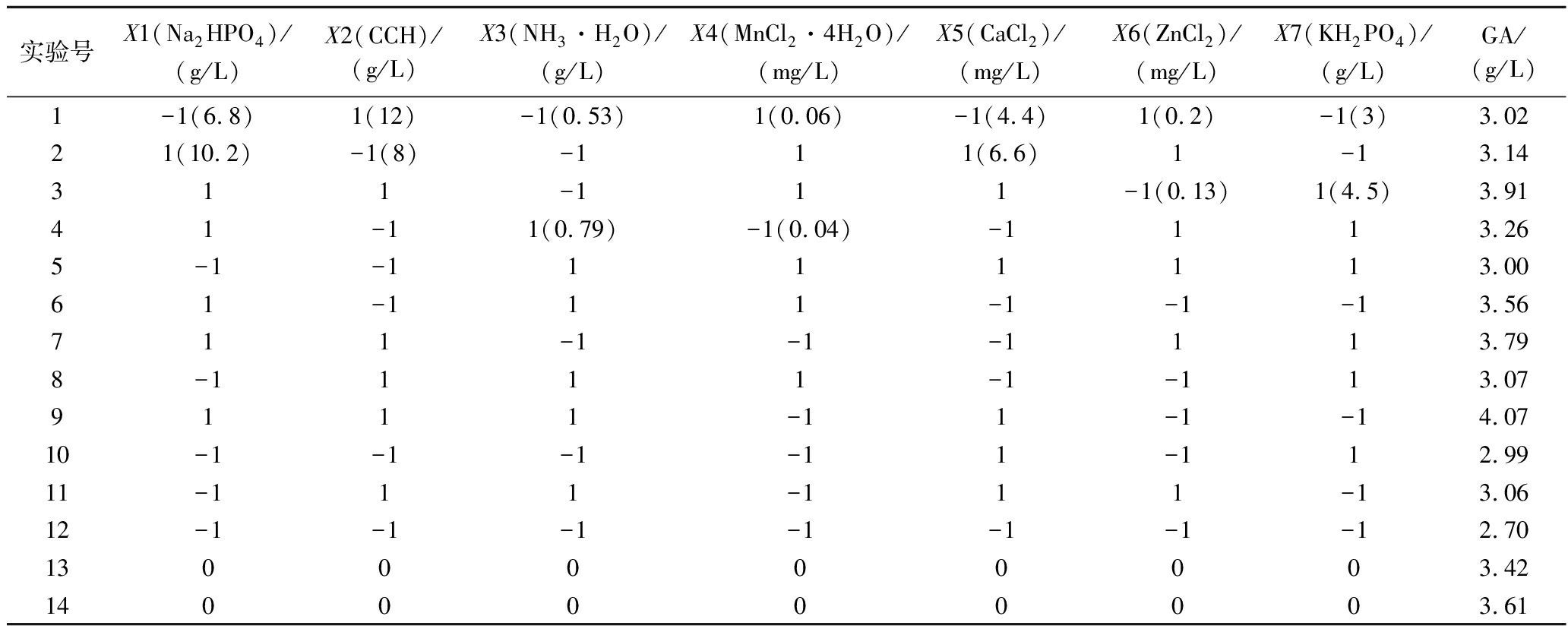
实验号X1(Na2HPO4)/(g/L)X2(CCH)/(g/L)X3(NH3·H2O)/(g/L)X4(MnCl2·4H2O)/(mg/L)X5(CaCl2)/(mg/L)X6(ZnCl2)/(mg/L)X7(KH2PO4)/(g/L)GA/(g/L)1-1(6.8)1(12)-1(0.53)1(0.06)-1(4.4)1(0.2)-1(3)3.02 21(10.2)-1(8)-111(6.6)1-13.14 311-111-1(0.13)1(4.5)3.91 41-11(0.79)-1(0.04)-1113.26 5-1-1111113.00 61-111-1-1-13.56 711-1-1-1113.79 8-1111-1-113.07 9111-11-1-14.07 10-1-1-1-11-112.99 11-111-111-13.06 12-1-1-1-1-1-1-12.70 1300000003.42 1400000003.61
表2 PB实验方差分析
Table 2 PB analysis of variance
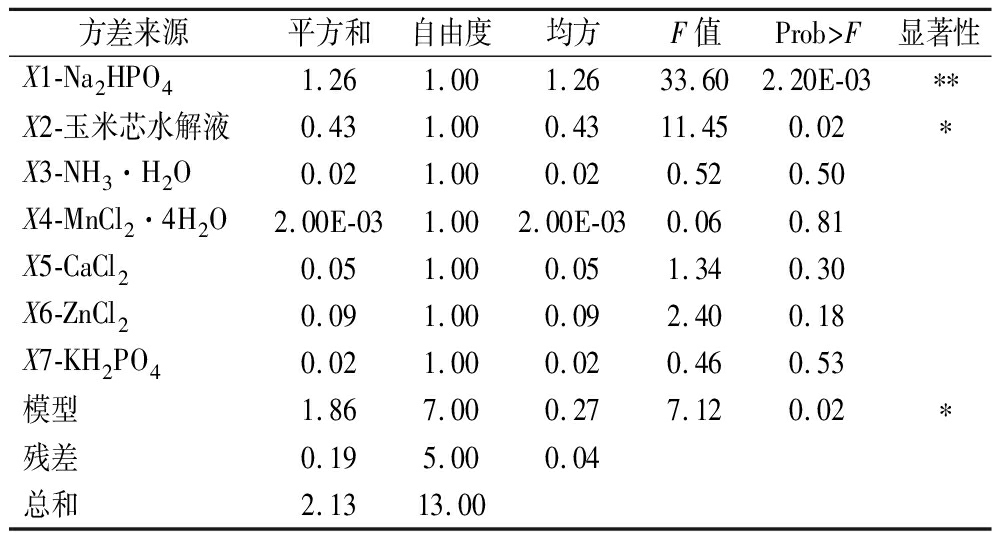
方差来源平方和自由度均方F值Prob>F显著性X1-Na2HPO41.26 1.00 1.26 33.60 2.20E-03∗∗X2-玉米芯水解液0.43 1.00 0.43 11.45 0.02 ∗X3-NH3·H2O0.02 1.00 0.02 0.52 0.50 X4-MnCl2·4H2O2.00E-03 1.00 2.00E-03 0.06 0.81 X5-CaCl20.05 1.00 0.05 1.34 0.30 X6-ZnCl20.09 1.00 0.09 2.40 0.18 X7-KH2PO40.02 1.00 0.02 0.46 0.53 模型1.86 7.00 0.27 7.12 0.02 ∗残差0.19 5.00 0.04 总和2.13 13.00
注:*代表显著水平P<0.05,**代表极显著水平,P<0.01。
2.2.3 Central Composite Design实验
CCD实验的设计和结果、方差分析如表3和表4所示,P模型<0.01,P失拟项>0.05,说明该模型有较高拟合度。对表3数据进行回归分析可得二次多项式方程:GA=3.73+0.23A+0.87B-0.01C-(3.00E-03)AB+0.02AC+0.04BC-0.03A2-0.03B2+0.04C2。该方程的相关系数R2=0.958 1,说明此模型选择正确。
表3 CCD实验结果
Table 3 CCD experimental results
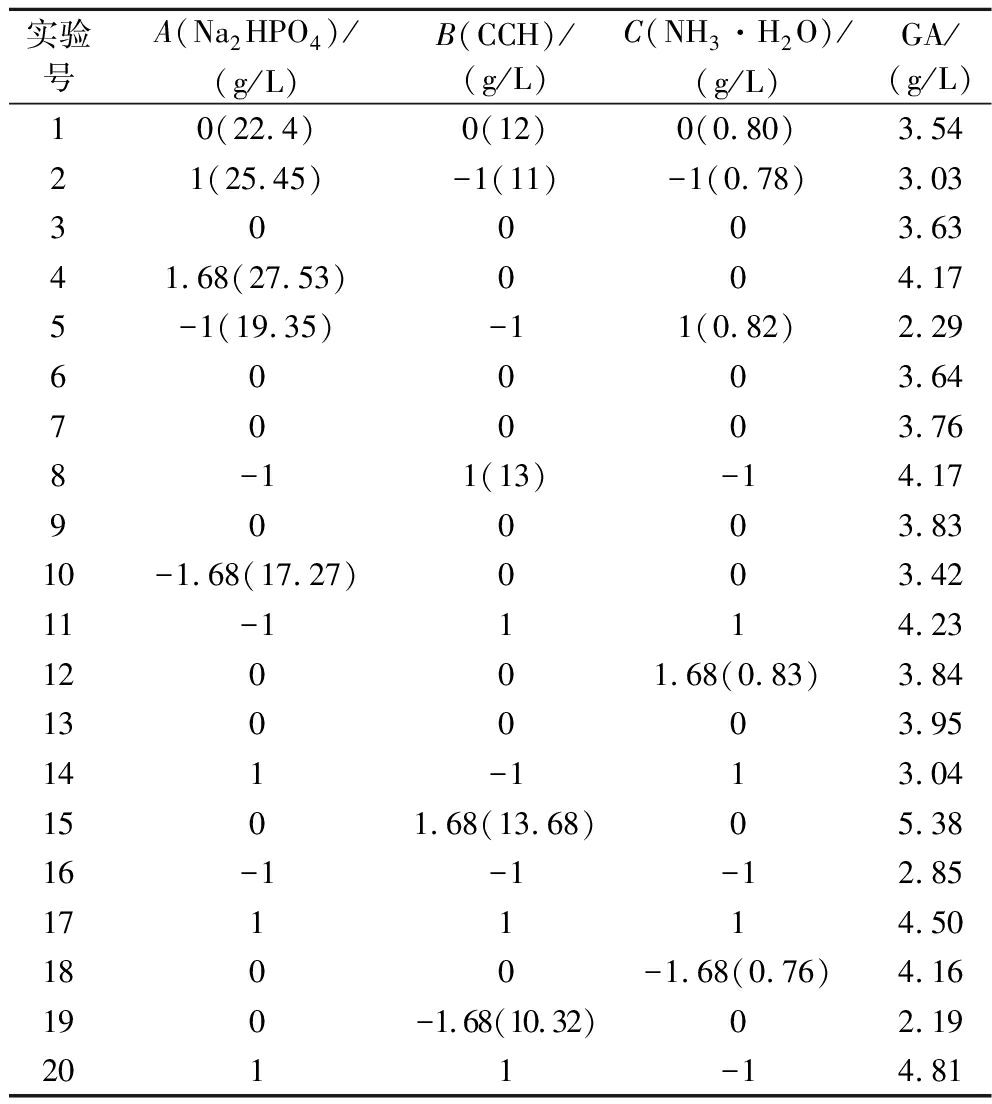
实验号A(Na2HPO4)/(g/L)B(CCH)/(g/L)C(NH3·H2O)/(g/L)GA/(g/L)10(22.4)0(12)0(0.80)3.5421(25.45)-1(11)-1(0.78)3.0330003.6341.68(27.53)004.175-1(19.35)-11(0.82)2.2960003.6470003.768-11(13)-14.1790003.8310-1.68(17.27)003.4211-1114.2312001.68(0.83)3.84130003.95141-113.041501.68(13.68)05.3816-1-1-12.85171114.501800-1.68(0.76)4.16190-1.68(10.32)02.192011-14.81
根据回归方程,交互影响的等高线图和三维响应面图分析结果,得到3种成分最佳配比为:玉米芯水解液13 g/L,NH3·H2O 0.78 g/L,Na2HPO4 25.45 g/L,乙醇酸产量预测值为4.85 g/L。结合预测实验条件进行3次平行试验,结果如图5-a所示,乙醇酸产量可达(4.77±0.12) g/L,接近预测值,说明模型与实际情况拟合较好。
表4 CCD实验方差分析
Table 4 CCD experimental variance analysis
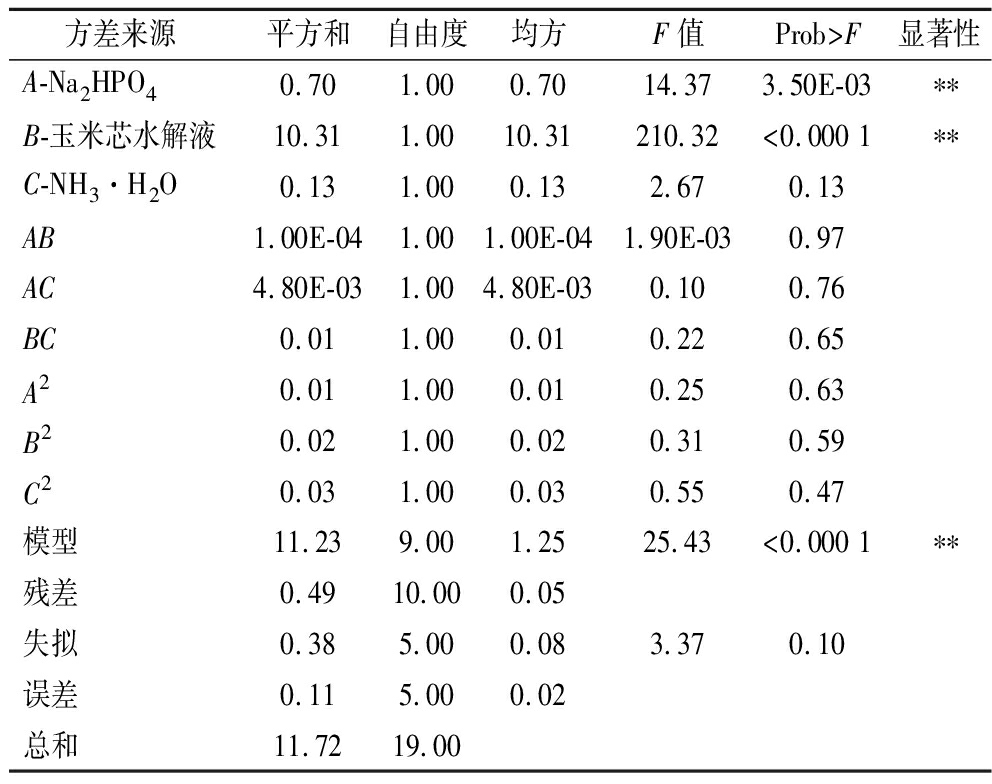
方差来源平方和自由度均方F值Prob>F显著性A-Na2HPO40.70 1.00 0.70 14.37 3.50E-03 ∗∗B-玉米芯水解液10.31 1.00 10.31 210.32 <0.000 1∗∗C-NH3·H2O0.13 1.00 0.13 2.67 0.13 AB1.00E-04 1.00 1.00E-04 1.90E-03 0.97 AC4.80E-031.00 4.80E-03 0.10 0.76 BC0.01 1.00 0.01 0.22 0.65 A20.01 1.00 0.01 0.25 0.63 B20.02 1.00 0.02 0.31 0.59 C20.03 1.00 0.03 0.55 0.47 模型11.23 9.00 1.25 25.43 <0.000 1∗∗残差0.49 10.00 0.05 失拟0.38 5.00 0.08 3.37 0.10 误差0.11 5.00 0.02 总和11.72 19.00
2.3 5 L发酵罐发酵验证
筛选的Mgly71工程菌株在M9发酵培养基和优化培养基中的发酵结果如图5-b和图5-c所示,乙醇酸产量和菌体浓度基本呈生长偶联趋势。培养基优化前后乙醇酸的最高产量分别为30、42 g/L,乙醇酸产量提高了40%;菌体浓度(OD600)最高分别为15.8、22,得到了大幅提升。其主要原因可能在于根据蛋白胨中总氮含量更高但氨态氮含量稍低的特点,找到了合适的氮源比例能,让两者在乙醇酸生产过程中发挥更好的作用,显著提高了菌体浓度。同时,优化后培养基中额外添加的的玉米芯水解液、金属离子在菌体细胞生长、酶合成等方面提供了必要元素[15-18],最终乙醇酸产量得到明显的提高。
2.4 乙醇酸的分离纯化
2.4.1 活性炭纯化乙醇酸
发酵结束后,采用高温灭菌和离心对发酵液进行预处理,玉米芯水解液,酵母粉和蛋白胨本身的颜色在经过高温灭菌后有所加深,故需要进行脱色处理便于后续乙醇酸的分离纯化。活性炭具有很好的物理和化学吸附作用,常作为发酵液脱色剂,可以对乙醇酸发酵液进行脱色、脱蛋白。据文献报道[19],粉末状活性炭脱色效果明显优于颗粒状活性炭,故本研究采用粉末状活性炭对预处理后的发酵液进行研究,同时探究不同活性炭添加量、脱色温度、脱色时间对脱色率和乙醇酸损失率的影响,结果如图6所示。
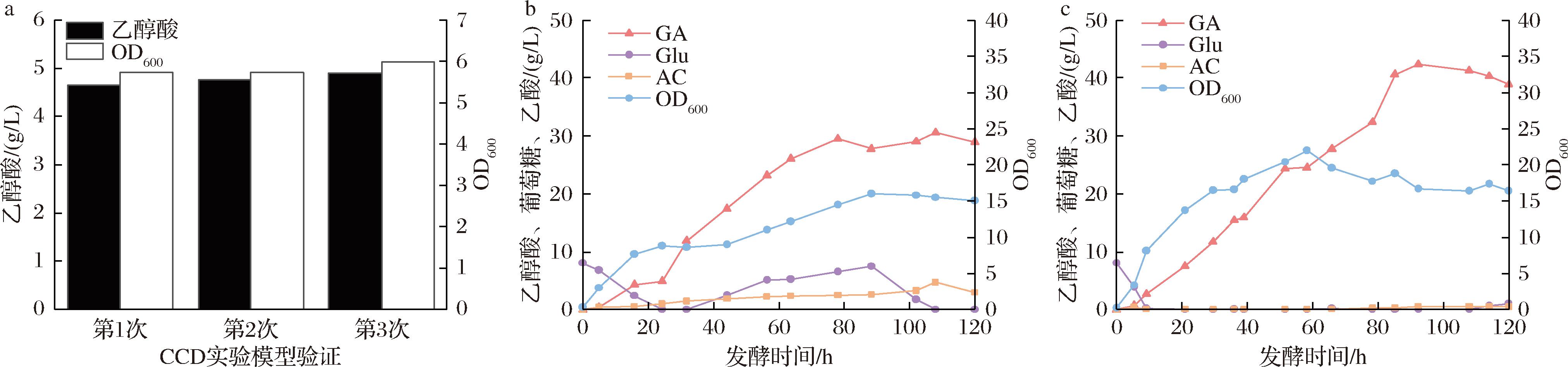
a-CCD实验模型验证结果;b-优化前培养基;c-优化后培养基
图5 CCD预测模型验证和5 L发酵罐放大验证
Fig.5 CCD prediction model verification and fermentation in a 5L fermenter
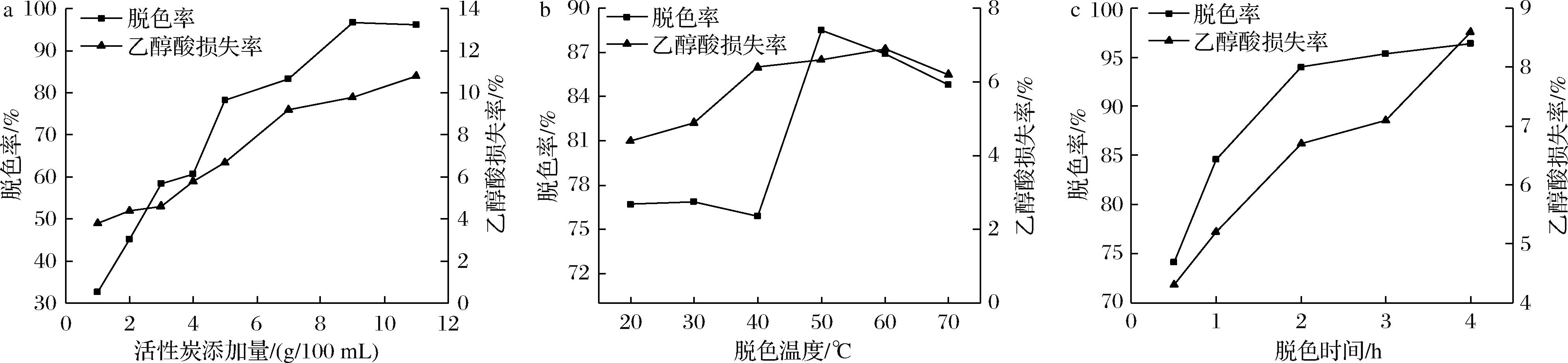
a-活性炭添加量;b-脱色温度;c-脱色时间
图6 不同脱色条件对脱色率、乙醇酸损失率的影响
Fig.6 Effect of different conditions on decolorization rate and glycolic acid loss ratio
如图6-a所示,随着活性炭添加量的增加,脱色率和乙醇酸损失率均呈上升趋势。当活性炭添加量为9 g/100 mL时,脱色率达最高96.7%;活性炭添加量至11 g/100 mL时,脱色率不再增加(96.2%),反而乙醇酸损失率提高至10.8%;当活性炭添加量为5 g/100 mL时,乙醇酸损失率(6.7%)较低,而脱色率可达到78.3%。这是因为单位体积与色素分子碰撞的活性炭增多使色素被吸附的可能性增大,即“范德瓦尔斯力”效应[20]。考虑到活性炭对乙醇酸有一定吸附作用与工业应用成本,确认最佳活性炭添加量为5 g/100 mL。
如图6-b所示,随着温度的升高,脱色率基本呈先升后降的趋势,当脱色温度为50 ℃时,脱色率最高达88.5%,当温度继续升高,脱色率反而呈下降趋势,这主要因为在低温范围内,随着温度升高,发酵液的流动性增大,色素分子的热运动加快,与活性炭接触碰撞的几率增大,且此时活性炭吸附作用大于解析作用,有利于吸附脱色;当温度继续增大时,分子热运动继续加快,被活性炭吸附上的色素又被解析下来,解析作用占优势地位,造成脱色率下降[21]。此外在整个实验温度范围内,乙醇酸损失率变化极小,稳定在7%以下,综合考虑,确认50 ℃为最佳脱色温度。
如图6-c所示,随着脱色时间的增长,脱色率逐渐升高。当脱色时间为2 h时,脱色率为94%,且2 h之后脱色率趋于平稳。这是由于随着脱色时间的增长,当体系中固定量的活性炭吸附逐渐达到饱和状态后,吸附和解析过程处于动态平衡状态,脱色率也趋于稳定[22]。同时在脱色时间大于2 h之后,乙醇酸损失率逐渐从6.7%提高至8.6%。故综合考虑,确认2 h为最佳脱色时间。
2.4.2 沉淀法纯化乙醇酸
在活性炭添加量为5 g/100 mL,脱色温度为50 ℃,脱色时间为2 h的条件下对预处理过的发酵上清液进行初步纯化分离,得到脱色液。采用沉淀酸化法和减压蒸发对脱色液纯化、浓缩得到酸化溶液、脱盐溶液、浓缩料液,经过不同处理后的乙醇酸含量和得率见表5。
由表5可知,经过活性炭预处理纯化后,乙醇酸得率为95.32%;经过硫酸酸化后的酸化溶液中乙醇酸得率为89.5%;最终真空浓缩得到乙醇酸浓缩液的得率为72.15%。将得到的浓缩乙醇酸料液进行结晶,经HPLC测定结果如图7所示,所得乙醇酸样品纯度为99.3%。本研究初步探索发酵液中提取乙醇酸的条件,在后续研究中仍需要进一步优化。
表5 不同处理后乙醇酸含量和得率
Table 5 Contents and yield of glycolate after different treatments
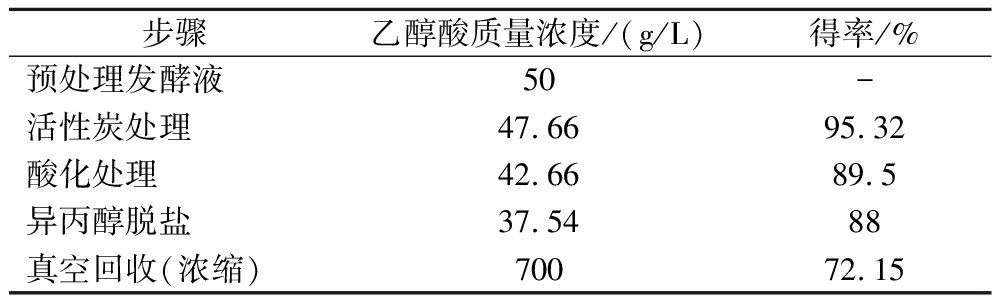
步骤乙醇酸质量浓度/(g/L)得率/%预处理发酵液50-活性炭处理47.66 95.32酸化处理42.66 89.5异丙醇脱盐37.54 88真空回收(浓缩)70072.15

a-乙醇酸标样;b-乙醇酸晶体
图7 乙醇酸标样和Mgly71菌株发酵液纯化 乙醇酸晶体的HPLC谱图
Fig.7 HPLC spectrum of glycolate and glycolate purified from fermentation liquid of recombinant E.coli Mgly71
3 结论
随着发酵工业的不断发展,降低发酵成本、提高生产效率成为了现代发酵领域的研究热点。本研究采用统计学方法,首先对碳源、氮源、金属离子等单因素进行优化,再通过Plackett-Burman实验、响应面实验获得了最佳培养基组成。实验表明采用最佳培养基:6.66 mg/L CaCl2,12 mg/L MgSO4·7H2O,0.13 mg/L ZnCl2,0.04 mg/L MnCl2·4H2O,4.5 g/L KH2PO4,13 g/L 玉米芯水解液,0.78 g/L NH3·H2O,1.5 g/L 酵母粉,8.5 g/L 胰蛋白胨,0.5 g/L NaCl,25.45 g/L Na2HPO4,摇瓶乙醇酸的产量提高至优化前的3.58倍,5 L罐产量达到42 g/L。此外本研究以活性炭为脱色剂对乙醇酸发酵液进行脱色,最适处理条件为活性炭添加量5 g/100 mL,脱色温度50 ℃,脱色时间2 h,此时的脱色率为97.6%。经沉淀法和减压回收进一步纯化后,最终乙醇酸晶体纯度达到99.3%,本研究为后续生物基乙醇酸的工业化生产提供了思路和实验基础。
[1] KOIVISTOINEN O M, KUIVANEN J, BARTH D, et al.Glycolic acid production in the engineered yeasts Saccharomyces cerevisiae and Kluyveromyces lactis[J].Microbial Cell Factories, 2013, 12:82.
[2] GAEDDA T M, PIRTTIMAA M, KOIVISTOINEN O M, et al.The industrial potential of bio-based glycolic acid and polyglycolic acid[J].Appita:Technology, Innovation, Manufacturing, Environment, 2014, 67(1):12.
[3] LYU J M, WANG X W, MARIN-MULLER C, et al.Current advances in research and clinical applications of PLGA-based nanotechnology[J].Expert Review of Molecular Diagnostics, 2009, 9(4):325-341.
[4] PANOVA A, MERSINGER L, LIU Q A, et al.Chemoenzymatic synthesis of glycolic acid[J].Advanced Synthesis &Catalysis, 2007, 349(8-9):1462-1474.
[5] DENG Y, MA N, ZHU K J, et al.Balancing the carbon flux distributions between the TCA cycle and glyoxylate shunt to produce glycolate at high yield and titer in Escherichia coli[J].Metabolic Engineering, 2018, 46:28-34.
[6] YU Y, SHAO M Y, LI D, et al.Construction of a carbon-conserving pathway for glycolate production by synergetic utilization of acetate and glucose in Escherichia coli[J].Metabolic Engineering, 2020, 61:152-159.
[7] WEI J C, YUAN Q P, WANG T X, et al.Purification and crystallization of xylitol from fermentation broth of corncob hydrolysates[J].Frontiers of Chemical Engineering in China, 2010, 4(1):57-64.
[8] XU S M, ZHANG L P, ZHOU S H, et al.Biosensor-based multigene pathway optimization for enhancing the production of glycolate[J].Applied and Environmental Microbiology, 2021, 87(12):e0011321.
[9] LONG Y P, MA Y W, WAN J Q, et al.Hydrolysate from the enzymatic treatment of corn cob as a carbon source for heterotrophic denitrification process[J].Journal of Water Process Engineering, 2023, 51:103473. [10] XU Q Q, ZHAO M J, YU Z Z, et al.Enhancing enzymatic hydrolysis of corn cob, corn stover and sorghum stalk by dilute aqueous ammonia combined with ultrasonic pretreatment[J].Industrial Crops and Products, 2017, 109:220-226.
[11] AVIGNONE ROSSA C A, YANTORNO O M, ARCAS J A, et al.Organic and inorganic nitrogen source ratio effects on Bacillus thuringiensis var.israelensis delta-endotoxin production[J].World Journal of Microbiology and Biotechnology, 1990, 6(1):27-31.
[12] ZHU K J, LI G H, WEI R, et al.Systematic analysis of the effects of different nitrogen source and ICDH knockout on glycolate synthesis in Escherichia coli[J].Journal of Biological Engineering, 2019, 13(1):30.
[13] BORKOW G, GABBAY J.Copper, an ancient remedy returning to fight microbial, fungal and viral infections[J].Current Chemical Biology, 2009, 3(3):272-278.
[14] 肖冬光, 韩宁宁, 张翠英, 等.木糖发酵产2, 3-丁二醇培养基的优化[J].酿酒科技, 2010(4):26-30. XIAO D G, HAN N N, ZHANG C Y, et al.Optimization of xylose-based fermentation medium for the production of 2,3-butanediol by response surface method[J].Liquor-Making Science &Technology, 2010(4):26-30.
[15] SUZUKI Y, KOYAMA N.Uptake and degradation of EDTA by Escherichia coli[J].Biodegradation, 2009, 20(1):39-44.
[16] DENG X, ZHENG Y C, LI Q B.Effect of ambient conditions on simultaneous growth and bioaccumulation of mercuric ion by genetically engineered E.coli JM109[J].Journal of Hazardous Materials, 2006, 136(2):233-238.
[17] WANG X, YUAN W L, TAO J H, et al.Interactions between Escherichia coli survival and manganese and iron oxides in water under freeze-thaw[J].Environmental Pollution, 2021, 268:115237.
[18] POPOV S, SAPHIER O, POPOV M, et al.Factors enhancing the antibacterial effect of monovalent copper ions[J].Current Microbiology, 2020, 77(3):361-368.
[19] WANG F Q, LIANG J Z, WANG W, et al.A new and efficient method for purification of poly-γ- glutamic acid from high-viscosity fermentation broth[J].Tropical Journal of Pharmaceutical Research, 2017, 16(6):1267.
[20] ZEEGERS-HUYSKENS T, HUYSKENS P.Intermolecular Forces[M].Berlin Heidelberg:Springer, 1991.
[21] CHIANG Y C, CHIANG P C, HUANG C P.Effects of pore structure and temperature on VOC adsorption on activated carbon[J].Carbon, 2001, 39(4):523-534.
[22] 张丽红, 谢三都, 徐芳, 等.紫苏叶多糖活性炭脱色工艺优化[J].食品与机械, 2015, 31(3):224-230;241. ZHANG L H, XIE S D, XU F, et al.Optimization on decolorizing conditions for perilla leaf polysaccharide(Ⅱ) by active charcoal[J].Food &Machinery, 2015, 31(3):224-230;241.