生姜(Zingiber officinale Rosc.)又名百辣云,为姜科姜属多年生宿根草本植物根茎,在我国广泛分布于中部、东南部及西南部地区,具有独特的风味和药用价值,是典型的药食两用植物[1-2]。生姜中不仅富含蛋白质、维生素和纤维素等人体必需营养物质,而且含有姜酚、姜酮和挥发油等多种生物活性成分[3]。生姜精油是从生姜根茎中萃取得到的一类具有浓郁芳香的挥发性成分,也是天然香料的重要组成部分,因其具有去腥增香[4]、抑菌消炎[5-6]、抗氧化损伤[7]等功效,在食品、医药、化妆品等领域均有广泛的应用前景[8]。生姜精油常用的提取方法有水蒸气蒸馏法、溶剂浸提法、超临界流体萃取等[9-10]。然而水蒸气蒸馏法、溶剂浸提法等传统方法存在操作温度高、提取效率低、易发生热敏成分副反应以及溶剂残留等问题,限制了其广泛应用[11]。超临界流体萃取是一种新型的萃取技术,具有萃取效率高、无溶剂残留、操作条件温和等优点,克服了传统萃取工艺的弊端,有效保持了天然活性物质的特性,被称为“绿色萃取技术”[12]。目前,超临界CO2流体萃取技术已在植物活性物质萃取方面得到了广泛应用[13]。但超临界CO2流体萃取生姜油成分复杂,不仅含有挥发性的精油,还含有非挥发性的姜辣素等物质,需要对其进一步分离纯化[14]。因此,联合现代仪器分析技术,开发节能高效、绿色环保的萃取分离技术对生姜精油产品的开发和应用具有重要意义。
分子蒸馏是近年来新兴的一种分离纯化技术,主要利用不同物质分子平均自由程及挥发性的差别而实现高效分离[15]。该技术在高真空远低于沸点的温度下进行的,物料受热时间短且分离效果好,特别适用于浓缩、纯化或分离分子质量高、沸点高、黏度高的物质及热稳定性差的有机混合物[16],已成为分离目标产物最温和的蒸馏方法。由于生姜油中主要的挥发性成分是萜烯类物质,大多为热敏性化合物,易受光、热等因素而发生氧化或降解[17],采用超临界CO2流体萃取技术联合分子蒸馏技术能较好的保持生姜精油挥发性成分稳定,提升精油产品品质。然而,目前采用超临界CO2流体萃取制备生姜油,并结合分子蒸馏分离纯化生姜精油挥发性成分的研究鲜有报道。
本研究以舒城黄姜为研究对象,通过优化生姜精油超临界CO2流体萃取联合分子蒸馏工艺条件制备高品质生姜精油,并利用气相色谱-质谱联用技术对萃取生姜精油的挥发性成分进行分析,以期为舒城黄姜精深加工产品的开发利用提供技术参考。
1 材料与方法
1.1 材料与试剂
实验所用生姜原料为舒城黄姜,安徽谷瑞农业科技开发有限公司种植基地;生姜原料采收于2021年9月,在15 ℃恒温库中贮藏至2022年5月,然后用于生姜精油提取工艺研究。CO2(纯度≥99.99%,食品级),合肥申和气体有限责任公司;甲醇、乙醇(均为色谱纯),德国Merck公司。
1.2 仪器与设备
ME204电子显示天平,梅特勒-托利多(上海)仪器有限公司;Milli-Q去离子水发生器,美国Millipore公司;20 mL顶空进样瓶,上海安谱实验科技股份有限公司;SC-C03-CXGA空气源热泵烘干机组,郑州欧纳尔冷暖科技有限公司;SFJ粉碎机,上海申银机械厂;HA220-50-06型超临界CO2流体萃取设备,南通市华安超临界萃取有限公司;FZL-001刮膜式分子蒸馏设备,天津达纯科技有限公司;三重四级杆气质联用仪(配备7890B气相色谱仪、7000B质谱检测器),美国Agilent公司。
1.3 实验方法
1.3.1 生姜预处理
生姜经过挑选、清洗、摊晾、切片后,采用烘房60 ℃干燥至生姜水分含量≤5%,粉碎过40目筛后密封包装,然后置于阴凉干燥处保存备用。
1.3.2 水蒸气蒸馏提取生姜精油
准确称取50 g生姜粉置于蒸馏烧瓶中,加入适量蒸馏水,连接提取装置,蒸馏完成后,静置分层,分离出上层精油,并加入适量无水Na2SO4干燥,经过滤后,称重并计算精油得率为0.96%。
1.3.3 超临界CO2萃取生姜油的单因素试验
准确称取3.0 kg生姜粉装入10 L的超临界CO2萃取釜Ⅰ中,分别调节CO2流量、萃取温度和压力等参数进行萃取试验。在萃取压力24 MPa、萃取温度40 ℃条件下萃取2 h,固定其他因素,分别考察萃取压力(16、20、24、28、32 MPa)、萃取温度(30、35、40、45、50 ℃)和萃取时间(0.5、1、1.5、2、2.5 h)对生姜油萃取得率的影响。生姜油萃取率的计算如公式(1)所示:
姜油萃取率![]()
1.3.4 正交试验设计
在单因素试验的基础上,选取萃取压力、萃取温度和萃取时间为考察因素,设计三因素三水平正交试验[L9(34)正交表],进一步考察各因素对生姜油萃取率的影响,正交试验因素水平设计见表1。
表1 正交试验因素与水平
Table 1 Code and level of independent variables used for orthogonal array design
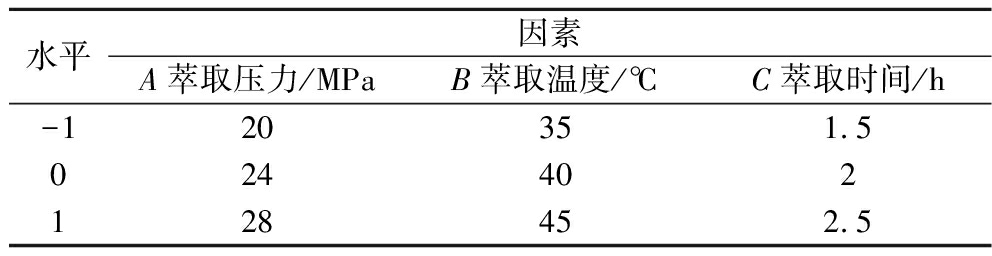
水平因素A萃取压力/MPaB萃取温度/℃C萃取时间/h-120351.5024402128452.5
1.3.5 分子蒸馏技术纯化生姜精油
将一定量的超临界CO2流体萃取生姜油装入分子蒸馏物料桶中,打开加热器、真空泵、冷水机,固定分子蒸馏冷凝温度5 ℃,刮膜转速200 r/min,设定蒸馏温度(50、60、70、80、90、100 ℃),调节进料阀保持进料流量2 mL/min,系统真空度65 Pa,进行分子蒸馏分离纯化,并对所得馏出物轻组分(生姜精油)和重组分进行收集,分别称取质量并计算各组分得率,考察不同蒸馏温度对生姜精油分离纯化效果及品质的影响。
1.3.6 气相色谱-质谱分析条件
将经过萃取分离得到的生姜精油用甲醇按照体积比稀释50倍,过0.22 μm有机相尼龙微孔滤膜,供气相色谱-质谱分析。色谱(GC)条件:DB-5MS石英毛细柱(60 m×250 μm×0.25 μm);色谱柱升温程序:起始温度50 ℃,保持1.5 min后以8 ℃/min升至125 ℃,然后以3 ℃/min升至145 ℃,再以0.5 ℃/min升至150 ℃,保持10 min,最后以15 ℃/min升至260 ℃,保持8 min至完成分析;载气为高纯氦气(99.999%),流速为1 mL/min;进样口温度250 ℃,进样量1 μL,分流比30∶1。质谱(MS)条件:电子轰击(electron impact, EI)离子源,电子能量70 eV;传输线温度280 ℃,四级杆温度150 ℃,离子源温度230 ℃;扫描方式为离子监测模式,扫描质量范围35~450 amu。
1.3.7 定性定量方法
移取C7~C30正构烷烃标准品,用正己烷溶剂将其配制为质量分数为5%的标准溶液,按照1.3.6节分析条件进样,测定各正构烷烃的保留时间。各成分的RI值根据Kovats公式进行计算,如公式(2)所示:
式中:RI,被分析组分的保留指数;tx,被分析组分流出峰的保留时间,min;tn和tn+1,n和n+1碳原子数的正构烷烃流出峰的保留时间。
生姜精油样品经过GC-MS/MS分析后,利用仪器配置的质谱数据系统NIST11质谱库对生姜精油中的化学成分进行自动检索,然后计算各分析组分的保留指数,将计算的保留指数与ESO精油数据库中的保留指数进行比对,对其成分进行定性分析,采用色谱峰面积归一化法计算各成分的相对百分含量。
1.4 数据处理
所有实验均设置3组平行,结果以平均值±标准差表示。使用SPSS Statistics 22.0软件进行数据统计分析,采用最小显著性差异(least significance difference, LSD)法分析差异显著性(P<0.05),利用Origin 2017软件和GraphPad Prism 6软件进行绘图。
2 结果与分析
2.1 单因素试验结果
2.1.1 萃取压力对萃取率的影响
萃取压力是超临界CO2流体萃取工艺中重要的参数之一,萃取压力的变化不仅影响萃取效率,而且对萃取选择性也有重要影响[18]。在萃取温度为40 ℃,萃取时间为2 h,CO2流量35 L/h条件下,考察了不同萃取压力(16、20、24、28、32 MPa)对生姜油萃取率的影响。由图1可知,萃取压力对生姜油萃取率的影响显著,随着萃取压力的增大,姜油萃取率逐渐升高,这是因为在萃取温度等条件一定时,压力增大,流体密度增加,溶剂的溶解度增加,导致萃取率升高。当萃取压力达到24 MPa时,此时的生姜油萃取率最高为5.28%,而萃取压力进一步增加,生姜油萃取率呈现下降趋势,可能是由于压力过大,导致物料过分紧实,物料之间的缝隙变小,影响了萃取物的扩散速率,导致生姜油的萃取率下降[19],因此,生姜油的最佳萃取压力选择为24 MPa。
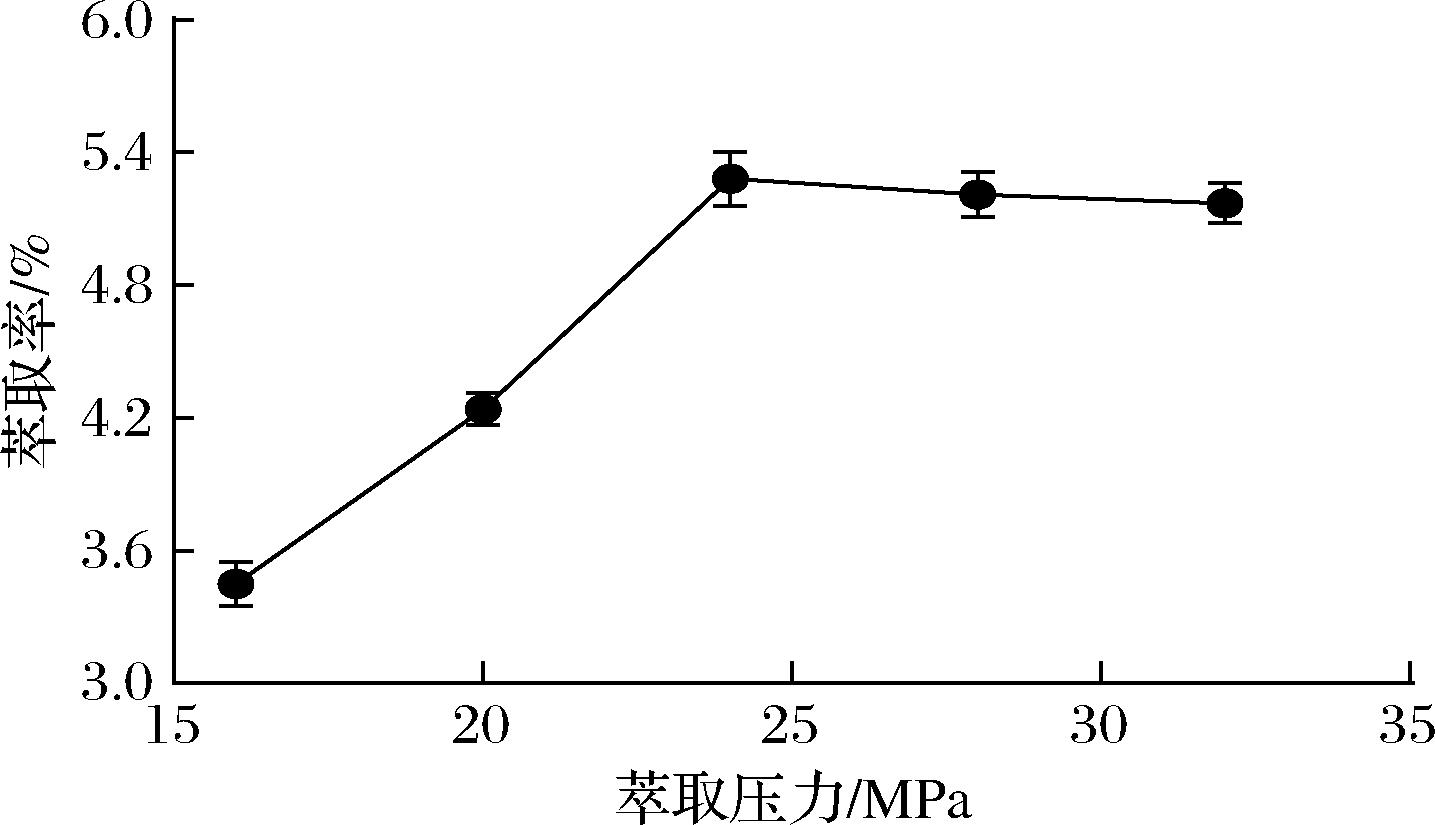
图1 萃取压力对姜油萃取率的影响
Fig.1 Effect of extraction pressure on the extraction rate of ginger oil
2.1.2 萃取温度对提取率的影响
萃取温度对超临界流体的溶解能力影响较大,是影响超临界萃取的主要因素之一[20]。在萃取压力24 MPa,萃取时间为2 h,CO2流量35 L/h条件下,考察了不同萃取温度(30、35、40、45、50 ℃)对姜油萃取率的影响。如图2所示,当温度在30~40 ℃时,随着萃取温度的升高,生姜油的萃取率逐渐增加,当萃取温度高于40 ℃时,萃取率变化趋于平缓,当温度由45 ℃增加到50 ℃时,生姜油的萃取率有略微下降。温度对生姜油萃取率的影响在于:一定范围内温度升高促使溶质分子扩散能力增强,溶质的溶解度升高,使生姜油萃取率增加;温度升高会导致超临界流体溶剂化效应降低,使其溶解度降低,从而导致生姜油萃取率降低。综合以上分析,生姜油萃取温度以40 ℃为宜。
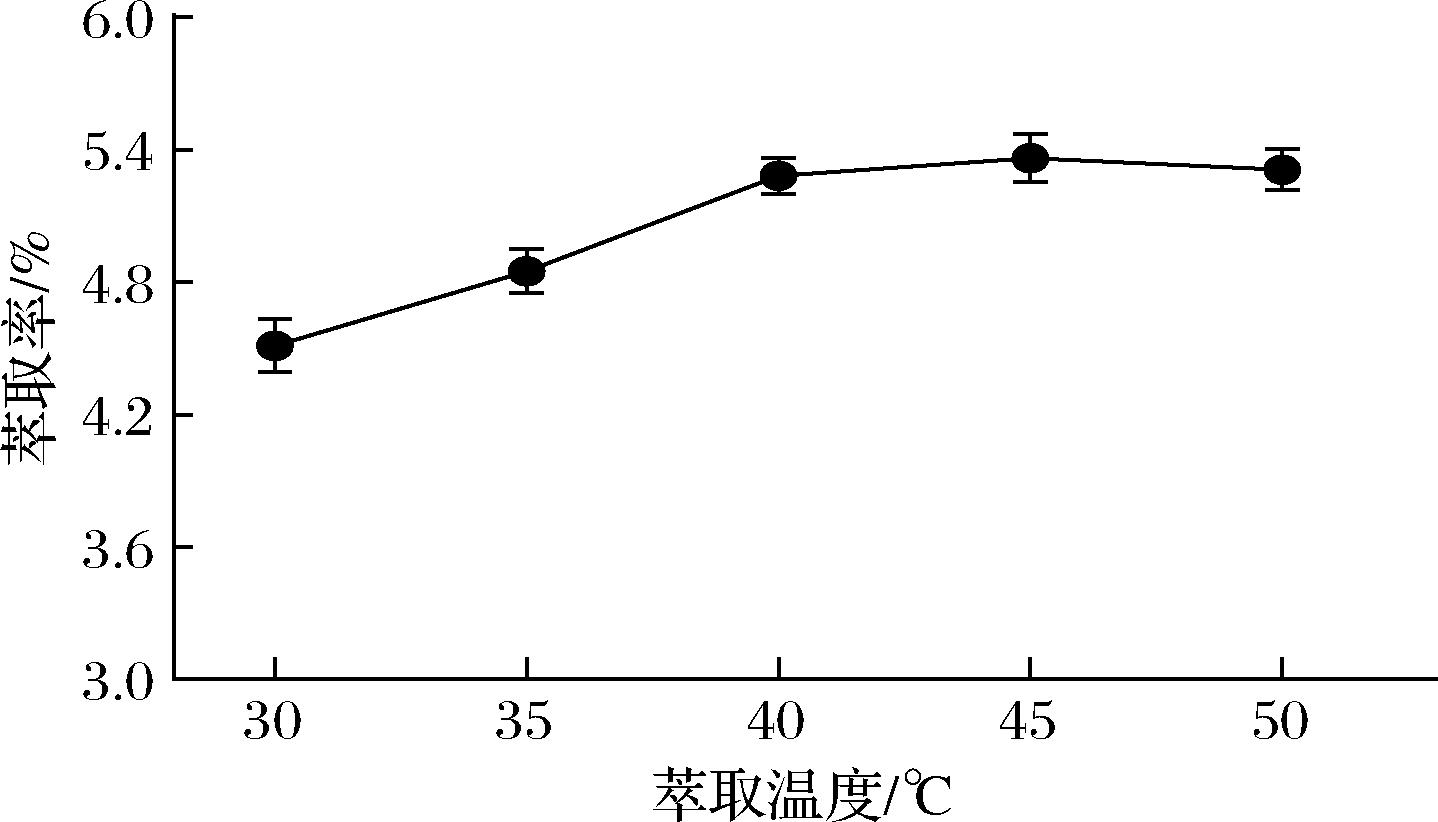
图2 萃取温度对姜油萃取率的影响
Fig.2 Effect of extraction temperature on the extraction rate of ginger oil
2.1.3 萃取时间对提取率的影响
萃取时间也是超临界流体萃取的一项重要参数,不仅与萃取效率密切相关,而且直接关系到运行成本的高低[21]。在萃取压力24 MPa,萃取温度40 ℃,CO2流量35 L/h条件下,考察了不同萃取时间(0.5、1、1.5、2、2.5 h)对姜油萃取率的影响。由图3可知,随着萃取时间的延长,生姜油的萃取率呈现一个上升的趋势,2 h之后,萃取率随时间的延长没有显著变化,说明此时萃取已经相当充分,延长时间已不太可能增加生姜油萃取得率,而且萃取时间过长会导致萃取物中树脂类等成分增多,影响生姜油的品质。因此,从能效和产品品质方面考虑,生姜油最适萃取时间为2 h。
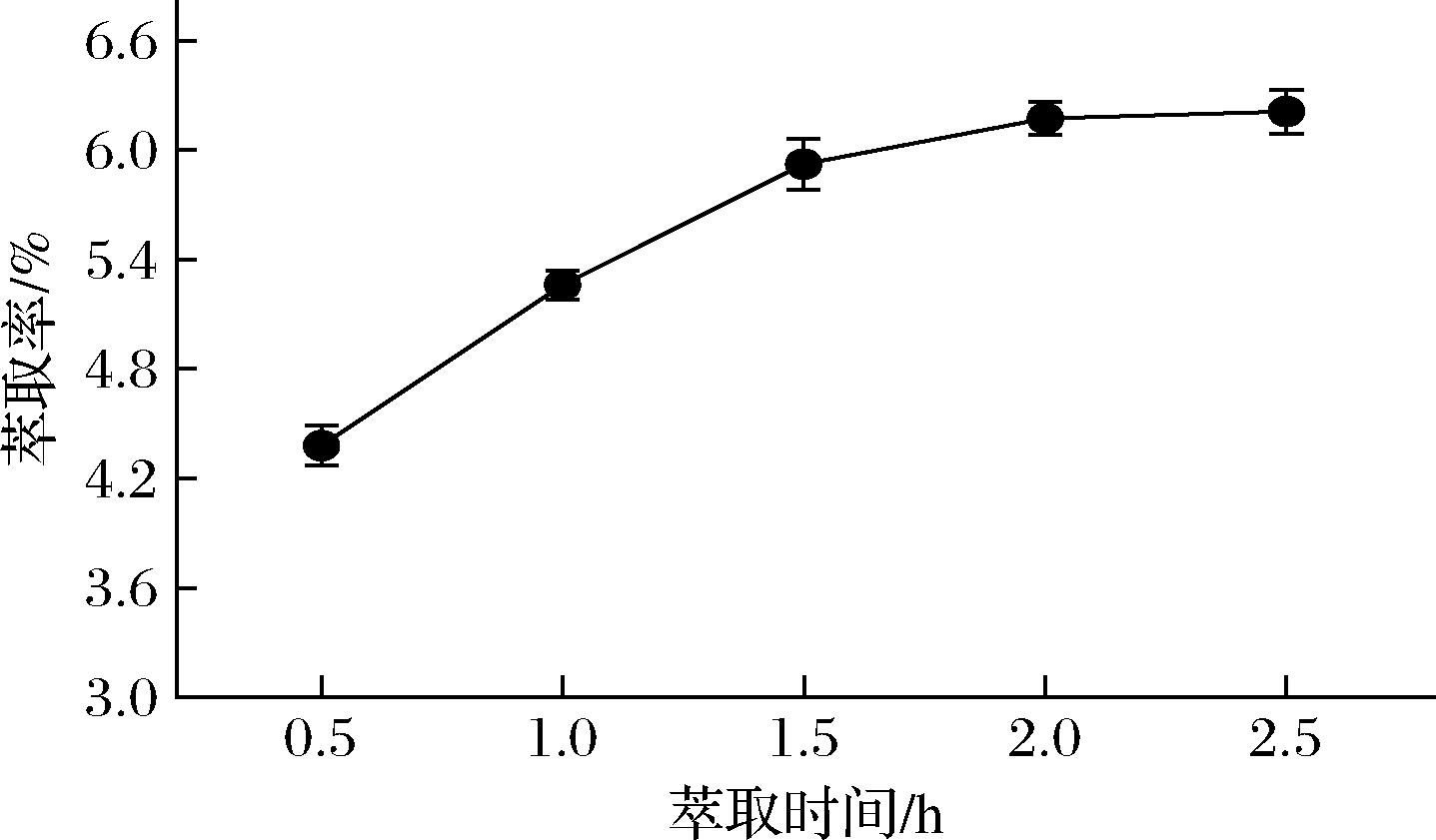
图3 萃取时间对姜油萃取率的影响
Fig.3 Effect of extraction duration on the extraction rate of ginger oil
2.2 正交试验结果
为全面考察超临界CO2萃取各因素对生姜油萃取率的影响,在单因素试验的基础上设计了正交试验。根据单因素试验,对超临界CO2萃取生姜油的萃取压力、萃取温度和萃取时间3个因素进行L9(34)正交试验,超临界CO2萃取生姜油的正交试验结果见表2。
表2 正交试验设计及结果
Table 2 Arrangement and results of the L9(34) orthogonal array design
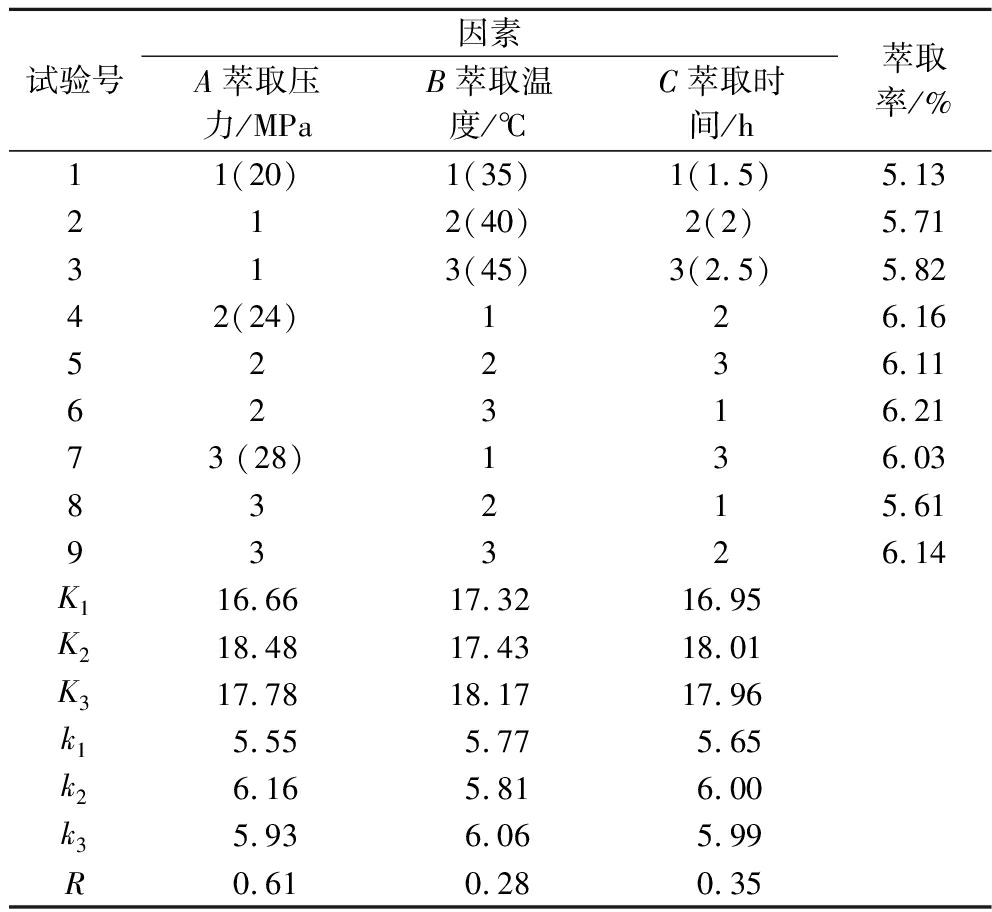
试验号因素A萃取压力/MPaB萃取温度/℃C萃取时间/h萃取率/%11(20)1(35)1(1.5)5.13212(40)2(2)5.71313(45)3(2.5)5.8242(24)126.1652236.1162316.2173 (28)136.0383215.6193326.14K116.66 17.32 16.95 K218.48 17.43 18.01 K317.78 18.17 17.96 k15.55 5.77 5.65 k26.16 5.81 6.00 k35.93 6.06 5.99 R0.61 0.28 0.35
由表2可知,不同的超临界CO2萃取工艺条件对生姜油的萃取率的影响存在一定的差异。通过极差分析可知,萃取压力(A)的极差最大,对生姜油萃取效果的影响最大,其第2水平的值最大,即萃取压力为24 MPa的萃取效果最好,其次是萃取时间和萃取温度,分别以第2水平和第3水平为最佳,正交试验结果表明各萃取因素对生姜油萃取率的影响大小依次为:A>C>B,即:萃取压力>萃取时间>萃取温度。在试验范围内最佳效果的萃取工艺条件为A2B3C2,即萃取压力为24 MPa,萃取温度为45 ℃,萃取时间为2 h。为验证试验的重现性,在最优工艺条件下进行3次重复试验,平均萃取率为(6.23±0.70)%。结果表明试验设计合理可行,数据可靠,重现性良好,适宜生姜中姜油的萃取。
2.3 分子蒸馏参数优化
在分子蒸馏系统中,蒸馏温度是影响物料分离效果的关键因素之一。蒸馏温度越高,物质的分子平均自由程越大,轻、重组分物质的分离效果越好,同时较高的温度会对分离组分产生不同程度的影响[22]。在真空度为65 Pa,转速为200 r/min,流速为5 mL/min,考察了不同温度(50、60、70、80、90、100 ℃)生姜精油得率的影响。生姜油经过分子蒸馏,被分为轻组分和重组分,轻组分主要是挥发性芳香精油,重组分主要是非挥发性姜辣素。如图4所示,轻重组分总的回收率均保持在90%以上,其中轻组分得率随着温度的升高而逐渐提高,重组分得率随着温度的升高逐渐降低。经50~80 ℃分子蒸馏,生姜精油得率持续上升,80 ℃之后随蒸馏温度升高生姜精油得率呈现缓慢升高趋势,在80、90、100 ℃时,生姜精油的得率差异不大。同时,随着蒸馏温度升高,生姜精油的颜色逐渐加深,由淡黄色向黄色转变,可能是由于蒸馏温度升高,有少量的姜辣素等物质被带入生姜精油,考虑到较高的蒸馏温度可能会对姜烯等热敏物质因热降解反应引起较大的损失[23],因此,选择最佳的蒸馏温度为80 ℃,此时,生姜精油的得率为40.59%,在此条件下,生姜精油的综合得率为2.53%。
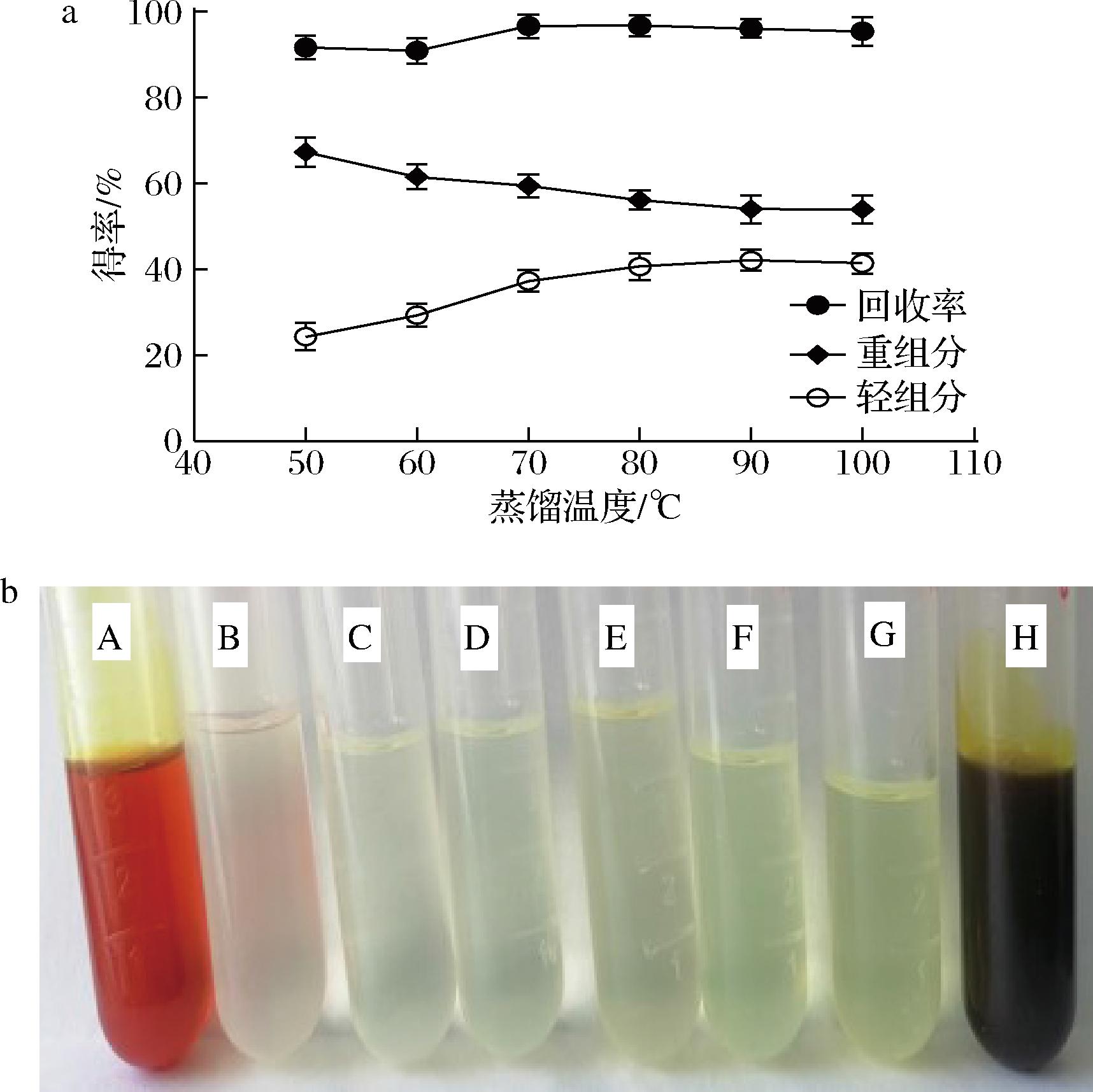
a-得率;b-感官品质
图4 蒸馏温度对各组分的影响
Fig.4 Effects of extraction temperature on compents of ginger oil
2.4 生姜油GC-MS/MS分析
采用GC-MS/MS对生姜精油挥发性成分进行分析,得到生姜精油总离子流图(图5),对生姜精油中各挥发性物质进行了定性,确定了超临界CO2萃取联合分子蒸馏萃取生姜精油的主要挥发性成分,并将超临界CO2萃取生姜精油与水蒸馏生姜精油进行了比较。由表3可知,不同萃取工艺所得生姜精油的挥发性成分组成和含量均存在一定差异,但主要挥发性成分基本保持一致。生姜精油中共鉴定出26种挥发性物质,其中超临界CO2萃取联合分子蒸馏萃取生姜精油鉴定出22种挥发性物质,包括17种萜烯类、4种醇类及1种酯类,相对百分含量最高的是α-姜烯(42.13%)、其次是β-倍半水芹烯(17.05%)和β-红没药烯(13.52%);水蒸馏生姜精油共鉴定出21种挥发性物质,包括14种萜烯类、6种醇类及1种酯类,百分含量最高的是α-姜烯(40.59%)、其次是β-倍半水芹烯(17.01%)和β-红没药烯(12.86%)。α-姜烯、β-倍半水芹烯、β-红没药烯在两种萃取方法所得生姜精油中均占有较高比重,百分含量均达70%以上,基本确定是生姜精油的主要化学成分[24]。不同方式所得生姜精油在百分含量和成分上也存在一定差异,其中α-姜烯、β-倍半水芹烯、β-红没药烯等成分在超临界CO2生姜精油中相对百分含量较高,α-合金欢烯和α-姜黄烯在水蒸馏法生姜精油中的相对百分含量较高。另外,超临界CO2萃取联合分子蒸馏得到的生姜精油的单萜烯类挥发性物质和出峰时间靠前的挥发性物质较多,如α-水芹烯、α-葑烯、β-水芹烯等,而水蒸气蒸馏得到的生姜精油的醇类物质和出峰时间靠后的物质较多,如顺式-水合倍半萜桧烯、蛇麻-1,6-二烯-3-醇、6-芹子烯-4醇等。这可能是由于超临界CO2萃取联合分子蒸馏工艺条件温和,较好的保留了热敏物质,而水蒸气蒸馏法需要较高的温度(100 ℃),造成了生姜精油中热敏性化学成分的降解与损失[25],表明了超临界CO2萃取联合分子蒸馏在萃取挥发性风味物质工艺上具有显著的优势。
图5 生姜油总离子流图
Fig.5 Total ion chromatogram of crude ginger oil
表3 不同萃取工艺制得的生姜精油中挥发性成分分析
Table 3 GC-MS/MS chemical composition analysis results of extracts from different extraction processes

序号保留时间/min保留指数RI化合物名称分子式CAS相对百分含量/%超临界结合分子蒸馏法水蒸馏法116.942 924α-水芹烯C10H1699-83-20.15-217.682941α-葑烯C10H16471-84-10.17-317.684951莰烯C10H1679-92-50.720.36421.111 005β-水芹烯C10H16555-10-21.72-521.1431 031桉叶油醇C10H18O470-82-60.880.29626.8171 172龙脑C10H18O464-45-90.810.44730.8321 281乙酸冰片酯C12H20O25655-61-80.020.23833.9651 364(+)-环苜蓿烯C15H2422469-52-90.410.34934.0961 373α-可巴烯C15H243856-25-50.710.741034.4341 387β-榄香烯C15H24515-13-91.081.241135.5371 387γ-榄香烯C15H2429873-99-20.210.221235.9651 455(E)-β-金合欢烯C15H2418794-84-80.44-1335.9661 455顺式-β-金合欢烯C15H2428973-97-9-0.401436.4761 472香树烯C15H2425246-27-90.320.341536.7791 481α-姜黄烯C15H22644-30-47.759.351636.9591 621β-荜澄茄油烯C15H2413744-15-53.012.481737.1361 495α-姜烯C15H24495-60-342.1340.591837.2121 502α-金合欢烯C15H24502-61-47.378.771937.4061 505β-红没药烯C15H24495-61-413.5212.862037.6691 519双环倍半水芹烯C15H2454274-73-60.87-
续表3
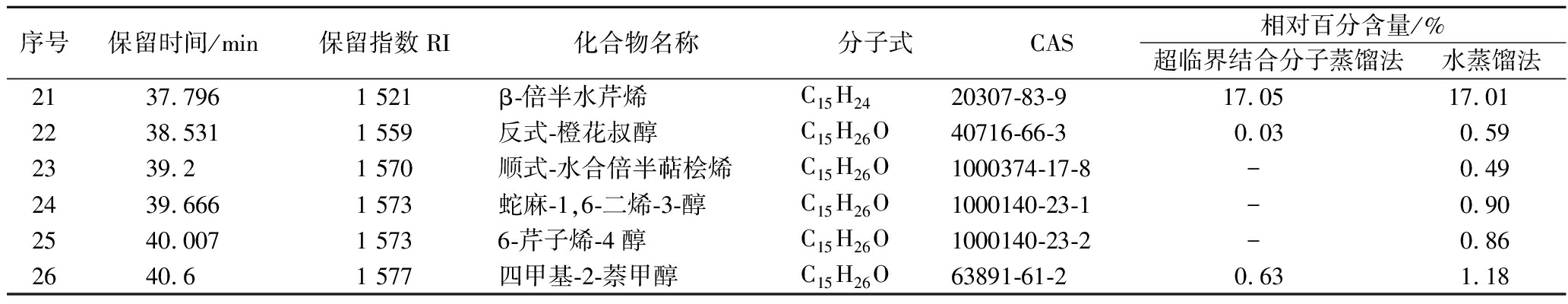
序号保留时间/min保留指数RI化合物名称分子式CAS相对百分含量/%超临界结合分子蒸馏法水蒸馏法2137.7961 521β-倍半水芹烯C15H2420307-83-917.0517.012238.5311 559反式-橙花叔醇C15H26O40716-66-30.030.592339.21 570顺式-水合倍半萜桧烯C15H26O1000374-17-8-0.492439.6661 573蛇麻-1,6-二烯-3-醇C15H26O1000140-23-1-0.902540.0071 5736-芹子烯-4醇C15H26O1000140-23-2-0.862640.61 577四甲基-2-萘甲醇C15H26O63891-61-20.631.18
3 结论与讨论
在本研究采用超临界CO2流体萃取联合分子蒸馏技术对生姜精油的萃取进行了系统研究。经过单因素和正交试验优化,得到超临界流体萃取技术最佳工艺条件为萃取压力24 MPa、萃取温度45 ℃、萃取时间2 h,分子蒸馏分离纯化生姜精油最佳温度为80 ℃,在此条件下的生姜精油综合萃取率达到了2.53%,基于GC-MS/MS对不同提取方式生姜精油挥发性成分进行了分析,确定了生姜精油的主要挥发性成分为α-姜烯、β-倍半水芹烯、β-红没药烯等萜烯类物质,百分含量达70%以上,其中α-姜烯百分含量为42.13%。采用超临界CO2流体萃取联合分子蒸馏法纯化生姜精油得率和品质均优于传统的水蒸气蒸馏法。该方法的建立,可为生姜精油的产业化与后续研究提供依据。
本研究通过GC-MS/MS对超临界结合分子蒸馏生姜精油与水蒸气蒸馏生姜精油的挥发性组分进行了分析,共鉴定出26种挥发性成分,其中超临界结合分子蒸馏纯化生姜精油中鉴定出22种,主要包括17种萜烯类、4种醇类、1种酯类,其主要挥发性成分是α-姜烯、β-倍半水芹烯、β-红没药烯、α-姜黄烯;水蒸气蒸馏生姜精油中鉴定出21种挥发性成分,主要包括14种萜烯类、6种醇类、1种酯类,其主要挥发性成分是α-姜烯、β-倍半水芹烯、β-红没药烯、α-姜黄烯。2种提取方法得到的生姜精油的主要挥发性成分基本一致,但超临界结合分子蒸馏纯化得到的生姜精油含有一定量的低沸点挥发性物质,比如α-水芹烯、α-葑烯和β-水芹烯等,在水蒸气蒸馏得到的生姜精油中未检出,可能是水蒸馏温度过高,导致低沸点挥发性物质发生了热降解或者转化。GB/T 39014—2020《生姜精油》对水蒸气蒸馏法提取生姜精油的特征组分进行了明确,主要有莰烯、姜黄烯、α-姜烯、β-红没药烯,而对于其他方法提取得到的生姜精油尚没有明确规定。不同提取方法得到的生姜精油的挥发性物质的种类数量存在一定差异。刘红霞等[26]采用水蒸气蒸馏法提取云南小黄姜精油,共鉴定出27种化学成分,主要是α-姜烯、β-倍半水芹烯、β-红没药烯、α-姜黄烯等;许舒雯等[27]采用有机溶剂萃取法提取铜陵生姜的挥发油化学成分, 共鉴定出12种主要成分,主要是乙酸香叶酯、α-姜黄烯、姜烯、α-法尼烯、β-甜没药烯、β-倍半水芹烯等。这说明不同的提取方法,不同产地的生姜提取生姜精油的挥发性风味物质有所差异,因此在分析鉴定生姜精油中挥发性成分时要充分考虑提取方法、生姜产地对其鉴定结果的影响。
[1] 郭家刚, 杨松, 丁思年, 等.基于气相离子迁移谱的不同产地生姜挥发性有机物指纹图谱分析[J].食品科学, 2021, 42(24):236-241. GUO J G, YANG S, DING S N, et al.Fingerprint analysis of volatile organic compounds in ginger rhizomes from different geographical origins by gas chromatography-ion mobility spectrometry[J].Food Science, 2021, 42(24):236-241.
[2] AFZAL M, AL-HADIDI D, MENON M, et al.Ginger:An ethnomedical, chemical and pharmacological review[J].Drug Metabolism and Drug Interactions, 2001, 18(3-4):159-190.
[3] 赵文竹, 张瑞雪, 于志鹏, 等.生姜的化学成分及生物活性研究进展[J].食品工业科技, 2016, 37(11):383-389. ZHAO W Z, ZHANG R X, YU Z P, et al.Research process in ginger chemical composition and biological activity[J].Science and Technology of Food Industry, 2016, 37(11):383-389.
[4] 李芳, 李洪军, 李少博, 等.天然香辛料的功能特性及其在肉与肉制品中的应用研究现状[J].食品与发酵工业, 2020, 46(20):274-281. LI F, LI H J, LI S B, et al.The functional properties of natural spices and their application in meat and meat products:A review[J].Food and Fermentation Industries, 2020, 46(20):274-281.
[5] BARBOSA L N, RALL V L M, FERNANDES A A H, et al.Essential oils against foodborne pathogens and spoilage bacteria in minced meat[J].Foodborne Pathogens and Disease, 2009, 6(6):725-728.
[6] PRIYA RANI M, PADMAKUMARI K P, SANKARIKUTTY B, et al.Inhibitory potential of ginger extracts against enzymes linked to type 2 diabetes, inflammation and induced oxidative stress[J].International Journal of Food Sciences and Nutrition, 2011, 62(2):106-110.
[7] NOORI S, ZEYNALI F, ALMASI H.Antimicrobial and antioxidant efficiency of nanoemulsion-based edible coating containing ginger (Zingiber officinale) essential oil and its effect on safety and quality attributes of chicken breast fillets[J].Food Control, 2018, 84:312-320.
[8] MUNDA S, DUTTA S, HALDAR S, et al.Chemical analysis and therapeutic uses of ginger (Zingiber officinale rosc.) essential oil:A review[J].Journal of Essential Oil Bearing Plants, 2018, 21(4):994-1002.
[9] 胡文杰, 于宏, 赵晨宏, 等.不同产地生姜精油化学组分比较与分析[J].食品与发酵工业, 2020, 46(20):236-240. HU W J, YU H, ZHAO C H, et al.The comparation and analysis of essential oil components of Zingiber officinale from different regions[J].Food and Fermentation Industries, 2020, 46(20):236-240. [10] SALEA R, VERIANSYAH B, TJANDRAWINATA R R.Optimization and scale-up process for supercritical fluids extraction of ginger oil from Zingiber officinale var.Amarum[J].The Journal of Supercritical Fluids, 2017, 120:285-294.
[11] PHAKAWAT T, SOOTTAWAT B.Essential oils:Extraction, bioactivities, and their uses for food preservation[J].Journal of Food Science, 2014, 79(7):R1231-R1249.
[12] DE SOUZA A T, BENAZZI T L, GRINGS M B, et al.Supercritical extraction process and phase equilibrium of Candeia (Eremanthus erythropappus) oil using supercritical carbon dioxide[J].The Journal of Supercritical Fluids, 2008, 47(2):182-187.
[13] 黄梦, 苏丽媛, 张丽红, 等.咖啡精油超临界CO2萃取工艺优化及理化特性分析[J].食品工业科技, 2022, 43(3):145-154. HUANG M, SU L Y, ZHANG L H, et al.Optimization of supercritical CO2 extraction process and analysis of physicochemical properties of coffee essential oil[J].Science and Technology of Food Industry, 2022, 43(3):145-154.
[14] ALI A, HEI G K, KEAT Y W.Efficacy of ginger oil and extract combined with gum Arabic on anthracnose and quality of papaya fruit during cold storage[J].Journal of Food Science and Technology, 2016, 53(3):1435-1444.
[15] 黄会娜, 刘玉兰, 杨争光, 等.分子蒸馏法脱除油脂中3-氯丙醇酯和缩水甘油酯[J].食品科学, 2020, 41(20):41-45. HUANG H N, LIU Y L, YANG Z G, et al.Removal of 3-monochloro-1, 2-propanediol esters and glycidyl esters from corn oil by molecular distillation[J].Food Science, 2020, 41(20):41-45.
[16] MEZZA G N, BORGARELLO A V, GROSSO N R, et al.Antioxidant activity of rosemary essential oil fractions obtained by molecular distillation and their effect on oxidative stability of sunflower oil[J].Food Chemistry, 2018, 242:9-15.
[17] 葛毅强, 倪元颖, 张振华, 等.生姜、大蒜、洋葱3种传统香辛调味料的研究开发[J].食品与发酵工业, 2003, 29(7):59-64. GE Y Q, NI Y Y, ZHANG Z H, et al.Research and development of three traditional flavourings of ginger, garlic and onion[J].Food and Fermentation Industries, 2003, 29(7):59-64.
[18] 文宁, 李晓朋, 陶宁萍.奇亚籽油、多酚和芳香水的分级提取及理化性质分析[J].食品与发酵工业, 2019, 45(13):141-147. WEN N, LI X P, TAO N P.Fraction extraction and physiochemical properties of Chia(Salvia hispanica) seed oil, polyphenols, and aromatic water[J].Food and Fermentation Industries, 2019, 45(13):141-147.
[19] 孙益民, 颜佳, 贾娜, 等.超临界二氧化碳提取辣椒籽油工艺的可视化分析研究[J].食品科技, 2012, 37(6):209-214. SUN Y M, YAN J, JIA N, et al.Visual analysis of extraction process of paprika seeds oil with supercritical carbon dioxide[J].Food Science and Technology, 2012, 37(6):209-214.
[20] RAI A, MOHANTY B, BHARGAVA R.Modeling and response surface analysis of supercritical extraction of watermelon seed oil using carbon dioxide[J].Separation and Purification Technology, 2015, 141:354-365.
[21] 杨万政, 常华, 杜晓鸣, 等.超临界二氧化碳萃取番茄红素的研究[J].河北农业大学学报, 2009, 32(6):114-116;120. YANG W Z, CHANG H, DU X M, et al.Study on the super critical CO2 extraction of lycopene[J].Journal of Agricultural University of Hebei, 2009, 32(6):114-116;120.
[22] 黄惠芳, 陈跃新, 梁立娟, 等.不同温度条件下分子蒸馏姜黄精油收率及其成分的GC-MS分析[J].食品工业科技, 2012, 33(1):265-267. HUANG H F, CHEN Y X, LIANG L J, et al.Yield of molecular distillation turmeric oil under different temperature conditions and its components analysis by GC-MS[J].Science and Technology of Food Industry, 2012, 33(1):265-267.
[23] 陈冬, 张晓阳, 刘尧政, 等.姜油纳米乳液特性与贮藏稳定性研究[J].农业机械学报, 2016, 47(8):233-240. CHEN D, ZHANG X Y, LIU Y Z, et al.Property and storage stability of ginger oil nano-emulsions[J].Transactions of the Chinese Society for Agricultural Machinery, 2016, 47(8):233-240.
[24] 朱艺佳, 唐泽群, 陈可可, 等.不同提取工艺对生姜提取物及化学组成的影响[J].食品与发酵工业, 2023, 49(2):113-119. ZHU Y J, TANG Z Q, CHEN K K, et al.Effects of different extraction processes on ginger extract and chemical composition[J].Food and Fermentation Industries, 2023, 49(2):113-119.
[25] CORNELL D W, JORDAN R A.Composition and distinctive volatile flavour characteristics of the essential oil from Australian-grown ginger (Zingiber officinale)[J].Journal of the Science of Food and Agriculture, 1971, 22(2):93-95.
[26] 刘红霞, 丁荣良, 仝锦豪, 等.姜精油提取工艺优化及对比成分分析[J].中国调味品, 2021, 46(8):101-104. LIU H X, DING R L, TONG J H, et al.Optimization of extraction process of ginger essential oil and comparative analysis of its components[J].China Condiment, 2021, 46(8):101-104.
[27] 许舒雯, 彭丽华, 王凯, 等.铜陵生姜挥发油化学成分的GC-MS分析[J].安徽农业科学, 2013, 41(15):6910-6911. XU S W, PENG L H, WANG K, et al.Study on the chemical components of volatile oils from Tongling ginger by GC-MS[J].Journal of Anhui Agricultural Sciences, 2013, 41(15):6910-6911.