小米又称粟米,禾本科植物,性喜温暖,适应性强,一年生草本植物,被认为是世界第六大谷物,广泛种植于亚洲及非洲的干旱和半干旱地区[1]。小米蛋白质含量远高于其他谷类植物,约占总质量的11%,含人体所需的8种必需氨基酸,其中脯氨酸和天门冬氨酸含量较玉米和大米分别高出40%、55%,可作为优质天然蛋白质的来源之一[2]。硒(Se)是人体不可或缺的微量元素之一,缺硒会导致严重的健康问题,如克山病、糖尿病、心血管疾病等。自然界中硒以有机硒与无机硒的形式存在。植物根系吸收土壤中的无机硒,并通过硫同化作用将其转化为有机形式,所以植物性食物是机体摄入硒的主要来源[3]。SURAI等[4]发现,与有机硒相比,无机硒在动物消化道中的毒性更大,更不易吸收。但目前常见植物性食物中的硒含量并不能满足人体日常膳食营养需求,天然富硒食品也因此备受青睐[5]。
通过特定富硒土壤种植的小米中有机硒得以富集,有效提高了硒的生物利用度及小米的营养价值。硒在植物中常以硒蛋白的形式存在[6],但对富硒小米蛋白仍缺乏了解,极大地影响其应用价值。研究表明,施硒使花生蛋白质在合成过程中,半胱氨酸和蛋氨酸被硒代氨基酸所取代,造成蛋氨酸和含硫氨基酸的含量[7]较对照组相比呈现相反趋势;Se可以通过S—S、Se—S和Se—Se键与大豆蛋白结合,影响蛋白质的二硫键和二级结构[8]。HUANG等[9]对硒生物强化的大豆蛋白进行研究,发现高浓度的硒蛋白其β-折叠增加,无规则卷曲减少,表明蛋白质分子从有序转变为无序结构,刚性结构减弱,柔性结构增强[10]。蛋白质越柔韧越容易在界面处形成黏弹性的膜,使大豆硒蛋白的起泡性、乳化稳定性等功能特性低于对照组。此外与普通秀珍菇蛋白相比,富硒秀珍菇蛋白二硫键含量增加。二硫键的增长改变了蛋白质的空间结构,使蛋白质分子间结合更加紧密,结构越稳定,无益于富硒蛋白的持水性持油性[11]。综上所述,植物中硒的累积过程对蛋白质的组成及结构有显著影响,而结构的改变可能会影响蛋白质的某些功能特性、理化性质及其在食品加工中的应用。
然而国内外目前对富硒小米蛋白的研究主要集中在抗氧化、抗菌性等生理功能方面,对其理化特性、功能特性及结构研究较少。本文以普通小米蛋白(common millet protein, MP)为对照,研究富硒小米蛋白(selenium-rich millet protein, SMP)的理化性质、功能特性及结构,以期为SMP产品的综合开发利用提供理论基础。
1 材料与方法
1.1 材料与试剂
富硒小米,宁夏兴鲜杂粮种植加工基地(有限公司);普通小米,市售;石油醚、NaOH、HCl、磷酸,天津市大茂化学分析厂;考马斯亮蓝G250,北京博奥拓科技有限公司;PAGE凝胶超快速制备试剂盒12.5%,大连美仑生物技术有限公司。以上试剂均为分析纯。
1.2 主要仪器设备
ZK-08A密封型摇摆式粉碎机,北京中科浩宇科技发展有限公司;V-5100型可见分光光度计,南京菲勒仪器有限公司;FD-1A-50真空冷冻干燥机,上海继谱电子科技有限公司;TDL-5-A型台式大容量离心机,上海安亭科学仪器厂。
1.3 实验方法
1.3.1 小米蛋白的提取
参考AKHARUME等[12]的方法并加以改进。将2种小米分别粉碎,过60目筛,室温下用1∶6(g∶mL)的石油醚,索式抽提4 h脱去脂肪。室温干燥12 h,于4 ℃冰箱冷藏备用。
准确称取一定量的脱脂小米粉,按料液比1∶8(g∶mL)加入蒸馏水,搅拌均匀后使用1 mol/L NaOH溶液调节pH 9.5,温度30 ℃,提取2 h,提取结束后4 000 r/min离心20 min;收集上清液,使用1 mol/L HCl溶液调节pH 4,静置30 min,5 000 r/min离心15 min,收集沉淀即为蛋白质粗品。冷冻干燥,-20 ℃保存待用。
1.3.2 小米蛋白纯度及硒含量的测定
参考SN/T 3926—2014《出口乳、蛋、豆类食品中蛋白质含量的测定 考马斯亮蓝法》测定蛋白质含量。
牛血清蛋白标准曲线的线性回归方程为y=0.771 7x+0.077,线性因子R2=0.998 3,说明在0~0.1 mg/mL质量浓度范围内,牛血清蛋白标准品溶液浓度与其吸光度呈良好的线性关系。
参考GB 5009.268—2016《食品安全国家标准 食品中多元素的测定》测定蛋白中的硒含量。
1.3.3 小米蛋白理化性质研究
1.3.3.1 氨基酸含量的测定
准确称取固体样品200 mg,加入水解管中。加入6 mol/L HCl溶液10 mL,管中吹入N2 30 s并密封,置于油浴锅110 ℃水解24 h。水解结束后待冷却至室温,定容至50 mL容量瓶。吸取样品2 mL,置旋转蒸发仪45 ℃脱酸,加入2 mL样品缓冲液充分溶解,通过0.45 μm过滤器过滤后上机分析。
1.3.3.2 SDS-PAGE凝胶电泳
分别取100 μL 10 mg/mL MP、SMP蛋白溶液,加入25 μL SDS-PAGE样品缓冲液。将样品溶液于95 ℃水浴加热5 min后,吸取10 μL上清液开始进样,在80~100 V电压下电泳3 h。电泳结束后,用考马斯亮蓝染色处理胶片,脱色,对蛋白质条带拍照观察。
1.3.4 小米蛋白功能特性研究
1.3.4.1 溶解度(solubility,PS)
称取0.1 g MP、SMP蛋白粉末溶于10 mL蒸馏水中,使用电动分散均质机均质2 min后,在4 000 r/min下离心5 min。取上清液1 mL,根据1.3.2节中SN/T 3926—2014《出口乳、蛋、豆类食品中蛋白质含量的测定 考马斯亮蓝法》测定上清液蛋白质含量。溶解度按公式(1)计算:
溶解度![]()
式中:A1,样品中的蛋白质含量,%;A0,上清液中的蛋白质含量,%。
1.3.4.2 持水性(water holding capacity,WA)
参考TABTABAEI 等[13]的方法。称取0.1 g MP、SMP蛋白粉末,加入1 mL蒸馏水,充分振荡,混匀后,静置20 min后,离心15 min,弃去上清液,称质量,蛋白持水性的计算如公式(2)所示:
持水性![]()
式中:m0,样品的质量,g;m1,离心管和样品的总质量,g;m2,离心后离心管加沉淀的总质量,g。
1.3.4.3 持油性(oil-holding property,FA)
称取0.1 g MP、SMP蛋白粉末,加入5 mL大豆油,充分振荡,混匀后,静置20 min离心15 min,弃去上层油液,称质量,蛋白持油性的计算如公式(3)所示:
持油性![]()
式中:m0,样品的质量,g;m1,离心管和样品的总质量,g;m2,离心后离心管加沉淀的总质量,g。
1.3.4.4 乳化性(emulsification capability,EC)及乳化稳定性(emulsion stability,ES)
参考AKHARUME等[12]方法,稍加修改。将MP、SMP配制成10 g/L的蛋白溶液,取样品溶液4 mL,加入2 mL大豆油,使用均质机(12 000 r/min)将体系混合均匀,均质后在0和10 min时取底部乳液50 μL,加入1 g/L SDS溶液5 mL,在500 nm处测定吸光度。乳化性和乳化稳定性的计算分别如公式(4)、公式(5)所示:
乳化性![]()
乳化稳定性![]()
式中:A0,0 min时蛋白乳化液吸光度;A10,10 min时乳化液吸光度;L,比色皿光程(1 cm);n,溶液稀释倍数;ρ,蛋白质量浓度,g/100 mL;φ,油相体积分数,25%;Δt,10 min。
1.3.4.5 起泡性(froth capability,FC)及起泡稳定性(froth stability,FS)
取一定量MP、SMP蛋白粉末,用蒸馏水复溶,加入10 mL蒸馏水,在12 000 r/min下高速分散2 min,使溶液均匀起泡,立即测定均质后总体积,静置30 min再次测定体积。起泡性和起泡性稳定性的计算分别如公式(6)、公式(7)所示:
起泡性![]()
起泡性稳定性![]()
式中:V0,样品水溶液的体积,g/mL;V1,样品均质后的总体积,mL;V2,静置30 min后的体积,mL。
1.3.5 小米蛋白结构表征
1.3.5.1 扫描电子显微镜
采用ZHU等[14]的方法,参数稍加修改。取适量MP、SMP蛋白样品,喷金导电,在扫描电子显微镜上观察样品表观结构,电压20 kV。
1.3.5.2 傅立叶红外光谱
参考张红印[15]的方法,稍加修改。取适量MP、SMP蛋白样品,与KBr混合并平铺在压片机上压片,将已制备好的KBr薄片在400~4 000 cm-1范围内扫描,分辨率为16 cm-1。
1.4 数据处理与分析
试验数据用Excel 2019整理并做标准差;采用SPSS 26进行显著性分析;Origin 2021b、FeakFit v 4.12等软件绘图。每个试验进行3次重复,结果以平均值±标准差来表示,P<0.05表示为差异显著。
2 结果与分析
2.1 富硒小米基本成分分析
由表1可知,由于小米生长受光照、土壤、温度、气候等因素的影响,导致2种小米的水分、灰分、脂肪、淀粉等营养成分均存在显著差异(P<0.05)。除水分外,富硒小米的灰分、淀粉、脂肪、蛋白质含量均高出普通小米,其中蛋白质、硒含量分别高出普通小米1.817个百分点、0.203 mg/kg。这可能是因为在对小米施硒处理时,由于不同品种的小米对硒的富集及转化能力不同,而硒在转化过程中取代硫,形成硒代氨基酸化合物,进一步转运至小米中以硒蛋白的形式储存在蛋白质中[16],造成硒、蛋白质含量差异(P<0.05)。
表1 两种小米基本成分分析
Table 1 Analysis of basic components of two kinds of millet

基本成分指标普通小米富硒小米水分/%11.167±0.042a10.050±0.028b灰分/%1.050±0.029b1.199±0.058a脂肪/%3.100±0.056b6.633±0.152a淀粉/%57.513±0.740b61.016±1.861a蛋白质/%8.583±0.035b10.400±0.036a硒/(mg/kg)0.258±0.003b0.461±0.002a
注:不同字母表示具有显著性差异(P<0.05)(下同)。
2.2 MP/SMP中蛋白质纯度及硒含量
由表2可知,使用碱溶酸沉的方法提取小米蛋白、富硒小米蛋白,根据标准曲线计算出,蛋白质纯度为48.720%,54.810%;硒含量分别为0.080、0.630 mg/kg。由此可知,蛋白质中的硒含量变化与表1小米中的硒含量基本一致,SMP硒含量较富硒小米高出0.169 mg/kg。张雪莉等[17]对杏鲍菇硒蛋白进行定性与定量分析,发现硒蛋白的硒含量要高于原料,这与本实验结果相同,且有机硒含量占总硒的94.6%。NIU等[18]研究发现富硒苦麦蛋白中的硒含量占苦荞总硒的81.58%,进一步说明硒主要与蛋白质结合。
表2 MP/SMP的蛋白质纯度及硒含量
Table 2 Protein purity and selenium content of MP/SMP

小米种类硒含量/(mg/kg)蛋白质纯度/%MP0.080±0.009b48.720±0.029bSMP0.630±0.004a54.810±0.042a
2.3 理化性质分析
2.3.1 氨基酸含量分析
SMP与MP的氨基酸组成及含量见表3。由表可知2种小米蛋白均检出17种氨基酸且组成相似,其中谷氨酸含量最高,这与大多数植物蛋白中氨基酸组成相同[19]。且对比2种小米蛋白氨基酸含量,其中Met+Cys含量相差最大为1.304 g/100 g。这是由于植物中的硒通过含硫氨基酸的代谢途径非特异性的将硒代含硫氨基酸结合到蛋白质中,取代含硫氨基酸而产生,从而造成某些含硫氨基酸(Met、Cys)含量发生变化[3]。
与FAO/WHO推荐模式进行对比。如表3所示2种小米蛋白中只有异亮氨酸、蛋氨酸+胱氨酸含量符合FAO/WHO给出的儿童推荐要求,成人推荐要求只有组氨酸没有达到标准。根据FAO/WHO标准推荐模式,品质良好的蛋白质其EAA/TAA在40%左右,EAA/NEAA在0.6以上[20]。2种小米蛋白中EAA含量丰富,SMP与MP的EAA/TAA分别为53.529%、51.101%,高出FAO/WHO规定标准13.53个百分点、11.101个百分点;EAA/NEAA为1.152、1.045,说明2种小米蛋白均可作为优质蛋白质,且SMP的EAA/TAA与EAA/NEAA的比值较MP高出2.428和0.017个百分点,表现出更高的营养价值。
表3 SMP/MP氨基酸含量及FAO/WHO推荐模式表
Table 3 SMP/MP amino acid content and FAO/WHO recommended model table
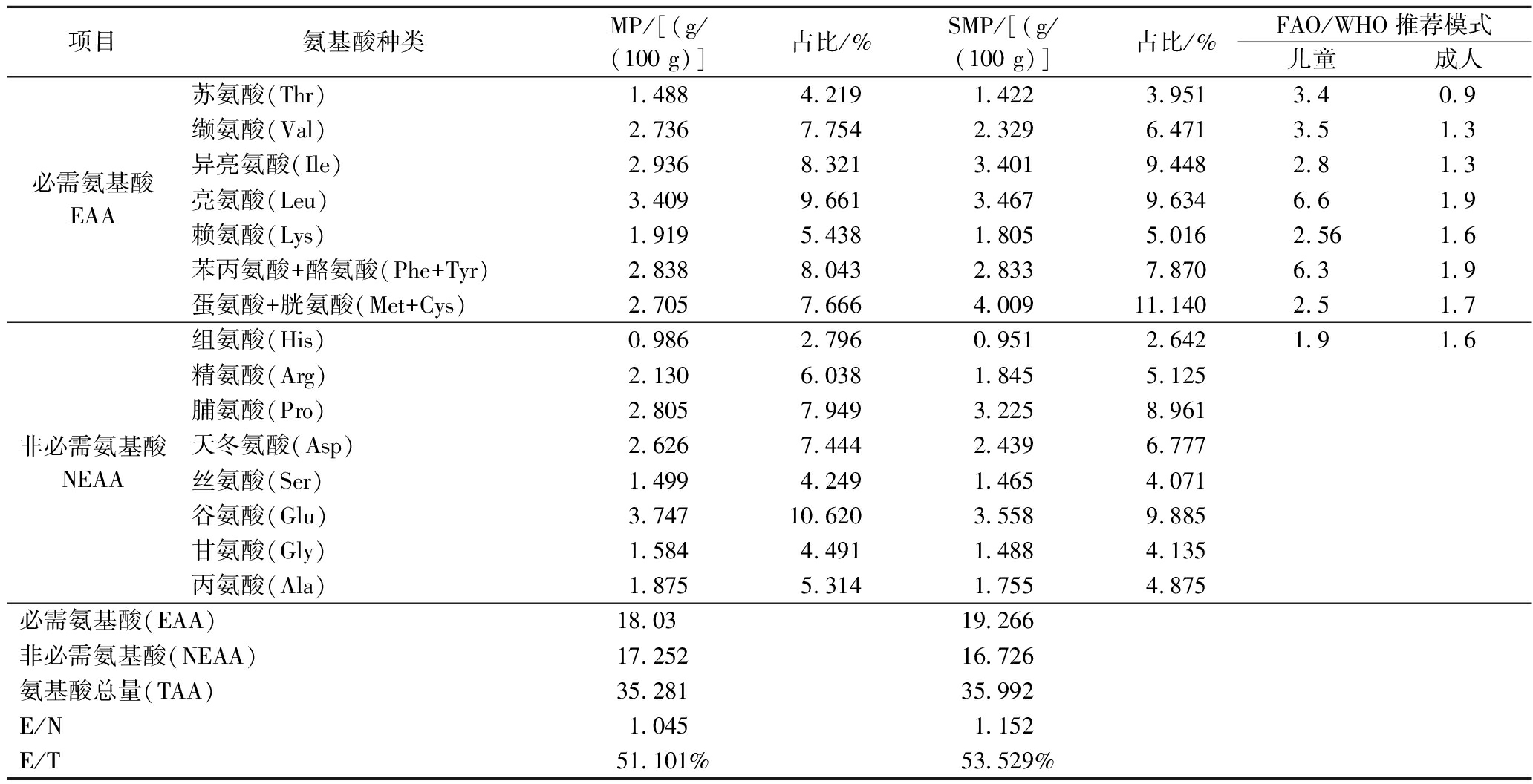
项目氨基酸种类MP/[(g/(100 g)]占比/%SMP/[(g/(100 g)]占比/%FAO/WHO推荐模式儿童成人必需氨基酸EAA苏氨酸(Thr)1.4884.2191.4223.9513.40.9缬氨酸(Val)2.7367.7542.3296.4713.51.3异亮氨酸(Ile)2.9368.3213.4019.4482.81.3亮氨酸(Leu)3.4099.6613.4679.6346.61.9赖氨酸(Lys)1.9195.4381.8055.0162.561.6苯丙氨酸+酪氨酸(Phe+Tyr)2.8388.0432.8337.8706.31.9蛋氨酸+胱氨酸(Met+Cys)2.7057.6664.00911.1402.51.7非必需氨基酸NEAA组氨酸(His)0.9862.7960.9512.6421.91.6精氨酸(Arg)2.1306.0381.8455.125脯氨酸(Pro)2.8057.9493.2258.961天冬氨酸(Asp)2.6267.4442.4396.777丝氨酸(Ser)1.4994.2491.4654.071谷氨酸(Glu)3.74710.6203.5589.885甘氨酸(Gly)1.5844.4911.4884.135丙氨酸(Ala)1.8755.3141.7554.875必需氨基酸(EAA)18.03 19.266 非必需氨基酸(NEAA)17.25216.726氨基酸总量(TAA)35.28135.992E/N1.0451.152E/T51.101%53.529%
2.3.2 SDS-PAGE分析
如图1所示,MP与SMP条带分布基本一致,在分子质量13~70.2 kDa的范围内均有存在。高分子质量范围70.2、43 kDa处有2条清晰的谱带,低分子质量范围36.5、28、15.7、14 kDa有4条较弱的谱带。JHAN等[21]鉴定出3种小米蛋白的分子质量基本分布在12、18、35、43、71 kDa,不同品种间分子质量略有不同,鉴定出的谱带范围与本实验结果基本一致。谱带颜色深浅不同说明2种小米蛋白在高分子质量范围内蛋白含量存在差异,当分子质量>70.2 kDa时条带趋于消失,2种小米蛋白的蛋白质含量相对较少,MP的条带明显弱于SMP,说明了SMP的蛋白含量高于MP[22]。研究表明,植物施硒对蛋白质分布不会产生影响,当硒被植物吸收转运到植株内与果实时,会提高小米籽粒中蛋白质含量,但不会对蛋白质的代谢途径做出改变,所以不会改变蛋白质的分布[23]。
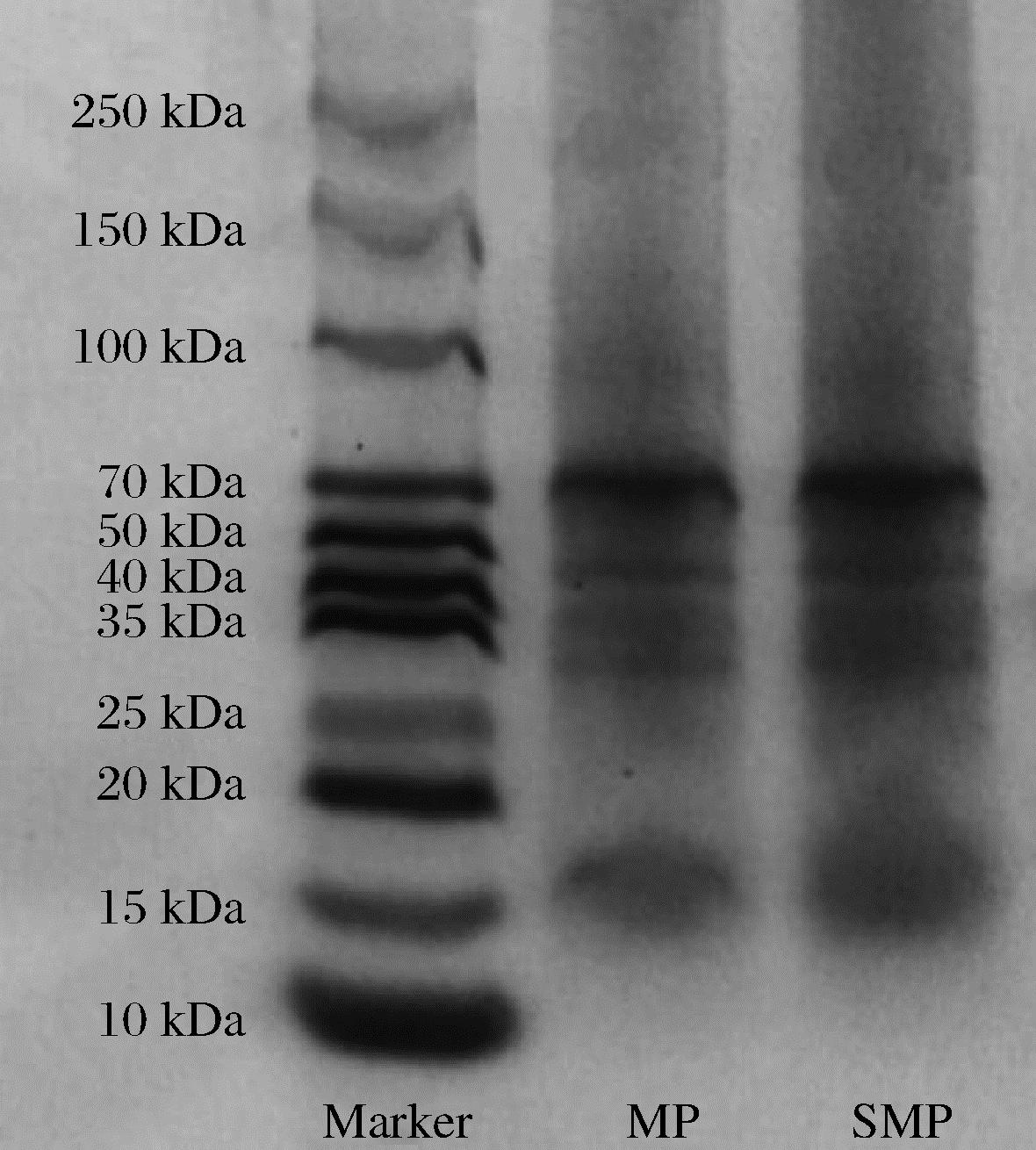
图1 SDS-PAGE结果
Fig.1 Results of SDS-PAGE
2.4 功能特性分析
2.4.1 pH对MP/SMP功能特性的影响
如图2所示,随着pH的增大,MP与SMP的PS、WA、FC及FS、EC均呈现先下降后上升,ES显现出相反趋势(P<0.05)。pH值为4时除ES外均达到最低值。当pH值大于6时,MP的溶解性优于SMP。这是因为,在碱性条件下,蛋白结构由紧密变得疏松,次级键被破坏,使蛋白质分子表面出现较多相同的电荷,由于静电斥力和离子水合作用增加,从而使蛋白质PS升高[24]。pH 2时MP的PS与SMP相差20.22%,可能与其等电点较低有关。由于蛋白质的功能特性在很大程度上与PS相关[25],在等电点附近蛋白水化能力较小,仅仅是蛋白质的可溶部分参与泡沫的生成,因此FC较差。在酸性或碱性范围内,水化能力增强,所以WA、FC与FS都较好。高碱性条件下蛋白质带负电荷,导致多肽链在油水界面上展开与排斥,有利于2种蛋白质的溶解,已溶解的蛋白质能够快速吸附至油水界面,并且吸附的越多,乳状液界面积越大,EC越好[26]。李丹丹等[27]和JHAN等[21]分别对水溶性蚕茧蛋白和纳米蛋白的功能特性进行研究,发现ES与EC趋势相反则有可能是因为随着pH的增大,蛋白表面电荷的增加破坏了界面蛋白膜的黏合性,导致油聚结率提高,ES下降。
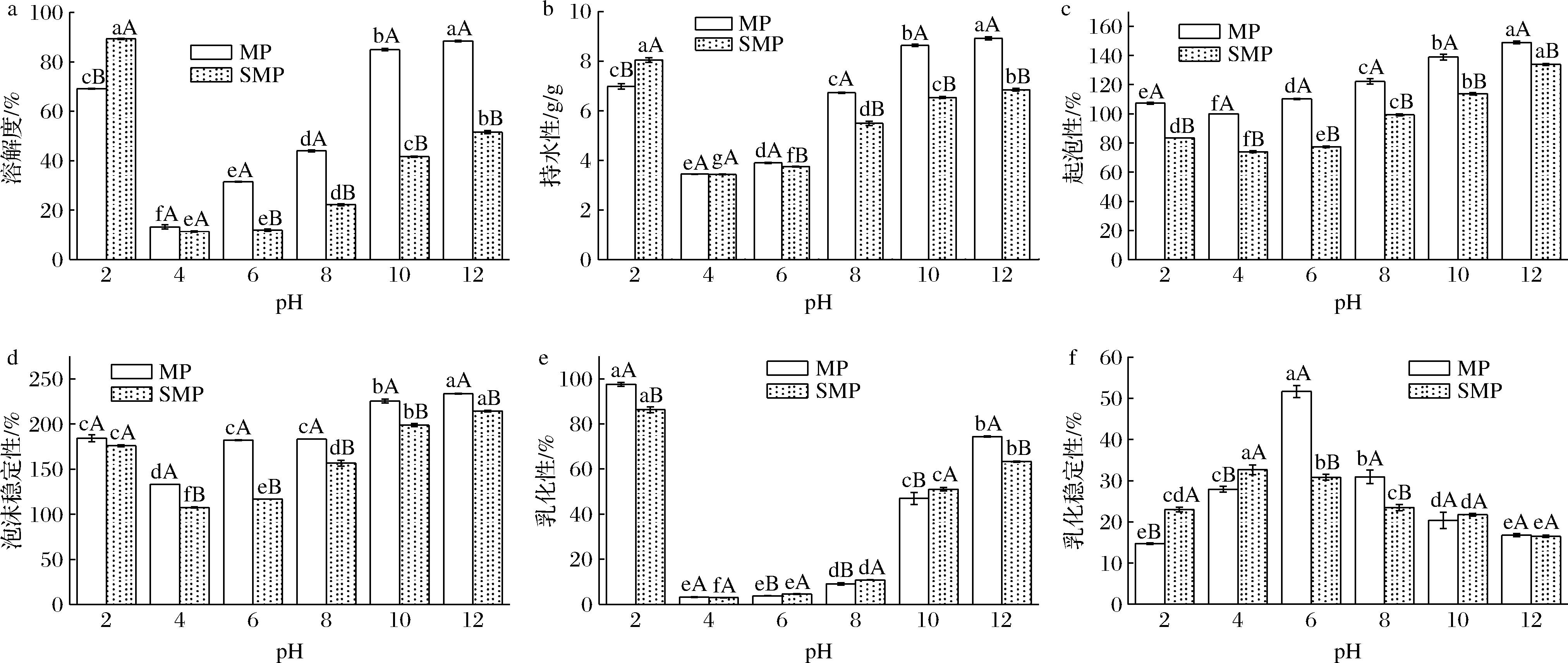
a-溶解度;b-持水性;c-起泡性;d-泡沫稳定性;e-乳化性;f-乳化稳定性
图2 pH对MP/SMP功能特性的影响
Fig.2 Effect of pH on the functional properties of MP/SMP 注:同种小米蛋白不同处理方式的显著性差异用小写字母表示,同种处理方式不同小米蛋白的显著性差异用大写字母表示(P<0.05)(下同)。
2.4.2 温度对MP/SMP功能特性的影响
如图3所示,温度对2种小米蛋白功能特性的影响一致,呈现先上升后下降的趋势(P<0.05)。其中SMP的功能特性均低于MP。刘思杉等[11]对富硒、富锌秀珍菇蛋白的功能特性进行研究,发现经过硒处理的样品功能特性低于对照组,这与本实验结果一致。这是因为小米经过硒处理,使蛋白质结构更加稳定,不易溶于水,导致蛋白质PS、WA等特性低于MP。当MP的温度为50 ℃时,PS达到最大值59.667%;SMP温度为60 ℃时,PS达到最大值25.849%;这是由于升高温度使蛋白质分子的立体结构伸展,有利于蛋白质分子与水分子的相互作用,起到了增溶的效果[28]。当温度继续升高,会导致蛋白质变性,在此状态下,PS受蛋白质-水的相互作用,影响了多肽链二级和三级结构的结合,导致PS降低[29]。
当温度为60~70 ℃时,MP、SMP的WA最高,分别为5.62、4.84 g/g;FA在60 ℃时最大。继续升温导致蛋白的变性和聚集现象的发生,蛋白表面积减少,极性分子对水的结合力降低,因此WA下降;在油水界面加热处理会形成脂质-蛋白质络合物[30],油的流动性增大,黏度减小,削弱了蛋白质与油的相互作用,降低了蛋白质的FA。
对于FS来说,当温度达到70~80 ℃时,泡沫基本全部消失。这可能是过热损害了蛋白质的起泡能力,导致热变性聚合形成了大分子不可溶性聚体,不易在气-水界面扩展和吸附,从而降低了蛋白质的FC。KAUR等[31]认为高起泡稳定性通常要求蛋白具有适当的表面活性特性和在界面处足够的分子间相互作用,而加热导致空气膨胀,黏性降低,气泡破裂,因此稳定性下降;当温度达到50与60 ℃时,SMP与MP的EC分别达到最大值10.624%、12.897%;在40与50 ℃时,ES达到最大值41.190%、53.939%。温度上升,随着蛋白分子链收缩折叠状态的转变,分子表面的疏水基团向内部转移,从而降低了蛋白质的EC。蛋白质的功能特性有助于产品的加工,是产品性能的基础,虽然SMP的功能特性低于MP,但是不可忽略其作为一种天然硒补充剂的应用价值。

a-溶解度;b-持水性;c-持油性;d-起泡性;e-泡沫稳定性;f-乳化性;g-乳化稳定性
图3 温度对MP/SMP功能特性的影响
Fig.3 Effect of temperature on the functional characteristics of MP/SMP
2.5 小米蛋白的结构表征
2.5.1 扫描电镜分析
利用扫描电镜放大2 000倍、5 000倍分别观察MP与SMP的微观结构,2种小米蛋白的表面形态如图4所示。SMP表面光滑,蛋白聚集度高,呈现致密均匀无孔状结构。与SMP相比MP表面粗糙,蛋白表面有较多分布不均,大小不一的凸起。
2.5.2 傅立叶红外光谱分析
如图5-a所示,2种蛋白的红外光谱图并无太大差别,说明小米经过富硒处理后,未产生新的键,但SMP的吸收峰位置略微后移。2种蛋白质均在3 292 cm-1附近有一个由N—H伸缩振动引起的弱吸收峰,此为酰胺A的特征峰,说明2种小米蛋白有氢键的存在[32];在2 932 cm-1周围出现由饱和结构中的CH3和CH2基团中C—H伸缩振动引起的酰胺B的吸收峰;在1 700~1 600 cm-1处存在由蛋白质的肽骨架C![]() O伸缩振动引起的较强的吸收峰,此为酰胺Ⅰ带;在1 220~1 330 cm-1处出现一组主要由N—H弯曲振动和C—H伸缩振动所引起的较弱的吸收峰,此为酰胺Ⅲ带[23];在570~704 cm-1附近有一组由对称环伸缩振动引起的峰,可能为Se
O伸缩振动引起的较强的吸收峰,此为酰胺Ⅰ带;在1 220~1 330 cm-1处出现一组主要由N—H弯曲振动和C—H伸缩振动所引起的较弱的吸收峰,此为酰胺Ⅲ带[23];在570~704 cm-1附近有一组由对称环伸缩振动引起的峰,可能为Se![]() O、Se—H结构[33]。
O、Se—H结构[33]。

a、b-MP;c、d-SMP
图4 MP/SMP扫描电镜图
Fig.4 MP/SMP scanning electron microscope image
由于酰胺Ⅰ带中具有丰富的二级结构信息,对酰胺Ⅰ带进行峰形拟合和面积计算后各二级结构的相对百分比结果如图5-b、图5-c所示,MP经二阶拟合得到10个峰,SMP得到7个峰,两者相比,SMP峰值明显发生了偏移。各二级结构组分含量如表4所示,SMP的α-螺旋、β-转角、β-折叠3种结构明显比MP分别高出5.532、5.506、2.885个百分点,而SMP的无规则卷曲含量则为0,这与MP二阶导数拟合图相符,这也说明SMP的有序性优于MP[34]。这与2.5.1节的扫描电镜分析结果相互印证。此外,有研究表明高比例的无规则卷曲一定程度上会提高蛋白质的PS,从侧面证明了MP与SMP的PS差异[35]。
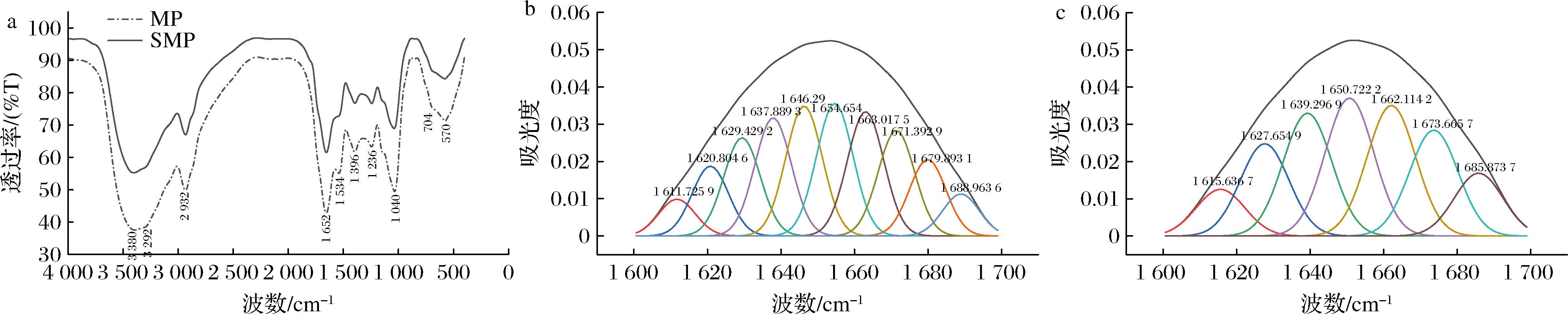
a-MP/SMP傅立叶红外光谱图;b-MP二阶导数拟合图;c-SMP二阶导数拟合图
图5 MP/SMP 傅立叶红外光谱图及二阶导数拟合图
Fig.5 MP/SMP FTIR spectra and second-order derivative fit
表4 MP/SMP二级结构含量
Table 4 MP/SMP secondary structure content

组分二级结构含量/%MPSMPβ-折叠(1 600~1 640 cm-1)34.57137.456无规则卷曲(1 640~1 650 cm-1)13.9230α-螺旋(1 650~1 660 cm-1)14.19419.726β-转角(1 660~1 700 cm-1)37.31242.818
3 结论
通过对富硒小米和普通小米基本成分分析,富硒小米水分含量低于普通小米,灰分、淀粉、脂肪、蛋白质和硒含量等指标均高于普通小米。MP与SMP共检出17种氨基酸,其中SMP的营养价值更高。从SDS-PAGE图像观察2种蛋白条带基本相同。研究了pH、温度对蛋白质功能特性的影响得出以下结论:当pH升高,2种小米蛋白都呈现先下降后升高的趋势,ES则相反呈现先上升后下降的趋势。温度上升2种小米蛋白的PS、WA、FA、EC、ES、FC、FS趋势一致,均呈现先上升后下降的趋势(P<0.05)。SEM呈现出SMP表面光滑,MP表面呈现沟壑状;FT-IR对比其二级结构,MP结构与SMP相比更为无序,因此在一定程度上影响了蛋白质的功能特性。综上所述,富硒小米蛋白质具有一定的工业应用前景,本研究结果为天然富硒食品的开发及加工提供了重要依据。
[1] SHARMA N, NIRANJAN K.Foxtail millet:Properties, processing, health benefits, and uses[J].Food Reviews International, 2018, 34(4):329-363.
[2] SHARMA R, SHARMA S, DAR B N, et al.Millets as potential nutri-cereals:A review of nutrient composition, phytochemical profile and techno-functionality[J].International Journal of Food Science &Technology, 2021, 56(8):3703-3718.
[3] ZHANG X, HE H, XIANG J Q, et al.Selenium-containing proteins/peptides from plants:A review on the structures and functions[J].Journal of Agricultural and Food Chemistry, 2020, 68(51):15061-15073.
[4] SURAI P F, FISININ V I.Selenium in poultry breeder nutrition:An update[J].Animal Feed Science and Technology, 2014, 191:1-15.
[5] GAO Q, WU J L, JIANG L P, et al.Se-O bond is unique to high Se enriched sweet potato stem protein with better antioxidant ability[J].Foods, 2021, 10(12):3064.
[6] ZHANG J, ZHOU H C, LI H, et al.Research progress on separation of selenoproteins/Se-enriched peptides and their physiological activities[J].Food &Function, 2021, 12(4):1390-1401.
[7] LUO L P, ZHANG J P, ZHANG K Y, et al.Peanut selenium distribution, concentration, speciation, and effects on proteins after exogenous selenium biofortification[J].Food Chemistry, 2021, 354:129515.
[8] DENG X F, LIAO J X, ZHAO Z Q, et al.Distribution and speciation of selenium in soybean proteins and its effect on protein structure and functionality[J].Food Chemistry, 2022, 370:130982.
[9] HUANG Y T, FAN B, LEI N Y, et al.Selenium biofortification of soybean sprouts:Effects of selenium enrichment on proteins, protein structure, and functional properties[J].Frontiers in Nutrition, 2022, 9:849928. [10] LIU W C, ADELINA N M, ZHANG L G, et al.Effects of roasting treatment on functional properties and structure of proteins in grafted Korean pine[J].Journal of Food Processing and Preservation, 2022, 46(10):e16810.
[11] 刘思杉, 冮洁, 朱淑珍, 等.富锌、富硒秀珍菇蛋白质结构特征及其功能特性[J].食品科学, 2021, 42(12):52-59. LIU S S, GANG J, ZHU S Z, et al.Structural and functional characteristics of proteins extracted from zinc-enriched and selenium-enriched fruit bodies of Pleurotus geesteranus[J].Food Science, 2021, 42(12):52-59.
[12] AKHARUME F, SANTRA D, ADEDEJI A.Physicochemical and functional properties of proso millet storage protein fractions[J].Food Hydrocolloids, 2020, 108:105497.
[13] TABTABAEI S, HIJAR B, CHEN B K, et al.Functional properties of protein isolates produced by aqueous extraction of de-hulled yellow mustard[J].Journal of the American Oil Chemists’ Society, 2017, 94(1):149-160.
[14] ZHU J X, DU M K, WU M R, et al.Preparation, physicochemical characterization and identification of two novel mixed ACE-inhibiting peptides from two distinct tea alkali-soluble protein[J].European Food Research and Technology, 2020, 246(7):1483-1494.
[15] 张红印. 酸枣仁蛋白的提取及其生物活性研究[D].长春:长春中医药大学, 2021. ZHANG H Y.Study on protein extraction and biological activity of Semen ziziphi spinosae[D].Changchun:Changchun University of Chinese Medicine, 2021.
[16] DENG X F, LIU K Z, LI M F, et al.Difference of selenium uptake and distribution in the plant and selenium form in the grains of rice with foliar spray of selenite or selenate at different stages[J].Field Crops Research, 2017, 211:165-171.
[17] 张雪莉, 胡秋辉, 纪阳, 等.杏鲍菇富硒蛋白的营养结构特性及对铅毒性的缓解作用[J].食品科学, 2022, 43(15):125-133. ZHANG X L, HU Q H, JI Y, et al.Nutritional and structural characteristics of selenium-enriched protein from Pleurotus eryngii and its alleviative effect on lead toxicity[J].Food Science, 2022, 43(15):125-133.
[18] NIU Q W, DONG R, MESSIA M C, et al.Selenium in Se-enriched tartary buckwheat (Fagopyrum tataricum L.Gaertn.):Its molecular form and changes during processing[J].Journal of Cereal Science, 2020, 95:103022.
[19] YU X Y, ZOU Y, ZHENG Q W, et al.Physicochemical, functional and structural properties of the major protein fractions extracted from Cordyceps militaris fruit body[J].Food Research International, 2021, 142:110211.
[20] LIU M J, SHI F F, ZHANG Q A.Evaluation of the ultrasonically accelerated debitterizing with citric acid solutions of different pH:On the basis of amino acids changes in apricot kernels during debitterizing[J].Journal of Food Processing and Preservation, 2021, 45(5):e15403.
[21] JHAN F, GANI A, NOOR N, et al.Nanoreduction of millet proteins:Effect on structural and functional properties[J].ACS Food Science &Technology, 2021, 1(8):1418-1427.
[22] 郭莲东, 徐丽, 欧才智, 等.小米蛋白的分子组成及结构特性[J].食品科学, 2019, 40(24):201-206. GUO L D, XU L, OU C Z, et al.Molecular compositions and structural properties of proteins in millet[J].Food Science, 2019, 40(24):201-206.
[23] 冯明菊. 富硒糙米蛋白理化特性及其酶解物的抗氧化与抗炎活性的研究[D].南昌:南昌大学, 2020. FENG M J.Study on physicochemical properties of Se-enriched brown rice protein and antioxidant and anti-inflammatory activities of its enzymatic hydrolysates[D].Nanchang:Nanchang University, 2020.
[24] 殷东. 米糠蛋白和大米蛋白功能特性的对比研究[D].哈尔滨:东北农业大学, 2014. YIN D.The functional properties research of rice bran protein and rice protein[D].Harbin:Northeast Agricultural University, 2014.
[25] ÇELIK M, GÜZEL M, YILDIRIM M.Effect of pH on protein extraction from sour cherry kernels and functional properties of resulting protein concentrate[J].Journal of Food Science and Technology, 2019, 56(6):3023-3032.
[26] WU C Y, FANG Y Z, HUANG S W, et al.Profiles of sturgeon protein prepared by two methods and the correlation between protein fractions and functional properties[J].International Journal of Food Science &Technology, 2022, 57(8):5450-5460.
[27] 李丹丹, 谢盛莉, 马良, 等.水溶性蚕蛹蛋白功能特性探究[J].食品与发酵工业, 2021, 47(4):7-14. LI D D, XIE S L, MA L, et al.The functional analysis of water-soluble silkworm pupa protein[J].Food and Fermentation Industries, 2021, 47(4):7-14.
[28] 林洋. 黑木耳蛋白质的提取、分离纯化及特性研究[D].哈尔滨:东北林业大学, 2016. LIN Y.Extraction, purification and characteristic analysis of the protein from Auricularia auricular[D].Harbin:Northeast Forestry University, 2016.
[29] LEE H J, KIM J H, JI D S, et al.Effects of heating time and temperature on functional properties of proteins of yellow mealworm larvae (Tenebrio molitor L.)[J].Food Science of Animal Resources, 2019, 39(2):296-308.
[30] 朱国君. 紫苏饼粕蛋白质的分离提取及其功能特性研究[D].重庆:西南大学, 2008. ZHU G J.Study on the extraction of protein from Perilla seed meal and its functional properties[D].Chongqing:Southwest University, 2008.
[31] KAUR M, SINGH N.Characterization of protein isolates from different Indian chickpea (Cicer arietinum L.) cultivars[J].Food Chemistry, 2007, 102(1):366-374.
[32] ROZI P, MAIMAITI P, ABUDUWAILI A, et al.Isolation and evaluation of bioactive protein and peptide from domestic animals’ bone marrow[J].Molecules, 2018, 23(7):1673.
[33] 石宝霞, 车会莲, 赵利霞, 等.碎米荠硒多糖的分离纯化及光谱分析[J].食品科学, 2007, 28(6):298-302. SHI B X, CHE H L, ZHAO L X, et al.Study on purification and spectra analysis of Cardamine urbaniana O.E.Schlz-selenium polysaccharide[J].Food Science, 2007, 28(6):298-302.
[34] 姬中伟. 小米醇溶蛋白肽的制备及其抗氧化与抗炎活性研究[D].无锡:江南大学, 2020. JI Z W.Study on the preparation of foxtail millet prolamins peptide and its antioxidant and anti-inflammatory activities[D].Wuxi:Jiangnan University, 2020.
[35] WANG H L, LI D M, WAN C X, et al.Improving the functionality of proso millet protein and its potential as a functional food ingredient by applying nitrogen fertiliser[J].Foods, 2021, 10(6):1332.