结冷胶最初被称为多糖S-60,是少动鞘氨醇单胞菌(旧名为Sphingomonas elodea和Pseudomonas elodea)发酵所产胞外多糖[1]。结冷胶是近年来在食品领域中应用最广泛的凝胶剂之一,1992年美国食品和药品管理局批准其作为凝胶剂、悬浮剂和稳定剂应用于食品和化妆品工业,1996年我国批准其作为食品添加剂[2]。结冷胶能在冷、热条件下形成热可逆水凝胶[3],在食品中使用量一般为0.1%~0.3%,只需0.25%的用量即可达到琼脂1.5%的凝胶强度。在食品工业中,结冷胶作为稳定剂用于乳液凝胶,在连续相和油水界面处形成网络结构[4-5],结冷胶可应用于多种类型的果冻、布丁等凝胶性食品的加工[6-8],在饮料中使用也能有效防止不溶物沉淀产生[9]。结冷胶在医疗领域可作为新型材料用于软骨组织再生[10-12],也可作为药物递送载体用于鼻、眼、胃和结肠给药[13-14]。在个人护理领域中应用于面膜、沐浴露和喷雾等产品。在化工领域结冷胶作为抗溶胀黏土稳定剂广泛用于石油开采[15]。在农业领域结冷胶复合水凝胶显示出高保水性,可控制肥料的释放[16]。GAMAL等[17]学者率先对结冷胶生物合成途径和代谢调控进行研究,参与合成部分基因已克隆测序,为其代谢调控提供方向,但目前对结冷胶合成调控机制尚未完全解析[18-21]。本文主要从结冷胶生物合成途径和代谢调控进行综述,以期加深对结冷胶生物合成的认识,为构建产结冷胶工程菌株提供新思路。
1 结冷胶的组成和结构
结冷胶分子骨架由β(1→3)-D-葡萄糖、β(1→4)-D-葡萄糖醛酸、β(1→4)-D-葡萄糖和α(1→4)-L-鼠李糖线性四糖重复单元组成,按摩尔比1∶1∶1∶1聚合,分子质量约为5×105 Da[22-23]。结冷胶存在两种形式:高酰基结冷胶(也称天然结冷胶)和低酰基结冷胶(也称脱酰基结冷胶)。高酰基结冷胶在第一个葡萄糖基的C-3位置上为甘油酯基,在同一葡萄糖基的C-6位置上为乙酰基(图1),每重复单元有1 mol甘油酯基和0.5 mol乙酰基[24]。高酰基结冷胶因含有丰富的酰基,形成的凝胶富有弹性且较柔软,与黄原胶和刺槐豆胶性能相似,适合做增稠剂[25]。高酰基结冷胶通过热碱处理,可除去甘油酯基和乙酰基,获得低酰基结冷胶。低酰基结冷胶在冷热水中均溶解,加入阳离子可形成强度大、坚硬但易脆裂并具有更高热稳定性的凝胶[26-27]。二价阳离子(Ca2+和Mg2+)比一价阳离子(Na+和K+)更有效地促进胶凝,结冷胶在Ca2+存在下形成最稳定的凝胶[28]。不同化学结构决定高酰基和低酰基结冷胶性能上的差异,结冷胶在溶液状态下冷却时形成的有序形式是双链螺旋结构[29]。低酰基结冷胶多糖链之间平行排列成为半交错互相缠绕的双螺旋结构,而高酰基结冷胶的分子则呈内卷曲折叠结构。
2 结冷胶的生物合成途径
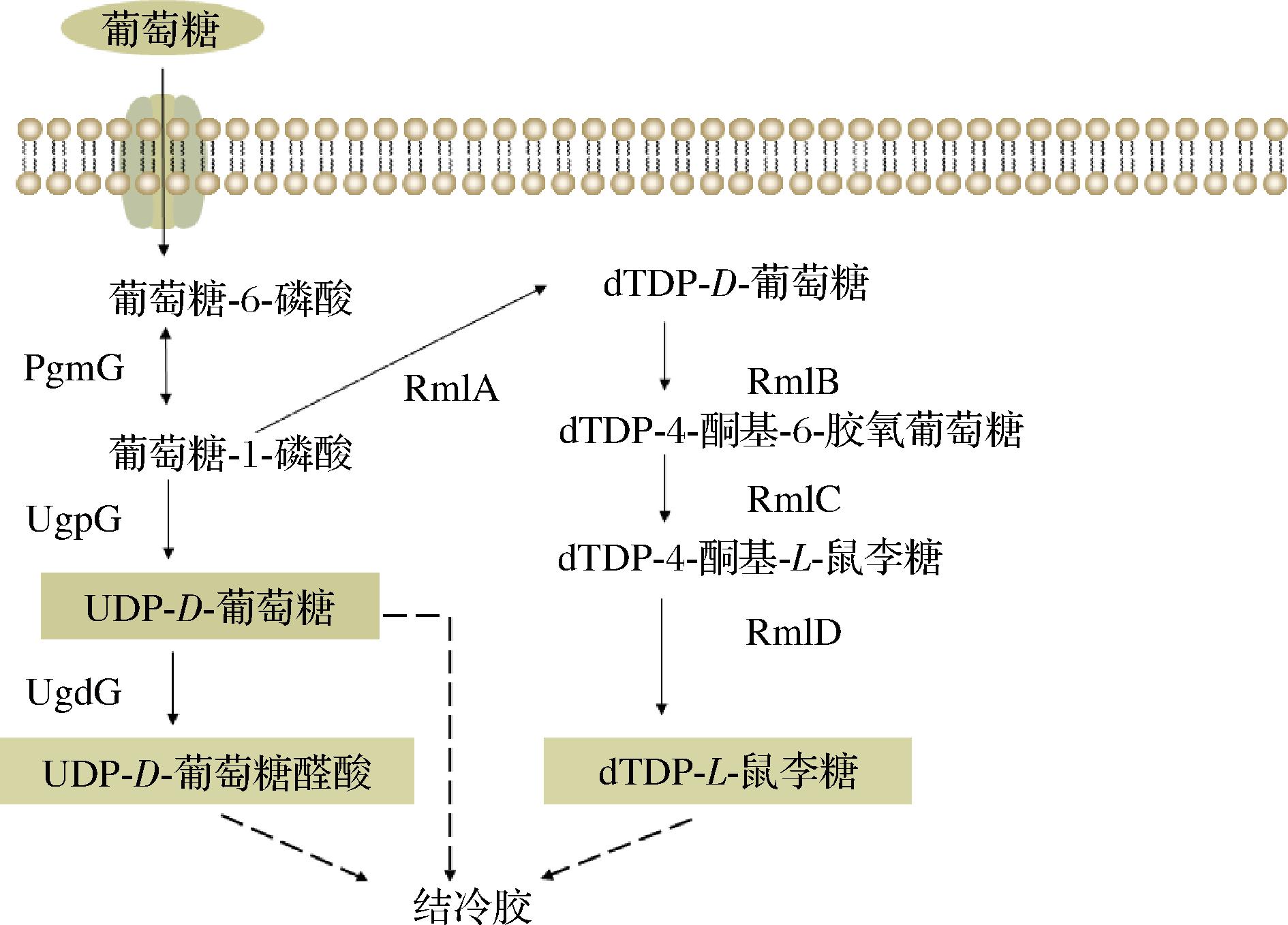
少动鞘氨醇单胞菌基因组大小约为4.12 Mb,GC含量为67.4%。结冷胶生物合成基因簇主要分布在基因组的3个区域(图2-a),彼此互不相连。Ⅰ区从gelQ到orf302共19个基因,22 021 bp;Ⅲ区为gelA单个基因,2 391 bp;Ⅳ区从gelR到gelG共3个基因,5 009 bp。Ⅰ区和Ⅳ区间隔2 180 kbp,Ⅳ区和Ⅲ区间隔1 035 kbp。此外,参与糖前体合成的基因pgmG、ugpG和ugdG位于基因组上其他位置。结冷胶生物合成途径共分为3步(图2-b):a)核苷酸糖前体合成;b)四糖重复单元组装;c)重复单元的聚合和输出[20]。
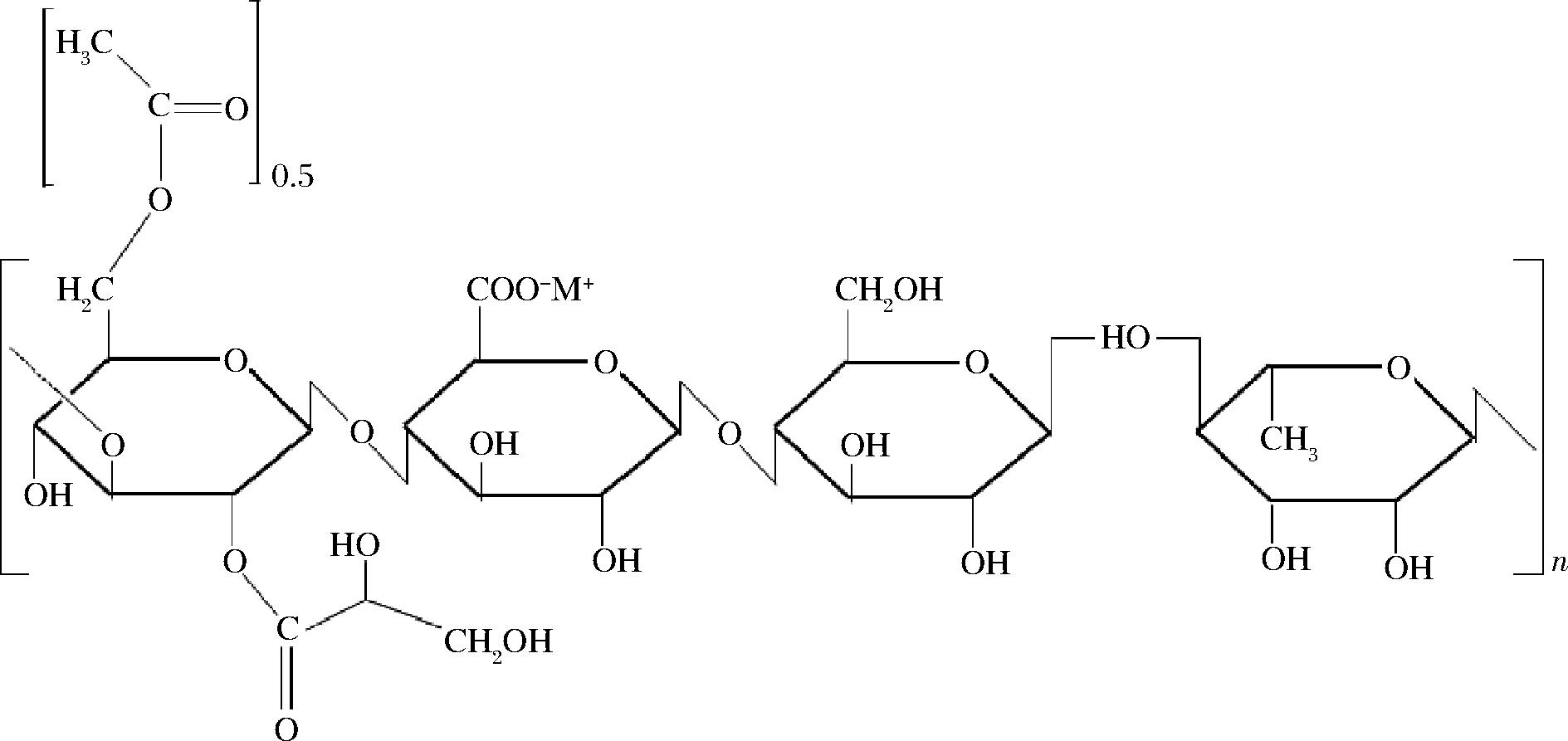
图1 结冷胶的重复单元
Fig.1 Repeated units of gellan gum

a-结冷胶组装模型;b-结冷胶生物合成和装配的模式
图2 结冷胶生物合成途径
Fig.2 The biosynthetic pathway of gellan gum
2.1 核苷酸-糖前体的生物合成
结冷胶生物合成途径从糖核苷酸前体开始,该前体包括UDP-D-葡萄糖、UDP-D-葡糖醛酸和dTDP-L-鼠李糖(图3)。葡萄糖-1-磷酸是UDP-D-葡萄糖醛酸和dTDP-L-鼠李糖合成的底物,由磷酸甘露糖变位酶/磷酸葡萄糖变位酶(phosphomannomutase/phosphoglucomutase,PMM/PgmG)催化形成,PgmG催化葡萄糖-1-磷酸比甘露糖-1-磷酸的效率(Kcat/Km)高约15倍[30]。合成葡萄糖-1-磷酸后,UDP-葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase,UgpG)催化葡萄糖-1-磷酸可逆转化为UDP-D-葡萄糖[31];UDP-葡萄糖脱氢酶(UDP-glucose dehydrogenase,UgdG)将UDP-D-葡萄糖转化为UDP-D-葡萄糖醛酸[32]。TDP-葡萄糖焦磷酸化酶(dTDP-D-glucose pyrophosphorylase,RmlA)将葡萄糖-1-磷酸和胸腺嘧啶三磷酸转化为TDP-D-葡萄糖,再经过dTDP-D-葡萄糖-4,6-脱水酶(dTDP-D-glucose 4,6-dehydratase,RmlB)、dTDP-6-脱氧-D-葡萄糖异构酶(dTDP-4 dehydrorhamnose 3,5 epimerase,RmlC)和dTDP-6-脱氧鼠李糖脱氢酶(dTDP-4 dehydrorhamnose reductase,RmlD)催化形成dTDP-L-鼠李糖。
PgmG:磷酸葡萄糖变位酶
图3 结冷胶的核苷酸-糖前体生物合成
Fig.3 Biosynthesis of nucleotide-sugar precursors of gellan gum
2.2 四糖重复单元的合成
在糖基转移酶作用下将糖核苷酸前体转移至活化的C55-异戊二烯磷酸酯脂质载体,参与此过程的基因主要包括gelQ、gelK、gelL和gelB[33](图2-a)。GelB与少动鞘氨醇单胞菌ATCC 31554的糖基转移酶SpsB同源,推测可将葡萄糖-1-磷酸从UDP-葡萄糖转移到脂质载体上。GelK具有糖基转移酶活性,能催化葡萄糖醛酸连接到脂质载体相连的第一个葡萄糖上[34]。四糖单元组装所需的另外两种糖基转移酶可能为GelL和GelQ,推测分别参与UDP-葡萄糖和dTDP-L-鼠李糖的添加。
2.3 结冷胶重复单元的聚合和输出
多糖生物合成下一步是重复单元的聚合并形成长链,GelS、GelG、GelC、GelE和GelD参与结冷胶的聚合和输出。结冷胶聚合反应机制推测是Wzy依赖途径(Wzy-dependent pathway),每个四糖重复单元通过转运蛋白Wzx从内膜转移至周质空间,然后通过聚合酶Wzy聚合形成一个长链聚合物。GelS与转运蛋白Wzx同源,预测含10个跨膜结构域,可能与多糖链转运相关[35]。GelG与聚合酶Wzy具有同源性,是一种位于质膜上的整合蛋白,有假定聚合酶特征,推测GelG参与多糖聚合[21]。多糖共聚酶(polysaccharide co-polymerase,PCP)蛋白家族控制合成多糖链长,GelC和GelE预测为PCP,与野生型菌株相比,缺失GelC和GelE的突变体显示出非黏液表型,表明两者控制多糖链长。多糖转运至膜外需要外膜辅助家族蛋白(outer membrane auxiliary,OMA)介导形成的蛋白质通道,多糖经此通道输出至细胞膜外。GelD与OMA外膜蛋白同源,GelD缺失显著降低结冷胶产量,因此推测GelD起结冷胶转运的功能。第Ⅲ区由双组分调节蛋白GelA组成,含组氨酸蛋白激酶和响应调节蛋白同源区域,是结冷胶生物合成的正调节因子。GelA突变体在液体培养基中产生少量多糖,推测该蛋白可感知环境变化,在碳源丰富的条件下启动结冷胶生产[20]。
结冷胶生物合成基因簇部分基因得到表征,但仍有一些基因未证实功能。研究发现,GelF中的突变可能是致命的,推测形成脂质连接中间体的第一步如果被阻断,会损害细胞壁合成,或者是突变对下游基因产生极性效应,影响细胞存活。GelI突变会影响结冷胶的产量,但不会影响其组成。GelI与参与周质或外膜蛋白质折叠的肽基脯氨酰顺反异构酶有弱同源性,推测GelI可能参与蛋白质加工和结冷胶的分泌。GelM和GelN的缺失导致结冷胶产量减少和黏度降低,但不影响其组成,表明这些蛋白质可能影响结冷胶的链长和分泌。AtrD和AtrB与I型分泌系统的ABC转运蛋白显示出同源性,ABC转运蛋白可通过内膜输出胞外多糖,也可能决定胞外多糖链长[36]。但AtrD和AtrB的突变没有影响结冷胶的合成,其在结冷胶生产中的作用未知[37]。
3 结冷胶生产菌株的代谢调控
3.1 敲除旁支途径相关基因
糖核苷酸前体合成是结冷胶生物合成的重要步骤,葡萄糖-6-磷酸不仅在PGM催化下生成葡萄糖-1-磷酸,继而合成结冷胶糖核苷酸前体,还在磷酸葡萄糖脱氢酶(Zwf)催化下生成6-磷酸葡萄糖酸酯,参与磷酸戊糖途径(pentose phosphate pathway,PPP途径)。VARTAK等[38]无效突变Zwf,期望使碳通量转移到结冷胶合成中,但结冷胶产量并无改变,可能是在zwf突变株中,葡萄糖通过涉及葡萄糖酸激酶的途径被利用,转化为6-磷酸葡萄糖酸酯进入PPP途径。
结冷胶发酵生产中会积累大量代谢副产物类胡萝卜素和聚β-羟丁酸(poly-β-hydroxybutyric acid,PHB),类胡萝卜素使发酵液呈黄色,影响产品的透明度,PHB使发酵液浊度增加。葡萄糖-6-磷酸经糖酵解途径转化为甘油醛-3-磷酸后,催化生成乙酰辅酶A,PHB生物合成途径始于乙酰辅酶A,类胡萝卜素生物合成始于3-磷酸-甘油醛。为使葡萄糖-6-磷酸更集中流向合成葡萄糖-1-磷酸,LI等[39]和ZHU等[40]敲除类胡萝卜素生物合成途径中的八氢番茄红素去饱和酶基因crtl和编码PHB合酶的phaC基因,以期结冷胶产量增加,减少副产物合成降低生产成本;结果显示,crtI突变体尽管菌落形态与野生型菌株接近,但菌落呈白色,而野生型菌落呈黄色。ΔphaCΔcrtI双敲除突变体的多糖产量显著下降,推测双敲除突变体中PHB合成途径的阻断可能会影响整个葡萄糖代谢网络,导致代谢中间体包括丙酮酸等有机酸的积累,对结冷胶生产造成不利影响[28]。此外,类胡萝卜素和PHB合成过程部分途径如乙酰辅酶A在酶催化下生成3-羟基丁酰辅酶A是NADP(H)依赖性反应,阻断PHB合成可能会破坏整个代谢网络中NADPH和NADP+平衡,导致结冷胶产量降低。
3.2 增加合成途径相关基因的表达
PgmG催化葡萄糖-6-磷酸形成葡萄糖-1-磷酸,UgpG直接参与催化生成UDP-葡萄糖,并间接参与另一结冷胶糖核苷酸前体UDP-葡萄糖醛酸的形成(图3)。研究表明,ugpG、pgmG和gelK基因单独过表达尽管导致其编码的酶活性增加,但对结冷胶合成并无显著影响,而共表达gelK和pgmG使结冷胶合成提升20%,黏度增加[41],推测单独过表达PgmG虽然能提高糖核苷酸前体供给,但多糖重复单元组装成为限制步骤,而共表达GelK和PgmG使糖核苷酸前体更高效的转移至脂质载体进而合成结冷胶。在鞘氨醇单胞菌S7中单独过表达pgmG,共表达pgmG和S7c6(spsGQIKLFDCEBrhsACB)也有类似的结果,单独过表达pgmG对S-7多糖合成没有显著影响,但共表达pgmG和S7c6使发酵液黏度增加40%(30 000 Pa·s),产量提高10%[42]。spsGQIKLFDCEB编码S-7多糖合成基因簇中4种糖基转移酶和分泌蛋白,rhsACB负责鼠李糖合成。黏度增加40%可能是由于S7c6片段缺少编码连接两个侧链葡萄糖残基的糖基转移酶,缺乏侧链的聚合物积累使发酵液黏度大幅增加,导致工程菌氧气利用率降低,S-7多糖产量仅提升10%。
参考相关文献对少动鞘氨醇单胞菌合成结冷胶的代谢调控进行归纳总结,如表2所示。GelD负责将结冷胶转运到胞外,过表达gelD工程菌结冷胶产量约为野生型的两倍,高达12.46 g/L[43],推测GelD是影响结冷胶分泌到胞外的关键酶。分别使用载体pBBR122克隆少动鞘氨醇结冷胶生物合成基因gelQ、gelB、gelL和gelK,其中gelQ工程菌结冷胶产量是野生型两倍[44]。GelQ是结冷胶四糖重复单元组装的最后环节,参与dTDP-L-鼠李糖的添加,推测其为限制结冷胶四糖重复单元组装的关键步骤。LEE等[45]分别过表达结冷胶合成途径中的gelN和gelA基因,工程菌表型更黏稠,结冷胶产量分别增加48.3%和21.2%。GelA为双组分调节蛋白,GelA过表达导致胞外多糖转运蛋白、糖结合输出蛋白和双组分系统调节蛋白表达分别上调3.61、2.57和2.11倍,而糖差向异构酶下调2.1倍,糖单元差向异构化可能改变多糖的理化性质,该蛋白下调可能使工程菌环境适应能力增强。过表达GelN导致甘露糖-1-磷酸鸟苷基转移酶/甘露糖-6-磷酸异构酶和总分泌蛋白L表达分别上调2.7和3.23倍,推测GelN与甘露糖向三磷酸鸟苷的转移和促进结冷胶分泌有关;共表达GelA和GelN可能影响结冷胶合成与输出的相关步骤,保障结冷胶的生物合成和分泌。
表2 少动鞘氨醇单胞菌合成结冷胶的代谢调控
Table 2 Metabolic regulation of gellan gum biosynthesis

菌株名称调控方式结冷胶产量参考文献ATCC 31461过表达ugpG基因工程菌产量无明显变化,黏度增加[31]ATCC 31461过表达gelD基因工程菌产量12.46 g/L,增加8.44%[43]ATCC 31461过表达gelQ基因工程菌产量11.71 g/L,增加16.57%[44]ATCC 31461共表达pgmG和ugpG基因工程菌产量7.79 g/L,增加20.03%[41]ATCC 31461敲除crtl和phaC基因工程菌产量13.20 g/L,野生型为11.89 g/L,产量无显著变化[39]ATCC 31461敲除crtl基因工程菌产量14.88 g/L,产量无显著变化[40]ATCC 31461敲除zwf基因工程菌产量23.20 g/L,野生型为22.80 g/L,产量无显著变化[38]ATCC 31461分别过表达gelN和gelA基因过表达gelN工程菌产量17.50 g/L,增加48.3%过表达gelA工程菌产量14.30 g/L,增加21.2%[45]
4 结论与展望
目前对结冷胶生物合成基因簇的研究仅能推测核苷酸糖前体的组成和重复单元的组装模式,但四糖重复单元组装的生化等实验研究相对较少。参与结冷胶生物合成的基因多达26个,但结冷胶生产菌株的代谢调控目前仅限于少数基因的过表达或敲除。因此,结冷胶生物合成机制解析和结冷胶高产菌株构建工作未来可开展下列研究:1)缺少高效的遗传操作工具限制了少动鞘氨醇单胞菌基因编辑,可建立CRISPR等新一代基因修饰系统全面解析结冷胶生物合成中各基因的具体功能和调控机制;2)结冷胶四糖重复单元组装时甘油酯基在酶的作用下转移到多糖链上,不同酰基含量会影响结冷胶的特性,甘油酯基会引起结冷胶脱酰基化时显著的流变学变化,而编码甘油酰基转移酶的基因还尚未阐明,后续在基因功能解析基础上可通过基因工程手段调控甘油酰基转移酶来控制结冷胶酰基含量;3)由于目前对鞘氨醇单胞菌合成结冷胶的生物途径认识还不够清晰,可在大肠杆菌、枯草芽孢杆菌和酿酒酵母等遗传背景清晰的宿主中,通过构建cosmid文库、TAR克隆技术、Rec/ET同源重组技术等异源表达结冷胶基因簇,避开原始宿主中复杂调控网络的紧密控制,探究结冷胶生物合成的最简模块和调控机制;4)通过开发诱导调控元件,对代谢途径代谢网络节点关键酶基因进行动态调控,快速响应细胞外环境及细胞内代谢物浓度变化,实现结冷胶高效合成。结冷胶生物合成途径的深入研究,将为基因工程和代谢工程等方法促进结冷胶合成提供理论基础,也将推动利用分子生物学技术开发具有不同结构和物理性质的新型结冷胶多糖。
[1] WANG F, WEN Y, BAI T C.The composite hydrogels of polyvinyl alcohol-gellan gum-Ca2 + with improved network structure and mechanical property[J].Materials Science and Engineering:C, 2016, 69:268-275.
[2] SONJE A G, MAHAJAN H S.Nasal inserts containing ondansetron hydrochloride based on Chitosan-gellan gum polyelectrolyte complex:In vitro-in vivo studies[J].Materials Science and Engineering:C, 2016, 64:329-335.
[3] WARREN H, IN HET PANHUIS M.Highly conducting composite hydrogels from gellan gum, PEDOT:PSS and carbon nanofibres[J].Synthetic Metals, 2015, 206:61-65.
[4] JIANG Y, ZHANG C, YUAN J H, et al.Exploiting the robust network structure of zein/low-acyl gellan gum nano complexes to create Pickering emulsion gels with favorable properties[J].Food Chemistry, 2021, 349:129112.
[5] LI A Q, GONG T, LI X F, et al.Preparation of thermally stable emulsion gels based on Glucono-δ-lactone induced gelation of gellan gum[J].International Journal of Biological Macromolecules, 2020, 156:565-575.
[6] DE ALENCAR COSTA E, DE SOUSA P H M, SIQUEIRA A C P, et al.Fruit pastes with organic honey texturized with gellan gum:Bioacessibility of antioxidant activity and sensory analysis fruit pastes with gellan and organic honey[J].Food Science and Technology, 2019, 39(3):667-676.
[7] DANALACHE F, MATA P, MOLD O-MARTINS M, et al.Novel mango bars using gellan gum as gelling agent:Rheological and microstructural studies[J].LWT - Food Science and Technology, 2015, 62(1):576-583.
O-MARTINS M, et al.Novel mango bars using gellan gum as gelling agent:Rheological and microstructural studies[J].LWT - Food Science and Technology, 2015, 62(1):576-583.
[8] DA COSTA J N, LEAL A R, NASCIMENTO L G L, et al.Texture, microstructure and volatile profile of structured guava using agar and gellan gum[J].International Journal of Gastronomy and Food Science, 2020, 20:100207.
[9] LEAL A R, HOLANDA L E O, SOARES F C M, et al.Effect of gellan gum concentration on the physicochemical, rheological and sensory properties of acerola smoothie[J].Food Science and Technology, 2022, 42:e05721. [10] AMIRI F, BABAEI M, JAMSHIDI N, et al.Fabrication and assessment of a novel hybrid scaffold consisted of polyurethane-gellan gum-hyaluronic acid-glucosamine for meniscus tissue engineering[J].International Journal of Biological Macromolecules, 2022, 203:610-622.
[11] MODI D, NIRMAL J, WARSI M H, et al.Formulation and development of tacrolimus-gellan gum nanoformulation for treatment of dry eye disease[J].Colloids and Surfaces.B, Biointerfaces, 2022, 211:112255.
[12] NG J Y, TAN K Y F, EE P L R.Sugar-assisted cryopreservation of stem cell-laden gellan gum-collagen interpenetrating network hydrogels[J].Biomacromolecules, 2022, 23(7):2803-2813.
[13] NIETO C, VEGA M A, RODR GUEZ V, et al.Biodegradable gellan gum hydrogels loaded with paclitaxel for HER2+ breast cancer local therapy[J].Carbohydrate Polymers, 2022, 294:119732.
GUEZ V, et al.Biodegradable gellan gum hydrogels loaded with paclitaxel for HER2+ breast cancer local therapy[J].Carbohydrate Polymers, 2022, 294:119732.
[14] YU H J, WANG H T, SU W T, et al.Co-delivery of hydrophobic astaxanthin and hydrophilic phycocyanin by a pH-sensitive water-in-oil-in-water double emulsion-filled gellan gum hydrogel[J].Food Hydrocolloids, 2022, 131:107810.
[15] 李瑞国. 一种防膨粘土稳定剂及其制备方法: 中国, CN104119854-A; CN104119854-B[P]. 2014-10-29. LI R G. Anti-swelling clay stabilizer and preparation method thereof: China, CN104119854-A; CN104119854-B[P]. 2014-10-29.
[16] SABADINI R C, SILVA M M, PAWLICKA A, et al.Gellan gum-O, O′-bis(2-aminopropyl)-polyethylene glycol hydrogel for controlled fertilizer release[J].Journal of Applied Polymer Science, 2018, 45636:1-7.
[17] GAMAL R F, ABDEL-HADY H M, AMIN S A, et al.Production of gellan gum by Sphingomonas paucimobilis on crude sweet whey using different bioreactor feeding strategies[J].South Asian Journal of Research in Microbiology, 2018:1-12.
[18] NAMPOOTHIRI K M, SINGHANIA R R, SABARINATH C, et al.Fermentative production of gellan using Sphingomonas paucimobilis[J].Process Biochemistry, 2003, 38(11):1513-1519.
[19] HUANG J, ZHU S Q, LI C B, et al.Cost-effective optimization of gellan gum production by Sphingomonas paucimobilis using corn steep liquor[J].Preparative Biochemistry &Biotechnology, 2020, 50(2):191-197.
[20] FIALHO A M, MOREIRA L M, GRANJA A T, et al.Occurrence, production, and applications of gellan:Current state and perspectives[J].Applied Microbiology and Biotechnology, 2008, 79(6):889-900.
[21] DRUMMELSMITH J, WHITFIELD C.Gene products required for surface expression of the capsular form of the group 1 K antigen in Escherichia coli (O9a:K30)[J].Molecular Microbiology, 1999, 31(5):1321-1332.
[22] MORRIS E R, NISHINARI K, RINAUDO M.Gelation of gellan: A review[J].Food Hydrocolloids, 2012, 28(2):373-411.
[23] DUAN Y W, CAI X Q, DU H L, et al.Novel in situ gel systems based on P123/TPGS mixed micelles and gellan gum for ophthalmic delivery of curcumin[J].Colloids and Surfaces B:Biointerfaces, 2015, 128:322-330.
[24] ZAND-RAJABI H, MADADLOU A.Caffeine-loaded whey protein hydrogels reinforced with gellan and enriched with calcium chloride[J].International Dairy Journal, 2016, 56:38-44.
[25] BULDO P, BENFELDT C, CAREY J P, et al.Interactions of milk proteins with low and high acyl gellan:Effect on microstructure and textural properties of acidified milk[J].Food Hydrocolloids, 2016, 60:225-231.
[26] WANG X J, FENG T T, XIA S Q.Saltiness perception related to salt release of surimi emulsified sausages:Modulation in texture and microstructure by polysaccharides[J].International Journal of Food Science &Technology, 2021, 56(8):3893-3902.
[27] FANG S, WANG J, XU X J, et al.Influence of low acyl and high acyl gellan gums on pasting and rheological properties of rice starch gel[J].Food Biophysics, 2018, 13(2):116-123.
[28] SCHMID J, SPERL N, SIEBER V.A comparison of genes involved in sphingan biosynthesis brought up to date[J].Applied Microbiology and Biotechnology, 2014, 98(18):7719-7733.
[29] PETRIC Z, RUŽI J, ŽUNTAR I.The controversies of parabens-an overview nowadays[J].Acta Pharmaceutica, 2021, 71(1):17-32.
J, ŽUNTAR I.The controversies of parabens-an overview nowadays[J].Acta Pharmaceutica, 2021, 71(1):17-32.
[30] HUANG H D, LI X Y, WU M M, et al.Cloning, expression and characterization of a phosphoglucomutase/phosphomannomutase from sphingan-producing Sphingomonas sanxanigenens[J].Biotechnology Letters, 2013, 35(8):1265-1270.
[31] MARQUES A R, FERREIRA P B, S -CORREIA I, et al.Characterization of the ugpG gene encoding a UDP-glucose pyrophosphorylase from the gellan gum producer Sphingomonas paucimobilis ATCC 31461[J].Molecular Genetics and Genomics, 2003, 268(6):816-824.
-CORREIA I, et al.Characterization of the ugpG gene encoding a UDP-glucose pyrophosphorylase from the gellan gum producer Sphingomonas paucimobilis ATCC 31461[J].Molecular Genetics and Genomics, 2003, 268(6):816-824.
[32] SILVA E, MARQUES A R, FIALHO A M, et al.Proteins encoded by Sphingomonas elodea ATCC 31461 rmlA and ugpG genes, involved in gellan gum biosynthesis, exhibit both dTDP- and UDP-glucose pyrophosphorylase activities[J].Applied and Environmental Microbiology, 2005, 71(8):4703-4712.
[33] PRAJAPATI V D, JANI G K, ZALA B S, et al.An insight into the emerging exopolysaccharide gellan gum as a novel polymer[J].Carbohydrate Polymers, 2013, 93(2):670-678.
[34] VIDEIRA P, FIALHO A, GEREMIA R A, et al.Biochemical characterization of the β-1, 4-glucuronosyltransferase GelK in the gellan gum-producing strain Sphingomonas paucimobilis ATCC 31461[J].The Biochemical Journal, 2001, 358(Pt 2):457-464.
[35] LIU D, COLE R A, REEVES P R.An O-antigen processing function for Wzx (RfbX):A promising candidate for O-unit flippase[J].Journal of Bacteriology, 1996, 178(7):2102-2107.
[36] SCHMID J.Recent insights in microbial exopolysaccharide biosynthesis and engineering strategies[J].Current Opinion in Biotechnology, 2018, 53:130-136.
[37] BAJAJ I B, SURVASE S A, SAUDAGAR P S, et al.Gellan gum:Fermentative production, downstream processing and applications[J].Food Technology and Biotechnology, 2007, 45(4):341-354.
[38] VARTAK N B, LIN C C, CLEARY J M, et al.Glucose metabolism in ‘Sphingomonas elodea’:Pathway engineering via construction of a glucose-6-phosphate dehydrogenase insertion mutant[J].Microbiology, 1995, 141(9):2339-2350.
[39] LI A, HU T T, LUO H Q, et al.A carotenoid- and poly-β-hydroxybutyrate-free mutant strain of Sphingomonas elodea ATCC 31461 for the commercial production of gellan[J].mSphere, 2019, 4(5):e00668-19.
[40] ZHU L, WU X C, LI O, et al.Cloning and knockout of phytoene desaturase gene in Sphingomonas elodea ATCC 31461 for economic recovery of gellan gum[J].Journal of Industrial Microbiology &Biotechnology, 2011, 38(9):1507-1513.
[41] S -CORREIA I, FIALHO A M, VIDEIRA P, et al.Gellan gum biosynthesis in Sphingomonas paucimobilis ATCC 31461:Genes, enzymes and exopolysaccharide production engineering[J].Journal of Industrial Microbiology and Biotechnology, 2002, 29(4):170-176.
-CORREIA I, FIALHO A M, VIDEIRA P, et al.Gellan gum biosynthesis in Sphingomonas paucimobilis ATCC 31461:Genes, enzymes and exopolysaccharide production engineering[J].Journal of Industrial Microbiology and Biotechnology, 2002, 29(4):170-176.
[42] THORNE L, MIKOLAJCZAK M J, ARMENTROUT R W, et al.Increasing the yield and viscosity of exopolysaccharides secreted by Sphingomonas by augmentation of chromosomal genes with multiple copies of cloned biosynthetic genes[J].Journal of Industrial Microbiology and Biotechnology, 2000, 25(1):49-57.
[43] SOUMIYA S, SANTHIAGU A, MANJUSHA CHEMMATTU M.Optimization of cultural conditions of gellan gum production from recombinant Sphingomonas paucimobilis ATCC 31461 and its characterization[J].Journal of Applied Biology &Biotechnology, 2021, 9(1):58-67.
[44] MANJUSHA C M, SOUMIYA S, SANTHIAGU A.Cloning and expression of gellan gum biosynthetic genes gelQ, gelB, gelL and gelK of Sphingomonas paucimobilis, production and characterization of the recombinant gellan gum[J].Biocatalysis and Agricultural Biotechnology, 2020, 30:101850.
[45] LEE S Y, AHN J Y, KIM M, et al.Phenotypic and proteomic analysis of positively regulated gellan biosynthesis pathway in Sphingomonas elodea[J].Animal Cells and Systems, 2017, 21(2):115-123.