青春双歧杆菌广泛分布于动物和人类肠道中[1],可以调节过氧化氢酶活性和宿主代谢,维持宿主健康[2-3],目前已经被广泛应用到保健食品、日化用品及化妆品领域。
迄今为止,细胞周期培养[4]、透析培养[5]、细胞固定化培养[6]已被开发用于解决与双歧杆菌传统培养相关的问题。因此,恒pH分批培养法仍然是主流,但双歧杆菌的培养密度小于1.0×109 CFU/mL;初始底物浓度过高时,高浓度的代谢产物和副产物的积累可能导致发酵体系渗透压增加引起的细胞停止生长,从而影响工业生产。此外,在真空冷冻干燥过程中,随着降温速度的变化,未冷冻部分溶液的电解质浓度增加也会产生渗透胁迫抑制双歧杆菌增殖。我们前期研究发现,菌株发酵可达到的最高活菌浓度与其耐渗透压的能力呈正相关[7]。但是目前青春双歧杆菌的发酵浓度均不高,可能与其渗透压耐受能力低有关[8],因此,筛选出能在高渗透压环境下生存的青春双歧杆菌对其生产和应用都具有重要意义。
本研究旨在筛选出能够耐受高渗透压的青春双歧杆菌,同时还要保证其耐渗透压能力的遗传稳定性,在发酵生产中长期使用。结合培养基成分及培养工艺优化,进一步提高耐高渗青春双歧杆菌在发酵液中的活菌数,解决青春双歧杆菌商业应用中发酵密度低的难题,同时在实际生产中,也有更广泛的发展前景。
1 材料与方法
1.1 材料与试剂
青春双歧杆菌菌株(共94株)均由江南大学食品生物技术中心保藏。
MRS-L培养基(g/L):胰蛋白胨10,牛肉浸膏10,酵母浸粉5,葡萄糖20,CH3COONa 5,吐温80 1 mL,K2HPO4 2.0,柠檬酸二铵2.0,MgSO4·7H2O 0.1,MnSO4·H2O 0.05,半胱氨酸磷酸盐1,pH 6.2~6.4,115 ℃灭菌20 min。原料均购自中国医药集团有限公司。
半胱氨酸磷酸盐缓冲液(CYS缓冲液,g/L):L-半胱氨酸盐酸盐0.5,Na2HPO4 6.0,KH2PO4 4.5,NaCl 4.0,吐温80 0.6,pH 6.8~7.0,115 ℃灭菌20 min。原料均购自中国医药集团有限公司。
氮源利用偏好性分析培养基(g/L):氮源1,葡萄糖6,K2HPO4 10,Na2HPO4 10,MgSO4·7H2O 0.25、MnSO4·H2O 0.05,吐温80 1 mL,pH 6.0,115 ℃灭菌20 min,其中氮源有:酵母浸粉FM528、安琪大豆蛋白胨FP410、胰蛋白胨、鱼骨蛋白胨FP351、牛骨蛋白胨FP326、牛肉浸粉购自国药集团,胰酪蛋白胨,上海创赛科技有限公司。
MRS-N培养基:在MRS-L液体培养基中添加NaCl调节其渗透压,1 L MRS-L液体培养基中添加3 g NaCl渗透压平均增长100 mOsm/kg。
1.2 仪器与设备
GRP-9080恒温培养箱,上海森信实验仪器有限公司;FE20 pH计、EL3002电子天平,梅特勒-托利多仪器(上海)有限公司;UV-2450紫外分光光度计,日本岛津公司;MS-3-basic涡旋振荡器,德国IKA公司;MLS-3750高温高压灭菌锅,日本SANYO公司;ZHJH-C1115B超净工作台,上海智诚分析仪器制造有限公司;löser-om806 m冰点渗透压测定仪,德国löser公司;LYOBETA-5PS真空冷冻干燥机,西班牙Telstar公司;RC-BIOS10落地式离心机,赛默飞世尔公司。
1.3 实验方法
1.3.1 菌株活化与培养
将-80 ℃冰箱中冻藏的青春双歧杆菌菌株在MRS固体板上用接种环划线接种,在温度为37 ℃的厌氧工作站生长36~48 h,挑取单菌落转移至5 mL液体培养基中,37 ℃厌氧生长24 h,再以4%接种量传代至新的液体培养基中,在37 ℃条件下厌氧生长24 h,连续活化3~5次作为种子培养液。
1.3.2 耐渗菌株筛选
将菌种连续活化两代后的种子培养液,按4%接种量在MRS-L培养基37 ℃厌氧培养18~20 h;将上述步骤得到的培养液按5%的接种量接种到渗透压为300、500、700、900、1 200、1 400 mOsm/kg的MRS-N液体培养基中,置于37 ℃厌氧工作站培养,测定菌株稳定期时OD600值。
1.3.3 耐渗透压能力测定
将筛选得到的青春双歧杆菌CCFM1302和CCFM1066按照4%的接种量分别在渗透压为300~1 500 mOsm/kg的MRS-N培养基中厌氧培养24~36 h,每隔2 h取样测定OD600值,根据生长曲线计算对数期代时。
代时是指菌株在生长过程中平均每分裂1次所需要的时间,能够直接反映生长的快慢,代时越短表明生长的越快。代时计算方法为:取对数生长期的数据,以菌株生长时间为横坐标,以log(OD600值,2)为纵坐标,绘制曲线,计算代时,线性斜率倒数即为代时。
1.3.4 耐渗透压能力遗传稳定性检测
为进一步证实筛选得到的菌株性状是否稳定遗传,将青春双歧杆菌CCFM1302和CCFM1066首先在较低渗透压下(500 mOsm/kg)传代3次,再分别置于对应的耐受渗透压下进行6次连续传代培养,绘制曲线,测定稳定期的OD600值。将冻存的菌株在-20 ℃保存3个月,取出后活化2~3代,置于对应的渗透压培养基下培养,测定稳定期OD600值。
1.3.5 氮源利用的偏好性分析
使用氮源利用偏好性分析培养基[9],其中氮源分别为:微生物类氮源、乳基类氮源、植物类氮源和动物类氮源,对照组采用混合氮源(0.2 g/L酵母提取物、0.4 g/L牛肉膏、0.4 g/L胰蛋白胨)。培养基灭菌后按5%比例接种,37 ℃厌氧培养,测定不同氮源下的稳定期OD600值及对数期代时。
1.3.6 碳氮消耗比的测定
使用氮源偏好性培养基,氮源为最佳氮源。以5%接种量接种到各5 mL液体培养基中,在菌株发酵过程中每隔2 h测定OD600值和发酵液中葡萄糖剩余量,计算生长速率开始被抑制和完全抑制时的碳氮消耗比。
1.3.7 生长限制性微量元素(Mg、Mn)分析
参考氮源利用偏好性培养基配制4组不同微量元素的培养基,其中氮源为最佳氮源。A组:不添加;B组:MgSO4·7H2O 0.25 g/L;C组:MnSO4·H2O 0.05 g/L;D组:MgSO4·7H2O 0.25 g/L,MnSO4·H2O 0.05 g/L。其余成分:最佳氮源1 g/L、葡萄糖6 g/L、K2HPO4 7 g/L、Na2HPO4 7 g/L、半胱氨酸1 g/L。调节pH 6.4,115 ℃灭菌20 min。按照5%的接种量接入4组培养基中,在厌氧工作站中37 ℃培养至稳定期,测定OD600值。
1.3.8 最适生长pH的测定
根据生长速率初始被抑制碳氮消耗比和菌株的耐渗透压能力确定发酵培养基的初始碳氮源的最适添加量,115 ℃灭菌20 min后,调节转速为100 r/min,温度为37 ℃,分别设置pH值为5.0、5.5、6.0、6.5,以5%的接种量将种子液接种到5 L发酵罐培养(培养基为3.5 L),灭菌后N2保压0.12 MPa,在稳定期取样测定发酵液中的活菌数。
1.3.9 生长限制性微量元素的最适添加量
使用最佳氮源的氮源利用偏好性分析培养基,其中微量元素质量浓度设置为0.05、0.25、0.75、1.25 g/L,以5%接种量接入菌株至发酵罐,灭菌后通入N2并保压0.1 MPa,于最适生长pH、37 ℃发酵。每隔2 h取样测定OD600值,在稳定期测定发酵液中的活菌数。
1.3.10 数据统计与分析
所有实验至少重复了3次,结果表示为平均值±标准差。使用SPSS 22.0软件(SPSS Inc.,Chicago,Illinois,USA)分析数据。并进行了单因素方差分析(ANOVA)和DUNCAN多重比较完成了差异显著性分析,P<0.05值的差异被认为具有统计学意义。
2 结果与分析
2.1 耐渗菌株筛选及耐渗透压能力遗传稳定性检测
2.1.1 耐渗菌株的筛选
通过测定94株青春双歧杆菌在不同渗透压条件下的MRS培养基的生长情况进行分析发现,大部分青春双歧杆菌在渗透压为900 mOsm/kg时,表现出较差的活力(OD600<0.3),而青春双歧杆菌CCFM1302和CCFM1066在1 500 mOsm/kg时,生长才被完全抑制,因此选取此2株青春双歧杆菌进行下一步研究(图1)。
2.1.2 耐渗青春双歧杆菌在不同耐渗透压条件下的生长曲线
已有研究表明在中性条件下,双歧杆菌代谢产生的醋酸和乳酸对细胞无明显毒害作用,渗透压升高是抑制其生长的限制性因素[10],所以青春双歧杆菌培养困难与其渗透压耐受性差有密切关系,因此通过测定耐渗青春双歧杆菌在不同渗透压下的生长情况,明确其耐渗透压能力。如图2所示,青春双歧杆菌CCFM1302在渗透压低于1 000 mOsm/kg时生长速率不受影响,且渗透压继续增高的情况下虽然生长受到一定程度抑制但没有被完全抑制,菌株依然可以得到生长;在1 500 mOsm/kg时,生长曲线斜率趋于0,青春双歧杆菌CCFM1302生长完全被抑制。在发酵过程中,菌株消耗葡萄糖积累酸根,即渗透压增加,但发酵前期生物量较少,底物消耗和渗透压增加亦比较慢,所以培养基浓度控制在不影响菌株生长的浓度,发酵前期对菌株生长的影响不大;待菌达到一定数量且进入对数生长期后期,糖的消耗和渗透压的积累是个较快的增加过程,此时发酵体系的渗透压有可能影响菌的生长,但如果尚未达到完全抑制渗透压,对最高生物量的影响较小。根据前期研究成果[11-12],该菌要达到高生物量,需使其发酵终点渗透压达到或略低于1 500 mOsm/kg(生长速率被抑制时的渗透压)。对于青春双歧杆菌CCFM1066,在渗透压低于900 mOsm/kg时,生长速率不受影响。而在1 500 mOsm/kg时,生长曲线斜率趋于0,青春双歧杆菌CCFM1066生长完全被抑制,因此,为达到最高生物量,将其培养基的渗透压提高至使发酵终点渗透压达到或略低于1 500 mOsm/kg。

图1 青春双歧杆菌在不同渗透压下稳定期的最大生物量
Fig.1 Maximum biomass in stable period of Bifidobacterium adolensentis with different osmolarity
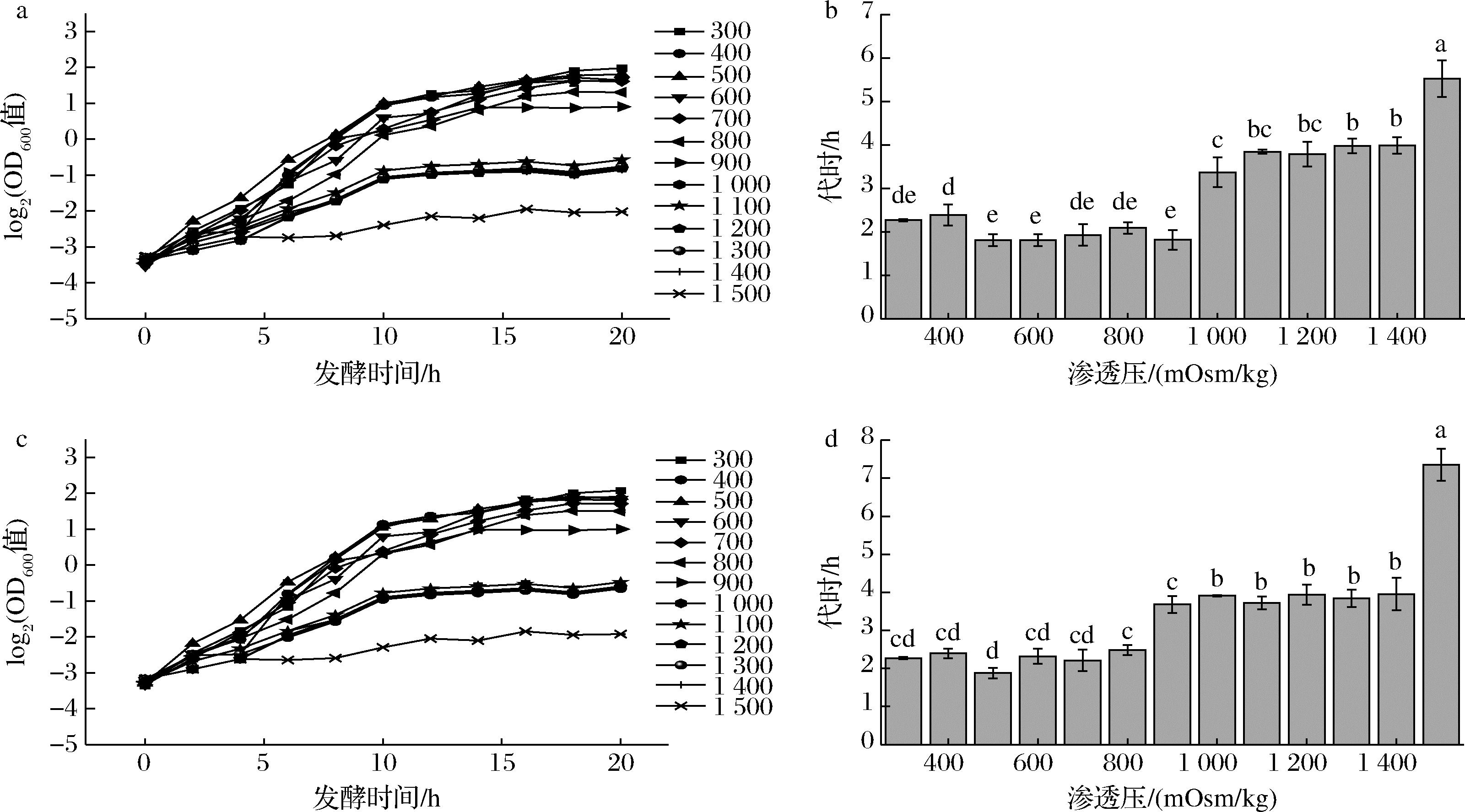
a-CCFM1302生长曲线;b-CCFM1302生长代时;c-CCFM1066生长曲线;d-CCFM1066生长代时
图2 青春双歧杆菌渗透压生长曲线和不同渗透压下生长代时
Fig.2 The osmotic stress curve and the generation time of B. adolensentis under different osmotic stress conditions 注:不同字母表示差异显著(P<0.05)(下同)。
2.1.3 耐渗菌株耐渗透压能力遗传稳定性
遗传稳定性的间接证据是不同世代菌株生长行为的重复性。在本实验中,青春双歧杆菌CCFM1302和CCFM1066的遗传稳定性均较好,在6次传代之后,仍表现出相似的生长行为(图3-a),表明在驯化之后的菌株具有良好的遗传稳定性。从图3-b可以看出,在-20 ℃冻存3个月,活化后在高渗浓度下的生长OD600值依然能达到2.0以上。综上得出结论:青春双歧杆菌CCFM1302和CCFM1066的耐渗透压能力可以稳定遗传。
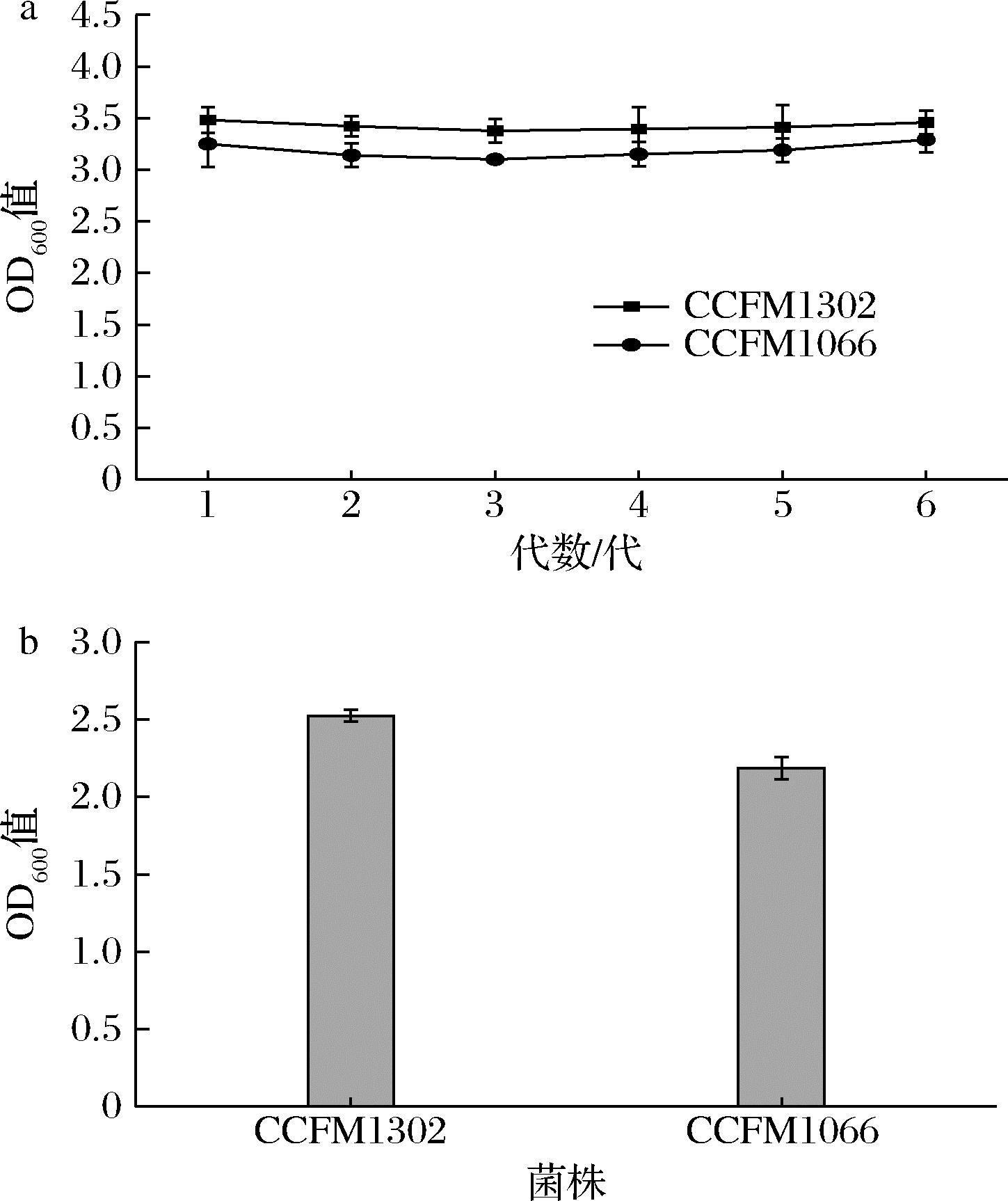
a-菌株在初始抑制渗透压下连续传代培养生长情况; b-冻存菌株在初始抑制渗透压下生长情况
图3 菌株耐渗透压能力遗传稳定性
Fig.3 Stability of strain for osmolarity tolerance
2.1.4 氮源偏好性分析
传统培养基中的氮源通常过剩,当菌株因培养基中的碳源不足或者渗透压抑制停止生长时,就会导致氮源无法得到充分利用[11]。因此,不能准确判定可以有效利用的最佳氮源。因此本实验采用氮源利用偏好性分析培养基[12],通过提高培养基的碳氮比,同时确保菌株停止生长时,培养基中仍有充足的碳源和适宜的pH不会抑制菌株正常的生长水平,分析哪种氮源可以被高效利用。
本实验选取了4大类氮源,使用氮源利用偏好性分析培养基比较青春双歧杆菌CCFM1302和CCFM1066对不同氮源的利用率,结果如表1所示,除胰酪蛋白胨外,各单一氮源对青春双歧杆菌的增殖作用均弱于对照组,其原因可能是进口的胰酪蛋白胨以酪蛋白为基础进行消化,具有较国内其他乳基氮源更好的成分和更优的工艺。
表1 不同氮源培养基对青春双歧杆菌增殖的影响
Table 1 Effects of different nitrogen sources on the proliferation of B.adolensentis
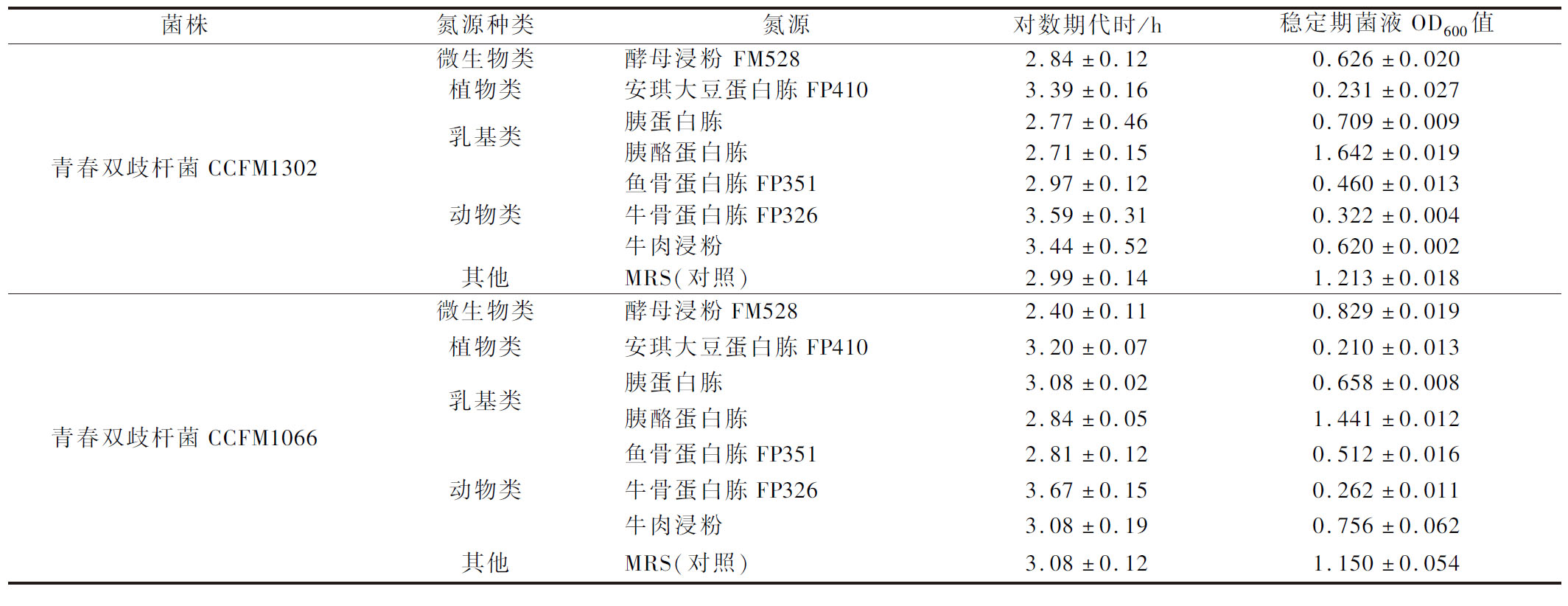
菌株氮源种类氮源对数期代时/h稳定期菌液OD600值青春双歧杆菌CCFM1302微生物类植物类乳基类动物类其他酵母浸粉 FM5282.84±0.120.626±0.020安琪大豆蛋白胨FP4103.39±0.160.231±0.027胰蛋白胨2.77±0.460.709±0.009胰酪蛋白胨2.71±0.151.642±0.019鱼骨蛋白胨FP3512.97±0.120.460±0.013牛骨蛋白胨FP3263.59±0.310.322±0.004牛肉浸粉3.44±0.520.620±0.002MRS(对照)2.99±0.141.213±0.018青春双歧杆菌CCFM1066微生物类植物类乳基类动物类其他酵母浸粉FM5282.40±0.110.829±0.019安琪大豆蛋白胨FP4103.20±0.070.210±0.013胰蛋白胨3.08±0.020.658±0.008胰酪蛋白胨2.84±0.051.441±0.012鱼骨蛋白胨FP3512.81±0.120.512±0.016牛骨蛋白胨FP3263.67±0.150.262±0.011牛肉浸粉3.08±0.190.756±0.062MRS(对照)3.08±0.121.150±0.054
酵母粉中含双歧杆菌所需的维生素、氨基酸和多肽[13],而胰蛋白胨、牛肉膏只含较多的氨基酸,因此考虑将酵母提取物和胰酪蛋白胨以质量比1∶1复配,比较两者叠加是否大于单一氮源。如图4所示,酵母浸粉FM528的添加提高了胰酪蛋白胨的利用效率,虽然在代时上的差异不显著,但是菌株生长至稳定期时OD600值变化明显;此外,胰酪蛋白胨与酵母提取物复配氮源与胰酪蛋白胨作为单一氮源相比更具成本效益,因此本实验使用胰酪蛋白胨与酵母浸粉FM528复合物作为青春双歧杆菌的最佳氮源。
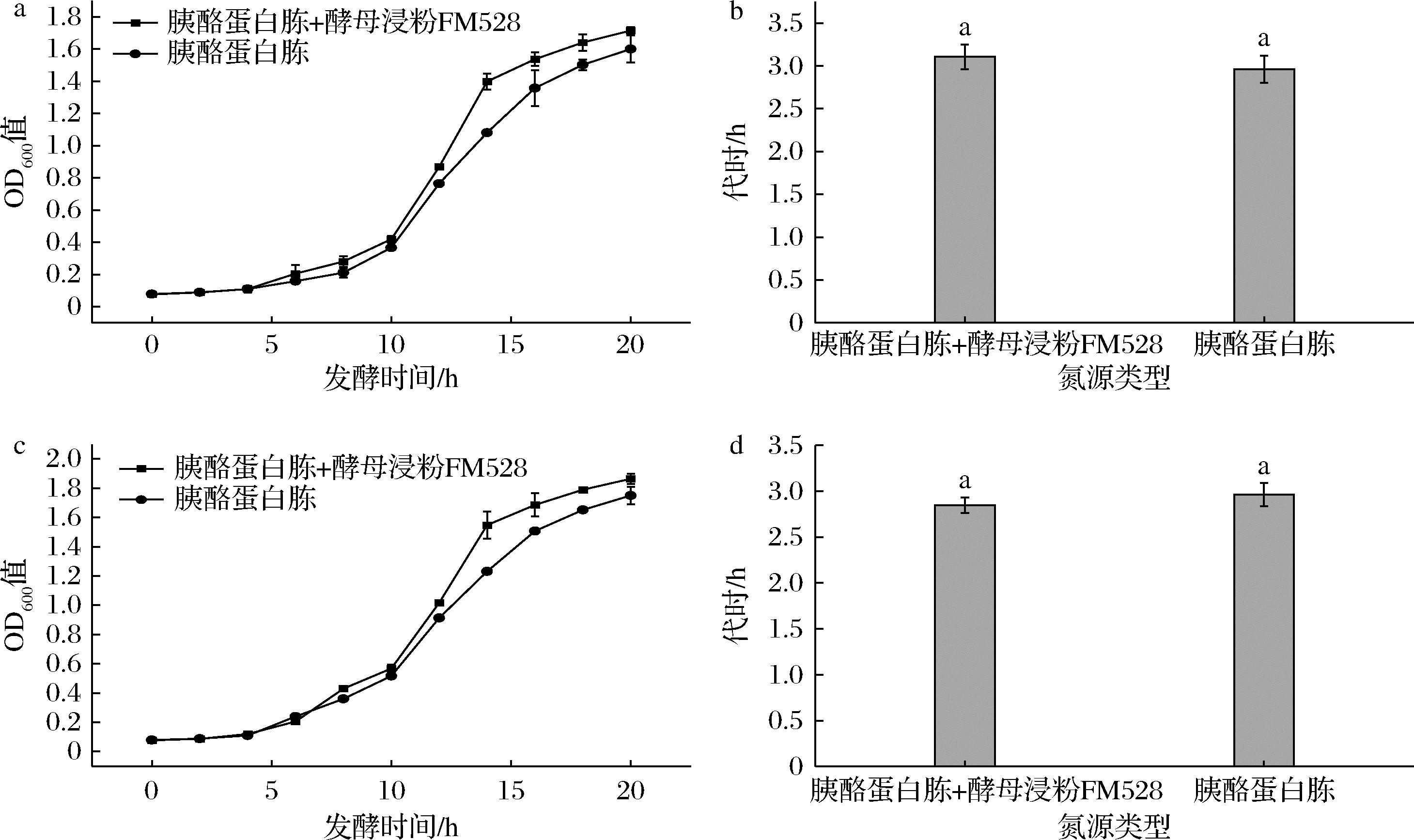
a-菌株CCFM1066在复合氮源中生长曲线;b-菌株CCFM1066在复合氮源中生长代时; c-菌株CCFM1302在复合氮源中生长曲线;d-菌株CCFM1302在复合氮源中生长代时
图4 菌株在不同类别氮源下的生长曲线及对数期代时
Fig.4 Growth curve and logarithmic generation time of strain with different types of nitrogen sources
2.1.5 生长限制性微量元素分析
微量元素是双歧杆菌中某些酶的重要成分或催化剂,其中大部分是金属离子,对酶的活性有关键作用;此外还作为结构稳定剂以及信号转导因子发挥作用[14-15]。已有研究表明Mn2+和Mg2+相较于Fe2+、Zn2+、Ca2+和Cu2+在菌株增殖方面更重要[16];此外,不同于乳杆菌,双歧杆菌有自己独特的双歧代谢途径[17]。双歧杆菌通过果糖-6-磷酸盐酮糖酶途径代谢葡萄糖,产生乳酸和乙酸作为主要终产物。果糖-6-磷酸盐酮糖酶是该途径的特征酶,Mg2+、Ca2+或Mn2+等离子作为辅助因子促进其活性发挥。此外,双歧杆菌葡萄糖代谢途径中的乙酸激酶、葡糖激酶、磷酸甘油酸激酶以及转酮醇酶等关键酶发挥作用都需要Mg2+作为酶促因子[18],因此本研究挑选Mn2+和Mg2+研究其浓度对菌株增殖的影响。
由图5可知,相对于空白对照组,只添加MgSO4对生物量有显著提升,Mg元素是青春双歧杆菌CCFM1302和CCFM1066的限制性微量元素,添加
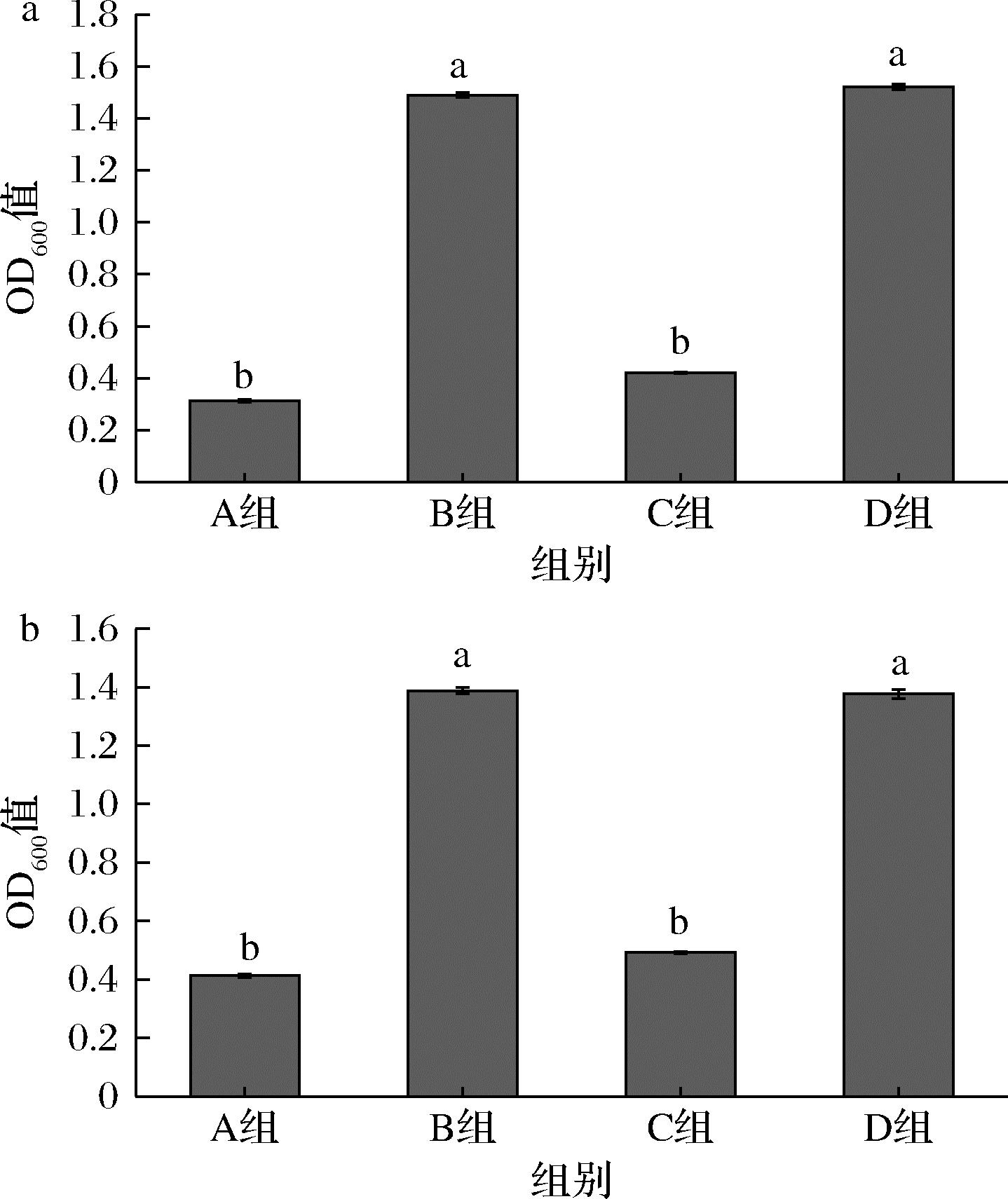
a-菌株CCFM1302;b-菌株CCFM1066
图5 不同微量元素含量对菌株生长的影响
Fig.5 The effect of different trace element contents on the growth of strain
MgSO4与添加MgSO4+MnSO4菌体的生长浓度相似,而单独添加Mn2+生物量没有显著提升,几乎没有生长。因此本实验在培养青春双歧杆菌CCFM1302和CCFM1066时只添加MgSO4作为微量元素。
2.2 发酵工艺优化
2.2.1 碳氮消耗比
通过以上试验,明确了菌株生长所需的最佳碳源和氮源及微量元素。此外,还必须考虑碳氮比对增殖效率的影响。培养基中碳氮质量比一直是高密度培养的重中之重,碳氮比不当不仅会造成底物的浪费,甚至会影响菌株的生长和代谢[19]。王玉林等[20]和高欣伟等[10]的研究已证实,在双歧杆菌的发酵培养中,当初始发酵培养基中碳源和氮源的比例为生长速率被抑制时的碳氮消耗比时增殖效率最高。
结果显示,使用优化后的培养基,青春双歧杆菌CCFM1302和CCFM1066在生长速率被抑制时的碳氮消耗比分别为(2.71±0.23)∶1和(2.53±0.11)∶1。
2.2.2 最适生长pH
双歧杆菌胞内涉及碳水化合物和氨基酸代谢的酶在一定的pH范围内活性较高,但有机酸以未解离分子形式存在是双歧杆菌分批培养的主要抑制因素[7]。因此调节pH,找到最适生长的pH恒定培养,从而最大程度满足细菌的生长繁殖。
张莹[21]和高欣伟等[10]的研究表明,菌株培养要达到最高增殖效率,以生长速率被抑制时的碳氮消耗比及生长速率被完全抑制时的渗透压作为发酵终点时的渗透压倒推得到青春双歧杆菌CCFM1302和CCFM1066培养基中碳氮源的最适添加量分别为:复合氮源17 g/L,葡萄糖49 g/L;复合氮源19 g/L,葡萄糖51 g/L,此外添加MgSO4·7H2O 0.25 g/L,半胱氨酸1 g/L、吐温80 1 mL/L,然后在37 ℃条件下控制不同pH培养,研究pH对发酵液活菌数的影响。
图6的结果显示了青春双歧杆菌CCFM1302和CCFM1066在pH 5.5的条件下,其发酵液活菌数最高,分别达到了(1.58±0.03)×1010CFU/mL和(1.35±0.05)×1010CFU/mL。另分析了培养过程中发酵体系渗透压的变化,在发酵前期渗透压未达到各自的生长速率抑制渗透压,菌株生长不受影响;在发酵后期,发酵体系的渗透压得到较高的增幅,菌株发酵终点时青春双歧杆菌CCFM1302和CCFM1066的发酵体系渗透压分别为(1 416±12) mOsm/kg和(1 413±17) mOsm/kg,虽对菌株生长速率有影响,但未完全抑制其生长。测定了发酵终点时残糖的含量,分别为(2.42±0.21) g/L和(1.53±0.53) g/L,说明培养基的营养成分得到了高效利用。
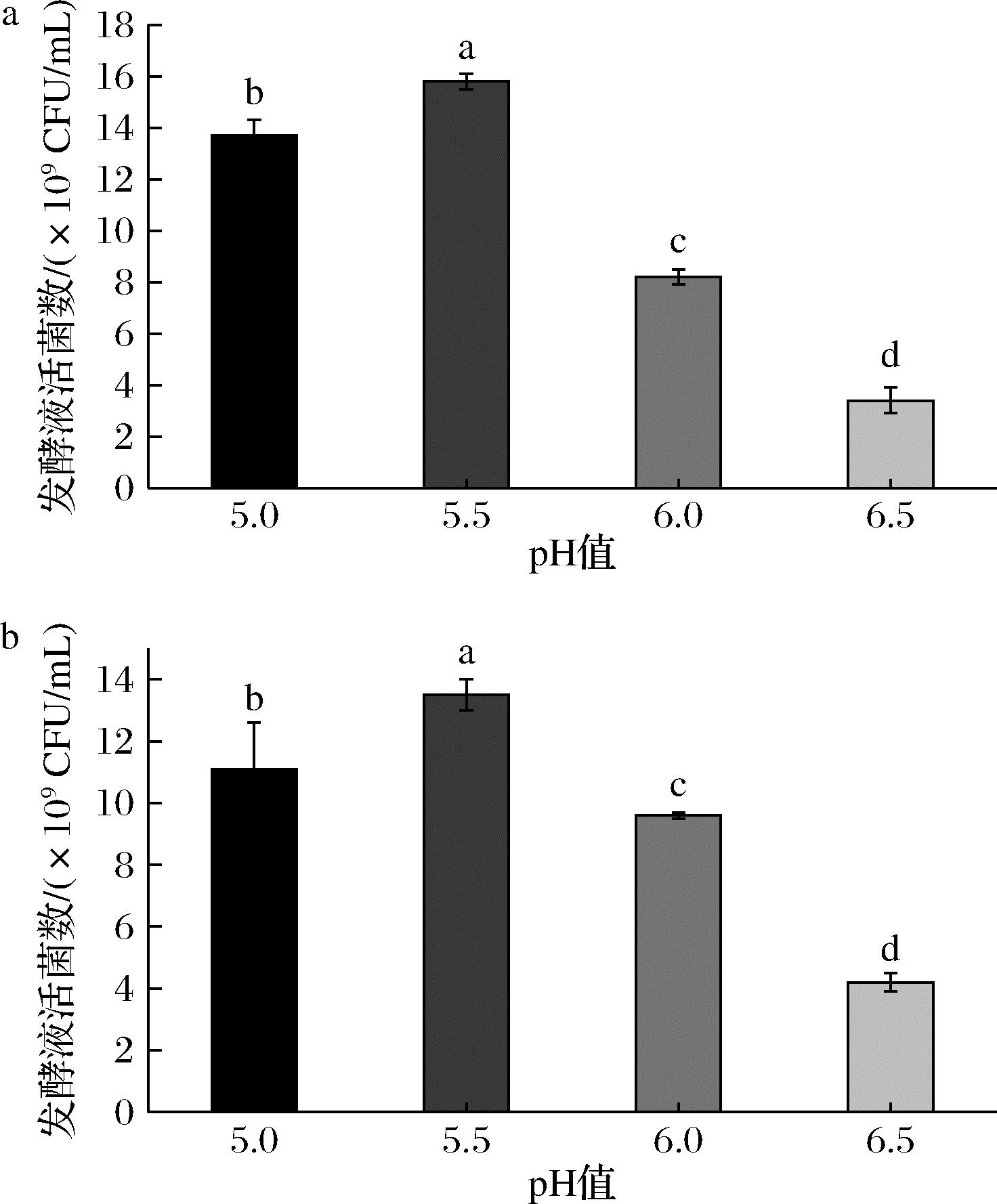
a-菌株CCFM1302;b-菌株CCFM1066
图6 菌株CCFM1302和CCFM1066在不同 pH下发酵活菌数
Fig.6 The number of viable strains at different pH for CCFM1302 and CCFM1066
2.2.3 最适微量元素添加量
Mg是青春双歧杆菌的限制性微量元素,而高密度发酵中微生物浓度会不断增加,所以有必要确定是否需要更高浓度的镁来确保关键酶持续活性。本研究通过添加不同浓度的MgSO4·7H2O,探究其浓度与活菌数的关系。由于在氮源利用偏好性分析培养基中MgSO4·7H2O质量浓度为0.25 g/L,以此为参照,设置4个梯度,进行分批发酵罐培养,由图7可知,随着Mg2+浓度升高,其生长趋势逐渐增加。因此,Mg是青春双歧杆菌培养环境中的关键微量元素,当MgSO4·7H2O质量浓度为0.25 g/L时,青春双歧杆菌CCFM1302和CCFM1066发酵液活菌数最高,分别达到了(1.82±0.08)×1010 CFU/mL和(1.70±0.03)×1010 CFU/mL。因此,在青春双歧杆菌CCFM1302和CCFM1066的培养基中添加0.25 g/L的MgSO4·7H2O较为合适。
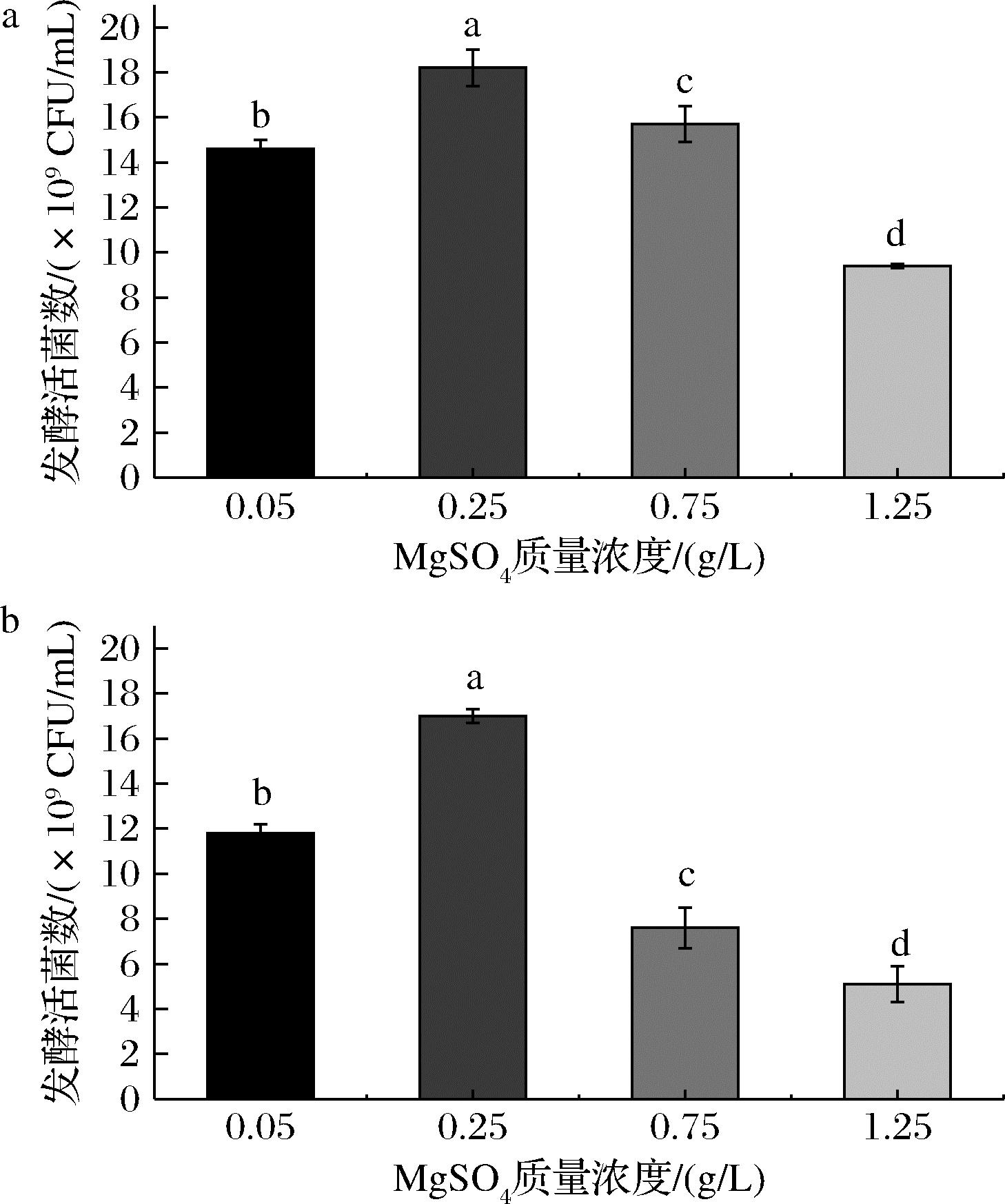
a-菌株CCFM1302;b-菌株CCFM1066
图7 菌株CCFM1302和CCFM1066在不同微量元素 浓度下发酵活菌数
Fig.7 The number of viable strains at different concentration of trace element for CCFM1302 and CCFM1066
3 结论
大部分青春双歧杆菌在渗透压为900 mOsm/kg时,表现出较差的活力(OD600<0.3),而本文筛选得到的青春双歧杆菌CCFM1302和CCFM1066最高可耐受1 400 mOsm/kg;其对不同氮源的利用程度不同,单一氮源中胰酪蛋白胨增殖效果最佳,若将胰酪蛋白胨与富含生长因子的酵母浸粉FM528复配可以得到最高的利用效率;此外,菌株最大生物量与Mg2+浓度有关;青春双歧杆菌CCFM1302和CCFM1066的最佳生长pH值均为5.5;青春双歧杆菌CCFM1302和CCFM1066的生长速率被抑制时的碳氮消耗比分别为(2.71±0.23)∶1、(2.53±0.11)∶1。
因此,通过菌株生长速率被完全抑制时渗透压及生长速率被抑制时的碳氮消耗比倒推得到的青春双歧杆菌CCFM1302和CCFM1066的最适底物浓度为分别为:复合氮源21.0 g/L,葡萄糖57.0 g/L;复合氮源22.4 g/L,葡萄糖56.5 g/L,此外添加MgSO4·7H2O 0.25 g/L,半胱氨酸1 g/L、吐温80 1 mL/L。在该浓度下的底物发酵结束时代谢产生的酸根积累引起的渗透压升高达到菌株完全抑制渗透压(1 500 mOsm/kg)。若底物含量高于该浓度,菌株停止生长时尚有底物未利用,不仅浪费且初始浓度的底物也会引起渗透压升高不利于菌株生长;若底物含量低于该浓度,菌株停止生长时是因为底物不够,因此活菌浓度达不到最高。在优化后的发酵条件下,发酵液活菌数可达到(1.82±0.08)×1010 CFU/mL和(1.70±0.03)×1010 CFU/mL。
[1] WANG G, JIAO T, XU Y, et al.Bifidobacterium adolescentis and Lactobacillus rhamnosus alleviate non-alcoholic fatty liver disease induced by a high-fat, high-cholesterol diet through modulation of different gut microbiota-dependent pathways[J].Food &Function, 2020, 11(7):6115-6127.
[2] ZHU G S, MA F L, WANG G, et al.Bifidobacteria attenuate the development of metabolic disorders, with inter- and intra-species differences[J].Food &Function, 2018, 9(6):3509-3522.
[3] CHEN S J, CHEN L Y, QI Y D, et al.Bifidobacterium adolescentis regulates catalase activity and host metabolism and improves healthspan and lifespan in multiple species[J].Nature Aging, 2021, 1(11):991-1001.
[4] ROBERTS T, KALTENBACH H M, RUDOLF F.Development and optimisation of a defined high cell density yeast medium[J].Yeast, 2020, 37(5-6):336-347.
[5] LIU W C, XIANG H B, ZHANG T, et al.Development of a new high-cell density fermentation strategy for enhanced production of a fungus β-glucosidase in Pichia pastoris[J].Frontiers in Microbiology, 2020, 11:1988.
[6] HÖRNER M, GERHARDT K, SALAVEI P, et al.Production of phytochromes by high-cell-density E.coli fermentation[J].ACS Synthetic Biology, 2019, 8(10):2442-2450.
[7] 崔树茂. 乳酸菌的生长抑制和冻干存活的影响因素及规律[D].无锡:江南大学, 2017. CUI S M.The impact factors and rules of growth inhibition and freeze-drying survival for lactic acid bacteria[D].Wuxi:Jiangnan University, 2017.
[8] CUI S M, SADIQ F A, MAO B Y, et al.High-density cultivation of Lactobacillus and Bifidobacterium using an automatic feedback feeding method[J].LWT, 2019, 112:108232.
[9] 陈卫, 崔树茂, 朱丹凤, 等.一种筛选适宜双歧杆菌增殖的氮源的培养基:中国.CN109913523B[P].2020-09-04. CHEN W, CUI S M, ZHU D F, et al.A method for screening nitrogen sources suitable for Bifidobacterium proliferation:China.CN109913523B[P].2020-09-04. [10] 高欣伟, 崔树茂, 唐鑫, 等.长双歧杆菌的最适底物解析和高密度发酵工艺优化[J].食品与发酵工业, 2021, 47(19):12-20. GAO X W, CUI S M, TANG X, et al.Optimization of substrate in high-density fermentation of Bifidobacterium longum[J].Food and Fermentation Industries, 2021, 47(19):12-20.
[11] 孙媛媛, 崔树茂, 唐鑫, 等.发酵乳杆菌的生长限制性因素分析及高密度培养工艺优化[J].食品与发酵工业, 2021, 47(6):1-10. SUN Y Y, CUI S M, TANG X, et al.Growth limiting factors of Lactobacillus fermentum and optimization of its high-density cultivation[J].Food and Fermentation Industries, 2021, 47(6):1-10.
[12] 崔树茂, 陈卫, 朱丹凤, 等.一种筛选适宜乳杆菌增殖的氮源的方法:中国, CN110004088B[P].2021-03-26. CUI S M,CHEN W, ZHU D F, et al.A method for screening nitrogen sources suitable for Lactobacillus proliferation:China, CN110004088B[P].2021-03-26.
[13] 汪文丽. 双歧杆菌氮源利用的选择性及特征分析[D].无锡:江南大学, 2021. WANG W L.Selectivity and characteristic analysis of nitrogen source utilization by bifidobacteria[D].Wuxi:Jiangnan University, 2021.
[14] BEGG S L.The role of metal ions in the virulence and viability of bacterial pathogens[J].Biochemical Society Transactions, 2019, 47(1):77-87.
[15] PALMER L D, SKAAR E P.Transition metals and virulence in bacteria[J].Annual Review of Genetics, 2016, 50:67-91.
[16] CUI S M, ZHU D F, MAO B Y, et al.Rapid evaluation of optimal growth substrates and improvement of industrial production of Bifidobacterium adolescentis based on the automatic feedback feeding method[J].LWT, 2021, 143:110960.
[17] WONG C B, ODAMAKI T, XIAO J Z.Insights into the reason of Human-Residential Bifidobacteria (HRB) being the natural inhabitants of the human gut and their potential health-promoting benefits[J].FEMS Microbiology Reviews, 2020, 44(3):369-385.
[18] DE VRIES W, STOUTHAMER A H.Pathway of glucose fermentation in relation to the taxonomy of bifidobacteria[J].Journal of Bacteriology, 1967, 93(2):574-576.
[19] OMONI V T, BANKOLE P O, NWOSU T F X, et al.Impact of different nitrogen amendments on the biodegradation of 14C-phenanthrene by endophytic fungal strains in liquid culture[J].Microbiological Research, 2023, 266:127223.
[20] 王玉林, 黄洁, 崔树茂, 等.植物乳杆菌最适生长底物解析及高密度培养工艺[J].食品与发酵工业, 2020, 46(4):19-27. WANG Y L, HUANG J, CUI S M, et al.Analysis of optimal growth substrate and high-density culture process of Lactobacillus plantarum[J].Food and Fermentation Industries, 2020, 46(4):19-27.
[21] 张莹. 两歧双歧杆菌耐渗关键分子机制及制备工艺的研究[D].无锡:江南大学, 2022. ZHANG Y.The key molecular mechanism for osmotic tolerance of Bifidobacterium bifidum and its manufacturing process[D].Wuxi:Jiangnan University, 2022.